Общая характеристика d-элементов » HimEge.ru
Понятие переходный элемент обычно используется для обозначения любого элемента с валентными d- или f-электронами. Эти элементы занимают в периодической таблице переходное положение между электроположительными s-элементами и электроотрицательными p-элементами.
d-Элементы принято называть главными переходными элементами. Их атомы характеризуются внутренней застройкой d-подоболочек. Дело в том, что s-орбиталь их внешней оболочки обычно заполнена уже до того, как начинается заполнение d-орбиталей в предшествующей электронной оболочке. Это означает, что каждый новый электрон, добавляемый в электронную оболочку очередного d-элемента, в соответствии с принципом заполнения, попадает не на внешнюю оболочку, а на предшествующую ей внутреннюю подоболочку. Химические свойства этих элементов определяются участием в реакциях электронов обеих указанных оболочек.
d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.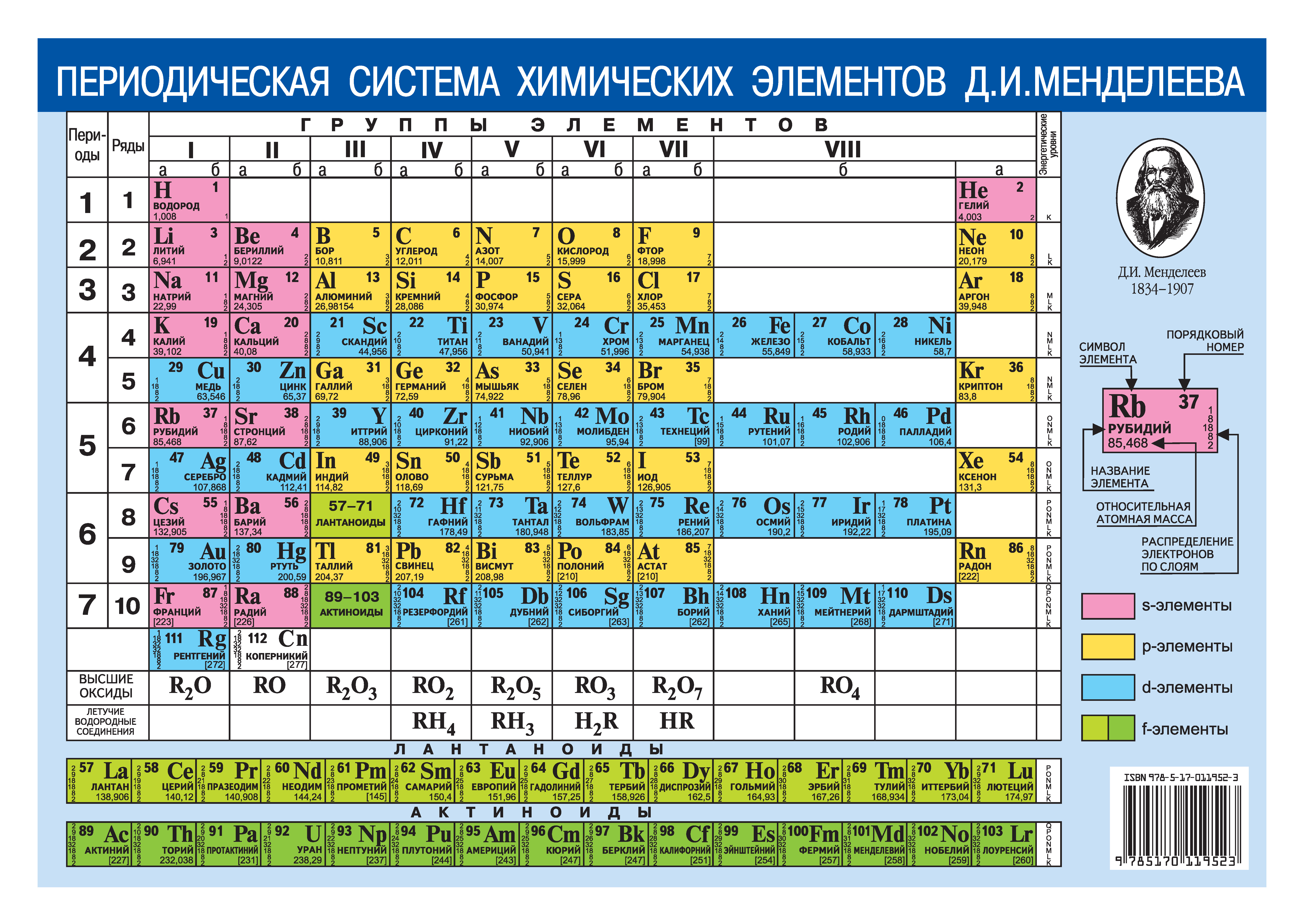
Следует, однако, отметить существование двух аномалий. Хром и медь имеют на своих 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или полностью заполненные подоболочки обладают большей устойчивостью, чем частично заполненные подоболочки.
В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов. Аналогичная аномалия наблюдается у серебра.
Все d-элементы являются металлами.
Электронные конфигурации элементов четвертого периода от скандия до цинка:
Характерные степени окисления d элементов:
Хром находится в 4-м периоде, в VI группе, в побочной подгруппе. Это металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. CrO — типичный основный оксид, Cr2O3 — амфотерный оксид, CrO3 — типичный кислотный оксид со свойствами сильного окислителя, т. е. рост степени окисления сопровождается усилением кислотных свойств.
Это металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. CrO — типичный основный оксид, Cr2O3 — амфотерный оксид, CrO3 — типичный кислотный оксид со свойствами сильного окислителя, т. е. рост степени окисления сопровождается усилением кислотных свойств.
Железо находится в 4-м периоде, в VIII группе, в побочной подгруппе. Железо — металл средней активности, в своих соединениях проявляет наиболее характерные степени окисления +2 и +3. Известны также соединения железа, в которых оно проявляет степень окисления +6, которые являются сильными окислителями. FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойств.
Медь находится в 4-м периоде, в I группе, в побочной подгруппе. Ее наиболее устойчивые степени окисления +2 и +1. В ряду напряжений металлов медь находится после водорода, ее химическая активность не очень велика. Оксиды меди: Cu2O CuO.![]()
Цинк находится в 4-м периоде, во II-группе, в побочной подгруппе. Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Оксид и гидроксид цинка являются амфотерными.
Школьники узнали секреты таблицы Менделеева на Всероссийском открытом уроке по химии
7 февраля прошел Всероссийский открытый урок «Менделеев? Элементарно!». Мероприятие, организованное Министерством просвещения РФ совместно с порталом «ПроеКТОриЯ», было посвящено Международному году Периодической таблицы химических элементов Д.И. Менделеева.
Во время урока ребята познакомились с человеком-легендой Юрием Оганесяном. В честь Юрия Цолаковича назван 118-ый химический элемент периодической таблицы — оганесон. Научный руководитель лаборатории ядерных реакций им. Г.Н. Флёрова Объединенного института ядерных исследований в Дубне объяснил зрителям, как получают новые элементы и отметил значимость открытия Менделеева: «Меня часто спрашивают: „Периодический закон на самом деле такой фундаментальный?“. Да! Природа создавала всё другим способом, мы это делаем в лаборатории тоже другим. Но если это атом, он должен быть сконструирован по вполне определенному закону. Именно по этому знаменитому Периодическому закону, которому сегодня исполняется 150 лет».
Да! Природа создавала всё другим способом, мы это делаем в лаборатории тоже другим. Но если это атом, он должен быть сконструирован по вполне определенному закону. Именно по этому знаменитому Периодическому закону, которому сегодня исполняется 150 лет».
Специальным гостем урока стал Григорий Трубников, первый заместитель Министра науки и высшего образования РФ. Он рассказал школьникам, кто такой — современный учёный:
«Это очень разносторонние люди: и в литературе, и в музыке, и в языках. Но самая главная черта, которая движет ученым — быть первым там, где никто никогда не был». И пригласил ребят в науку, потому что мы знаем об окружающем мире лишь 4% тайн природы.
Вице-президент Российского химического общества им. Д.И. Менделеева Юлия Горбунова
«Гениальность заключается в том, что Дмитрий Иванович не просто объединил их по сходству свойств, а ещё и предсказал появление новых элементов.
И на сегодняшний день 118 элементов располагаются по той самой структуре, которую придумал Менделеев».
Спикеры уделили внимание и самой сложной биохимической лаборатории — человеку. Степан Калмыков, декан химического факультета МГУ им. М.В.Ломоносова поделился с аудиторией «формулами» любви, рассказал, какие вещества отвечают за наши эмоции, и развеял миф о том, что хорошее образование можно получить только в столице.
«У нас появилось много хороших университетов не только в Москве и Санкт-Петербурге. Качественное образование вы можете получить далеко за их пределами — в Тюмени, Новосибирске, Красноярске, Томске», — добавил Степан Николаевич.
О новых материалах в современном протезировании рассказал научный сотрудник Центра композиционных материалов НИТУ «МИСиС» Фёдор Сенатов. Школьники из Тобольска поинтересовались, можно ли печатать элементы костной ткани на 3D-принтере и как быстро эта технология распространится по стране.
«Аддитивные технологии огромными шагами двигаются по всей России. Хорошие 3D-принтеры, способные напечатать костную ткань, есть во многих городах. Просто у каждого своя задача: можно печатать металлами, а можно — целыми клетками. Эти технологии есть, они активно развиваются, и это наше будущее», — ответил Фёдор.
Прямая трансляция урока была организована на портале «ПроеКТОриЯ» и в группах проекта в социальных сетях ВКонтакте и Одноклассники. К эфиру из Центра прототипирования высокой сложности «Кинетика» НИТУ «МИСиС» в режиме телемоста подключились ребята из Тобольска (родина Д.И.Менделеева), Чебоксар, Новокузнецка и Тюмени. Видеосвязь с точками подключения обеспечила компания «Ростелеком».
В конце урока модератор, известный теле—, радиоведущий Антон Комолов предложил педагогам и школьникам стать соавторами следующих открытых уроков и записать видео для рубрик «Просто о сложном» и «Поставь вопросом в тупик». А также объявил старт опроса «Кто из известных людей увлекался химией?». Правильные ответы зрители смогут узнать в группах «ПроеКТОрии» в социальных сетях.
Правильные ответы зрители смогут узнать в группах «ПроеКТОрии» в социальных сетях.
Следующий Всероссийский открытый урок состоится 21 февраля в 13:00 (мск) и будет посвящен градостроению и умным городам.
Закон нулевого уровня – Наука – Коммерсантъ
Русский ученый, химик Дмитрий Менделеев
Ничего сравнимого с Периодическим законом российская наука мировой не дала. Это открытие высшего, нулевого уровня, так сказал о Периодической таблице химических элементов Дмитрия Менделеева вице-президент РАН Алексей Хохлов. Что позволяет отнести открытие Менделеева, которому исполнилось 150 лет, к числу важнейших в истории науки?
Таблицы с двумя недостатками
За 40 лет до Менделеева сходные по свойствам элементы объединил в триады немецкий химик Иоганн Вольфганг Дёберейнер. Известны таблицы польского химика Леопольда Гмелина, немецкого врача, химика и гигиениста Макса Йозефа фон Петтенкофера, французского химика Жана Батиста Дюма.
Таблица с предсказаниями
6 марта 1869 года на заседании Русского химического общества Менделеев зачитал доклад «Опыт системы элементов, основанной на их атомном весе и химическом сродстве». В следующие полтора года Менделеев уточнил характер этой зависимости и 3 декабря 1870 года вывел окончательную формулировку закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Главное в Периодической системе Менделеева — ее предсказательная способность. Он не побоялся сказать, что набор элементов неполон; что существуют неоткрытые элементы с весами более легкими, чем уже известные,— иначе не складывается единая система. В таблице Менделеева появились ячейки для «экаалюминия», «экабора» и «экасилиция». Для каждого из этих элементов Менделеев предложил примерную атомную массу, набор ключевых химических и физических свойств. Кроме того, он указал на неправильно определенную массу 9 химических элементов и впоследствии описал еще 8 неизвестных науке элементов.
В таблице Менделеева появились ячейки для «экаалюминия», «экабора» и «экасилиция». Для каждого из этих элементов Менделеев предложил примерную атомную массу, набор ключевых химических и физических свойств. Кроме того, он указал на неправильно определенную массу 9 химических элементов и впоследствии описал еще 8 неизвестных науке элементов.
Глубокий патриот
Говорят, что на здоровье [Менделеева] сильно подействовал исход Японской войны. Будучи глубоким патриотом, он очень тяжело переживал наши неудачи на Дальнем Востоке, нередко даже плакал… К 1906 г. он как-то быстро стал дряхлеть, стал часто прихварывать. В этом году он два раза ездил за границу и как будто поправился. Но дни его были сочтены, и он сам уже как бы предчувствовал близкий конец.
Лев Чугаев, «Дмитрий Менделеев, жизнь и деятельность»
Таблица верна
Лотар Мейер, который выпустил в 1870 году работу «Природа элементов как функция их атомного веса», уже сослался на таблицу Менделеева. Мейер писал, что ему не хватило научной дерзости Менделеева, чтобы понять всю систему.
Мейер писал, что ему не хватило научной дерзости Менделеева, чтобы понять всю систему.
Но в работе русского ученого было столько нового, что часть научного сообщества встретила его исследование с недоверием. Тем более что он указывал на неправильно определенные характеристики уже открытых элементов. Прямой и жесткий, Менделеев не стеснялся открыто указывать людям на их ошибки — можно себе представить, как встретили академики его открытие.
Но в 1875 году во Франции открывают предсказанный «экаалюминий» (галлий), в 1879 году — «экабор» (скандий), а в 1885-м — «экасилиций» (германий). Характеристики каждого полностью укладываются в значения, предсказанные Менделеевым. И научный мир признает, что эта система — верная. Даже открытые сегодня, спустя 150 лет, химические элементы по-прежнему укладываются в эту систему. «Можно смело утверждать, что во Вселенной не существует химических элементов вне описанной Менделеевым системы»,— сказал декан химического факультета МГУ имени Ломоносова, член-корреспондент РАН и один из ведущих радиохимиков мира Степан Калмыков.
«Опыт системы элементов, основанной на их атомном весе и химическом сходстве», рукопись Д.И. Менделеева. Это прообраз современной таблицы химических элементов
Фото: Science & Society Picture Library / SSPL / Getty Images
Слишком вкусил от физиологии
Менделеев дал мне тему, рассказал, как приготовлять вещество, азотистометиловый эфир, что делать с ним, дал мне комнату, посуду, материалы, и я с великим удовольствием принялся за работу, тем более что не имел до того в руках веществ, кипящих при низких температурах, а это кипело при 12°C. Результаты той ученической работы описал сам Дмитрий Иванович. Быть учеником такого учителя, как Менделеев, было, конечно, и приятно, и полезно, но я уже слишком много вкусил от физиологии, чтобы изменить ей, и химиком не сделался.
«Автобиографические записки Ивана Михайловича Сеченова»
Таблица сокровищ
Как говорили великие люди (например, Генри Форд): «Не обязательно знать все. Главное — знать, где посмотреть». Периодический закон стал картой сокровищ для химиков, прямо указывая, какие элементы и с какими характеристиками стоит искать. Начался взрывной рост неорганической химии: понимание свойств и их изменений по группам и периодам позволило ученым либо впервые, либо более простым способом синтезировать множество новых неорганических соединений.
Главное — знать, где посмотреть». Периодический закон стал картой сокровищ для химиков, прямо указывая, какие элементы и с какими характеристиками стоит искать. Начался взрывной рост неорганической химии: понимание свойств и их изменений по группам и периодам позволило ученым либо впервые, либо более простым способом синтезировать множество новых неорганических соединений.
Но исследователи задались следующим вопросом: «Почему так, а не иначе?» В начале XX века с открытием радиоактивности, электрона, протона, а затем и нейтрона Периодический закон получил новые подтверждения, обрел дополнительный физический смысл. Оказалось, что порядковый номер элемента тождествен заряду ядра, что элементы разной массы, но с одинаковым зарядом ядра химически эквивалентны. Что электроны бегают вокруг ядра не кучкой, а по орбитам, что и приводит именно к таким химическим свойствам.
Ученые осознали и природу химической связи, из-за чего получили мощный толчок целые направления: каталитическая химия, квантовая химия, элементоорганическая химия, вычислительная химия и многие другие.
Не менее важно, пожалуй, и то, чего ученые не делали благодаря Периодическому закону. Понимая, как устроены химические элементы, исследователи не провели множества экспериментов.
Ругайся — и будешь здоров
Нельзя отрицать, что нрав у него был крутой, но он был вспыльчив, да отходчив. Слушать его крик, воркотню было иногда нелегко, но мы знали, что он кричит и ворчит не со зла, а такова уж его натура. Вероятно, в шутку он говорил, что держать в себе раздражение вредно для здоровья; надо, чтобы оно выходило наружу. «Ругайся себе направо-налево и будешь здоров».
Вячеслав Тищенко, «Воспоминания о Д. И. Менделееве»
Таблица с отклонениями
Первооткрыватель 10 трансурановых элементов, ректор Калифорнийского университета в Беркли, человек-элемент Гленн Теодор Сиборг и его коллеги в 1955 году решили назвать элемент №101 менделевием. Как писал Сиборг: «Согласно обычаю, ученые, получившие новый элемент, имеют право дать ему имя. Американские ученые предложили назвать элемент 101 менделевием — в честь великого русского химика, который первым использовал Периодическую систему для предсказания химических свойств неоткрытых элементов. Этот принцип явился ключевым при открытии почти всех трансурановых элементов и бесспорно сохранит свое значение в последующих попытках продвинуться в этой области науки».
Этот принцип явился ключевым при открытии почти всех трансурановых элементов и бесспорно сохранит свое значение в последующих попытках продвинуться в этой области науки».
Даже отклонения от Периодического закона, которые обнаружила при открытии последней пятерки элементов группа физиков под руководством еще одного человека-элемента, академика Юрия Оганесяна, также вытекают из этого закона. И каждое новое открытие так или иначе подтверждает величие закона Менделеева.
Он не гнался за патентованием изобретений, хотя за приоритет в открытиях бился жестко. Поэтому в признание его заслуг было бы правильно присвоить Периодической таблице его имя. И к такому решению постепенно склоняется все мировое сообщество. Неслучайно год 150-летия со дня открытия Менделеевым Периодического закона объявлен Международным годом Периодической таблицы химических элементов. Вероятно, вопрос о всемирном присвоении Периодической таблице химических элементов имени Менделеева в конце года будет поставлен на голосование перед IUPAC (Международным союзом теоретической и прикладной химии).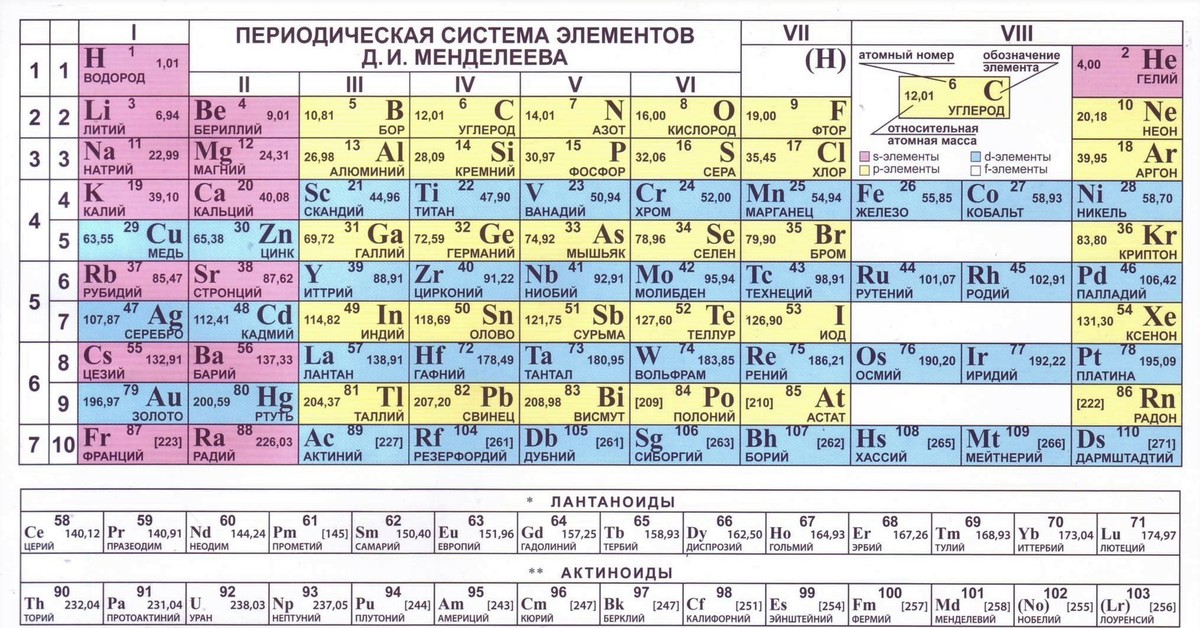
Валерий Сергеев
Переходные металлы комплексы и строение
Переходные металлы, Переходные металлы. переходные металлы — простые и сложные комплексы переходных металлов. Переходные металлы (переходные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом: . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на -орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Общая характеристика переходных элементов. Все переходные элементы имеют следующие общие свойства:
Небольшие значения электроотрицательности.
Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди. Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность. [8]
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами. [9]
[9]
Медь, Медные группы. Медь представляет собой довольно мягкий металл красно-жёлтого цвета. В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях (в азотной кислоте любой концентрации и в концентрированной серной кислоте):
таб?
В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди (II).
Для меди наиболее характерна степень окисления +2, однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Платиновые металлы
Основная статья: Металлы платиновой группы
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Нас находят по запросам:
— переходные металлы
— комплексы переходных металлов
— строение переходные металлы
— простые и переходные металлы
— галогениды переходных металлов
— нитриды переходных металлов
— комплексы переходных металлов
— сплав переходных металлов
— расчёт комплексов переходных металлов
— водорастворимые полимеры переходные металлы
— свойства комплексов переходных металлов
— структура переходных металлов
Урок 25. классификация химических элементов.понятие о группах сходных элементов.периодический закон и периодическая таблица д. и. менделеева – Химия – 8 класс
Классификация химических элементов. Понятие о группах сходных элементов. Периодический закон и периодическая таблица Д. И. Менделеева
Для ориентировки в мире окружающих нас веществ необходима их классификация.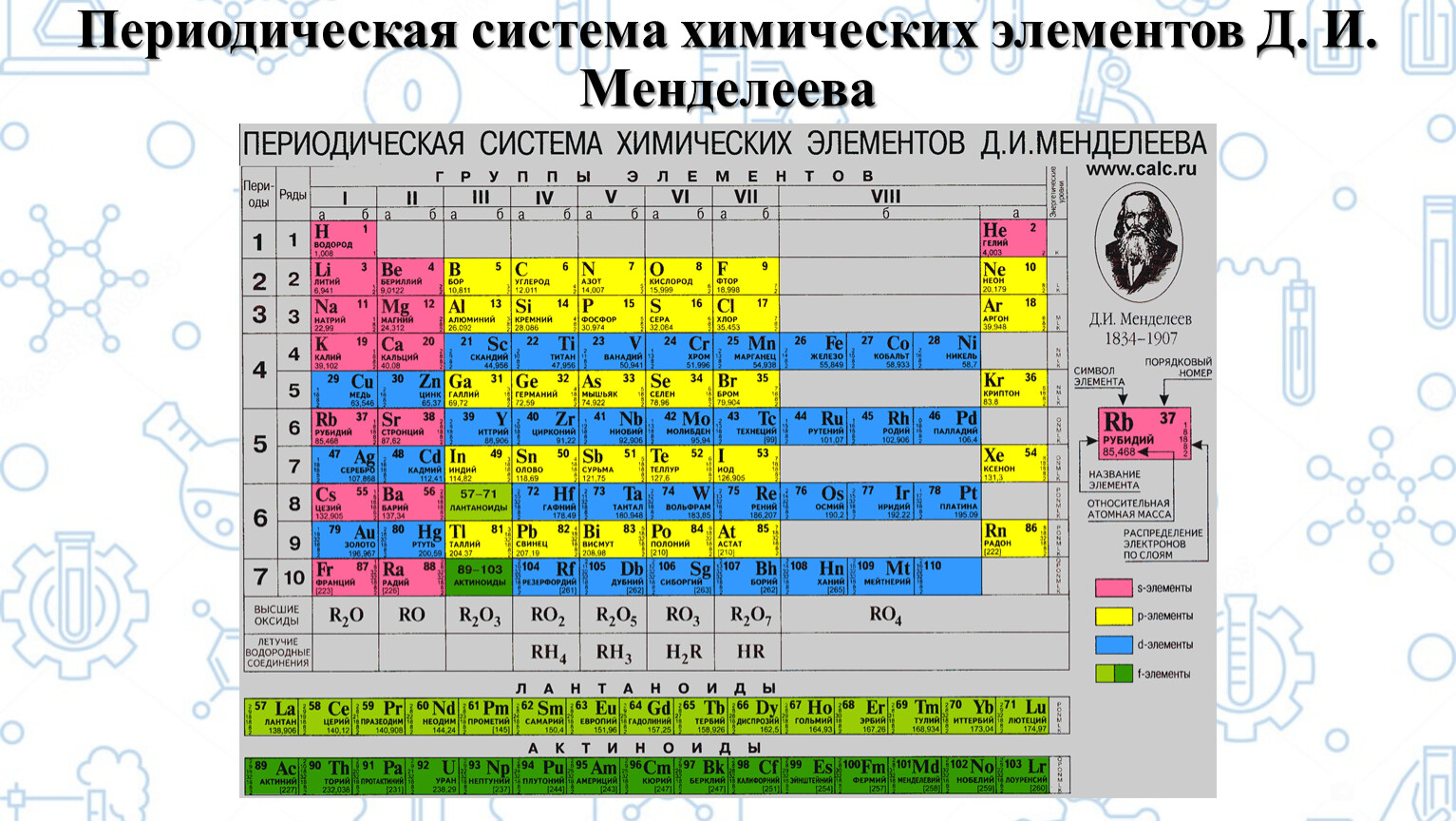 Попытки ее создать предпринимались с давних пор. Металлы уже с давних времён выделяли в отдельную группу. Михаил Васильевич Ломоносов говорил про металлы так: «Металлы – суть светлые тела, которые ковать можно». В этих словах заключено общее свойство металлов – ковкость. Если посмотреть на внешний вид металла, то мы заметим ещё одно сходство – все металлы обладают металлическим блеском. И ещё все металлы хорошо проводят тепло и электрический ток. Существуют физические свойства – общие для всех металлов, которые позволили их объединить под этим названием. А у неметаллов общих физических свойств нет. Общим в простых веществах-неметаллах является только то, что для них не характерны свойства металлов. На металлы и неметаллы стали разделять и химические элементы. Такая классификация была слишком условной, учёные не оставляли попыток боле точно классифицировать химические элементы.
Попытки ее создать предпринимались с давних пор. Металлы уже с давних времён выделяли в отдельную группу. Михаил Васильевич Ломоносов говорил про металлы так: «Металлы – суть светлые тела, которые ковать можно». В этих словах заключено общее свойство металлов – ковкость. Если посмотреть на внешний вид металла, то мы заметим ещё одно сходство – все металлы обладают металлическим блеском. И ещё все металлы хорошо проводят тепло и электрический ток. Существуют физические свойства – общие для всех металлов, которые позволили их объединить под этим названием. А у неметаллов общих физических свойств нет. Общим в простых веществах-неметаллах является только то, что для них не характерны свойства металлов. На металлы и неметаллы стали разделять и химические элементы. Такая классификация была слишком условной, учёные не оставляли попыток боле точно классифицировать химические элементы.
Дёберейнер Иоганн Вольфганг выявил сходство между химическими элементами, так называемое «Правило Триад»: элементы в триадах образуют сходные по составу со-единения и обладают сходными свойствами (например, общей формулой оксидов)
Li Na K;
Ca Sr Ba;
P As Sb;
S Se Te;
Cl Br I
В дальнейшем число элементов в триадах увеличилось до 4–5. Такие группы полу-чили своё название – естественные семейства химических элементов. К началу 60-х годов XIX века практически все известные химические элементы были объединены в естественные семейства.
Такие группы полу-чили своё название – естественные семейства химических элементов. К началу 60-х годов XIX века практически все известные химические элементы были объединены в естественные семейства.
Были предприняты и другие попытки создать единую систему химических элемен-тов. Александр Эмиль Бегье де Шанкуртуа Расположил химические элементы по спирали, пытаясь связать свойства с их атомной массой, Джон Александер Ньюлендс расположил элементы в таблицу по возрастанию их атомных масс и сформулировал закон Октав, Лотар-Юлиус Мейер рассмотрел общую систему химических элементов, расположив их по возрастанию атомных масс.
Все предложенные системы имели слишком много исключений из правил, в отли-чие от системы, созданной Дмитрием Ивановичем Менделеевым.
В основу системы были положены следующие подходы:
– расположение химических элементов в порядке возрастания их атомных масс;
учёт валентности и свойств образуемых ими соединений.
В таблице Менделеева были предусмотрены пробелы для ещё неоткрытых химиче-ских элементов. Открытие предсказанных химических элементов только подтвердило теорию Дмитрия Ивановича. С течением времени были изменены атомные массы некото-рых элементов, изменён порядок расположения элементов по сравнению с принципом возрастания атомной массы.
Открытие предсказанных химических элементов только подтвердило теорию Дмитрия Ивановича. С течением времени были изменены атомные массы некото-рых элементов, изменён порядок расположения элементов по сравнению с принципом возрастания атомной массы.
1869 год считается годом открытия периодического закона: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
Периодическую систему химических элементов можно представить в виде перио-дической таблицы. Каждый элемент занимает определённое место (клетку) и имеет свой порядковый (атомный) номер. Расположив химические элементы по возрастанию их атомных масс, Менделеев разделил эту последовательность на ряды (периоды), которые начинались щелочным металлом, а заканчивались инертным газом.
Например, элементы третьего периода – 11Na 12Mg 13Al 14N 15P 16S 17Cl
В периодах постепенно увеличивается высшая валентность химических элементов, свойства металлов сменяются неметаллическими свойствами.
Вертикальные ряды химических элементов тоже получили своё название – группы.
Малые периоды состоят только из элементов главных подгрупп, символы химических элементов побочных подгрупп находятся сбоку от символов главных. Элементы одной подгруппы обладают сходными свойствами:
1. Одинаковое значение высшей валентности
2. Одинаковые общие формулы высших оксидов, летучих водородных соеди-нений, гидроксидов.
3. Сходство в свойствах простых веществ и соединениях химических элемен-тов.
Как Россия и США заполняли таблицу Менделеева
Согласно решению ООН, 2019 год объявлен Международным годом периодической таблицы химических элементов. Открытие Менделеева, революционизировавшее химию, было сделано полтора века назад. Однако последняя точка в истории этой научной концепции до сих пор не поставлена.
В момент открытия периодического закона химикам было известно 63 элемента. С тех пор было открыто еще 55 — в среднем новый химический элемент открывали каждые три года. Однако сам характер подобных исследований существенно изменился. С середины ХХ века новые клетки таблицы заполняются искусственными элементами, синтезированными с помощью ускорителей. Главные действующие лица этого процесса уже не химики, а физики. А поскольку синтез новых элементов представляет собой высокотехнологичный и дорогостоящий процесс, в гонке за приоритет осталось лишь несколько участников — крупнейших лабораторий из России, США, Европы и Японии. Как и в космических исследованиях, здесь нашлось место и для элемента геополитического соперничества.
Однако сам характер подобных исследований существенно изменился. С середины ХХ века новые клетки таблицы заполняются искусственными элементами, синтезированными с помощью ускорителей. Главные действующие лица этого процесса уже не химики, а физики. А поскольку синтез новых элементов представляет собой высокотехнологичный и дорогостоящий процесс, в гонке за приоритет осталось лишь несколько участников — крупнейших лабораторий из России, США, Европы и Японии. Как и в космических исследованиях, здесь нашлось место и для элемента геополитического соперничества.
Самый тяжелый элемент, встречающийся в природе в сколько-нибудь заметных количествах, — это уран с атомным номером 92 (это значит, что в его ядре 92 положительно заряженных протона). Для получения более тяжелого элемента необходим ускоритель, где более легкие ядра будут врезаться в тяжелые и иногда сливаться с ними с образованием новых элементов, которые затем будут распадаться. По продуктам распада физики делают заключения о том, что именно там произошло. К примеру, если ядра урана бомбардировать ядрами неона с атомным номером 10, иногда будут получаться ядра синтетического элемента нобелия, занимающего в таблице 102-ю клетку (92+10=102).
К примеру, если ядра урана бомбардировать ядрами неона с атомным номером 10, иногда будут получаться ядра синтетического элемента нобелия, занимающего в таблице 102-ю клетку (92+10=102).
До начала 1960-х приоритет в синтезе новых элементов принадлежал США. Однако вскоре важным игроком стал Объединенный Институт Ядерных Исследований (ОИЯИ) в Дубне под Москвой. Элементы со 101-го по 106-й советские и американские физики синтезировали практически наперегонки. Приоритет в некоторых случаях оказывался предметом споров: так, элемент 104 (резерфордий) в СССР довольно долго был известен как «курчатовий», а элемент 102 (нобелий) по инициативе советских физиков первоначально получил имя «жолиотий» (в честь Фредерика Жолио-Кюри). Окончательное решение о названии элемента и приоритета в его открытии принимает Международный союз теоретической и прикладной химии (ИЮПАК).
На рисунке изображена таблица Менделеева со всеми элементами, экспериментально полученными к настоящему времени (источник иллюстрации — статья Сэма Кина в журнале Science). Можно видеть, как приоритет в заполнении новых клеток на протяжении конца ХХ — начала XXI вв. переходил от одного региона мира к другому.
Можно видеть, как приоритет в заполнении новых клеток на протяжении конца ХХ — начала XXI вв. переходил от одного региона мира к другому.
Приоритет СССР и России был связан с несколькими важными технологическими разработками, выполненными в ОИЯИ при участии или под руководством академика Юрия Оганесяна. К примеру, получение элементов с номером больше 104 (их называют сверхтяжелыми) требует специальных трюков, поскольку отталкивание положительно заряженных ядер становится слишком сильным, а если сталкивать их на большой скорости, избыток энергии приводит к тому, что ядро разваливается, не успев образоваться. Юрий Оганесян предложил в 1970-х метод «холодного слияния» — соединения двух ядер таким образом, чтобы вся кинетическая энергия в точности уходила на преодоление кулоновского отталкивания и в момент слияния ядра лишь «мягко касались» друг друга. Эта техника впоследствии была использована немецкими физиками из Дармштадта (Центр Гельмгольца по исследованию тяжелых ионов), которые с ее помощью получили элементы со 107-го по 112-й. Затем холодное слияние взяли на вооружение японцы из института RIKEN в Вако: в 2005 году они получили всего пару атомов элемента 113 (нихоний), обстреливая висмут ядрами цинка. Чтобы получить третий атом — именно столько нужно было для официальной регистрации открытия — понадобилось еще 7 лет. Именно тогда, в начале 2000-х, впервые дала сбой закономерность «каждые три года — новый элемент».
Затем холодное слияние взяли на вооружение японцы из института RIKEN в Вако: в 2005 году они получили всего пару атомов элемента 113 (нихоний), обстреливая висмут ядрами цинка. Чтобы получить третий атом — именно столько нужно было для официальной регистрации открытия — понадобилось еще 7 лет. Именно тогда, в начале 2000-х, впервые дала сбой закономерность «каждые три года — новый элемент».
Реклама на Forbes
Между тем, в конце 1990-х ОИЯИ был разработан новый способ синтеза, основанный на ядрах кальция-48. Это очень редкий и дорогой изотоп обычного кальция (атомный номер 20) с большим избытков нейтронов. Этот способ позволил российским физикам окончательно оторваться от погони. Их усилиями был заполнен 7-й ряд таблицы Менделеева. В 2012 году элемент №118 (впервые полученный еще в 2005-м) получил официальное имя «оганессон» — в честь академика Юрия Оганесяна, чей персональный вклад в синтез новых элементов признан во всем мире.
Чтобы продолжить заполнять таблицу дальше, исследователям понадобится решить несколько принципиальных вопросов. Один из них состоит в том, что для 119-го элемента фокус с ядрами кальция по техническим причинам неприменим. Большие надежды возлагают на новую установку, получившую название Superheavy Element Factore («Фабрика сверхтяжелых элементов», SHEF), которая была запущена в Дубне в конце прошлого года. Ожидается, что установка позволит получить элементы с номерами 119, 120 и 121. Тем самым будет начато заполнение восьмого ряда таблицы.
Один из них состоит в том, что для 119-го элемента фокус с ядрами кальция по техническим причинам неприменим. Большие надежды возлагают на новую установку, получившую название Superheavy Element Factore («Фабрика сверхтяжелых элементов», SHEF), которая была запущена в Дубне в конце прошлого года. Ожидается, что установка позволит получить элементы с номерами 119, 120 и 121. Тем самым будет начато заполнение восьмого ряда таблицы.
Сколько всего рядов у таблицы Менделеева, конечна ли она? Теоретики дают на эти вопросы самые разные ответы. Согласно одной из теорий, при числе протонов больше 172-х ядро начинает захватывать электроны, так что протоны превращаются в нейтроны и атомный номер возвращается к 172. Экспериментальная проверка этой и всех прочих теорий — один из резонов продолжения экспериментов по синтезу новых элементов. И хотя некоторые ученые ставят под сомнение научную ценность подобных работ (и, главным образом, оправданность огромных финансовых затрат), никто не отменял человеческого и идеологического аспекта: открытие новых элементов — один из способов утвердить приоритет национальной науки и тем самым убедить общество и государство в необходимости выделять достаточное финансирование для физических исследований.
Подробный рассказ о синтезе новых химических элементов в ОИЯИ опубликован на прошлой неделе в журнале Science. Статья отдает должное приоритету российских исследователей в синтезе новых элементов и признает особые заслуги 85-летнего Юрия Оганесяна, чья личная энергия легла в основу лидерства России в этой области науки.
элементы – это… Что такое d-элементы?
d-блок в периодической таблице элементов — электронная оболочка атомов, валентные электроны которых с наивысшей энергией занимают d-орбиталь.
Данный блок представляет собой часть периодической таблицы; в него входят элементы от 3 до 12 группы[1][2]. Элементы данного блока заполняют d-оболочку d-электронами, которая у элементов начинается s2d1 (третья группа) и заканчивается s2d10 (двенадцатая группа). Однако существуют некоторые нарушения в этой последовательности, например, у хрома s1d5 (но не s2d4) вся одиннадцатая группа имеет конфигурацию s1d10 (но не s2d9). Одиннадцатая группа имеет заполненные s- и d-электроны.
Одиннадцатая группа имеет заполненные s- и d-электроны.
D-блок-элементы также известны как переходные металлы или переходные элементы. Однако точные границы, отделяющие переходные металлы от остальных групп химических элементов, еще не проведены. Хотя некоторые авторы считают, что элементы, входящие в d-блок, являются переходными элементами[1], в которых d-электроны являются частично заполненными либо в нейтральных атомах или ионах, где степень окисления равна нулю[2][3]. ИЮПАК в данное время принимает такие исследования как достоверные и сообщает, что это относится только к 3—12 группам химических элементов[4]. Металлы 12ой вследствие полного заполнения d-оболочки не соответствуют классическому определению d-элементов, поэтому их можно считать и постпереходными металлами. Также было пересмотрено историческое применение термина «переходные элементы» и d-блока[5].
В s-блоке и p-блоке периодической таблицы аналогичные свойства, через периоды, как правило, не наблюдаются: самые важные свойства усиливаются по вертикали у нижних элементов данных групп. Примечательно, что различия элементов входящих в d-блок по горизонтали, через периоды, становятся более выраженными.
Примечательно, что различия элементов входящих в d-блок по горизонтали, через периоды, становятся более выраженными.
Лютеций и лоуренсий находятся в d-блоке, и они не считаются переходными металлами, но лантаноиды и актиноиды, что примечательно, таковыми считаются с точки зрения ИЮПАК[6]. Двенадцатая группа химических элементов хоть и находится в d-блоке, однако считается, что входящие в неё элементы являются постпереходными элементами[6].
См. также
Примечания
- ↑ 1 2 R.H. Petrucci, W.S. Harwood, F.G. Herring «General Chemistry». — 8-е изд. — Prentice-Hall, 2002. — С. 341—342.
- ↑ 1 2 C.E. Housecroft и A.G. Sharpe «Inorganic Chemistry». — 2-е изд. — Pearson Prentice-Hall, 2005. — С. 20—21.
- ↑ F.A. Cotton и G. Wilkinson «Advanced Inorganic Chemistry». — 5-е изд. — John Wiley, 1988. — С. 625.

- ↑ Международный союз теоретической и прикладной химии Transition element. Compendium of Chemical Terminology. — Internet edition. Архивировано из первоисточника 8 мая 2012. Проверено 29 сентября 2011.
- ↑ Jensen, William B. «The Place of Zinc, Cadmium, and Mercury in the Periodic Table» (англ.) 952—961. Journal of Chemical Education (2003). Архивировано из первоисточника 8 мая 2012. Проверено 29 сентября 2011.
- ↑ 1 2 IUPAC Provisional Recommendations for the Nomenclature of Inorganic Chemistry (англ.) (2004). — online draft of an updated version of the «Red Book» IR 3—6. Проверено 29 сентября 2011.
Сколько там элементов?
Таблица Менделеева.- В таблице Менделеева 118 элементов
- Число протонов в элементе дает атомный номер элемента
- В 2016 году в периодическую таблицу Менделеева было добавлено еще четыре элемента
Элемент – это вещество, состоящее из атомов одного вида. Все атомы в определенном элементе имеют один и тот же атомный номер. Элементы не могут быть далее разбиты на более мелкие вещества с помощью химических реакций. Однако они могут быть преобразованы в другие элементы только ядерными методами. Атомы в элементе содержат одинаковое количество протонов, но количество нейтронов варьируется. Когда количество протонов в атоме изменяется, тогда изменяется и элемент.
Все атомы в определенном элементе имеют один и тот же атомный номер. Элементы не могут быть далее разбиты на более мелкие вещества с помощью химических реакций. Однако они могут быть преобразованы в другие элементы только ядерными методами. Атомы в элементе содержат одинаковое количество протонов, но количество нейтронов варьируется. Когда количество протонов в атоме изменяется, тогда изменяется и элемент.
Каждый известный элемент имеет имя и номер, которые указаны в периодической таблице.В периодической таблице указаны электронная конфигурация каждого элемента, атомный номер элемента и химические свойства элемента. Атомный номер относится к числу протонов, обнаруженных в атоме элемента. Элементы можно разделить на три основные группы, которые включают металлы, неметаллы и металлоиды.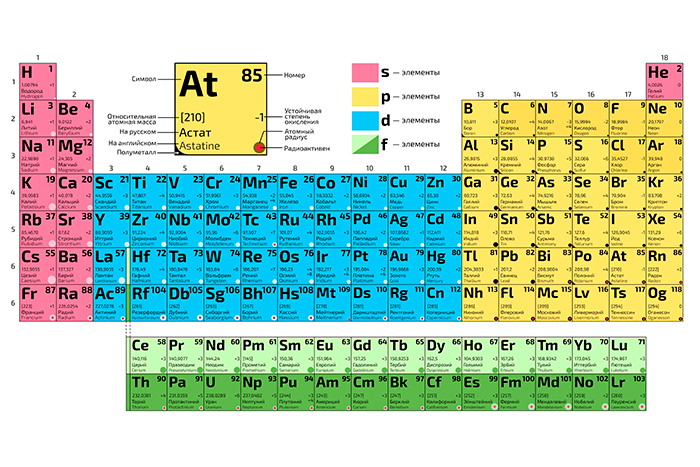 Элементы, расположенные в левой части таблицы Менделеева, обычно являются металлами. В то время как элементы в правой части таблицы Менделеева – неметаллы. Некоторые элементы, такие как водород и натрий, популярны, в то время как другие, такие как диспрозий, остаются неизвестными, потому что используются редко.Такие элементы, как медь, углерод и серебро, существуют уже тысячи лет.
Элементы, расположенные в левой части таблицы Менделеева, обычно являются металлами. В то время как элементы в правой части таблицы Менделеева – неметаллы. Некоторые элементы, такие как водород и натрий, популярны, в то время как другие, такие как диспрозий, остаются неизвестными, потому что используются редко.Такие элементы, как медь, углерод и серебро, существуют уже тысячи лет.
Периодическая таблица Менделеева содержит в общей сложности 118 элементов.Четыре из них были включены в список в 2016 году. Это Nihonium (113), Moskovi (115), Tennessine (117) и Oganesson (118). Первые 98 элементов, перечисленных в периодической таблице, встречаются в природе, а остальные можно найти только в ядерных ускорителях и лабораториях. Тридцать два из 98 элементов находятся в чистом виде. Остальные существуют в виде соединений. Восемьдесят природных элементов стабильны, что означает, что они не могут подвергаться радиоактивному распаду. Десять из 98 элементов существуют только в следовых количествах.Как правило, все элементы периодической таблицы с более высоким атомным номером, чем свинец, нестабильны, поэтому подвержены радиоактивному распаду. Хотя некоторые из обнаруженных элементов существуют естественным образом, лишь некоторые из них существуют в своей естественной форме. Среди немногих – благородные газы, которые нелегко образуют соединения, а также такие металлы, как медь, серебро и золото. Неметаллы, которые попадают в эту категорию, включают азот, кислород и углерод. Элементы, которые не существуют в их естественной форме, включают щелочные и щелочные металлы, а также редкоземельные элементы.
Редкие элементы получают в результате радиоактивного распада некоторых обычных элементов. Например, франций образуется из распавшегося актиния. Ряд элементов, недавно перечисленных в периодической таблице, возможно, образовался в результате распада неизвестных элементов, которые существовали долгое время.Родные элементы, с другой стороны, представляют собой естественные элементы в несоединенной форме. Однако лишь несколько природных элементов встречаются в сложной форме.
Например, франций образуется из распавшегося актиния. Ряд элементов, недавно перечисленных в периодической таблице, возможно, образовался в результате распада неизвестных элементов, которые существовали долгое время.Родные элементы, с другой стороны, представляют собой естественные элементы в несоединенной форме. Однако лишь несколько природных элементов встречаются в сложной форме.
В период с 2012 по 2016 год было обнаружено шесть новых элементов, которые заполнили пробелы, оставшиеся в нижней части таблицы Менделеева.В 2019 году исполнилось 150 лет с момента создания таблицы. Поскольку химические свойства известных элементов продолжают изменяться, новые открытия элементов продолжают происходить. Большинство изменений в таблице Менделеева будет результатом искусственных элементов, созданных учеными с помощью ускорителей высоких энергий. Однако, в отличие от природных элементов, с которыми можно работать, эти синтетические элементы, вероятно, будут нестабильными, поэтому быстро разлагаются. Тем не менее, есть возможность для более интересных открытий в атомном мире.
Поскольку химические свойства известных элементов продолжают изменяться, новые открытия элементов продолжают происходить. Большинство изменений в таблице Менделеева будет результатом искусственных элементов, созданных учеными с помощью ускорителей высоких энергий. Однако, в отличие от природных элементов, с которыми можно работать, эти синтетические элементы, вероятно, будут нестабильными, поэтому быстро разлагаются. Тем не менее, есть возможность для более интересных открытий в атомном мире.
Сколько там элементов?
| Рейтинг | Символ | Происхождение названия [2] [3] | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H | Водород | ||||||||||||
| 2 | He | Гелий | ||||||||||||
| 3 | Li | Литий | ||||||||||||
| 4 | Be | Бериллий | ||||||||||||
| 5 | B | Бор | ||||||||||||
| 6 | C | Углерод | ||||||||||||
| 7 | N | Азот | ||||||||||||
| 8 | O | Кислород | ||||||||||||
| 9 | F | Фтор | ||||||||||||
| 10 | Ne | Neon | 11 | Na | Натрий | |||||||||
| 12 | Mg | Магний | ||||||||||||
| 13 | Al | Алюминий | ||||||||||||
| 14 | Si | Кремний | ||||||||||||
| 15 | P | Фосфор | ||||||||||||
| 16 | S | Сера | ||||||||||||
| 17 | Cl | Хлор | ||||||||||||
| Ar | Аргон | |||||||||||||
| 19 | K | Калий | ||||||||||||
| 20 | Ca | Кальций | ||||||||||||
| 21 | Sc | Скандий | ||||||||||||
| 22 | т i | Титан | ||||||||||||
| 23 | V | Ванадий | ||||||||||||
| 24 | Cr | Хром | ||||||||||||
| 25 | Mn | Марганец | ||||||||||||
| 26 | Fe | Железо | ||||||||||||
| 27 | Co | Кобальт | ||||||||||||
| 28 | Ni | Никель | ||||||||||||
| 29 | Cu | Медь | ||||||||||||
| 30 | Zn | Цинк | ||||||||||||
| 31 | Ga | Галлий | ||||||||||||
| 32 | Ge | Германий | ||||||||||||
| 33 | As | Мышьяк | ||||||||||||
| 34 | Se | Селен | ||||||||||||
| 35 | Br | Бром | ||||||||||||
| 36 | Kr | Krypton | ||||||||||||
| 37 | Rb | Рубидий | ||||||||||||
| 38 | Sr | Стронций | ||||||||||||
| 39 | Y | Иттрий | ||||||||||||
| 40 | Zr | Цирконий | 55 | 55 | ||||||||||
| 41 | Nb | Ниобий | ||||||||||||
| 42 | Mo | Молибден | ||||||||||||
| 43 | Tc | Технеций | ||||||||||||
| 44 | Рутений | 900 50 | ||||||||||||
| 45 | Rh | Родий | ||||||||||||
| 46 | Pd | Палладий | ||||||||||||
| 47 | Ag | Серебро | ||||||||||||
| 48 | Cd | Кадмий | ||||||||||||
| 49 | In | Индий | ||||||||||||
| 50 | Sn | Олово | ||||||||||||
| 51 | Sb | Сурьма | 52 | Te | Теллур | |||||||||
| 53 | I | Йод | ||||||||||||
| 54 | Xe | Ксенон | ||||||||||||
| 55 | Cs | Cs | Cs | |||||||||||
| 56 | Ba 9 0055 | Барий | ||||||||||||
| 57 | La | Лантан | ||||||||||||
| 58 | Ce | Церий | ||||||||||||
| 59 | Pr | Празеодим | ||||||||||||
| 60 | Nd | Неодим | ||||||||||||
| 61 | Pm | Прометий | ||||||||||||
| 62 | Sm | Самарий | ||||||||||||
| 63 | Eu | Европий|||||||||||||
| 64 | Gd | Гадолиний | ||||||||||||
| 65 | Tb | Тербий | ||||||||||||
| 66 | Dy | Dysprosium | 67 | Ho | Ho лмий | |||||||||
| 68 | Er | Эрбий | ||||||||||||
| 69 | Tm | Тулий | ||||||||||||
| 70 | Yb | Иттербий | 71 | Lu | Лютеций | |||||||||
| 72 | Hf | Гафний | ||||||||||||
| 73 | Ta | Тантал | ||||||||||||
| 74 | W | Вольфрам|||||||||||||
| 75 | Re | Рений | ||||||||||||
| 76 | Os | Осмий | ||||||||||||
| 77 | Ir | Иридий | ||||||||||||
| 78 | Pt | Платина | 90 060 | |||||||||||
| 79 | Au | Золото | ||||||||||||
| 80 | Hg | Меркурий | ||||||||||||
| 81 | Tl | Таллий | ||||||||||||
| 82 | Pb | Свинец | ||||||||||||
| 83 | Bi | Висмут | ||||||||||||
| 84 | Po | Полоний | ||||||||||||
| 85 | At | Астатин | ||||||||||||
| 86 | Rn | Радон | ||||||||||||
| 87 | Fr | Франций | ||||||||||||
| 88 | Ra | Радий | ||||||||||||
| 89 | Ac | Актиний | ||||||||||||
| 90 | 9 0054 ThТорий | |||||||||||||
| 91 | Па | Протактиний | ||||||||||||
| 92 | U | Уран | ||||||||||||
| 93 | Np | Нептуний | Нептуний | |||||||||||
| 94 | Pu | Плутоний | ||||||||||||
| 95 | Am | Америций | ||||||||||||
| 96 | Cm | Курий | ||||||||||||
| 97 | Bk | Берклий | ||||||||||||
| 98 | Cf | Калифорний | ||||||||||||
| 99 | Es | Эйнштейний | ||||||||||||
| 100 | Fm | Фермий | ||||||||||||
| 101 | Md 900 55 | Менделевий | ||||||||||||
| 102 | № | Нобелий | ||||||||||||
| 103 | Lr | Лоуренсий | ||||||||||||
| 104 | Rf | Rutherford60 | ||||||||||||
| 105 | Db | Дубний | ||||||||||||
| 106 | Sg | Сиборгий | ||||||||||||
| 107 | Bh | Бориум | ||||||||||||
| 10855 | Hs Калий | |||||||||||||
| 109 | Mt | Мейтнерий | ||||||||||||
| 110 | DS | Дармштадций | ||||||||||||
| 111 | Rg | Рентгений | 112 9005 4 Cn | Copernicium | ||||||||||
| 113 | Nh | Nihonium | ||||||||||||
| 114 | Fl | Flerovium | ||||||||||||
| 115 | Mc | Moscovium | ||||||||||||
| 116 | Уровень | Ливерморий | ||||||||||||
| 117 | Ts | Теннессин | ||||||||||||
| 118 | Ог | Оганессон |
- org/BreadcrumbList”>
- Дом
- Среда
- Сколько там элементов?
Спец. Сайт Dr.Периодическая таблица элементов
Периодическая таблица AR TEL – это периодическая таблица элементов с функциями дополненной реальности (AR). Он доступен в виде плаката и доступен на этой странице.
Специальное бесплатное приложение для смартфонов оживляет расширенную периодическую таблицу AR, чтобы сделать обучение увлекательным. С включенным повествованием эти анимации позволяют глубже понять элементы.
Существует две версии периодической таблицы Менделеева: одна на японском языке, а другая – на английском.Используйте приложение для управления камерой AR, которая поддерживает вашу версию.
Использование приложения
Загрузите приложение Tokyo Electron AR (бесплатно) или обновите его до последней версии. Как только он запустится, наслаждайтесь анимированными кадрами с карточками элементов.
Поддерживаемые устройства
ОС: iOS 11.3 и новее или Android 7.0 и новее
(в зависимости от технических характеристик на некоторых моделях смартфонов она может работать некорректно)
Примечания:
- Пользователи могут нести плату за передачу данных при загрузке или использовании этого приложения.
- Приложение может работать некорректно при слабом подключении к Интернету. Перед использованием убедитесь, что сигнал сильный.
- Карты элементов могут не обнаруживаться, если часть карты закрыта.
- Наслаждайтесь приложением с периодической таблицей элементов TEL издания 2017 года.

Просмотр периодической таблицы AR с экрана компьютера
- Прокрутите до Периодической таблицы AR на этой странице и щелкните карточку элемента, чтобы увеличить ее.Откройте приложение, запустите камеру AR и удерживайте ее над увеличенной карточкой элемента.
* Apple, логотип Apple, iPhone и iPad являются товарными знаками Apple Inc., зарегистрированными в США и других странах и
регионы. App Store является знаком обслуживания Apple Inc. * Google Play и логотип Google Play являются товарными знаками Google LLC.
* Плата за передачу данных взимается при загрузке приложений.
Разные цвета представляют разные группы элементов со схожими свойствами.
Новые элементы и их обозначения, заявленные в 2016 году
- ・ Элемент 113 / Название: Nihonium / Символ: Nh *
- ・ Элемент 115 / Название: Московиум / Символ: Mc *
- ・ Элемент 117 / Название: Tennessine / Символ: Ts *
- ・ Элемент 118 / Название: Оганессон / Символ: Ог *
* Названия и символы одобрены IUPAC (Международный союз теоретической и прикладной химии)
Химические характеристики каждого элемента основаны на IUPAC.
- * 1. Бериллий и магний иногда исключаются из этой группы.
- * 2. Скандий, иттрий, лютеций и лоуренсий в группе 3 также являются элементами d-блока. Однако на этой таблице они были окрашены как редкоземельные элементы или актиноиды.
- * 3. «Состояние при комнатной температуре» и «Классификация металлических / неметаллических / металлоидных элементов» для элементов от фермия до оганесона (элементы 100–118) являются оценочными (по состоянию на апрель 2017 г.).Хотя химические характеристики теннессина неизвестны, он был обозначен цветом как галоген из-за того, что исходный элемент имел формат галогена. Более того, хотя химические характеристики оганессона неизвестны, он был обозначен цветом как благородный газ, потому что название элемента дано в формате благородного газа.
- Значения атомного веса основаны на «Таблице атомных весов 2017 года», редактируемой Химическим обществом Японии.
Использование и приложения, написанные в описании каждого элемента, являются примерами.
Вся материя, известная человеку, состоит из атомов. Атомы состоят из ядра, содержащего протоны и нейтроны, которое окружено электронами. Элементы – это общие имена, используемые для классификации атомов с различными свойствами.
У каждого атома всегда одинаковое количество электронов и протонов, при этом номер элемента равен количеству электронов / протонов в атоме. Другими словами, водород (атомный номер 1) имеет один электрон и один протон, гелий (атомный номер 2) имеет два электрона и два протона и так далее.Периодическая таблица – это метод, с помощью которого мы упорядочиваем все эти элементы по их атомным номерам.
Таблица Менделеева позволяет с первого взгляда понять свойства каждого элемента, поэтому она используется в качестве полезного руководства в областях химии и физики.
Периодическая таблица и элементы организма
2.1: Периодическая таблица и элементы организма
Обзор
Элементы – это мельчайшие единицы вещества, которые не могут быть расщеплены химическими процессами. Известно 118 элементов, но не все они встречаются в природе, и еще меньше жизненно необходимых. Живое вещество состоит в основном из углерода, азота, водорода и кислорода с меньшим количеством других элементов, таких как кальций, фосфор, калий и сера. Другие элементы также необходимы для жизни, но только в следовых количествах.
Известно 118 элементов, но не все они встречаются в природе, и еще меньше жизненно необходимых. Живое вещество состоит в основном из углерода, азота, водорода и кислорода с меньшим количеством других элементов, таких как кальций, фосфор, калий и сера. Другие элементы также необходимы для жизни, но только в следовых количествах.
Периодическая таблица содержит информацию о физических и химических свойствах элементов
В периодической таблице элементы организованы на основе их физических и химических свойств.Атомный номер элемента соответствует количеству протонов в его ядре, и каждый квадрат в периодической таблице также содержит полное название, химический символ и атомный вес элемента. Число протонов дает информацию о размере элемента, но это не единственный организационный принцип, лежащий в основе структуры периодической таблицы. Элементы организованы в столбцы (группы) и строки (периоды) на основе других физических и химических свойств, таких как реакционная способность, расположение их самых удаленных электронов и способность создавать определенные типы связей. Элементы в одной группе (т. Е. Столбце) различаются по размеру, но имеют много общих химических свойств друг с другом. Напротив, элементы в одном периоде (то есть в ряду) более похожи по размеру и имеют свои электроны, расположенные в аналогичном месте, но сильно различаются по своим химическим свойствам.
Элементы в одной группе (т. Е. Столбце) различаются по размеру, но имеют много общих химических свойств друг с другом. Напротив, элементы в одном периоде (то есть в ряду) более похожи по размеру и имеют свои электроны, расположенные в аналогичном месте, но сильно различаются по своим химическим свойствам.
Основные элементы и микроэлементы составляют тело человека
Вся жизнь на Земле содержит элементы кислород, углерод, водород и азот. Точнее, 96% человеческого тела состоит из этих четырех элементов.Остальные 4% состоят в основном из кальция, фосфора, калия, серы, натрия, хлора и магния в порядке относительного содержания. Кроме того, некоторые элементы необходимы для человека, но их содержание в организме составляет менее 0,01%; они называются микроэлементами. Несмотря на то, что они присутствуют в небольших количествах, микроэлементы по-прежнему важны для здоровья. Железо, например, играет важную роль в красных кровяных тельцах, помогая связывать кислород, чтобы его можно было транспортировать по кровеносной системе. Недостаток железа может привести к железодефицитной анемии, которая характеризуется симптомами, вызванными недостатком кислорода, включая усталость, одышку, слабость и нерегулярные сердечные ритмы.
Недостаток железа может привести к железодефицитной анемии, которая характеризуется симптомами, вызванными недостатком кислорода, включая усталость, одышку, слабость и нерегулярные сердечные ритмы.
Некоторые элементы вредны для живых организмов
Некоторые элементы даже в малых дозах оказывают вредное воздействие на здоровье. Ртуть, например, является одним из нескольких тяжелых металлов, которые могут вызывать ряд симптомов в малых дозах – в зависимости от пораженной ткани – и вызывать смерть в больших дозах.Со временем он может накапливаться в тканях многоклеточных организмов, поэтому повторное воздействие является проблемой. Новые способы удаления тяжелых металлов из окружающей среды с использованием биологических методов – биоремедиации – требуют исследований, чтобы понять как химический состав загрязняющих веществ, так и биологию первых организмов, на которые они влияют. Тяжелые металлы часто попадают в пищевую сеть на уровне первичных продуцентов, прежде чем они затронут организмы на более высоких трофических уровнях, такие как люди.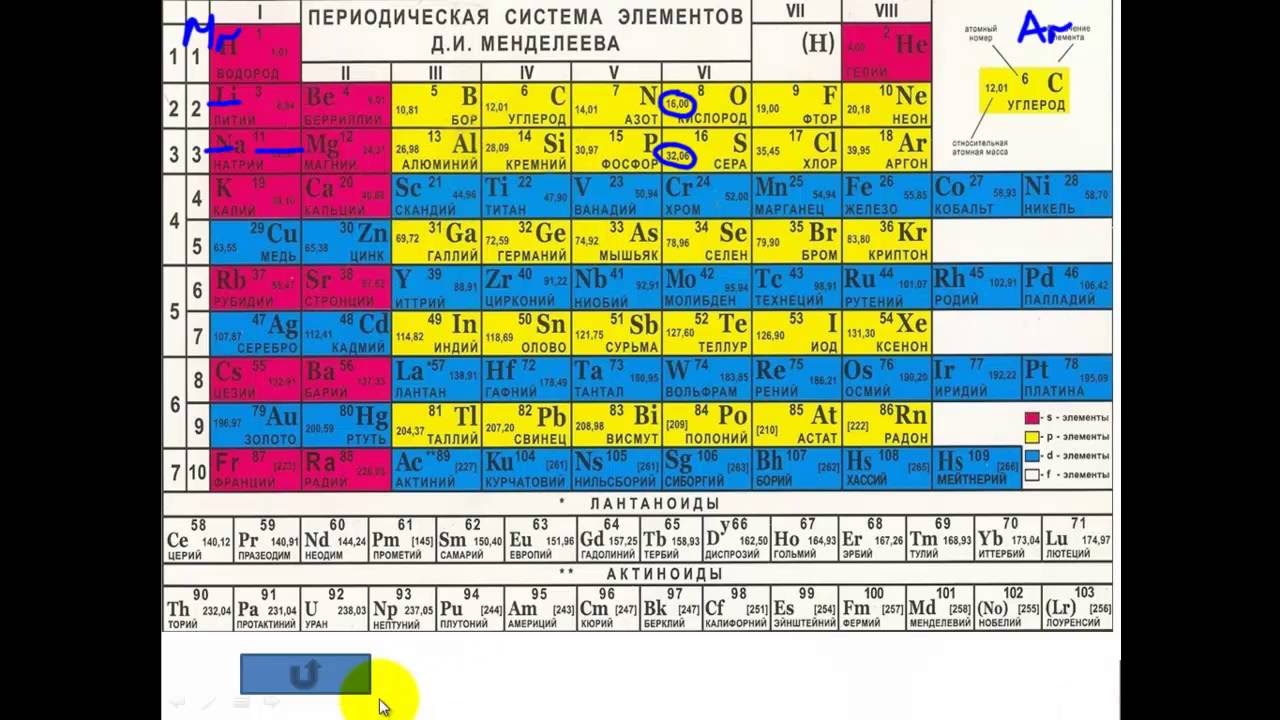
Рекомендуемая литература
Райс, Кевин М., Эрнест М. Уокер, Миаозонг Ву, Крис Джиллетт и Эрик Р. Блаф. «Ртуть в окружающей среде и ее токсическое воздействие». Журнал профилактической медицины и общественного здравоохранения 47, no. 2 (31 марта 2014 г.): 74–83. [Источник]
Раскрытые элементы: интерактивная периодическая таблица
Газ, жидкий или твердый, радиоактивный или стабильный, реактивный или инертный, токсичный или безвредный, узнайте, что делает ваш любимый элемент уникальным
РекламаОсновные источники и многое другое для изучения:
- Прочтите «В поисках сверхтяжелых элементов и остров стабильности» в мартовском выпуске Scientific American за 2018 год.Большинство этих массивных элементов чрезвычайно недолговечны, но теория предсказывает, что если ученые смогут создавать атомы с правильными комбинациями протонов и нейтронов, они могут стать стабильными и сохраняться в течение минут, дней или даже лет.

- В честь встречи в Линдау в 2013 году, посвященной химии, мы обновили нашу интерактивную таблицу Менделеева, добавив ссылки на серию эссе «In Your Element» от Nature Chemistry. Каждое эссе рассказывает историю определенного элемента, часто описывая его открытие, историю и возможное использование.
- В октябрьском номере журнала Scientific American за 2011 год мы отмечаем Международный год химии. Узнайте больше о его влиянии на нашу повседневную жизнь в нашем специальном отчете.
- Справочник отравителя: убийство и зарождение судебной медицины в эпоху джаза, Нью-Йорк . Дебора Блюм. Penguin Press; 2010.
- Исчезающая ложка: и другие правдивые сказки о безумии, любви и мировой истории из Периодической таблицы элементов .Сэм Кин. Литтл, Браун и компания; 2010.
- В твоей стихии. Ежемесячная колонка журнала Nature Chemistry
- История и использование химических элементов нашей Земли: справочное руководство .
 Роберт Э. Кребс.
Роберт Э. Кребс. - Химия в ее элементе подкаст от Chemistry World.
- Элементы , Том Лерер.
- Майкл Батталья «Я был хранителем элементов подросткового возраста».
- Трещины в Периодической таблице, Эрик Скерри.
- Это все элементарно: десятилетия идей от лауреатов Нобелевской премии по химии, под редакцией Ферриса Джабра, введение Стюарта Кантрилла.
Интерактивное от Кристы Фуэнтес
ОБ АВТОРЕ (-И)
Давиде Кастельвекки – старший репортер Nature в Лондоне, освещающий физику, астрономию, математику и информатику.
Следуйте за Давиде Кастельвекки в Твиттере
Последние статьи Давиде Кастельвекки
Информационный бюллетень
Станьте умнее.Подпишитесь на нашу новостную е-мэйл рассылку.
Поддержите научную журналистику
Откройте для себя науку, меняющую мир. Изучите наш цифровой архив 1845 года, в который входят статьи более 150 лауреатов Нобелевской премии.
Подпишитесь сейчас!Лучшие книги и карточки с периодической таблицей
Одна из забавных вещей, связанных с отсутствием учебы в школе, – это возможность выбирать, о чем вы хотите узнать. Возьмем, к примеру, науку. Заставить запоминать таблицу Менделеева было непросто, но с прекрасной книгой Теодора Грея обо всех 118 элементах изучение того, из чего все сделано, еще никогда не было таким увлекательным занятием.Или так красочно! Здесь представлены невиданные ранее фотографические изображения каждого элемента, изображения, которые видны невооруженным глазом.
Книги Периодической таблицы Теодора Грея: Трилогия об элементах
Элементы
В этом бестселлере таблицы Менделеева элементы расположены в порядке их появления в таблице Менделеева. И у каждого элемента есть полный разворот, который включает его изображения в различных формах.Вы знаете, что такое кислород, но знаете ли вы, как он на самом деле выглядит в чистом виде? (Спойлер: великолепный синий.) В книгу также включены факты, цифры и рассказы об элементах, а также атомный вес, плотность, температура плавления и кипения, валентность, электроотрицательность, а также год и местоположение каждого элемента. элемент был обнаружен.
Распечатано более одного миллиона копий, The Elements – это информационная шахта для всех. (Видите, что я там делал?) А с его красивой фотографией и макетом, а также отрывным плакатом с впечатляющей визуальной периодической таблицей Теодора Грея, это идеальный подарок для любителей науки, фотографии или всех, кто любит учиться.
Молекулы
В этом издании в мягкой обложке любимой второй книги бестселлера Теодора Грея (1,5 миллиона экземпляров) трилогии «Элементы» Грей демонстрирует, как элементы периодической таблицы объединяются в молекулы, которые образуют то, что составляет наш мир.
Molecules – вторая книга в популярной трилогии «Элементы», тираж которой составляет миллион экземпляров. В книге Molecules Теодор Грей делает следующий шаг в истории, которая началась с периодической таблицы в его бестселлере Элементы: визуальное исследование каждого известного атома во Вселенной (2015) и завершилась публикацией из реакций: иллюстрированное исследование элементов, молекул и изменений во Вселенной (2017) .Здесь он исследует через увлекательные истории и потрясающие фотографии самые интересные, важные, полезные и красивые из миллионов химических структур, из которых состоит каждый материал в мире.
Грей начинает с объяснения того, как атомы связываются, образуя молекулы и соединения, а также с разницы между органической и неорганической химией. Затем он переходит к исследованию огромного множества материалов, которые могут создавать молекулы, в том числе: мыла и растворителей; липкие масла и масла; горные породы и руды; канаты и волокна; обезболивающие и опасные препараты; подсластители; духи и вонючие бомбы; краски и пигменты; и противоречивые соединения, включая асбест, ХФУ и тимеросал.
Большие великолепные фотографии, а также диаграммы соединений и их химических связей, визуализированные с невиданной ранее красотой, заполняют страницы и фиксируют молекулы в их различных состояниях.
Это идеальная книга для его преданных поклонников, которые стремились к большему, и для всех, кто увлечен тайнами материального мира.
Реакции
Долгожданная третья часть культовой трилогии «Элементы» Теодора Грея.Первые две игры, Elements и Molecules , разошлись тиражом более 1,5 миллиона копий по всему миру.
С Реакциями автор бестселлеров Теодор Грей продолжает путешествие по нашему молекулярному и химическому миру, которое началось с Tour de force The Elements и продолжилось с Molecules . В серии The Elements Грей дал нам невиданный прежде, завораживающий фотографический вид 118 элементов периодической таблицы.В книге Molecules , с той же феноменальной фотографической проницательностью, плюс прекрасно визуализированная компьютерная графика, он показал нам, как элементы объединяются, чтобы сформировать содержимое, составляющее нашу Вселенную, от поваренной соли до кислорода и множества цветов и запахов, которые окружают нас.
Наконец, мы достигли Реакций , в которых Грей снова применяет свои фотографии и рассказывание историй, демонстрируя, как молекулы взаимодействуют способами, которые необходимы для самого нашего существования.Книга начинается с краткого обзора элементов и молекул, а затем продолжается объяснение важных концепций, характеризующих химическую реакцию, включая энергию, энтропию и время. Затем он организован по типу реакции, включая такие главы, как «Фантастические реакции и их местонахождение», «О происхождении света и цвета», «Скучная глава», в которых мы узнаем о таких реакциях, как высыхание краски, трава. выращивание и кипение воды, и «Жажда скорости», включая такие темы, как погода, возгорание и огонь.
Лучшие карточки с периодической таблицей, головоломки, заметки и многое другое
Помимо всемирно известного бестселлера, есть еще несколько замечательных предметов, которые станут отличным подарком для поклонников The Elements или всех, кто любит яркие цвета, науку и обучение. Атом в твой список! (Извините, но не пожалейте.)
Головоломка Элементов
Эта головоломка размером 36 ″ X 16 ″ представляет собой красивое изображение потрясающей таблицы Менделеева Теодора Грея, сделанной из прочного высококачественного материала.1000 ярких деталей подарят часам увлекательное развлечение для любого любителя головоломок.
Колода фотографических карт Элементов
Эта колода таблицы Менделеева содержит красивые фотографии всех 118 элементов таблицы Менделеева. Каждая карточка размером 5 x 5 дюймов имеет полноразмерное изображение каждого элемента на лицевой стороне, а на оборотной стороне есть информация о нем, включая атомный вес, плотность, температуру плавления и кипения, валентность и процент найденного элемента. во Вселенной, в земной коре, в океанах и в людях; графики показывают точки плавления / кипения, плотность, электронную конфигурацию и атомный радиус; и увлекательный факт об элементе, а также дата его открытия.
Есть одна карточка для каждого элемента, плюс дополнительные карточки, которые объясняют устройство периодической таблицы, представляют элементы, отсортированные по различным свойствам, и предлагают действия и способы использования карточек. Эти уникальные информативные карточки с периодической таблицей идеально подходят для студентов, изучающих элементы, людей, которые хотят освежить свои знания, или для всех, кто любит красоту мира природы.
Блокноты Elements
Этот набор записных книжек в бумажном переплете включает захватывающее изображение из книги The Elements Теодора Грея.На каждом покрытии из матового лака есть великолепная фотография одного из трех важнейших элементов во Вселенной: водорода, кислорода и углерода. Каждый 48-страничный блокнот размером 5,7 x 1 x 7,6 дюйма с бумагой, не содержащей древесной кости, прошитой внакидку. Они идеального размера для карманов, сумочек, автомобильных солнцезащитных козырьков и многого другого!
Блокноты The Elements
Покажите миру, из чего вы сделаны, с помощью этих визуально привлекательных открыток.Этот восхитительный набор состоит из 10 полноцветных матовых карточек для заметок с бумажными конвертами, не содержащими древесной массы. Каждая коробка включает в себя пять различных рисунков (по 2 каждого) с надписью «Привет!», «Объятия + поцелуи», «Скучаю по тебе», «Спасибо» и полное изображение полной фотографической таблицы Менделеева с сообщением внутри. «Я думаю о тебе периодически». (Это комедия AU, вот здесь.)
Детские периодические книги Теодора Грея
Элементы ABC Теодора Грея
Восхитительная новая настольная книга Elements, которая учит ребенка в возрасте 0–3 лет всему азбуке и элементам периодической таблицы одновременно.С детским текстом и большими яркими красочными фотографиями!
ABC ELEMENTS содержит 26 элементов, которые представляют каждую из букв алфавита – A для алюминия, B для висмута, C для меди и т. Д. Каждая буква алфавита будет проиллюстрирована большой красивой фотографией элемента от Теодора. Знаменитая коллекция фотографических элементов Грея.
Мои первые элементы Теодора Грея
Познакомьте малыша с чудесными красочными элементами, из которых состоит его мир!
Эта настольная книга для младенцев в возрасте от 6 месяцев до 3 лет содержит большие, смелые и яркие фотографии из бестселлера для взрослых Теодора Грея The Elements , а также восхитительный, понятный для детей текст. Мои первые элементы включает 10 элементов, по одному на разворот. На каждом развороте есть большая фотография элемента на одной странице, например, железная подкова или самородок золота. На противоположной странице показаны фотографии тех мест в мире ребенка, где содержится элемент: от воздушных шаров для гелия до плавательного бассейна для хлора и водорослей для йода.
Теодор Грей является автором The Elements , Molecules и Reactions , а также Theodore Gray’s Completely Mad Science .Он является создателем бестселлеров для iPad «Elements» и «Molecules», которые были названы Apple «приложением недели», и был директором «Disney Animated» (также удостоенного награды Apple «iPad-приложение года». »). Грей несколько раз появлялся на сцене со Стивом Джобсом в качестве создателя программного обеспечения. Он также стал соучредителем Wolfram Research, Inc., создателя широко используемого программного обеспечения Mathematica и веб-сайта Wolfram Alpha. Он живет в Урбане, штат Иллинойс.
Ник Манн – фотограф Элементы: визуальное исследование каждого известного атома во Вселенной и многих других книг и комплектов Теодора Грея.Помимо того, что он сфотографировал больше элементов и соединений, чем, вероятно, кто-либо в мире, он также является опытным фотографом ландшафта, спорта и событий. Он живет в Урбане, штат Иллинойс.
Получайте рекомендуемые книги, предложения и многое другое от Hachette
Нажимая «Зарегистрироваться», я подтверждаю, что прочитал и согласен с Политикой конфиденциальности Hachette Book Group. и Условия использования
Либерти Харди – старший редактор Book Riot, соведущий All the Books, судья «Книга месяца» и, прежде всего, жадный читатель.Она живет в штате Мэн со своими кошками Миллеем, Фаррохом и Зевоном. Вы можете увидеть фотографии ее кошек и заказать уловы в Twitter @MissLiberty и Instagram @franzencomesalive.
goREACT
goREACTПериодическая таблица
Периодическая таблица упорядочивает элементы в соответствии с их свойствами. Один атом каждого элемента состоит из протонов, нейтронов и электронов. Количество электронов определяет реакцию элемента.Число протонов придает элементу индивидуальность. Посмотрите на разные группы, чтобы понять, как элементы будут реагировать.
Благородные газы обычно не реагируют, потому что они не стремятся набирать или терять электроны.
Щелочные и щелочноземельные металлы мягкие и плавятся при низких температурах. Они хорошо реагируют с неметаллами, потому что могут легко отдавать электроны для образования ионов.
Переходные металлы могут иметь небольшой заряд, что позволяет им легко связываться с неметаллами. Соединения с этими элементами имеют тенденцию быть окрашенными и обладают интересными магнитными свойствами.
Галогены – очень реактивные неметаллы, потому что они легко принимают электроны от других элементов.
Металлы-лантаноиды обладают высокой реакционной способностью, но их способность приобретать или терять электроны варьируется в зависимости от размера каждого элемента, поэтому они менее реактивны слева направо по таблице.
Актиниды Металлы радиоактивны, потому что у них недостаточно энергии, чтобы удерживать вместе протоны и нейтроны в ядре атома надолго. Они очень реактивны и могут получать или терять разное количество электронов в реакциях./>
Металлы проводят тепло и электричество и обычно теряют электроны в реакции.
Полуметаллы обладают свойствами между металлами и неметаллами и могут приобретать или терять разное количество электронов в реакциях.
Неметаллы плохо проводят тепло и электричество и обычно получают электроны в реакции.
Свойства элемента
Химические свойства элементов обычно представлены следующим образом:
Атомный номер – это количество протонов в элементе.Количество протонов в ядре атома – вот что отличает один элемент от другого.
Атомарный символ – это сокращение, используемое для обозначения определенного элемента. Символы часто, но не всегда, основаны на имени элемента.
Атомная масса – это средняя масса всех электронов, протонов и нейтронов в элементе.
Современная динамическая периодическая таблица элементов с подробными свойствами
Динамическая интерактивная периодическая таблица элементов – последняя версия периодической таблицы
Изучите новейшую интерактивную периодическую таблицу химических элементов с динамическими макетами.Что такое интерактивная динамическая периодическая таблица элементов? Вышеупомянутый динамический периодический Таблица элементов разработана таким образом, чтобы помочь студентам-химикам понять все о химических элементах. Эта полная таблица Менделеева основана на современной периодической классификации элементов. Вы можете узнать об именах, Атомный номер, протоны, электроны, окисление, орбитали, изотопы и все другие свойства элементов в современной периодической таблице. Визуализация тренда также доступна для всех ключевых свойств.Исследовать химических элементов, используя эту периодическую таблицу элементов с названиями, и вы также можете бесплатно скачать периодическую таблицу элементов для печати. Вы также можете исследовать свойства периодической таблицы химических элементов, используя «Современные тенденции в таблице Менделеева» (тенденции визуализации для всех свойств элемента) или «Сравнить элементы периодической таблицы». Наш инструмент сравнения периодических элементов позволяет сравнивать свойства периодических элементов бок о бок для всех 118 элементов.
Что такое Периодическая таблица? – Определение Периодической таблицы
Таблица Менделеева представляет собой табличное расположение химических элементы, упорядоченные по их атомному номеру (числу протонов), электронным конфигурациям и повторяющиеся химические свойства.Русский химик Дмитрий Менделеев издал первое широко признанное периодическое издание. таблица в 1869 году. Текущая Периодическая таблица состоит из 118 элементов. Ранние попытки классификации элементов – Триады Доберейнера, Закон октав Ньюленда, Периодическая таблица Менделеева.
Все элементы с атомными номерами от 1 (водород) до 118 (Оганессон) были открыты или синтезированы. В первые 94 элемента существуют в природе, хотя некоторые из них встречаются только в следовых количествах и были синтезированы в лабораториях до того, как их нашли в природе.Элементы с атомными номерами от 95 до 118 были только синтезированы в лабораториях или ядерных реакторах.
Какие недавние изменения в Периодической таблице?
Недавно в таблицу Менделеева были добавлены 4 новых элемента – Nihonium, Moscovium, Tennessine и Oganesson. Это добавление было подтверждено Международный союз теоретической и прикладной химии (IUPAC) 30 декабря 2015 г. и официально назван 28 ноября 2016 г.Атомные номера этих недавно добавленных элементов – 113, 115, 117 и 118.
Как читать периодическую таблицу
Эта Периодическая таблица с динамической химией охватывает все элементы периодической таблицы. Как легко понять периодическую таблицу Менделеева, у каждого возникает этот вопрос, когда они знакомятся с концепцией периодической таблицы. Мы разработали эту интерактивную динамическую периодическую таблицу таким образом, чтобы каждому было легко читать периодическую таблицу, понимать и изучать элементы и их свойства.
Каждая строка в Периодической таблице называется периодом, а каждый столбец в Периодической таблице называется группой.
- Все элементы в периоде Периодической таблицы имеют одинаковое количество орбиталей, начиная от одной орбитали в верхней строке до семи орбиталей в нижней строке Периодической таблицы. Мы видим увеличение на одну орбиталь в каждом ряду. Элементы в один и тот же период обладают схожими физическими свойствами.
- Все элементы в каждой группе Периодической таблицы имеют одинаковое количество электронов на внешней оболочке.Элементы в одной группе одинаково реагируют с другими элементами.
Интерактивный инструмент периодической таблицы – основные характеристики
Эта Периодическая таблица с динамической химией охватывает все элементы периодической таблицы. Из школы собираются ученики в эксперты отрасли, каждый может чему-то научиться с помощью этого инструмента.
Периодическая таблица с именем
Названия всех элементов таблицы Менделеева
Периодическая таблица по группам
Динамическая таблица с группами периодической таблицы
Свойства периодической таблицы
Химические и физические свойства всех элементов периодической таблицы.
Блок периодической таблицы
Классификация таблицы Менделеева по блокам – с п д ф блок периодической сказки
Периодическая таблица с начислениями
Заряды всех элементов таблицы Менделеева
Периодическая таблица с цветовой кодировкой
Черно-белая и цветная периодическая таблица элементов.
Электронная конфигурация элементов
Электронная конфигурация всех элементов
Изобилие и стабильность
Возникновение элементов и соответствующие ядерные свойства
Таблица Менделеева по периодам
Динамическая таблица с периодами периодической таблицы
Сравнение элементов
Сравнить элементы друг с другом по всем объектам
Периодическая таблица с атомной массой
Атомная масса всех элементов таблицы Менделеева
Тренд периодической таблицы
Изучите различные тенденции Периодической таблицы с помощью нашего инструмента
Dynamic Periodic Table Trend ToolХронология открытия периодической таблицы
Знайте, когда были обнаружены или идентифицированы различные элементы таблицы Менделеева
Информация об элементах
Полная информация обо всех элементах таблицы Менделеева
Скачать Периодическую таблицу элементов
Вы можете бесплатно скачать распечатанную периодическую таблицу элементов, воспользовавшись приведенными ниже ссылками.Вы можете скачать эту таблицу Менделеева взять распечатать.
- Загрузить таблицу периодов в формате pdf: используйте эту ссылку, чтобы загрузить файл в формате pdf с таблицей периодов
- Скачать распечатанную периодическую диаграмму с названием, символом, числом и массой
- Скачать для печати таблицу Менделеева с названиями
- Скачать распечатанную таблицу Менделеева с цветовой кодировкой
- Скачать периодическую таблицу Менделеева для печати с начислениями
- Скачать периодическую таблицу элементов для печати
- Скачать распечатанную таблицу Менделеева для детей
- Скачать для печати периодическую таблицу элементов с названиями и обозначениями
- Скачать пустой печатный лист периодической таблицы для практических целей
Что такое 118 элемент таблицы Менделеева?
Текущая периодическая таблица состоит из 118 элементов.Элемент 118 – это Оганессон.
Сколько элементов в периодической таблице?
Текущая периодическая таблица состоит из 118 элементов. Все элементы от 1 (водород) до 118 (Оганессон) были открыты или синтезированы. Первые 94 элемента существуют в природе, хотя некоторые из них обнаружены только в следовых количествах и были синтезированы в лабораториях до того, как были обнаружены в природе. Элементы с атомными номерами от 95 до 118 были синтезированы только в лабораториях или ядерных реакторах.
.