Давление идеального одноатомного газа уменьшилось на 50 кПа. Газ находится в закрытом сосуде при постоянном объёме 0,3 м3. Какое количество теплоты было отдано газом….
Дано:
Δp = P₂-P₁ = 50kПа
V = const. = 0.3 м³
R = 8.31 Дж/моль*К
———————————-
Найти: Q – ?
Решение:
1. Единицы измерения переводим в систему СИ:
Δp = 50кПа = 50 000 Па
2. Газ находится в закрытом сосуде при постоянном объеме, значит, процесс изохорный. В изохорном процессе работа не совершается, так как ΔV=0:
А = p ΔV = 0
3. Газ в идеальном состоянии, значит, применяем уравнение Менделеева – Клапейрона для обоих состояний газа:
P₁V = νRT₁ (до уменьшения на 50кПа) (1)
P₂V = νRT₂ (после уменьшения на 50кПа) (2)
Отнимаем (1) из (2):
P₂V – P₁V = νRT₂ – νRT₁
VΔp = νRΔT (3)
4. Для расчета количества теплоты воспользуемся первым законом термодинамики:
Для расчета количества теплоты воспользуемся первым законом термодинамики:
Q = A + ΔU
где А – работа; ΔU – внутренняя энергия.
Для изохорного процесса это уравнение примет следующий вид:
Q = ΔU
Формула внутренней энергии для одноатомного газа:
ΔU = 3/2 νRΔT
Следовательно, Q = 3/2 νRΔT (4)
Выразим νR из равенства (3):
νR = VΔp/ΔT
Подставляем полученное в (4) и находим количество теплоты:
Q = 3/2 νRΔT = (3/2) * (VΔp/ΔT)* ΔT = (3/2) * VΔp =1.5*0.3*50000 = 22 500 Дж = 22.5кДж
Ответ: Q = 22.5кДж
Давление идеального одноатомного газа уменьшилось на 50 кПа. Газ находится в
Дано:
p = P-P = 50kПа
V = const. = 0.3 м
= 0.3 м
R = 8.31 Дж/моль*К
———————————-
Отыскать: Q – ?
Решение:
p = 50кПа = 50 000 Па
2. Газ находится в закрытом сосуде при постоянном объеме, означает, процесс изохорный. В изохорном процессе работа не совершается, так как V=0:
А = p V = 0
3. Газ в идеальном состоянии, означает, применяем уравнение Менделеева – Клапейрона для обоих состояний газа:
PV = RT (до убавления на 50кПа) (1)
PV = RT (после убавленья на 50кПа) (2)
Отнимаем (1) из (2):
PV – PV = RT – RT
V(P-P) = R(T-T)
Vp = RT (3)
4. Для расчета количества теплоты воспользуемся первым законом термодинамики:
Q = A + U
где А – работа; U – внутренняя энергия.
Для изохорного процесса это уравнение воспримет последующий вид:
Q = U
Формула внутренней энергии для одноатомного газа:
U = 3/2 RT
Как следует, Q = 3/2 RT (4)
Выразим R из равенства (3):
R = Vp/T
Подставляем приобретенное в (4) и находим количество теплоты:
Q = 3/2 RT = (3/2) * (Vp/T)* T = (3/2) * Vp =1.5*0.3*50000 = 22 500 Дж = 22.5кДж
Ответ: Q = 22.5кДж
2.1.10 Модель идеального газа в термодинамике
Видеоурок 1: Уравнение состояния идеального газаВидеоурок 2: Термодинамика: Внутренняя энергия идеального газа
Лекция: Модель идеального газа в термодинамике
Уравнение Менделеева-Клапейрона
Идеальный газ можно описать тремя основными макропараметрами: давлением, температурой и объемом. Все эти величины объединяет уравнение состояния, которые практически одновременно открыли два ученых, поэтому данный закон носит название уравнения Менделеева-Клапейрона:
Все эти величины объединяет уравнение состояния, которые практически одновременно открыли два ученых, поэтому данный закон носит название уравнения Менделеева-Клапейрона:
р – давление идеального газа
V – объем идеального газаm – масса газа
M – молярная масса газа
R – универсальная газовая постоянная
Т – абсолютная температура идеального газа
R – универсальная газовая постоянная, Дж/К*моль
k – постоянная Больцмана, Дж/К
NA – число Авогадро, 1/моль
Внутренняя энергия идеального газа
Все структурные единицы газа находятся в постоянном и непрерывном движении, поэтому все они обладают кинетической энергией.
Сумма кинетических энергий всех структурных единиц – внутренняя энергия газа.
Так как энергия одной структурной единицы вещества определяется по формуле:
, а таких единиц N:
, то внутренняя энергия идеального одноатомного газа равна:
.
Не сложно заметить, что данная формула похожа на правую часть уравнения Менделеева-Клапейрона. Поэтому можно сделать вывод, что найти внутреннюю энергию структурной единицы можно и по следующей формуле:
Данные уравнения соответствуют одноатомному газу. Если газ двухатомный, то внутренняя энергия равна:
Общий вид уравнения внутренней энергии:
Идеальный одноатомный газ – обзор
19.7 Функция разделения и плотность состояний
При подходящих обстоятельствах уровни энергии квантовых состояний системы можно рассматривать как квазинепрерывные. В частности, интервал между уровнями должен быть небольшим по сравнению с k B T , что часто возможно для больших систем, если температура не слишком низкая. В этих условиях сумма по составляет , которое используется для вычисления статистической суммы, а именно 18
В этих условиях сумма по составляет , которое используется для вычисления статистической суммы, а именно 18
(19.142) Z (β) = jexp (−βEj),
можно аппроксимировать интегралом вида
(19,143) Z (β) = ∫0∞e − βED (E) dE,
где D (E) известна как плотность состояний и учитывает интервалы и вырождение квантовых состояний. В частности, D (E) – это функция распределения, такая что D (E) dE – количество квантовых состояний в интервале энергий между E и E + d E . Уравнение (19.143) имеет ту же форму, что и преобразование Лапласа с переменной преобразования β .Следовательно, можно использовать формулу обращения Лапласа
(19,144) D (E) = 12πi∫BreβEZ (β) dβ
для вычисления D (E), зная Z ( β ). В формуле. (19.144), β рассматривается как комплексная переменная, и интегрирование проводится по контуру Br в комплексной плоскости, известной как контур Бромвича. Этот контур начинается при β = −i∞, идет вправо от всех сингулярностей 19 Z ( β ) и заканчивается при β = i∞. Можно использовать теорему Коши, чтобы деформировать контур и, таким образом, вычислить D (E) стандартными методами контурного интегрирования.
Этот контур начинается при β = −i∞, идет вправо от всех сингулярностей 19 Z ( β ) и заканчивается при β = i∞. Можно использовать теорему Коши, чтобы деформировать контур и, таким образом, вычислить D (E) стандартными методами контурного интегрирования.
Пример задачи 19,3
Вычислить преобразование Лапласа Z ( β ) статистической суммы для N атомов монотонного идеального газа, чтобы определить его плотность состояний D (E) и связать D (E) соответствующей функции Ω ( E ) микроканонического ансамбля.
Решение 19,3
Комбинируя уравнение. (19.48) с формулой. (19.56), мы видим, что статистическая сумма для N атомов одноатомного идеального газа равна
(19.145) Z (β) = (VnQ) NN! = VNN! M2πℏ2β3N / 2.
Таким образом,(19,146) D (E) = VNN! M2πℏ23N / 212πi∫BreβEβ3N / 2dβ.
Подынтегральное выражение, безусловно, имеет сингулярность при β = 0, но если N – нечетное целое число, также требуется разрез ветви, обычно взятый от β = 0 до β = −∞ вдоль вещественной оси, чтобы сделать его аналитическим. Но N большое, поэтому нам все равно, четное оно или нечетное. Поэтому мы временно делаем вид, что он четный, и в этом случае подынтегральная функция имеет полюс порядка 3N / 2 в начале координат. Таким образом, мы можем замкнуть контур в левой полуплоскости и применить теорему Коши, чтобы сжать контур до небольшого круга около β = 0.Хорошо известно, что результатом интегрирования является
Но N большое, поэтому нам все равно, четное оно или нечетное. Поэтому мы временно делаем вид, что он четный, и в этом случае подынтегральная функция имеет полюс порядка 3N / 2 в начале координат. Таким образом, мы можем замкнуть контур в левой полуплоскости и применить теорему Коши, чтобы сжать контур до небольшого круга около β = 0.Хорошо известно, что результатом интегрирования является(19,147) ∫BreβEβ3N / 2dβ = 2πiResidueeβEβ3N / 2 = 2πiE3N / 2−1 (3N / 2−1) !,
, где остаток означает извлечение коэффициента 1/ β. . Таким образом,(19,148) D (E) = VNN! (3N / 2−1)! ME2πℏ23N / 21E.
Отметим, что D (E) имеет размеры 1/ E , так что D (E) dE безразмерно, как и должно быть. В данном случае мы можем легко проверить наш результат, потому что уравнение (16.44) дает выражение для Ω, которое представляет собой общее количество микросостояний с энергией менее E .Дифференцирование относительно E показывает, что ∂Ω / ∂EN, V = D (E), как и должно быть (см. Уравнение (19.154) для более подробной информации).
Уравнение (19.154) для более подробной информации).Обратите внимание, что уравнение. (19.148) можно записать через гамма-функцию в виде
(19.149) D (E) = VNN! Γ (3N / 2) mE2πℏ23N / 21E.
Конечно, Γ (3N / 2) имеет смысл, даже когда 3N / 2 является полуцелым числом, поэтому мы подозреваем, что уравнение. (19.149) в целом может быть верным. Подстановка в уравнение. (19.143) показывает, что эта гипотеза верна.Отметим, что та же самая связь преобразования Лапласа сохраняется между плотностью состояний D1 (ε) отдельной частицы и ее статистической суммой z ( β ).Таким образом, для идеального газа
(19,150) z (β) = VnQ = Vm2πℏ2β3 / 2,
, поэтому
(19,151) D1 (ε) = VΓ (3/2) mε2πℏ23 / 21ε = V (1/2 ) π1 / 2mε2πℏ23 / 21ε, без спинового вырождения,
, где мы использовали Γ ( x + 1) = x Γ ( x ) и Γ (1/2) = π 1/2 . Этот результат совпадает с плотностью состояний G ( ε ) / 2, заданной уравнением. (25.13), где деление на 2 необходимо, поскольку G ( ε ) содержит множитель 2 из-за спинового вырождения.Поскольку D1 (ε) пропорционален V , часто имеют дело с интенсивной величиной
(25.13), где деление на 2 необходимо, поскольку G ( ε ) содержит множитель 2 из-за спинового вырождения.Поскольку D1 (ε) пропорционален V , часто имеют дело с интенсивной величиной
(19.152) D1 (ε) V = 1 (1/2) π1 / 2mε2πℏ23 / 21ε,
, которую также называют плотностью состояний и имеет единицы (объемная энергия) −1 . Поэтому нужно быть осторожным, чтобы выяснить из контекста, какая плотность состояний используется!
Строго говоря, нужно иметь D (E) = (1 / N!) ∂VR / ∂E, где V R определяется уравнением. (16.39) – общее количество микросостояний для всех энергий ≤ E .Но (1 / N!) VR = Ω (E) / F, где F задается формулой. (16,40). Следовательно,
(19,153) D (E) = ∂ (Ω / F) ∂E = 1F∂Ω∂E + ΩF23NΔE2E2exp − 3NΔE2E.
Второй член в уравнении. (19,153) пренебрежимо мало по сравнению с первым (из-за экспоненты) и F≈1, поэтому
(19,154) D (E) ≈∂Ω (E) ∂E
в отличном приближении.
Наконец, мы сделаем еще одну связь между микроканоническим ансамблем и каноническим ансамблем следующим образом. Для микроканонического ансамбля S = kBlnΩ (E); однако для канонического ансамбля
(19.155) S = U − FT = kBlnZ + UkBT = kBlnZeU / kBT.
Если E и U почти одинаковы, мы должны иметь
(19,156) ln (Ω (E)) ∼ln (Ω ~ (U)) ≡ln (ZeU / kBT).
Однако уравнение. (19.156) следует интерпретировать очень осторожно, потому что сравниваемые системы не совсем одинаковы. Ω ( E ) относится к микроканоническому ансамблю, для которого указана энергия E каждого микросостояния, тогда как Ω ~ (U) относится к каноническому ансамблю, для которого указана температура, поэтому только средняя энергия U ( Т ) уточняется.Следовательно, если мы возведем в степень обе части уравнения. (19.156) получаем
(19.157) Ω (E) ∼Ω ~ (U) ≡ZeU / kBT,
, что справедливо только в той степени, в которой lnΩ (E) ∼lnΩ ~ (U), когда частично расширенные члены пренебрегали.
Например, для идеального газа, для которого U = (3/2) NkBT, имеем
(19,158) Ом ~ (U) = 1N! VNmU3πℏ2N3N / 2e3N / 2.
Согласно формуле. (16.44) имеем
(19,159) Ω (E) = VN (mE / 2πℏ2) 3N / 2N! (3N / 2) !.
Мы видим, что множители, умножающие U3N / 2 и E3N / 2, не совсем одинаковы, но, поскольку N велико, мы можем использовать (3N / 2)! ∼N3N / 2e − 3N / 23πN, чтобы записать уравнение.(19,158) в виде
(19,160) Ω ~ (U) ∼3πNVN (mU / 2πℏ2) 3N / 2N! (3N / 2) !.
Таким образом, в термодинамическом пределе чрезвычайно большого N мы имеем
(19,161) lnΩ ~ (U) = lnΩ (E) + (1/2) ln (3πN)
, в котором последний член суб- обширный, а значит, незначительный. Также полезно использовать формулу. (19.148) с E → U, чтобы выразить Ω ~ (U) через плотность состояний, оцененную при энергии U , что дает
(19,162) Ω ~ (U) ∼2πU3N / 2D (U) = 2π3N / 2kBTD (U).
С учетом уравнения.(19.89), мы признаем фактор 3N / 2kBT = 〈(ΔE) 2〉 как меру разброса энергии при температуре T . Таким образом, уравнение. (19.162) можно записать
Таким образом, уравнение. (19.162) можно записать
(19.163) Ω ~ (U) ∼2π 〈(ΔE) 2〉 D (U),
, что ясно демонстрирует, что плотность состояний D (U) должна быть умножена на разброс энергия, чтобы приблизиться к числу микросостояний Ω ~ (U).
Для одной частицы идеального газа соответствие, подразумеваемое уравнением. (19.157) даст
(19.164) Ω1 (ε) ∼zexp (〈ε〉 / kBT) = ze3 / 2,
, что показывает, что z , по сути, является мерой количества состояний, доступных отдельной частице. при температуре Т .
Другой способ оценки Ω ~ в уравнении. (19.157) состоит в приближении статистической суммы
(19.165) Z = ∫0∞D (E) e − βEdE = ∫0∞e [−βE + lnD (E)] dE
путем разложения по наиболее вероятному государство. Для этого мы признаем, что D (E) – это быстро возрастающая функция от E , а e – βE – быстро убывающая функция от E . Таким образом, подынтегральная функция имеет резкий максимум при наиболее вероятном значении E *, которое удовлетворяет
(19. 166) 0 = ∂∂E [−βE + lnD (E)] E * = – β + [lnD (E *)] ′,
166) 0 = ∂∂E [−βE + lnD (E)] E * = – β + [lnD (E *)] ′,
, где штрих указывает на производную. Таким образом, мы можем разложить экспоненту в правом подынтегральном выражении в уравнении. (19,165) до второго порядка для получения
(19,167) −βE + lnD (E) = – βE * + lnD (E *) – (1/2) α (E − E *) 2 + ⋯,
где
(19,168) α: = – [lnD (E *)] ″> 0
положительно, поскольку E * соответствует резкому максимуму. Таким образом, при ξ = E – E *,
(19,169) Z≈D (E *) e − βE * ∫ − E * ∞e− (α / 2) ξ2dξ≈2π1αD (E *) e − βE *,
, где нижний предел во втором интеграле был аппроксимирован −∞, потому что пик очень резкий.См. Widom [17, Eq.1.25] для получения эквивалентного результата с его δE = 2 / α. Таким образом,
(19,170) Ω ~ ∼2π1αD (E *) e − β (E * −U).
Но разница 20 между E * и U составляет порядка k B T , поэтому экспонента в уравнении. (19.170) дает числовой коэффициент порядка 1, и результат очень напоминает уравнение. (19,162). В частности, для одноатомного идеального газа уравнение. (19.148) показывает, что D (E) = AE3N / 2−1, поэтому E * = (3N / 2−1) kBT и α = (3N / 2−1) / (E *) 2.Поскольку U = (3N / 2) kBT, уравнение. (19,170) становится
(19.170) дает числовой коэффициент порядка 1, и результат очень напоминает уравнение. (19,162). В частности, для одноатомного идеального газа уравнение. (19.148) показывает, что D (E) = AE3N / 2−1, поэтому E * = (3N / 2−1) kBT и α = (3N / 2−1) / (E *) 2.Поскольку U = (3N / 2) kBT, уравнение. (19,170) становится
(19,171) Ω ~ ∼2πE * 3N / 2−1D (E *) e = 2πU3N / 2−1D (U) e (E * / U) 3N / 2.
Но
(19,172) (E * / U) 3N / 2 = 3N / 2−13N / 23N / 2 = 1−23N3N / 2∼e − 2 / 3N3N / 2 = e − 1.
Таким образом, уравнение. (19,170) сокращается до
(19,173) Ω ~ ∼2πU3N / 2−1D (U) = 2π 〈(ΔE) 2〉 D (U),
, что прекрасно согласуется с уравнением. (19,163), потому что 1 в квадратном корне пренебрежимо мала.
Идеальный одноатомный газ | Азимут
Сегодня в Институте Топос Софи Либкинд, Оуэн Линч и я некоторое время говорили о термодинамике, двигателях Карно и тому подобном.В результате я хочу выработать для себя некоторые основные факты об идеальном газе.
Для фона цикл Карно выглядит примерно так:
На самом деле это очень неточная картинка, но она передает суть. У нас есть баллон с газом, и мы заставляем его совершать циклическое движение, поэтому его давление и объем образуют петлю на плоскости.Как видите, этот цикл состоит из четырех кривых:
• В первом, от a до b, мы помещаем емкость с газом в контакт с горячей средой. Затем мы заставляем его подвергаться изотермическому расширению, то есть расширению при постоянной температуре.
• Во втором, от b до c, мы изолируем контейнер и позволяем газу претерпевать адиабатическое обратимое расширение: то есть расширение, при котором тепло не входит и не выходит. Температура падает, но просто потому, что контейнер расширяется, а не потому, что уходит тепло.Достигает более низкой температуры. Затем снимаем изоляцию.
• В третьем, от c до d, мы помещаем контейнер в контакт с холодной средой, соответствующей его температуре. Затем мы заставляем его испытывать изотермическое сжатие, то есть сжатие при постоянной температуре.
Затем мы заставляем его испытывать изотермическое сжатие, то есть сжатие при постоянной температуре.
• В четвертом, от d до a, мы изолируем контейнер и позволяем газу претерпевать адиабатическое обратимое сжатие: то есть сжатие, пока тепло не входит и не выходит. Температура увеличивается до тех пор, пока не станет равной температуре горячей среды.Затем снимаем изоляцию.
Цикл Карно исторически важен, потому что это пример максимально эффективного теплового двигателя: он дает максимально возможную работу для данного количества тепла, передаваемого от горячей среды к холодной. Но я не хочу вдаваться в подробности. Я просто хочу найти формулы для всего, что здесь происходит, включая формулы для четырех кривых на этом рисунке!
Чтобы получить конкретные формулы, я буду рассматривать идеальный одноатомный газ, то есть газ, состоящий из отдельных атомов, например гелий.Некоторые характеристики идеального газа, например формула зависимости энергии от температуры, зависят от того, является ли он одноатомным.
В качестве необычного дополнительного бонуса я хотел бы подчеркнуть, как определенные свойства идеального одноатомного газа зависят от размерности пространства. Есть определенная часть теории, которая не зависит от размерности пространства, пока вы интерпретируете «объем» как означающий n -мерный аналог объема. Но число 3 появляется в формуле энергии идеального одноатомного газа.И это потому, что пространство трехмерно! Так что ради интереса я проведу весь анализ в измерениях
Нам нужно знать четыре основные формулы.
Во-первых, у нас есть закон идеального газа:
где
• – давление.
• – это объемный объем n .
• – количество молекул в баллоне с газом.
• постоянная, называемая постоянной Больцмана.
• – температура.
Во-вторых, у нас есть формула для энергии, или, точнее, внутренней энергии одноатомного идеального газа:
где
• – внутренняя энергия.
• – это размерность пространства.
Фактор n /2 проявляется благодаря теореме о равнораспределении: классически гармонический осциллятор при температуре имеет ожидаемую энергию, равную его количеству степеней свободы. Грубо говоря, дело в том, что в измерениях n существует n различных направлений, в которых атом может двигаться.
В-третьих, у нас есть связь между внутренней энергией, работой и теплом:
Здесь
• – дифференциал внутренней энергии.
• бесконечно малая работа, выполненная с до газа.
• бесконечно малая теплота, переданная к газу.
Интуиция проста: чтобы увеличить энергию какого-либо газа, вы можете воздействовать на него или передавать ему тепло. Но математика может показаться немного туманной, поэтому позвольте мне объяснить.
Я подчеркиваю «до», потому что это влияет на знак: например, работа, выполненная с по по газу, минус работа с по по газу. Работа, выполненная с по , газ увеличивает его внутреннюю энергию, а работа, выполненная с по , уменьшает его внутреннюю энергию.Аналогично для тепла.
Работа, выполненная с по , газ увеличивает его внутреннюю энергию, а работа, выполненная с по , уменьшает его внутреннюю энергию.Аналогично для тепла.
Но что это за “бесконечно малые” штуки и эти странные символы?
Через минуту я собираюсь выразить все в терминах и So, и буду функциями на плоскости с координатами, и будет 1-форма на этой плоскости: это дифференциал функции
Но и есть , а не дифференциалов функций, а Нет функций на плоскости, называемых а Нельзя брать баллончик с газом и измерять его работу, или тепло! Есть только 1-формы, называемые и описывающие изменение в работе или в тепле.Это не точные 1-формы: то есть они не дифференциалы функций.
Четвертый и последний:
Это должно быть интуитивно понятно. Работа, выполненная на : газ во внешнем мире, немного изменив его объем, равняется давлению, умноженному на изменение объема. Итак, проделанная работа с по газа равна минус давление, умноженное на изменение объема.
Одна приятная особенность 1-формы заключается в следующем: когда мы интегрируем ее вокруг простой замкнутой кривой, идущей против часовой стрелки, мы получаем площадь, ограниченную этой кривой.Итак, площадь данного региона:
кв.– это работа, выполненная нашим контейнером с газом во время цикла Карно. (Здесь есть много минусовых знаков, о которых стоит беспокоиться, но не волнуйтесь, они у меня под контролем. Наша кривая идет по часовой стрелке, поэтому работа, выполненная с по , наш баллон с газом отрицательна, и это минус площадь в обл.)
Хорошо, теперь, когда у нас есть четыре основных уравнения, мы можем поиграть с ними и вывести следствия. Предположим, что количество атомов в нашем сосуде с газом фиксировано – константа.Затем мы думаем обо всем как о функции двух переменных: и
Во-первых, так как у нас
Таким образом, температура пропорциональна давлению, умноженному на объем.
Второе, так как и у нас
Итак, как и температура, внутренняя энергия газа пропорциональна давлению, умноженному на объем, но зависит от размерности пространства!
Отсюда получаем
Из этой и наших формул получаем
Вот и все!
Но теперь мы знаем, как понять все о цикле Карно. Я не буду здесь все делать, но я разработаю формулы для кривых в этом цикле:
Я не буду здесь все делать, но я разработаю формулы для кривых в этом цикле:
Изотермические кривые просты, поскольку мы видели, что температура пропорциональна давлению, умноженному на объем:
Итак, изотермическая кривая – это любая кривая с
Адиабатические обратимые кривые, или для краткости «адиабаты», намного интереснее. Кривая на плоскости представляет собой адиабату , если, когда емкость с газом меняет давление и объем при движении по этой кривой, тепло не передается газу или от него.То есть:
, где забавный символ означает, что я ограничиваю 1-форму кривой и получаю 1-форму на этой кривой (которая оказывается нулевой).
Давайте разберемся, как выглядит адиабата! По нашей формуле мы имеем
или
или
Теперь мы можем объединить обе стороны вдоль части кривой и получить
или
Итак, в трехмерном пространстве, когда вы позволяете газу адиабатически расширяться – скажем, помещая его в изолированный цилиндр, чтобы тепло не могло проникать или выходить, – его давление падает по мере увеличения объема. Но для одноатомного газа оно падает таким своеобразным специфическим образом: давление увеличивается, как и объем, в степени -5/3.
Но для одноатомного газа оно падает таким своеобразным специфическим образом: давление увеличивается, как и объем, в степени -5/3.
В любом измерении давление одноатомного газа падает на более круто, , когда контейнер адиабатически расширяется, чем когда он расширяется при постоянной температуре. Почему? Потому что падает быстрее, чем с
г.А как,
, поэтому адиабаты становятся все ближе и ближе к изотермическим кривым в больших размерах.Это не важно для понимания концептуально значимых особенностей цикла Карно! Но это любопытно, и я хотел бы улучшить свое понимание, размышляя над этим, пока это не станет очевидным. Пока нет.
Эта запись была опубликована в четверг, 15 июля 2021 г., в 4:38 и относится к разделам химия, физика. Вы можете следить за любыми ответами на эту запись через канал RSS 2.0. Вы можете оставить отзыв или откликнуться со своего сайта.
Сообщение навигации
” Предыдущий пост Следующее сообщение »Теплоемкость газа
Теплоемкость вещества говорит нам, сколько тепла требуется, чтобы поднять определенное количество вещества на один градус. Для газа мы можем определить молярную теплоемкость C – тепло, необходимое для повышения температуры 1 моля газа на 1 К.
Для газа мы можем определить молярную теплоемкость C – тепло, необходимое для повышения температуры 1 моля газа на 1 К.
Q = nCΔT
Значение теплоемкости зависит от того, добавляется ли тепло при постоянном объеме, постоянном давлении и т. Д.
Теплоемкость при постоянном объеме
Q = нКл В ΔT
Для идеального газа применение Первого закона термодинамики говорит нам, что тепло также равно:
Q = ΔE int + W, хотя W = 0 при постоянном объеме.
| Для одноатомного идеального газа мы показали, что | ΔE внутр | = |
| нР ΔT |
Сравнение двух наших уравнений
| Q = nC V ΔT и Q = |
| нР ΔT |
мы видим, что для одноатомного идеального газа:
| С В | = |
| R |
Для двухатомных и многоатомных идеальных газов мы получаем:
| двухатомный: C V | = |
| R |
многоатомный: C V = 3R
Это из-за дополнительных 2 или 3 вкладов во внутреннюю энергию от вращений.
Поскольку Q = ΔE int при постоянном объеме изменение внутренней энергии всегда можно записать:
ΔE внутр = n C V ΔT
Теплоемкость при постоянном давлении
Для идеального газа при постоянном давлении для достижения такого же изменения температуры требуется больше тепла, чем при постоянном объеме. При постоянном объеме все добавленное тепло идет на повышение температуры. При постоянном давлении часть тепла уходит на работу.
Q = нКл P ΔT
Для идеального газа применение Первого закона термодинамики говорит нам, что тепло также равно:
Q = ΔE внутр + W
При постоянном давлении W = PΔV = nR ΔT
| Для одноатомного идеального газа, где | ΔE внутренний | = |
| нР ΔT | , получаем: |
| Q | = |
| нР ΔT | + nR ΔT | = |
| нР ΔT |
| Итак, для одноатомного идеального газа: C P | = |
| R |
Для двухатомных и многоатомных идеальных газов мы получаем:
| двухатомный: C P | = |
| R |
многоатомный: C P = 4R
Соотношение C
P / C V Оказывается, соотношение удельных теплоемкостей является важным числом. Для обозначения отношения используется символ γ. Для одноатомного идеального газа имеем:
Для обозначения отношения используется символ γ. Для одноатомного идеального газа имеем:
| γ | = |
| = |
| * |
| = |
|
Идеальные газы при постоянном объеме, постоянном давлении, постоянной температуре и адиабатических условиях
Идеально Газы в постоянном объеме, постоянном давлении, постоянной температуре, И адиабатические условия
Примечание
студенту: Следующий раздел представляет собой сокращение оценок колледжа
Я сделал вводную термодинамику. Его не так легко читать, как
предыдущие разделы. Я включил его сюда, потому что для меня он представлял
существенное объединение идей, изложенных в тексте и во время
лекция. Это обязательно пригодится первокурснику колледжа.
Его не так легко читать, как
предыдущие разделы. Я включил его сюда, потому что для меня он представлял
существенное объединение идей, изложенных в тексте и во время
лекция. Это обязательно пригодится первокурснику колледжа.
Уравнение состояния для идеального газа
| pV = RT |
где p – давление газа, V – объем, – число молей, R – универсальная газовая постоянная (= 8.3144 Дж / ( o К моль)), T – абсолютная температура. Первый закон термодинамики, закон сохранения энергии может быть записан в дифференциальной форме как
где
dq – ввод тепловой энергии в газ, du – изменение внутренней
энергия газа, а p dV – работа, совершаемая газом при расширении через
изменение объема dV.
Константа Объем процесса
Если V = const., то dV = 0, а из 2 dq = du; т.е. все тепловая энергия газа переходит во внутреннюю энергию газа. Мы следует ожидать повышения температуры. Если газ имеет удельную теплоемкость при постоянной объем C V (дж / ( o K моль)), то можно положить dq = С В dT. В этом случае следует, что
| ду = С В dT |
С du изначально не был указан, мы можем выбрать его математическую форму.Уравнение 2 будет сохраняться для du в оставшейся части. случаев.
Константа Процесс давления
Если p
= const. , то dp = 0, и, начиная с 1, p dV = R
dT; т.е. работа, совершаемая газом при расширении через дифференциал
объем dV прямо пропорционален изменению температуры dT. Если
газ имеет удельную теплоемкость при постоянном давлении C p , тогда dq
= C p dT, а, из 2 (с 3),
, то dp = 0, и, начиная с 1, p dV = R
dT; т.е. работа, совершаемая газом при расширении через дифференциал
объем dV прямо пропорционален изменению температуры dT. Если
газ имеет удельную теплоемкость при постоянном давлении C p , тогда dq
= C p dT, а, из 2 (с 3),
Упрощение дает важную определяющую взаимосвязь между C V , C p , и R, а именно:
Константа Температурный процесс
Если T = const., то dT = 0, а из 1 d (pV) = 0, т. е. давление и объем обратно пропорциональны. Далее, с 2, dq = p dV; т.е. нет изменения внутренней энергии (с 3, du = 0), и весь вклад тепла в газ идет на работу расширения.
Адиабатический Процесс
Если q
= const, то dq = 0, и, начиная с 2 (с 3),
0 = С В dT + p dV; я. е. внутренняя энергия газа может быть уменьшена в пользу
расширения или наоборот. Это выражение может быть записано в эквиваленте
форма как
е. внутренняя энергия газа может быть уменьшена в пользу
расширения или наоборот. Это выражение может быть записано в эквиваленте
форма как
(дивизия первого срока по RT, а второй член – на pV). Далее, с 1,
p dV + V dp = R dTили, эквивалентно | dp / p + dV / V = dT / T |
(дивизия левой стороны по pV, а правой стороны по RT).
Уравнения 5 и 6 могут использоваться для развития отношений между p и V или p и T:
Чемодан 1:
Устранить T, используйте 6 из 5 для dT / T, чтобы получить 0 = (C V / R) (dp / p + dV / V) + dV / V, или
– (С В / Р) dp / p = (1 + C В / R) dV / V |
Использование
4, мы можем написать C V / R = C V / (C p – С В ) = 1 / (-
1) где
= C p / C V , отношение удельных теплоемкостей (> 1;
на самом деле примерно 1. 4 для воздуха на СТП). Таким образом, уравнение 6a
становится (после упрощения)
4 для воздуха на СТП). Таким образом, уравнение 6a
становится (после упрощения)
который, после интегрирования дает
| п 0 / п = (В / В 0 ) | 7. |
и.е., давление изменяется обратно пропорционально увеличению объема.
Чемодан 2:
Устранить V, используйте уравнение 6 для записи dV / V = dT / T – dp / p и замените dV / V в ур. 5
(C V / R + 1) dT / T = dp / p
Продолжение как и раньше дает результат
/ ( – 1) | |
п / п 0 = (Т / Т 0 ) | 8. |
Энтропия изменения могут быть рассчитаны для каждого из вышеуказанных термодинамических процессов. Определение энтропии –
где dS – изменение дифференциальной энтропии.
Для постоянного объемные процессы, dq = C V dT, так что dS = C V dT / T и
| S = С В ln (Т / Т 0 ) | 10. |
Для постоянного процессы давления, dq = C p dT, так что dS = C p dT / T и
| S = C p ln (Т / Т 0 ) | 11. |
Для постоянного температурных процессов, dq = p dV, так что dS = p dV / T = R dV / V и
| S = R ln (В / В 0 ) | 12. |
Для адиабатического процессов, dq = 0, так что ds = 0 и
S = const.
Проблема :
Оцените скорость сухого адиабатического градиента для восходящего потока воздуха вблизи
земная поверхность.
Решение :
Скорость сухого адиабатического градиента для восходящего пучка воздуха вблизи земной
поверхность может быть оценена из приведенных выше выражений. (Для сравнения,
опубликованное значение – 5.5 o F на тысячу футов). Начнем
с уравнением Бернулли
(Для сравнения,
опубликованное значение – 5.5 o F на тысячу футов). Начнем
с уравнением Бернулли
| п + gh = p 0 | 13. |
где p – давление воздуха на высоте h над земной поверхностью, – плотность воздуха в кг / м 3 , г – ускорение свободного падения, p 0 – атмосферное давление у поверхности земли.Дифференцировать это выражение один раз, мы получаем
| дп + г dh = 0 |
Мы сейчас
запишем уравнение состояния идеального газа в виде p = nkT, где n –
плотность газа в м -3 , а k – постоянная Больцмана. Далее мы можем написать n = / M
где M – средняя молекулярная масса воздуха в кг. Используя это выражение
в уравнении состояния идеального газа и решение для,
у нас есть
= пМ / кТл. Подставляя этот результат в 13a, получаем
Далее мы можем написать n = / M
где M – средняя молекулярная масса воздуха в кг. Используя это выражение
в уравнении состояния идеального газа и решение для,
у нас есть
= пМ / кТл. Подставляя этот результат в 13a, получаем
дп + (пМг / кТ) dh = 0
Мы можем теперь разделите переменные и интегрируйте. При этом принято Предположим, что изменением T с h можно пренебречь (изотермическое приближение).Таким образом,
дп / п = – (Mg / kT) dh| или п / п 0 = е – (Мг / кТ) ч | 14. |
Срок
kT / Mg часто называют масштабной высотой атмосферы (т.е.
при котором расчетное давление падает до 1 / е от исходного значения; в
изотермическая атмосфера, это число имеет физический смысл). На земле
поверхности, при STP (стандартная температура и давление, 1 атм.) имеем
На земле
поверхности, при STP (стандартная температура и давление, 1 атм.) имеем
млн =
4,81 x 10 -26 кг
g = 9,81 м / с 2
k = 1,38 x 10 -23 j / o K
Т = 273 o К
так что высота шкалы составляет 7,99 км = 2,53 x 10 4 футов. Если теперь установить p 0 = 1 атм, то при h = 1000 футов, находим
п = 9,61 х 10 -1 атм.
Мы можем используйте это давление в уравнении 8 как оценку атмосферного давление (хотя уравнение 8 относится к адиабатическому атмосфере, а не изотермической), и вычислить температуру на высоте 1000 футов. Когда мы это делаем, мы находим
Т = 270 o Кили | Т
= 3 o K = 5. 4 o F 4 o F | 15. |
Это стоимость удовлетворительно близка к балансовой стоимости 5,5 o F за 1000 футов для удовлетворения наших потребностей.
Один моль идеального одноатомного газа первоначально при 300 К и давлении 15 атм расширяется до конечного давления 1 атм.Расширение может происходить одним из четырех различных путей: 1. изотермическим и …
.Вопрос:
Один моль идеального одноатомного газа первоначально при 300 К и давлении 15 атм расширяется до конечного давления 1 атм. Расширение может происходить по одному из четырех различных путей: 1. изотермический и обратимый, 2. изотермический и необратимый, 3. адиабатический обратимый и 4. адиабатический необратимый. В необратимых процессах расширение происходит при внешнем давлении 1 атм.для каждого случая вычислите значения q , w , Δ U и Δ H . Пожалуйста, покажите всю работу, пытаясь понять, как все взаимосвязано друг с другом.
Пожалуйста, покажите всю работу, пытаясь понять, как все взаимосвязано друг с другом.
Первый закон термодинамики:
Энергия в замкнутой изолированной системе постоянна, и энергия не может ни создаваться, ни разрушаться. Вместо этого энергия может быть преобразована только из одной формы в другую. Отметив, что энергия в изолированной системе постоянна, мы имеем следующее математическое выражение для изменения полной внутренней энергии ΔU:
$$ ΔU = Q-W $$
, где Q – количество тепловой энергии, подаваемой или забираемой из системы, а W – количество работы, выполняемой системой / над окружающей средой / окружающей средой.{V_2} \ dfrac {dV} {V} \\ = -nRT \; \ ln \; \ left (\ dfrac {V_2} {V_1} \ right) $$
$$ → W = -nRT \; \ ln \; \ left (\ dfrac {V_2} {V_1} \ right) $$
Или, по давлению:
$$ W = -nRT \; \ ln \; \ left (\ dfrac {P_1} {P_2} \ right) $$
Энтальпия системы:
Энтальпия системы определяется как:
$$ H = U + PV $$
Для изотермического процесса Δ H = 0, поскольку Δ U = 0 как следствие изотермического процесса и Δ ( PV ) = 0 в соответствии с законом Бойля.
Изотермический процесс:
В изотермическом процессе температура системы поддерживается постоянной на всем протяжении. С математической точки зрения это означает,
$$ T = \ text {константа} \\ Δ Т = 0 \\ $$
Поскольку изменение общей внутренней энергии зависит от температуры, для идеального газа нет изменений в общей внутренней энергии. Таким образом, первый закон термодинамики становится:
$$ Q – W = 0 \\ Q = W $$
Адиабатический процесс:
В адиабатическом процессе теплопередача отсутствует.γ = \ текст {константа} $$
где
$$ γ = \ dfrac {C_P} {C_V} $$
, где {eq} C_P {/ eq} и {eq} C_V {/ eq} – теплоемкости при постоянном давлении и объеме, соответственно. Для одноатомного идеального газа {eq} γ = \ dfrac {5} {3} {/ экв}.
Ответ и объяснение: 1
Путь 1: Изотермический обратимый
Работа, совершаемая идеальным газом, определяется по:
$$ W_ {rev} = \ rm – (1 \ space mol) (8. 3145 \ пробел Дж / К \ cdot моль) (300 \ пробел …
3145 \ пробел Дж / К \ cdot моль) (300 \ пробел …
См. Полный ответ ниже.
РЕШЕНИЕ: Идеальный одноатомный газ при 1 бар и 300 \ mathrm {K} адиабатически расширяется против постоянного давления \ frac {1} {2} бар, пока конечное давление не станет \ frac {1} {2} бар. Каковы значения q на моль, w на моль, \ Delta \ bar {U} и \ Delta \ bar {H}? Дано: \ bar {C} _ {V} = \ frac {3} {2} R.
Стенограмма видеозаписи
раствор Ансари перемешивали идеальный моноатом.У Guess начальное давление от 1,0 связи, то есть 1,0, умноженное на 1,132 атома. Начальная температура называется равной 300 по шкале Кальвина. Постоянное давление называется 0,500 бар, а конечное давление – 0,500 бар, учитывая, что CB, называемый тремя на два, следовательно, мы знаем формулу первого закона термодинамики, которую мы называем пальцем ноги. de que plus dw. Но проблема предоставления – это автоматический процесс. Итак, мы предположили, что d кабина 20 Так и будет. Тогда у нас есть dw, равное toe p external, то есть e x t v tu минус женщины.И здесь мы рассматриваем это как вопрос первый. Мы должны вычислить, мы хотим, и мы делаем это, чтобы вычислить, мы хотим, чтобы мы поместили значения в уравнение. Вычисляя это, мы получаем значение. У нас один – 24 балла против семи, а прагматичный – около 24,3. И в диабетическом процессе мы будем и я вызвали константу, так что у нас есть вопрос в P один на P равным вето. Мы выиграли лямбду Холла для моноатомного газа Их они назвали пятым на два, теперь подставляя значение для вычисления право вето в уравнении.Здесь мы подставляем значение и решаем это, и мы выходим из Вэлли. Мы двое – это 32,6 л, теперь руки из уравнения первое, что d W, равное 0,500, умноженное на 1,13, до 80 м, обратно на 32,7 минус 24,3 л. Здесь мы подставляем значения в уравнение один и, решая для этого, получаем значение, равное трем годам 398 У j есть три девятки. День отработанный, а Кармел – неидеальный.
Итак, мы предположили, что d кабина 20 Так и будет. Тогда у нас есть dw, равное toe p external, то есть e x t v tu минус женщины.И здесь мы рассматриваем это как вопрос первый. Мы должны вычислить, мы хотим, и мы делаем это, чтобы вычислить, мы хотим, чтобы мы поместили значения в уравнение. Вычисляя это, мы получаем значение. У нас один – 24 балла против семи, а прагматичный – около 24,3. И в диабетическом процессе мы будем и я вызвали константу, так что у нас есть вопрос в P один на P равным вето. Мы выиграли лямбду Холла для моноатомного газа Их они назвали пятым на два, теперь подставляя значение для вычисления право вето в уравнении.Здесь мы подставляем значение и решаем это, и мы выходим из Вэлли. Мы двое – это 32,6 л, теперь руки из уравнения первое, что d W, равное 0,500, умноженное на 1,13, до 80 м, обратно на 32,7 минус 24,3 л. Здесь мы подставляем значения в уравнение один и, решая для этого, получаем значение, равное трем годам 398 У j есть три девятки. День отработанный, а Кармел – неидеальный. Угадай, теперь tf равно toe t i. P два на p 11 минус один снова здесь. Подставляем значения в уравнение и решаем 40 f, и получаем WTF 198 K.Следовательно, Delta Magical Tow, N, C, P, Delta, T и C V плюс наша дельта T как значение CPC B плюс. И здесь мы подставляем значения в уравнение и решение для Delta Edge. И мы получаем окончательное значение минус 2,12 убийственных камня. Итак, это подробное решение. Шаг за шагом. Пожалуйста, пройдите через это. Спасибо.
Угадай, теперь tf равно toe t i. P два на p 11 минус один снова здесь. Подставляем значения в уравнение и решаем 40 f, и получаем WTF 198 K.Следовательно, Delta Magical Tow, N, C, P, Delta, T и C V плюс наша дельта T как значение CPC B плюс. И здесь мы подставляем значения в уравнение и решение для Delta Edge. И мы получаем окончательное значение минус 2,12 убийственных камня. Итак, это подробное решение. Шаг за шагом. Пожалуйста, пройдите через это. Спасибо.
Диаграммы давление-объем – Практика – Физический гипертекст
Вычислите изменение внутренней энергии в каждом сегменте, используя функцию состояния.
∆ U = 3 2 nR ∆ T
Сделайте это четыре раза и смотрите на знаки. Они важны для последующих вычислений.
| ∆ U A → B = | 3 2 (1 моль) (8,31 Дж / моль K) |
| ∆ U A → B = | + 6000 Дж |
| ∆ U B → C = | 3 2 (1 моль) (8. 31 Дж / моль K) 31 Дж / моль K) |
| ∆ U B → C = | + 9000 Дж |
| ∆ U C → D = | 3 2 (1 моль) (8,31 Дж / моль K) |
| ∆ U C → D = | – 12000 Дж |
| ∆ U D → A = | 3 2 (1 моль) (8.31 Дж / моль K) |
| ∆ U D → A = | – 3000 Дж |
Приступим к заполнению таблицы. Включите знак со всеми числами, связанными с путем. Числа давления, объема и температуры всегда положительны, поэтому добавление к ним знака было бы лишним. Мне нравится использовать красный цвет для отрицательных значений в таблице, но это личное предпочтение.
| состояние | A | Б | С | D | ||
|---|---|---|---|---|---|---|
| п. | (Па) | 100, | 100, | 200, | 200, | |
| В | (м 3 ) | 0.020 | 0,060 | 0,060 | 0,020 | |
| т | (К) | 240 | 720 | 1440 | 480 | |
| путь | А → В | В → С | С → D | D → А | ABCDA | |
|---|---|---|---|---|---|---|
| описание | изобарический | изохорный | изобарический | изохорный | замкнутый цикл | |
| Δ U | (Дж) | +6,000 | +9,000 | −12 000 | −3,000 | |
| Q | (Дж) | |||||
| Вт | (Дж) | |||||
Посчитайте работу, проделанную на каждом следующем сегменте. Это просто зона с вывеской. Обе площади под изохорами равны нулю. Обе области под изобарами представляют собой прямоугольники. Когда вы обнаруживаете область под сегментом, идущую в положительном направлении, это положительно. Когда вы идете другим путем, это отрицательно. Если вы предпочитаете производить вычисления систематически, вычислите прямоугольные области, используя базовое умножение на высоту, где «база» – это конечный минус начальный объем (порядок вычитания имеет значение), а «высота» – это объем.
Это просто зона с вывеской. Обе площади под изохорами равны нулю. Обе области под изобарами представляют собой прямоугольники. Когда вы обнаруживаете область под сегментом, идущую в положительном направлении, это положительно. Когда вы идете другим путем, это отрицательно. Если вы предпочитаете производить вычисления систематически, вычислите прямоугольные области, используя базовое умножение на высоту, где «база» – это конечный минус начальный объем (порядок вычитания имеет значение), а «высота» – это объем.
W = – площадь = – bh = – ( V 2 – V 1 ) P
Сделайте это дважды.
| Вт A → B = | – (0,060 м 3 – 0,020 м 3 ) 100000 Па |
| Вт A → B = | -4,000 Дж |
| W C → D = | – (0,020 м 3 – 0,060 м 3 ) 200000 Па |
| W C → D = | +8000 Дж |
Добавьте результаты в таблицу.
| состояние | A | Б | С | D | ||
|---|---|---|---|---|---|---|
| п. | (Па) | 100, | 100, | 200, | 200, | |
| В | (м 3 ) | 0.020 | 0,060 | 0,060 | 0,020 | |
| т | (К) | 240 | 720 | 1440 | 480 | |
| путь | А → В | В → С | С → D | D → А | ABCDA | |
|---|---|---|---|---|---|---|
| описание | изобарический | изохорный | изобарический | изохорный | замкнутый цикл | |
| Δ U | (Дж) | +6, | +9, | −12, | −3, | |
| Q | (Дж) | |||||
| Вт | (Дж) | −4,000 | 0 | +8,000 | 0 | |
Оставшиеся пустые ячейки заполняются по первому закону термодинамики…
∆ U = Q + W
или, в случае всего цикла ABCD, просто суммируя строку.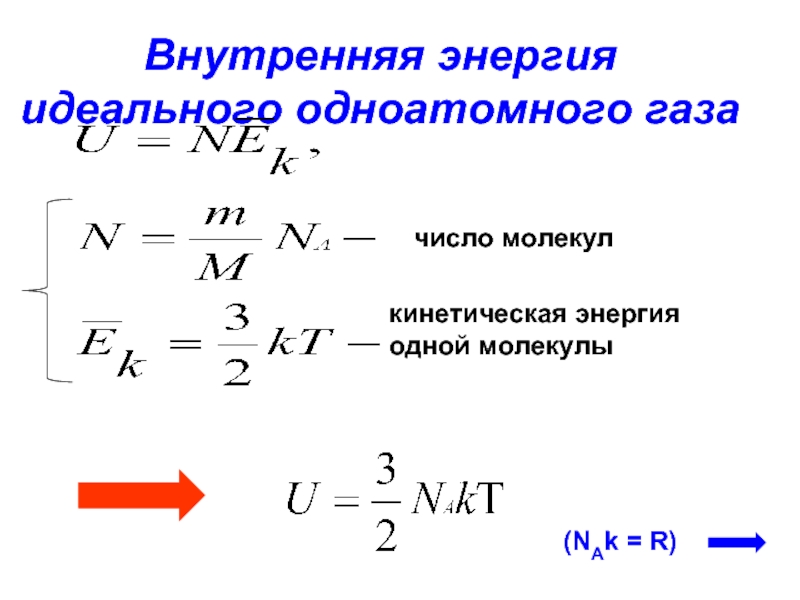
| состояние | A | Б | С | D | ||
|---|---|---|---|---|---|---|
| п. | (Па) | 100, | 100, | 200, | 200, | |
| В | (м 3 ) | 0.020 | 0,060 | 0,060 | 0,020 | |
| т | (К) | 240 | 720 | 1440 | 480 | |
| путь | А → В | В → С | С → D | D → А | ABCDA | |
|---|---|---|---|---|---|---|
| описание | изобарический | изохорный | изобарический | изохорный | замкнутый цикл | |
| Δ U | (Дж) | +6, | +9, | −12, | −3, | 0 |
| Q | (Дж) | +10,000 | +9,000 | −20,000 | −3,000 | −4,000 |
| Вт | (Дж) | −4, | 0 | +8, | 0 | +4,000 |



