Типы давления: абсолютное давление, избыточное давление, дифференциальное давление
- Казахстан Website
- Русский
- WIKA Группа компаний
- WIKA Центральная Азия
- Новости & Выставки
- Почему WIKA?
- Ваши перспективы
- Работая в ВИКА Казахстан
- Вакансии
- Контактные лица
- Анкета
- Обратная связь
- Наши реквизиты
- Месторасположение
- WIKA в мире
- Технические семинары
- Обработка заказов
- Акции на КИПиА WIKA
- E-бизнес
WIKA средства измерения давления
-
Все классы точности
-
Запрос
Вам нужно больше информации? Напишите нам.
К форме
Наравне с температурой давление является одним из наиболее важных параметров, описывающих физическое состояние среды. Давление определяется как сила (FN), постоянно действующая на заданную площадь поверхности (A). Типы давления отличаются друг от друга только по отношению к выбранному эталонному давлению.
Абсолютное давление
Наиболее приемлемым эталонным давлением является нулевое, которое существует в безвоздушном космическом пространстве. Любое давление относительно данного известно как абсолютное. Для отличия такого давления от других типов оно обозначается как “ abs”, что является сокращением от латинского слова “absolutus”, означающего отдельный, независимый.
Для отличия такого давления от других типов оно обозначается как “ abs”, что является сокращением от латинского слова “absolutus”, означающего отдельный, независимый.
Атмосферное давление
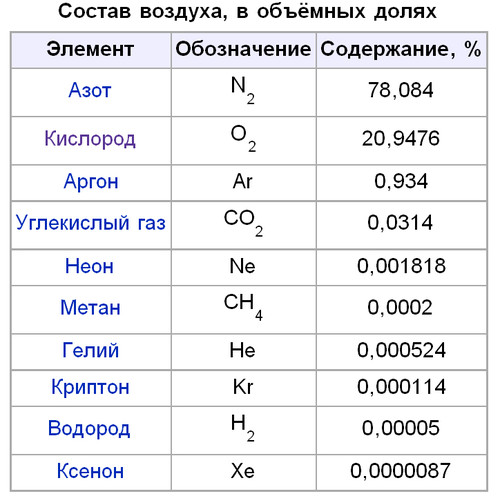
Наверное наиболее важным типом давления для жизни на земле является атмосферное давление, pamb (amb = ambiens = окружающий). Это давление образовано массой атмосферы, окружающей землю на высоте примерно до 500 км. До этой высоты, на которой абсолютное давление pabs = 0, его величина постоянно уменьшается. Тем не менее, атмосферное давление подвержено погодным колебаниям, что хорошо нам известно из ежедневного прогноза погоды. На уровне моря pamb в среднем составляет 1013,25 гектопаскаля (ГПа), что соответствует 1013,25 миллибара (мбар). Благодаря “циклонам” и “антициклонам” это давление может колебаться в пределах, примерно, 5 %.
Дифференциальное давление
Разница между двумя величинами давления p1 и p2 известна как перепад давления
Δp = p1 – p2. В случаях, когда разница между двумя значениями представляет собой измеренное значение переменной процесса, говорят о дифференциальном давлении p1,2.
В случаях, когда разница между двумя значениями представляет собой измеренное значение переменной процесса, говорят о дифференциальном давлении p1,2.
Избыточное (манометрическое) давление
К наиболее часто встречающемуся типу измеряемого давления на технологических объектах относится перепад атмосферного давления, Pe (e = excedens = превышение). Оно представляет собой разницу между абсолютным давлением Pabs и относительным (абсолютным) атмосферным давлением (pe = pabs – pamb), более известное как избыточное или манометрическое давление.
Понятие положительного избыточного давления используют, когда абсолютное давление превышает атмосферное. В противном случае говорят об отрицательном избыточном давлении.
Сокращения в формулах “abs”, “amb” и “e” однозначно указывают на тип измеряемого давления. Эти сокращения относятся в формулах к букве Р, но не к единицам измерения.
Неважно какое давление – абсолютное, избыточное или дифференциальное. С помощью WIKA вы подберете необходимый измерительный прибор для любого типа давления:
С помощью WIKA вы подберете необходимый измерительный прибор для любого типа давления:
Манометры
Датчики давления
Реле давления
Свяжитесь с нами
Вам нужна дополнительная информация? Напишите нам:
ДРУГИЕ ТЕМЫ Тензодатчик Датчик силы Преобразователь силы tecsis Сертификат о калибровке калибровка манометров Уровнемер Циферблат термометра KSR Kuebler Принцип действия манометра Измерение уровня DH Budenberg Термометр показывающий Pt1000 манометр Измерение температуры Сигнализатор давления Гидростатический датчик уровня Манометр давления Калибровочная лаборатория Pt100 Коррозионностойкие манометры Балочный датчик и тензодатчики балочные Измерительная диафрагма Датчик давления Термоэлектрический преобразователь Термопара Преобразователь давления Поверка и калибровка средств измерений Грузопоршневой манометр Дифференциальный манометр Манометр Устройство Измерение давления электроконтактный манометр Манометр высокого давления Ettore Cella гильзы для термопреобразователей напоромер манометр виброустойчивый калибровка приборов Калибратор давления гидростатические уровнемеры Избыточное давление Российская система калибровки
Осмотическое давление.
Осмос-это самопроизвольный переход растворителя через полупроницаемую мембрану из разбавленного раствора или чистого растворителя в концентрированный раствор.
Мембрана, пропускающая частицы растворителя, но не пропускающая частицы растворенного вещества, называется полупроницаемой мембраной. Полупроницаемая мембрана пропускает частицы растворителя в обоих направлениях. Однако, поскольку с той стороны мембраны, где концентрация раствора выше, концентрация растворителя, наоборот, ниже, происходит результирующий переход растворителя в концентрированный раствор. Это приводит к установлению разности давлений по обе стороны мембраны.
Осмотическое давление является коллигативным свойством, поскольку оно зависит только от концентрации растворенных частиц, а не от их химического состава.
Осмотическое давление играет важную роль в биологических процессах. Например, в организме животных некоторые типы клеток, например эритроциты, содержат солевой раствор. Эти клетки ограничены плазматической мембраной. В водной среде эритроциты подвергаются осмосу, набухают и лопаются. Однако, если они попадают в более концентрированный раствор соли, клетки сморщиваются.
Модули установки для получения сверхчистой воды на основе обратного осмоса. Такая вода необходима в полупроводниковой промышленности.
Амеба-одноклеточное существо. Вода непрерывно поступает в ее тело благодаря осмосу.
Растительные клетки содержат солевые растворы в особых полостях – вакуолях. Вакуоль окружена тонким слоем цитоплазмы, который обладает свойствами полупроницаемой мембраны и контролирует поглощение воды растительной клеткой.
Если давление, приложенное к концентрированному раствору, превышает осмотическое давление, растворитель переходит из концентрированного раствора через мембрану в разбавленный раствор. Этот процесс называется обратный осмос. Он находит промышленное применение с целью получения питьевой воды из морской воды.
Эксперименты, подобные описанному выше с сахарным раствором, показывают, что: 1) при постоянной температуре осмотическое давление прямо пропорционально разности концентраций в растворах, разделенных мембраной; 2) при фиксированной разности концентраций осмотическое давление прямо пропорционально абсолютной температуре.
Соотношение между осмотическим давлением и температурой аналогично уравнению состояния идеального газа (см. разд. 3.1). Оно называется уравнением Вант-Гоффа:
(11)
В этом уравнении тс – осмотическое давление, К-объем раствора, и-число молей растворенного вещества, T-абсолютная температура, Л-молярная газовая постоянная.
Уравнение Вант-Гоффа является приближенным и справедливо только для разбавленных растворов.
Определение относительной молекулярной массы растворенного вещества по осмотическому давлению раствора
Уравнение Вант-Гоффа может использоваться для определения относительной молекулярной массы растворенного вещества по создаваемому им осмотическому давлению, которое устанавливают экспериментальным путем. Этот метод особенно удобен для определения средней относительной молекулярной массы полимеров и других макро-молекулярных веществ.
Пример
Раствор сахара с концентрацией 2,5 г/дм3 создает осмотическое давление 8,3 х х 104 атм при 25 °С. Вычислим относительную молекулярную массу растворенного вещества.
Решение
Искомое значение относительной молекулярной массы Мг растворенного вещества можно найти непосредственно с помощью уравнения Вант-Гоффа (11). Исходные данные задачи таковы:
Оглавление:
- часть 1 (Cтроение атома, Химическая связь)
- часть 2 (Газы, жидкости и твердые вещества, Стехиометрия, Энергетика)
- часть 3 (Фазовые равновесия, Химическое равновесие, Ионы, Химическая кинетика)
- часть 4 (Электрохимия)
10.
 2: Давление — Химия LibreTexts
2: Давление — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21760
Цели обучения
- описывать и измерять давление газа.
На макроскопическом уровне полное физическое описание образца газа требует четырех величин:
- температура (выражается в кельвинах),
- объем (в литрах),
- количество
- давление (в атм.).
Как мы показали ниже, эти переменные , а не независимыми (т. е. их нельзя произвольно изменять). Если мы знаем значения любых трех этих величин, мы можем вычислить четвертую и тем самым получить полное физическое описание газа. Температура, объем и количество обсуждались в предыдущих главах. Теперь обсудим давление и его единицы измерения.
е. их нельзя произвольно изменять). Если мы знаем значения любых трех этих величин, мы можем вычислить четвертую и тем самым получить полное физическое описание газа. Температура, объем и количество обсуждались в предыдущих главах. Теперь обсудим давление и его единицы измерения.
Единицы давления
Любой объект, будь то ваш компьютер, человек или образец газа, оказывает силу на любую поверхность, с которой он соприкасается. Воздух в воздушном шаре, например, действует на внутреннюю поверхность воздушного шара, а жидкость, нагнетаемая в форму, действует на внутреннюю поверхность формы, точно так же, как стул действует на пол из-за его масса и действие гравитации. Если воздух в воздушном шаре нагрет, увеличенная кинетическая энергия газа в конечном итоге приведет к тому, что воздушный шар лопнет из-за повышенного давления (\(P\)) газа, сила (\(F\)) на единицу площади (\(A\)) поверхности:
\[P=\dfrac{\rm Force}{\rm Area}=\dfrac{F}{A}\label{10.2.1} \]
Давление зависит от как приложенной силы , так и размер области, к которой приложена сила. 2\)), который называется 92 \label{10.2.2} \]
2\)), который называется 92 \label{10.2.2} \]
Пример \(\PageIndex{1}\)
Предположим, что книга в мягкой обложке имеет массу 2,00 кг, длину 27,0 см, ширину 21,0 см и толщину. 4,5 см, какое давление он оказывает на поверхность, если она лежит горизонтально?
Дано: масса и размеры объекта
Запрошено: давление
Стратегия:
- Рассчитайте силу, действующую на книгу, а затем вычислите площадь, которая соприкасается с поверхностью.
- Подставьте эти два значения в уравнение \(\ref{10.2.1}\), чтобы найти давление, оказываемое на поверхность в каждой ориентации.
Решение:
Сила, действующая на книгу, , а не зависит от ее ориентации. Напомним, что сила, действующая на объект, равна F = мА , где m — его масса, а a — его ускорение. В гравитационном поле Земли ускорение обусловлено силой тяжести (9,8067 м/с 93 \;\rm Pa \nonumber \]
Упражнение \(\PageIndex{1}\)
Какое давление оказывает на пол студент массой 60,0 кг
- , когда он стоит на ногах в лаборатории в паре теннисные туфли (площадь подошвы примерно 180 см 2 )?
- , когда она выходит на танцпол пяткой вперед в туфлях на высоком каблуке (площадь каблука = 1,0 см 2 )?
- Ответить на
3,27 × 10 4 Па
- Ответ б
5,9 × 10 6 Па
Барометрическое давление
Подобно тому, как мы оказываем давление на поверхность из-за гравитации, так же действует и наша атмосфера. Мы живем на дне газового океана, который с увеличением высоты становится все менее плотным. Приблизительно 99 % массы атмосферы находится в пределах 30 км от поверхности Земли (рис. \(\PageIndex{1}\)). Каждая точка на поверхности Земли испытывает чистое давление, называемое барометрическое давление . Давление, оказываемое атмосферой, велико: столбик высотой 1 м 2 , измеренный от уровня моря до верхней границы атмосферы, имеет массу около 10 000 кг, что дает давление около 101 кПа:
Мы живем на дне газового океана, который с увеличением высоты становится все менее плотным. Приблизительно 99 % массы атмосферы находится в пределах 30 км от поверхности Земли (рис. \(\PageIndex{1}\)). Каждая точка на поверхности Земли испытывает чистое давление, называемое барометрическое давление . Давление, оказываемое атмосферой, велико: столбик высотой 1 м 2 , измеренный от уровня моря до верхней границы атмосферы, имеет массу около 10 000 кг, что дает давление около 101 кПа:
Барометрическое давление можно измерить с помощью барометра, прибора, изобретенного в 1643 году одним из учеников Галилея, Эванджелистой Торричелли (1608–1647). Барометр может быть изготовлен из длинной стеклянной трубки, закрытой с одного конца. Его наполняют ртутью и помещают вверх дном в чашу с ртутью, не допуская попадания воздуха в трубку. Часть ртути вытечет из трубки, но внутри останется относительно высокий столбик (рис. \(\PageIndex{2}\)). Почему не кончается вся ртуть? Гравитация, безусловно, оказывает направленное вниз давление на ртуть в трубке, но ей противостоит давление атмосферы, давит на поверхность ртути в чашке, что в конечном итоге приводит к выталкиванию ртути вверх в трубку. Поскольку над ртутью внутри трубки в правильно заполненном барометре нет воздуха (в нем вакуум), давление на колонку не оказывается. Таким образом, ртуть вытекает из трубки до тех пор, пока давление самого ртутного столба точно не уравновесит давление атмосферы. Давление, оказываемое ртутным столбиком, можно выразить как:
Часть ртути вытечет из трубки, но внутри останется относительно высокий столбик (рис. \(\PageIndex{2}\)). Почему не кончается вся ртуть? Гравитация, безусловно, оказывает направленное вниз давление на ртуть в трубке, но ей противостоит давление атмосферы, давит на поверхность ртути в чашке, что в конечном итоге приводит к выталкиванию ртути вверх в трубку. Поскольку над ртутью внутри трубки в правильно заполненном барометре нет воздуха (в нем вакуум), давление на колонку не оказывается. Таким образом, ртуть вытекает из трубки до тех пор, пока давление самого ртутного столба точно не уравновесит давление атмосферы. Давление, оказываемое ртутным столбиком, можно выразить как:
\[\begin{align} P&=\dfrac{F}{A} \\[4pt] &= \dfrac{mg}{A} \\[4pt] &= \dfrac{\rho V\cdot g }{A} \\[4pt] &= \dfrac{ \rho \cdot Ah\cdot g}{A} \\[4pt] &= \rho gh \end{align} \nonumber \]
с
- \(g\) – ускорение свободного падения,
- \(m\) – масса,
- \(\rho\) – плотность,
- \(V\) – объем,
- \(A\) — нижняя область, а
- \(h\) – высота ртутного столба.

При нормальных погодных условиях на уровне моря две силы уравновешиваются, когда верхняя часть ртутного столба находится приблизительно на 760 мм выше уровня ртути в чашке, как показано на рисунке \(\PageIndex{2}\). Это значение зависит от метеорологических условий и высоты над уровнем моря. В Денвере, штат Колорадо, например, на высоте около 1 мили или 1609 м (5280 футов) высота ртутного столба составляет 630 мм, а не 760 мм.
Рисунок \(\PageIndex{2}\): Ртутный барометр. Давление, оказываемое атмосферой на поверхность ртутного бассейна, поддерживает столбик ртути в трубке высотой около 760 мм. Поскольку температура кипения ртути довольно высока (356,73 °С), паров ртути в пространстве над ртутным столбом очень мало. Ртутные барометры использовались для измерения барометрического давления так долго, что у них есть собственная единица измерения давления: миллиметр ртутного столба (мм рт. ст.), часто называемый торром в честь Торричелли. Стандартное барометрическое давление — это барометрическое давление, необходимое для поддержания столба ртути высотой ровно 760 мм; это давление также называют 1 атмосферой (атм).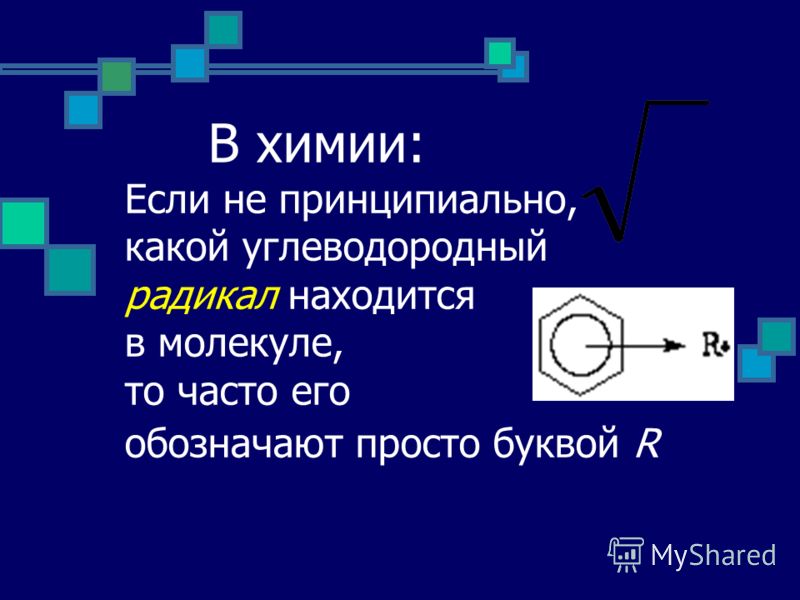 5 \; Па \\[4pt] &= 101,325 \; кПа\метка{10.2.3} \end{align} \]
5 \; Па \\[4pt] &= 101,325 \; кПа\метка{10.2.3} \end{align} \]
Таким образом, давление в 1 атм в точности равно 760 мм ртутного столба.
Мы так привыкли жить под этим давлением, что даже не замечаем его. Вместо этого мы замечаем изменения давления, например, когда наши уши лопаются в быстрых лифтах в небоскребах или в самолетах при быстрых изменениях высоты. Мы используем атмосферное давление разными способами. Мы можем использовать соломинку для питья, потому что всасывание через нее удаляет воздух и тем самым снижает давление внутри соломинки. Атмосферное давление давит на жидкость в стакане, а затем заставляет жидкость подниматься по соломинке.
Пример \(\PageIndex{2}\): Барометрическое давление
Несколько лет назад один из авторов посетил национальный парк Роки-Маунтин. Вылетев из аэропорта на уровне моря на востоке США, он прибыл в Денвер (высота 5280 футов), арендовал машину и поехал к верхней части шоссе за пределами Эстес-парка (высота 14000 футов). Он заметил, что на этой высоте, где барометрическое давление составляет всего 454 мм рт. ст., очень тяжело даже небольшое усилие. Преобразуйте это давление в
Он заметил, что на этой высоте, где барометрическое давление составляет всего 454 мм рт. ст., очень тяжело даже небольшое усилие. Преобразуйте это давление в
- атмосферы (атм).
- бар.
Дано: давление в миллиметрах рт. ртутного столба в атмосферы и килопаскали.
Решение:
Из уравнения \(\ref{10.2.3}\) имеем 1 атм = 760 мм рт.ст. = 101,325 кПа. Таким образом, давление на высоте 14 000 футов в атм составляет
\[ \begin{align} P &=\rm 454 \;mmHg\times\dfrac{1\;atm}{760\;mmHg} \\[4pt] &= 0.597\;atm \nonumber \end{ align} \nonumber \]
Давление в барах определяется как
\[ \begin{align} P&=\rm 0.597\;atm\times\dfrac{1.01325\;bar}{1\;atm}\\ [4pt] &= 0,605\;бар \nonumber \end{align} \nonumber \]
Упражнение \(\PageIndex{2}\): Атмосферное давление
Эверест на высоте 29 028 футов над уровнем моря самая высокая гора в мире. Нормальное барометрическое давление на этой высоте составляет около 0,308 атм. Преобразуйте это давление в
Преобразуйте это давление в
- миллиметра ртутного столба.
- бар.
- Ответить на
234 мм рт.ст.;
- Ответ б
0,312 бар
Манометры
Барометры измеряют барометрическое давление, но манометры измеряют давление проб газов, содержащихся в аппарате. Ключевой особенностью манометра является U-образная трубка, содержащая ртуть (или иногда другую нелетучую жидкость). Манометр с закрытым концом схематично показан в части (а) на рисунке \(\PageIndex{3}\). Когда колба не содержит газа (т. е. когда внутри ее почти вакуум), высоты двух ртутных столбиков одинаковы, потому что пространство над ртутью слева представляет собой почти вакуум (оно содержит только следы паров ртути). ). Если газ выпустить в колбу справа, он будет оказывать давление на ртуть в правом столбике, и два столбика ртути больше не будут иметь одинаковую высоту. разность между высотами двух столбцов равна давлению газа.
разность между высотами двух столбцов равна давлению газа.
Если трубка открыта в атмосферу, а не закрыта, как в манометре с открытым концом, показанном в части (b) на рисунке \(\PageIndex{3}\), то два столбика ртути имеют одинаковую высоту, только если газ в колбе имеет давление, равное барометрическому давлению. Если давление газа в колбе выше, чем , ртуть в открытой трубке будет выталкиваться вверх газом, давит на ртуть в другом плече U-образной трубки. Таким образом, давление газа в колбе представляет собой сумму барометрического давления (измеряемого барометром) и разницы высот двух столбцов. Если газ в колбе имеет давление меньше , чем у атмосферы, то высота ртути будет больше в плече, прикрепленном к колбе. В этом случае давление газа в колбе равно барометрическому давлению за вычетом разницы высот двух столбцов.
Если газ в колбе имеет давление меньше , чем у атмосферы, то высота ртути будет больше в плече, прикрепленном к колбе. В этом случае давление газа в колбе равно барометрическому давлению за вычетом разницы высот двух столбцов.
Пример \(\PageIndex{3}\)
Предположим, вы хотите построить закрытый манометр для измерения давления газа в диапазоне 0,000–0,200 атм. Из-за токсичности ртути вы решили использовать воду, а не ртуть. Какой высоты столб воды вам нужен? (Плотность воды 1,00 г/см 3 ; плотность ртути 13,53 г/см 3 .)
Дано: диапазон давления и плотности воды и ртути
Запрашиваемый: высота столбца
Стратегия:
- 90 ртутного столба, что соответствует 0,200 атм в миллиметрах ртутного столба. Это высота, необходимая для столба, заполненного ртутью.
- Из заданных плотностей используйте пропорцию, чтобы вычислить высоту, необходимую для столба, заполненного водой.

Решение:
A В миллиметрах ртутного столба давление газа 0,200 атм равно
\[P=\rm 0,200\;атм\times\dfrac{760\;мм рт.ст.}{1\;атм}= 152\;mmHg \nonumber\]
При использовании ртутного манометра вам потребуется ртутный столбик высотой не менее 152 мм.
B Поскольку плотность воды меньше плотности ртути, вам потребуется более высокий столб воды, чтобы достичь того же давления, что и данный столб ртути. Высота, необходимая для заполненного водой столба, соответствующая давлению 0,200 атм, пропорциональна отношению плотности ртути к плотности воды 93}=2070\;мм \номер \]
Ответ имеет смысл: для достижения того же давления требуется более высокий столб менее плотной жидкости.
Упражнение \(\PageIndex{3}\)
Предположим, вы хотите разработать барометр для измерения барометрического давления в среде, температура которой всегда выше 30°C. Чтобы не использовать ртуть, вы решаете использовать галлий, который плавится при 29,76 °C; плотность жидкого галлия при 25°С составляет 6,114 г/см 3 .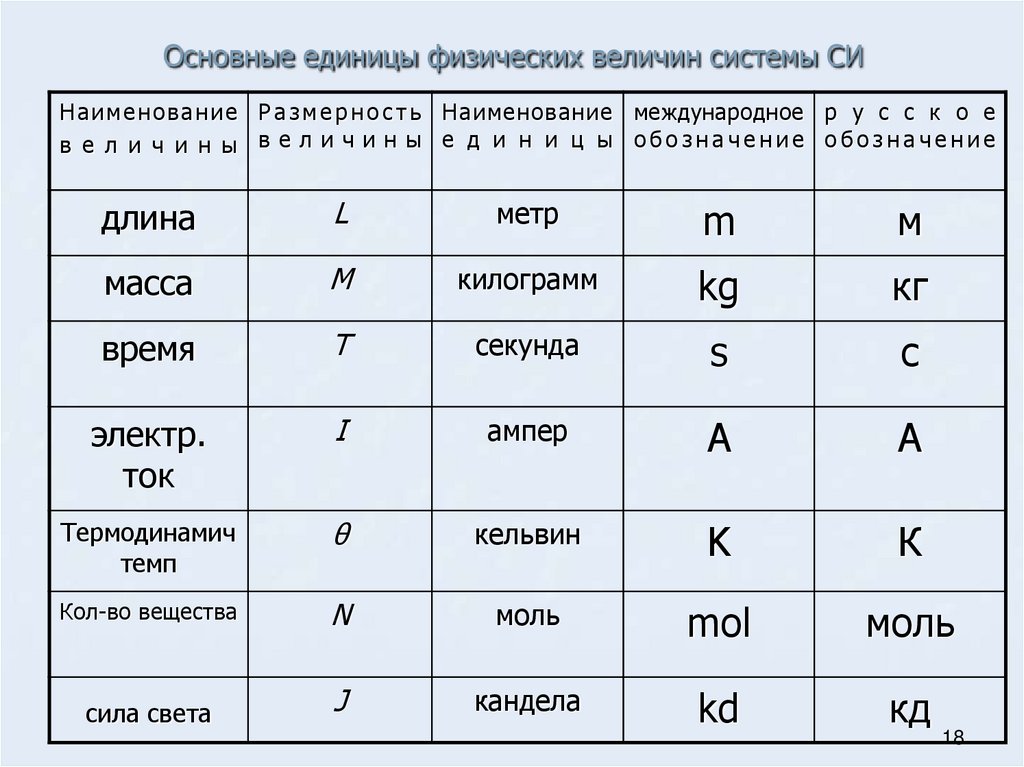 Какой высоты столбик галлия вам нужен, если 94\;мм \nonumber \\[4pt] &= 10,3\;м \nonumber \end{align} \nonumber \]
Какой высоты столбик галлия вам нужен, если 94\;мм \nonumber \\[4pt] &= 10,3\;м \nonumber \end{align} \nonumber \]
Всасывающий насос — это просто более сложная версия соломинки: он создает вакуум над жидкостью и полагается на атмосферное давление, чтобы заставить жидкость подниматься по трубе. Если давление в 1 атм соответствует водяному столбу высотой 10,3 м (33,8 фута), то барометрическое давление физически не может поднять воду в колодце выше этого значения. До тех пор, пока не были изобретены электрические насосы для механического откачивания воды с больших глубин, этот фактор сильно ограничивал возможности проживания людей, поскольку добывать воду из колодцев глубиной более 33 футов было сложно.
Резюме
Давление определяется как сила, действующая на единицу площади; его можно измерить с помощью барометра или манометра. Для полного физического описания образца газа необходимо знать четыре величины: температура , объем , количество и давление . Давление — сила на единицу площади поверхности; единицей давления в СИ является паскаля (Па) , определяемая как 1 ньютон на квадратный метр (Н/м 2 ). Давление, оказываемое объектом, пропорционально силе, которую он оказывает, и обратно пропорционально площади, на которую действует сила. Давление, оказываемое атмосферой Земли, называется барометрическое давление составляет около 101 кПа или 14,7 фунта/дюйм. 2 на уровне моря. барометрическое давление можно измерить барометром , закрытой перевернутой трубкой, наполненной ртутью. Высота ртутного столба пропорциональна барометрическому давлению, которое часто выражается в единицах миллиметра ртутного столба (мм рт.ст.) , также называемых торр . Стандартное барометрическое давление , давление, необходимое для поддержания столба ртути высотой 760 мм, является еще одной единицей давления: 1 атмосфера (атм) .
Давление — сила на единицу площади поверхности; единицей давления в СИ является паскаля (Па) , определяемая как 1 ньютон на квадратный метр (Н/м 2 ). Давление, оказываемое объектом, пропорционально силе, которую он оказывает, и обратно пропорционально площади, на которую действует сила. Давление, оказываемое атмосферой Земли, называется барометрическое давление составляет около 101 кПа или 14,7 фунта/дюйм. 2 на уровне моря. барометрическое давление можно измерить барометром , закрытой перевернутой трубкой, наполненной ртутью. Высота ртутного столба пропорциональна барометрическому давлению, которое часто выражается в единицах миллиметра ртутного столба (мм рт.ст.) , также называемых торр . Стандартное барометрическое давление , давление, необходимое для поддержания столба ртути высотой 760 мм, является еще одной единицей давления: 1 атмосфера (атм) .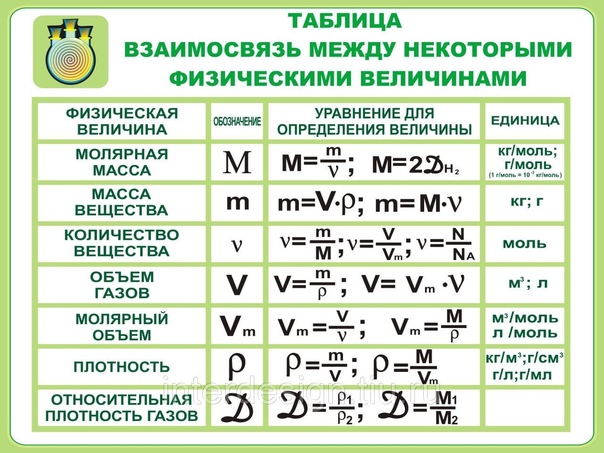 Манометр представляет собой прибор, используемый для измерения давления пробы газа.
Манометр представляет собой прибор, используемый для измерения давления пробы газа.
10.2: Давление распространяется под лицензией CC BY-NC-SA 3.0 и было создано, изменено и/или курировано LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- атмосфера
- барометр
- барометрическое давление
- манометр
- миллиметра ртутного столба
- Единица измерения Паскаль
- давление
- стандартное барометрическое давление
- температура
- торр
- том
Свойства вещества: Газы | Живая наука
Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Газ — это состояние вещества, которое не имеет фиксированной формы и фиксированного объема. Газы имеют более низкую плотность, чем другие состояния вещества, такие как твердые тела и жидкости. Между частицами, обладающими большой кинетической энергией и не особо притягивающимися друг к другу, имеется много пустого пространства. Частицы газа движутся очень быстро и сталкиваются друг с другом, вызывая их диффузию или распространение до тех пор, пока они не будут равномерно распределены по всему объему контейнера.
Согласно образовательному веб-сайту Lumen Learning , газ можно сдержать, только полностью окружив его контейнером или удерживая вместе под действием силы тяжести.
Чем больше частиц газа попадает в контейнер, тем меньше места для распространения частиц и они сжимаются. Частицы оказывают большее воздействие на внутренний объем контейнера.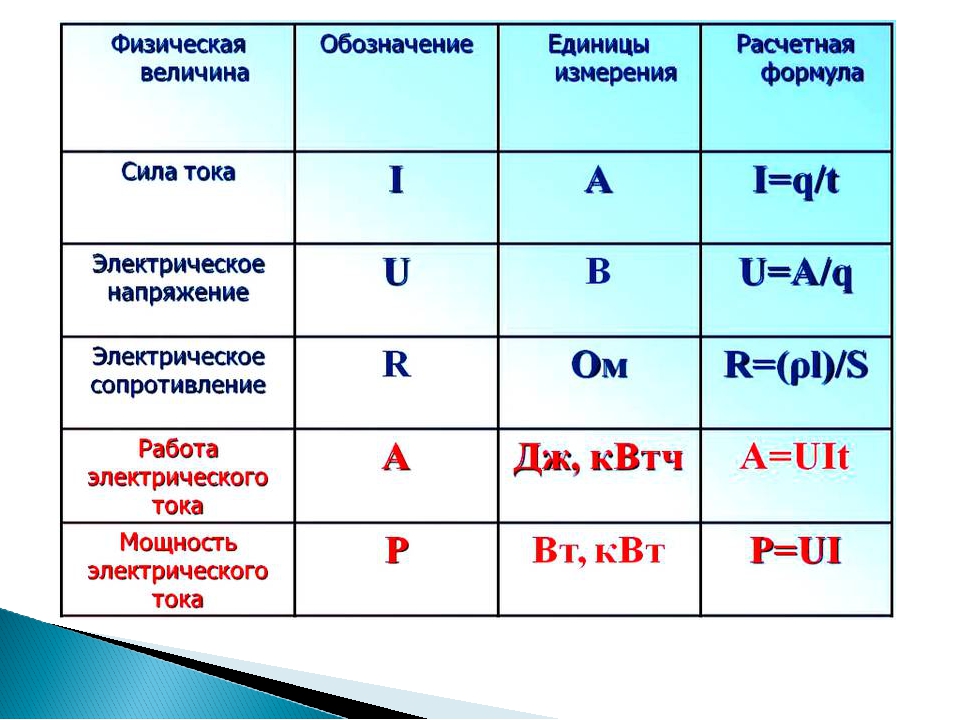 Эта сила называется давлением. Есть несколько единиц, используемых для выражения давления. Некоторыми из наиболее распространенных являются атмосферы (атм), фунты на квадратный дюйм (psi), миллиметры ртутного столба (мм рт.ст.) и паскали (Па). Единицы соотносятся друг с другом следующим образом: 1 атм = 14,7 фунтов на квадратный дюйм = 760 мм рт.ст. = 101,3 кПа (1000 паскалей).
Эта сила называется давлением. Есть несколько единиц, используемых для выражения давления. Некоторыми из наиболее распространенных являются атмосферы (атм), фунты на квадратный дюйм (psi), миллиметры ртутного столба (мм рт.ст.) и паскали (Па). Единицы соотносятся друг с другом следующим образом: 1 атм = 14,7 фунтов на квадратный дюйм = 760 мм рт.ст. = 101,3 кПа (1000 паскалей).
Связанный: Парниковые газы: причины, источники и воздействие на окружающую среду
По данным Университета Пердью, газ может быть преобразован в жидкость путем сжатия при подходящей температуре . Но если достигается критическая температура, пар не может быть сжижен независимо от того, какое давление приложено. Критическое давление – это давление, необходимое для сжижения газа при его критической температуре.
Примеры критических температур и давлений различных веществ согласно Engineering Toolbox (открывается в новой вкладке)
Swipe to scroll horizontally
| Substance | Critical temperature (degrees Fahrenheit) | Critical temperature (degrees Celsius) | Critical pressure (psi) |
|---|---|---|---|
| Oxygen | minus 181. 5 5 | minus 118,6 | 732 |
| Гелий | минус 456 | минус 271 | 33,2 |
| Аммиак0528 | 132.4 | 1636 | |
| Chlorine | 291 | 144 | 1118.7 |
Measurable properties of gases
Besides pressure, denoted in equations as P, gases have other measurable properties: temperature (T ), объем (V) и количество частиц, которое выражается числом молей (n или моль). В работе, связанной с температурой газа, часто используется шкала Кельвина.
Поскольку температура и давление варьируются от места к месту, ученые используют стандартную точку отсчета, называемую стандартной температурой и давлением (STP), в расчетах и уравнениях. Стандартной температурой является точка замерзания воды — 32 градуса по Фаренгейту (0 градусов по Цельсию, или 273,15 по Кельвину).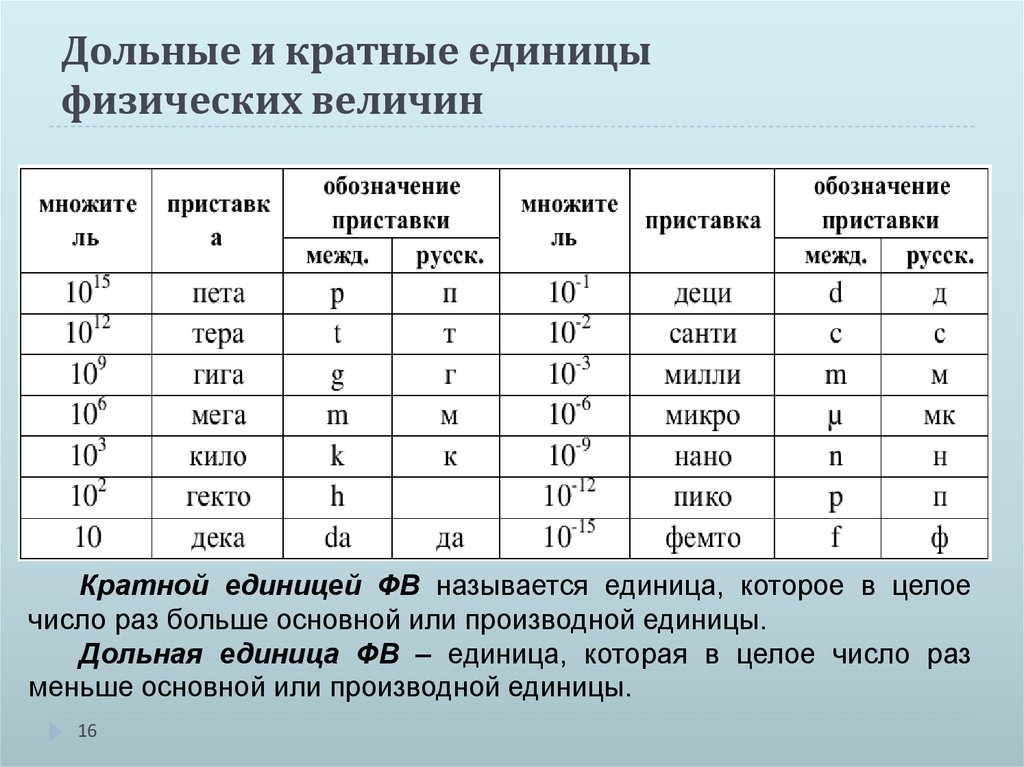 Стандартное давление — одна атмосфера (атм) — давление, оказываемое атмосферой на Землю на уровне моря.
Стандартное давление — одна атмосфера (атм) — давление, оказываемое атмосферой на Землю на уровне моря.
Газовые законы
Температура, давление, количество и объем газа взаимозависимы, и многие ученые разработали законы для описания отношений между ними.
Закон Бойля
Химик Роберт Бойль заявил, что если поддерживать постоянную температуру, объем и давление находятся в обратной зависимости; то есть по мере увеличения объема давление уменьшается. Это известно как закон Бойля. (Изображение предоставлено: GeorgiosArt через Getty Images)(открывается в новой вкладке)
Назван в честь Роберта Бойля, который впервые сформулировал его в 1662 году. Закон Бойля гласит, что если температуру поддерживать постоянной, объем и давление находятся в обратной зависимости; то есть по мере увеличения объема давление уменьшается, согласно ChemWiki Калифорнийского университета Дэвиса (открывается в новой вкладке).
Увеличение доступного пространства позволит частицам газа разлетаться дальше друг от друга, но это уменьшит количество частиц, которые могут столкнуться с контейнером, поэтому давление уменьшится.
Уменьшение объема контейнера заставляет частицы сталкиваться чаще, поэтому давление увеличивается. Хорошим примером этого является наполнение шины воздухом. По мере того, как поступает больше воздуха, молекулы газа собираются вместе, уменьшая их объем. Пока температура остается неизменной, давление увеличивается.
Закон Шарля (закон Гей-Люссака)
В 1802 году Жозеф Луи Гей-Люссак, французский химик и физик, сослался на данные, собранные его соотечественником Жаком Шарлем, в статье, описывающей прямую зависимость между температурой и объемом газ, находящийся под постоянным давлением. В большинстве текстов это называется законом Шарля, но некоторые называют его законом Гей-Люссака или даже законом Шарля Гей-Люссака.
Этот закон гласит, что объем и температура газа имеют прямую зависимость: при повышении температуры объем увеличивается, когда давление остается постоянным. Нагрев газа увеличивает кинетическую энергию частиц, заставляя газ расширяться. Чтобы поддерживать постоянное давление, при нагревании газа необходимо увеличивать объем сосуда.
Этот закон объясняет, почему важным правилом безопасности является то, что вы никогда не должны нагревать закрытый контейнер. Повышение температуры без увеличения объема, доступного для размещения расширяющегося газа, означает, что внутри контейнера повышается давление, что может привести к его взрыву. Закон также объясняет, почему термометр для индейки выскакивает, когда индейка готова: объем воздуха, попавшего под поршень, увеличивается по мере того, как температура внутри индейки поднимается.
Жозеф-Луи Гей-Люссак собирает пробы воздуха на разной высоте вместе с Жаном-Батистом Био в 1804 году. (Изображение предоставлено Луизой Валлон Фуми через Getty Images) ученый Амедео Авогадро выдвинул идею о том, что равные объемы газа при одинаковых температуре и давлении будут иметь одинаковое количество частиц, независимо от их химической природы и физических свойств.Постоянная идеального газа
Кинетическая энергия на единицу температуры одного моля газа является постоянной величиной, иногда называемой константой Рено, названной в честь французского химика Анри Виктора Рено . Обозначается буквой Р. Реньо изучал тепловые свойства вещества и обнаружил, что закон Бойля несовершенен. Когда температура вещества приближается к точке кипения, расширение частиц газа не совсем равномерно.
Обозначается буквой Р. Реньо изучал тепловые свойства вещества и обнаружил, что закон Бойля несовершенен. Когда температура вещества приближается к точке кипения, расширение частиц газа не совсем равномерно.
Закон идеального газа
Число Авогадро, постоянная идеального газа и законы Бойля и Шарля в совокупности описывают теоретический идеальный газ, в котором все столкновения частиц абсолютно равны. Законы очень близки к описанию поведения большинства газов, но есть очень крошечные математические отклонения из-за различий в реальном размере частиц и крошечных межмолекулярных сил в реальных газах. Тем не менее, эти важные законы часто объединяются в одно уравнение, известное как закон идеального газа. Используя этот закон, вы можете найти значение любой из других переменных — давления, объема, числа или температуры — если вы знаете значение трех других.
Дополнительные ресурсы
Узнайте больше о сверхкритических жидкостях и их использовании из этой статьи SciMed (откроется в новой вкладке) . Чтобы быстро ознакомиться с интересными для детей фактами о газах, посетите образовательный веб-сайт Love My Science (открывается в новой вкладке) . Узнайте больше о газах с помощью этого информационного материала с образовательного веб-сайта Science Notes (откроется в новой вкладке).
Чтобы быстро ознакомиться с интересными для детей фактами о газах, посетите образовательный веб-сайт Love My Science (открывается в новой вкладке) . Узнайте больше о газах с помощью этого информационного материала с образовательного веб-сайта Science Notes (откроется в новой вкладке).
Библиография
- Knez, Željko, et al. «Промышленное применение сверхкритических флюидов: обзор (открывается в новой вкладке)» Energy 77 (2014): 235-243.
- Зильберберг, Мартин. Основы общей химии (откроется в новой вкладке). McGraw-Hill Education, 2012.
- Леви, Шарона Т. и Ури Виленски. «Газовые законы и не только: стратегии изучения моделей динамики изменения газообразного состояния (открывается в новой вкладке)», ежегодное собрание Национальной ассоциации исследований в области преподавания естественных наук, Сан-Франциско, Калифорния. 2006.
При участии
- Дейзи Добриевич Автор ссылок, Space.