Ты знал, что существует круглая таблица Менделеева? А ещё спиральная! | KAMILYATOR
Рассказываю какие бывают формы у таблицы Менделеева и показываю её альтернативные варианты.
Таблица Менделеева — возможно самое важное изобретение за всю историю химии. В неё вложен огромный смысл, каждый элемент находится на своём месте. Закономерности, заложенные в основу мироздания отражены в периодической системе химических элементов.
Самыми распространёнными формами таблицы Менделеева являются: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». Давайте полистаем на картинки и сравним их:
Короткая форма. https://filtravod.ru/uploads/gallery/Tablica-Elementov/periodic_table.pngДлинная форма. https://forstudents.minemegashop.ru/pictures/1017667611.jpgСверхдлинная. Свободный источникКороткая форма. https://filtravod.ru/uploads/gallery/Tablica-Elementov/periodic_table.png
Короткая форма была официально отменена ИЮПАК (Международный союз теоретической и прикладной химии) в 1989 году.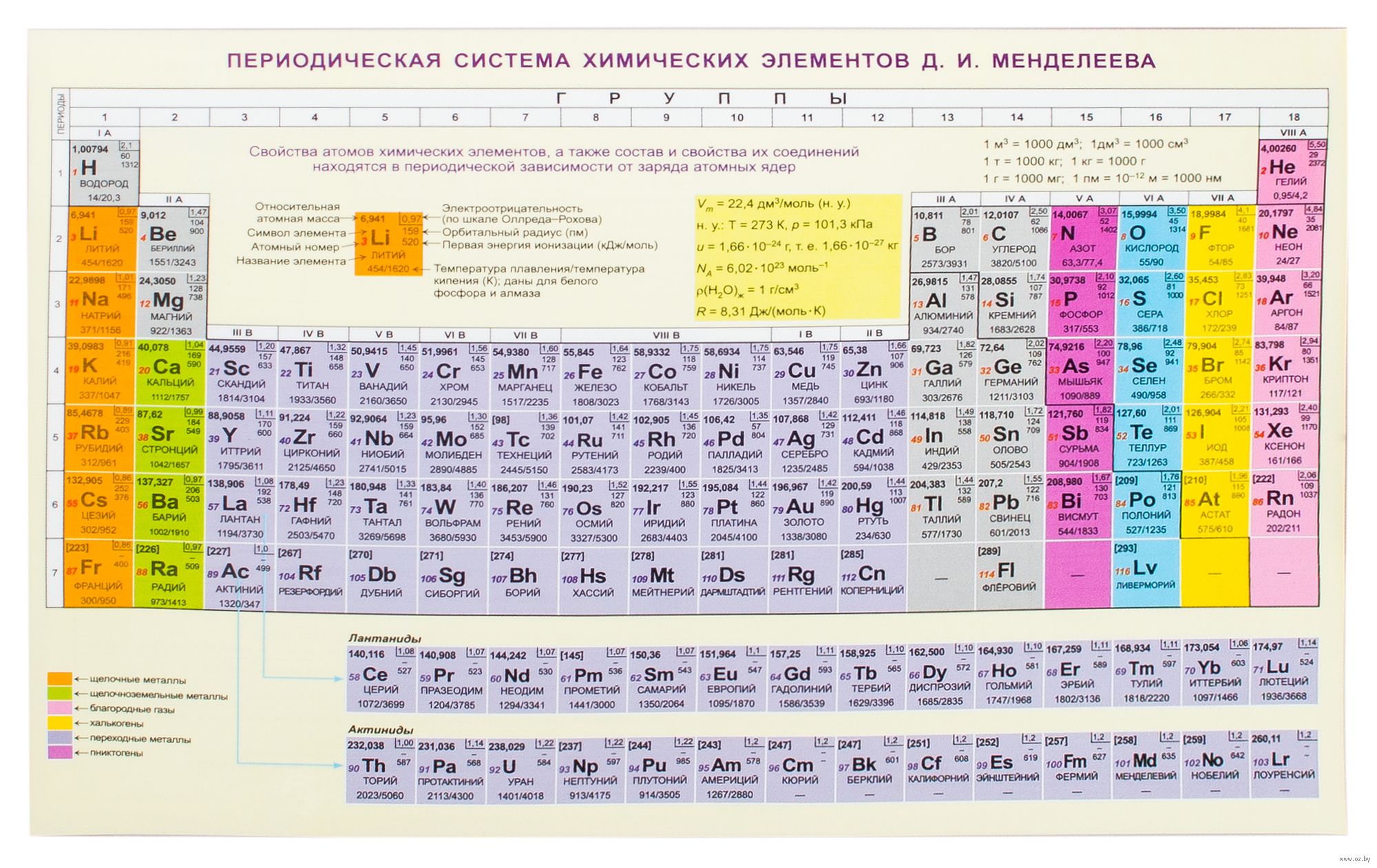 Однако, её продолжают использовать во многих школьных учебниках и кабинетах химии. Из современной иностранной литературы короткая форма исключена полностью, а вместо неё используется длинная форма.
Однако, её продолжают использовать во многих школьных учебниках и кабинетах химии. Из современной иностранной литературы короткая форма исключена полностью, а вместо неё используется длинная форма.
В 1970 году Теодор Сиборг предложил расширенную периодическую таблицу элементов.
С момента создания периодической таблицы прошло много времени. На сегодня разработано несколько сотен вариантов таблицы и не всегда они похожи на таблицу 🙂 есть даже объёмные.
Альтернативные виды периодической таблицы
Альтернативная система элементов Теодора БенфеяАльтернативная система элементов Теодора Бенфея
Интересный факт: На во многих западных странах таблицу Менделеева называют без упоминания фамилии автора, просто: Periodic table (англ. Периодическая таблица). Причина такая же, что и в истории с изобретателем радио: у нас Попов Александр Степанович, в западе Гульельмо Маркони.
Спиральная таблица, автор Robert W HarrisonСпиральная таблица, автор Robert W Harrison
Интересный факт: Уран — последний по номеру химический элемент в таблице, который можно встретить в природе, остальные элементы можно создать только искусственным путем.
TROPE – это аббревиатура с анг. The Ring Of Periodic Elements
Интересный факт: Галлий (Ga) стал первым пробелом в таблице, заполненным уже после смерти ученого. Металлический галлий известен тем, что он сохраняет твердость при комнатной температуре, но в руках плавится.
Периодическая таблица с завитой лентой (J. F. Hyde)Периодическая таблица с завитой лентой (J. F. Hyde)
Интересный факт: есть версия, что изначально таблица Менделеева включала Эфир и он стоял первым номером.
Альтернативная круговая периодическая таблицаКруговая периодическая таблицаПериодическая таблица “Stowe”Альтернативная круговая периодическая таблица
При изучении Периодического закона в школе меня сильно удивило, насколько Вселенная безупречна, что каждый атом, каждый электрон образует сложнейшую систему из хаоса.
Оценивай статью и пиши комментарий, для меня это будет хорошей наградой за труд 🙂Таблица менделеева фото крупным планом фото
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме.
В периодической таблице Менделеева
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы.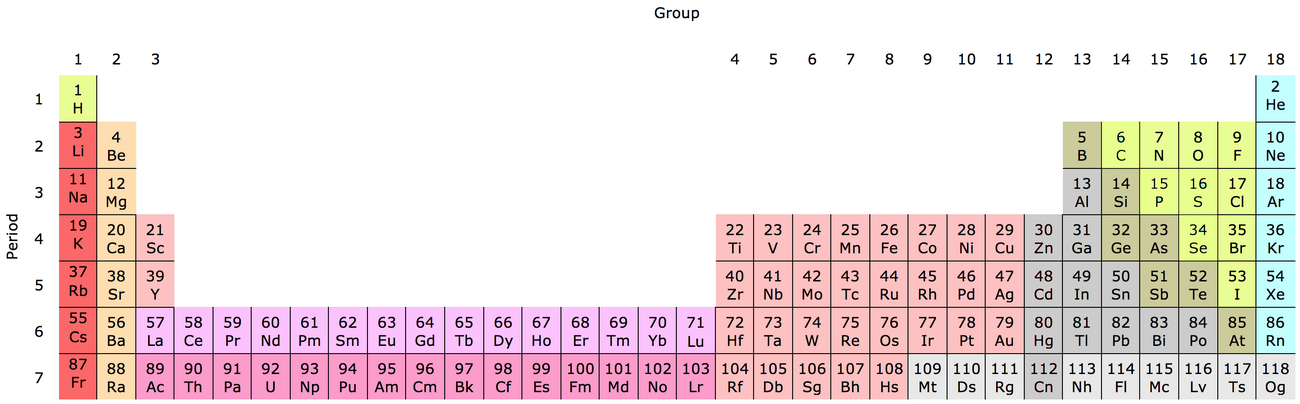
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.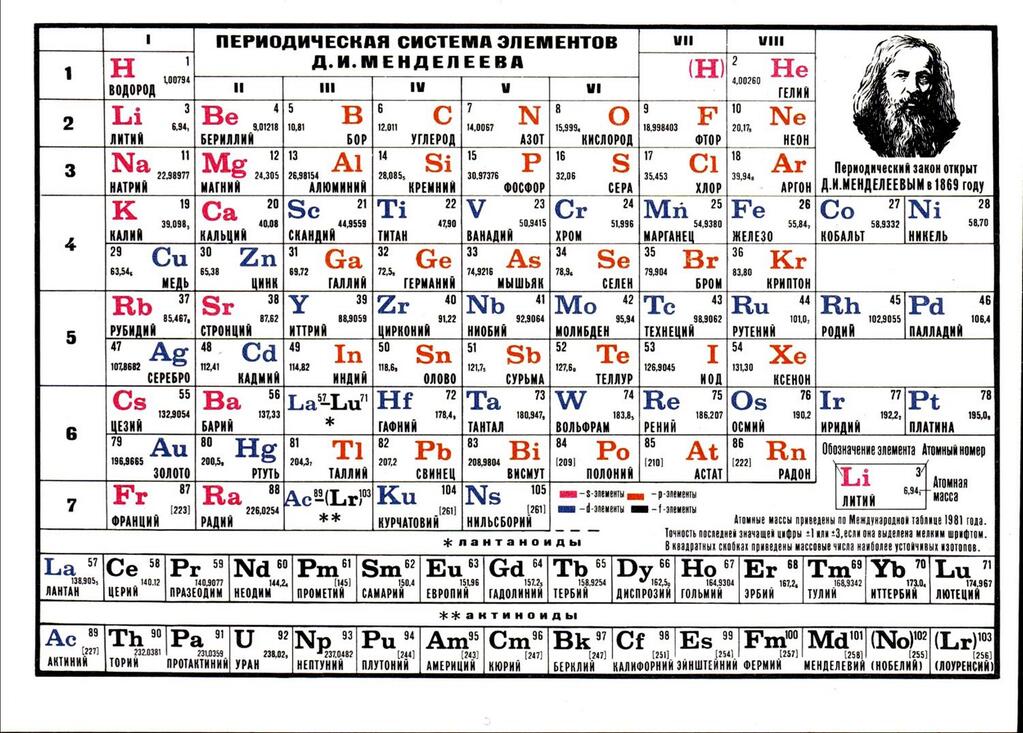
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и 
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью.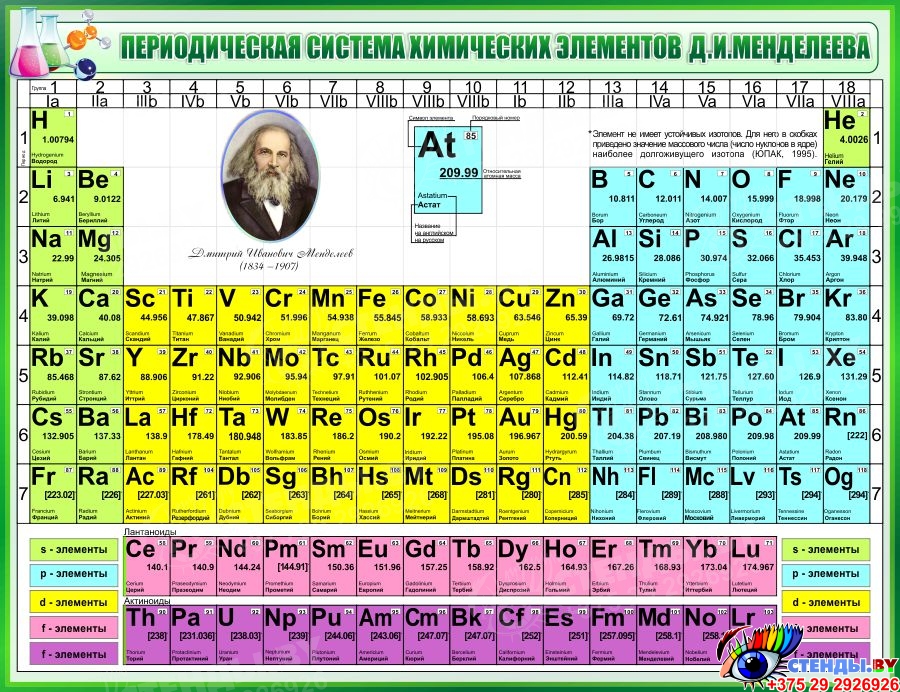 Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Таблица Менделеева онлайн
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера. Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной. В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон. Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов. Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы, обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами.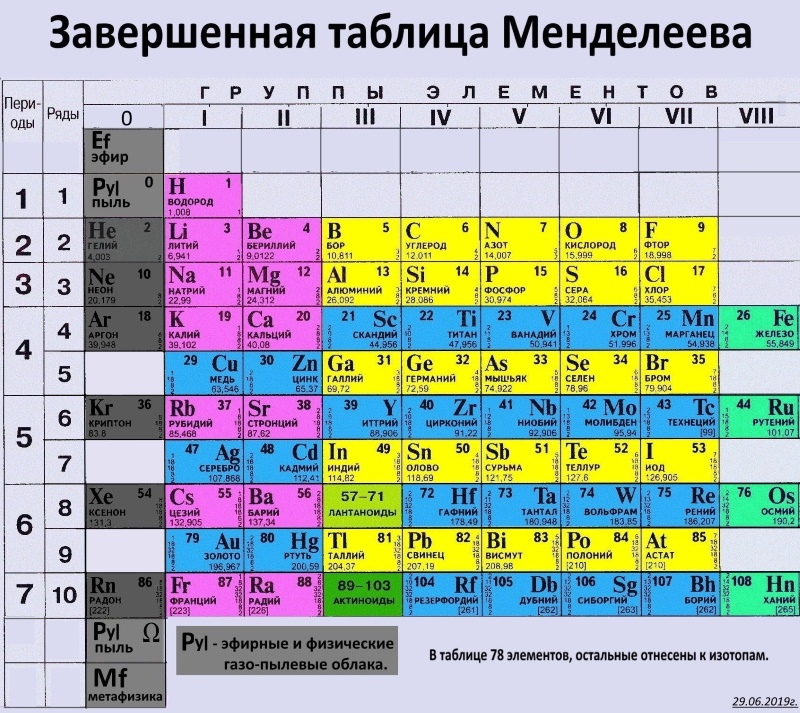 А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах. Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах. Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства. Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Таблица Менделеева черно белая
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы. А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами.
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Таблица Менделеева для егэ
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии, необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы, чтобы на экзамене не столкнуться с некоторыми трудностями.
Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы, чтобы на экзамене не столкнуться с некоторыми трудностями.
Таблица Менделеева растворимости веществ
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ. По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом.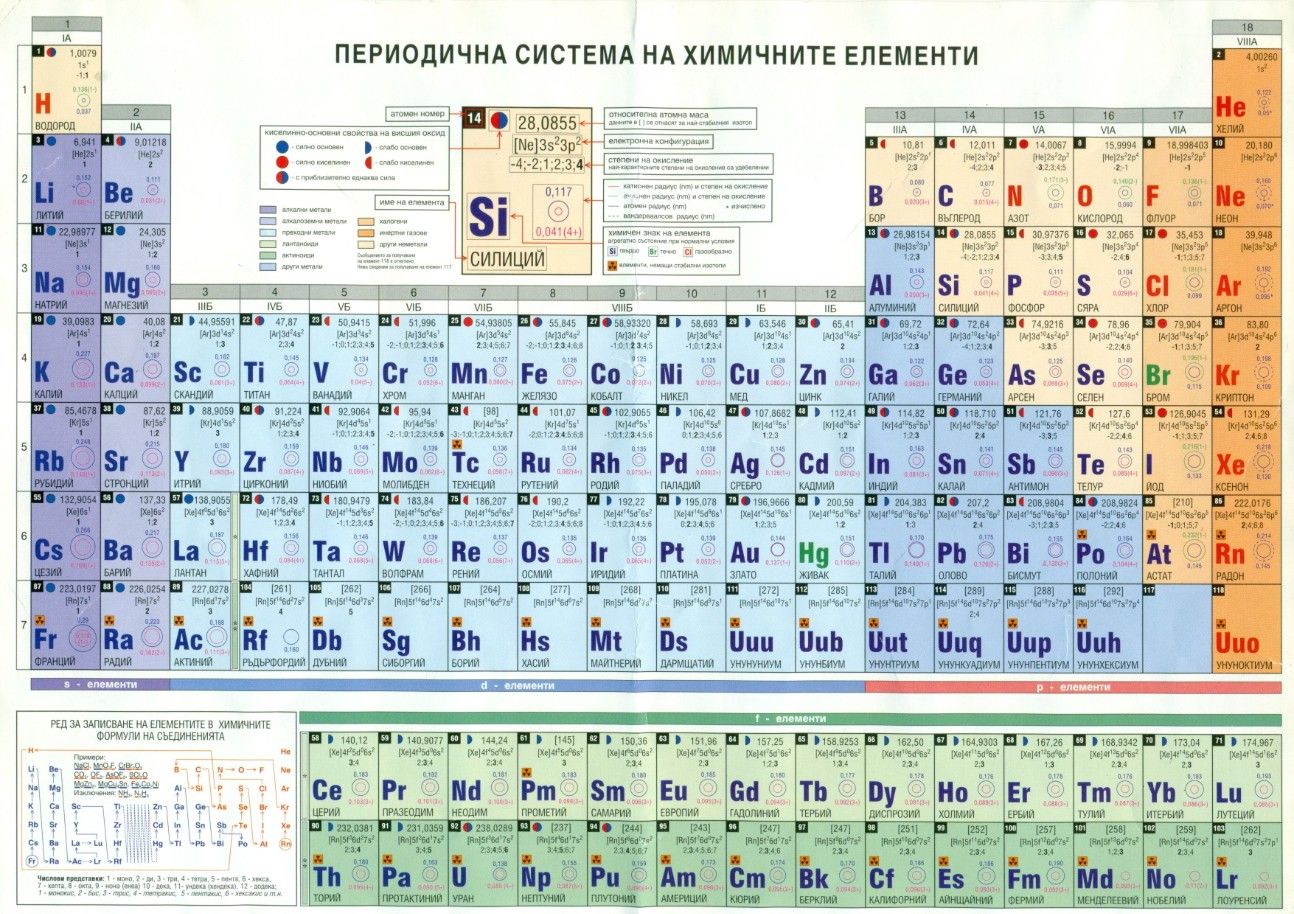 Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы, отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Подробнее о таблице Менделеева, ее химических элементах, соединениях ее элементов читайте ниже.
Дмитрий Иванович Менделеев: заслуги в науке и интересные факты
Большой вклад в мировую научную школу внёс Дмитрий Иванович Менделеев. Заслуги в науке поистине огромны. Он не только изучал вопросы, связанные с химией, но также делал открытия и углублялся в…
Периодическая таблица Менделеева в хорошем качестве
Разумеется, любой, кто учился в школе знает о том, что среди обязательных предметов уже долгие годы располагается химия. В каждом классе обязательно присутствовала периодическая таблица Менделеева в хорошем качестве, без…
Менделеев Дмитрий Иванович краткая биография и его открытия
В XIX веке как никогда много было сделано научных открытий и создано технических изобретений.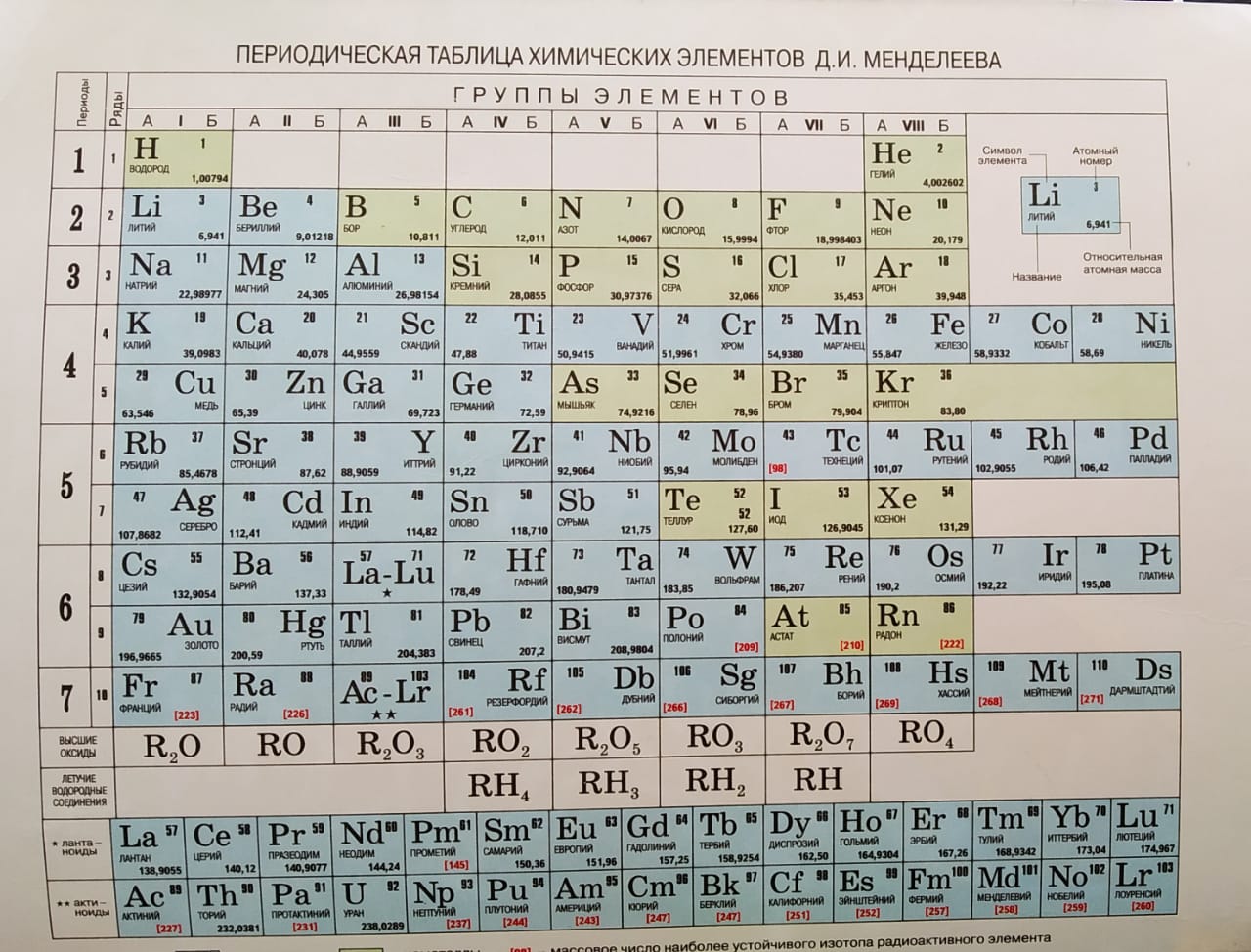 Казалось, что нет ничего необъяснимого или неподвластного науке. Одним из ярчайших представителей того времени стал ученый…
Казалось, что нет ничего необъяснимого или неподвластного науке. Одним из ярчайших представителей того времени стал ученый…
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера. Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной. В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон. Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов. Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы, обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах. Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах. Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства. Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Таблица Менделеева черно белая
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы. А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами.
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Таблица Менделеева для егэ
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии, необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы, чтобы на экзамене не столкнуться с некоторыми трудностями.
Таблица Менделеева растворимости веществ
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ. По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Например, существуют таблицы растворимости и электроотрицательности веществ. По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом. Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы, отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Подробнее о таблице Менделеева, ее химических элементах, соединениях ее элементов читайте ниже.
Периодическая таблица химических элементов Д. И. Менделеева в высоком разрешении для качественной печати. Таблицу можно распечатать на листе бумаги формата А4, а так же в большого размера для оформления кабинета Химии.
Чтобы скачать и распечатать картинку — выберите нужный вариант таблицы и нажмите на изображение.
Второй вариант оформления таблицы Менделеева. Картинка в высоком разрешении для печати большого формата:
“>
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА (МОДИФИКАЦИЯ)
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА (МОДИФИКАЦИЯ)
Антипова Ю.К. 11МБОУ Дзержинская СШ №1
Фишер О.В. 11МБОУ Дзержинская СШ №1
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
Паспорт проектной работы
Название проекта: (модификация) Периодическая система химических элементов Д.И.Менделеева
Авторы проекта: 1) Антипова Юля, ученица 8Б класса
2) Фишер Ольга Викторовна, учитель химии
Целевая аудитория: учащиеся 5-11классов
Цели проекта: модифицировать ПСХЭ Д. И.Менделеева, (дополнить информацией о свойствах химических элементов и ученых открывших данные химические элементы.)
И.Менделеева, (дополнить информацией о свойствах химических элементов и ученых открывших данные химические элементы.)
Задачи проекта: 1) Найти информацию о уже существующих таблицах ПСХЭ.
2) Подобрать материал о каждом химическом элементе.
3) Дополнить информацией Периодическую систему химических элементов Д.И.Менделеева.
Результат проекта: баннер « Периодическая система химических элементов» (модифицированная).
План проектной работы:
|
Этапы |
Дата |
Планируемый результат |
|
Подготовительный |
сентябрь |
|
|
Поисковый |
Октябрь-ноябрь |
|
|
Технологический |
Декабрь-январь |
|
|
Заключительный |
Февраль |
|
Механизм реализации проекта: анализ и систематизация знаний о химических элементах, модификация ПСХЭ Д. И.Менделеева
И.Менделеева
Материально-техническое обеспечение проекта: компьютер с выходом в интернет.
Введение
Изучая темы курса химии 8-11 классов, приходится часто обращаться к ПСХЭ Д.И.Менделеева. Периодическая система химических элементов дает информацию о строении элемента и о его химических свойствах. Для того, чтобы узнать о физических свойствах простого вещества, образованного химическим элементом, необходимо обращаться к учебнику или дополнительной литературе. Глядя в ПСХЭ Д.И.Менделеева, мы плохо представляем то, как выглядит, какого цвета, какого агрегатного состояния то или иное простое вещество образованное химическим элементом. Если дополнить ПСХЭ Д.И.Менделеева фотографиями простых веществ и ученых, открывших химические элементы, то она становится более информативной и интересной для восприятия и изучения. Такая таблица может быть интересна и полезна не только для учащихся старшей школы, но и для младшего и среднего звена.
Просмотрев таблицы имеющиеся на сайтах в сети интернет и печатных изданиях , мы не нашли той, которая бы максимально отражала свойства простых веществ. Этот факт нацелил нас на создание такой модифицированной таблицы. В задачи входило: 1. Поиск фотографий простых веществ, фотографий ученых открывших химические элементы и даты их открытия. 2. Дополнить Периодическую систему химических элементов найденной информацией.
История создания ПСХЭ Д.И.Менделеева.
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам. Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа, который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер. Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов»; ещё ранее научное извещение об открытии было им разослано ведущим химикам мира.
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». [4].
[4].
Написав на карточках основные свойства каждого элемента, Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы, в котором элементы были расставлены по девятнадцати горизонтальным рядам и по шести вертикальным столбцам. В 1870 году Менделеев в «Основах химии» публикует второй вариант системы, имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. В 2010 году, с синтезом 117 элемента, седьмой период периодической системы был завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.
Обзор имеющихся таблиц ПСХЭ Д.И.Менделеева
Периодическая система химических элементов — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса. Всего предложено несколько сотен вариантов изображения периодической системы. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Всего предложено несколько сотен вариантов изображения периодической системы. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Распространённее других являются 3 формы таблицы Менделеева: «короткая», «длинная» и «сверхдлинная».(приложение 1) В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Короткая форма таблицы, содержащая восемь групп элементов, была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжает приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной информации. В 1970 году Теодор Сиборг предложил расширенную периодическую таблицу элементов. Нильсом Бором разрабатывалась лестничная форма периодической системы.(приложение 2).
Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной информации. В 1970 году Теодор Сиборг предложил расширенную периодическую таблицу элементов. Нильсом Бором разрабатывалась лестничная форма периодической системы.(приложение 2).
Сегодня существуют несколько сотен вариантов таблицы, при этом учёные предлагают всё новые варианты. Но из предложенного многообразия печатных таблиц нет той, которая наглядно бы отражала дополнительную информацию об физических свойствах и ученых открывших химические элементы. Конечно, существуют варианты интерактивных таблиц и они есть в продаже, но цена не позволяет приобрести их общеобразовательной школе. Поэтому мы решились на создание своего варианта информативной и оригинальной таблицы.
Этапы выполнения проекта.
|
Этапы |
Дата |
Описание этапов |
Полученный результат |
|
Подготовительный |
сентябрь |
1.Изучение истории создания ПСХЭ. 2.Осуществление анализа имеющихся таблиц в интернете и печатных изданиях. |
|
|
Поисковый |
Октябрь-ноябрь |
Сбор информации (фотографий) простых веществ, ученых открывших тот или иной химический элемент и даты их открытия. |
Подобран материал: фотографии простых веществ, фотографии ученых открывших химические элементы и выписаны даты их открытия. |
|
Технологический |
Декабрь-январь |
Создание ПСХЭ в компьютерной программе Microsoft Word , дополненной информацией найденной ранее ( фотографиями, формулами молекул и датами открытия химических элементов). |
Модифицированная таблица химических элементов, созданная в компьютерной программе Microsoft Word . |
|
Заключительный |
Февраль |
|
1.Баннер «Периодическая система химических элементов» (модификация) 2.Презентация проекта |
Заключение
При выполнении проекта «Периодическая система химических элементов Д. И.Менделеева (модификация)», мы пополнили свои знания об истории открытия химических элементов , о многообразии вариантов ПСХЭ Д.И.Менделеева. Работа над проектом помогла совершенствовать навыки поиска, анализа и систематизации информации, как при работе с печатными изданиями, так и в сети интернет. Приложив усердие, терпение и труд мы достигли своей цели. Нами создан еще один вариант Периодической системы химических элементов Д.И.Менделеева (приложение 3) и как нам кажется не хуже тех, что уже существуют. Таблица дополнена информацией, которая послужит учащимся основой для получения прочных знаний о простых веществах. А портреты ученых могут вызвать интерес учащихся для изучения истории открытия химических элементов и биографий этих ученых.
И.Менделеева (модификация)», мы пополнили свои знания об истории открытия химических элементов , о многообразии вариантов ПСХЭ Д.И.Менделеева. Работа над проектом помогла совершенствовать навыки поиска, анализа и систематизации информации, как при работе с печатными изданиями, так и в сети интернет. Приложив усердие, терпение и труд мы достигли своей цели. Нами создан еще один вариант Периодической системы химических элементов Д.И.Менделеева (приложение 3) и как нам кажется не хуже тех, что уже существуют. Таблица дополнена информацией, которая послужит учащимся основой для получения прочных знаний о простых веществах. А портреты ученых могут вызвать интерес учащихся для изучения истории открытия химических элементов и биографий этих ученых.
Список используемых источников
-
Энциклопедия для детей. Том 17. Химия/Глав.ред.В.А.Володин.-М.:Аванта+,2001.-640с.:ил.
-
Химия: Энциклопедия химических элементов / Под ред.
 проф. А.М.Смолеговского.- М.: Дрофа, 2000.-432с.: ил.
проф. А.М.Смолеговского.- М.: Дрофа, 2000.-432с.: ил.
-
Химия. 8 класс: учеб. Для общеобразовательных учреждений / О.С.Габриелян. – 12-е изд., стереотип. – М.: Дрофа, 2007. – 267, с.: ил.
-
http://4108.ru/
-
http://kakprosto.ru
-
http:// alltimeades.ru
-
http:// Wikipedia/ru
Приложение 1
Короткая форма Периодической таблицы химических элементов
Длинная форма Периодической таблицы химических элементов
Сверхдлинная форма Периодической таблицы химических элементов
Приложение 2
Лестничная форма периодической системы химических элементов
Приложение 3
|
периоды |
Г Р У П П Ы Э Л Е М Е Н Т О В |
||||||||||||||||
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
||||||||||
|
1 |
(H) |
1H Водород Кавендиш (1766) |
|
2Не Гелий Жансен (1868) |
|||||||||||||
|
2 |
3 Li Литий Арфведсон (1817) |
4Be Вериллий Воклен (1798) |
5B Бор Тенар (1808) |
6С Углерод Дэви (1830) |
7 N Азот Рутерфорд (1772) |
8О Кислород O2 Пристли (1774) |
9F Фтор Муассан (1898) |
10Ne Неон Рамзай (1898) |
|||||||||
|
3 |
11Na Натрий Дэви (1807) |
12 Mg Магний Дэви (1808) |
13Al Алюминий Эрстед (1825) |
14Si Кремний Берцелиу (1823) |
15 P Фосфор Бранд (1669) |
16 S Сера
VIII в. |
17Cl Хлор Шееле (1774) |
18Ar Аргон Рамзай(1894) |
|||||||||
|
4 |
19K Калий Дэви (1807) |
20Ca Кальций Дэви (1808) |
21Sc Скандий Нильсон (1879) |
22Ti Титан Клапрот (1797) |
23V Ванадий Сефстрем (1830) |
24Cr Хром Воклен (1797) |
25Mn Марганец Шееле (1774) |
26Fe Железо
4-е тыс. |
27Со Кобальт Г.Брандт (1735) |
28 Ni Никель Кронстедт (1751) |
|||||||
|
29Cu Медь 3000 лет до н. э |
30Zn Цинк VII в. |
31Ga Галий Буабодран (1875) |
32Ge Германий Винклер (1886) |
33As Мышьяк XIII в. |
34Se Селен Ган (1817) |
35Br Бром Балар (1826) |
36Kr Криптон Траверс (1898) |
||||||||||
|
5 |
37Rb Рубидий Бунзен (1861) |
38Sr Стронций Крофорд(1787) |
39 Y Иттрий Гадолин (1794) |
40 Zr Цирконий Клапрот (1789) |
41 Nb Ниобий Хатчетт (1801) |
42Mo Молибден Шееле (1778) |
43 Тс Технеций Сегре (1937) |
44 Ru Рутений Клаус (1844) |
45 Rh Родий Вулластон (1804) |
46 Pd Палладий Вулластон (1808) |
|||||||
|
47Ag Серебро |
48Сd (1817) Кадмий Штромейер |
49 In Индий Райх (1863) |
50 Sn Олово IV тыс.до н. э. |
51 Sb Сурьма 3000 лет до н. э. |
52 Te (1782) Теллур Рейхенштейн |
53I (1811) Йод Куртуа |
54 Xe (1898) Ксенон Траверс |
||||||||||
|
6 |
55 Cs Цезий Бунзен (1860) |
56Ba Барий Шееле (1774) |
57 La* Лантан Мосандер (1839) |
72 Hf (1923) Гафний Костер |
73 Ta Тантал Экеберг (1802) |
74W (1781) Вольфрам Шееле |
75Re (1828) Рений Такке |
76Os (1804) Осмий Теннант |
77Ir (1804) Иридий Теннант |
78PtПлатина Лавуазье (1789) |
|||||||
|
79 Au Золото II тыс. до н. э. |
80 Hg Ртуть III тыс. до н. э. |
81Tl Таллий (1861) Крукс |
82 Pb Свинец 6400 г. до н.э. |
83Bi Висмут XV в. Н.Э. |
84Pо Полоний (1898) Склодовская-Кюри Кюри |
85At Астат (1940) Сегре |
86Rn Радон (1900) Дорн |
||||||||||
|
7 |
87Fr Франций Пере (1939) |
88Ra Радий Кюри |
89Ac (1899) Актиний Дебьерн |
104Rf (1969) Резерфордий Флёров |
105Db (1970) Дубний Флёров |
106Sg Сиборгий Сиборг (1974) |
107Bh (1981) Борий Армбрустер |
108Hs Хассий Звара (1984) |
109Mt (1987) Мейтнерий Армбрустер |
110Ds Дармштадтий |
|||||||
|
R2O |
RO |
R2O3 |
RO2 |
R2O5 |
RO3 |
R2O7 |
RO4 |
||||||||||
|
RH4 |
RH3 |
RH2 |
RH |
||||||||||||||
|
Лантаноид |
58Се (1803) Церий Клапрот |
59Pr (1885)Празеодим Вельсба |
60 Nb (1885) Неодим Вельсба |
61Pm (1945) Прометий Гленденин |
62Sm (1879) Самарий Буабодран |
63Eu (1901) Европий Демарсе |
64Gd (1886) Гадолиний Буабодран |
65Tb (1843) Тербий Мосандер |
66Dy (1886) Диспрозий Буабодран |
67Ho (1879) Гольмий Клеве |
68Er (1843) Эрбий Мосандер |
69Tm(1879)Тулий Клеве |
70YbИттербий Мариньяк (1878) |
71Lu Лютеций Юрбен (1907) |
|||
|
Актиноиды |
90Th (1828) Торий Берцелиус |
91Pr(1885)Празеодим Вельсбах |
92U (1789) Уран Клапрот |
93Nq (1940) Нептуний Абельсон |
94Pu (1934) Плутоний Ферми |
95Am (1944) Америций Сиборг |
96CmКюрий Гиорсо |
97Bk (1949) Берклий Сиборг |
(1950)98 KfКалифорний Сиборг |
(1952)99 EsЭнштейнийГиорсо |
100Fm (1952)Фермий Гиорсо |
101MdМенделевий Гиорсо (1955) |
102NoНобелий Флёров(1967) |
103LrЛоуренсий Флёров(1965) |
|||
Периодическая система химических элементов (модифицированная)
Просмотров работы: 2156
Современная трактовка таблицы Менделеева контрольная по химии
ОГЛАВЛЕНИЕ ВВЕДЕНИЕ………………………………………………………………………..3 1. Периодический закон Менделеева в свете строения атома…………………5 1.1 Принцип Баули. Правило Гунда……………………………………………..5 1.2Характеристики атома.Энергия ионизации атомов…………………………7 1.3 О таблице Менделеева………………………………………………………..8 1.4 Современная трактовка таблицы:……………………………………………9 1.5 Метод валентных связей…………………………………………………….11 1.6 Метод молекулярных орбиталей…………………………………………………………..12 1.7 Сигма и П – связь…………………………………………………………………………..14 2. Получение сверхтяжелых изотопов легких элементов……………………..15 2.2 Современная форма таблицы Менделеева…………………………………16 2.3 Сверх тяжелые элементы……………………………………………………23 Список литературы………………………………………………………….…..31 ВВЕДЕНИЕ Периодическая система элементов (таблица Менделеева) — классификация химических элементов, позволяющая выявить зависимость их различных свойств от числа протонов в атомном ядре. Первоначально система PAGE 2 разработана русским химиком Д. И. Менделеевым в 1869—1871 годы на основании открытого им в 1869 году периодического закона зависимости свойств элементов от атомной массы и является его графическим выражением. Всего предложено несколько сот вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двухмерную таблицу, в которой каждый столбец (число столбцов составляет 8) определяет основные физико-химические свойства, а строки представляют собой периоды, в определенной мере подобные друг другу. Изначальная работа была озаглавлена Менделеевым как «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». По легенде, мысль о такой системе пришла к нему во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, Менделеев ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Немец Л. Мейер в 1864 году на основании данных об атомных весах предложил таблицу, показывающую соотношение атомных весов для нескольких характерных групп элементов. Многие, особенно в Германии, считают и его первооткрывателем системы — в 1870 году он опубликовал свою таблицу элементов, разработанную, по всей видимости, независимо от Менделеева. Чтобы не путаться с авторскими правами, большинство школьников западного мира изучают эту систему просто как «периодическую систему элементов», без упоминания имени первооткрывателя. Сущность открытия заключалась в том, что с ростом атомного веса химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, неон похож на аргон, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. PAGE 2 Принцип Баули: в атоме не может быть двух электронов с одинаковым набором всех четырёх квантовых чисел. n, l, m, p n, I, m, p На р- подуровне в первом уровне может находиться 2 электрона с противоположными спинами. Распределение электронов по уровням и подуровням описывается с помощью электронных формул и энергетических ячеек. Согласно органическому принципу Баули электронная конфигурация на последовательном уровне может накапливаться в электронах. h2 1s1 He2 1s2 Li3 1s22p1 C6 1s22p22p2 Правило Гунда: Суммарный спин электронов на подуровне должен быть максимален, т.е. электроны на подуровне стремятся занять максимальное число свободных квантовых состояний. Число неспор. электронов или свободных квантовых состояний определяется валентностью атома. В пределах электронного уровня электроны могут исходить с подуровня на подуровень. s2р2=s1р3. Валентность2 – валентность 4. Постулат Луи де Броля: он связал импульс движения материального объекта с длиной волны этого объекта через следующую величину. L = h/p = h/mv, p = mv. Функция не является квантовым числом, а содержит эти квантовые числа. Принцип неопределённости де Броля: если частица имеет макроскопические размеры, то длина волны для этой частицы сравнительно мала. m = 1г, v = 4 м/c, =10-21cм. В качестве валентных выступают S и р подуровни. PAGE 2 1.2 Характеристики атома. Энергия ионизации атомов. 1).Энергия, которую необходимо затратить, чтобы оторвать электрон от атома и переместить его на бесконечно далёкий от него уровень. Причём атом становится полностью заряженным. Эта энергия называется потенциалом ионизации. Li: 5,39 Эл. Вольт. Энергия отрыва одного электрона от атома Li –75,6 ЭВ, для второго атома Li – 122,4 ЭВ… Потенциал ионизации изменяется скачком 1. Электронные оболочки имеют ступенчатые (слоистые) строения. 2). Энергия сродства к электрону – изменение энергии атома при его присоединении к нейтральному атому с образованием отрицательного иона при 01К. А + е А-. Электрон занимает нижнюю орбиталь с соблюдением правила Гунда. Наиболее высокие энергии сродства у галогенов. Сумма всех энергий ионизации = Е полная. 3). Универсальная характеристика, объединяющая 1,2 электроотрицательность. • сумма энергии ионизации и энергии сродства. Чем больше электроотрицательность, тем легче атом превращается в заряженный ион. Электроотрицательность: Li =1, Na =0.9, K = 0.8, Cs = 0.7, Be = 1.5, Mg = 1.2, B = 2, F = 4, p = 2.5. Периодический закон Менделеева. Формулировка Менделеева. Свойства простых веществ, а также форма и свойства сложных элементов находятся в периодической зависимости от атомных весов этих элементов. Периодическая система – графическое отражение периодического закона. 1.3 О таблице Менделеева. 8 групп главных PAGE 2 побочные – переходные элементы. 22 не Ме 11 не Ме – газы полупроводники элементарные В,С Р S Si As 6гр Se Ge Sb Te Sn Главный базовый полупроводник – Si(кремний) А3В5 GaP InP AlP Ga As InAs AlAs GaSb Isb AlSb AlN CaN 6эВ AlxGa1-xAs – инфракрасное излучение. InN HgGaTe PbTe CuTe CdTe 1.4 Современная трактовка таблицы: Свойства элементов и их соединений находятся в периодической зависимости от зарядов и ядер, атомов, элементов Порядок заполнения электронных уровней и подуровней. Правило Клечковского В.М. Электрон заполнение. Подуровень должен иметь минимально избыточной энергией по отношению к подуровню энергии. Li 1822S1 PAGE 2 5. Валентно насыщенные молекулы могут образовывать соединения за счет донорного акценторного взаимодействия (наличие валентной Атомной Орбитали и не поделенной пары электронов). Направленность спинов: Энергия связи. Под ней понимается та энергия, которая выделяется в результате взаимодействия данных атомов , участвующих в реакции. Если соединение двух атомов; m0- атомарная энергия обр. (тепловой эффект ), есть энергия связи Пример: 1.6 Метод молекулярных орбиталей: Характеристики: 1. Молекула рассматривается как целое, а не как совокупность сохраняющих индивидуальность атомов (индивидуальные характеристики). 1.2. Каждый электрон принадлежит целой молекуле и движется в поле ядер. 2. Состояние электрона в молекуле описывается молекулярной орбиталью, которая характерна набором квантовых чисел 2.1 Молекулярная орбиталь многоцентровая. 3.Каждой молекулярной орбитали соответствует своя энергия, которая потенциалу ионизации данной орбитали. Совокупность молекулярных орбиталей молекулы называют её эл конфигураций, в основе которой лежат два принципа: 1. Принцип наименьшей энергии.(электроны занимают орбиты с наименьшей энергией). PAGE 2 2. Принцип Паули.(на одной молекулярной орбитале не может быть больше двух электр с антипаралельными спинами). Движение электр в молекуле рассматривается как взаимодействие. Электронная энергия молекул есть сумма энергий орбиталей за вычетом суммы энергий межэлектродного отталкивания + сумма энергий отталкивания между ядрами. Направленность ковалентных связей. Виды ковалентных связей: 1. Ионная 2. Ковалентная 3. Металлическая 4. Водородная связь обусловлена силой Вандервальса, при взаимодействии атомы, которые вступают в связь, сильно отличны по электроотрицательности. K и F Na и Cl [Na+] + [Cl-] Na+Cl- Na – e Na+ Cl + e Cl- Взаимодействие осуществляется за счёт сил электростатического взаимодействия. За счёт перераспределения электроны образуют те или иные связи. (2) Связь возникает между атомами, незначительно различными по энергии электроотрицательности. Практически отсутствует обмен Е, возникают общие электронные пары. Каждая пара находится на своей орбитали. Разновидностями является и связь. PAGE 2 Ковалентная полярная связь: ковалентные связи в случае их полярности имеют определённые направленности и определённую форму молекулы. Пример: 1. неполярная ковалентная связь 2. – молекула воды 2Р – электрона и 2 S – элемента Этот L определяет отчасти сложные свойства воды 3. Гибридизация электронных облаков 4. (Образуется линейная структура) 1.7 Сигма и П – связь На примере этилена С2Н4 PAGE 2 сегодняшний день элементов. Она будет полезна всем, кто изучает химию и физику или просто интересуется современной наукой. Из истории создания и развития периодической системы Первого марта 1869 года Д.И. Менделеев обнародовал периодический закон и его следствие — таблицу элементов. В 1870 году он назвал систему „естественной“, а спустя год — „периодической“. Таблица (далёкий прообраз современной), демонстрирующая закон, была представлена Менделеевым под названием „Опыт системы элементов, основанный на их же атомном весе и химическом сходстве“. Им же была дана формулировка закона: „Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, находятся в периодической зависимости от их же атомного веса“. Таблица состояла из шести вертикальных групп, предшественниц будущих периодов. По горизонтали прослеживались ещё не полные ряды элементов, прообразов будущих подгрупп (сегодня — групп) элементов. Она содержала 67 элементов (сейчас их около 120), в том числе три предсказанных, впоследствии открытых и названных „укрепителями периодического закона“. Естественно, первая таблица была несовершенной, и в последующие годы Менделеев многократно дополнял её и вносил в её структуру изменения. В момент представления первого варианта таблицы (март 1869 года) не были ещё известны благородные („инертные“) газы (Не, Ne, Ar, Kr, Xe, Rn) и отсутствовали сведения о внутреннем строении атомов. Лишь в двадцатых годах прошлого столетия, после революционных открытий в физике, применения рентгеновских лучей и обнаружения благородных газов, стало возможным дать современное определение закона о периодической зависимости свойств элементов от порядкового номера элемента, а не от атомного веса, как было вначале отмечено Д. Менделеевым. Иными словами, в трактовке закона понятие „атомный вес“ элемента было заменено словами „порядковый (или атомный) номер“, что отвечает числу протонов в ядре атома и, соответственно, числу электронов у нейтрального атома. Определение стало отвечать данным об электронном строении атома, диктующим периодическую повторяемость свойств атомов через 2 (s- PAGE 2 элементы), 6 (р-элементы), 10 (d-элементы) и 14 (f-элементы) элементов. Эти цифры отвечают максимально возможному числу электронов на определённом энергетическом уровне атома. Они же соответствуют и числу возможных элементов в соответствующем периоде. На первом энергетическом уровне дозволено быть только двум электронам (на s-уровне). Они привели к наличию в первом периоде двух элементов: водорода и гелия. На втором энергетическом уровне восемь разных электронов отвечают появлению восьми новых элементов — от лития до неона. Аналогичная картина наблюдается и в третьем периоде. В нём, вместо ожидаемых восемнадцати, также восемь элементов — от натрия до аргона. Здесь произошла задержка с образованием десяти d-элементов из-за того, что 3d-электроны оказались на более высоком энергетическом уровне, чем 4s- электроны. По этой причине 3d-элементы (скандий, титан и др.) появляются лишь в четвёртом периоде после двух 4s-элементов (калий и кальций). Они предшествуют 4р-элементам (от галлия до криптона). Этим объясняется возникновение обобщающего термина — „переходные элементы“, „вставная декада“. В пятом периоде наблюдается аналогичная картина, в него с опозданием приходят 4d-элементы; они также оказываются переходными. Описанные естественные явления были одной из причин создания таблицы из восьми групп. Однако „запаздывают“ также по четырнадцать 4f- и 5f- элементов уже на два периода. Из-за их большего числа и расположения этих электронов в третьем снаружи слое (близость свойств) в обеих обсуждаемых здесь формах таблиц они выделены вне групп. Общее правило при образовании периодов системы — все они начинаются со щелочных металлов с первым ns1-электроном, образующим n-период (n — номер периода системы). Завершает каждый период „инертный“ газ с последним np6-электроном. Исключение — первый период системы, он находится всегда на особом положении. Таким образом, число элементов в семи известных периодах составляет 2, 8, 8, 18, 18, 32, 32. В соответствии с указанными числами будут наполняться элементами все периоды в порядке возрастания их порядковых номеров. При PAGE 2 этом один и тот же элемент может оказаться в различных по номеру группах, что заметно при сравнении двух таблиц. Рассмотренные цифры позволяют создать таблицы, состоящие из 2, 8, 18 или 32 групп элементов в трёх вариантах — из (2+6), (2+6+10) или (2+6+10+14) групп. Исторически, как наиболее удобные, распространение получили в первую очередь таблицы, состоящие из 8 или 18 вертикальных групп: а) Короткая форма таблицы. Она, к сожалению, до сих пор приводится в большинстве российских справочников и учебных пособий, хотя официально отменена ИЮПАК в 1989 году. Таблица состояла из VIII (+0) групп „типических“ элементов, подгрупп (иногда и рядов) и периодов элементов. В современной зарубежной литературе эта форма таблицы заменена длинной формой. б) Длинная (реже называемая длиннопериодной или полудлинной) форма таблицы. Она была утверждена ИЮПАК в 1989 году, состоит из 18 групп, обозначенных арабскими (вместо римских) цифрами, и не содержит „типических“ элементов, подгрупп, рядов и семейств. Её упрощённые варианты появлялись гораздо раньше, но чаще всего с одним отличием — групп, обозначенных римскими цифрами, было восемь (с их растяжкой до восемнадцати за счёт приставок а и b и искусственным созданием триад элементов). в) Сверхдлинная (реже именуемая длинной) форма таблицы состояла бы из 32 групп элементов. Официально она вряд ли будет принята в предвидимом будущем, так как каждая из 14 дополнительных групп (сверх 18) содержала бы лишь два элемента (один лантаноид и один актиноид), близкие по свойствам ко всем остальным тринадцати элементам периода. Новая форма таблицы До 80–90-х годов прошлого века были распространены две первые формы таблицы. Первая архаичная короткая форма с „насильственной“ упаковкой элементов в восемь (I-VIII), иногда девять (+0) групп, подразделённых дополнительно ещё на ряды (8 или 10) и подгруппы, содержавшие два или PAGE 2 2,5 для углерода до 4,0 для фтора) называются соответственно карбидом, нитридом, оксидом и фторидом водорода. В соответствии с этим приведённые написания формул аммиака и метана более справедливы, нежели традиционные (Nh4 и СН4). Однако, несмотря на справедливое разрешение ИЮПАК давно назревшей проблемы и принятие новой системы во всём мире, её использование в российском образовании и науке неоправданно запаздывает. Вместе с тем есть и отрадные исключения из этого. Помимо ряда изданий нового варианта таблицы, предложенного авторами настоящей статьи, можно отметить публикации простых вариантов длинной формы таблицы рядом передовых российских издательств, а современной таблицы на двух языках в новом семитомном справочном издании. В отличие от российских, зарубежное образование и наука приняли к исполнению решение ИЮПАК 1989 года незамедлительно. Интернет также сообщает только о наличии длинной формы таблицы. Современный вариант периодической системы, первый в российских публикациях, был создан в 1999 году. Новая форма таблицы Менделеева учебно-справочного назначения отвечает международным стандартам. Кроме русских и латинских названий элементов в ней приводятся английские и американские формы их написания. Чтобы сохранить преемственность таблиц и упростить использование её длинной формы, новые номера групп в ней согласованы со старыми (римскими) номерами групп (I — VIII) и подгрупп (a, b), хотя зарубежные источники прежние обозначения уже не указывают. Упрощённые варианты рациональной длинной таблицы были распространены ещё задолго до 1989 года, в том числе в СССР, с одним отличием — номеров групп было восемь (они обозначались римскими цифрами), но они „растягивались“ до восемнадцати за счёт приставок а и b и искусственного создания триад элементов. В новой таблице приведены исправленные атомные массы элементов, утверждённые ИЮПАК в 1995 году, и новые названия десяти последних элементов, окончательно утверждённые, PAGE 2 также этой организацией, в 1997-м. Аналоги такой системы, в основном англоязычные, широко распространены в зарубежной литературе. 2.3 Сверх тяжелые элементы. Российские ученые открыли 116-й элемент таблицы Менделлева (5.09.2000г | Русский Переплет) Около двух месяцев назад, 14 июня, в лаборатории ядерных реакций имени Г.Н. Флерова Объединенного института ядерных исследований в Дубне начался эксперимент по синтезу нового, 116-го, элемента таблицы Менделеева. И 19 июля, в 1 час 21 минуту, было зарегистрировано событие, которое можно интерпретировать как распад ядра 116-го элемента. “В нашем циклотроне У-400 мы бомбардировали мишени из кюрия-248 ионами кальция-48, разогнанными до скорости 0,1 от скорости света, – рассказывает научный руководитель лаборатории ядерных реакций, член- корреспондент РАН Юрий Оганесян. – При слиянии должен был образоваться стабильный элемент, который испытывает альфа-распад и тогда превращается в 114-й. Этот, в свою очередь, – в 112-й элемент, а потом в 110-й. И вот, 19 июля, мы такую цепочку распадов зарегистрировали”. Время жизни 116-го элемента – 50 миллисекунд. Пока зафиксировано только одно такое событие, но эксперимент будет продолжаться до конца года. Однако важен не столько даже сам факт синтеза нового химического элемента. Уже 35 лет существует и развивается теоретическая гипотеза относительно того, что таблица Менделеева не кончается трансурановыми элементами. И это несмотря на то что по мере того, как мы идем ко все более тяжелым элементам, время их жизни резко уменьшается. Если уран, 92-й номер в таблице, живет миллиард лет, то 112- й элемент, который был синтезирован в Германии в 1995 г., живет 240 микросекунд! Но теория предсказывает, что если пойти еще дальше, ко все более тяжелым элементам, время их жизни начнет опять сильно возрастать. В таком случае правомерно поставить вопрос: где верхняя граница периодической системы? Когда в прошлом веке Дмитрий Иванович Менделеев сформулировал свой периодический закон, ему было известно 63 PAGE 2 химических элемента. К 1940 г. была заполнена практически вся таблица Менделеева до номера 92 – урана – включительно. (Кроме элемента 61 – прометий, открытого в 1945 г.) Надо сказать, что уран – это своего рода Рубикон в таблице Менделеева: последний элемент, распространенный в естественном виде в земной коре. Все последующие 18 трансурановых элементов в буквальном смысле творение рук человеческих. В природе их практически нет. И чем дальше за уран, тем меньше время существования новых атомов вплоть до тысячных долей секунды. Но вот что удивительно. Теоретики предсказали, что около элемента с атомным номером 114 при числе нейтронов в ядре 182 должен существовать “остров стабильности”. Время жизни этого гипотетического элемента оценивается в несколько миллионов лет. Нынешний эксперимент в Дубне стал очень важным тестом на правильность всей ядерной теории. “Честно сказать, больше всего нас интересует не синтез еще одного элемента. Ну, 116-й, ну еще один Ну и что? – комментирует результаты эксперимента Юрий Оганесян. – Если действительно правильно (а как будто это так), структура ядерной материи может так сильно менять свойства всей системы – ядра, атома, потом молекулы – то, вообще-то говоря, речь идет о совершенно необычном веществе, основу которого составляет очень тяжелое ядро”. Впрочем, достигнуть пика – 114-го элемента со 182 нейтронами в ядре – невозможно. Никакие мыслимые на сегодня реакции синтеза не приводят к такому большому количеству нейтронов в ядре. В конце прошлого года в лаборатории ядерных реакций было синтезировано ядро 114-го элемента, но в него удалось “вбить” только 174 нейтрона. А в данной ситуации каждый нейтрон значит очень много. Так, прибавление всего шести нейтронов к ядру 112-го элемента со 165 нейтронами увеличивает время жизни нового изотопа в четыре млн. раз, и оно составляет минуты! Однако о приближении к вершине “острова стабильности” можно судить и по “отрогам”. Полученное ядро элемента # 116 содержит 180 нейтронов. По словам Оганесяна, на “отрогах” время жизни нового элемента оказалось даже больше, чем предсказывает теория. И этот факт сам по себе еще требует PAGE 2 года отозвала свое заявление после того, как в ходе расследования было установлено, что один из ученых – доктор Виктор Нинов – сфабриковал данные. Позднее Нинов был уволен. Доктор Кен Муди, ведущий американский исследователь, принимавший участие в работе, заявил, что было сделано все возможное с целью уберечься от фальсификаций, анализ проводился независимо в России и в Соединенных Штатах. Отчет группы о предполагаемом открытии был принят престижным научным журналом Physical Review C, после того как другие специалисты высказали свое мнение, рассказал редактор журнала, доктор Джонатан Линэган. Однако происходящее связано не столько с опасениями подлога, сколько с обычной осторожностью ученых, которая заставляет некоторых из них воздерживаться от оценки. Российская лаборатория и ее сотрудники сообщили об открытии пяти элементов – 113-го, 114-го, 115-го, 116-го, а теперь и 118-го – но ни одно из этих открытий не подтверждено другими учеными, продолжает The New York Times. (Полный текст статьи на сайте InoPressa.ru.) “Следует быть чрезвычайно осторожным в отношении подобных радостных заявлений”, – говорит доктор Витольд Назаревич, теоретик в области ядерной физики из Университета штата Теннеси, работающий в Окриджской национальной лаборатории. “Это происходит не из-за того, что кто-то что-то неправильно сделал. Дело в том, что имеют место очень тонкие измерения – на грани статистической погрешности”, – пояснил Назаревич. Группа, получившая новый элемент, которая состоит из ученых Ливерморской национальной лаборатории Лоуренса в Калифорнии и представителей Объединенного института ядерных исследований в российском городе Дубна, заявила о получении трех атомов нового элемента в течение полугода экспериментов по синтезу его из более легких элементов. Ученые также говорят, что полученные результаты дают надежду на приближение к давно предсказанному “острову стабильности”, состоящему PAGE 2 из еще более тяжелых элементов, время жизни которых дольше и которые, возможно, обладают новыми, необычными химическими свойствами. “Это существенно расширяет границы существующего материального мира”, – сообщил в своем электронном письме доктор Юрий Оганесян. Он является директором Лаборатории ядерных реакций при институте им. Флерова в Дубне, где проводились эксперименты с использованием циклотрона – циклического ускорителя заряженных частиц. В свою очередь исследовательница из Ливермора, доктор Нэнси Дж. Стойер, сообщила, что, по расчетам группы, вероятность того, что полученные результаты являются последствием статистической ошибки, составляет одну стотысячную. “Мы более чем уверены”, – подчеркнула Стойер. Другие ученые-экспериментаторы сообщили, что никаких явных несоответствий в работе нет. “Я полагаю, что имеющиеся у них доказательства убедительны, – сказал, в частности, доктор С. Конрад Гельбке, директор Национальной лаборатории Мичиганского университета, изучающей применение сверхпроводимости в ускорителях. – Все выглядит неплохо”. Эксперименты, проводившиеся российскими учеными с помощью циклотрона, включали бомбардировку мишени из калифорния, содержащего 98 протонов, атомами кальция, содержащими 20 протонов. В результате этого, как надеялись ученые, частицы должны были слипнуться, словно комочки клейкой массы, объяснил еще один участник эксперимента из Ливермора, доктор Доун А. Шоунесси. В исключительно редких случаях они соединились. После 10 миллиардов бомбардировок детекторы обнаружили, что два набора протонов соединились, породив в результате 118-й элемент. Вес элемента определяется общим числом протонов, которые имеют положительные заряд, и нейтронов, не имеющих заряда, в ядре атома. По этому показателю новый элемент также является самым тяжелым из когда-либо созданных. Доктор Гельбке считает, что есть одна убедительная причина, по которой российская лаборатория опередила всех конкурентов в мире. По его словам, PAGE 2 ученые данной лаборатории обладают высокой квалификацией в обращении с калифорнием, радиоактивным и опасным для несведущих элементом. “Лично я бы не стал с ним работать, – отметил доктор Гельбке. – Для большинства людей это довольно опасное вещество”. Если полученные результаты будут признаны, то они станут еще одним шагом в достижении “острова стабильности”, который, согласно предсказаниям теоретиков, составляет группа сверхтяжелых элементов периодической таблицы. Ядра имеют оболочечное строение, и наиболее стабильные атомы содержат так называемые “магические числа” протонов и нейтронов, которые составляют закрытую, или заполненную, оболочку. Числа 2, 8, 20, 28, 50 и 82 являются магическими как для протонов, так и для нейтронов. Самым высоким магическим числом для нейтронов является 126, так что обычный свинец, содержащий 82 протона и 126 нейтронов, является самым тяжелым из “дважды магических”, то есть особо устойчивых, изотопов в периодической таблице. Однако теоретики предсказывает, что существуют и другие элементы с закрытой оболочкой, расположенные дальше всех известных на настоящий момент элементов, включая последний. “Это как Плам-Айленд у оконечности Лонг-Айленда, – пояснил главный редактор Physical Review доктор Мартин Блюм. – Вы идете туда, затем море, а потом Плам-Айленд”. Предполагается, что следующее магическое число для нейтронов равняется 184, однако это пока невозможно подтвердить экспериментально. При этом среди ученых нет единого мнения по вопросу о следующем магическом числе для протонов. “Мне кажется, есть основания для ведения поисков в данном районе, – считает доктор Блюм. Российские ученые предлагают назвать новый элемент “Московий” Синтез 118-го сверхтяжелого элемента периодической таблицы Менделеева стал большим вкладом ученых России и США в фундаментальную науку, заявил во вторник ИТАР-ТАСС заместитель директора Объединенного института ядерных исследований в Дубне Михаил Иткис, комментируя открытие нового элемента. “Работа над синтезом 118-го элемента длилась PAGE 2
Длинная форма – периодическая система
Длинная форма – периодическая система
Cтраница 1
Длинная форма периодической системы подразделяется на семь рядов, которые совпадают с соответствующими периодами. В больших периодах длиннопериодной формы таблицы восемнадцать групп и элементы побочных подгрупп отделены от элементов главных подгрупп. Родство элементов побочных подгрупп с элементами соответствующих главных подгрупп в длиннопериодной форме устанавливается тем, что соответствующим подгруппам придаются одинаковые номера, только с разными индексами: главным – А, а побочным – В. [1]
Длинная форма периодической системы элементов Д.И.Менделеева также содержит 7 периодов и 18 групп. Группы нумеруются римскими цифрами с буквами А или В. Лантаноиды, как и актиноиды, называют семейством и не относят к какой-либо группе. [2]
Длинная форма периодической системы элементов Д. И. Менделеева также содержит 7 периодов и 16 групп. Группы нумеруются римскими цифрами с буквами А или В. Лантаноиды, как и актиноиды, называют семейством и не относят к какой-либо группе. [3]
Говоря о структуре длинной формы периодической системы элементов Д. И. Менделеева, прежде всего следует остановиться на. Их семь ( обозначены арабскими цифрами), из них первый, второй и третий называются малыми, а четвертый, пятый, шестой и седьмой – большими, так как в первом периоде 2 элемента, во втором и третьем – по 8, в четвертом и пятом – по 18, в шестом – 32, в седьмом ( незавершенном) – 21 элемент. [4]
На первом форзаце данной книги помещен вариант длинной формы периодической системы. Это также вариант Менделеева, не в современном оформлении. На втором форзаце книги представлен вариант короткой формы периодической, системы. Он рассматривается в средней школе, им часто пользуются и в вузах. [5]
Применяя в дальнейшем тот же принцип, приходим к длинной форме периодической системы ( стр. В таблице Менделеева ( стр. [6]
Тем самым был подтвержден и сделанный нами в 1935 – 1936 гг. вывод о том, что длинная форма периодической системы лучше отвечает свойствам элементов. [7]
В этой таблице внимание сосредоточено на порядке заполнения электронных подуровней в зависимости от увеличения энергии состояний. Таблица Лонгэ-Хиггинса удобна, но она не дает ничего принципиально нового по сравнению с длинной формой периодической системы. То, что предлагается так много таблиц, указывает на разнообразие существующих мнений и в то же время на то, как трудно было бы выбрать лучшую. [8]
Теоретическому выводу [12] [15] о затрудненности образования кислородных соединений 8-валентного железа и невозможности образования соединений восьмивалентного никеля противоречили опубликованные в научной печати сведения о том, что такие соединения выделены. Тем самым был подтвержден и сделанный нами в 1935 – 1936 гг. вывод о том, что длинная форма периодической системы лучше отвечает свойствам элементов. [9]
На первом форзаце данной книги помещен вариант короткой формы периодической системы. Он рассматривается в средней школе, им часто пользуются и в вузах. На втором форзаце книги представлен вариант длинной формы периодической системы. Это также вариант Менделеева, но в современном оформлении. [10]
В больших периодах оказывается восемнадцать групп и элементы побочных подгрупп отделены от элементов соответствующих главных подгрупп. В этом заключаются как преимущество, так и недостаток длиннопериодной формы. Родство элементов побочных подгрупп с элементами соответствующих главных подгрупп в длиннопериодной форме устанавливается тем, что соответствующим подгруппам придаются одинаковые номера, только с разными индексами – главным А, а побочным В. В длиннопериодной форме, хотя и устраняются противоречия, связанные с совмещением элементов главных и побочных подгрупп, однако противоречия правилам изменений свойств элементов в некоторых рядах и группах остаются. Помимо этих противоречий, в длинной форме периодической системы отсутствует симметрия расположения элементов, особенно при разделении их на металлические и неметаллические, а также имеются разрывы в малых периодах, которые нарушают наши представления о непрерывности изменения свойств элементов. [11]
В больших периодах оказывается восемнадцать групп и элементы побочных подгрупп отделены от элементов соответствующих главных подгрупп. В этом заключаются как преимущество, так и недостаток длиннопериодной формы. Родство элементов побочных подгрупп с элементами соответствующих главных подгрупп в длиннопериодной форме устанавливается тем, что соответствующим подгруппам придаются одинаковые номера, только с разными индексами – главным А, а побочным В. Таким образом обозначаются шестнадцать групп, а группы кобальта и никеля или оставляют вообще без номера, или присоединяют их к группе железа, придавая всем трем группам номер VIIIB. В длиннопериодной форме, хотя и устраняются противоречия, связанные с совмещением элементов главных и побочных подгрупп, однако противоречия правилам изменений свойств элементов в некоторых рядах и группах остаются. Помимо этих противоречий, в длинной форме периодической системы отсутствует симметрия расположения элементов, особенно при разделении их на металлические и неметаллические, а также имеются разрывы в малых периодах, которые нарушают наши представления о непрерывности изменения свойств элементов. [12]
Страницы: 1
gaz.wiki – gaz.wiki
- Main page
Languages
- Deutsch
- Français
- Nederlands
- Русский
- Italiano
- Español
- Polski
- Português
- Norsk
- Suomen kieli
- Magyar
- Čeština
- Türkçe
- Dansk
- Română
- Svenska
Структура периодической системы
Структура периодической системы
Наиболее распространёнными являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды и актиноиды вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток.
Ниже приведён длинный вариант (длиннопериодная форма), утверждённый Международным союзом теоретической и прикладной химии (IUPAC) в качестве основного.
Периодическая система элементов[2] | |||||||||||||||||||||||||||||||||
Группа → Период ↓ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| |||||||||||||||||||||||||||||||||
1 | 1 H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2 He | |||||||||||||||
2 | 3 Li | 4 Be |
|
|
|
|
|
|
|
|
|
| 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | |||||||||||||||
3 | 11 Na | 12 Mg |
|
|
|
|
|
|
|
|
|
| 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | |||||||||||||||
4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | |||||||||||||||
5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | |||||||||||||||
6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn | |||||||||||||||
7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||||||||||||||
| |||||||||||||||||||||||||||||||||
Лантаноиды * | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | 71 Lu | ||||||||||||||||||
Актиноиды ** | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | 103 Lr | ||||||||||||||||||
п·о·р Семейства химических элементов | |||
| Щелочные металлы |
| Неметаллы |
| Щёлочноземельные металлы |
| Галогены |
| Переходные металлы |
| Инертные газы |
| Металлы |
| Лантаноиды |
| Полуметаллы — металлоиды |
| Актиноиды |
Короткая форма таблицы, содержащая восемь групп элементов[3], была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжает приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной (международной) информации[4].
В 1970 году Теодор Сиборг предложил расширенную периодическую таблицу элементов. Нильсом Бором разрабатывалась лестничная (пирамидальная) форма периодической системы. Существует и множество других, редко или вовсе не используемых, но весьма оригинальных, способов графического отображения Периодического закона[5][6]. Сегодня существуют несколько сотен вариантов таблицы, при этом учёные предлагают всё новые варианты[7].
Значение периодической системы
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Разработанная в XIX в. в рамках науки химии, периодическая таблица явилась готовой систематизацией типов атомов для новых разделов физики, получивших развитие в начале XX в. — физики атома и физики ядра. В ходе исследований атома методами физики было установлено, что порядковый номер элемента в таблице Менделеева (атомный номер) является мерой электрического заряда атомного ядра этого элемента, номер горизонтального ряда (периода) в таблице определяет число электронных оболочек атома, а номер вертикального ряда — квантовую структуру верхней оболочки, чему элементы этого ряда и обязаны сходством химических свойств.
Появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Полная форма современной Периодической таблицы элементов с дефектами и достоинствами
Зачем нам нужна Современная таблица Менделеева?
Нам нужна длинная форма современной периодической таблицы элементов по следующим причинам: как только было обнаружено достаточно большое количество элементов и их свойства были достаточно хорошо охарактеризованы, возникла необходимость систематизировать их на основе их свойств. Были предприняты попытки классифицировать элементы несколькими способами. Наиболее примечательным из них является работа русского химика Дмитрия Менделеева в 1869 году, который дал закон, известный как Периодический закон Менделеева, который гласит:
Физические и химические свойства элементов являются периодической функцией их атомных масс.Менделеев расположил известные элементы в порядке возрастания их атомных масс в последовательных последовательностях так, чтобы элементы с аналогичными свойствами попадали в один столбец в виде таблицы, известной как Периодическая таблица Менделеева в честь его имени.
Менделеев не мог перечислить элементы в порядке возрастания атомного номера, как это делается в современной таблице Менделеева, потому что в то время атомные номера не были известны. Он признал, что перечисление элементов по атомной массе неудовлетворительно.Менделеев предположил, что наблюдаемые химические свойства элементов были более важными, чем атомные массы, приписываемые элементам – хорошее предположение: учитывая подозрительную природу многих атомных масс того времени.
итак вопрос:
Кто устроил современную таблицу Менделеева?
В 1913 году Генри Мозли разработал концепцию атомных чисел. Мозли определил частоты испускаемых рентгеновских лучей при бомбардировке различных элементов электронами высокой энергии.Он обнаружил, что каждый элемент излучает рентгеновские лучи уникальной частоты; кроме того, он обнаружил, что частота обычно увеличивается с увеличением атомной массы.
Он упорядочил частоты рентгеновских лучей, присвоив каждому элементу уникальное целое число, называемое атомным номером. Мозли отождествлял атомный номер с числом протонов в ядре атома и числом электронов в атоме ». Концепция атомного номера прояснила некоторые проблемы в ранней модели периодической таблицы, основанной на атомных массах.
Современная периодическая таблица (Длинная форма периодической таблицы)
Работа Мозли без сомнения доказала, что свойства элементов хорошо объяснены и большинство аномалий и дефектов Периодической таблицы Менделеева исчезают, если основу классификации изменить с атомных масс на атомные номера. Это формулирует современный Периодический закон , который гласит:
Физические и химические свойства элементов являются периодической функцией их атомных номеров.Чтобы устранить недостатки периодической таблицы Менделеева, был предложен ряд таблиц для классификации элементов на основе современного периодического закона. Из таких разнообразных таблиц наиболее широко используется длинная форма периодической таблицы , которую также называют таблицей Бора.
Так как он основан на схеме Бора классификации элементов на четыре типа на основе их электронных конфигураций. Табличное расположение элементов в порядке возрастания атомных номеров в строках и столбцах, подчеркивающее регулярное повторение свойств элементов, называется периодической таблицей.Основная структура таблицы Менделеева – ее разделение на строки и столбцы.
Современная версия таблицы Менделеева с элементами, упорядоченными по атомным номерам, представлена в таблице 1.1. Каждая запись содержит атомный номер, атомный символ и атомную массу элемента. Горизонтальные ряды в периодической таблице называются периодами. Есть семь периодов, которые пронумерованы от 1 до 7 с использованием арабских цифр, и они сильно различаются по длине.
Каждый период начинается с щелочного металла и заканчивается элементом инертного газа.Вертикальные столбцы в периодической таблице называются группами. Имеется 18 вертикальных столбцов, составляющих 16 групп элементов. Они пронумерованы 1A, IIA, IIIB… .. VIIB, VIIIB IB, lIB, IIIA–– VIIA и VIIIA (или ноль) в соответствии с традиционной системой номенклатуры (то есть североамериканской системой номенклатуры). Северная Америка маркирует группы римскими цифрами, имеющими обозначения A и B.
Европейцы используют аналогичное соглашение о нумерации столбцов от IA до 8A, а затем от 1 до 18, тем самым присваивая метку 7B (или VIIB) вместо 7A группе, возглавляемой фтором (F), и, таким образом, некоторые столбцы имеют A и B меняются местами.Чтобы устранить эту путаницу, Международный союз теоретической и прикладной химии (IUPAC) предложил новое соглашение, в котором группы нумеруются от 1 до 18 без обозначений A или B, как показано в таблице 1.1, которая показывает традиционные североамериканские и IUPAC. условности.
Когда мы ссылаемся на элемент по его периодической группе, мы будем использовать традиционное североамериканское соглашение. Элементы в группе имеют схожие химические свойства. Свойства элементов в одной группе отличаются от свойств элементов в другой группе.Элементы в пределах периода имеют свойства, которые постепенно меняются по таблице.
Точка содержит элементы в порядке возрастания атомного номера. Начинается новый период для размещения элементов аналогичных свойств в вертикальных столбцах. Элемент может быть расположен в периодической таблице, указав его период и номер группы Периоды. Это горизонтальные ряды.
Первый период (n = 1) содержит два элемента, водород и гелий, n указывает номер основного энергетического уровня для элементов в периоде.Таким образом, первый период имеет только один основной энергетический уровень для элементов.
Второй период (n = 2) состоит из 8 элементов, начиная с Li и заканчивая неоном (Ne), то есть Li 3 – Ne 1 0. Третий период (n = 3) также имеет 8 элементов, начиная с Na и заканчивая Ar, то есть от Na 11 до Ar 18 .
Первый, второй и третий периоды называются короткими периодами, потому что они содержат небольшое количество (2 или 8) элементов.
Четвертый и пятый периоды состоят из 18 элементов каждый ( 19 крон – 36 крон) и ( 37 руб. – 54 рублей) соответственно.Из них восемь являются типичными (нормальными) элементами, которые принадлежат к группе A, в то время как другие 10 элементов принадлежат к группе B (кроме IIB) в периодической таблице, являются переходными металлами, потому что каждый из этих элементов либо имеет неполную подоболочку, либо легко дает Возникновение катионов с неполной подоболочкой. Шестой период состоит из 32 элементов от Cs до Rn.
Из них восемь в группах A являются типичными элементами, элементы в группах B (кроме IIB, т. Е. Hg) являются переходными металлами и четырнадцать от 58 Ce до 71 Lu являются внутренними переходными элементами.
Внутренние переходные элементы, также называемые лантаноидами или редкоземельными металлами, перечислены отдельно внизу таблицы.
Четвертый, пятый и шестой периоды называются длинными периодами, потому что они содержат большое количество (18 или 32) элементов.
Седьмой период неполный, но считается длинным (потенциально 32 элемента). 14 элементов с 90Th по 103 Lr, извлеченные из седьмого периода и помещенные внизу таблицы, называются актинидами.
В настоящее время этот период насчитывает 23 элемента, которые находятся в диапазоне от 87 Fr до 109 Une. Все эти элементы радиоактивны.
Из них элементы, а именно 87 Fr, 88 Па, 89 Ас, 90 Th, 91 Па и 92 U, являются 4 радиоактивными элементами естественного происхождения, а остальные элементы (т. Е. 93 Np до 109 Une – это искусственно созданные (т.е. искусственно приготовленные) радиоактивные элементы, которые называются трансурановыми элементами.
Разделение лантаноидов и актинидов носит практический характер. Если бы этого не было сделано, таблица была бы слишком широкой, чтобы поместиться на большинстве страниц, поэтому они помещаются внизу периодической таблицы для экономии места.
В отдельном списке также подчеркивается большое сходство свойств элементов в каждой из двух серий.
Группы . В периодической таблице 18 вертикальных столбцов, которые составляют 18 групп и пронумерованы как 1, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 и 18. согласно рекомендации IUPAC, принятой в 1984 г.
Элементы, принадлежащие к группам 1, 2, 13, 14, 15, 16, 17 и 18, известны как нормальные или репрезентативные элементы. Элементы между группами 2 и 13 (то есть 3-12) называются переходными элементами, потому что они представляют собой переход (изменение) от электроположительных элементов с левой стороны к электроотрицательным элементам с правой стороны периодической таблицы.
Два ряда элементов (каждый по 14 элементов) известны как лантаноиды и актиниды соответственно. Они размещены отдельно внизу периодической таблицы, чтобы избежать неконтролируемого бокового расширения таблицы Менделеева.
Согласно североамериканской системе 18 вертикальных столбцов составляют 16 групп элементов. Это:
- Группы IA, IIA, IIIA, IVA, VA, VIA, VIIA и VIIIA (нулевые группы). Элемент этих групп называется нормальным элементом. Другими словами, элементы группы А в периодической таблице называются нормальными или репрезентативными элементами.
- Группы IB, IIB, IIIB, IVB, VB, VIB, VIIB и VIIIB. Группа VIIIB состоит из трех столбцов. Группы IB, IVB, VB, VIB, VIIB и VIIIB имеют чисто переходные элементы, в то время как в группе IIIB некоторые элементы являются переходными элементами, а остальные – внутренними переходными элементами.Другими словами, элементы в группах B (кроме IIB) известны как переходные элементы.
Следует отметить, что есть три семейства, сгруппированных вместе в группу VIIIB, потому что все элементы группы VIIIB обладают схожими свойствами. Они отдельно называются семействами железа, кобальта и никеля.
Элементы с одним и тем же номером группы, но с разными обозначениями, имеют относительно немного схожих свойств. Несколько групп репрезентативных элементов имеют общие названия.
Элементы группы IA (кроме H) называются щелочными металлами, а элементы группы IIA – щелочноземельными металлами. Группа VIA называется галогенами, группа VIA называется галогенами, а группа VIIA называется благородными (или инертными) газами.
Достоинства современной периодической таблицы
Современная таблица Менделеева имеет ряд преимуществ перед периодической таблицей Менделеева в следующих отношениях:
- Расположение элементов основано на более фундаментальном свойстве, а именно на атомном номере.
- В этой периодической таблице положение элемента связано с электронной конфигурацией его атома.
- Он объясняет сходства и различия в свойствах элементов с точки зрения электронных конфигураций и четко выявляет тенденции в химических свойствах на протяжении длительных периодов времени.
- Инертные газы полностью заполнили электронные оболочки, помещенные в конце каждого периода. Такое расположение инертных газов представляет собой логическое завершение каждого периода.
- Самое большое преимущество этой периодической таблицы состоит в том, что ее можно разделить на четыре блочных элемента, а именно s-, p-, d- и f-блочные элементы.
- Он обеспечивает четкое разграничение различных типов элементов, таких как активные металлы, переходные металлы, неметаллы, металлоиды, инертные газы, лантаноиды и актиниды.
- Из-за разделения на две подгруппы разнородные элементы (например, щелочные металлы и металлы для чеканки) не попадают вместе.
- Лантаноиды и актиниды получили отдельное место в нижней части таблицы Менделеева из-за их аналогичного химического поведения.
- Такое расположение элементов легко запомнить и воспроизвести.
Дефекты современной таблицы Менделеева
Хотя современная таблица Менделеева имеет много преимуществ, у нее есть некоторые недостатки, которые приведены ниже:
- Проблема положения водорода до сих пор остается нерешенной.
- Основная часть таблицы Менделеева не может включать лантаноиды и актиниды.
- Эта таблица Менделеева не отражает точное распределение электронов среди всех элементов.
- Химический гелий является инертным газом, но поскольку остальные члены группы инертного газа обладают электронной конфигурацией ns2p6 по сравнению с конфигурацией He -> 1s 2 , гелию следует отвести другое место.
Самое длинное слово с использованием символов периодической таблицы
Самое длинное слово начинается с N, обозначающего азот.Можете ли вы назвать самое длинное слово, состоящее из символов таблицы Менделеева, обозначающих химические элементы?
Ответ на английском: непредставлений . Это слово состоит из 23 букв.
Нерепрезентативности можно записать с помощью символов элементов следующими способами:
NON Re P Re Se N Ta Ti O Na Li Sm S
Нет N Re P Re Se N Ta Ti ON Al I Sm S
NON Re P Re Se N Ta Ti ON Al I Sm S
No N Re P Re Se N Ta Ti O Na Li Sm S
Хотя не во всех словарях встречается еще более длинное слово (29 букв):
Floccinaucinihilipilification
Это слово обозначает акт признания чего-либо бесполезным.Один из способов записать это слово с использованием символов элементов:
Fl OCC In Au CI Ni HI Li PI Li FI Ca Ti ON
Хотя это не «настоящее» слово, суперкалифрагилистический может быть записан с помощью символов:
SUP Er Ca Li Fr Ag I Li S Ti C
Самое длинное слово с использованием различных символов элементов
Самое длинное слово, которое можно написать без повторного использования каких-либо символов элементов:
Ir Re SPON Si BI Li Ti Es
Примеры других длинных слов, составленных с использованием символов таблицы Менделеева:
HY Po Th Al Am I Co HY Po PHY Si Al (24 буквы)
Технически это длиннее, чем нерепрезентационализм, но оно записывается как слово с дефисом гипоталамико-гипофизарный или гипоталамико-гипофизарный, поэтому, вероятно, не в счет.
HYP Er Co N Sc IOU Sn Es Se S (20 букв)
HYP Er Co Ag U La Bi Li Ti Es (20 букв)
Слово с наибольшим количеством символов элементов
Связанный факт – это слово который содержит наибольшее количество символов элементов. Это пневмоноультрамикроскопия, силиковулканокониоз , заболевание легких, которое можно получить при вдыхании вулканической пыли. Хотя слово не может быть написано только с использованием символов таблицы Менделеева, оно содержит 14 символов элементов:
P – Фосфор
N – Азот
U – Уран
Mo – Молибден
N – Азот
O – Кислород
C – Углерод
Sc – Скандий
I – Йод
Si – Кремний
Co – Кобальт
V – Ванадий
Ca – Кальций
Нет – Нобелий
Смешные ответы на самый длинный вопрос
INF In I Te в элементахВ дополнение к серьезным отвечает на вопрос: «Какое самое длинное слово состоит из символов элементов таблицы Менделеева?» есть несколько юмористических ответов.По сути, вместо того, чтобы искать слово, использующее наибольшее количество букв, используйте слово, обозначающее наибольшее расстояние («самое длинное» слово):
- YArD – три фута в длину или около метра.
- PArSeC – Парсек составляет около 3,26 светового года или расстояние, которое свет проходит за 3,26 года.
- INFINITe – Вы можете пройти гораздо больше, чем бесконечное расстояние!
ДЛИННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
ДОЛГОВАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ Бора в 1920 г. изменил современную таблицу Менделеева, которая называется длинной формой таблицы Менделеева.Следовательно, это улучшенная и расширенная форма Менделеева и основана на современном периодическом законе. Это заявляет, что “физическое и химические свойства электрона являются периодической функцией их атомных свойств. количество.”Бора классификация элементов в периодической таблице разделяет все известные элементы на разные группы и подгруппы. По этой классификации осталось часть таблицы Менделеева состоит из высокоположительного металла, элементы правая часть состоит из известных металлов с высокой электроотрицательностью, некоторых тяжелых металлов и металлоидов, а средняя часть состоит из переходной и внутренней переходные элементы. ЗНАЧЕНИЕ ДЛИТЕЛЬНОЙ ФОРМЫ ПЕРИОДИЧЕСКОГО ТАБЛИЦА Длинная форма таблицы Менделеева устраняет некоторые серьезные недостатки периодической таблицы Менделеева и занимает высшую позицию в классификации. Некоторые из значений; 1. Расположение элемента основано на более фундаментальной основе, атомный номер. 2. Положение элемента в определенной группе или период связан с электронным конфигурация его атома. 3. Дает полное разделение между металлами и неметаллы.4. Он разделен на четыре блока в зависимости от конфигурация валентной оболочки атома, такая как s, p, d, f блокировать. 5. Из-за разделения групп на подгруппы, разнородные элементы относятся к разным группам, таким как щелочные металлы и чеканка металла. 6. Положение элемента переходного металла и внутренний переходный металлический элемент подходит из-за их переходного поведения между s -block и p- block элементы. ОТЗЫВЫ / ОГРАНИЧЕНИЕ Хотя убирает больше недостатков периодической таблицы Менделеева, но все же страдают следующими дефектами; 1. Положение водорода; Положение водорода в этой периодической таблице не решено. полностью, поскольку конфигурация валентной оболочки такая же, как у щелочи но у металлов свойства совсем другие. 2. Положение Геллиума; Поскольку Hellium имеет такую же электронную конфигурацию с щелочноземельным металлом. металл, но свойства аналогичны благородным газам, даже если конфигурация другой. 3. Положение лантаноидов и актинидов Лантаноиды и актиниды выделены отдельно ниже таблица Менделеева, но не может быть включена в основную часть таблицы Менделеева.
Длинная таблица Менделеева. | Скачать научную диаграмму
Контекст 1
… структура, хотя во многих случаях периодическая таблица указывала путь к открытиям в атомной структуре, а не наоборот. Среди этих разработок модель атома Бора, одно из первых приложений квантовой теории к структуре атома, заслуживает особого упоминания. Придя к электронным конфигурациям атомов, которые затем используются для объяснения того, почему определенные элементы сгруппированы вместе в периодической таблице, Бор подошел к проблеме полуэмпирическим образом, обратившись к химическому поведению и спектральным данным.Принцип исключения, имеющий далеко идущие последствия для всей науки, был мотивирован желанием Паулиса объяснить проблему закрытия электронных оболочек после того, как они заполнены определенным числом электронов. Хотя подход Паулиса к введению четвертых квантовых чисел в сочетании с предыдущей работой по взаимосвязи между тремя квантовыми числами обеспечил полностью дедуктивное объяснение этого явления, этого не было в случае более химически важного факта закрытия периодов.В то время как объяснение закрытия электронных оболочек часто представляется в учебниках естествознания как окончательное объяснение периодической системы, отсутствие строгого вывода точки, в которой периоды сближаются, препятствует полному сокращению периодической системы до квантовая механика, как указывали современные философы химии (S CERRI, 2007a). Появление строгой квантовой механики в период 1925-26 годов обеспечило более дедуктивный подход к электронным конфигурациям, по крайней мере в принципе.Но только после того, как такие методы аппроксимации были разработаны такими специалистами, как HARTREE и F OCK, стало возможным решить уравнение Шредингера для любого конкретного атома с надежным уровнем точности. С этого времени электронные конфигурации атомов могут быть выведены ab initio способом, утверждение, которое оспаривается некоторыми философами химии (Scerri, 2004), но защищается некоторыми химиками-теоретиками и физиками (S CHWARZ, 2007, 2009; О СТРОВСКИЙ, 2001; Ф. РЕЙДРИХ, 2004).Первоначальные периодические таблицы пионеров обычно состояли из восьми столбцов, чтобы отразить периодичность элементов. Эти краткие таблицы (рис. 1) просуществовали до двадцатого века. Если элементы расположены в порядке возрастания атомного веса, приблизительное повторение свойств элементов происходит после восьми элементов до тех пор, пока не будет достигнуто железо (атомный вес 55). Чтобы справиться с этим очевидным нарушением периодичности, Менделеев был вынужден удалять наборы из трех элементов, таких как железо, кобальт и никель, из каждого последующего периода и помещать их в аномальную группу, которую он назвал переходными элементами и обозначил как группу VIII.Следующее существенное изменение в форме периодической таблицы произошло, когда наборы из десяти элементов, а не просто трех, были удалены из основной части таблицы из восьми столбцов, в результате чего был получен блок из тридцати переходных элементов, к которым были добавлены еще десять элементов. добавлен совсем недавно. Значение термина переходный элемент также изменилось, чтобы обозначить элемент, атомы которого находятся в процессе заполнения внутренней, а не внешней электронной оболочки. Размещение этих элементов обычно выполняется между так называемыми блоками s и p или тем, что составляет основную часть бывшей таблицы краткой формы, а не с правой стороны, как Менделеев разместил свои переходные элементы.Причина этого размещения состоит в том, чтобы сохранить порядок увеличения атомного веса, а затем и атомного номера, в так называемой периодической таблице средней длины (рис. 2). Хотя это и не было предсказано, в конце девятнадцатого века была открыта новая группа, принадлежащая к современному р-блоку элементов. Этими элементами являются благородные газы гелий, неон, аргон, криптон, ксенон и радон. Конечным результатом этого открытия является то, что, хотя группа Менделеева VIII была включена в основную часть таблицы средне-длинных форм, появилась новая группа VIII, которая заняла ее место в том, что касается элементов главного блока.Это означает, что правило восьми M ENDELEEV, A BEGG, K OSSELL и правило октетов Льюиса и Ленгмюра сохранились и продолжают предоставлять упрощенное объяснение возникновения химической связи. Хотя есть много исключений, также есть много случаев, когда элементы образуют соединения, чтобы подчиняться правилу восьми или, говоря современным языком, для достижения полной внешней оболочки из восьми электронов (PALMER, 1965). Даже совсем недавно, особенно после того, как в 1940-х годах были впервые синтезированы новые искусственные элементы, общая форма таблицы Менделеева претерпела дальнейшие изменения.Это изменение в некоторой степени аналогично переходу от короткой формы к средне-длинной в том, что внутренние переходные элементы, ранее называемые редкоземельными элементами, были удалены, чтобы сформировать f-блок, который вставляется между песком d- блоки, чтобы сохранить порядок возрастания атомного номера (рисунок 3) или часто отображаются в виде сноски. Недавний синтез элементов до элемента -118 включительно, за исключением элемента 117, привел к предположению, что периодическая таблица должна подвергнуться дальнейшему расширению для размещения элементов g-блока, которые начнутся, по крайней мере формально, в элементе -121 (S CERRI, 2009b).Некоторые химики, металлурги и геологи предложили менее элегантные периодические системы, но такие, которые могут лучше отражать сходство между элементами (R AYNER -C ANHAM, 2003). В этом контексте также можно рассматривать континуум периодических систем в диапазоне от химически более точных, но менее симметричных форматов, с одной стороны, до более симметричных, и более абстрактных систем, таких как таблица с левой ступенькой, с другой стороны. . Неудивительно, что популярная в настоящее время форма средней длины, кажется, находит компромисс между отображением слишком большого количества химических сходств и в то же время сохранением большей общей регулярности, хотя и не доходит до того, чтобы поместить элемент гелий в группу щелочноземельных элементов.Сама концепция элементов, составляющих периодическую таблицу, является предметом продолжающейся дискуссии, восходящей к древнегреческим философам и их представлениям о природе материи. Следует ли рассматривать элемент как фундаментальную абстрактную сущность или физически реализованную субстанцию, или, возможно, как и то, и другое? М. ЭНДЕЛЕЕВ, первооткрыватель периодической системы, много сказал по этому вопросу и считал, что периодическая таблица в первую очередь является классификацией абстрактного смысла элементов. Также давно ведутся споры о том, как элементы сохраняются, если они действительно сохраняются, когда присутствуют в соединениях.Современные дискуссии в области философии химии в значительной степени основаны на часто цитируемой статье радиохимика Ф.А.Панета, который также предложил текущее определение химического элемента, принятое ИЮПАК в 1923 году (P ANETH, 2003). Классическую статью Панета о природе элементов перевел его сын Хайнц Панет, который позже изменил свою фамилию на Пост. Терминология, использованная Постом, была элементом как основной субстанцией для Панетса Грундстоффа и элементом как простой субстанцией для Панетса Эйнфахерстоффа.Эта терминология и ее интерпретация были источником разногласий среди современных авторов (E ARLEY, 2005; H ENDRY, 2005; N EEDHAM, 2005; R UTHENBERG, 2009; S CERRI, 2009 A; S HARLOW, 2006). Учитывая интерес к вопросу о сокращении химии в современной философии химии, периодическая таблица играет по крайней мере две взаимосвязанные роли в таких исследованиях. Во-первых, он предоставляет более ограниченную область, на которой можно сосредоточить внимание на вопросе восстановления, чем вся химия.Во-вторых, некоторые авторы утверждали, что периодическая таблица не сводится полностью к квантовой механике (S CERRI, 2004). Другие оспаривают эти антиредукционистские утверждения и подчеркивают, что физика дает приблизительное объяснение периодической таблицы (O STROVSKY, 2005). ; S CHWARZ, 2007; F RIEDRICH, 2004). Например, структура современной таблицы Менделеева такова, что продолжительность последовательных периодов повторяется, за исключением самого первого короткого периода из двух элементов. Некоторые авторы утверждали, что эта особенность, которая резюмируется в правиле Маделунга, или n + l-правила заполнения электронами, еще не выведена из квантовой механики (L ÖWDIN, 1969; S CERRI, 2004).Совсем недавно Шварц заявил, что правило Маделунга в некоторой степени неуместно, поскольку оно относится к конфигурации основного состояния атомов в их несвязанной газовой фазе, а не к атомам, которые подверглись химической связи (S CHWARZ, 2007). Это возвращает нас к вопросу о том, как интерпретировать термин «элемент», поскольку Шварц также утверждал, что связанные атомы эквивалентны элементам в качестве основных веществ, и это мнение недавно было оспорено (S CERRI, 2009a). Квантовая механика отнюдь не единственный подход, используемый в попытке объяснить периодическую систему из первых принципов.Например, Кайс и Хершбах попытались разработать глобальные подходы, которые обещают решить периодическую таблицу одним движением руки вместо того, чтобы решать уравнение Шредингера для каждого атома Ã Ã отдельно Ã (K AIS et al., 1994). Ã Ã Ã Ã Ã Ã Ã Периодическая система служила ареной, на которой была проведена одна из наиболее Ã подробных Ã Ã попыток Ã Ã свести Ã Ã химию Ã Ã к Ã атомной Ã физике Ã Ã. В 1985 году голландские философы науки Хеттема и Кейперс разработали то, что они назвали формализацией периодической системы, и использовали ее в качестве основы для обсуждения сведения химии к атомной физике (H ETTEMA, K UIPERS, 1988; S CERRI, 1997).ЛЕПИДЕВИН широко ссылался на периодическую таблицу в исследовании, утверждающем, что химия онтологически даже не сводится к физике (LEPOIDEVIN, 2005). В литературе появилось две независимых критики этой статьи (H ENDRY, N EEDHAM, 2007; S CERRI, 2007b). На …
ПЕРИОДИЧЕСКИЙ КЛАССИФИКАЦИЯ | |||||||||||||||||||||||||||||
СОВРЕМЕННЫЙ ПЕРИОДИЧЕСКИЙ ЗАКОН | |||||||||||||||||||||||||||||
| дюйм 1913 г., английский физик МОСЕЛИ, в результате его работы над характеристиками Рентгеновские лучи элементов открыли фундаментальный и самый точный связь между химическими свойствами и атомным числом элементов, известен как «Современный периодический закон». | |||||||||||||||||||||||||||||
ПО СОГЛАШЕНИЮ К СОВРЕМЕННОМУ ПЕРИОДИЧЕСКОМУ ЗАКОНУ: | |||||||||||||||||||||||||||||
1. Химические и физические свойства элементов являются периодической функцией их атомных номеров ». | |||||||||||||||||||||||||||||
2. Свойства элементов зависят от их электронной конфигурации. которые изменяются с увеличением атомный номер периодическим способом ». | |||||||||||||||||||||||||||||
| The современный периодический закон дает логическое и научное основание для классификации элементов. | |||||||||||||||||||||||||||||
ДЛИННЫЙ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ | |||||||||||||||||||||||||||||
| Периоды | |||||||||||||||||||||||||||||
Периодический
Таблица разделена на семь горизонтальных рядов элементов. Каждый ряд элементов
называется «ПЕРИОД». | |||||||||||||||||||||||||||||
| 1- Номер периода элемента представляет количество уровней энергии в элементе. Например, | |||||||||||||||||||||||||||||
ЭЛЕМЕНТЫ | ПЕРИОД | НОМЕР УРОВНЕЙ ЭНЕРГИИ | |||||||||||||||||||||||||||
Na
(Z = 23) | Третий | 3
(K, L, M) | |||||||||||||||||||||||||||
| . | . | . | |||||||||||||||||||||||||||
| 1.
Размер атома уменьшается за период. 2 -Ядерный заряд увеличивается за период. 3 -Потенциал ионизации увеличивается за период. 4 -Электроотрицательность увеличивается за период. 5 -Уменьшается электроположительность и металлический характер в период. 6 -Каждый период начинается с щелочного металла и заканчивается Благородный газ. Например: 2 nd период : Li ……………………………. Ne 3 rd период: Na ……………………………. Ar 7 -Первый элемент каждого периода наиболее реактивный (электроположительный), и последний элемент химически инертен. | |||||||||||||||||||||||||||||
ОПИСАНИЕ ПЕРИОДОВ | |||||||||||||||||||||||||||||
Первый период | |||||||||||||||||||||||||||||
Это является самым коротким периодом и содержит всего два элемента (H и He).Этот период соответствует заполнению К-оболочки. Электронная конфигурация элементов этого периода – 1с 1 и 1с 2 | |||||||||||||||||||||||||||||
Секунда период | |||||||||||||||||||||||||||||
| Это
называется первым коротким периодом и содержит восемь элементов. Этот период
соответствует заполнению L-оболочки. В этот период электроны
занимают 2s и 2p орбитали.Этот период содержит 2 элемента s-блока и шесть
из п-блок | |||||||||||||||||||||||||||||
Третий период | |||||||||||||||||||||||||||||
| Это
также содержит восемь элементов и известен как второй короткий период. Это соответствует
заправке M-shell. Он содержит 2 s-блочных и 6 P-блочных элементов. В этот период Заполняются орбитали 3s и 3P. | |||||||||||||||||||||||||||||
Четвертый период | |||||||||||||||||||||||||||||
Это
содержит 18 элементов и известен как первый долгий период.Этот период соответствует
до заправки | |||||||||||||||||||||||||||||
Пятый период | |||||||||||||||||||||||||||||
| Пятая период содержит 18 элементов и известен как 2 и долгий период . Это соответствует заполнению О-оболочки.Начинается с начинки 5S-орбитали, за которой следуют 4d и 5p орбитали. | |||||||||||||||||||||||||||||
Шестой период | |||||||||||||||||||||||||||||
| Шестой
период содержит 32 элемента, и это самый длинный период. Из 32 элементов: 2 элемента s-блока с электронной конфигурацией 6s 1 и 6s 2. 6 элементов p-блока с электронной конфигурацией 6s 2 , 6p 1 до 6s 2 , 6p 6 . 10 элементов d-блока с электронной конфигурацией 6s 2 , 5d 1 до 6s 2 , 5d 10 14 элементов f-блока с электронной конфигурацией 6s 2 , 5d 1 , 4f 1 до 6s 2 , 5d 1 , 4f 14 . В шестом периоде электроны начинают заполнять 4f-орбиталь после 5d-орбитали. разместить один электрон. | |||||||||||||||||||||||||||||
Седьмой период | |||||||||||||||||||||||||||||
| 7 -й период неполный период. В том числе: | |||||||||||||||||||||||||||||
| 2 элементы s-блока с электронной конфигурацией 7s 1 , 7s 2 | |||||||||||||||||||||||||||||
| 10 элементы d-блока с электронной конфигурацией 7s 2 , 6d 1 к 7с 2 , 6д 10 | |||||||||||||||||||||||||||||
| 14 элементы f-блока с электронной конфигурацией 7s 2 , 6d 1 , 5f 1 до 7s 2 , 6d 1 , 5f 14 | |||||||||||||||||||||||||||||
Группы | |||||||||||||||||||||||||||||
| Современное Таблица Менделеева разделена на восемь вертикальных столбцов элементов.Каждый вертикальный столбец элементов называется «ГРУППА». Группы периодической таблицы Менделеева делятся на две подгруппы или семейства «А и Б». Элементы подгруппы «А» известны как нормальные элементы. или Репрезентативные элементы. В то время как элементы подгруппы «B» известны как переходные элементы. Номера групп обозначены Романом. числа. | |||||||||||||||||||||||||||||
Общие характеристики группы как под | |||||||||||||||||||||||||||||
| 1-группа номер элемента показывает количество электронов во внешней оболочке этого элемента | |||||||||||||||||||||||||||||
ЭЛЕМЕНТ | НОМЕР ЭЛЕКТРОНОВ ВАЛЕНС | ГРУППА | |||||||||||||||||||||||||||
Na | 1 | I-A | |||||||||||||||||||||||||||
| 2-атомный
размер увеличивается в группе. 3-Ионизационный потенциал элементов уменьшается по группе. 4-Электроотрицательность уменьшается по группе. 5-Металлический характер увеличивается по группам. | |||||||||||||||||||||||||||||
БЛОКОВ | |||||||||||||||||||||||||||||
| Вкл.
Основа электронной конфигурации валентной оболочки, периодическая таблица разделена
на четыре отдельных блока элементов. 1. блок 2.р-блок 3. d-блок 4. Ф-блок | |||||||||||||||||||||||||||||
S-блок элементы | |||||||||||||||||||||||||||||
| Все
элементы, в которых последний электрон попадает на орбиталь “нс”, известны как s-блок.
элементы. Элементы группы I-A и II-A относятся к s-блоку. Их электронная валентная оболочка – это нс 1 до нс 2 . Все элементы s-блока очень реактивные и электроположительные. в природе. S-образные элементы являются хорошими восстановителями. Они образуют ионные соединения. Они все металлические и твердые. Это металлы с низкой плотностью. Например: Li (z = 3) 1s 2 , 2s 1 Na (z = 11) 1s 2 , 2s 2 , 2p 6 , 3s 1 Be (z = 4) 1 с 2 , 2 с 2 | |||||||||||||||||||||||||||||
р-блок элементы | |||||||||||||||||||||||||||||
элементы, в которых валентные электроны входят в p-орбиталь, и эта орбиталь
постепенно заполняются | |||||||||||||||||||||||||||||
d-блок элементы | |||||||||||||||||||||||||||||
| The
элементы, в которые последний электрон входит (n-1) d-орбитали, называются d-блоком
элементы или внешние переходные элементы. Валентная оболочка электронная конфигурация этих элементов нс 2 , (н-1) д 1-10 . Все эти элементы – металлы. Есть четыре ряда внешних переходные элементы. Четвертая серия неполная. | |||||||||||||||||||||||||||||
f-блок элементы | |||||||||||||||||||||||||||||
| The элементы, в которые последний электрон входит (n-2) f-орбитали, называются f-блоком элементы или внутренние переходные элементы.Их внешняя электронная конфигурация: ns 2 , (n-1) d 1 , (n-2) f 1-14 .f-block элементы составляют 2 серии элементов. | |||||||||||||||||||||||||||||
| (1)
лантаноиды (2) Актиниды | |||||||||||||||||||||||||||||
Лантаноиды | |||||||||||||||||||||||||||||
| Элементы от церий (Ce: Z = 58) до лютеция (Lu: Z = 71) в периодической таблица известна как « лантаноидов ».Это серия из 14 элементы появляются в 6-м периоде. Все они серебристые и довольно реактивные. металлы. Большинство их соединений содержат ионы M +3 . Некоторые другие лантаноиды также образуют комплексные фториды M +4 . также известны как « редкоземельных металла, ». | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
Актиниды | |||||||||||||||||||||||||||||
| Элементы
от торий (Th: Z = 90) от до лоуренсий (Lw
: Z = 103) в периодической таблице известны как « актинидов ». Это серия из 14 элементов, происходящая в 7 периоде. Все актиниды – радиоактивные элементы. Большинство из них имеют очень короткий период полураспада. Они довольно реактивны металлы. Большинство их соединений содержат ионы M +3 . Среди более тяжелых элементов M +2 состояние становится стабильным. Они есть также известные как « Искусственные элементы », как они не возникает естественным образом. Они были обнаружены как продукты, образовавшиеся во время ядерных испытаний. реакции. | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Расширенная или полная форма таблицы Менделеева, Справка по назначению, Современная таблица Менделеева, Группы, Химия
Расширенная или полная форма таблицы Менделеева
Современная таблица Менделеева также называется длинной формой периодической таблицы или таблицей Бора.В этой таблице элементы расположены в порядке возрастания их атомных номеров. Он состоит из 4 блоков ( s , p , d и f ), 18 групп, пронумерованных от 1 до 18, и 7 периодов, пронумерованных от 1 до 7.
Блоки : Периодическая таблица разделена на четыре основных блока ( s, p, d и f ) в зависимости от подоболочки, в которую входит валентный электрон.
(1) Элементы группы 1 и 2 составляют s -Block.
(2) Элементы группы 13, 14, 15, 16, 17, 18 составляют p -Блок
(3) Элементы группы 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 составляют d -Блок
(4) Элементы f-блока состоят из двух горизонтальных рядов, размещенных внизу периодической таблицы, чтобы избежать ее ненужного расширения.
Элементы s- и p -блоков известны как обычные или репрезентативные элементы , элементы d -блока называются переходными элементами , а элементы f -блоков называются внутренними. переходные элементы .
Группы : 18 вертикальных столбцов называются группами. Элементы, принадлежащие к определенной группе, называются семейством и обычно называются по первому номеру. Помимо этого, некоторым группам даны типичные имена, как показано ниже,
(1) Элементы группы 1 известны как Щелочные металлы .
(2) Элементы группы 2 известны как щелочных земель .
(3) Элементы группы 3 известны как Pnicogens .
(4) Элементы группы 16 известны как Халькогены .
(5) Элементы группы 17 известны как Галогены .
(6) Элементы группы 18 известны как благородные газы или аэрогены
Все эти группы названы в честь первого члена каждой группы.
Периоды : горизонтальные строки называются периодами. В длинной форме таблицы Менделеева семь периодов:
.(1) I период 1 H → 2 Он имеет 2 элемента.Это самый короткий период.
(2) 2-й период ( 3 Li → 10 Ne) и 3-й период ( 11 Na → 18 Ar) содержат по 8 элементов. Это короткие периоды.
(3) 4-й период ( 19 K → 36Kr) и 5-й период ( 37 Rb → 54 Ne) содержат по 18 элементов каждый. Это длительные периоды.
(4) 6-й период ( 55 Cs → 86 Ra) состоит из 32 элементов, и этот период является самым длинным.
(5) 7-й период, начиная с 87 Fr, неполный и состоит из 19 элементов.
Помощь с заданиями по химии на основе электронной почты – помощь в выполнении домашних заданий в Expertsmind
Вы ищете у специалиста по химии помощь с расширенной или длинной формой вопросов о таблице Менделеева? Расширенная или длинная форма темы таблицы Менделеева не легче выучить без посторонней помощи? Мы на сайте www.expertsmind.com предлагаем лучшие услуги по помощи при задании по химии и помощи в выполнении домашних заданий по химии.Живые репетиторы доступны круглосуточно и без выходных, помогая студентам в расширенной или длинной форме задач, связанных с периодической таблицей. Мы предоставляем пошаговые ответы на вопросы в расширенной или длинной форме таблицы Менделеева со 100% содержанием без плагиата. Мы готовим качественный контент и заметки по теме «Расширенная или полная форма таблицы Менделеева» по теории химии и учебным материалам. Они доступны для подписанных пользователей, и они могут получить преимущества в любое время.
Почему Expertsmind для помощи при назначении
- Обладатель высшего образования и сеть опытных экспертов
- Пунктуальность и ответственность в работе
- Качественное решение со 100% ответами без плагиата
- Срок поставки
- Конфиденциальность информации и реквизитов
- Превосходство в решении вопросов по химии в формате excels и word.

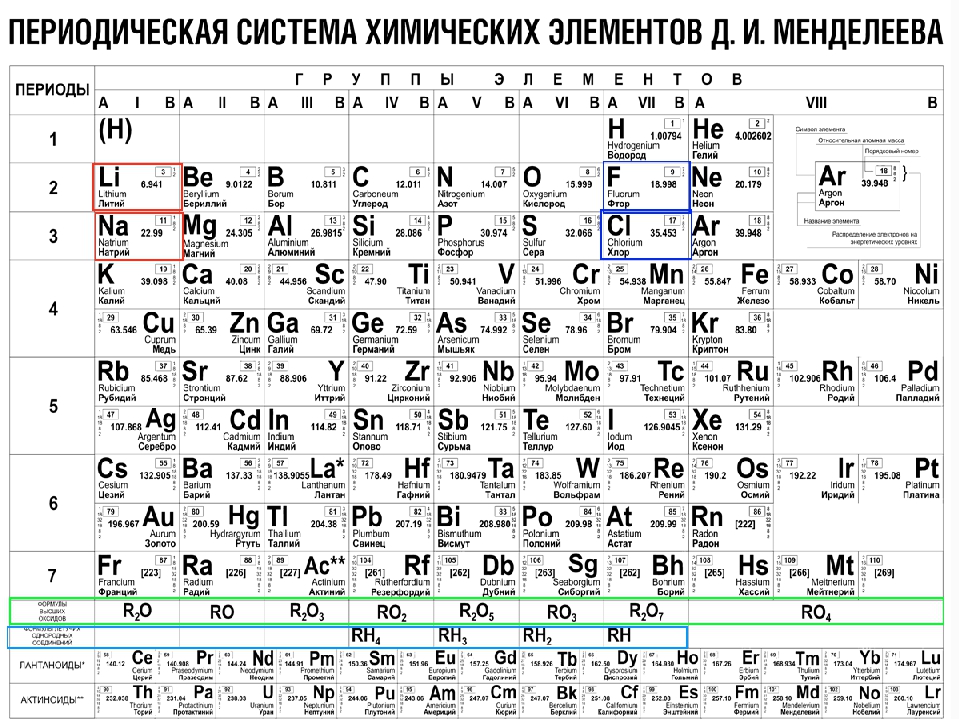 Собрана информация о существующих видах ПСХЭ
Собрана информация о существующих видах ПСХЭ

 проф. А.М.Смолеговского.- М.: Дрофа, 2000.-432с.: ил.
проф. А.М.Смолеговского.- М.: Дрофа, 2000.-432с.: ил.
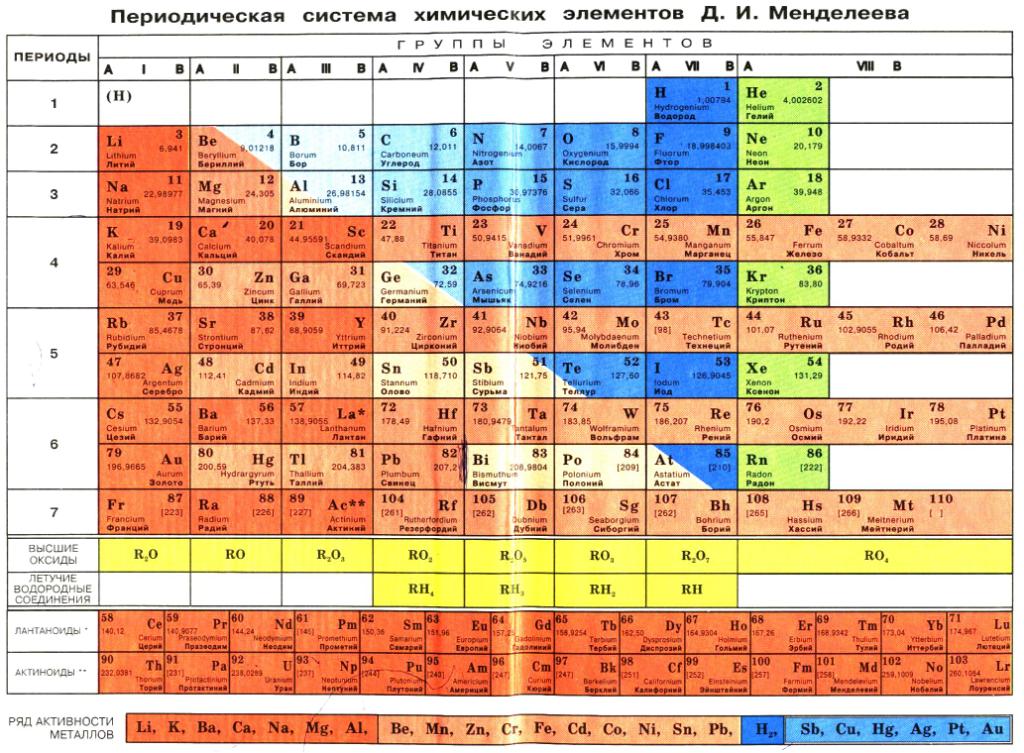
 до н. э.
до н. э.