реферат на тему таблица Менделеева
ТАШКЕНТСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. ИСЛАМА КАРИМОВА Энергетический факультет САМОСТОЯТЕЛЬНАЯ РАБОТА №1 ПО ПРЕДМЕТУ : ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЛЫ НА ТЕМУ « ТАБЛИЦА МЕНДЕЛЕЕВА » ВЫПОЛНИЛ : Студент: Гадаев Дилшоджон Группа: 183-19 ПРОВЕРИЛА: Иванова В.П. ТАШКЕНТ 2019 Таблица Менделеева План 1. Введение 2. Основная часть: 2.1 История открытия периодического закона и периодической системы элементов; 2.2 Периодический закон и периодическая система элементов; 2.3 Структура периодической системы: периоды, группы, подгруппы; 2.4 Периодический закон и его обоснование; 3. Выводы 4. Список используемой литературы. Я считаю, что Периодический закон и Периодическая система химических элементов Д.И. Менделеева является основой современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения. Открытие периодического закона и периодической системы химических элементов было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Дмитрия Ивановича, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы.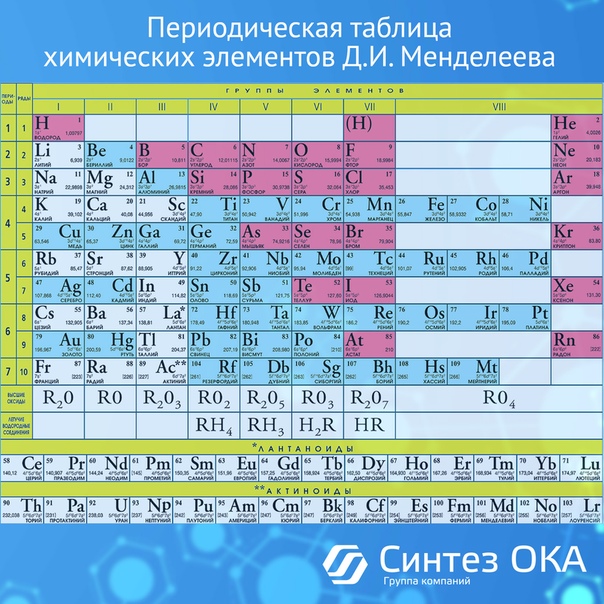 2. Основная часть 2.1 История открытия периодического закона и периодической системы химических элементов Утверждение атомно-молекулярной теории на рубеже XIIX – XIX веков сопровождалось бурным ростом числа известных химических элементов. Только за первое десятилетие 19 века было открыто 14 новых элементов. Рекордсменом среди первооткрывателей оказался английский химик Гемфри Деви , который за один год с помощью электролиза получил 6 новых простых веществ (натрий, калий, магний, кальций, барий, стронций). А к 1830 году число известных элементов достигло 55. Существование такого количества элементов, разнородных по своим свойствам, озадачивало химиков и требовало упорядочения и систематизации элементов. Многие учёные занимались поисками закономерностей в списке элементов и добивались определённого прогресса. Можно выделить три наиболее значительные работы, которые оспаривали приоритет открытия периодического закона у Д.И. Менделеева. В 1860 году состоялся первый Международный химический конгресс, после которого стало ясно, что основной характеристикой химического элемента является его атомный вес.
2. Основная часть 2.1 История открытия периодического закона и периодической системы химических элементов Утверждение атомно-молекулярной теории на рубеже XIIX – XIX веков сопровождалось бурным ростом числа известных химических элементов. Только за первое десятилетие 19 века было открыто 14 новых элементов. Рекордсменом среди первооткрывателей оказался английский химик Гемфри Деви , который за один год с помощью электролиза получил 6 новых простых веществ (натрий, калий, магний, кальций, барий, стронций). А к 1830 году число известных элементов достигло 55. Существование такого количества элементов, разнородных по своим свойствам, озадачивало химиков и требовало упорядочения и систематизации элементов. Многие учёные занимались поисками закономерностей в списке элементов и добивались определённого прогресса. Можно выделить три наиболее значительные работы, которые оспаривали приоритет открытия периодического закона у Д.И. Менделеева. В 1860 году состоялся первый Международный химический конгресс, после которого стало ясно, что основной характеристикой химического элемента является его атомный вес.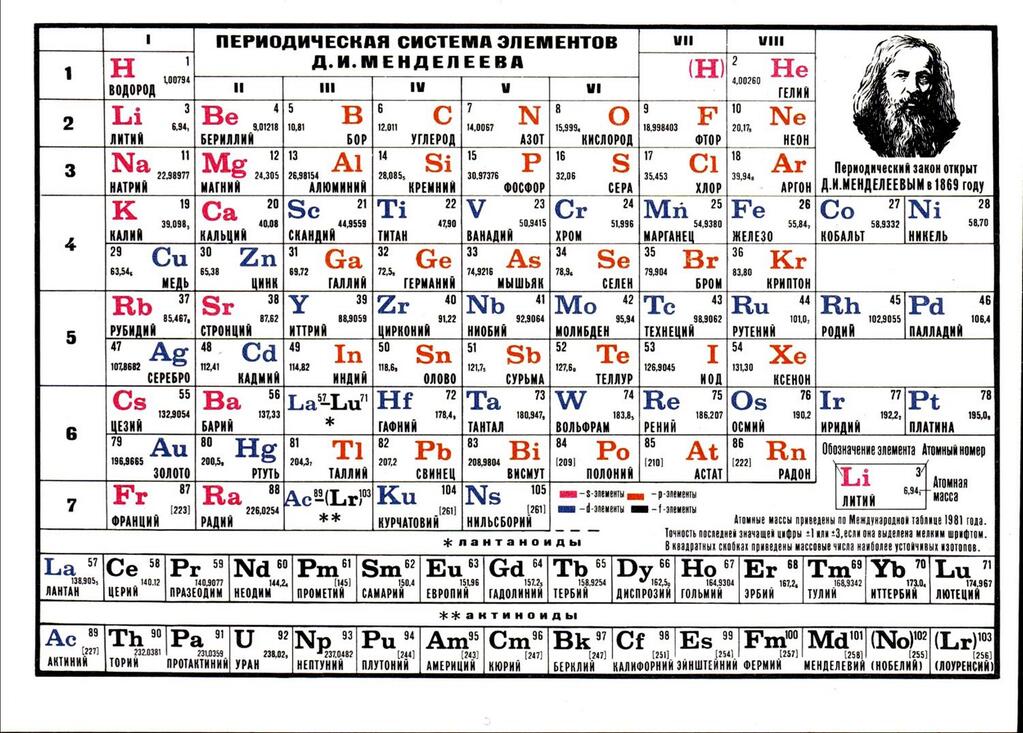 Французский учёный Б. де Шанкуртуа в 1862 году впервые расположил элементы в порядке возрастания атомных весов и разместил их по спирали вокруг цилиндра. Каждый виток спирали содержал 16 элементов, сходные элементы, как правило, попадали в вертикальные столбцы, хотя были отмечены и значительные расхождения. Работа де Шанкуртуа осталась незамеченной, но выдвинутая им идея сортировки элементов в порядке возрастания атомных весов оказалась плодотворной. И двумя годами позже, руководствуясь этой идеей, английский химик Джон Ньюлендс разместил элементы в виде таблицы и заметил, что свойства элементов периодически повторяются через каждые семь номеров. Например, хлор по свойствам похож на фтор, калий – на натрий, селен – на серу и т.д. Данную закономерность Ньюлендс назвал «законом октав», практически опередив понятие периода. Но Ньюлендс настаивал на том, что длина периода (равная семи) является неизменной, поэтому его таблица содержит не только правильные закономерности, но и случайные пары (кобальт – хлор, железо – сера и углерод – ртуть).
Французский учёный Б. де Шанкуртуа в 1862 году впервые расположил элементы в порядке возрастания атомных весов и разместил их по спирали вокруг цилиндра. Каждый виток спирали содержал 16 элементов, сходные элементы, как правило, попадали в вертикальные столбцы, хотя были отмечены и значительные расхождения. Работа де Шанкуртуа осталась незамеченной, но выдвинутая им идея сортировки элементов в порядке возрастания атомных весов оказалась плодотворной. И двумя годами позже, руководствуясь этой идеей, английский химик Джон Ньюлендс разместил элементы в виде таблицы и заметил, что свойства элементов периодически повторяются через каждые семь номеров. Например, хлор по свойствам похож на фтор, калий – на натрий, селен – на серу и т.д. Данную закономерность Ньюлендс назвал «законом октав», практически опередив понятие периода. Но Ньюлендс настаивал на том, что длина периода (равная семи) является неизменной, поэтому его таблица содержит не только правильные закономерности, но и случайные пары (кобальт – хлор, железо – сера и углерод – ртуть). А вот немецкий учёный Лотар Мейер в 1870 году построил график зависимости атомного объёма элементов от их атомного веса и обнаружил отчётливую периодическую зависимость, причём длина периода не совпадала с законом октав и была переменной величиной. Во всех этих работах много общего. Де Шанкуртуа, Ньюлендс и Мейер открыли проявление периодичности изменения свойств элементов в зависимости от их атомного веса. Но они не смогли создать единую периодическую систему всех элементов, поскольку в открытых ими закономерностях многие элементы не находили своего места. Никаких серьёзных выводов из своих наблюдений этим учёным так же сделать не удалось, хотя они чувствовали, что многочисленные соотношения между атомными весами элементов являются проявлением какого-то общего закона. Этот общий закон был открыт великим русским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Менделеев сформулировал периодический закон в виде следующих основных положений: 1. Элементы, расположенные по величине атомного веса, представляют явственную периодичность свойств.
А вот немецкий учёный Лотар Мейер в 1870 году построил график зависимости атомного объёма элементов от их атомного веса и обнаружил отчётливую периодическую зависимость, причём длина периода не совпадала с законом октав и была переменной величиной. Во всех этих работах много общего. Де Шанкуртуа, Ньюлендс и Мейер открыли проявление периодичности изменения свойств элементов в зависимости от их атомного веса. Но они не смогли создать единую периодическую систему всех элементов, поскольку в открытых ими закономерностях многие элементы не находили своего места. Никаких серьёзных выводов из своих наблюдений этим учёным так же сделать не удалось, хотя они чувствовали, что многочисленные соотношения между атомными весами элементов являются проявлением какого-то общего закона. Этот общий закон был открыт великим русским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Менделеев сформулировал периодический закон в виде следующих основных положений: 1. Элементы, расположенные по величине атомного веса, представляют явственную периодичность свойств.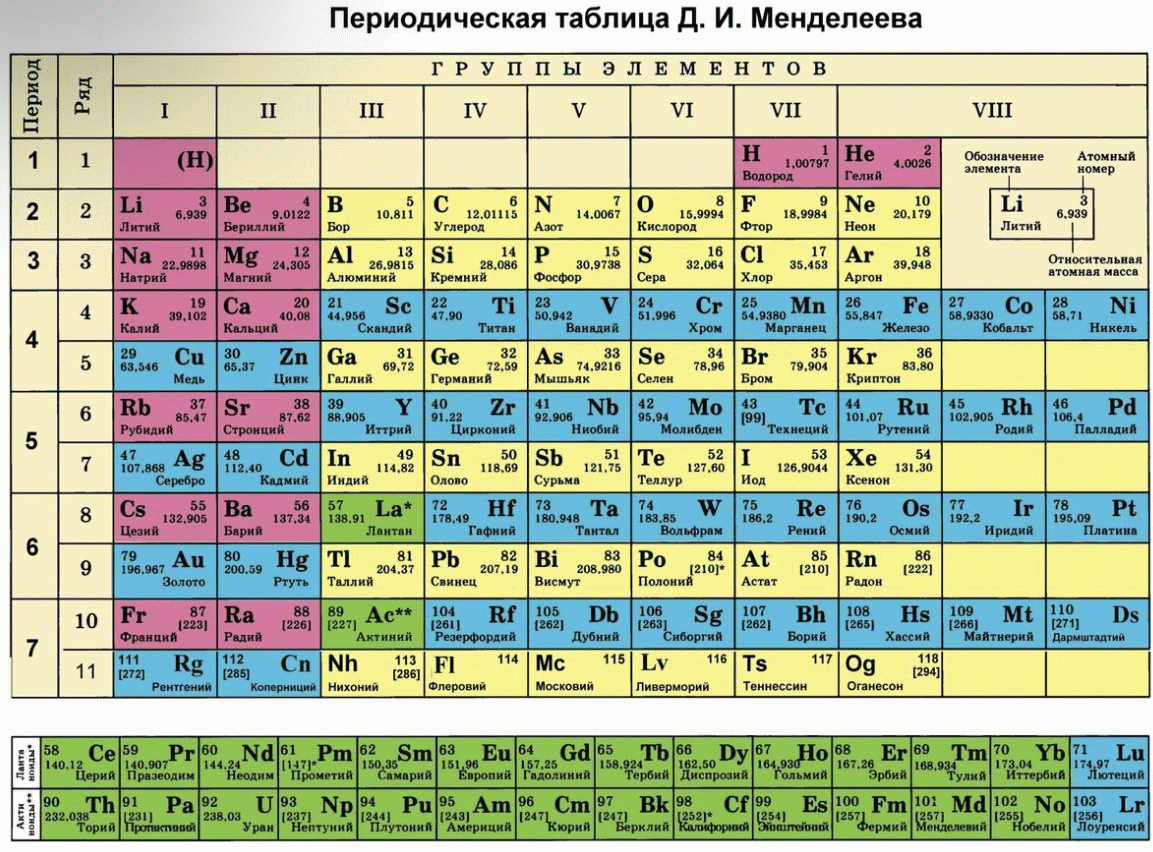 2. Должно ожидать открытия ещё многих неизвестных простых тел, например, сходных с Al и Si элементов с атомным весом 65 – 75. 3. Величина атомного веса элемента иногда может быть исправлена, зная его аналогии. Некоторые аналогии открываются по величине веса их атома. Первое положение было известно ещё до Менделеева, но именно он придал ему свойства галлия совпадают со свойствами предсказанного им экаалюминия, и сообщил Лекок де Буабодрану, что тот неверно измерил плотность галлия, которая должна быть равна 5,9-6,0 г/см3 вместо 4,7 г/см3. И действительно, более аккуратные измерения привели к правильному значению 5,904 г/см3. В 1879 году шведский химик Л. Нильсон при разделении редкоземельных элементов, полученных из минерала гадолинита, выделил новый элемент и назвал его скандием. Это оказывается предсказанный Менделеевым экабор. Окончательного признания периодический закон Д.И. Менделеева добился после 1886 года, когда немецкий химик К. Винклер, анализируя серебряную руду, получил элемент, который он назвал германием.
2. Должно ожидать открытия ещё многих неизвестных простых тел, например, сходных с Al и Si элементов с атомным весом 65 – 75. 3. Величина атомного веса элемента иногда может быть исправлена, зная его аналогии. Некоторые аналогии открываются по величине веса их атома. Первое положение было известно ещё до Менделеева, но именно он придал ему свойства галлия совпадают со свойствами предсказанного им экаалюминия, и сообщил Лекок де Буабодрану, что тот неверно измерил плотность галлия, которая должна быть равна 5,9-6,0 г/см3 вместо 4,7 г/см3. И действительно, более аккуратные измерения привели к правильному значению 5,904 г/см3. В 1879 году шведский химик Л. Нильсон при разделении редкоземельных элементов, полученных из минерала гадолинита, выделил новый элемент и назвал его скандием. Это оказывается предсказанный Менделеевым экабор. Окончательного признания периодический закон Д.И. Менделеева добился после 1886 года, когда немецкий химик К. Винклер, анализируя серебряную руду, получил элемент, который он назвал германием. Это оказывается экасицилий. 2.2 Периодический закон и периодическая система химических элементов Периодический закон – один из важнейших законов химии. Менделеев считал, что главной характеристикой элемента является его атомная масса. Поэтому он расположил все элементы в один ряд в порядке увеличения их атомной массы. Если рассмотреть ряд элементов от Li до F, то можно увидеть, что металлические свойства элементов ослабляются, а неметаллические свойства усиливаются. Аналогично изменяются и свойства элементов в ряду от Na до Cl. Следующий знак К, как Li и Na, является типичным металлом. Высшая валентность элементов увеличивается от I y Li до V y N (кислород и фтор имеют постоянную валентность, соответственно II и I) и от I y Na до VII y Cl. Следующий элемент К, как Li и Na, имеет валентность I. В ряду оксидов от Li2O до N2O5 и гидроксидов от LiОН до HNO3 основные свойства ослабляются, а кислотные свойства усиливаются. Аналогично изменяются свойства оксидов в ряду от Na2O и NaOH до Cl2O7 и HClO4.
Это оказывается экасицилий. 2.2 Периодический закон и периодическая система химических элементов Периодический закон – один из важнейших законов химии. Менделеев считал, что главной характеристикой элемента является его атомная масса. Поэтому он расположил все элементы в один ряд в порядке увеличения их атомной массы. Если рассмотреть ряд элементов от Li до F, то можно увидеть, что металлические свойства элементов ослабляются, а неметаллические свойства усиливаются. Аналогично изменяются и свойства элементов в ряду от Na до Cl. Следующий знак К, как Li и Na, является типичным металлом. Высшая валентность элементов увеличивается от I y Li до V y N (кислород и фтор имеют постоянную валентность, соответственно II и I) и от I y Na до VII y Cl. Следующий элемент К, как Li и Na, имеет валентность I. В ряду оксидов от Li2O до N2O5 и гидроксидов от LiОН до HNO3 основные свойства ослабляются, а кислотные свойства усиливаются. Аналогично изменяются свойства оксидов в ряду от Na2O и NaOH до Cl2O7 и HClO4. Оксид калия К2О, как и оксиды лития и натрия Li2O и Na2O, является основным оксидом, а гидроксид калия КОН, как и гидроксиды лития и натрия LiOH и NaOH, является типичным основанием. Аналогично изменяются формы и свойства неметаллов от Ch5 до HF и от Sih5 до HCl. Такой характер свойств элементов и их соединений, какой наблюдается при увеличении атомной массы элементов, называется периодическим изменением. Свойства всех химических элементов при увеличении атомной массы изменяются периодически. Это периодическое изменение называется периодической зависимостью свойств элементов и их соединений от величины атомной массы. Поэтому Д.И. Менделеев сформулировал открытый им закон так: Свойства элементов, а так же формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов. Менделеев расположил периоды элементов друг под другом и в результате составил периодическую систему элементов. Он говорил, что таблица элементов – плод не только его собственного труда, но и усилий многих химиков, среди которых он особо отмечал «укрепителей периодического закона», открывших предсказанные им элементы.
Оксид калия К2О, как и оксиды лития и натрия Li2O и Na2O, является основным оксидом, а гидроксид калия КОН, как и гидроксиды лития и натрия LiOH и NaOH, является типичным основанием. Аналогично изменяются формы и свойства неметаллов от Ch5 до HF и от Sih5 до HCl. Такой характер свойств элементов и их соединений, какой наблюдается при увеличении атомной массы элементов, называется периодическим изменением. Свойства всех химических элементов при увеличении атомной массы изменяются периодически. Это периодическое изменение называется периодической зависимостью свойств элементов и их соединений от величины атомной массы. Поэтому Д.И. Менделеев сформулировал открытый им закон так: Свойства элементов, а так же формы и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов. Менделеев расположил периоды элементов друг под другом и в результате составил периодическую систему элементов. Он говорил, что таблица элементов – плод не только его собственного труда, но и усилий многих химиков, среди которых он особо отмечал «укрепителей периодического закона», открывших предсказанные им элементы. Для создания современной таблицы потребовалась напряженная многолетняя работа тысяч и тысяч химиков и физиков. Если бы Менделеев был сейчас жив, он, глядя на современную таблицу элементов, вполне мог бы повторить слова английского химика Дж.У.Меллора, автора классической 16-томной энциклопедии по неорганической и теоретической химии. Закончив в 1937, после 15-летней работы, свой труд, он написал с признательностью на титульном листе: «Посвящается рядовым огромной армии химиков. Их имена забыты, их работы остались»… Периодическая система – это классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона. На октябрь 2009 года известно 117 химических элементов (с порядковыми номерами с 1 по 116 и 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах). Остальные23 получены искусственно в результате ядерных реакций – это процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма- квантами и друг с другом, обычно приводящий к выделению колоссального количества энергии.
Для создания современной таблицы потребовалась напряженная многолетняя работа тысяч и тысяч химиков и физиков. Если бы Менделеев был сейчас жив, он, глядя на современную таблицу элементов, вполне мог бы повторить слова английского химика Дж.У.Меллора, автора классической 16-томной энциклопедии по неорганической и теоретической химии. Закончив в 1937, после 15-летней работы, свой труд, он написал с признательностью на титульном листе: «Посвящается рядовым огромной армии химиков. Их имена забыты, их работы остались»… Периодическая система – это классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона. На октябрь 2009 года известно 117 химических элементов (с порядковыми номерами с 1 по 116 и 118), из них 94 обнаружены в природе (некоторые — лишь в следовых количествах). Остальные23 получены искусственно в результате ядерных реакций – это процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма- квантами и друг с другом, обычно приводящий к выделению колоссального количества энергии. Первые 112 элементов имеют постоянные названия, остальные — временные. Открытие 112-го элемента (самый тяжелый из официальных) признано Международным союзом теоретической и прикладной химии. Самый стабильный из известных изотопов данного элемента имеет период полураспада 34 секунды. На начало июня 2009 года носит неофициальное имя унунбий, был впервые синтезирован в феврале 1996 года на ускорителе тяжелых ионов в Институте тяжелых ионов в Дармштадте, Германия (в результате бомбардировки свинцовой мишени ядрами цинка). Первооткрыватели имеют полгода, чтобы предложить новое официальное название для добавления в таблицу (ими уже предлагались Виксхаузий, Гельмгольций, Венусий, Фриший, Штрассманий и Гейзенбергий). В настоящее время известны трансурановые элементы с номерами 113-116 и 118, полученные в Объединенном институте ядерных исследований в Дубне, однако они официально пока не признаны. Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная».
Первые 112 элементов имеют постоянные названия, остальные — временные. Открытие 112-го элемента (самый тяжелый из официальных) признано Международным союзом теоретической и прикладной химии. Самый стабильный из известных изотопов данного элемента имеет период полураспада 34 секунды. На начало июня 2009 года носит неофициальное имя унунбий, был впервые синтезирован в феврале 1996 года на ускорителе тяжелых ионов в Институте тяжелых ионов в Дармштадте, Германия (в результате бомбардировки свинцовой мишени ядрами цинка). Первооткрыватели имеют полгода, чтобы предложить новое официальное название для добавления в таблицу (ими уже предлагались Виксхаузий, Гельмгольций, Венусий, Фриший, Штрассманий и Гейзенбергий). В настоящее время известны трансурановые элементы с номерами 113-116 и 118, полученные в Объединенном институте ядерных исследований в Дубне, однако они официально пока не признаны. Распространённее других являются 3 формы таблицы Менделеева: «короткая» (короткопериодная), «длинная» (длиннопериодная) и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды (семейство из 14 химических элементов с порядковыми номерами 58—71, расположенных в VI периоде системы) и актиноиды (семейство радиоактивных химических элементов, состоящее из актиния и 14 подобных ему по своим химическим свойствам) вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Короткая форма таблицы, содержащая восемь групп элементов, была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжила приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов.
В «сверхдлинном» варианте каждый период занимает ровно одну строчку. В «длинном» варианте лантаноиды (семейство из 14 химических элементов с порядковыми номерами 58—71, расположенных в VI периоде системы) и актиноиды (семейство радиоактивных химических элементов, состоящее из актиния и 14 подобных ему по своим химическим свойствам) вынесены из общей таблицы, делая её более компактной. В «короткой» форме записи, в дополнение к этому, четвёртый и последующие периоды занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток. Короткая форма таблицы, содержащая восемь групп элементов, была официально отменена ИЮПАК в 1989 году. Несмотря на рекомендацию использовать длинную форму, короткая форма продолжила приводиться в большом числе российских справочников и пособий и после этого времени. Из современной иностранной литературы короткая форма исключена полностью, из двух подгрупп: главной и побочной. Главная подгруппа – А, содержит элементы малых и больших периодов.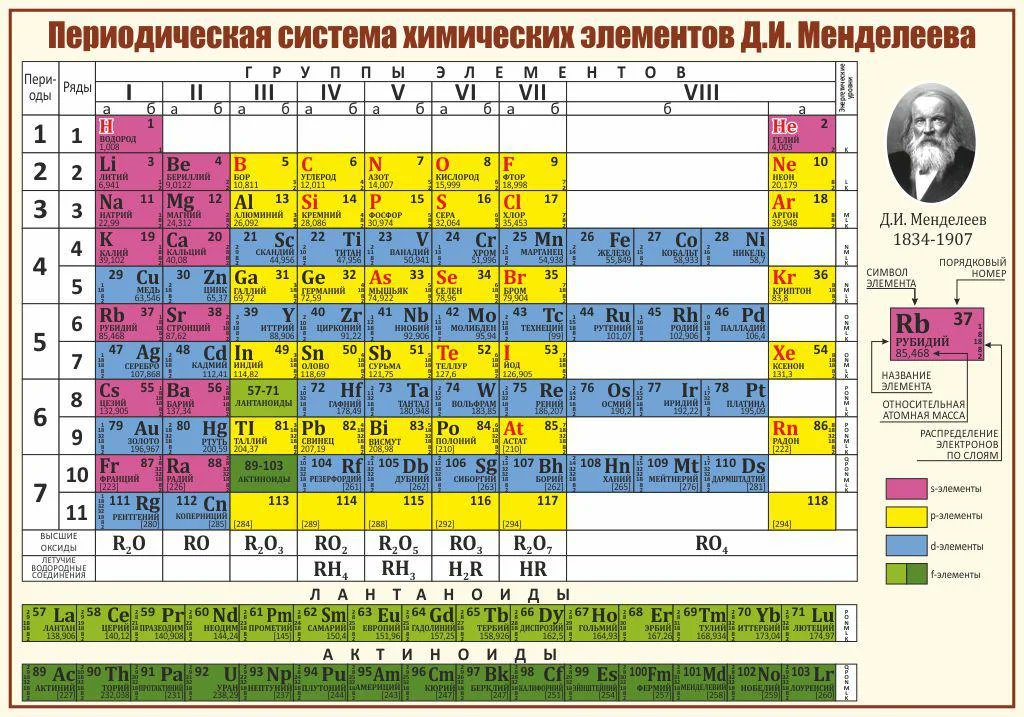 Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого. В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами. Рис 2 Таблица Менделеева 2.4 Периодический закон и его обоснование Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной. Особо четко она проявляется в структурировании научного и учебного материала химии. Академик А. Е. Ферсман говорил, что система объединила всю химию в рамки единой пространственной, хронологической, генетической, энергетической связи. Интегративная роль Периодического закона проявилась и в том, что некоторые данные об элементах, якобы выпадавшие из общих закономерностей, были проверены и уточнены как самим автором, так и его последователями. Так случилось с характеристиками бериллия. До работы Менделеева его считали трехвалентным аналогом алюминия из-за их так называемого диагонального сходства.
Побочная подгруппа – В, содержит элементы только больших периодов. В них входят элементы периодов, начиная с четвёртого. В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами. Рис 2 Таблица Менделеева 2.4 Периодический закон и его обоснование Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной. Особо четко она проявляется в структурировании научного и учебного материала химии. Академик А. Е. Ферсман говорил, что система объединила всю химию в рамки единой пространственной, хронологической, генетической, энергетической связи. Интегративная роль Периодического закона проявилась и в том, что некоторые данные об элементах, якобы выпадавшие из общих закономерностей, были проверены и уточнены как самим автором, так и его последователями. Так случилось с характеристиками бериллия. До работы Менделеева его считали трехвалентным аналогом алюминия из-за их так называемого диагонального сходства.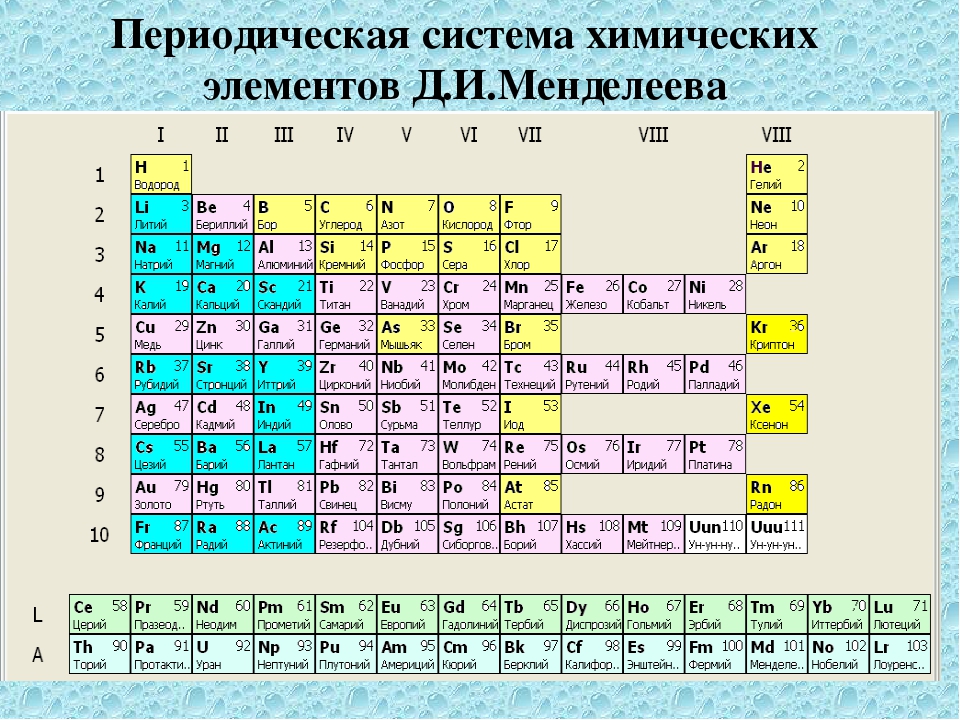 Таким образом, во втором периоде оказывалось два трехвалентных элемента и ни одного двухвалентного. Именно на этой стадии Менделеев заподозрил ошибку в исследованиях свойств бериллия, он нашел работу российского химика Авдеева, утверждавшего, что бериллий двухвалентен и имеет атомный вес 9. Работа Авдеева оставалась не замеченной ученым миром, автор рано скончался, по-видимому, получив отравление чрезвычайно ядовитыми бериллиевыми соединениями. Результаты исследования Авдеева утвердились в науке благодаря Периодическому закону. Такие изменения и уточнения значений и атомных весов, и валентностей были сделаны Менделеевым еще для девяти элементов (In, V, Th, U, La, Ce и трех других лантаноидов). Еще у десяти элементов были исправлены только атомные веса. И все эти уточнения впоследствии были подтверждены экспериментально. Прогностическая (предсказательная) функция Периодического закона получила самое яркое подтверждение в открытии неизвестных элементов с порядковыми номерами 21, 31 и 32.
Таким образом, во втором периоде оказывалось два трехвалентных элемента и ни одного двухвалентного. Именно на этой стадии Менделеев заподозрил ошибку в исследованиях свойств бериллия, он нашел работу российского химика Авдеева, утверждавшего, что бериллий двухвалентен и имеет атомный вес 9. Работа Авдеева оставалась не замеченной ученым миром, автор рано скончался, по-видимому, получив отравление чрезвычайно ядовитыми бериллиевыми соединениями. Результаты исследования Авдеева утвердились в науке благодаря Периодическому закону. Такие изменения и уточнения значений и атомных весов, и валентностей были сделаны Менделеевым еще для девяти элементов (In, V, Th, U, La, Ce и трех других лантаноидов). Еще у десяти элементов были исправлены только атомные веса. И все эти уточнения впоследствии были подтверждены экспериментально. Прогностическая (предсказательная) функция Периодического закона получила самое яркое подтверждение в открытии неизвестных элементов с порядковыми номерами 21, 31 и 32. Их существование сначала было предсказано на интуитивном уровне, но с формированием системы Менделеев с высокой степенью точности смог рассчитать их свойства. Хорошо известная история открытия скандия, галлия и германия явилась триумфом менделеевского открытия. Он все предсказания делал на основе им же самим открытого всеобщего закона природы. Всего же Менделеевым были предсказаны двенадцать элементов. С самого начала Менделеев указал, что закон описывает свойства не только самих химических элементов, но и множества их соединений. Для подтверждения этого достаточно привести такой пример. С 1929 г., когда академик П. Л. Капица впервые обнаружил неметаллическую проводимость германия, во всех странах мира началось развитие учения о полупроводниках. Сразу стало ясно, что элементы с такими свойствами занимают главную подгруппу IV группы. Со временем пришло понимание, что полупроводниковыми свойствами должны в большей или меньшей мере обладать соединения элементов, расположенных в периодах равно удаленной от этой группы (например, с общей формулой типа АзВ).
Их существование сначала было предсказано на интуитивном уровне, но с формированием системы Менделеев с высокой степенью точности смог рассчитать их свойства. Хорошо известная история открытия скандия, галлия и германия явилась триумфом менделеевского открытия. Он все предсказания делал на основе им же самим открытого всеобщего закона природы. Всего же Менделеевым были предсказаны двенадцать элементов. С самого начала Менделеев указал, что закон описывает свойства не только самих химических элементов, но и множества их соединений. Для подтверждения этого достаточно привести такой пример. С 1929 г., когда академик П. Л. Капица впервые обнаружил неметаллическую проводимость германия, во всех странах мира началось развитие учения о полупроводниках. Сразу стало ясно, что элементы с такими свойствами занимают главную подгруппу IV группы. Со временем пришло понимание, что полупроводниковыми свойствами должны в большей или меньшей мере обладать соединения элементов, расположенных в периодах равно удаленной от этой группы (например, с общей формулой типа АзВ). Это сразу сделало поиск новых практически важных полупроводников целенаправленным и предсказуемым. На таких соединениях основывается практически вся современная электроника. Важно отметить, что предсказания в рамках Периодической системы делались и после ее всеобщего признания. В 1913г. Мозли обнаружил, что длина волн рентгеновских лучей, которые получены от антикатодов, сделанных из разных элементов, изменяется закономерно в зависимости от порядкового номера, условно присвоенного элементам в Периодической системе. Эксперимент подтвердил, что порядковый номер элемента имеет прямой физический смысл. Лишь позднее порядковые номера были связаны со значением положительного заряда ядра. Зато закон Мозли позволил сразу экспериментально подтвердить число элементов в периодах и вместе с тем предсказать места еще не открытых к тому времени гафния (№ 72) и рения (№ 75). Долгое время шел спор: выделять инертные газы в самостоятельную нулевую группу элементов или считать их главной подгруппой VIII группы.
Это сразу сделало поиск новых практически важных полупроводников целенаправленным и предсказуемым. На таких соединениях основывается практически вся современная электроника. Важно отметить, что предсказания в рамках Периодической системы делались и после ее всеобщего признания. В 1913г. Мозли обнаружил, что длина волн рентгеновских лучей, которые получены от антикатодов, сделанных из разных элементов, изменяется закономерно в зависимости от порядкового номера, условно присвоенного элементам в Периодической системе. Эксперимент подтвердил, что порядковый номер элемента имеет прямой физический смысл. Лишь позднее порядковые номера были связаны со значением положительного заряда ядра. Зато закон Мозли позволил сразу экспериментально подтвердить число элементов в периодах и вместе с тем предсказать места еще не открытых к тому времени гафния (№ 72) и рения (№ 75). Долгое время шел спор: выделять инертные газы в самостоятельную нулевую группу элементов или считать их главной подгруппой VIII группы. Исходя из положения элементов в Периодической системе, химики- теоретики во главе с Лайнусом Полингом давно сомневались в полной химической пассивности инертных газов, напрямую указывая на возможную устойчивость их фторидов и оксидов. Но только в 1962 г. американский химик Нил Бартлетт впервые осуществил в самых обычных условиях реакцию Периодический закон и сделанные на его основе открытия в различных областях естествознания и техники являются величайшим триумфом человеческого разума, свидетельством всё более глубокого проникновения в самые сокровенные тайны природы, успешного преобразования природы на благо человека. «Редко бывает, чтобы научное открытие оказалось чем-то совершенно неожиданным, почти всегда оно предчувствуется, однако последующим поколениям, которые пользуются апробированными ответами на все вопросы, часто нелегко оценить, каких трудностей это стоило их предшественникам». Д.И. Менделеев. 4. Список используемой литературы: 1. Глинка Н.Л.«Общая химия», Москва , изд. «Интеграл – пресс»,2002 г.
Исходя из положения элементов в Периодической системе, химики- теоретики во главе с Лайнусом Полингом давно сомневались в полной химической пассивности инертных газов, напрямую указывая на возможную устойчивость их фторидов и оксидов. Но только в 1962 г. американский химик Нил Бартлетт впервые осуществил в самых обычных условиях реакцию Периодический закон и сделанные на его основе открытия в различных областях естествознания и техники являются величайшим триумфом человеческого разума, свидетельством всё более глубокого проникновения в самые сокровенные тайны природы, успешного преобразования природы на благо человека. «Редко бывает, чтобы научное открытие оказалось чем-то совершенно неожиданным, почти всегда оно предчувствуется, однако последующим поколениям, которые пользуются апробированными ответами на все вопросы, часто нелегко оценить, каких трудностей это стоило их предшественникам». Д.И. Менделеев. 4. Список используемой литературы: 1. Глинка Н.Л.«Общая химия», Москва , изд. «Интеграл – пресс»,2002 г. 2. Ахметов Н.С. «Актуальные вопросы курса неорганической химии», Москва, изд. «Просвещение», 1991 г. 3. Макареня А.А., Рысев Ю.В, «Д.И. Менделеев», Москва, изд. «Просвещение», 1988 г. 4. Ред. Егорова А.С. «Репетитор по химии», Ростов-на-Дону, изд. «Феникс», 2006 г. 5. Кузьменко Н.Е., Ерёмин В.В., Попков В.А. «Начала химии», Москва, изд. «Экзамен», 2004 г. 6. Кошель П.А. «Большая школьная энциклопедия. 6-11 кл., Т. 2., Москва, изд. «ОЛМА – Пресс», 1999 г. 7. Авт. Сост. Савина Л.А. Я познаю мир: Детская энциклопедия: Химия, Москва, изд. «АСТ – ЛТД», 1988 г. 8. Химия. 9 класс: Учеб. Для общеобразоват. учеб. заведений. – 3-е изд., стереотип. – Москва, изд. «Дрофа», 2000 г.
2. Ахметов Н.С. «Актуальные вопросы курса неорганической химии», Москва, изд. «Просвещение», 1991 г. 3. Макареня А.А., Рысев Ю.В, «Д.И. Менделеев», Москва, изд. «Просвещение», 1988 г. 4. Ред. Егорова А.С. «Репетитор по химии», Ростов-на-Дону, изд. «Феникс», 2006 г. 5. Кузьменко Н.Е., Ерёмин В.В., Попков В.А. «Начала химии», Москва, изд. «Экзамен», 2004 г. 6. Кошель П.А. «Большая школьная энциклопедия. 6-11 кл., Т. 2., Москва, изд. «ОЛМА – Пресс», 1999 г. 7. Авт. Сост. Савина Л.А. Я познаю мир: Детская энциклопедия: Химия, Москва, изд. «АСТ – ЛТД», 1988 г. 8. Химия. 9 класс: Учеб. Для общеобразоват. учеб. заведений. – 3-е изд., стереотип. – Москва, изд. «Дрофа», 2000 г.
Реферат по химии на тему “Как создавалась таблица Менделеева”
Государственное бюджетное образовательное учреждение
средняя общеобразовательная школа №225 Адмиралтейского района Санкт-Петербурга
Школа БИОТОП Лаборатории непрерывного математического образования
РЕФЕРАТ
ПО ХИМИИ
_____________________________
Как создавалась таблица Менделеева
_____________________________
Выполнил ученик
7б класса
Хдяков Тимур Евгеневич
Учитель химии: Ворнаев Иван Генадевич
Оценка ___________________
Санкт-Петербург
2018
титульный лист (1 страница)
оглавления (2 страница)
введение (3 страницы)
основная часть (4-8 страницы)
заключение (9 страница)
библиография (10 страница)
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность , это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок – D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Менделеев родился 8 февраля 1834 году в Тобольске в семье директора гимназии. Учился в этой гимназии, затем был принят на отделение естественных наук физико-математического факультета Главного педагогического института в Петербурге. Курс окончил с золотой медалью, однако за годы напряжённых занятий подорвал здоровье.
В 1855 г. уехал в Одессу, где преподавал в гимназии при Ришельевском лицее. Благодатный южный климат позволил Менделееву уже в следующем году вернуться в Петербург. Он защитил магистерскую диссертацию и приступил к чтению лекций по органической химии в Петербургском университете.
В 1859—1861 гг. посетил Германию «для усовершенствования в науках», а по возвращении на родину издал первый в России учебник по органической химии, который был удостоен Демидовской премии.
В 1865 г. Менделеев защитил докторскую диссертацию, заложившую основы учения о растворах.
В 1869 г. учёный совершил одно из величайших открытий в истории химии — вывел периодический закон химических элементов. В 1871 г. вышел его классический труд «Основы химии», где обобщались представления о любимой науке.
Дмитрий Иванович отдавал много сил преподавательской деятельности — был профессором Петербургского университета, вёл курсы в других учебных заведениях. На склоне лет он отмечал: «Из тысяч моих учеников много теперь повсюду видных деятелей, профессоров, администраторов, и, встречая их, всегда слышал, что доброе в них семя полагал, а не простую отбывал повинность».
В 1890 г. Менделеев покинул университет в знак протеста против притеснения студенчества. Несколько лет учёный был консультантом научно-технической лаборатории Морского министерства; в 1892 году он организовал производство изобретённого им бездымного пороха.
Несколько лет учёный был консультантом научно-технической лаборатории Морского министерства; в 1892 году он организовал производство изобретённого им бездымного пороха.
С 1892 года и до конца своей жизни Дмитрий Иванович возглавлял Главную палату мер и весов.
Скончался 2 февраля 1907 г. в Петербурге.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление. В итоге, в феврале 1869 года Менделеев сформулировал первый периодический закон, а уже в марте его доклад «Соотношение свойств с атомным весом элементов» был представлен на рассмотрение Русского химического общества историком химии Н. А. Меншуткиным. Затем в том же году публикация Менделеева была напечатана в журнале «Zeitschrift fur Chemie» в Германии, а в 1871 году новую обширную публикацию учёного, посвящённую его открытию, опубликовал другой немецкий журнал «Annalen der Chemie».
Создание периодической таблицы
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток безе перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева
Многие слышали историю, что Д. И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы). Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
Подготовка – этап формулирования основной задачи и первые попытки её решения;
Инкубация – этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне;
Озарение – этап, на котором находится интуитивное решение.
 Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;Проверка – этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
Из всего выше сказанного можно извлечь то, что неважно кем ты являешься, ведь каждый человек если захочет сделает всё что угодно
БИБЛИОГРАФИЯ
Статья про Менделеева: http://citaty.su/kratkaya-biografiya-mendeleeva
Статья про создание таблицы: https://4brain.ru/blog/как-создавалась-таблица-менделеева/
Таблица Менделеева: http://tablica-mendeleeva.ru/
Таблица Менделеева
«Первый постановщик элементов природы». Так называлась статья в Курьере ЮНЕКО за июнь 1971 года, посвященная Дмитрию Менделееву, человеку, благодаря которому «изучение химии шагнуло от средневекового движения на ощупь в современную науку».
Что же он сделал? Если описать в двух словах, анализирует автор статьи, то «русский ученый предложил расположить внутри таблицы [химические] элементы по линиям и колонкам, названным периодами и группами, таким образом, что вес атома шел по возрастающей слева направо по каждой линии, начиная с верхней. В вертикальных колонках оказались элементы, имевшие аналогичные свойства, например, общий способ формирования окисей».
В вертикальных колонках оказались элементы, имевшие аналогичные свойства, например, общий способ формирования окисей».
Что же революционного в этой таблице? Теория периодической классификации элементов по весу их атомов, которую этот 35-летний сибиряк представил Российскому химическому обществу 14 марта 1869 года, представляет собой открытие закона природы. Ее построение позволило не только исправить большое количество ошибок в расчетах, но и предсказать открытие неизвестных до тех пор элементов, как, например, галлий, скандий или германий (названный так позднее в честь страны, где он был найден).
Великие открыватели будоражат людское воображение. О Ньютоне, например, говорят, будто он открыл закон притяжения после того, как ему на голову упало яблоко, или, что кастрюля кипящей воды подсказала Джеймсу Уатту идею создания паровой машины. Про Менделеева же пишут, что периодическая таблица привиделась ему во сне!
В заключение автор статьи пишет, что «мы склонны забывать о том, что если научная истина вдруг, как молния, озаряет человека, то этот ученый потратил несколько лет, изучая данный предмет. Луи Пастер говорил: “Удача всегда одаривает лишь подготовленные умы“. Если мы посмотрим на работу Менделеева до 1869 года, то станет очевидно, что составление периодической таблицы элементов не было делом случая».
Луи Пастер говорил: “Удача всегда одаривает лишь подготовленные умы“. Если мы посмотрим на работу Менделеева до 1869 года, то станет очевидно, что составление периодической таблицы элементов не было делом случая».
Кроме периодической таблицы элементов в памяти человечества навсегда останется фраза, произнесенная Менделеевым по поводу нефти: «Это очень ценный продукт. Сжигать нефть – это все равно, что топить печь ассигнациями. Ее следует использовать как сырье для химического синтеза».
Катерина Маркелова
Дополнительная информация
Дмитрий Менделеев: уроки пророка, «Курьер ЮНЕСКО», апрель-июнь 2019
Карта на стене лаборатории, «Курьер ЮНЕСКО», июнь 1971
Дмитрий Менделеев, «Курьер ЮНЕСКО», июнь 1971
В Париже состоялась церемония открытия международного года периодической таблицы химических элементов / Интерфакс
В торжественной церемонии приняли участие: министр науки и высшего образования РФ Михаил Котюков, президент Российской академии наук Александр Сергеев, президент Академии наук Франции Пьер Корволь, генеральный директор ЮНЕСКО Одри Азуле. Генеральным партнером Международного года Периодической таблицы химических элементов в России выступает Благотворительный Фонд Алишера Усманова “Искусство, наука и спорт”.
Генеральным партнером Международного года Периодической таблицы химических элементов в России выступает Благотворительный Фонд Алишера Усманова “Искусство, наука и спорт”.
“Во всем мире Периодическая таблица химических элементов ассоциируется с именем Дмитрия Ивановича Менделеева, что является признанием феноменального открытия, которое стало единым языком всех естественных наук. И именно поэтому ученые разных специальностей – химики, физики, астрономы, геологи, медики, биологи и географы – считают эту таблицу своей. Роль сделанного 150 лет назад открытия не только не стирается временем, но и продолжает расти. Гигантская работа ученого по осмыслению всего доступного на тот период времени пласта знаний привела к созданию единой стройной системы, не только объясняющей взаимную связь между элементами, но и позволяющей предсказывать существование новых химических элементов”, – сказал Михаил Котюков.
Президент Российской академии наук РАН Александр Сергеев добавил: “Сегодня очень важный день для России. Важный, во-первых, благодаря Дмитрию Ивановичу Менделееву и его открытию. Во-вторых, важно то, что наша страна выступила инициатором Международного года таблицы химических элементов, и это предложение было единогласно поддержано международным сообществом. И наконец, мы видим большой вклад в организацию и проведение Международного года, который внесли со своей стороны наша власть и наш бизнес. Поэтому роль и значение России в проведении Международного года таблицы чрезвычайно велики”.
Важный, во-первых, благодаря Дмитрию Ивановичу Менделееву и его открытию. Во-вторых, важно то, что наша страна выступила инициатором Международного года таблицы химических элементов, и это предложение было единогласно поддержано международным сообществом. И наконец, мы видим большой вклад в организацию и проведение Международного года, который внесли со своей стороны наша власть и наш бизнес. Поэтому роль и значение России в проведении Международного года таблицы чрезвычайно велики”.
В рамках церемонии состоялись выступления всемирно известных ученых. Так, Нобелевский лауреат по химии 2016 года, профессор Бен Феринга представил свой доклад на тему “Периодическая таблица для общества и будущего”. Научный руководитель Лаборатории ядерных реакций имени Г.Н.Флерова, профессор Юрий Оганесян, именем которого был назван 118-й элемент Таблицы “оганесон”, выступил с лекцией о новых элементах Периодической таблицы. Вице-президент Лондонского королевского общества, автор серии “Видео о периодической таблице”, сэр Мартин Полякофф в своей лекции на тему “Менделеев – подарок для образования” отметил роль Периодической таблицы в популяризации науки и образования.
Большой интерес представляли выступления известных ученых на тему космоса и происхождения химических элементов. Так, профессор Института космических исследований РАН Александр Лутовинов прочел лекцию “Звезды: от колыбели до могилы”, а лауреат премии Кавли 2018 Эвина Ван Дисхук рассказала о происхождении элементов в космическом пространстве. Также с докладами и лекциями о Таблице Менделеева выступили молодые талантливые ученые из Европы, Африки, Азии, Латинской Америки и стран Востока. Дополнили программу научные шоу и музыкальные спектакли.
В рамках мероприятий, приуроченных к церемонии открытия Международного года Периодической таблицы химических элементов, в Париже с 28 января начала свою работу международная выставка, посвященная химии и современным достижениям в области химической науки. Свои уникальные экспозиции на выставке представили: Россия, Великобритания, Франция, Нидерланды, США, Швейцария, Китай, Япония и Шотландия.
Самой масштабной частью международной выставки стала экспозиция России, где в увлекательной форме продемонстрированы не только достижения ведущих российских научно-исследовательских групп в области химии и материаловедения, но и интерактивная Периодическая таблица химических элементов.
Участниками российской экспозиции стали ведущие вузы и инновационные, научно-исследовательские и образовательные организации страны, такие как – МГУ имени М.В.Ломоносова, Российский химико-технологический университет имени Д.И. Менделеева, Объединенный Институт Ядерных Исследований (в знак признания заслуг учёных этого института названы новые элементы Таблицы – дубний, флеровий, московий и оганесон), компания “ФосАгро” и многие другие. На каждом из стендов посетители выставки могут поучаствовать в экспериментах по созданию и применению различных материалов и химических элементов, а также пообщаться с учеными-исследователями в области синтетической химии и современного материаловедения.
Всероссийский фестиваль науки NAUKA 0+ разместил в международной экспозиции свою Интерактивную химическую выставку – с зоной виртуальной реальности и новейшими технологиями образования, зоной научных экспериментов, IT-зоной с возможностью создания своей собственной Таблицы элементов, зоной “зеленой химии”, а также зоной научного искусства, где представлены художественные работы на тему химии. Кроме того, посетители этой выставки могут сделать сэлфи с Д.И.Менделеевым в химической лаборатории 19 века, выпить коктейль в молекулярном баре и протестировать химических роботов.
Кроме того, посетители этой выставки могут сделать сэлфи с Д.И.Менделеевым в химической лаборатории 19 века, выпить коктейль в молекулярном баре и протестировать химических роботов.
Международная химическая выставка в рамках открытия Года Периодической таблицы в Париже продлится до 30 января. Затем экспозиция переместится в Москву и продолжит свою работу в дни открытия Международного года Периодической таблицы в России.
Церемония открытия Международного года Периодической таблицы химических элементов в России состоится 6 февраля 2019 года в Москве и будет приурочена ко Дню российской науки и одновременно Дню рождения Д.И.Менделеева.
Официальным оператором церемоний открытия Международного года Периодической таблицы химических элементов в Париже и Москве выступает Всероссийский фестиваль науки NAUKA 0+. Главной темой Фестиваля науки в 2019 году объявлена Периодическая Таблица Менделеева.
В рамках Международного года во всех регионах России планируется проведение более 500 научно-популярных и образовательных мероприятий, посвященных 150-летию выдающегося открытия Д. И.Менделеева и направленных на привлечение внимания школьников, студентов и молодежи в целом к науке и ее достижениям.
И.Менделеева и направленных на привлечение внимания школьников, студентов и молодежи в целом к науке и ее достижениям.
Проведение в 2019 году Международного года Периодической таблицы химических элементов имеет особое значение для России. Это событие будет способствовать международному признанию заслуг великого русского ученого Д.И.Менделеева, а также укреплению престижа и популяризации отечественной науки.
Таблица Менделеева – мифы и реальность
Личность выдающегося русского химика и физика Дмитрия Менделеева окутана слухами и легендами. Говорят, что таблица химических элементов приснилась ему во сне. А еще ему приписывают изобретение формулы водки… В нашей статье – интересные факты о знаменитом ученом и о его открытиях.
1 марта 1869 г (17 февраля по старому стилю) Дмитрий Иванович Менделеев сдал в печать рукопись “Опыт системы элементов, основанной на их атомном весе и химическом сходстве” – первый вариант всем известной Периодической таблицы химических элементов. Это работа перевернула все прежние представления о химии.
Это работа перевернула все прежние представления о химии.
Еще до Менделеева свои варианты расположения 63 известных на то время химических элементов предлагали французский геолог и химик Александр Эмиль Шанкуртуа, а также английский химик и музыкант Джон Александр Ньюлендс. Однако их работы не привлекли внимания научной общественности. А вот таблица Менделеева совершила настоящий переворот в науке.
В Европе о таблице Менделеева узнали уже в апреле 1869 года. Первая публикация появилась в лейпцигском “Журнале практической химии”. Ну а в 1871 году во второй части учебника Менделеева “Основы химии” опубликован второй вариант Периодической системы, имеющий более привычный нам вид таблицы.
Ученый доказал, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определенного количества разных по свойствам элементов, расположенных по возрастанию атомного веса, их свойства начинают повторяться.
Менделеев не только систематизировал уже известные науке химические элементы, но и предсказал открытие новых. В 70-80-е годы XIX века таблицу дополнили галлий, скандий и германий. Дмитрий Иванович ранее с поразительной точностью описал их физические и химические свойства.
В 70-80-е годы XIX века таблицу дополнили галлий, скандий и германий. Дмитрий Иванович ранее с поразительной точностью описал их физические и химические свойства.
По легенде, идея о системе химических элементов пришла к Менделееву во сне. Еще при жизни ученого спросили, правда ли Это. Менделеев ответил: “Я над ней, может быть, двадцать лет думал, а вы полагаете: сидел и вдруг… готово”.
Также немало анекдотов гуляет по поводу открытия Менделеевым формулы водки. Эта история даже публикуется на этикетках алкоголя известных марок. Согласно экспозиции Музея водки в Санкт-Петербурге, Менделеев считал идеальной крепость знаменитого алкогольного напитка в 38°, но это число было округлено до 40° для упрощения расчета акциза на алкоголь.
Как же обстояли дела на самом деле? В 1865 году Дмитрий Менделеев действительно защитил докторскую диссертацию на тему “О соединении спирта с водою”. Однако к изобретению формулы водки это не имеет никакого отношения. На самом деле в своей работе Менделеев установил, при какой концентрации происходит максимальное взаимное растворение воды и спирта друг в друге.
Однако к изобретению формулы водки это не имеет никакого отношения. На самом деле в своей работе Менделеев установил, при какой концентрации происходит максимальное взаимное растворение воды и спирта друг в друге.
1. Мало кто знает, но Менделеев прославился не только открытием Периодической системы химических элементов. Ученый занимался проектированием аэростатов, ледокола, является автором ряда работ по метрологии, создал точную теорию весов. Кроме того, он участвовал в испытаниях бездымного пороха и первым предложил идею создания нефтепровода.
2. В свое время знаменитый ученый также прославился “производством чемоданов”. Еще в юности Дмитрий Иванович обучился переплетному делу. Для всех своих документов, архивов, фотографий и писем ученый самостоятельно изготавливал переплеты. Он мастерил оригинальные рамки для фотографий, переплеты для книг и чемоданы. Рассказывают, что однажды Менделеев делал покупки в Гостином дворе, как вдруг услышал за спиной разговор:
Рассказывают, что однажды Менделеев делал покупки в Гостином дворе, как вдруг услышал за спиной разговор:
— Кто этот почтенный господин?
— Таких людей знать надо, — с уважением в голосе ответил приказчик. — Это мастер чемоданных дел Менделеев…
3. Многие свои научные труды Менделеев создавал в своей летней лаборатории, которая располагалась в … дупле дуба. Огромное дерево росло в дворянском имении Боблово, которое химик купил вместе с коллегой, профессором Ильиным. Прямо внутри дерева ученый оборудовал уютную летнюю лабораторию, поставив маленький столик и стул, а со временем установил там даже радиоантенну!
4. За открытие Периодического закона иностранные ученые Дмитрия Менделеева трижды выдвигали на Нобелевскую премию по химии. Однако он ее так и не получил.
5. Дмитрий Менделеев – первый русский ученый, получивший докторскую степень в Кембридже.
6. В 1955 году заслуги Менделеева были увековечены: сто первый открытый химический элемент называется “Менделевий”. Таблица постоянно обновляется. Сегодня в ней уже 118 элементов.
Таблица постоянно обновляется. Сегодня в ней уже 118 элементов.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Политехники отметили 150-летие создания таблицы Менделеева
Круглый стол, посвященный юбилею известной таблицы, а также 185-летию со дня рождения ее основателя — выдающегося ученого-химика Дмитрия Ивановича Менделеева состоялся в Харьковской государственной научной библиотеке им. В.Г. Короленко. Мероприятие объединило более полусотни человек — научных сотрудников и студентов НТУ «ХПИ», представителей сферы медицины, других. Один из организаторов встречи — кафедра биотехнологии, биофизики и аналитической химии НТУ «ХПИ».
В рамках Круглого стола «Д.И. Менделеев: история открытия периодической таблицы» были представлены доклады ученых НТУ «ХПИ», Харьковской медицинской академии последипломного образования. В частности, профессор кафедры биотехнологии, биофизики и аналитической химии НТУ «ХПИ» д.т.н. Николай Клещев, и профессор Харьковской медицинской академии последипломного образования, профессор кафедры биотехнологии, биофизики и аналитической химии НТУ «ХПИ» д.м.н. Василий Россихин готовили доклады на темы: «185 лет со дня рождения Дмитрия Ивановича Менделеева», «150 лет периодической системы химических элементов», «Д.И. Менделеев — «… фигура уровня И. Ньютона и Ч. Дарвина».
В частности, профессор кафедры биотехнологии, биофизики и аналитической химии НТУ «ХПИ» д.т.н. Николай Клещев, и профессор Харьковской медицинской академии последипломного образования, профессор кафедры биотехнологии, биофизики и аналитической химии НТУ «ХПИ» д.м.н. Василий Россихин готовили доклады на темы: «185 лет со дня рождения Дмитрия Ивановича Менделеева», «150 лет периодической системы химических элементов», «Д.И. Менделеев — «… фигура уровня И. Ньютона и Ч. Дарвина».
Участники смогли прослушать и обсудить не только общеизвестные факты об открытиях ученого, но другие научные достижения гениального химика, интересные детали его работы. В частности, спикеры отметили, что со времен открытия закона Д. Менделеева прошло 150 лет, но никто не может сказать, когда же содержание знаменитой таблицы будет раскрыто до конца. Кроме того, не последнее место ученый-химик сыграл и в истории Харьковского технологического института (ныне НТУ «ХПИ»), приняв активное участие в основании вуза. Впоследствии он стал одним из первых Почетных докторов первого технического вуза Восточной Украины.
Впоследствии он стал одним из первых Почетных докторов первого технического вуза Восточной Украины.
Для гостей Круглого стола была представлена выставка «Дмитрий Менделеев — великан мысли и труда».
Организатор мероприятия — кафедра биотехнологии, биофизики и аналитической химии НТУ «ХПИ» совместно с Харьковской государственной библиотеке им. В.Г. Короленко, Харьковской медицинской академией последипломного образования.
Справка:
Генеральная ассамблея ООН провозгласила 2019 год Международным годом Периодической таблицы химических элементов.
Периодическая система и здоровье нации
В Политехническом университете состоялась XIV Всероссийская научно-практическая конференция с международным участием «Здоровье – основа человеческого потенциала: проблемы и пути их решения».
В этом году конференция, помимо основной темы, была посвящена трем юбилейным датам: 185-летию со дня рождения великого ученого Дмитрия Ивановича МЕНДЕЛЕЕВА, 150-летию открытия им Периодического закона химических элементов и 170-летию со дня рождения выдающегося физиолога, первого Нобелевского лауреата России Ивана Петровича ПАВЛОВА. Труды обоих ученых, безусловно, имеют самое прямое отношение к здоровью, и участники конференции подчеркивали это в своих выступлениях. А для Политеха юбилей Менделеева тоже имеет особое значение, ведь знаменитый химик был одним из инициаторов создания Санкт-Петербургского политехнического института. Таким образом, завершающийся 2019 год стал юбилейным и для университета, отметившего 120-летие, и для одного из основателей.
Труды обоих ученых, безусловно, имеют самое прямое отношение к здоровью, и участники конференции подчеркивали это в своих выступлениях. А для Политеха юбилей Менделеева тоже имеет особое значение, ведь знаменитый химик был одним из инициаторов создания Санкт-Петербургского политехнического института. Таким образом, завершающийся 2019 год стал юбилейным и для университета, отметившего 120-летие, и для одного из основателей.
Академик РАН Владимир ОКРЕПИЛОВ, заведующий кафедрой ЮНЕСКО СПбПУ, выступил с докладом «Дмитрий Иванович Менделеев – ученый, педагог, гражданин». 40 лет назад Владимир Валентинович начал работать в научно-производственном объединении «Всероссийский научно-исследовательский институт метрологии имени Д.И. Менделеева». Эта организация – преемник Главной палаты мер и весов, управляющим которой был знаменитый химик. Затем больше тридцати лет Владимир Окрепилов возглавлял Государственный региональный центр стандартизации, метрологии и испытаний в Санкт-Петербурге и Ленинградской области (ФБУ «Тест-С. -Петербург»). По сути, занимался общим с Менделеевым делом, отсюда интерес и особое отношение к личности великого соотечественника.
-Петербург»). По сути, занимался общим с Менделеевым делом, отсюда интерес и особое отношение к личности великого соотечественника.
«В конце октября 150-летие создания периодической таблицы Менделеева отметили на Конгрессе мировой организации химиков, в котором приняли участие 4000 делегатов, – рассказал Владимир Окрепилов. – По результатам опроса общественного мнения, кто самый выдающийся ученый мира, Менделеев занял третье место после Эйнштейна и Ньютона. Сам Дмитрий Иванович говорил о том, что у него три службы Родине: первая – это занятие естественными науками, вторая – преподавательская деятельность, и третья – развитие промышленности. Он говорил, что “профессор, который только читает курс, а сам не работает в науке, не двигается вперед. Он не только бесполезен, но и вреден”. Сам занимался метрологией, конструировал приборы. Создавая учебник, он открыл периодический закон химических элементов, который перевернул основы химии и естествознания. Развитие народного образования и просвещения он рассматривал как необходимое условие преодоления экономической отсталости России. Круг проблем, которыми он занимался, очень широк: воздухоплавание (он одним из первых поднялся на воздушном шаре без сопровождающих), таможенные тарифы, денежное обращение, переработка нефти, судостроение, освоение Арктики. Был горячим сторонником политики протекционизма, считал, что нужно защищать российскую промышленность от конкуренции западных стран. Развитие промышленности он связывал с таможенной политикой. Введение таможенного тарифа – заслуга Дмитрия Менделеева».
Круг проблем, которыми он занимался, очень широк: воздухоплавание (он одним из первых поднялся на воздушном шаре без сопровождающих), таможенные тарифы, денежное обращение, переработка нефти, судостроение, освоение Арктики. Был горячим сторонником политики протекционизма, считал, что нужно защищать российскую промышленность от конкуренции западных стран. Развитие промышленности он связывал с таможенной политикой. Введение таможенного тарифа – заслуга Дмитрия Менделеева».
Отдавая должное теме конференции, директор музея Д. И. Менделеева СПбГУ Игорь ДМИТРИЕВ в начале выступления отметил, что сам Дмитрий Менделеев был довольно здоровым человеком и, кстати, совсем равнодушным к алкоголю, несмотря на сложившийся миф об изобретении им русской водки. Вот только имел проблемы с легкими, хотя при этом много курил.
«Он не был зациклен на здоровье, но соблюдал посты, диеты, у него были свои рецепты блюд, разных оладушек, он все делал по-своему. Кроме того, любил дальние прогулки, косил сено, был в движении, на воздухе», – рассказал Игорь Сергеевич.
По словам Игоря Дмитриева, в гимназии Менделеев, как, кстати, некоторые другие великие ученые, учился неважно. Позже он сформировал целую философию насчет ненужности классического образования. Менделеев считал, что Россия модернизируется и нужно развивать прежде всего политехническое образование, или, как говорили в XIX веке, реальное. Что, собственно, он и воплотил, продвигая идею основания Политехнического института в столице империи.
Менделеев уделял внимания и вопросам демографии, рассказал декан факультета социальных наук, заведующий кафедрой истории и теории социологии РГПУ им. А. И. Герцена, президент Петровской академии наук и искусств Алексей ВОРОНЦОВ: «До сих пор в публикациях о различных направлениях творчества Менделеева не было уделено внимание анализу им демографических проблем. В большинстве современных учебных пособий и монографий по демографии имя Менделеева отсутствует. Социально-философские его воззрения раньше замалчивались, особенно это касалось его работ ”Заветные мысли”, “К познанию России”».
О демографии говорили и в Ресурсном центре международной деятельности Политеха, где проходила конференция. О том, что начиная с 2016 года населения России уменьшается, и что надо делать, чтобы исправить положение.
«Почему мы посвятили социально-экономическую, медико-биологическую, социально-демографическую конференцию химику Менделееву и физиологу Павлову? – обратился к слушателям профессор кафедры факультетской хирургии Медицинского факультета СПбГУ Сергей ВАРЗИН. – Мы хотим показать, что в России рождаются умные люди, которые определяют развитие науки и человечества, и они могут родиться еще и еще не один раз, но для этого нужно создавать атмосферу, развивать систему образования и здравоохранения».
На второй день конференции участники продолжили обсуждение вопросов здоровья нации в самом широком смысле: не только физического, но и нравственного, духовного; продолжительности жизни в стране; медицинской помощи и обеспеченности лекарства; продовольственной безопасности и экологии; просвещения и образования; экономики и благосостояния граждан.
Материал подготовлен Управлением по связям с общественностью. Текст: Екатерина ЕФИМОВА.
Все о Периодической таблице
Периодической таблице
Периодическая таблица, также известная как таблица Менделеева, представляет собой таблицу химических элементов, существующих на Земле. Русскому химику Дмитрию Менделееву приписывают его создание в 1869 году, хотя до этого существовали менее обширные таблицы. Он намеревался показать закономерности, проявляющиеся в химических свойствах каждого элемента. С момента его первоначального создания были обнаружены новые элементы и добавлены к исходной таблице Менделеева.
СТРУКТУРА Структура таблицы Менделеева очень важна. Текущая таблица содержит 117 элементов в очень четком порядке с целью показать сходства и различия в химических свойствах. Из всех элементов 94 встречаются в природе, а остальные 24 были произведены синтетически с помощью ускорителей частиц. Кроме того, большинство копий таблицы Менделеева разделяют металлические и неметаллические элементы темной линией ступенек.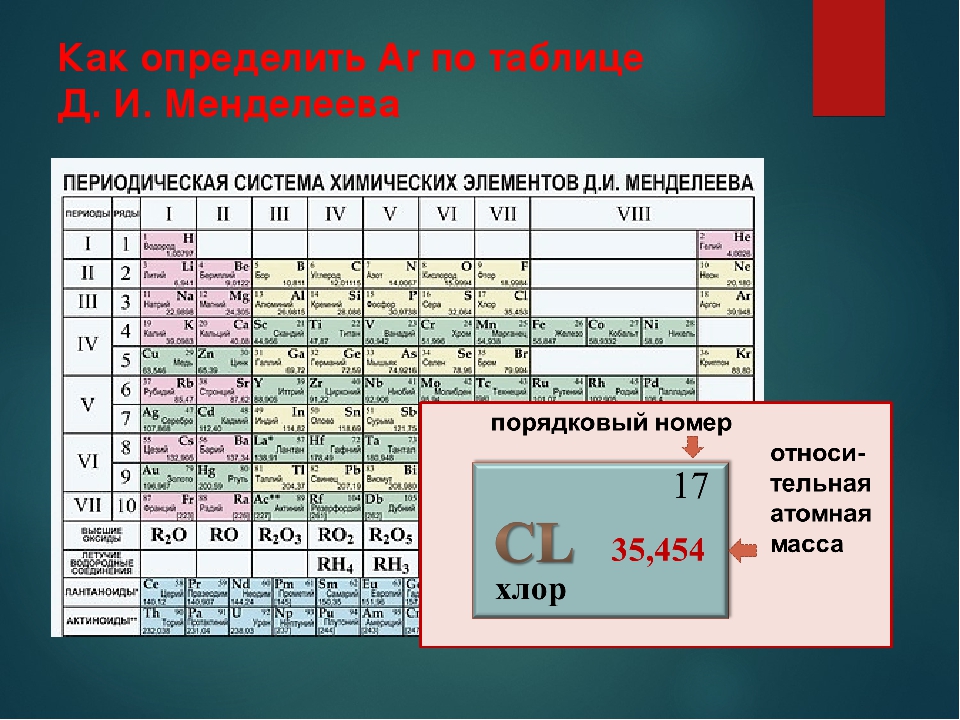 Металлы находятся слева, а неметаллы – справа.Кроме того, элементы располагаются в порядке возрастания атомного номера, который представляет собой количество протонов в ядре атома элемента. Строки также организованы таким образом, что элементы с похожими свойствами находятся в одних и тех же столбцах. Внутри квадрата каждого элемента можно найти информацию о символе элемента, атомном номере, атомной массе, электроотрицательности, электронной конфигурации и валентных числах. Внизу периодической таблицы находится двухрядный блок элементов, содержащих лантаноиды и актиниды.Эти группы классифицируются как внутренние переходные металлы.
Металлы находятся слева, а неметаллы – справа.Кроме того, элементы располагаются в порядке возрастания атомного номера, который представляет собой количество протонов в ядре атома элемента. Строки также организованы таким образом, что элементы с похожими свойствами находятся в одних и тех же столбцах. Внутри квадрата каждого элемента можно найти информацию о символе элемента, атомном номере, атомной массе, электроотрицательности, электронной конфигурации и валентных числах. Внизу периодической таблицы находится двухрядный блок элементов, содержащих лантаноиды и актиниды.Эти группы классифицируются как внутренние переходные металлы.
Химические элементы, классифицированные по группам, периодам и блокам. Группы, также называемые семьями, представляют собой вертикальные столбцы, расположенные в периодической таблице. Группы считаются наиболее важной формой классификации. Многие группы содержат элементы с очень похожими свойствами и имеют специальные названия, такие как галогены и щелочноземельные металлы. Точки состоят из горизонтальных строк таблицы.Так же, как группы содержат определенные тенденции в сходных свойствах, периоды тоже. Например, d-блок содержит ряд переходных металлов. Блоки важны как различные области периодической таблицы из-за внешней оболочки, состоящей из выборов внутри атомов элементов. Блоки ориентированы на эту внешнюю оболочку. Блоки периодической таблицы включают s-блок, p-блок, d-блок и f-блок. Другие группы включают бедные металлы, переходные металлы, металлоиды и платиновую группу.
ХИМИЧЕСКИЕ СВОЙСТВАРасположение элементов в периодической таблице чрезвычайно важно из-за тенденций изменения химических свойств в группах и строках.Свойства элемента можно фактически предсказать, основываясь на его расположении в таблице. Важно помнить, что тренды действуют по-разному при перемещении по таблице вертикально и горизонтально. Тенденции внутри групп объясняются общей электронной конфигурацией в их валентных оболочках. Это также создает сходство в атомном радиусе, электроотрицательности и энергии ионизации. Сверху группы вниз атомные радиусы элементов увеличиваются. Точно так же энергия ионизации и электроотрицательность уменьшаются из-за электронной конфигурации.Периоды также обладают аналогичными тенденциями в электроотрицательности, энергии ионизации, атомных радиусах, а также сродстве к электрону. Двигаясь от левой части таблицы Менделеева к правой, атомные радиусы уменьшаются, что приводит к увеличению энергии ионизации. Кроме того, при движении слева направо возрастают электроотрицательность и сродство к электрону.
ИНТЕРАКТИВНЫЕ РЕСУРСЫПериодическая таблица: интерактивная таблица с подробной информацией по каждому элементу.
Периодическая таблица химических элементов: интерактивный ресурс для изучения отдельных элементов.
Периодическая таблица: интерактивная таблица с биографией Дмитрия Менделеева.
Электроны и периодическая таблица: ресурс о важности электронной конфигурации и периодических тенденций.
Enhanced NMR Periodic Table: еще одна интерактивная таблица с интерактивными элементами от Техасского университета A&M.
2.1.1: Периодическая таблица – Chemistry LibreTexts
Цели обучения
- Ознакомиться с историей периодической таблицы Менделеева.
Современная таблица Менделеева сформировалась в результате долгой истории попыток химиков расположить элементы в соответствии с их реакционной способностью и другими свойствами, чтобы помочь в прогнозировании химического поведения. Теперь, когда мы расположили таблицу в соответствии с электронной структурой, имеет смысл вернуться и взглянуть на более ранние попытки в свете того, что мы знаем об электронной структуре.
Одним из первых, кто предложил такое расположение, был немецкий химик Йоханнес Доберейнер (1780–1849), который заметил, что многие из известных элементов могут быть сгруппированы в триады, наборы из трех элементов, которые имеют сходные свойства, например, хлор, бром и йод; или медь, серебро и золото.Доберейнер предложил сгруппировать все элементы в такие триады, но последующие попытки расширить его концепцию оказались безуспешными. Теперь мы знаем, что части периодической таблицы – в частности, блок d – содержат триады элементов с существенным сходством. Средние три члена большинства других столбцов, такие как сера, селен и теллур в группе 16 или алюминий, галлий и индий в группе 13, также имеют удивительно похожий химический состав.
К середине 19 века атомные массы многих элементов были определены.Английский химик Джон Ньюлендс (1838–1898), предположив, что химический состав элементов может быть связан с их массами, расположил известные элементы в порядке увеличения атомной массы и обнаружил, что каждый седьмой элемент имеет аналогичные свойства (рис. 3.4.1). . Поэтому Ньюлендс предположил, что элементы можно разделить на октавы: группу из семи элементов (не считая благородных газов, которые были неизвестны в то время), которые соответствуют горизонтальным рядам в элементах основной группы.К сожалению, «закон октав» Ньюлендса, похоже, не работал для элементов тяжелее кальция, и его идея публично высмеивалась. На одной из научных встреч Ньюлендса спросили, почему он не расположил элементы в алфавитном порядке, а не по атомной массе, поскольку это имело бы такой же смысл! На самом деле Ньюлендс был на правильном пути – за некоторыми исключениями, атомная масса действительно увеличивается с атомным номером, и аналогичные свойства проявляются каждый раз, когда заполняется набор из нс 2 np 6 подоболочек.Несмотря на то, что в таблице Ньюлендса не было логического места для элементов блока d , в 1887 году Лондонское королевское общество наградило его за идею за свою идею.
Джон Ньюлендс (1838–1898)
Ньюлендс заметил, что свойства элемента повторяются каждый седьмой (или кратный семи) элемент, как музыкальные ноты повторяются каждую восьмую ноту.
Рисунок 3.4.1 Расположение элементов в октавах, предложенное Newlands: Представленная здесь таблица сопровождала письмо 27-летнего Ньюлендса редактору журнала Chemical News , в котором он писал : «Если элементы расположены в порядке их эквивалентов с небольшими перестановками, как в прилагаемой таблице, можно заметить, что элементы, принадлежащие к одной группе, обычно появляются на одной горизонтальной линии.Также будет видно, что количество аналогичных элементов обычно различается либо на 7, либо на несколько кратных семи; другими словами, члены одной и той же группы стоят по отношению друг к другу в таком же отношении, как концы одной или нескольких октав в музыке. Таким образом, в группе азота между азотом и фосфором находится 7 элементов; между фосфором и мышьяком – 14; между мышьяком и сурьмой – 14; и, наконец, между сурьмой и висмутом, 14 также. Я предлагаю условно обозначить это своеобразное отношение закон октав как .Я и т. Д. Джон А. Р. Ньюлендс, F.C.S. Лаборатория, 19, Грейт-Сент-Хеленс, штат Коннектикут, 8 августа 1865 года.Периодическая таблица приобрела свою современную форму благодаря работам немецкого химика Юлиуса Лотара Мейера (1830–1895) и русского химика Дмитрия Менделеева (1834–1907), оба из которых сосредоточились на взаимосвязи между атомной массой и различными физическими и химическими веществами. характеристики. В 1869 году они независимо друг от друга предложили по существу идентичное расположение элементов. Мейер выровнял элементы в своей таблице в соответствии с периодическими изменениями простых атомных свойств, таких как «атомный объем» (рис. 3.{3} / моль \ справа) \ tag {3.4.1} \)
Как показано на рисунке 3.4.2, щелочные металлы имеют самые высокие молярные объемы твердых элементов. На графике Мейера зависимости атомного объема от атомной массы неметаллы находятся на восходящей части графика, а металлы – на пиках, во впадинах и на спусках.
Дмитрий Менделеев (1834–1907)
Когда стеклянный завод его семьи был разрушен пожаром, Менделеев переехал в Санкт-Петербург, Россия, изучать науку.Он заболел и не ожидал, что выздоровеет, но защитил докторскую диссертацию с помощью своих профессоров и сокурсников. Помимо таблицы Менделеева, еще одним вкладом Менделеева в науку стал выдающийся учебник The Principles of Chemistry , которым пользовались многие годы.
Рисунок 3.4.2 Изменение атомного объема в зависимости от атомного номера, адаптировано из графика Мейера 1870: Обратите внимание на на периодическое увеличение и уменьшение атомного объема.Поскольку на момент составления этого графика благородные газы еще не были обнаружены, пики соответствуют щелочным металлам (группа 1).Периодическая таблица Менделеева
Менделеев, который впервые опубликовал свою периодическую таблицу в 1869 году (рис. 3.4.3), обычно считается создателем современной периодической таблицы. Ключевое различие между его расположением элементов и расположением элементов Мейера и других состоит в том, что Менделеев не предполагал, что все элементы были обнаружены (на самом деле в то время было известно только около двух третей встречающихся в природе элементов).Вместо этого он намеренно оставил пробелы в своей таблице с атомными массами 44, 68, 72 и 100 в надежде, что элементы с такими атомными массами будут обнаружены. Эти заготовки соответствуют элементам, которые мы теперь знаем как скандий, галлий, германий и технеций.
Рисунок 3.4.3 Периодическая таблица Менделеева, опубликованная в немецком журнале Annalen der Chemie und Pharmacie в 1872 г .: Заголовки столбцов «Reihen» и «Gruppe» на немецком языке означают «строка» и «группа». Формулы указывают тип соединений, образованных каждой группой, где «R» означает «любой элемент», и используются верхние индексы там, где мы теперь используем нижние индексы.Атомные массы показаны после знаков равенства и увеличиваются в каждой строке слева направо.Группы в таблице Менделеева определяются тем, сколько атомов кислорода или водорода необходимо для образования соединений с каждым элементом. Например, в группе I два атома водорода (H), лития (Li), натрия (Na) и калия (K) образуют соединения с одним атомом кислорода. В группе VII один атом фтора (F), хлора (Cl) и брома (Br) реагирует с одним атомом водорода. Обратите внимание, как у этого подхода есть проблемы с переходными металлами.Примерно до 1960 года прямоугольный стол, созданный на основе таблицы Менделеева, основанный на реакционной способности, был стандартом в передней части лекционных залов по химии.
Наиболее убедительным свидетельством в пользу расположения элементов Менделеева было открытие двух ранее неизвестных элементов, свойства которых полностью соответствовали его предсказаниям (Таблица 3.4.1). Два пустых места, которые Менделеев оставил в своей исходной таблице, находились под алюминием и кремнием в ожидании открытия двух еще неизвестных элементов: алюминия eka и кремния eka (на санскрите eka , что означает « один », как в« один за пределами алюминия »).Наблюдаемые свойства галлия и германия соответствовали свойствам алюминия eka и кремния eka настолько хорошо, что как только они были открыты, периодическая таблица Менделеева быстро получила признание.
Таблица 3.4.1 Сравнение свойств, предсказанных Менделеевым в 1869 г. для алюминия eka и кремния eka со свойствами галлия (обнаружен в 1875 г.) и германия (обнаружен в 1886 г.)
| Имущество | eka -Алюминий (прогнозируемый) | Галлий (наблюдаемый) | eka -Кремний (прогнозируемый) | Германий (наблюдаемое) |
|---|---|---|---|---|
| атомная масса | 68 | 69.723 | 72 | 72,64 |
| элемент | металл | металл | грязно-серый металл | серо-белый металл |
| низкий mp * | т.пл. = 29,8 ° C | высокая МП | т.пл. = 938 ° C | |
| d = 5,9 г / см 3 | d = 5.91 г / см 3 | d = 5,5 г / см 3 | d = 5,323 г / см 3 | |
| оксид | E 2 O 3 | Ga 2 O 3 | EO 2 | GeO 2 |
| d = 5,5 г / см 3 | d = 6.0 г / см 3 | d = 4,7 г / см 3 | d = 4,25 г / см 3 | |
| хлорид | ECl 3 | GaCl 3 | ECl 4 | GeCl 4 |
| летучие | т.пл. = 78 ° C т.кип. * = 201 ° C | т.кип. <100 ° C | т.кип. = 87 ° C | |
| * т.пл. = точка плавления; bp = точка кипения. | ||||
Когда химические свойства элемента предполагали, что ему могло быть отведено неправильное место в более ранних таблицах, Менделеев тщательно пересмотрел его атомную массу. Он обнаружил, например, что ранее сообщенные атомные массы бериллия, индия и урана были неверными. Первоначально сообщалось, что атомная масса индия составляет 75,6, исходя из предполагаемой стехиометрии InO для его оксида. Если бы эта атомная масса была правильной, то индий нужно было бы поместить в середину неметаллов, между мышьяком (атомная масса 75) и селеном (атомная масса 78).Однако, поскольку элементарный индий представляет собой серебристо-белый металл , Менделеев предположил, что стехиометрия его оксида на самом деле была In 2 O 3 , а не InO. Это означало бы, что атомная масса индия на самом деле была 113, что помещало этот элемент между двумя другими металлами, кадмием и оловом.
Одной из групп элементов, отсутствующих в таблице Менделеева, были благородные газы, все они были открыты более 20 лет спустя, между 1894 и 1898 годами, сэром Уильямом Рамзи (1852–1916; Нобелевская премия по химии 1904 года).Изначально Рамзи не знал, где разместить эти элементы в периодической таблице. Аргон, открытый первым, имел атомную массу 40. Это было больше, чем у хлора, и сравнимо с массой калия; поэтому Рамзи, используя те же рассуждения, что и Менделеев, решил поместить благородные газы между галогенами и щелочными металлами.
Роль атомного номера в Периодической таблице
Несмотря на свою полезность, периодическая таблица Менделеева была полностью основана на эмпирических наблюдениях, подкрепленных очень слабым пониманием.Только в 1913 году молодой британский физик Х. Дж. Мозли (1887–1915), анализируя частоты рентгеновских лучей, излучаемых элементами, обнаружил, что в основе порядка элементов лежит атомный номер , а не атомная масса. Мозли предположил, что размещение каждого элемента в его серии соответствовало его атомному номеру Z , который представляет собой количество положительных зарядов (протонов) в его ядре. Например, аргон, хотя и имеет атомную массу больше, чем у калия (39.9 а.е.м. против 39,1 а.е.м., соответственно), в периодической таблице располагалось с до калия. Анализируя частоты испускаемых рентгеновских лучей, Мозли заметил, что атомный номер аргона равен 18, а калия – 19, что указывает на то, что они действительно были размещены правильно. Мозли также заметил три пробела в своей таблице частот рентгеновского излучения, поэтому он предсказал существование трех неизвестных элементов: технеция ( Z = 43), открытого в 1937 году; прометий ( Z = 61), открытый в 1945 г .; и рений ( Z = 75), открытый в 1925 г.
Х. Дж. Мозли (1887–1915)
Мозли оставил свою исследовательскую работу в Оксфордском университете, чтобы присоединиться к британской армии в качестве офицера связи во время Первой мировой войны. Он был убит во время битвы при Галлиполи в Турции.
Пример 3.4.1
До его открытия в 1999 году некоторые теоретики полагали, что в природе существует элемент с Z из 114. Используйте рассуждения Менделеева, чтобы назвать элемент 114 как eka -______; затем определите известный элемент, химический состав которого, по вашему мнению, будет наиболее близок к химическому составу элемента 114.
Дано: атомный номер
Запрошено: имя с префиксом eka –
Стратегия:
A Используя таблицу Менделеева, найдите строку n = 7. Определите местонахождение неизвестного элемента с помощью Z = 114; затем определите известный элемент, который находится прямо над этим местом.
B Назовите неизвестный элемент, используя префикс eka – перед именем известного элемента.
Решение:
A Строку n = 7 можно заполнить, допустив существование элементов с атомными номерами больше 112, которые находятся под ртутью (Hg). Если подсчитать три прямоугольника вправо, получится элемент 114, который находится прямо под свинцом (Pb). B Если бы Менделеев был жив сегодня, он бы назвал элемент 114 eka – свинцом.
Упражнение
Используйте рассуждения Менделеева, чтобы назвать элемент 112 как eka -______; затем определите известный элемент, химический состав которого, по вашему мнению, будет наиболее близок к химическому составу элемента 112.
Ответ: эка -ртуть
Сводка
В периодической таблице элементы расположены в соответствии с их электронными конфигурациями, так что элементы в одном столбце имеют одинаковые валентные электронные конфигурации. Периодические изменения размера и химических свойств являются важными факторами, определяющими типы химических реакций, которым подвергаются элементы, и типы химических соединений, которые они образуют. Современная таблица Менделеева основана на эмпирических корреляциях таких свойств, как атомная масса; Ранние модели, использующие ограниченные данные, отметили существование триад и октав элементов с аналогичными свойствами.Периодическая таблица приобрела свою нынешнюю форму благодаря работе Дмитрия Менделеева и Юлиуса Лотара Мейера, которые оба сосредоточили внимание на взаимосвязи между атомной массой и химическими свойствами. Мейер расположил элементы по их атомному объему, который сегодня эквивалентен молярному объему , определяемому как деление молярной массы на молярную плотность. Корреляция с электронной структурой атомов была сделана, когда Г. Дж. Мозли показал, что периодическое расположение элементов определяется атомным номером, а не атомной массой.
Ключевые выводы
- Элементы в таблице Менделеева расположены в соответствии с их свойствами, а таблица Менделеева служит помощником в прогнозировании химического поведения.
Концептуальные проблемы
Йоханнесу Доберейнеру приписывают разработку концепции химических триад. Какие из 15 элементов группы вы ожидаете составить триаду? Ожидаете ли вы, что B, Al и Ga будут действовать как триада? Обоснуйте свои ответы.
Несмотря на то, что Доберейнер, Ньюлендс, Мейер и Менделеев внесли свой вклад в разработку современной таблицы Менделеева, Менделеев приписывают ее происхождение. Почему периодическая таблица Менделеева была принята так быстро?
Как вклад Мозли в разработку таблицы Менделеева объяснил расположение благородных газов?
Схема именования eka , разработанная Менделеевым, использовалась для описания неоткрытых элементов.
- Используйте этот метод присвоения имен, чтобы предсказать атомный номер eka -ртути, eka -астатина, eka -таллия и eka -гафния.
- Используя префикс eka , идентифицируйте элементы с этими атомными номерами: 79, 40, 51, 117 и 121.
Числовая задача
На основании предоставленных данных заполнить таблицу.
Виды Молярная масса (г / моль) Плотность (г / см 3 ) Молярный объем (см 3 / моль) А 40.078 25,85 B 39,09 0,856 С 32,065 16,35 D 1,823 16.98 E 26,98 9,992 Ф 22,98 0,968 Постройте график зависимости молярного объема от молярной массы этих веществ. Согласно Мейеру, какие металлы, а какие – неметаллы?
Ответ
Виды Молярная масса (г / моль) Плотность (г / см 3 ) Молярный объем (см 3 / моль) А 40.078 1,550 25,85 B 39,09 0,856 45,67 С 32,065 1,961 16,35 D 30.95 1,823 16,98 E 26,98 2,700 9,992 Ф 22,98 0,968 23,7 Мейер обнаружил, что щелочные металлы имеют самые высокие молярные объемы, и что молярные объемы неуклонно уменьшаются с увеличением атомной массы, затем выравниваются и, наконец, снова возрастают.Элементы, расположенные на восходящей части графика зависимости молярного объема от молярной массы, обычно были неметаллами. Если мы посмотрим на график данных в таблице, мы можем сразу идентифицировать те элементы с наибольшими молярными объемами (A, B, F) как металлы, расположенные в левой части периодической таблицы. Элемент с наименьшим молярным объемом (E) – алюминий. График показывает, что последующие элементы (C, D) имеют молярные объемы больше, чем у E, но меньше, чем у A и B.Таким образом, C и D, скорее всего, будут неметаллами (что имеет место: C = сера, D = фосфор).
Авторы и авторство
Изменено Джошуа Халперн
Видео с TED-Ed Lou Serocp
Отчет о тенденциях| Курс неорганической химии
Джессика Камби
Кортни Харт
Ручи Пател
Кори Прикетт
Периодические тенденции
Электроотрицательность определяется как способность атома притягивать связывающие пары электронов путем определения того, является ли молекула полярной, неполярной или ионной.Полярность определяется разностью двух атомов. Молекула неполярна, если разница меньше 0,5, полярная, если между 0,5 и 2,0, и, наконец, ионная, если разница больше 2,0. Например, HCL считается неполярным. [2,5 (Cl) – 2,1 (H) = 0,4] Поскольку фтор является наиболее электроотрицательным атомом, угол притяжения атома увеличивается вверх по столбцу и поперек периодической таблицы. Следовательно, электроотрицательность атомов должна уменьшаться в обратном направлении, но почему? Поскольку притяжение электронов зависит от количества протонов в ядре и расстояния от ядра, по мере того, как элементы располагаются при движении вниз по столбцу, увеличивается атомный радиус, перемещая протоны дальше от ядра, что приводит к более слабому тянуть.Кроме того, количество протонов в ядре отражает электроотрицательность атома, потому что перемещение по столу увеличивает количество зарядов на ядре, что приводит к более сильному сродству электронов к связывающим электронам пары. Исключение из тенденции – благородные газы, потому что они не образуют связи.
Диаграмма электроотрицательности
Сродство к электрону – это количество энергии, которое выделяется, когда нейтральный газообразный атом получает один электрон. Общие тенденции сродства к электрону увеличиваются слева направо в течение периода и уменьшаются сверху вниз в группе.По мере увеличения атомного номера эффективный заряд ядра увеличивается, а это означает, что он способен стабилизировать заряд для каждого дополнительного электрона. Таким образом, сродство к электрону будет увеличиваться слева направо. Более того, по мере того, как размер атома увеличивается в периодической таблице сверху вниз, маловероятно, что атом присоединится к электрону, потому что притяжение к ядру уменьшается. Следовательно, сродство к электрону уменьшается сверху вниз. Важные исключения из этой тенденции – от группы 1A к группе 2A и группы 5A к группе 6A.В этих двух исключениях сродство к электрону уменьшается, а не увеличивается. Это потому, что эти атомы стабильны из-за наполовину заполненного энергетического состояния. Как показано на рисунке ниже, при переходе от группы 1A к группе 2A аффинности уменьшаются: это также показано при переходе от группы 5A к группе 6A. Однако, если посмотреть на остальные элементы, сродство к электрону имеет тенденцию увеличиваться слева направо и уменьшаться сверху вниз.
Диаграмма сродства электронов
Периодическая тенденция изменения радиуса атома является мерой размера атома.Это можно сделать разными способами, наиболее распространенным из которых является среднее расстояние от ядра одного связанного атома до ядра его соседа.
Общая тенденция заключается в том, что радиусы уменьшаются с каждым периодом, увеличиваясь по каждой группе. Это связано с теорией электронных оболочек, согласно которой электроны добавляются к существующим внутренним электронным оболочкам и после заполнения начинают добавляться к внешним оболочкам. Исключением из общей тенденции являются благородные газы, которые по существу не могут быть измерены из-за их октетной стабильности и неспособности образовывать стабильные связи.Переходные металлы в группах 12-15 являются исключением из-за того, что электроны добавляются к внутренним оболочкам раньше, чем к внешним оболочкам. Это защищает электроны внешней оболочки от притяжения протонов в ядре, создавая больший радиус.
Энергия ионизации – это наименьшее количество энергии, необходимое для удаления электрона из газового атома. Обычно энергия ионизации увеличивается с течением времени и уменьшается с течением времени по группе. Эта тенденция связана с эффектами ядерного заряда, уровней энергии и экранирования.По мере прохождения периода притяжение между ядром и электронами (заряд ядра) увеличивается, что затрудняет удаление внешнего электрона. Уменьшение энергии ионизации, идущей вниз по таблице, происходит из-за увеличения количества уровней энергии, которые действуют как экраны. Чем больше уровней энергии, тем дальше от ядра находится внешний электрон, поэтому внешний электрон может быть легко удален. Есть несколько исключений из тенденции ионизации. Бериллий и бор – одно из этих исключений.Бор должен иметь более высокую энергию ионизации, чем бериллий, но это не так. Это вызвано тем, что бериллий имеет полную 2-секундную подоболочку, что делает его стабильным. 2p-электрон из бора удалить легче, чем 2s-электрон из бериллия. Еще одно исключение из правил – ртуть.
График данных, сравнивающий температуру кипения с атомным номером, имеет определяемую тенденцию. Общая тенденция состоит в том, что с увеличением атомного номера температура кипения увеличивается из-за большей энергии ионизации.Это вызвано наличием более стабильной внешней оболочки, которая влияет на силы Ван-дер-Ваала между молекулами. Электроотрицательность атома также влияет на температуру кипения. Это притяжение требует больше энергии для изменения состояния элемента, что приводит к более высокой температуре кипения.
СвязанныеПразднование Периодической таблицы
doi: 10.2138 / gselements.15.5.295
Нэнси Росс
Периодическая таблица химических элементов – одно из самых значительных достижений в науке, потому что она упорядочивает 118 известных элементов в обманчиво простом порядке, раскрывающем их свойства.Так как же возник этот «Розеттский камень природы»? Скорее всего, вы ответите Дмитрию Менделееву, русскому химику, который в 1869 году опубликовал версию таблицы Менделеева, которую мы знаем сегодня. Его таблица выражает периодический закон: элементы, расположенные в соответствии с размером их атомного веса, проявляют периодические свойства. В ознаменование 150-летия этого великого достижения Организация Объединенных Наций и ЮНЕСКО объявили 2019 год Международным годом Периодической таблицы элементов. Но заслуживает ли Менделеев всей заслуги? Научные открытия редко возникают изолированно; скорее, вклад исследователей на протяжении многих лет приводит к общей картине, которая в конечном итоге вырисовывается.Но иногда научные открытия делают одновременно разные исследователи. Такова история периодической таблицы.
Среди критических событий, которые привели к открытию таблицы Менделеева, было появление теории атома, которая была первоначально предложена в 1808 году Джоном Далтоном, британским наставником и школьным учителем. Ключевым достижением было присвоение Дальтоном относительных весов атомам элементов. Но как получить абсолютный вес атома? В 1811 году итальянский физик и математик Амедео Авогадро предложил идею вычисления атомного веса газов, но его гипотеза не получила широкого признания.Примерно 50 лет спустя итальянский химик Станислао Канниццаро возродил идеи Авогадро и показал, как можно однозначно вычислить атомный вес. Статья Канниццаро, опубликованная в местном журнале в Пизе (Италия), не привлекла много читателей и была переиздана в виде брошюры в 1859 году. Затем Канниццаро посетил конференцию, которая изменила ход истории периодической таблицы Менделеева. В 1860 году в Карлсруэ (Германия) состоялся первый международный химический конгресс, на котором присутствовали 140 ведущих химиков мира.Единственная цель встречи заключалась в том, чтобы разобраться в основных единицах химического взаимодействия и правильных методах определения однозначного атомного веса. Защита Канниццаро идей Авогадро вызвала большой интерес, и копии его брошюры были распространены. Действия Канниццаро послужили катализатором для разработки современной таблицы Менделеева. Химики Лотар Мейер, Уильям Одлинг и Дмитрий Менделеев посетили конференцию и были вдохновлены работой Канниццаро.
Рисунок 1. Модель де Шанкуртуа на теллурическом изображении, показывающая периодическое расположение элементов.
Французский геолог и минералог Александр-Эмиль Бегуйе де Шанкуртуа первым расположил химические элементы в порядке их атомного веса. Он разработал трехмерный спиральный график и нанес атомные веса на поверхность цилиндра, в результате чего аналогичные элементы были помещены в соответствующие точки над или под друг другом на цилиндре (рис. 1). Он представил свои идеи Французской академии наук и опубликовал свою работу в 1862 году.К сожалению, оригинальная диаграмма не вошла в публикацию, что затрудняет понимание статьи. Хотя позже де Шанкуртуа переиздал свою работу с диаграммой, химики ее в значительной степени проигнорировали. После этого он, казалось, потерял интерес к своей идее и вернулся к другим научным изысканиям.
Вскоре последовали новые открытия периодической системы элементов. Джон Ньюлендс, британский сахарный химик и частный преподаватель химии, заметил тенденции между элементами и их весом и опубликовал свой «закон октав» в 1865 году.Подобно де Шанкуртуа, работы Ньюлендса не привлекали особого внимания, и его рисунок не очень хорошо поддерживался. Через четыре года после Карлсруэ британский химик Уильям Одлинг опубликовал таблицу, включающую 57 элементов. Однако система Одлинга также не оказала большого влияния, и он не стал ее развивать. Густав Хинрикс, датчанин, иммигрировавший в Соединенные Штаты, опубликовал уникальную периодическую систему с элементами в форме «велосипедного колеса» с группами элементов, отображенными в виде спиц. Лотар Мейер, влиятельный немецкий химик, создал несколько версий таблицы Менделеева, начиная с 1864 года.К сожалению, работа Мейера не была опубликована до 1870 года, через год после периодической таблицы Менделеева 1869 года, поэтому его работы затмеваются Менделеевым.
История периодической таблицы Менделеева – замечательная история, включающая открытия, сделанные шестью разными людьми за семилетний период. Его развитие ускорили важные открытия и события, такие как Конгресс 1860 года. Менделеев, возможно, не был первым, кто разработал периодическую систему элементов, но он был мастером ее использования.Открытие таблицы Менделеева в том виде, в котором мы ее знаем сейчас, в 1869 году произвело революцию, поскольку освободило химическую науку от ассоциаций со средневековым мистицизмом алхимии. Таблица Менделеева даже давала намек на существование субатомной структуры, которая будет открыта в следующем столетии.
Из истории периодической таблицы можно извлечь много уроков. Открытия четырех из шести первооткрывателей таблицы были признаны только через много лет после их публикации.Мейер и Менделеев оба активно продвигали свои версии периодической таблицы Менделеева, но Менделеев – это имя, которое мы узнаем, потому что его более полная версия была опубликована до версии Мейера. И сегодняшним ученым, молодым и старым, следует извлечь уроки: широко читайте литературу в областях, выходящих за рамки вашей непосредственной специальности; публиковать широко и разумно; и будьте активны в продвижении своих идей, если они будут подкреплены научными доказательствами.
Как будет стоять периодическая таблица Менделеева в следующие 150 лет? Сколько новых элементов будет открыто? Будут ли эти элементы вести себя так, как предсказывает таблица Менделеева? Могут ли сверхтяжелые ядра образоваться в космосе? Оставайтесь с нами … увлекательная история периодической таблицы продолжается.
Нэнси Л. Росс
Главный редактор
ССЫЛКА
Scerri E (2015) Открытие таблицы Менделеева как случай одновременного открытия. Философские труды Королевского общества A: математические, физические и инженерные науки 373, DOI: 10.1098 / rsta.2014.0172
Периодическая таблица элементов и изотопов ИЮПАК (IPTEI) для образовательного сообщества (Технический отчет ИЮПАК)
IUPAC (Международный союз теоретической и прикладной химии) Периодическая таблица элементов и изотопов (IPTEI) была создана для ознакомления студентов, преподавателей и непрофессионалов с существованием и важностью изотопов химических элементов.IPTEI основан на известной Периодической таблице химических элементов. ИПТЭИ предназначен для размещения на стенах химических лабораторий и учебных аудиторий. Каждая ячейка IPTEI содержит химическое название, символ, атомный номер и стандартный атомный вес элемента. Цветные круговые диаграммы в каждой элементной ячейке отображают стабильные изотопы и относительно долгоживущие радиоактивные изотопы, имеющие характерный земной изотопный состав, который определяет стандартный атомный вес каждого элемента.Цветовая схема ячеек делит 118 элементов на четыре группы: (1) белый цвет означает, что элемент не имеет стандартного атомного веса, (2) синий означает, что элемент имеет только один изотоп, который используется для определения его стандартного атомного веса, т.е. задано как одно значение с неопределенностью, (3) желтый цвет указывает на то, что элемент имеет два или более изотопов, которые используются для определения его стандартного атомного веса, который задается как одно значение с неопределенностью, и (4) розовый указывает на элемент имеет хорошо задокументированное изменение атомного веса, а стандартный атомный вес выражается интервалом.Поэлементный обзор сопровождает IPTEI и включает таблицу всех известных стабильных и радиоактивных изотопов для каждого элемента. Практические применения изотопных измерений и технологий включены в следующие области: судебная медицина, геохронология, науки о земных системах, экология и науки о здоровье человека, включая медицинскую диагностику и лечение.
Эксперименты ученых с этим высокорадиоактивным элементом выявили некоторые неожиданные свойства – ScienceDaily
Поскольку элемент 99 – эйнштейний – был обнаружен в 1952 году в Национальной лаборатории им. Лоуренса Беркли Министерства энергетики США из обломков первой водородной бомбы. , ученые провели с ним очень мало экспериментов, потому что его очень сложно создать и он исключительно радиоактивен.Команда химиков из лаборатории Беркли преодолела эти препятствия, чтобы сообщить о первом исследовании, характеризующем некоторые из его свойств, открывающем дверь к лучшему пониманию оставшихся трансурановых элементов ряда актинидов.
Опубликовано в журнале Nature , исследование «Структурные и спектроскопические характеристики комплекса эйнштейний», проведенное совместно ученым из лаборатории Беркли Ребеккой Абергель и ученым из Национальной лаборатории Лос-Аламоса Стошем Козимором, в нем приняли участие ученые из двух лабораторий, Калифорнийский университет в Беркли и Джорджтаунский университет, некоторые из которых являются аспирантами и докторантами.Имея менее 250 нанограмм элемента, команда впервые измерила расстояние связи эйнштейния, основное свойство взаимодействия элемента с другими атомами и молекулами.
«Об эйнштейнии известно немного, – сказал Абергель, возглавляющий группу по химии тяжелых элементов в лаборатории Беркли и доцент кафедры ядерной инженерии Калифорнийского университета в Беркли. «Это замечательное достижение, что мы смогли работать с этим небольшим количеством материала и заниматься неорганической химией.Это важно, потому что чем больше мы понимаем его химическое поведение, тем больше мы можем применить это понимание для разработки новых материалов или новых технологий, не обязательно только с эйнштейнием, но и с остальными актинидами. И мы можем установить тенденции в периодической таблице ».
Недолговечные и труднодоступные
Абергель и ее команда использовали экспериментальные установки, недоступные несколько десятилетий назад, когда был впервые обнаружен эйнштейний, – Лаборатория молекулярного литья в Беркли и Стэнфордский источник синхротронного излучения (SSRL) в Национальной ускорительной лаборатории SLAC, оба пользовательских объекта Управления науки Министерства энергетики – для проведения люминесцентной спектроскопии. и эксперименты по рентгеновской абсорбционной спектроскопии.
Но во-первых, получение образца в пригодном для использования виде было почти половиной успеха. «Вся эта газета – длинная череда печальных событий», – криво сказала она.
Материал был изготовлен в реакторе изотопов с высоким потоком в Национальной лаборатории Ок-Ридж, одном из немногих мест в мире, способных производить эйнштейний, который включает бомбардировку кюриевых мишеней нейтронами, чтобы запустить длинную цепочку ядерных реакций. Первая проблема, с которой они столкнулись, заключалась в том, что образец был загрязнен значительным количеством калифорния, поскольку получение чистого эйнштейния в пригодном для использования количестве чрезвычайно сложно.
Таким образом, им пришлось отказаться от своего первоначального плана использования рентгеновской кристаллографии, которая считается золотым стандартом для получения структурной информации о высокорадиоактивных молекулах, но требует чистого образца металла, и вместо этого придумали новый способ получения образцы и использовать методы исследования конкретных элементов. Исследователи из Лос-Аламоса оказали критически важную помощь на этом этапе, разработав держатель для образцов, который уникально подходит для решения проблем, присущих эйнштейнию.
Тогда еще одной проблемой было бороться с радиоактивным распадом.Команда лаборатории Беркли провела свои эксперименты с эйнштейнием-254, одним из наиболее стабильных изотопов этого элемента. Его период полураспада составляет 276 дней, то есть время разложения половины материала. Хотя команда смогла провести многие эксперименты до пандемии коронавируса, у них были планы на последующие эксперименты, которые были прерваны из-за отключений, связанных с пандемией. К тому времени, когда им удалось вернуться в свою лабораторию прошлым летом, большая часть образца уже исчезла.
Расстояние до скрепления и за его пределами
Тем не менее, исследователи смогли измерить расстояние связи с эйнштейнием, а также обнаружили некоторое физико-химическое поведение, которое отличалось от того, что можно было бы ожидать от ряда актинидов, которые являются элементами в нижнем ряду периодической таблицы.
«Определение расстояния связи может показаться неинтересным, но это первое, что вам нужно знать о том, как металл связывается с другими молекулами. Какого рода химическое взаимодействие будет иметь этот элемент с другими атомами и молекулами?» – сказал Абергель.
Как только ученые получат эту картину расположения атомов в молекуле, включающей эйнштейний, они могут попытаться найти интересные химические свойства и улучшить понимание периодических тенденций. «Получая эти данные, мы получаем лучшее и более широкое понимание того, как ведет себя весь ряд актинидов.И в этой серии у нас есть элементы или изотопы, которые можно использовать для производства ядерной энергии или радиофармпрепаратов », – сказала она.
Удивительно, но это исследование также дает возможность изучить то, что находится за пределами таблицы Менделеева, и, возможно, обнаружить новый элемент. «Мы действительно начинаем немного лучше понимать, что происходит ближе к концу таблицы Менделеева, и следующее: вы также можете представить себе цель эйнштейния для открытия новых элементов», – сказал Абергель.«Подобно последним элементам, которые были обнаружены за последние 10 лет, таким как теннессин, в котором использовалась мишень из берклия, если бы вы смогли выделить достаточно чистого эйнштейния для создания мишени, вы могли бы начать искать другие элементы и приблизиться к (теоретическому) острову стабильности, “где ядерные физики предсказали, что период полураспада изотопов может составлять минуты или даже дни вместо микросекунд или меньше периодов полураспада, которые являются обычными для сверхтяжелых элементов.
Соавторами исследования были Кори Картер, Кэтрин Шилд, Курт Смит, Летисия Арнедо-Санчес, Трейси Маттокс, Лиана Моро и Корвин Бут из лаборатории Беркли; Захари Джонс и Стош Козимор из Лос-Аламосской национальной лаборатории; и Дженнифер Вакер и Кара Ноуп из Джорджтаунского университета.Исследование было поддержано Управлением науки Министерства энергетики США.
Есть ли конец периодической таблицы Менделеева? | MSUToday
В преддверии 150-летия создания Периодической таблицы химических элементов профессор Мичиганского государственного университета исследует пределы этой таблицы в недавней публикации Nature Physics Perspective.
В следующем году исполняется 150 лет со дня создания таблицы Менделеева. Соответственно, ООН провозгласила 2019 год Международным годом Периодической таблицы химических элементов.В 150 лет таблица все еще растет. В 2016 году было добавлено четыре новых элемента: нихоний, московий, теннессин и оганессон. Их атомные номера – количество протонов в ядре, определяющее их химические свойства и место в периодической таблице, – 113, 115, 117 и 118 соответственно.
Чтобы подтвердить эти последние четыре элемента, потребовалось десятилетие и всемирные усилия. И теперь ученые задаются вопросом: как далеко может зайти эта таблица? Некоторые ответы можно найти в недавнем обзоре Nature Physics Perspective Витека Назаревича, заслуженного профессора физики МГУ и главного научного сотрудника Центра редких изотопных пучков.
Все элементы, содержащие более 104 протонов, помечены как «сверхтяжелые» и являются частью огромной, совершенно неизвестной земли, которую ученые пытаются открыть. Предполагается, что атомы, содержащие до 172 протонов, могут физически образовать ядро, связанное ядерной силой. Эта сила предотвращает его распад, но только на несколько долей секунды.
Эти созданные в лаборатории ядра нестабильны и спонтанно распадаются вскоре после образования. Для тех, кто тяжелее оганессона, это может быть настолько быстрым, что у них не будет достаточно времени, чтобы привлечь и захватить электрон, чтобы сформировать атом.Они проведут всю свою жизнь как скопления протонов и нейтронов.
Если это так, то это бросит вызов сегодняшнему определению и пониманию атомов учеными. Их больше нельзя описать как центральное ядро с электронами, вращающимися вокруг него, так же, как планеты вращаются вокруг Солнца.
А могут ли эти ядра вообще образовываться, пока загадка.
Ученые медленно, но верно ползут в эту область, синтезируя элемент за элементом, не зная, как они будут выглядеть или где будет конец.Поиск элемента 119 продолжается в нескольких лабораториях, в основном в Объединенном институте ядерных исследований в России, в GSI в Германии и RIKEN в Японии.
«Ядерная теория не способна надежно предсказать оптимальные условия, необходимые для их синтеза, поэтому вам придется делать предположения и проводить эксперименты по термоядерному синтезу, пока не найдете что-нибудь. Таким образом можно было бегать годами », – сказал Назаревич.
Хотя новая установка для пучков редких изотопов в МГУ не собирается производить эти сверхтяжелые системы, по крайней мере, в рамках ее нынешней конструкции, она может пролить свет на то, какие реакции могут быть использованы, расширяя границы существующих экспериментальных методов.Если элемент 119 подтвержден, он добавит восьмой период в таблицу Менделеева.
Это было запечатлено в хайку элементалей Мэри Сун Ли:
Поднимется ли занавес?
Вы откроете восьмой акт?
Требовать в центре внимания?
Возможно, открытие не так уж и далеко. «Скоро может быть сейчас или через два-три года», – сказал Назаревич.
Остается еще один интересный вопрос. Могут ли сверхтяжелые ядра образоваться в космосе? Считается, что это может произойти в результате слияния нейтронных звезд, столкновения звезд настолько мощного, что буквально сотрясает саму ткань Вселенной.В звездных средах, подобных этой, где нейтронов много, ядро может сливаться с все большим и большим количеством нейтронов, образуя более тяжелый изотоп. Он будет иметь такое же число протонов и, следовательно, будет тем же элементом, но тяжелее. Проблема здесь в том, что тяжелые ядра настолько нестабильны, что разрушаются задолго до того, как добавятся нейтроны и образуются сверхтяжелые ядра. Это мешает их рождению в звездах. Есть надежда, что с помощью продвинутого моделирования ученые смогут «увидеть» эти неуловимые ядра через наблюдаемые образцы синтезированных элементов.
По мере развития экспериментальных возможностей ученые будут искать эти более тяжелые элементы, чтобы добавить их в модернизированную таблицу. А пока им остается только гадать, какие интересные приложения будут иметь эти экзотические системы.
«Мы не знаем, как они выглядят, и это проблема», – сказал Назаревич. «Но то, что мы узнали до сих пор, может означать конец периодической таблицы в том виде, в котором мы ее знаем».

 Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;