ОглавлениеПРЕДИСЛОВИЕВВЕДЕНИЕ ГЛАВА I.  ОСНОВЫ ФИЗИКО-ХИМИЧЕСКИХ (ИНСТРУМЕНТАЛЬНЫХ) МЕТОДОВ АНАЛИЗА ОСНОВЫ ФИЗИКО-ХИМИЧЕСКИХ (ИНСТРУМЕНТАЛЬНЫХ) МЕТОДОВ АНАЛИЗА§ 1. Особенности физико-химических методов анализа § 2. Области применения инструментальных методов анализа § 3. Анализ веществ высокой чистоты § 4. Повышение чувствительности и точности методов определения следов примесей § 5. Инструментальные методы титрования § 6. Применение физико-химических методов анализа для определения индивидуальных соединений § 7. Применение физико-химических методов для анализа смесей веществ § 8. Классификация инструментальных количественных методов анализа § 9. Электрохимические методы анализа § 10. Спектральные (оптические) методы анализа § 12. Радиометрические методы анализа § 13. Масс-спектрометрические методы анализа § 14. Физико-химический анализ по Н. С. Курнакову § 15. Другие методы анализа ГЛАВА II. ПОТЕНЦИОМЕТРИЯ И ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. Зависимость величины электродных потенциалов от концентрации (активности) § 2.  Применение потенциометрического метода анализа Применение потенциометрического метода анализа§ 3. Потенциометрическое титрование § 4. Потенциометрическое титрование без тока (i=0) § 5. Различные способы нахождения конечной точки потенциометрического титрования § 7. Потенциометрическое титрование под током (i != 0) Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 8. Измерение электродвижущей силы § 9. Установка для поляризации электродов при потенциометрическом титровании под током § 10. Некоторые приборы, применяемые в потенциометрическом титровании § 11. Электроды В. ПРАКТИЧЕСКИЕ РАБОТЫ ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ БЕЗ ТОКА (i=0) § 12. Кислотно-основное титрование § 13. Титрование по методу окисления — восстановления § 14. Титрование по методу осаждения § 15. Титрование по методу комплексообразования ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ ПОД ТОКОМ (i != 0) ГЛАВА III.  КОНДУКТОМЕТРИЯ и КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ КОНДУКТОМЕТРИЯ и КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ§ 1. Удельная и эквивалентная электропроводность § 2. Кондуктометрическне методы анализа § 3. Кислотно-основное титрование § 4. Титрование, основанное на реакциях осаждения § 5. Титрование, основанное на реакциях окисления — восстановления § 6. Титрование, основанное на реакциях комплексообразования Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 7. Измерение электропроводности растворов § 9. Измерения в хронокондуктометрическом титровании В. ПРАКТИЧЕСКИЕ РАБОТЫ § 10. Подготовка к определению §11. Определение индивидуальных кислот методом кондуктометрического титрования § 12. Определение индивидуальных оснований методом кондуктометрического титрования § 13. Анализ смесей оснований методом кондуктометрического титрования § 14. Определение солей методом кондуктометрического титрования § 15. Анализ смесей кислот и солей слабых оснований методом кондуктометрического титрования § 16.  Анализ смесей кислот методом хронокондуктометрического титрования Анализ смесей кислот методом хронокондуктометрического титрованияГЛАВА IV. ВЫСОКОЧАСТОТНОЕ ТИТРОВАНИЕ § 1. Общие положения теории высокочастотного титрования § 2. Физические основы и погрешности метода высокочастотного титрования § 3. Физические основы метода диэлкометрического титрования § 4. Погрешности метода диэлкометрического титрования ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ЕМКОСТНОГО ТИПА § 5. Электрическая эквивалентная схема ячейки и физические процессы, протекающие в ее объеме § 6. Импеданс и полная проводимость ячейки § 7. Характеристические кривые ячейки § 8. Чувствительность ячейки § 9. Критерий применимости и постоянная с-ячейки § 10. Электрическая эквивалентная схема ячейки § 11. Импеданс и характеристические кривые ячейки § 12. Критерий применимости и постоянная L-ячейки § 13.  Влияние на характеристические кривые ячейки ее некомпенсированного электрического поля Влияние на характеристические кривые ячейки ее некомпенсированного электрического поляДИАГРАММЫ СООТВЕТСТВИЯ § 14. Диаграмма соответствия для титрования по активной составляющей полной проводимости § 15. Диаграмма соответствия для титрования по реактивной составляющей полной проводимости § 16. Выбор типа диаграмм Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 18. Классификация аппаратуры высокочастотного метода § 19. Высокочастотные титраторы § 20. Общие правила работы с приборами для высокочастотного анализа В. ПРАКТИЧЕСКИЕ РАБОТЫ § 21. Высокочастотное титрование стандартных растворов § 22. Высокочастотное титрование растворов неизвестной концентрации ГЛАВА V. ПОЛЯРОГРАФИЧЕСКИЙ МЕТОД АНАЛИЗА И АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 1. Предельный, или диффузионный, ток § 2. Возникновение диффузионного тока на твердых микроэлектродах Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ПОЛЯРОГРАФИЧЕСКОГО АНАЛИЗА § 3.  § 4. Электролитическая ячейка § 5. Электролизеры § 6. Электроды сравнения § 7. Снятие полярограммы на полярографической установке с визуальным полярографом § 8. Методы количественного полярографического анализа § 9. Правила техники безопасности при работе с металлической ртутью В. НОВЫЕ НАПРАВЛЕНИЯ В ПОЛЯРОГРАФИИ § 10. Амальгамная полярография с накоплением § 11. Осциллографическая полярография § 12. Переменнотоковая полярография Г. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ ПОЛЯРОГРАФИЧЕСКОГО МЕТОДА АНАЛИЗА § 13. Примеры полярографических определений § 14. Особенности амперометрического титрования Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ § 15. Схема установки и применяемые электроды § 16. Амперометрическое титрование с двумя индикаторными электродами В. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ § 17. Примеры амперометрического титрования ГЛАВА VI.  КУЛОНОМЕТРИЯ И КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ КУЛОНОМЕТРИЯ И КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ§ 1. Сущность и классификация кулонометрических методов ПРЯМАЯ КУЛОНОМЕТРИЯ § 2. Прямая кулонометрия при постоянном потенциале рабочего электрода (прямая потенциостатическая кулонометрия) § 4. Прямая кулонометрия при постоянной силе тока электролиза (прямая амперостатическая кулонометрия) § 5. Использование прямой амперостатической кулонометрии КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ § 6. Кулонометрическое титрование при постоянной силе тока электролиза § 7. Использование амперостатического кулонометрического титрования § 8. Кулонометрическое титрование првд постоянном потенциале рабочего электрода § 9. Особенности кулонометрических методов анализа Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 10. Электроды § 11. Электролизеры § 12. Приборы для измерения количества электричества, израсходованного на электролиз вещества В.  ПРАКТИЧЕСКИЕ РАБОТЫ ПРАКТИЧЕСКИЕ РАБОТЫ§ 14. Работы, выполняемые методом прямой кулонометрии § 15. Работы, выполняемые методом косвенной кулонометрии, или кулонометрического титрования, при постоянной силе тока электролиза ГЛАВА VII. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА § 1. Общая характеристика метода § 2. Классификация методов эмиссионного спектрального анализа § 3. Качественный спектральный анализ § 4. Полуколичественные методы спектрального анализа § 6. Основы фотографического метода эмиссионного количественного анализа § 7. Зависимость между почернением фотопластинки и интенсивностью излучения Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 8. Источники возбуждения спектров § 9. Спектральные приборы § 10. Вспомогательные приборы и принадлежности § 11. Микрофотометр МФ-2 В. ПРАКТИЧЕСКИЕ РАБОТЫ § 12. Качественный анализ при помощи стилоскопа § 13. Качественный анализ фотографическим методом при помощи спектра железа в ультрафиолетовой области § 14.  Полуколичественный анализ Полуколичественный анализ§ 15. Количественный анализ СПЕКТРОФОТОМЕТРИЯ ПЛАМЕНИ § 16. Общая характеристика метода Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 17. Схема установки, применяемой для анализа методом спектрофотометрии пламени В. ПРАКТИЧЕСКИЕ РАБОТЫ § 18. Определения по методу спектрофотометрии пламени АТОМНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ § 19. Общая характеристика метода МОЛЕКУЛЯРНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ § 20. Общая характеристика метода § 21. Законы поглощения света § 22. Отклонения от закона Бугера—Ламберта—Бера § 23. Качественный анализ спектрофотометрическим методом § 24. Количественный анализ спектрофотометрическим методом § 25. Методы определения концентрации веществ, поглощающих в видимой и ультрафиолетовой областях спектра § 26. Определение нескольких компонентов в растворе § 27. Определение концентрации вещества в растворе дифференциальным методом § 28. Выбор толщины слоя и оптимальной концентрации исследуемого раствора § 29.  Выбор длины волны поглощаемого излучения при спектрофотометрических измерениях Выбор длины волны поглощаемого излучения при спектрофотометрических измеренияхБ. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 30. Приборы, применяемые для спектрофотометрического анализа в ультрафиолетовой и видимой областях спектра § 31. Приборы, применяемые для колориметрического анализа § 32. Приборы, применяемые для спектрофотометрического анализа в инфракрасной области спектра § 33. Нулевые растворы В. ПРАКТИЧЕСКИЕ РАБОТЫ § 34. Определение в ультрафиолетовой области спектра § 35. Определение в видимой области спектра § 36. Определение в инфракрасной области спектра СПЕКТРОФОТОМЕТРИЧЕСКИЕ (ФОТОМЕТРИЧЕСКИЕ) МЕТОДЫ ТИТРОВАНИЯ § 37. Общая характеристика метода § 38. Кривые спектрофотометрического титрования Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ТИТРОВАНИЯ § 39. Установки для спектрофотометрического титрования В. ПРАКТИЧЕСКИЕ РАБОТЫ § 40. Спектрофотометрическое титрование НЕФЕЛОМЕТРИЧЕСКИЙ И ТУРБИДИМЕТРИЧЕСКИЙ МЕТОДЫ АНАЛИЗА § 41.  Общая характеристика методов Общая характеристика методовБ. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА § 42. Приборы, применяемые для нефелометрических и турбидиметрических измерений В. ПРАКТИЧЕСКИЕ РАБОТЫ § 43. Нефелометрические и турбидиметрические определения § 44. Фототурбидиметрическое и фотонефелометрическое титрование ГЛАВА VIII. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА § 1. Классификация хроматографических методов анализа § 2. Адсорбционная хроматография § 3. Разновидности газовой хроматографии § 4. Распределительная хроматография § 5. Ионообменная хроматография § 6. Константа ионного обмена § 7. Осадочная хроматография § 8. Окислительно-восстановительная хроматография § 9. Адсорбционно-комплексообразовательная хроматография § 10. Хроматографические колонки, применяемые в адсорбционно-жидкостной хроматографии § 11. Аппаратура, применяемая в газовой хроматографии § 12. Приборы и материалы, применяемые в распределительной хроматографии § 13.  Колонки, применяемые в ионообменной хроматографии Колонки, применяемые в ионообменной хроматографии§ 14. Колонки, применяемые в осадочной и окислительновосстановительной хроматографии В. ПРАКТИЧЕСКИЕ РАБОТЫ § 15. Работы по методу адсорбционной (жидкостной и газовой) хроматографии § 16. Работы по методу распределительной хроматографии § 17. Работы по методу ионообменной хроматографии § 18. Работы по методу осадочной хроматографии § 19. Работы по методу окислительно-восстановительной хроматографии § 20. Работы по методу адсорбционно-комплексообразовательной хроматографии ГЛАВА IX. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА § 1. Виды радиоактивного распада § 2. Скорость распада § 3. Взаимодействие излучения с веществом § 4. Ошибки при измерении радиоактивности Б. ЭЛЕМЕНТЫ ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ С РАДИОАКТИВНЫМИ ВЕЩЕСТВАМИ § 5. Понятия и единицы измерения § 6. Классификация источников радиоактивного излучения и радиоактивных изотопов § 7. Классификация химических операций с радиоактивными веществами § 8.  Устройство лабораторий и классификация работ Устройство лабораторий и классификация работ§ 9. Специальное оборудование для работ с радиоактивными веществами § 10. Средства индивидуальной защиты § 11. Проведение работ в химической лаборатории с радиоактивными веществами § 12. Правила работы с радиоактивными веществами В. МЕТОДЫ РЕГИСТРАЦИИ РАДИОАКТИВНОГО ИЗЛУЧЕНИЯ § 13. Ионизационные методы § 14. Сцинтилляционный метод Г. АППАРАТУРА И ТЕХНИКА ИЗМЕРЕНИЯ РАДИОАКТИВНОСТИ § 15. Радиометрические установки § 16. Измерение радиоактивности § 17. Измерение дозы на рабочем месте, индивидуальной дозы, полученной работающим, и загрязненности рабочих поверхностей, рук и одежды § 18. Абсолютные и относительные измерения активности Д. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ § 19. Приготовление раствора с заданной активностью § 20. Прямое определение ионов химических элементов в растворе с помощью радиоактивных реагентов § 21. Практические работы, выполняемые методом прямого определения § 22.  Метод радиометрического титрования Метод радиометрического титрования§ 23. Практические работы, выполняемые методом радиометрического титрования § 24. Метод изотопного разбавления § 25. Практические работы, выполняемые методом изотопного разбавления § 26. Метод активационного анализа § 27. Практические работы, выполняемые методом активационного анализа § 28. Фотонейтронный метод § 29. Практические работы, выполняемые фотонейтронным методом § 30. Методы определения содержания химических элементов по излучению их естественных радиоактивных изотопов § 31. Практические работы по определению содержания химических элементов методом измерения излучения их естественных радиоактивных изотопов § 32. Методы анализа, основанные на поглощении излучения § 33. Практические работы, выполняемые по методу анализа, основанному на поглощении излучения § 34. Метод, основанный на отражении бетта-излучения § 35. Практические работы, выполняемые по методу, основанному на отражении бетта-излучения ГЛАВА X.  ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДКИХ ЭЛЕМЕНТОВ ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДКИХ ЭЛЕМЕНТОВ§ 1. Работы, выполняемые методом амперометрического титрования § 2. Работы, выполняемые полярографическим методом § 3. Работы, выполняемые фотометрическим методом § 4. Работы, выполняемые экстракционно-фотометрическим методом § 5. Работы, выполняемые спектрофотометрическим методом § 6. Работы, выполняемые флуориметрическим методом § 7. Работы, выполняемые методом потенциометрического титрования ГЛАВА XI. ФИЗИКО-ХИМИЧЕСКИЕ (ИНСТРУМЕНТАЛЬНЫЕ) МЕТОДЫ АНАЛИЗА НЕВОДНЫХ РАСТВОРОВ § 1. Влияние химической природы и физико-химических свойств растворителей на свойства растворенного вещества § 2. Классификация неводных растворителей по их протонно-донорно-акцепторным свойствам § 3. Классификация неводных растворителей по признаку их влияния на относительную силу электролитов § 4. Дифференцирующее действие растворителей § 5. Константы диссоциации, потенциалы полунейтрализации в неводных средах и относительная шкала кислотности § 6.  Шкала pH и константы автопротолиза неводных растворителей Шкала pH и константы автопротолиза неводных растворителей§ 7. Абсолютная (единая) шкала кислотности растворителей § 8. Химико-аналитическое использование неводных растворителей Б. АППАРАТУРА И ТЕХНИКА ТИТРОВАНИЯ НЕВОДНЫХ РАСТВОРОВ § 9. Установки, используемые при амперометрическом титровании неводных растворов § 10. Установки, используемые при потенциометрическом титровании неводных растворов § 11. Установки, используемые при кондуктометрическом титровании неводных растворов § 12. Установки, используемые при высокочастотном титровании неводных растворов § 13. Установки, используемые при спектрофотометрическом титровании неводных растворов В. ПРАКТИЧЕСКИЕ РАБОТЫ § 14. Очистка и обезвоживание неводных растворителей § 15. Титранты, применяемые для титрования кислот и оснований в неводных растворах § 16. Амперометрическое титрование § 17. Методы прямого потенциометрического титрования § 18. Методы косвенного потенциометрического титрования § 19.  Дифференцированное потенциометрическое титрование Дифференцированное потенциометрическое титрование§ 20. Комбинированные методы потенциометрического титрования § 21. Хронопотенциометрическое титрование § 22. Кондуктометрическое титрование § 23. Хронокондуктометрическое титрование § 24. Спектрофотометрическое титрование |
Электродвижущая сила аккумулятора
Можно ли по ЭДС точно судить о степени заряженности аккумулятора?
Электродвижущей силой (ЭДС) аккумулятора называется разность его электродных потенциалов, измеренная при разомкнутой внешней цепи:
Е = φ+ – φ–
где φ+ и φ– – соответственно потенциалы положительного и отрицательного электродов при разомкнутой внешней цепи.
ЭДС батареи, состоящей из n последовательно соединённых аккумуляторов:
Еб = n · Е
В свою очередь, электродный потенциал при разомкнутой цепи в общем случае состоит из равновесного электродного потенциала, характеризующего равновесное (стационарное) состояние электрода (при отсутствии переходных процессов в электрохимической системе), и потенциала поляризации.
Этот потенциал в общем случае определяется как разность между потенциалом электрода при разряде или заряде и его потенциалом в равновесном состоянии в отсутствии тока. Однако следует отметить, что состояние аккумулятора сразу после выключения зарядного или разрядного тока не является равновесным вследствие различия концентрации электролита в порах электродов и межэлектродном пространстве. Поэтому электродная поляризация сохраняется в аккумуляторе довольно длительное время и после отключения зарядного или разрядного тока и характеризует в этом случае отклонение электродного потенциала от равновесного значения за счёт переходного процесса, то есть в основном вследствие диффузионного выравнивания концентрации электролита в аккумуляторе от момента размыкания внешней цепи до установления равновесного стационарного состояния в аккумуляторе.
Химическая активность реагентов, собранных в электрохимическую систему аккумулятора, и, следовательно, изменение ЭДС аккумулятора весьма незначительно зависит от температуры. При изменении температуры от –30°С до+50°С (в рабочем диапазоне для АКБ) электродвижущая сила каждого аккумулятора в батарее изменяется всего на 0,04 В и при эксплуатации аккумуляторов им можно пренебречь.
При изменении температуры от –30°С до+50°С (в рабочем диапазоне для АКБ) электродвижущая сила каждого аккумулятора в батарее изменяется всего на 0,04 В и при эксплуатации аккумуляторов им можно пренебречь.
С повышением плотности электролита ЭДС повышается. При температуре +18°С и плотности 1,28 г/см3 аккумулятор (имеется в виду одна банка) обладает ЭДС равной2,12 В. Аккумуляторная батарея из шести элементов обладает ЭДС равной 12,72 В(6 ? 2,12 В = 12,72 В).
По ЭДС нельзя точно судить о степени заряженности аккумулятора.
ЭДС разряженного аккумулятора с большей плотностью электролита будет выше, чем ЭДС заряженного аккумулятора, но имеющего меньшую плотность электролита. Величина ЭДС исправного аккумулятора зависит от плотности электролита (степени его заряженности) и изменяется от 1,92 до 2,15 В.
При эксплуатации аккумуляторных батарей путём измерения ЭДС можно обнаружить серьёзную неисправность аккумуляторной батареи (замыкание пластин в одной или нескольких банках, обрыв соединительных проводников между банками и тому подобное).
ЭДС измеряют высокоомным вольтметром (внутреннее сопротивление вольтметране менее 300 Ом/В). В ходе выполнения измерений вольтметр присоединяют к выводам аккумулятора или батареи. При этом через аккумулятор (батарею) не должен протекать зарядный или разрядный ток!
***
Электродвижущая сила (ЭДС) – скалярная физическая величина, характеризующая работу сторонних сил, то есть любых сил неэлектрического происхождения, действующих в квазистационарных цепях постоянного или переменного тока.
ЭДС так же, как и напряжение, в Международной системе единиц (СИ) измеряется в вольтах.
Как измеряется ЭДС?
Последняя обновленная дата: 10 февраля 2023 г.
•
Всего просмотров: 165,6K
•
Просмотр сегодня: 2,56K
Ответ
Проверено
165.6K+ виды
HINT: .M.M.F. это полная энергия, обеспечиваемая ячейкой для прохождения единицы заряда через всю цепь, или она описывается как электрический потенциал, создаваемый либо гальванической ячейкой, либо изменением магнитного поля. ЭМП измеряется в вольтах, что соответствует разности потенциалов.
ЭМП измеряется в вольтах, что соответствует разности потенциалов.
Полный ответ:
Электродвижущая сила описывается как электрический потенциал, создаваемый либо гальваническим элементом, либо регулированием магнитного поля. ЭДС – это обычно используемая аббревиатура для электродвижущей силы.
Батарея или генератор используются для преобразования энергии из одного режима в другой. В этих устройствах один конец становится положительно заряженным, а противоположный — отрицательным. Соответственно, электродвижущая сила – это работа, совершаемая над единицей электрического заряда.
В электромагнитном расходомере используется электродвижущая сила, что соответствует закону Фарадея. ЭДС численно обозначается как количество джоулей мощности, отдаваемой источником, общим для каждого кулона, чтобы позволить единичному электрическому заряду течь по цепи.
Э.М.Ф. измеряется в вольтах, что равно разности потенциалов. Один вольт равен одному джоулю на кулон.
Примечание: ЭДС отличается от напряжения на клеммах тем, что напряжение на клеммах описывается как разность потенциалов на концах нагрузки, когда цепь включена. Для сравнения, ЭДС определяется как максимальная разность потенциалов, создаваемая батареей, когда ток отсутствует. Вольтметр используется для измерения напряжения на клеммах, тогда как потенциометр используется для измерения ЭДС.
Для сравнения, ЭДС определяется как максимальная разность потенциалов, создаваемая батареей, когда ток отсутствует. Вольтметр используется для измерения напряжения на клеммах, тогда как потенциометр используется для измерения ЭДС.
Недавно обновленные страницы
Большинство эубактериальных антибиотиков получены из биологии ризобия класса 12 NEET_UG
Биоинсектициды саламин были извлечены из класса 12 Biology NEET_UG
Какое из следующих утверждений, касающихся Baculovirussess 12 Biology Neet_ug
. Какое из следующих утверждений, касающихся Baculovirusses, NEET_UG
. Какое из следующих утверждений, касающихся Baculoviruses, Neet_ug
. муниципальные канализационные трубы не должны быть непосредственно 12 класса биологии NEET_UG
Очистка сточных вод выполняется микробами A B Удобрения 12 класса биологии NEET_UG
Иммобилизация фермента – это конверсия активного фермента класса 12 биологии NEET_UG
Большинство эубактериальных антибиотиков получают из биологического класса Rhizobium 12 NEET_UG
Саламиновые биоинсектициды были извлечены из биологического класса А 12 NEET_UG
12 класс биологии NEET_UG
Канализационные или городские канализационные трубы не должны быть напрямую 12 класс биологии NEET_UG
Очистка сточных вод выполняется микробами A B Удобрения 12 класс биологии NEET_UG
Иммобилизация фермента — это преобразование активного фермента класса 12 в биологии NEET_UG
Тенденции сомнений
Измерение ЭДС с помощью потенциометра
Измерение ЭДС с помощью потенциометраИзмерение ЭДС с помощью потенциометра
Посмотреть оборудование
МОТИВАЦИЯ:
Одним из наиболее важных приборов, используемых в электрической лаборатории, является потенциометр. Потенциометр используется для измерения напряжения или разности потенциалов, и до появления цифрового вольтметра он был практически единственным прибором, способным измерять очень маленькую разность потенциалов. Потенциометр имеет большое преимущество перед обычным вольтметром, поскольку при нормальных условиях работы потенциометр не потребляет ток от источника, напряжение которого измеряется. Таким образом, он не нарушает измеряемую разность потенциалов. Следовательно, потенциометры часто используются для калибровки других приборов, таких как вольтметры и амперметры.
Потенциометр используется для измерения напряжения или разности потенциалов, и до появления цифрового вольтметра он был практически единственным прибором, способным измерять очень маленькую разность потенциалов. Потенциометр имеет большое преимущество перед обычным вольтметром, поскольку при нормальных условиях работы потенциометр не потребляет ток от источника, напряжение которого измеряется. Таким образом, он не нарушает измеряемую разность потенциалов. Следовательно, потенциометры часто используются для калибровки других приборов, таких как вольтметры и амперметры.
В этом лабораторном упражнении мы будем использовать концепцию нулевого потребления тока потенциометром для измерения ЭДС ячейки. Вольтметр, поскольку он должен потреблять некоторый ток, измеряет только напряжение на клеммах ячейки. Однако потенциометр может измерять истинную ЭДС ячейки. Помимо измерения ЭДС элемента, мы будем измерять внутреннее сопротивление элемента.
КОНКРЕТНЫЕ ЗАДАЧИ:
По завершении экспериментального задания вы сможете: (1) определить ЭДС, напряжение на клеммах и внутреннее сопротивление; (2) измерить разность потенциалов с помощью потенциометра; 3) найти внутреннее сопротивление элемента по графику зависимости напряжения на его выводах от тока; и (4) определить максимальную мощность, которую может обеспечить ячейка.
ТЕОРИЯ:
Вольтметр используется для измерения разности потенциалов на некотором элементе цепи. Следовательно, он подключен так, что обеспечивает путь тока через вольтметр, параллельный пути через измеряемый элемент. Это означает, что небольшое изменение тока в остальной части цепи происходит из-за введения вольтметра. В большинстве случаев против этого нет никаких возражений, потому что хороший вольтметр является прибором с высоким сопротивлением и потребляет такой малый ток, что его эффектом можно пренебречь.
Однако, если кто-то заинтересован в определении ЭДС элемента, измерения вольтметра будет недостаточно, поскольку определение ЭДС представляет собой разность потенциалов, доступную, когда ячейка не подает ток. В новой ячейке разница между двумя случаями очень мала, но в старой ячейке разница может быть значительной. Старые аккумуляторы обычно имеют высокое внутреннее сопротивление, и разность потенциалов на клеммах равна ЭДС за вычетом падения потенциала из-за внутреннего сопротивления (r), или
(1)
Например, старый сухой элемент часто регистрирует на вольтметре менее 1,3 В, при этом показания медленно падают, пока вольтметр подключен. Та же ячейка часто показывает ЭДС до 1,45 вольта.
Та же ячейка часто показывает ЭДС до 1,45 вольта.
Потенциометр — это устройство, которое может измерять разность потенциалов, не требуя прохождения тока через ячейку или другое тестируемое устройство. Таким образом, он может точно измерить ЭДС ячейки. В простейшей форме он состоит из провода одинакового сечения, по которому постоянный ток поддерживается работающей батареей В (см. рис. 1). На проводе происходит постепенное падение потенциала от P до M, прямо пропорциональное положению на проводе.
Испытываемая ячейка С соединена параллельно с отрезком провода PM, при этом положительный вывод ячейки находится на положительном конце провода. Если гальванометр включить последовательно с испытательной ячейкой, то можно найти точку Q на проводе РМ, при которой через гальванометр не проходит ток. В этих условиях падение ИК на проводе от P до Q в точности равно ЭДС ячейки C.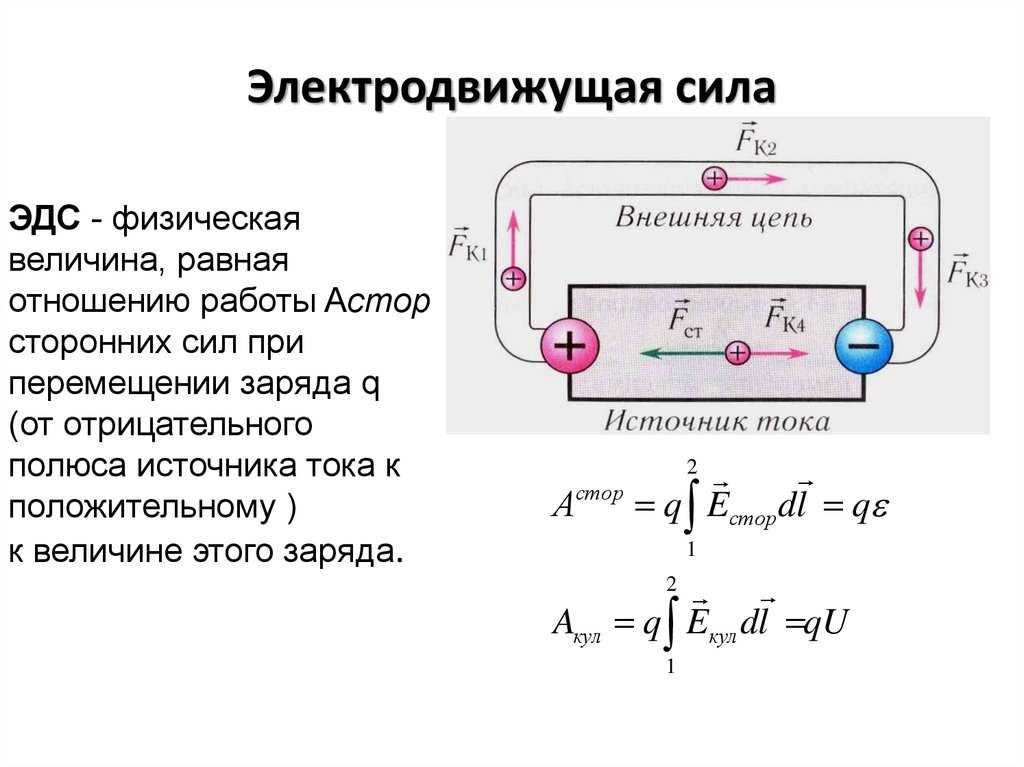
Для другой ячейки D новое положение Q’ может быть расположено так, что падение ИК сегмента PQ’ равно ЭДС ячейки D. Опять же, в этом состоянии ток через ячейку и гальванометр не течет. Поскольку ток через тестируемую ячейку не течет, ток в скользящей проволоке постоянен и позволяет нам записать
(2)
Если в ячейке C или ячейке D известно значение Emf, то это соотношение позволяет нам определить оставшееся или неизвестное значение. Таким образом, известное значение можно использовать для «калибровки» направляющей, чтобы можно было быстро определить неизвестные значения.
ЭКСПЕРИМЕНТАЛЬНАЯ ДЕЯТЕЛЬНОСТЬ:
Аппаратура для этого эксперимента представляет собой улучшенную версию потенциометра со скользящей проволокой, которая позволяет пользователю быстро и напрямую считывать разность потенциалов с точностью до 10 -4 вольт. Основное улучшение заключается в том, что длина направляющей проволочки увеличена за счет набора калиброванных катушек, каждая из которых имеет сопротивление, равное сопротивлению 1-метровой проволочной направляющей. При правильной калибровке каждая катушка имеет падение потенциала 0,1000 вольт, и путем «подсчета», сколько таких катушек последовательно с ползунком, сразу же получается первое десятичное значение показания. 1000-метровый скользящий провод также имеет падение потенциала 0,1000 вольт, что дает линейное падение 0,0001 вольт/миллиметр. Последние три десятичных знака четырехзначного показания находятся путем чтения точки контакта на скользящей проволоке в миллиметрах. Шкала скользящей проволоки специально разработана для облегчения такого чтения.
При правильной калибровке каждая катушка имеет падение потенциала 0,1000 вольт, и путем «подсчета», сколько таких катушек последовательно с ползунком, сразу же получается первое десятичное значение показания. 1000-метровый скользящий провод также имеет падение потенциала 0,1000 вольт, что дает линейное падение 0,0001 вольт/миллиметр. Последние три десятичных знака четырехзначного показания находятся путем чтения точки контакта на скользящей проволоке в миллиметрах. Шкала скользящей проволоки специально разработана для облегчения такого чтения.
:
Прежде чем использовать потенциометр, его необходимо откалибровать. Это делается с помощью известной ЭДС для установки падения потенциала на катушках и скользящем проводе. В этом эксперименте известная ЭДС обеспечивается «Стандартной ячейкой» или ячейкой Вестона, довольно дорогой ячейкой, которая обеспечивает высокую воспроизводимость ЭДС, которая остается постоянной в течение длительных периодов времени. Для того чтобы ячейка сохраняла постоянство своего ЭДС, из ячейки должны отводиться лишь очень малые токи, в несколько микроампер, и только в течение коротких промежутков времени. Стандартная ячейка не имеет никакой другой функции, кроме целей калибровки.
Для того чтобы ячейка сохраняла постоянство своего ЭДС, из ячейки должны отводиться лишь очень малые токи, в несколько микроампер, и только в течение коротких промежутков времени. Стандартная ячейка не имеет никакой другой функции, кроме целей калибровки.
Рисунок 2
Оборудование собирается по схеме рис. 2 и утверждается инструктором. Значение Emf для стандартной ячейки считывается с бирки на ячейке и записывается в таблицу данных. Затем потенциометр «устанавливается», выбирая катушку 1,0 и перемещая ползунковый регулятор, чтобы указать показание стандартной ячейки, а выходное напряжение источника питания настраивается для получения нулевого отклонения гальванометра, когда клавиша ползункового регулятора нажата. После того, как эта регулировка выходного напряжения выполнена, ее нельзя изменять. Это напряжение обеспечивает уникальное падение потенциала вдоль ползунка, что позволяет точно считывать показания потенциометра.
Во время этого эксперимента вы можете периодически перепроверять калибровку. Вот почему был включен переключатель DPDT. Чтобы проверить калибровку, просто установите значение ЭДС стандартной ячейки на потенциометре и переключите переключатель на стандартную ячейку. Если отклонение гальванометра не происходит, то прибор все еще правильно откалиброван.
измерение испытательной ячейки:
Стандартная батарейка для фонарика с номинальным значением 1,5 В используется для тестовой ячейки D. Эта ячейка подключена, как показано на схеме на рис. 2, и переключатель DPDT перемещен для включения ее в цепь вместо стандартной. клетка. Ожидаемое значение ЭДС будет около 1,5 вольт, поэтому потенциометр должен быть первоначально установлен с помощью катушки 1,5 вольт. Кратковременно нажмите контактную кнопку и отметьте величину и направление отклонения. Вы можете найти ЭДС этой ячейки, регулируя ползунковый регулятор до тех пор, пока отклонение гальванометра не станет равным нулю. Прочитайте и запишите значение в таблицу данных.
Прочитайте и запишите значение в таблицу данных.
Замените тестовую ячейку D другой ячейкой, похожей на нее, но старше. Определите ЭДС этой ячейки и запишите ее в свою таблицу данных. Кроме того, измерьте напряжение обоих этих тестовых элементов (но НЕ стандартного элемента) с помощью вольтметра и также запишите эти измерения в таблицу данных. По завершении тестирования этой старой ячейки удалите ее и снова подключите тестовую ячейку D.
.измерение внутреннего сопротивления элемента:
Теперь нам нужно получить ток от тестовой ячейки, пока мы измеряем разность потенциалов между ее выводами. Для этого мы добавляем боковую ветвь K-A-R, как показано на рисунке 3. Резистор R представляет собой переменный резистор, который можно настроить для управления током, который измеряется амперметром A. Переключатель используется для отключения тока, с тем чтобы избежать чрезмерного стока на испытательной ячейке.
Рисунок 3
Вам нужно будет работать быстро, чтобы одновременно измерить ток и напряжение на клеммах для этой ячейки. Рекомендуется взять около 10 точек данных, позволяя току находиться в диапазоне значений от 0,100 А до 2,0 А. Установите ток с помощью резистора, быстро выполните измерение напряжения, а затем отключите ток, пока не будете готовы сделать это. следующее измерение.
Рекомендуется взять около 10 точек данных, позволяя току находиться в диапазоне значений от 0,100 А до 2,0 А. Установите ток с помощью резистора, быстро выполните измерение напряжения, а затем отключите ток, пока не будете готовы сделать это. следующее измерение.
Поскольку ток иногда изменяется во время считывания, важно считывать оба значения одновременно и записывать их как можно точнее. Быть быстрым и точным поможет вашим значениям выйти правильно.
Чтобы проанализировать эти данные, постройте график зависимости напряжения на клеммах (В) от тока (I) для тестовой ячейки. В идеальных условиях это должна быть прямая линия, поэтому вы должны подогнать к этим данным наилучшую возможную линию. Как только эта подгонка выполнена, значение точки пересечения Y представляет собой ЭДС элемента, наклон линии представляет собой отрицательное значение внутреннего сопротивления (-r), а точка пересечения X представляет собой максимальный ток, который может обеспечить элемент (Imax ). Укажите эти значения в таблице данных. Кроме того, сравните значение ЭДС на графике со значением, которое вы измерили для этой ячейки в начале эксперимента, используя процентную разницу.
Укажите эти значения в таблице данных. Кроме того, сравните значение ЭДС на графике со значением, которое вы измерили для этой ячейки в начале эксперимента, используя процентную разницу.
У вас также должно быть достаточно данных, чтобы определить максимальную мощность, которую ячейка может передать на внешнюю нагрузку. Возможно, вам придется экстраполировать некоторые точки данных, используя вашу «линию» на графике для оценки напряжения при больших токах, но в данном случае это вполне допустимо. Чтобы найти мощность, постройте произведение напряжения и тока (V*I) как функцию тока (I). Этот график должен быть кривой, на самом деле параболой, которая открывается вниз. Высшая точка на кривой – максимальная мощность, P max , которые может доставить ячейка.
ОКОНЧАТЕЛЬНЫЙ РЕЗЮМЕ:
Вы должны указать наилучшие значения ЭДС и внутреннего сопротивления для элемента, который вы только что измерили, вместе с вашими оценками максимального тока и мощности, которые он может обеспечить.
