Электронная и электронно-графическая формула в химии
Онлайн калькуляторыНа нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
СправочникОсновные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решениеНе можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Главная Справочник Формулы по химии Электронная и электронно-графическая формула
Что такое электронная и электронно-графическая формула
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
Составление электронной и электронно-графической формулы
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p и т.д.
Так, значению n + l = 5 соответствуют энергетические подуровни 3d (n = 3, l=2), 4d (n=4, l=1) и 5s (n=5, l =0). Первым из этих подуровней заполняется тот, у которого ниже значение главного квантового числа.
Поведение электронов в атомах подчиняется принципу запрета, сформулированному швейцарским ученым В. Паули: в атоме не может быть двух электронов, у которых были бы одинаковыми все четыре квантовых числа. Согласно принципу Паули, на одной орбитали, характеризуемой определенными значениями трех квантовых чисел (главное, орбитальное и магнитное), могут находиться только два электрона, отличающиеся значением спинового квантового числа. Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа.
Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа.
Электронную формулу атома изображают следующим образом: каждому энергетическому уровню соответствует определенное главное квантовое число n, обозначаемое арабской цифрой; за каждой цифрой следует буква, соответствующая энергетическому подуровню и обозначающая орбитальное квантовое число. Верхний индекс у буквы показывает число электронов, находящихся в подуровне. Например, электронная формула атома натрия имеет следующий вид:
11N 1s22s22p63s1.
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным, что наиболее наглядно отражается при составлении электронно-графических формул.
Электронно-графические формулы обычно изображают для валентных электронов. В такой формуле все электроны помечаются стрелочками, а ячейками (квадратиками) – орбитали. В одной ячейке не может находиться более двух электронов. Рассмотрим на примере ванадия. Сначала записываем электронную формулу и определяем валентные электроны:
+74 W)2)8)18)32)12)2;
1s22s22p63s23p63d104s24p64f145s25p65d46s2.
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Электронные формулы и графические схемы атомов химических элементов
Здесь Вы можете познакомится с подробной информацией по электронной конфигурации атома любого элемента из периодической системы Менделеева.
Список всех химических элементов
[1] H (водород)
[2] He (гелий)
[3] Li (литий)
[4] Be (бериллий)
[5] B (бор)
[6] C (углерод)
[7] N (азот)
[8] O (кислород)
[9] F (фтор)
[10] Ne (неон)
[11] Na (натрий)
[12] Mg (магний)
[13] Al (алюминий)
[14] Si (кремний)
[15] P (фосфор)
[16] S (сера)
[17] Cl (хлор)
[18] Ar (аргон)
[19] K (калий)
[20] Ca (кальций)
[21] Sc (скандий)
[22] Ti (титан)
[23] V (ванадий)
[24] Cr (хром)
[25] Mn (марганец)
[26] Fe (железо)
[27] Co (кобальт)
[28] Ni (никель)
[29] Cu (медь)
[30] Zn (цинк)
[31] Ga (галлий)
[32] Ge (германий)
[33] As (мышьяк)
[34] Se (селен)
[35] Br (бром)
[36] Kr (криптон)
[37] Rb (рубидий)
[38] Sr (стронций)
[39] Y (иттрий)
[40] Zr (цирконий)
[41] Nb (ниобий)
[42] Mo (молибден)
[43] Tc (технеций)
[44] Ru (рутений)
[45] Rh (родий)
[46] Pd (палладий)
[47] Ag (серебро)
[48] Cd (кадмий)
[49] In (индий)
[50] Sn (олово)
[51] Sb (сурьма)
[52] Te (теллур)
[53] I (йод)
[54] Xe (ксенон)
[55] Cs (цезий)
[56] Ba (барий)
[57] La (лантан)
[58] Ce (церий)
[59] Pr (празеодим)
[60] Nd (неодим)
[61] Pm (прометий)
[62] Sm (самарий)
[63] Eu (европий)
[64] Gd (гадолиний)
[65] Tb (тербий)
[66] Dy (диспрозий)
[67] Ho (гольмий)
[68] Er (эрбий)
[69] Tm (тулий)
[70] Yb (иттербий)
[71] Lu (лютеций)
[72] Hf (гафний)
[73] Ta (тантал)
[74] W (вольфрам)
[75] Re (рений)
[76] Os (осмий)
[77] Ir (иридий)
[78] Pt (платина)
[79] Au (золото)
[80] Hg (ртуть)
[81] Tl (таллий)
[82] Pb (свинец)
[83] Bi (висмут)
[84] Po (полоний)
[85] At (астат)
[86] Rn (родон)
[87] Fr (франций)
[88] Ra (радий)
[89] Ac (актиний)
[90] Th (торий)
[91] Pa (протактиний)
[92] U (уран)
[93] Np (нептуний)
[94] Pu (плутоний)
[95] Am (амерций)
[96] Cm (кюрий)
[97] Bk (берклий)
[98] Cf (калифорний)
[99] Es (эйнштейний)
[100] Fm (фермий)
[101] Md (менделевий)
[102] No (нобелий)
[103] Lr (лоуренсий)
[104] Rf (резерфордий)
[105] Db (дубний)
[106] Sg (сиборгий)
[107] Bh (борий)
[108] Hs (хассий)
[109] Mt (мейтнерий)
[110] Ds (дармштадтий)
[111] Rg (рентгений)
[112] Cn (коперниций)
[113] Nh (нихоний)
[114] Fl (флеровий)
[115] Mc (московий)
[116] Lv (ливерморий)
[117] Ts (теннесcин)
[118] Og (оганесон)
Электронная структура атомов и молекул
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 37147
Электронная структура – это состояние движения электронов в электростатическом поле, создаваемом неподвижными ядрами.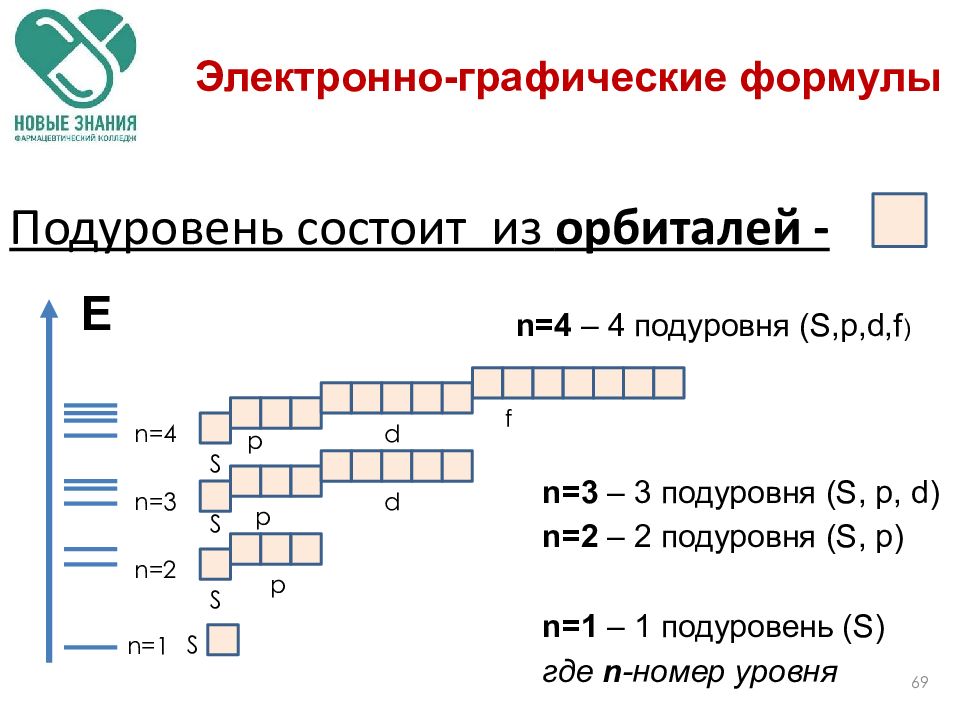
- Атомные орбитали
- На этой странице на вводном уровне обсуждаются атомные орбитали. Он довольно подробно исследует s- и p-орбитали, включая их форму и энергию. d-орбитали описываются только с точки зрения их энергии, а f-орбитали упоминаются лишь вскользь.
- Боровские диаграммы показывают электроны, вращающиеся вокруг ядра атома, что-то вроде орбит планет вокруг Солнца. В модели Бора электроны изображаются движущимися по кругу на разных оболочках, в зависимости от того, какой у вас элемент.
- Электронные конфигурации
- Электронная конфигурация атома представляет собой расположение электронов, распределенных между орбитальными оболочками и подоболочками. Обычно электронная конфигурация используется для описания орбиталей атома в его основном состоянии, но ее также можно использовать для представления атома, который ионизируется в катион или анион, компенсируя потерю или приобретение электронов в их последующих состояниях.

- Основная электронная структура атомов
- Практический пример: электронная конфигурация Mn по сравнению с Cu
- Занятие d-орбитали и электронные конфигурации
- Электронные конфигурации Введение
- Электронная структура и орбитали
- Правила Хунда
- Принцип исключения Паули
- Энергия спинового спаривания
- Спиновое квантовое число
- Процесс Ауфбау
- Правило октетов
- Порядок заполнения 3d- и 4s-орбиталей
- Оценка кратности спинов
- Величина кратности спинов и соответствующее ей состояние спинов были впервые обнаружены Фридрихом Хундом в 1925 году.
 .
.
- Спектр излучения атома водорода
- На этой странице представлен спектр излучения атома водорода, показывающий, как он возникает в результате движения электронов между энергетическими уровнями внутри атома. Это также объясняет, как можно использовать спектр для определения энергии ионизации водорода.
- Магнитное поведение двухатомных видов
- Прогнозирование порядка связей двухатомных видов
- В этой статье были освещены подходы к обучению на основе текста. инновационным и экономным по времени способом повысить интерес студентов которые принадлежат к зоне паранойи в химической связи. В этом педагогическом обзоре я попытался объединить когда-то экономическую педагогику, включив четыре (04) новых формулы в области химического образования. В этой статье исследуются результаты и приводятся выводы для контекстно-ориентированного преподавания, обучения и оценивания экономным по времени способом.

- Прогнозирование порядка связывания кислотных радикалов на основе оксидов
- Прогнозирование гибридизации простых молекул
- Прогнозирование ароматического, антиароматического и неароматического характера гетероциклических соединений по с их поведением бездействия – инновационная мнемоника
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Лицензия
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Электронные конфигурации атомов элементов
Здесь вы можете ознакомиться с подробной информацией об электронной конфигурации атома любого элемента из таблицы Менделеева. Эта информация включает электронные формулы (в порядке возрастания орбитальных энергий и в порядке уровней), графические диаграммы распределение электронов по энергетическим уровням, а также таблицы квантовых чисел (энергии, углового момента, магнитного момента, спина) валентных электронов.
Список всех химических элементов
[1] H (водород)
[2] He (гелий)
[3] Li (литий)
[4] Be (бериллий)
[5] B ( Бор)
[6] C (Углерод)
[7] N (Азот)
[8] O (Кислород)
[9] F (Фтор)
[10] Ne (Неон)
[ 11] Na (натрий)
[12] Mg (магний)
[13] Al (алюминий)
[14] Si (кремний)
[15] P (фосфор)
[16] S (сера)
[17] Cl (хлор)
[19] K (калий)
[20] Ca (кальций)
[21] Sc (скандий)
[22] Ti (титан)
[23] V (ванадий)
[24] Cr (хром)
[25] Mn (марганец)
[26] Fe (железо) 900 24
[27] Co (кобальт)
[28] Ni (никель)
[29] Cu (медь)
[30] Zn (цинк)
[31] Ga (галлий)
[32] Ge ( Германий)
[33] As (мышьяк)
[34] Se (селен)
[35] Br (бром)
[36] Kr (криптон)
[37] Rb (рубидий)
9 0023 [38] Sr (стронций)[39] Y (иттрий)
[40] Zr (цирконий)
[41] Nb (ниобий)
[42] Mo (молибден)
[43] Tc (техн.


 .
.
