ЭЛЕКТРОННЫЕ ТЕОРИИ • Большая российская энциклопедия
Авторы: С. З. Вацадзе
ЭЛЕКТРО́ННЫЕ ТЕО́РИИ в органической химии, комплекс теоретич. концепций, рассматривающих строение, физич. свойства и реакционную способность органич. соединений на базе знаний о распределении электронной плотности в атомах, ионах, молекулах, радикалах, ион-радикалах, в т. ч. и находящихся в возбуждённых состояниях.
Первые представления об электронной природе гетерополярной (ионной) химической связи сформулированы В. Косселем в 1916. В том же году Г. Льюис выдвинул предположение о том, что в образовании ординарной ковалентной химич. связи принимают участие два электрона – по одному от каждого из взаимодействующих атомов. Ответ на вопрос о природе этого взаимодействия дан в 1927 в работе В. Гайтлера и Ф. Лондона, которые выполнили расчёт строения молекулярного иона H2 + и молекулы водорода Н2 на основе квантовой механики. Этот подход лёг в основу предложенного в 1931 Дж. Слэтером и Л. Полингом метода валентных схем (валентных связей метода), в котором волновая функция молекулы строится исходя из комбинации волновых функций образующих молекулу атомов. В кон. 1920-х гг. Ф. Хунд, Дж. Леннард-Джонс, Р. Малликен и др. развили идею молекулярных орбиталей метода, в котором полная волновая функция молекулы строится из функций, описывающих поведение отд. электронов в поле, создаваемом остальными электронами и ядрами.
Этот подход лёг в основу предложенного в 1931 Дж. Слэтером и Л. Полингом метода валентных схем (валентных связей метода), в котором волновая функция молекулы строится исходя из комбинации волновых функций образующих молекулу атомов. В кон. 1920-х гг. Ф. Хунд, Дж. Леннард-Джонс, Р. Малликен и др. развили идею молекулярных орбиталей метода, в котором полная волновая функция молекулы строится из функций, описывающих поведение отд. электронов в поле, создаваемом остальными электронами и ядрами.
1920–30-е гг. – период развития теории внутримолекулярных взаимодействий, которая является, по сути, теорией электронных смещений. Установлены два осн. механизма электронных смещений (поляризационные эффекты) для молекул с закрытыми оболочками: смещения электронной плотности, распространяющиеся вдоль цепи связанных атомов по σ-связям, – индуктивный эффект; смещения электронной плотности, распространяющиеся по системе p-электронов соседних атомов, которые можно назвать сопряжёнными, – мезомерный эффект (механизм сопряжения). В совр. органич. химии выделяют три механизма сопряжения – π-сопряжение (взаимодействие π-связей), гиперконъюгация (взаимодействие π- и σ-связей) и σ-сопряжение (взаимодействие σ-связей).
В совр. органич. химии выделяют три механизма сопряжения – π-сопряжение (взаимодействие π-связей), гиперконъюгация (взаимодействие π- и σ-связей) и σ-сопряжение (взаимодействие σ-связей).
Представления об электронных смещениях, используемые для описания делокализованных связей, получили наиболее законченное выражение в теории мезомерии, разработанной К. Ингольдом в 1930–34. Согласно этой теории, истинное распределение электронной плотности в молекуле является промежуточным между распределениями, представленными двумя или несколькими классич. формулами. По своему содержанию теория мезомерии практически совпадает с предложенной в 1931–33 Л. Полингом «концепцией резонанса», оперирующей для описания молекул набором резонансных структур.
С сер. 1980-х гг. осн. положения классич. теории химич. строения стали предметом глубокого теоретич. анализа. Канад. химиком Р. Бейдером создана квантовая теория «атома в молекуле», рассматривающая проблемы делокализации и локализации электронной плотности и выделения «бассейнов» отд. атомов (QTAIM). У. Коном развит метод функционала электронной плотности (DFT), связывающий энергию любых электронно-ядерных систем с электронной плотностью осн. состояния. С сер. 1990-х гг. активно развивается подход, основанный на исследовании взаимодействия атомов, которое зависит от пространственного расположения связывающих и разрыхляющих орбиталей (т. н. стереоэлектронные эффекты).
анализа. Канад. химиком Р. Бейдером создана квантовая теория «атома в молекуле», рассматривающая проблемы делокализации и локализации электронной плотности и выделения «бассейнов» отд. атомов (QTAIM). У. Коном развит метод функционала электронной плотности (DFT), связывающий энергию любых электронно-ядерных систем с электронной плотностью осн. состояния. С сер. 1990-х гг. активно развивается подход, основанный на исследовании взаимодействия атомов, которое зависит от пространственного расположения связывающих и разрыхляющих орбиталей (т. н. стереоэлектронные эффекты).
Органическая химия 2 | Взаимное влияние атомов в молекулах органических соединений
Продолжаем разбирать основы органической химии. В теории Бутлерова сказано, что одна из особенностей строения веществ — взаимное влияние атомов друг на друга. Химические связи определяют свойства соединений. Например, в зависимости от радикалов и полярности связей в бензольном кольце новые атомы замещаются в разных положениях. Теория взаимного влияния атомов в молекуле — достаточно сложная тема. В статье мы разберем ее основы. Если вы хотите понимать химию лучше, запишитесь на курсы подготовки к ЕГЭ, где каждый раздел изучается подробно.
Теория взаимного влияния атомов в молекуле — достаточно сложная тема. В статье мы разберем ее основы. Если вы хотите понимать химию лучше, запишитесь на курсы подготовки к ЕГЭ, где каждый раздел изучается подробно.
Химические связи в органических веществах
Прежде чем изучать влияние атомов друг на друга, нужно разобраться в природе связей в молекулах органических соединений. Вещества в органике образованы неметаллами — углеродом, кислородом, водородом, азотом, серой. Элементы связаны между собой ковалентными полярными связями. Они образуются в результате появления общих электронных пар. Рассмотрим на примере неорганического вещества — HCl. Водород имеет всего один электрон. Он и участвует в образовании соединений. У хлора на внешнем уровне 7 валентных электронов. Происходит объединение, при котором образуется общая плотность с 8 электронами. Хлор — более электроотрицательный элемент, поэтому он оттягивает на себя электронную плотность.
Это влияет на свойства органических соединений. Когда молекула HCl распадается (например, в водных растворах), хлор забирает себе электроны и становится анионом с зарядом —. Он будет взаимодействовать с электроположительными областями, то есть является нуклеофилом. Водород лишается электрона, поэтому становится катионом с зарядом +. В реакциях он выступает в роли электрофила, взаимодействуя с электроотрицательными участками. Напомним, что при распаде молекул с неполярной связью образуются радикалы — нейтральные частицы.
Когда молекула HCl распадается (например, в водных растворах), хлор забирает себе электроны и становится анионом с зарядом —. Он будет взаимодействовать с электроположительными областями, то есть является нуклеофилом. Водород лишается электрона, поэтому становится катионом с зарядом +. В реакциях он выступает в роли электрофила, взаимодействуя с электроотрицательными участками. Напомним, что при распаде молекул с неполярной связью образуются радикалы — нейтральные частицы.
Смещение электронной плотности
Разберем влияние атомов в молекуле на примере хлорметана Ch4Cl. В нем присутствуют три типа связей: С-С, С-Н и С-Cl. Связь С-С неполярна, поэтому ее мы рассматривать не будем. В группе Ch4- углерод является более электроотрицательным элементом. Электронные плотности всех трех атомов водорода стянуты к нему. Они приобретают частично положительный заряд, а углерод — частично отрицательный. В связи C-Cl более электроотрицательным является хлор. Он забирает на себя электронную плотность со всей группы -Ch4. В химии это обозначают стрелками: Ch4→Cl. Метильный радикал передает электроны хлору, то есть является донором. Хлор, в свою очередь, выступает в роли акцептора. Если мы рассмотрим этан Ch4-Ch4, то не увидим такого явного донорно-акцепторного взаимодействия. Небольшое смещение наблюдается только по направлению от Н к С. В органических молекулах донорами являются все углеводородные радикалы. Акцепторами — группы, содержащие кислород, азот, галогены.
В химии это обозначают стрелками: Ch4→Cl. Метильный радикал передает электроны хлору, то есть является донором. Хлор, в свою очередь, выступает в роли акцептора. Если мы рассмотрим этан Ch4-Ch4, то не увидим такого явного донорно-акцепторного взаимодействия. Небольшое смещение наблюдается только по направлению от Н к С. В органических молекулах донорами являются все углеводородные радикалы. Акцепторами — группы, содержащие кислород, азот, галогены.
Индуктивный эффект
Первый вариант взаимного влияния атомов в молекулах органических веществ — индуктивный эффект. Он характеризует смещение плотности по сигма-связям. Эффект возникает в полярных молекулах, распространяется в одном направлении и быстро затухает. Пример индуктивного влияния — рассмотренный нами хлорметан Ch4→Cl. Метильная группа — это электрофильный (донорный) участок, обладающий положительным индуктивным эффектом +I. Галоген выступает в роли нуклеофильного участка с отрицательным эффектом -I. Важный момент: в акцепторной области всегда есть элемент с высокой электроотрицательностью (O, N, Hal).
Мезомерный эффект
Перед изучением мезомерного влияния атомов в молекулах органических веществ разберемся в таком понятии, как π-система. Как вам наверное известно, π-связь — часть кратной. Если в молекуле есть одна двойная или тройная связь, то она локализована, так как взаимодействует только с ядрами соседних атомов. Если же таких связей несколько и они разделены одним простым (сигма) переходом, то они делокализуются. Электронная плотность распределяется между всеми атомами, благодаря чему образуется сопряженная система. Простейшей π-системой является бутадиен-1,3. Кроме того, она реализуется в бензольном кольце. Сопряженные связи являются чем-то средним между одинарными и двойными. Они меняют свойства органических веществ.
Мезомерный эффект — это взаимное влияние атомов в молекуле с π-связями. В случае отрицательного эффекта электронная плотность притягивается атомом, в случае положительного — отталкивается.
Определение свойств веществ
Разберем примеры взаимного влияния атомов в молекулах. Сравним кислотные свойства фенола, этанола и азотной кислоты. Все три соединения можно описать общей формулой Х-О-Н. При этом электронная плотность смещается к более отрицательному кислороду, что обеспечивает отщепление водорода и, соответственно, кислотные свойства: Х-О←Н. Осталось определить, насколько сильно это взаимодействие:
Сравним кислотные свойства фенола, этанола и азотной кислоты. Все три соединения можно описать общей формулой Х-О-Н. При этом электронная плотность смещается к более отрицательному кислороду, что обеспечивает отщепление водорода и, соответственно, кислотные свойства: Х-О←Н. Осталось определить, насколько сильно это взаимодействие:
-
В азотной кислоте есть нитрогруппа -NO2, обладающая отрицательными мезомерным и индуктивным эффектами. Азот — электроотрицательный элемент, он стягивает на себя электронную плотность, поэтому водород становится еще более активным. Вещество является сильной кислотой.
-
У этанола вместо Х стоит углеводородный радикал. Он обладает положительным индуктивным эффектом, из-за чего полярность связи О-Н снижается. У вещества очень слабые кислотные свойства.
-
Особенность фенола — наличие бензольного кольца. У кислорода есть неподеленная электронная пара, которая вступает в сопряжение с π-системой.
 Благодаря этому электронная плотность стягивается в кольцо, водород становится более подвижным. Кислотные свойства фенола сильнее, чем у этанола, но слабее азотной кислоты.
Благодаря этому электронная плотность стягивается в кольцо, водород становится более подвижным. Кислотные свойства фенола сильнее, чем у этанола, но слабее азотной кислоты.
Итак, мы разобрались с взаимным влиянием атомов в молекуле, узнали о мезомерном и индуктивном эффектах. Эти термины не встречаются в ЕГЭ по химии, но они позволяют лучше понимать природу соединений и предсказывать их химические свойства. Разберитесь с теорией из статьи, а также уделите время практике, определяя эффекты у разных веществ. Это можно делать самостоятельно, а можно записаться на курсы и решать задачи под руководством преподавателя. В любом случае мы уверены — при должной подготовке вы сможете набрать высокие баллы на ЕГЭ.
электронных эффектов | bartleby
Что такое электронные эффекты?
Эффект электронов, находящихся в химических связях внутри атомов молекулы, называется электронным эффектом. Электронный эффект также объясняется как эффект, посредством которого реакционная способность соединения в одной части контролируется отталкиванием или притяжением электронов в другой части молекулы.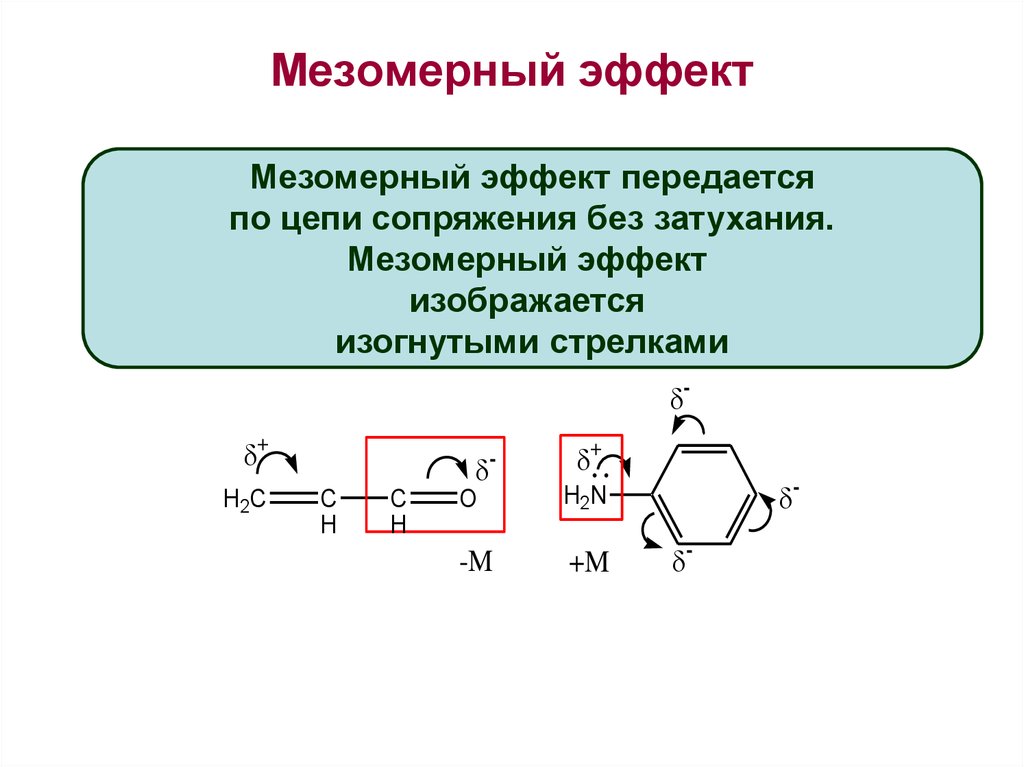
Электронный эффект влияет на реакционную способность, свойства и структуру соединения. Связь между электронной структурой и геометрией соединения можно также подчеркнуть с помощью термина «стереоэлектронный эффект».
Типы электронных эффектов
Электронные эффекты делятся на четыре различных типа, включая:
- Индуктивный эффект.
- Мезомерный эффект или эффект резонанса.
- Электромерный эффект.
- Гиперконъюгация.
Индуктивный эффект
При индуктивном эффекте постоянный диполь образуется в соединении неэквивалентным распределением связывающих электронов двух атомов (разных атомов) в молекуле. Индуктивный эффект в основном возникает в сигма-связях. Поляризация, созданная в этом эффекте, постоянна.
Подразделы индуктивного эффекта
Индуктивный эффект можно разделить на два типа:
- -I эффект.
- +I эффект.
-I эффект
Если в цепь ввести электроотрицательный атом, такой как галоген, он состоит из атомов углерода, которые создадут положительный заряд из-за неравномерного распределения электронов, и этот положительный заряд передается по цепи .
Это создаст постоянный дипольный момент в соединении, где атом, богатый электронами, содержит -ve заряд. Это называется электроноакцепторным индуктивным эффектом или эффектом -I.
+I эффект
При добавлении заместителя, высвобождающего электроны, например, алкильного заместителя, к цепи, содержащей атомы C, заряд будет передаваться по цепи. Это эффект +I.
Прогнозирование основности и кислотности с помощью индукционного эффекта
Основность и кислотность молекулы можно определить с помощью индукционного эффекта. Кислотность соединения снижается за счет электронодонорного заместителя и увеличивается за счет электроноакцепторного заместителя.
Пример
Когда мы рассматриваем RCOO –, заместителем, высвобождающим электроны, считается R, тогда сопряженное основание дестабилизируется из-за межэлектронного отталкивания. Когда электроноакцепторным заместителем считается R, то сопряженное основание стабилизируется за счет делокализации образовавшегося отрицательного заряда.
Мезомерный эффект
За счет переноса π электронов внутри атомов резонансной системы формируется полярность. Этот эффект называется мезомерным эффектом. Этот эффект возникает, если π-электроны удаляются или приближаются к заместителю в сопряженном орбитальном расположении. На рисунке ниже показан мезомерный эффект.
Мезомерный эффект можно классифицировать следующим образом:
- +М эффект.
- -М эффект.
+М эффект
Плотность электронов в сопряженной структуре увеличивается, когда π электронов из определенной группы направляются в сопряженную систему. Эта сопряженная система проявляет меньшую реакционную способность по отношению к нуклеофилу и большую реакционную способность по отношению к электрофилам. Это называется эффект +М. На рисунке ниже показан эффект +M.
Чтобы подвергнуться мезомерному эффекту, группа должна содержать -5 заряд или неподеленную пару электронов.
Заместители, проявляющие положительный мезомерный эффект:
-NH, -NH 2 , -NHR, -NR 2 -O, -OH, -OR, -F, -Cl, -O-COR , -NHCOR, -SH, -SR и т. д.
д.
-M-эффект
Плотность электронов в сопряженной структуре уменьшается, когда π-электроны смещаются из сопряженной структуры в определенную группу. В эффекте –М соединение проявляет меньшую реакционную способность в присутствии электрофила и высокую реакционную способность в присутствии нуклеофила. Это называется эффектом –М. На рисунке ниже показан эффект –M.
Для осуществления мезомерного эффекта заместитель должен содержать либо положительный заряд, либо вакантную орбиталь.
Заместители, проявляющие эффект –М:
-NO 2 ,-CN,-COX,-SO и т.д.
Электромерный эффект
Электромерный эффект – это эффект, при котором происходит абсолютный сдвиг π электронной пары из-за удара нуклеофила или электрофила. Электронный эффект является обратимой реакцией. При выводе атакующего реагента этот эффект исчезнет. Этот эффект возможен только при наличии реагента удара электронов. Электромерный эффект наблюдается в органических соединениях, имеющих хотя бы одну кратную связь. Если атом, участвующий в этих множественных связях, принадлежит управляющему ударному реагенту, одна π-связывающая пара электронов полностью перемещается к одному из 2 атомов.
Если атом, участвующий в этих множественных связях, принадлежит управляющему ударному реагенту, одна π-связывающая пара электронов полностью перемещается к одному из 2 атомов.
Подразделы электромерного эффекта
Электромерный эффект подразделяется на два класса, которые зависят от направления переноса электронной пары. Два типа:
- +E эффект.
- -E эффект.
+E-эффект
Если электронная пара, находящаяся в связи, переносится в сторону ударника, то это называется +E-эффектом. Эффект +Е возникает из-за присоединения кислоты к алкенам. Этот эффект обычно возникает, если ударяющий реагент является электрофилом, а π-электроны перемещаются в положительно заряженные атомы. Например, при протонировании этена будет иметь место эффект +Е, который проявляется следующим образом:
-Э Эффект
Если электронная пара, расположенная в π-связи, переносится от ударника, то это называется -Э эффектом. В случае эффекта –E ударный реагент соединяется с + сильно заряженным атомом, находящимся в соединении, то есть с атомом, который теряет пару электронов при переносе. Если ударным реагентом является нуклеофил, то будет иметь место эффект –E. Эффект –Э возникает при внедрении нуклеофилов в карбонильные соединения. На рисунке ниже показан эффект –E.
Если ударным реагентом является нуклеофил, то будет иметь место эффект –E. Эффект –Э возникает при внедрении нуклеофилов в карбонильные соединения. На рисунке ниже показан эффект –E.
Гиперконъюгация
Гиперконъюгация — это эффект, при котором локализация электронов группы С-Н алкильного заместителя непосредственно связана с атомом ненасыщенного соединения. Эта гиперконъюгация в основном полезна для стабилизации карбокатиона и помогает в распределении положительного заряда. Следовательно, чем больше число алкильных заместителей, связанных с атомом углеродсодержащего положительного заряда, тем выше будет гиперсопряжение, что приведет к большей стабилизации карбокатиона. На основе гиперконъюгации стабильность карбокатиона обозначена на рисунке следующим образом:
Сравнение стерического эффекта с электронным эффектом
Стерический эффект является несвязывающей реакцией, тогда как электронный эффект представляет собой связывающее взаимодействие. Это основное различие между стерическим эффектом и электронным эффектом.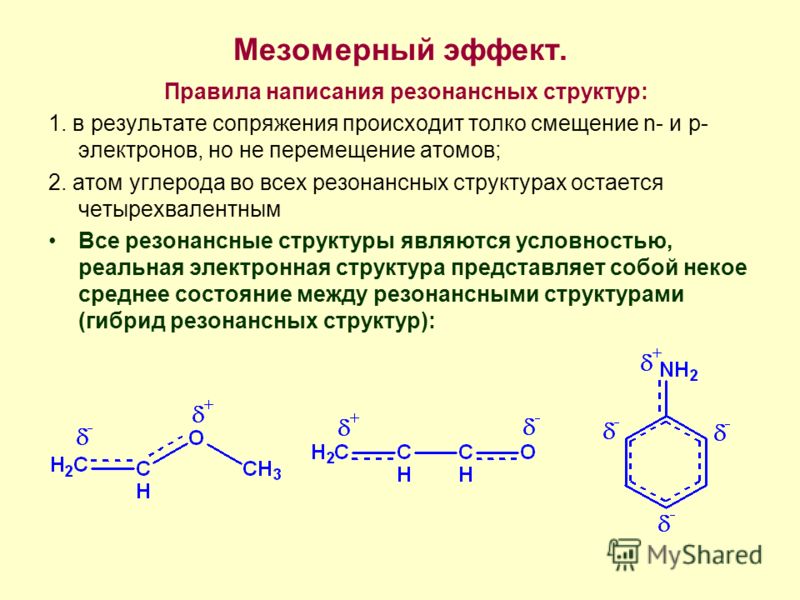 Электронный эффект выражает влияние электронов, находящихся в химических связях внутри атомов молекулы, тогда как стерический эффект выражает воздействие электронов, не участвующих в химической связи, но возникающих за счет неподеленной пары электронов или несвязывающих электроны. Стерический эффект контрастирует с электронным эффектом, подразумевающим влияние таких эффектов, как соединение, индукция, электростатическое взаимодействие, орбитальная симметрия и спиновое состояние.
Электронный эффект выражает влияние электронов, находящихся в химических связях внутри атомов молекулы, тогда как стерический эффект выражает воздействие электронов, не участвующих в химической связи, но возникающих за счет неподеленной пары электронов или несвязывающих электроны. Стерический эффект контрастирует с электронным эффектом, подразумевающим влияние таких эффектов, как соединение, индукция, электростатическое взаимодействие, орбитальная симметрия и спиновое состояние.
Контекст и приложения
Эта тема важна для всех студентов и аспирантов, особенно для бакалавров и магистров химии.
Практические задачи
Вопрос 1: Среди следующих эффект, который показывает постоянное смещение электронов
A) Электромерное
B) Индуктивный
C) Индуктомерика
D) Все вышеперечисленное
40004 C) Ответ : Вариант (b) правильный.
Пояснение : Индуктивный эффект определяется как эффект, при котором в молекуле образуется постоянный диполь из-за неэквивалентного распределения связывающих электронов двух разнородных атомов в соединении.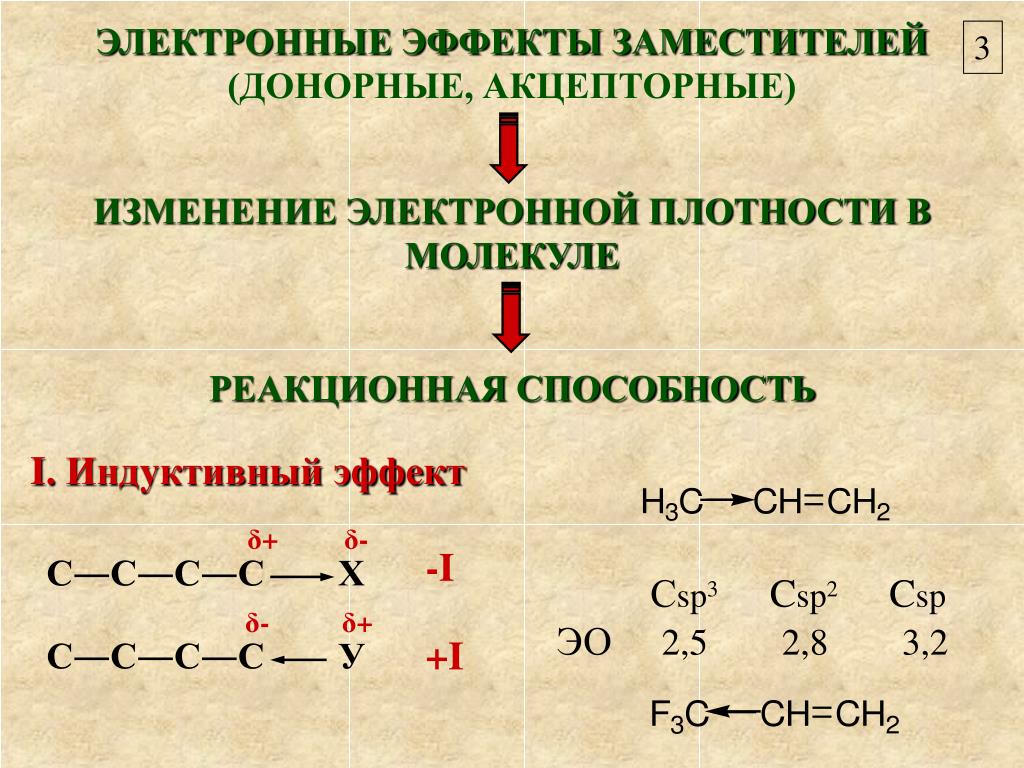 Смещение электрона, происходящее при индуктивном эффекте, является постоянным, тогда как замена электрона происходит при электромерном и индуктомерном эффекте, и оно временно.
Смещение электрона, происходящее при индуктивном эффекте, является постоянным, тогда как замена электрона происходит при электромерном и индуктомерном эффекте, и оно временно.
Вопрос 2: Какой из следующих эффектов резонанса?
1) Электромерный эффект
2) Мезомерный эффект
3)Индуктомерный эффект
4) Индуктивный эффект
Ответ: Верен вариант 2.
Пояснение: Другое название мезомерного эффекта — эффект резонанса. Это постоянный эффект, и он действует на вещества, имеющие по крайней мере 1 двойную связь.
Вопрос 3: Среди следующего, какой временный эффект возникает при необходимости атакующего реагента?
- Мезомерный эффект
- Индуктивный эффект
- Индуктометрический эффект
- Электромерный эффект
Ответ: Верен вариант 4.
Пояснение: Среди приведенных эффектов Электромерный эффект является временным эффектом, который приводится в действие при необходимости атакующего реагента. Этот эффект называется эффектом молекулярной поляризуемости, происходящим за счет внутримолекулярного смещения электронов.
Этот эффект называется эффектом молекулярной поляризуемости, происходящим за счет внутримолекулярного смещения электронов.
Вопрос 4: Больше число гиперконъюгаций, устойчивость свободных радикалов будет
- Уменьшение
- Остается прежним
- Увеличение
- Ничего из вышеперечисленного
Пояснение: Гиперконъюгация и стабильность свободных радикалов прямо пропорциональны друг другу. Следовательно, чем больше количество гиперконъюгаций, тем выше будет стабильность свободных радикалов.
Вопрос 5: Выберите правильное утверждение из следующего,
1) –I эффект слабее, чем сопряженный эффект
2) –I эффект сильнее, чем сопряженный эффект
3) Оба эффекта одинаковы
4) Ничего из вышеперечисленного
Ответ: Верен вариант 1.
Объяснение: -I-эффект слабее, чем сопряженный эффект, потому что сопряженный эффект – это эффект, при котором МО сопряжены с новыми МО, которые сильно делокализованы и, следовательно, обычно имеют меньшую энергию.
Электронные эффекты | bartleby
Что такое электронные эффекты?
Эффект электронов, находящихся в химических связях внутри атомов молекулы, называется электронным эффектом. Электронный эффект также объясняется как эффект, посредством которого реакционная способность соединения в одной части контролируется отталкиванием или притяжением электронов в другой части молекулы.
Электронный эффект влияет на реакционную способность, свойства и структуру соединения. Связь между электронной структурой и геометрией соединения можно также подчеркнуть с помощью термина «стереоэлектронный эффект».
Типы электронных эффектов
Электронные эффекты делятся на четыре различных типа, включая:
- Индуктивный эффект.
- Мезомерный эффект или эффект резонанса.
- Электромерный эффект.
- Гиперконъюгация.
Индуктивный эффект
При индуктивном эффекте постоянный диполь образуется в соединении неэквивалентным распределением связывающих электронов двух атомов (разных атомов) в молекуле. Индуктивный эффект в основном возникает в сигма-связях. Поляризация, созданная в этом эффекте, постоянна.
Индуктивный эффект в основном возникает в сигма-связях. Поляризация, созданная в этом эффекте, постоянна.
Подразделы индуктивного эффекта
Индуктивный эффект можно разделить на два типа:
- -I эффект.
- +I эффект.
-I эффект
Если в цепь ввести электроотрицательный атом, такой как галоген, он состоит из атомов углерода, которые создадут положительный заряд из-за неравномерного распределения электронов, и этот положительный заряд передается по цепи .
Это создаст постоянный дипольный момент в соединении, где атом, богатый электронами, содержит -ve заряд. Это называется электроноакцепторным индуктивным эффектом или эффектом -I.
+I эффект
При добавлении заместителя, высвобождающего электроны, например, алкильного заместителя, к цепи, содержащей атомы C, заряд будет передаваться по цепи. Это эффект +I.
Прогнозирование основности и кислотности с помощью индукционного эффекта
Основность и кислотность молекулы можно определить с помощью индукционного эффекта. Кислотность соединения снижается за счет электронодонорного заместителя и увеличивается за счет электроноакцепторного заместителя.
Кислотность соединения снижается за счет электронодонорного заместителя и увеличивается за счет электроноакцепторного заместителя.
Пример
Когда мы рассматриваем RCOO –, заместителем, высвобождающим электроны, считается R, тогда сопряженное основание дестабилизируется из-за межэлектронного отталкивания. Когда электроноакцепторным заместителем считается R, то сопряженное основание стабилизируется за счет делокализации образовавшегося отрицательного заряда.
Мезомерный эффект
За счет переноса π электронов внутри атомов резонансной системы формируется полярность. Этот эффект называется мезомерным эффектом. Этот эффект возникает, если π-электроны удаляются или приближаются к заместителю в сопряженном орбитальном расположении. На рисунке ниже показан мезомерный эффект.
Мезомерный эффект можно классифицировать следующим образом:
- +М эффект.
- -М эффект.
+М эффект
Плотность электронов в сопряженной структуре увеличивается, когда π электронов из определенной группы направляются в сопряженную систему. Эта сопряженная система проявляет меньшую реакционную способность по отношению к нуклеофилу и большую реакционную способность по отношению к электрофилам. Это называется эффект +М. На рисунке ниже показан эффект +M.
Эта сопряженная система проявляет меньшую реакционную способность по отношению к нуклеофилу и большую реакционную способность по отношению к электрофилам. Это называется эффект +М. На рисунке ниже показан эффект +M.
Чтобы подвергнуться мезомерному эффекту, группа должна содержать -5 заряд или неподеленную пару электронов.
Заместители, проявляющие положительный мезомерный эффект:
-NH, -NH 2 , -NHR, -NR 2 -O, -OH, -OR, -F, -Cl, -O-COR , -NHCOR, -SH, -SR и т. д.
-M-эффект
Плотность электронов в сопряженной структуре уменьшается, когда π-электроны смещаются из сопряженной структуры в определенную группу. В эффекте –М соединение проявляет меньшую реакционную способность в присутствии электрофила и высокую реакционную способность в присутствии нуклеофила. Это называется эффектом –М. На рисунке ниже показан эффект –M.
Для осуществления мезомерного эффекта заместитель должен содержать либо положительный заряд, либо вакантную орбиталь.
Заместители, проявляющие эффект –М:
-NO 2 ,-CN,-COX,-SO и т.д.
Электромерный эффект
Электромерный эффект – это эффект, при котором происходит абсолютный сдвиг π электронной пары из-за удара нуклеофила или электрофила. Электронный эффект является обратимой реакцией. При выводе атакующего реагента этот эффект исчезнет. Этот эффект возможен только при наличии реагента удара электронов. Электромерный эффект наблюдается в органических соединениях, имеющих хотя бы одну кратную связь. Если атом, участвующий в этих множественных связях, принадлежит управляющему ударному реагенту, одна π-связывающая пара электронов полностью перемещается к одному из 2 атомов.
Подразделы электромерного эффекта
Электромерный эффект подразделяется на два класса, которые зависят от направления переноса электронной пары. Два типа:
- +E эффект.
- -E эффект.
+E-эффект
Если электронная пара, находящаяся в связи, переносится в сторону ударника, то это называется +E-эффектом. Эффект +Е возникает из-за присоединения кислоты к алкенам. Этот эффект обычно возникает, если ударяющий реагент является электрофилом, а π-электроны перемещаются в положительно заряженные атомы. Например, при протонировании этена будет иметь место эффект +Е, который проявляется следующим образом:
Эффект +Е возникает из-за присоединения кислоты к алкенам. Этот эффект обычно возникает, если ударяющий реагент является электрофилом, а π-электроны перемещаются в положительно заряженные атомы. Например, при протонировании этена будет иметь место эффект +Е, который проявляется следующим образом:
-Э Эффект
Если электронная пара, расположенная в π-связи, переносится от ударника, то это называется -Э эффектом. В случае эффекта –E ударный реагент соединяется с + сильно заряженным атомом, находящимся в соединении, то есть с атомом, который теряет пару электронов при переносе. Если ударным реагентом является нуклеофил, то будет иметь место эффект –E. Эффект –Э возникает при внедрении нуклеофилов в карбонильные соединения. На рисунке ниже показан эффект –E.
Гиперконъюгация
Гиперконъюгация — это эффект, при котором локализация электронов группы С-Н алкильного заместителя непосредственно связана с атомом ненасыщенного соединения. Эта гиперконъюгация в основном полезна для стабилизации карбокатиона и помогает в распределении положительного заряда. Следовательно, чем больше число алкильных заместителей, связанных с атомом углеродсодержащего положительного заряда, тем выше будет гиперсопряжение, что приведет к большей стабилизации карбокатиона. На основе гиперконъюгации стабильность карбокатиона обозначена на рисунке следующим образом:
Следовательно, чем больше число алкильных заместителей, связанных с атомом углеродсодержащего положительного заряда, тем выше будет гиперсопряжение, что приведет к большей стабилизации карбокатиона. На основе гиперконъюгации стабильность карбокатиона обозначена на рисунке следующим образом:
Сравнение стерического эффекта с электронным эффектом
Стерический эффект является несвязывающей реакцией, тогда как электронный эффект представляет собой связывающее взаимодействие. Это основное различие между стерическим эффектом и электронным эффектом. Электронный эффект выражает влияние электронов, находящихся в химических связях внутри атомов молекулы, тогда как стерический эффект выражает воздействие электронов, не участвующих в химической связи, но возникающих за счет неподеленной пары электронов или несвязывающих электроны. Стерический эффект контрастирует с электронным эффектом, подразумевающим влияние таких эффектов, как соединение, индукция, электростатическое взаимодействие, орбитальная симметрия и спиновое состояние.
Контекст и приложения
Эта тема важна для всех студентов и аспирантов, особенно для бакалавров и магистров химии.
Практические задачи
Вопрос 1: Среди следующих эффект, который показывает постоянное смещение электронов
A) Электромерное
B) Индуктивный
C) Индуктомерика
D) Все вышеперечисленное
40004 C) Ответ : Вариант (b) правильный.
Пояснение : Индуктивный эффект определяется как эффект, при котором в молекуле образуется постоянный диполь из-за неэквивалентного распределения связывающих электронов двух разнородных атомов в соединении. Смещение электрона, происходящее при индуктивном эффекте, является постоянным, тогда как замена электрона происходит при электромерном и индуктомерном эффекте, и оно временно.
Вопрос 2: Какой из следующих эффектов резонанса?
1) Электромерный эффект
2) Мезомерный эффект
3)Индуктомерный эффект
4) Индуктивный эффект
Ответ: Верен вариант 2.
Пояснение: Другое название мезомерного эффекта — эффект резонанса. Это постоянный эффект, и он действует на вещества, имеющие по крайней мере 1 двойную связь.
Вопрос 3: Среди следующего, какой временный эффект возникает при необходимости атакующего реагента?
- Мезомерный эффект
- Индуктивный эффект
- Индуктометрический эффект
- Электромерный эффект
Ответ: Верен вариант 4.
Пояснение: Среди приведенных эффектов Электромерный эффект является временным эффектом, который приводится в действие при необходимости атакующего реагента. Этот эффект называется эффектом молекулярной поляризуемости, происходящим за счет внутримолекулярного смещения электронов.
Вопрос 4: Больше число гиперконъюгаций, устойчивость свободных радикалов будет
- Уменьшение
- Остается прежним
- Увеличение
- Ничего из вышеперечисленного


 Благодаря этому электронная плотность стягивается в кольцо, водород становится более подвижным. Кислотные свойства фенола сильнее, чем у этанола, но слабее азотной кислоты.
Благодаря этому электронная плотность стягивается в кольцо, водород становится более подвижным. Кислотные свойства фенола сильнее, чем у этанола, но слабее азотной кислоты.