химическ. элемент по “фамилии” Se, 5 (пять) букв
Вопрос с кроссворда
Ответ на вопрос “химическ. элемент по “фамилии” Se “, 5 (пять) букв:
селен
Альтернативные вопросы в кроссвордах для слова селен
Последователь мышьяка в таблице
Химический элемент, Se
Название этого элемента связано с тем, что в природе он часто встречается вместе с теллуром
Химический элемент
Химический элемент для полупроводников
хим. элемент, используемый в светочувствительных барабанах ксероксов
Лунный представитель в таблице имени Дмитрия Менделеева
Определение слова селен в словарях
Словарь медицинских терминов Значение слова в словаре Словарь медицинских терминов
химический элемент VI группы периодической системы Д. И. Менделеева; ат. номер 34, ат. масса 78,96; С. и все его соединения токсичны для человека.
И. Менделеева; ат. номер 34, ат. масса 78,96; С. и все его соединения токсичны для человека.
Толковый словарь живого великорусского языка, Даль Владимир Значение слова в словаре Толковый словарь живого великорусского языка, Даль Владимир
селений м. простое химическое начало, коего свойства ближе к сере, нежели к металлам. Селеновая кислота. Селенистая медь, содержащая селен. Селенит, гипсовый шпат, ископаемое.
Толковый словарь русского языка. Д.Н. Ушаков Значение слова в словаре Толковый словарь русского языка. Д.Н. Ушаков
 .обр. при выработке серной кислоты.
.обр. при выработке серной кислоты.Примеры употребления слова селен в литературе.
То был Антиной, комната которого находилась у самого места этого нападения и который, как только услышал лай Аргуса и крик Селены, поспешил удержать пса, страшно злого на страже и в потемках.
Антиной начал сильно тосковать по Селене – тот самый Антиной, которому во всех городах, где он бывал с императором, а в особенности в Риме, прославленные красавицы присылали букеты и нежные письма и который, однако же, с тех пор как оставил родину, не выказывал ни одному женскому существу и половины того интереса, который он питал к охотничьей лошади, подаренной ему императором, или к большой молосской собаке.
В то время как Селена с жестокой болью в ноге приближалась к папирусной мастерской, радость и счастье вернулись к Арсиное, так как, едва ее сестра и Антиной вышли, Хирам обратился к ней с просьбой показать флакончик, подаренный ей красивым юношей.
Электрические луны льют с высоты свои лучи, которым может позавидовать бледноликая Селена.
Артимпаса – Тривия, или Триодита, богиня трех дорог: Геката, Селена и Артемида, слитые воедино.
Я сказала Селене, что завтра собственноручно приготовлю на ужин зайчатину в соусе из красной смородины.
Источник: библиотека Максима Мошкова
Селен (Se, Selenium) – влияние на организм, польза и вред, описание
История селена
Селен открыл в 1817 году Й.Я. Берцелиус, в процессе исследования нового метода производства серной кислоты. Был обнаружен осадок, который содержал, по мнению ученого, редкий металл теллур (calorizator). Но вместо теллура Берцелиус открыл до тех пор неизвестный металл и назвал его селеном от греческого σελήνη, что означает «луна», ведь селен – природный спутник теллура, название которого переводится как «земля».
Общая характеристика селена
Селен является элементом XVI группы IV периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 34 и атомной массой 78,96. Принятое обозначение – Se (от латинского Selenium).
Принятое обозначение – Se (от латинского Selenium).
Нахождение в природе
В природе селен находится в земной коре в виде минералов и небольшое количество селена содержит морская вода.
Физические и химические свойства
Селен является хрупким и блестящим на изломе неметаллом, относящимся к халькогенам, имеет чёрный цвет, считается аналогом серы.
Суточная потребность в селене
Норма селена в сутки составляет 70-120 мкг, но зависит от пола и возраста человека. Суточная потребность в селене возрастает от 20 мкг у новорожденных, до 80 мкг у подростков, взрослые женщины должны получать 100-110 мкг селена, беременные и кормящие – до 400 мкг селена ежедневно. Взрослые здоровые мужчины нуждаются в 140 мкг селена в сутки.
Продукты питания богатые селеном
Селен поступает в организм с пищей как растительного, так и животного происхождения. Основными поставщиками селена являются злаки (овсяная и гречневая крупы, пшеничные отруби), оливковое масло, пивные дрожжи, овощи (чеснок, маслины, томаты), орехи, особенно – бразильские, белые грибы и шампиньоны, рыба и морепродукты (кальмары, креветки, устрицы, морская капуста), говяжьи почки и печень, каменная и морская соль, ржаной хлеб, куриные яйца.
Признаки нехватки селена
Дефицит селена характеризуется слабостью, болями в мышцах, снижением защитных функций организма, анемией, заболеваниями почек и поджелудочной железы, может спровоцировать развитие бесплодия у мужчин.
Признаки избытка селена
Чрезмерное количество селена в организме человека характеризуется желтушностью и шелушением кожи, поражением ногтевых пластин, выпадением волос, потерей аппетита, хронической усталостью, нервными расстройствами, артритами.
Полезные свойства селена и его влияние на организм
Научно доказано, что селен способствует повышению иммунитета и предотвращает развитие опухолей, в том числе злокачественных, оказывает стимулирующее действие на обменные процессы и репродуктивную функцию, участвует в образовании белков и эритроцитов, является частью ферментов и гормонов, оказывает благоприятное влияние на состояние кожных покровов, ногтей и волос, препятствует формированию свободных радикалов.
Применение селена в жизни
Селен применяется в электронике и электротехнике, технологии полупроводников, производстве военной техники, как мощный источник гамма-излучения, в медицине – как противоопухолевое средство и лекарство от себореи и кожных воспалений.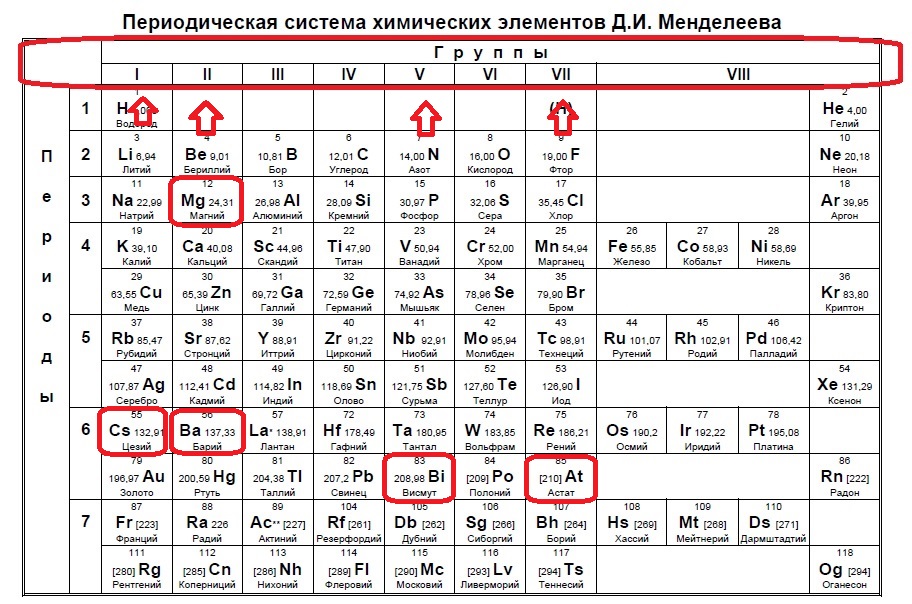
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Химия селена (Z=34) – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 92164
Элемент номер 34, селен, был открыт шведским химиком Йонсом Якобом Берцелиусом в 1817 году. Селен является неметаллом, и химически его можно сравнить с другими неметаллическими аналогами из группы 16: семейство кислорода, такими как сера и теллур. .
Свойства
| Химический код: | Se |
| Атомный номер: | 34 |
| Атомный вес: | 78,96 |
| Электронная конфигурация: | [Ar] 4s |
| Температура плавления: | 493,65 К |
| Точка кипения: | 958 К |
| Электроотрицательность: | 2,55 (Полинг) |
| Степени окисления: | Se -2 , Se +6 , Se +4 |
| Энергии ионизации: | Первый: 941 кДж/моль |
| Секунда: 2045 кДж/моль | |
| Третий: 2973,7 кДж/моль |
История
Селен был открыт Берцелиусом в 1818 году. Он назван в честь греческого слова «луна», селена. Открытие селена было важной находкой, но в то же время, казалось бы, случайной. Другой ученый Мартин Клапрот обнаружил загрязнение серной кислотой, создающее продукт красного цвета, который, как он полагал, связан с элементом теллуром. Однако Берцелиус продолжил дальнейший анализ примеси и пришел к выводу, что это был неизвестный элемент, обладающий свойствами, сходными со свойствами теллура. Основываясь на греческом слове «селена», означающем луну, Йонс Берцелиус решил назвать недавно открытый элемент селеном.
Он назван в честь греческого слова «луна», селена. Открытие селена было важной находкой, но в то же время, казалось бы, случайной. Другой ученый Мартин Клапрот обнаружил загрязнение серной кислотой, создающее продукт красного цвета, который, как он полагал, связан с элементом теллуром. Однако Берцелиус продолжил дальнейший анализ примеси и пришел к выводу, что это был неизвестный элемент, обладающий свойствами, сходными со свойствами теллура. Основываясь на греческом слове «селена», означающем луну, Йонс Берцелиус решил назвать недавно открытый элемент селеном.
Аллотропы и физические свойства
Селен может существовать в нескольких аллотропах, которые представляют собой существенно разные молекулярные формы элемента с различными физическими свойствами. Например, один аллотроп селена можно увидеть в виде амфорного («без кристаллической формы») красного порошка. Селен также имеет кристаллическую гексагональную структуру, образуя металлический серый аллотроп, который, как известно, стабилен. Наиболее термодинамически стабильным аллотропом селена является тригональный селен, который также имеет серый цвет. Большая часть селена извлекается в процессе электролитического рафинирования меди. Обычно это красный аллотроп.
Наиболее термодинамически стабильным аллотропом селена является тригональный селен, который также имеет серый цвет. Большая часть селена извлекается в процессе электролитического рафинирования меди. Обычно это красный аллотроп.
Селен в основном известен своими важными химическими свойствами, особенно связанными с электричеством. В отличие от серы, селен является полупроводником, а это означает, что он проводит некоторое количество электричества, но не так хорошо, как проводники. Селен является фотопроводником, а это значит, что он способен преобразовывать световую энергию в электрическую. Селен не только способен преобразовывать световую энергию в электрическую, но и обладает свойством фотопроводимости. Фотопроводимость — это идея о том, что электрическая проводимость селена увеличивается из-за присутствия света или, другими словами, он становится лучшим фотопроводником по мере увеличения интенсивности света.
Изотопы
Изотопы элемента – это атомы, имеющие одинаковые атомные номера, но разное количество нейтронов (разные массовые числа) в ядрах. Известно, что селен имеет более 20 различных изотопов; однако только 5 из них стабильны. Пять стабильных изотопов селена: 74 Se, 76 Se, 77 Se, 78 Se, 80 Se.
Известно, что селен имеет более 20 различных изотопов; однако только 5 из них стабильны. Пять стабильных изотопов селена: 74 Se, 76 Se, 77 Se, 78 Se, 80 Se.
Применение
Благодаря свойству селена фотопроводимости известно, что он используется в фотоэлементах, экспонометрах в фотографии, а также в солнечных элементах. Селен также можно увидеть в его производстве в копировальных аппаратах для обычной бумаги, лазерных принтерах и фотографических тонерах. Помимо использования в электронной промышленности, селен также популярен в стекольной промышленности. Когда селен добавляется в стекло, он способен свести на нет цвет других элементов, содержащихся в стекле, и существенно обесцвечивает его. Селен также способен создавать стекло рубиново-красного цвета при добавлении. Элемент также может использоваться в производстве сплавов и является добавкой к нержавеющей стали.
Опасность для здоровья
Селен, микроэлемент, важен для питания и здоровья как растений, так и животных, но его можно принимать только в очень малых количествах. Известно, что воздействие избыточного количества селена токсично и вызывает проблемы со здоровьем. При допустимом верхнем уровне потребления 400 мкг в день слишком много селена может привести к селенозу и может привести к проблемам со здоровьем и даже к смерти. Соединения селена также известны как канцерогены.
Известно, что воздействие избыточного количества селена токсично и вызывает проблемы со здоровьем. При допустимом верхнем уровне потребления 400 мкг в день слишком много селена может привести к селенозу и может привести к проблемам со здоровьем и даже к смерти. Соединения селена также известны как канцерогены.
Химическая реактивность
Реакция с водородом
Селен образует селенид водорода, H 2 Se, бесцветный легковоспламеняющийся газ при реакции с водородом.
Реакция с кислородом
Селен горит на воздухе голубым пламенем и образует твердый диоксид селена.
\[Se_{8(s)} + 8O_{2(g)} \rightarrow 8SeO_{2(s)}\]
Также известно, что селен образует триоксид селена, SeO 3 .
Реакция с галогенидами
Селен реагирует с фтором, F 2 и сгорает с образованием гексафторида селена.
\[Se_{8(s)} + 24F_{2(g)} \rightarrow 8SeF_{6(l)}\]
Селен также реагирует с хлором и бромом с образованием диселения дихлорида, \(Se_2Cl_2\) и диселения дибромид, \(Se_2Br_2\).
\[Se_8 + 4Cl_2 \rightarrow 4Se_2Cl_{2(l)}\]
\[Se_8 + 4Br_2 \rightarrow 4Se_2Br_{2(l)}\]
Селен также образует \(SeF_4\), \(SeCl_2 \) и \(SeCl_4\),
Селениды
Селен реагирует с металлами с образованием селенидов. Пример: селенид алюминия
\[3 Se_8 + 16 Al \rightarrow 8 Al_2Se_3\]
Селениты
Селен вступает в реакцию с образованием солей, называемых селенитами, например, селенита серебра (Ag 2 SeO 3 ) и селенита натрия (N8 9 29049 ) SeO 3 )
Проблемы
- Опишите свойство фотопроводимости селена.
- Реагирует ли селен с водородом? Если да, то какое соединение получается?
- Опишите назначение селена как микроэлемента.
- Каковы некоторые общие области применения селена?
- Реагирует ли селен с кислородом?
Решения
- Способность селена преобразовывать световую энергию в электрическую увеличивается по мере увеличения интенсивности света
- Да, селен реагирует с водородом и образует селенид водорода H 2 Se
- Селен важен для здоровья растений и животных, но безопасен только в небольших количествах.
 Слишком много селена может быть токсичным и вызвать серьезные проблемы со здоровьем.
Слишком много селена может быть токсичным и вызвать серьезные проблемы со здоровьем. - Селен сгорает на воздухе с образованием двуокиси селена. Он также способен образовывать триоксид селена.
Ссылка
- Минаев В.С., Тимошенков С.П., Калугин В.В. «Структурные и фазовые превращения в конденсированном селене». Журнал оптоэлектроники и передовых материалов, том 7, номер 4, 2005 г., стр. 1717–1741.
- Мэри Эльвира Уикс и Генри М. Лестер. Открытие элементов, 7-е издание. Истон, Пенсильвания: Журнал химического образования, 1968. .
Авторы и авторство
- Дэвид Джин (UCD)
Chemistry of Selenium (Z=34) распространяется под лицензией CC BY-NC-SA 4.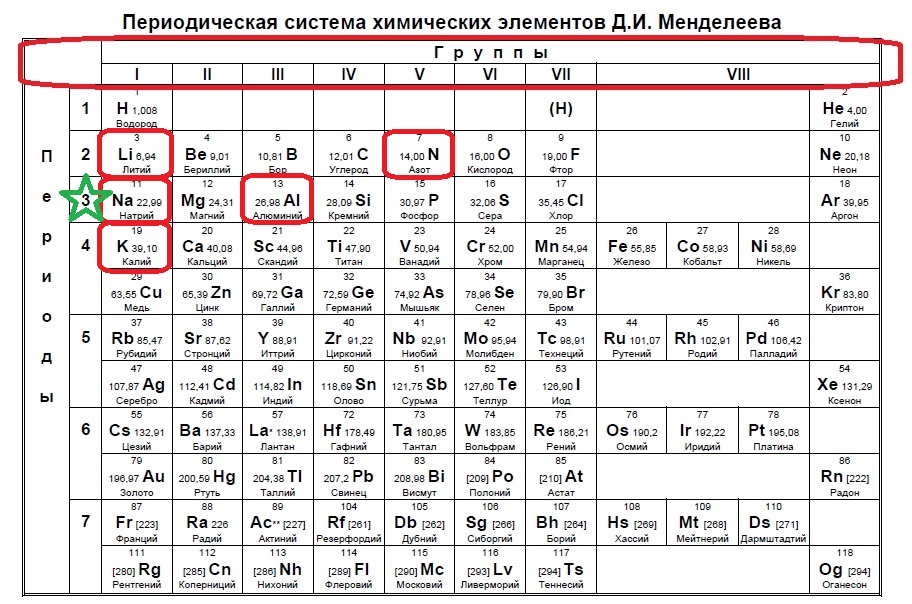 0, автор, ремикс и/или куратор LibreTexts.
0, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
Селен Se (элемент 34) Периодической таблицы
34 Se (селен)
Карточка селена
Селен является неметаллическим химическим элементом , существует в нескольких аллотропных формах, хотя обычно признаются три.
По химической активности и физическим свойствам напоминает серу и теллур.
Может быть получен либо с аморфной , либо с кристаллической структурой .
Цвет аморфного селена либо красный ( в виде порошка), либо черный (в стеклообразной форме).
Кристаллический моноклинный селен — темно-красный, а кристаллический гексагональный селен (наиболее стабильный вариант) — металлический серый цвет .
Селен сгорает за воздух и не действует вода , но растворяется в концентрированной азотной кислоте и щелочах.
Черный, стеклообразный аморфный (с тонким слоем серого селена) и красный (в виде порошка) аморфный селен
Идентификационный номер
Номер CAS: CAS7782-49-2
Номер CID: CID6326970
DOT H60.19 DOT H60.19 Номер: 2658
Номер RTECS: RTECSVS7700000
УКАЗАТЕЛЬ СОДЕРЖАНИЯ
Основные свойства Selenium Произношение: Sa-lee-nee-am
Внешний вид: черные, красные и серые аллотропы
Аллотропы: аморфный красный селен, аморфный черный селен, моноклинный селен, гексагональный селен
Массовое число: 79
Стандарт Атомный вес: 78,97 /моль
Атомный номер (Z): 34
Электроны: 34
Протоны: 34
Нейтроны: 45
Период: 4
Группа: 16
Блок: p
Категория элемента: Неметалл
Электронов на оболочку: K2, L8, M18, N6
Электронная конфигурация: 1 с 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 4
SELENIAM ELECLERGURAV Температура плавления: 494 K (221 o C, 430 o F)
Температура кипения: 958 K (685 o C, 1265 o F) , -297,67 o F)
Температура критической точки: 1766 K (149
Давление в критической точке: 27,2 МПа (268,443 атм)
K)
Молярная теплоемкость: 25,363 Дж/(моль. K)
K)
Показатель преломления: 1,000895
Тепловое расширение: аморфный: 37 мкм/(м∙K)
Теплопроводность: аморфный: 0,519 Вт/(м∙K)
A Магнитный тип: диамагнитный
Магнитная восприимчивость (x моль ): -25×10 -6 см 3 /моль
Объемная магнитная восприимчивость: -0,0000193
Массовая магнитная восприимчивость: -4×10 кг 3
Молярная магнитная восприимчивость: -0,316 × 10 -9 M 3 /моль Физические свойства селен
Плотность: 4,81 г/см 3 (серо ) 4,28 г/см 3 (стекловидное тело)
Молярный объем: 0,000016387 м 3 /моль
Модуль Янга: 10 ГПа
Модуль сдвига: 3,7 ГПа
Мохс. Твердость: 2,0
Модуль. /S
Состояния окисления: 6 , 5, 4 , 3, 2, 1, -1, -2
Electrons: 4S 4S 9005 2 9005 3 9005 3 9005 2 9005 2 9005 4S 9005 2 9005 4S 9005 2 9005 2 9005 4S 9005 2 9005 4S 9005 4S 9005 4S 9. 9005 4S 9.9005 4S -2
9005 4S 9.9005 4S -2
. 4
Ионный заряд: Se 9
Ионный радиус: 50 пм Ван-дер-Ваальса: 190 пм
Ковалентный радиус: 120±4 пм
Заполняющая орбита: 4p 4
Кристаллическая структура: гексагональная
Углы решетки: π/2, π/2, 2π/3
Постоянная решетки: 436,4, 436,4, 436,4, 436,4, 436,4, 436,4, 436,4, 436,4 495,9 пм
Параметры сетки: a=4,364 Å c=4,959 Å
Отношение c/a: 1,136
Название космической группы: P12 1 /C1
Номер космической группы: 14
Hexagonal
Реакционная способность SeleniumЭЛЕКТРОНЕГОВИНАТ: Полингинг. Ядерные свойства селена
Период полураспада: стабильный (бесконечность)
Срок службы: стабильный (бесконечность)
Квантовое число: 3 P 2
Нейтронное сечение (Бранс): 9 Масса.0307 Isotopes: 72 Se 74 Se 75 Se 76 Se 77 Se 78 Se 79 Se 80 Se 82 Se
| Isotope | Численность (%) | Атомная масса г/моль | Период полувыведения (t 1/2 ) |
| 72 | Син | – | 8,4 д |
| 74 Se | 0,86 | 73,922 | Стабильный |
| 75 Се | Син | – | 119,8 д |
| 76 Се | 9,23 | 75,919 | Стабильный |
| 77 Се | 7,60 | 76,920 | Стабильный |
| 78 Се | 23,69 | 77,917 | Стабильный |
| 79 Се | След | – | 3,27×10 5 у |
| 80 Се | 49,80 | 79,917 | Стабильный |
| 82 Se | 8,82 | 81. 917 917 | 1,08×10 20 у |
Горение селена на воздухе , 9С water , and forming selenious acid:
SeO 2 (s) + H 2 O (l) → H 2 SeO 3 (aq)
Reacts with Fluorine at 0 o C и образуя фторид Se (IV):
Se 8 (т) + 15 F 2 (г) → 8 SeF 4 (т) [бесцветный] (тетрафторид селена)
При сжигании с образованием фторида Se (VI):
Se 8 (s) + 24 F 2 (g) → 8 SeF 6 (l) [оранжевый] (гексафторид селена)
Se ( Предпочтительно суспендированный в CS 2 ) реагирует с хлором и бромом с образованием:
Se 8 + 4 Cl 2 → 4 Se 2 Cl 2 дихлорид селена)
Se 8 + 4 Br 2 → 4 Se 2 Br 2 (l) [оран] (диселендибромид)
Реагирует в контролируемых условиях с хлором, бромом и йодом с образованием:
Se 8 (т) + 16 Cl 2 (г) → 8 SeCl 4 (т) (селена (IV) хлорид)
Se 8 (т) + 16 Br 2 (г) → 8 SeBr 4 (т) (Selenium (IV) Bromide)
Se 8 (т) + 16 I 2 (г) → 8 SeI 4 (s) (Selenium (IV) Iodide)
Селен не реагирует с разбавленными неокисляющими кислотами .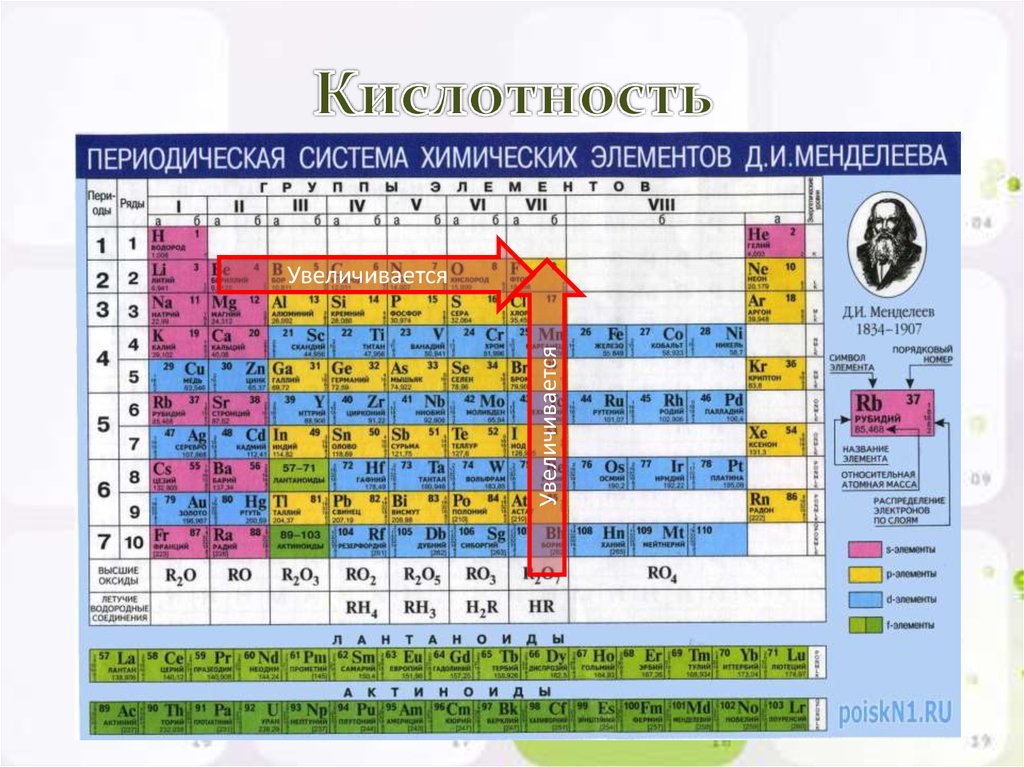
Селен(VI) в виде селенатов окисляется до селена(VI) сильным соляная кислота :
SeO 4 2- (водн.) + 2 H + (водн.) + 2 Cl – (водн.) 2 (водн.) + H 2 O (ж)
Селенистая кислота также может быть получена непосредственно путем окисления элементарного селена азотной кислотой :
3 Se + 4 HNO 3 + H 2 9 O H 2 SeO 3 + 4 NO (стабильный триоксид)
Триоксид селена термодинамически нестабилен и разлагается до диоксида выше 185 °C:
2 SeO 3 → 2 SeO 2 + O 2 (ΔH = -54 кДж/моль)
Сероводородная кислота реагирует с селеноводородом :
H 2 SeO 3 + 2 H 2 S → SeS 2 + 3 H 2 O
Селен(IV) в виде селеновой кислоты окисляется до 9-селеновой кислоты 9-селеновой кислотой.
5 H 2 SeO 3 (водный) + 2 MnO 4 _ (водн.) ⇌ 4 H + (водн.) + 5 SeO 4 2- (водн.) + H 2 O (л)
С высокоэлектроположительными металлами, такими как алюминий, селениды подвержен гидролизу:
AL 2 SE 3 + 3 H 2 O → AL 2 O 3 + 3 H 2 SE
Selenium Reacts с 2 SE
Selenium Reacts с 2 SE
Selenium Reacts с
именование: После Селена, греческая богиня Луны
Открытие и первая изоляция: Jöns Jakob Berzelius и Johann Gottlieb Gahn (1817)
9
Selenium9
Selenium. ) и фотопроводящие (электрическое сопротивление уменьшается при увеличении освещенности) свойства, и он широко используется в электронике, такой как фотоэлементы, фотокопировальные устройства (ксерография для воспроизведения и копирования документов, писем и т. д.), экспонометры и солнечные элементы.
д.), экспонометры и солнечные элементы. Наиболее широко селен используется в стекольной промышленности в качестве добавки к стеклу для обесцвечивания стекла (обесцвечивания стекла) и придания темно-красного цвета стеклу и эмали.
Его также можно использовать для уменьшения пропускания солнечного света архитектурным стеклом, придавая ему бронзовый оттенок.
Используется для изготовления пигментов для керамики, красок и пластмасс.
Селеновое стекло
Содержание селена около 15% в селените натрия (Na 2 SeO 3 ) для кормов для животных и пищевых добавок .
Селен используется в металлических сплавах, таких как свинцовые пластины, используемые в аккумуляторных батареях и в выпрямителях для преобразования тока переменного тока в ток постоянного тока .
Используется в качестве добавки для изготовления нержавеющей стали и для повышения стойкости к истиранию вулканизированных каучуков .
AСелен токсичен для грибка кожи головы, вызывающего перхоть, поэтому он используется в некоторых шампуни против перхоти .
Биологическая роль AСелен считается практически нетоксичным и считается важным микроэлементом для некоторых видов, включая человека.
Человеческие тела содержат около 14 миллиграммов, а каждая клетка человеческого тела содержит более миллиона атомов селена.
Слишком малое количество селена может вызвать проблем со здоровьем , но слишком много также опасно.
Больше, это канцерогенный и тератогенный (нарушает развитие эмбриона или плода).
Селенид водорода (H 2 Se) и другие соединения селена чрезвычайно токсичны и по своим физиологическим реакциям напоминают мышьяк.
Селенид водорода в концентрации 1,5 ppm непереносим для человека.
Несвязанный селен содержится в нескольких редких минералах , некоторые из которых могут содержать до 30% селена, и они обычно встречаются вместе с сульфидами металлов, таких как медь, цинк и свинец .
АСелен получают из анодных шламов, которые получают при электролитическом рафинировании меди.
Эти буровые растворы либо обжигают с карбонатом натрия (Na 2 Co 3 ) , либо с серной кислотой (H 2 SO 4 ), , либо плавят с карбонатом натрия для выделения селена.
Ежегодное мировое производство составляет около 2000 тонн.
30 × 10 -7 % (в Вселенной )
0,0013 % (в Метеориты )
5 × 10 -6 % (в Корек Земля )
4,5,5,5,5,5,5,5,5,59953 -8 – -8 -8 -8 -8 -8 % -8 % -8 % (.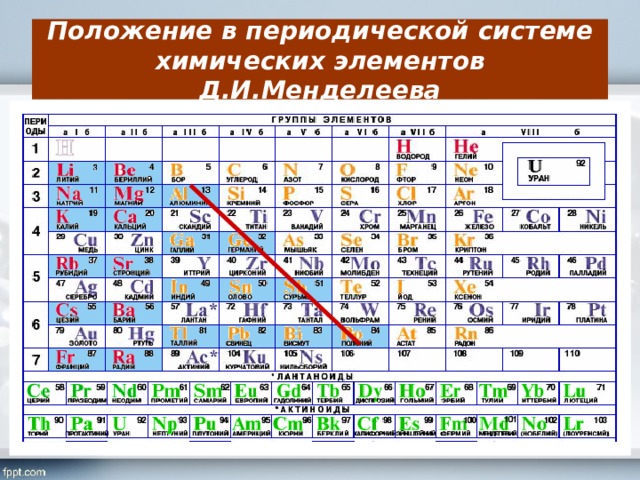

 Слишком много селена может быть токсичным и вызвать серьезные проблемы со здоровьем.
Слишком много селена может быть токсичным и вызвать серьезные проблемы со здоровьем.