ПромМетиз +7 (812) 385-76-07 Ртуть
Главная » Справочная информация » Таблица металлов » Ртуть
Общие сведения.
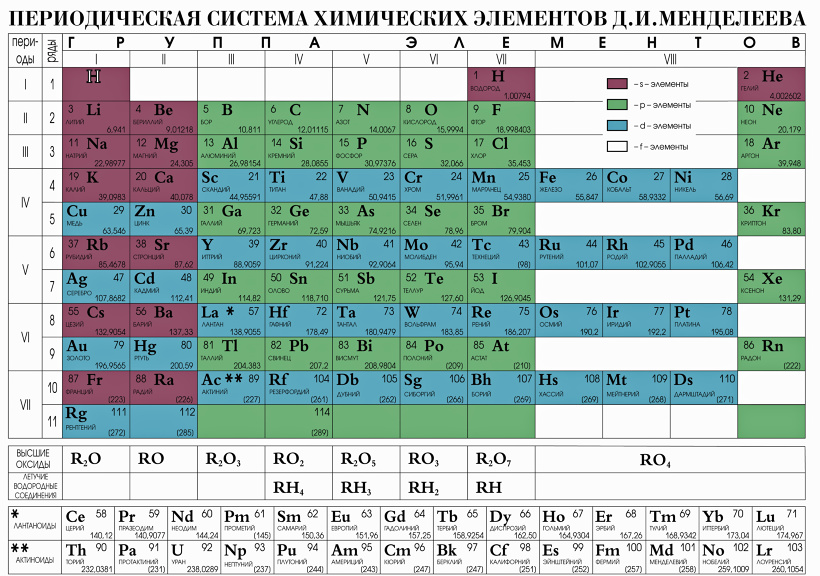
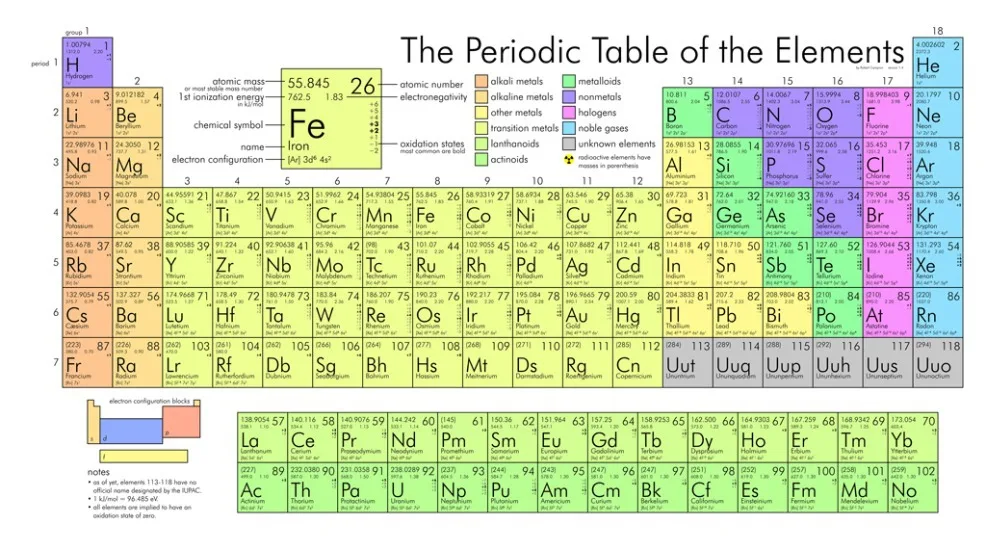
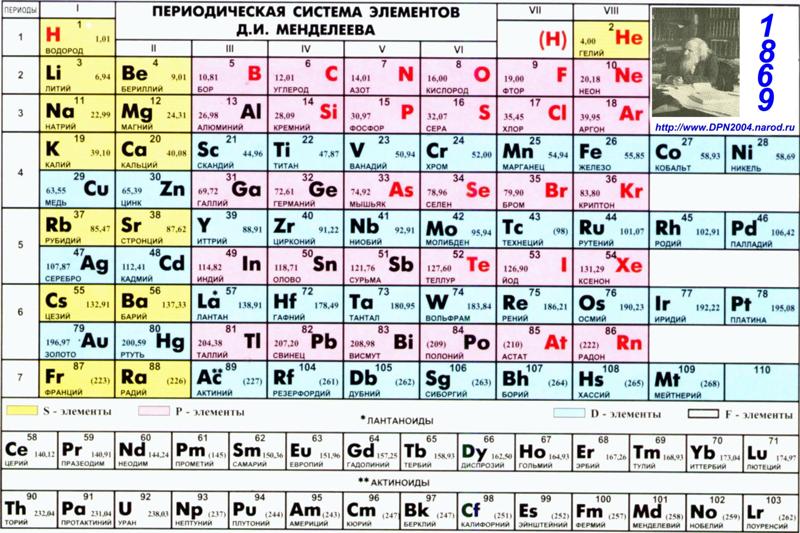
Ртуть относится к химическим элементам главной подгруппы второй группы в периодической таблице Менделеева. По данной классификации она относится к шестому периоду и обладает атомным номером 80. Ртуть относится к классу металлов, что позволяет определить основные свойства данного элемента. Атомная масса составляет 200,59 грамма на один моль. При комнатной температуре находится в жидком состоянии и обладает бело-серебряным цветом. Другой особенностью можно назвать довольно высокий показатель объёмной массы. В специализированной химической литературе ртуть обозначается двумя символами: Hg, что является сокращённым от латинского Hydrargyrum. Русское название было получено от слова «катиться» на литовском языке. Причина этого заключается в жидкой форме вещества, нетипичной для металлов при обычной температуре.
История.
Ртуть была известна человечеству с древних времён. Первоначально она была открыта в самородном виде, поскольку выступает каплями на некоторых горных породах. Поскольку такое количество не позволяет получить достаточных объёмов, то присутствовал другой способ, открытый несколько позже. Ртуть добывали методом обжига киновари, что являлось весьма токсичным способом. Несмотря на это, данный элемент всегда был востребован, поскольку с его помощью осуществлялась добыча золота. Стоит отметить тот факт, что получаемый металл не был чистым и содержал большое количество примесей в своём составе.
Только в 1735 году химиков из Швеции Георгом Брандтом была получена ртуть с минимальным процентным содержанием других элементов. Это стало важным этапом на пути развития знаний об этом элементе, поскольку позволило лучше исследовать его.
Нахождение в природе.
Данный элемент относится к категории относительно редких. Если рассматривать усреднённое значение, то оно составляет 83 миллиграмма ртути на одну тонну грунта. Ввиду некоторых своих характеристик, данный металл сложно реагирует с другими соединениями и простейшими веществами. Таким образом, ртутные руды являются одними из самых концентрированных среди всех остальных. Зачастую, элемент встречается в чистом виде, но такой вариант сложно встретить близко к поверхности. Практически вся ртуть рассеяна по планете и добыча в таком виде не может являться рентабельной. В месторождениях присутствует не более 0,02 процента от общих мировых запасов.
Если рассматривать усреднённое значение, то оно составляет 83 миллиграмма ртути на одну тонну грунта. Ввиду некоторых своих характеристик, данный металл сложно реагирует с другими соединениями и простейшими веществами. Таким образом, ртутные руды являются одними из самых концентрированных среди всех остальных. Зачастую, элемент встречается в чистом виде, но такой вариант сложно встретить близко к поверхности. Практически вся ртуть рассеяна по планете и добыча в таком виде не может являться рентабельной. В месторождениях присутствует не более 0,02 процента от общих мировых запасов.
На данный момент, геологами открыто около двух десятков минералов, содержащих ртуть. При этом, большинство из них не подходят для целей добычи. Наибольшая отдача возможна для киновари, поскольку в нём присутствует до 87 процентов исходного элемента. Несколько меньшей ценностью обладают метациннабарит и блёклая руда. Данные минералы являются основным источником ртути в современной промышленности.
Месторождения представлены по всему миру, но наиболее богатые и перспективные располагаются в России, Украине, Киргизии и некоторых других странах.
Содержание в атмосфере и влияние на человеческий организм.
Ртуть обладает большой биологической опасностью, поскольку, как и некоторые другие тяжёлые металлы, способна накапливаться в организме. Это приводит к тяжёлым отравлениям, а также возникновению наследственных заболеваний. Содержание в атмосфере до промышленной революции было минимальным. В наши дни оно несколько повысилось, но остаётся на допустимом уровне. Как правило, повышенная концентрация характерна для промышленных районов, где сосредоточено тяжёлое производство.
Физические и химические свойства.
Ртуть имеет плотность 13,546 грамма на кубический сантиметр. Температура плавления составляет 234 Кельвина, что несколько меньше, чем ноль градусов по Цельсию. В зависимости от нагрева, весьма сильно меняется объёмная масса вещества.
В зависимости от нагрева, весьма сильно меняется объёмная масса вещества.
По химическим свойствам ртуть имеет две степени окисления. В ходе химических реакций могут формироваться устойчивые катионы, что нехарактерно для металлов. Данное вещество реагирует с некоторыми оксидами и гидрокомплексами. Возможны соединения ртути +4, что связано с особенностями электронной оболочки. Они крайне неустойчивы и быстро разрушаются.
Применение.
Раньше ртуть использовалась в некоторых медицинских препаратах и оборудовании, но в наши дни она практически вытеснена из данной сферы. Несмотря на это, металл нашёл активное использование в других направлениях. Сюда относится применение в качестве заполнителя для термометров. За счёт своего расширения и сжатия в результате воздействия температурного фактора, элемент весьма популярен в этой сфере. Ртуть используется в люминесцентных лампах, датчиках положения, сплавах для ионных двигателей, а также герметичных выключателях.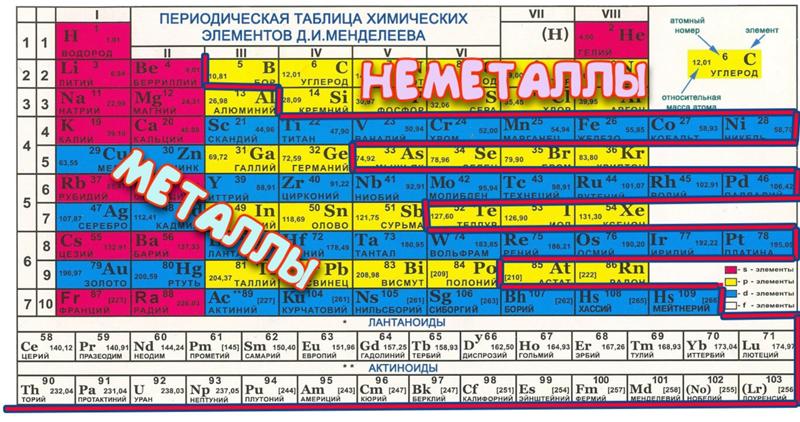
150-летие Таблицы Менделеева – Поиск-НН
В России торжественно открыт Год Периодической системы химических элементов
2019 г. провозглашен Генеральной ассамблеей ООН Международным годом Периодической таблицы химических элементов в честь 150-летия открытия великим российским ученым Дмитрием Ивановичем Менделеевым Периодического закона химических элементов. Идея была предложена Российской академией наук, Российским химическим обществом имени Д. И. Менделеева, Министерством науки и высшего образования РФ, российскими и зарубежными учеными. Инициатива была поддержана в Правительстве РФ, и 29 декабря 2018 г. Председатель Правительства РФ Дмитрий Медведев подписал распоряжение «О проведении в 2019 г. Международного года Периодической таблицы химических элементов». Инициативу России в проведении Года таблицы Менделеева поддержали зарубежные страны, международные научные организации и более 80 национальных академий наук и научных обществ.
Торжественное открытие Международного года Периодической таблицы химических элементов Д. И. Менделеева состоялось 29 января в Париже в штаб-квартире ЮНЕСКО (подробно об этом событии рассказывается в январском номере журнала «Поиск-НН»), а в России открытие прошло 6 февраля в стенах главного здания РАН. В преддверии церемонии оргкомитет по подготовке и проведению Международного года Периодической таблицы химических элементов собрался на последнее перед открытием заседание. Члены оргкомитета — премьер-министр Дмитрий Медведев, Министр науки и высшего образования РФ Михаил Котюков, Министр просвещения РФ Ольга Васильева, ректор МГУ им. М. В. Ломоносова Виктор Садовничий, президент РАН Александр Сергеев и другие — обсудили актуальные проблемы развития науки.
И. Менделеева состоялось 29 января в Париже в штаб-квартире ЮНЕСКО (подробно об этом событии рассказывается в январском номере журнала «Поиск-НН»), а в России открытие прошло 6 февраля в стенах главного здания РАН. В преддверии церемонии оргкомитет по подготовке и проведению Международного года Периодической таблицы химических элементов собрался на последнее перед открытием заседание. Члены оргкомитета — премьер-министр Дмитрий Медведев, Министр науки и высшего образования РФ Михаил Котюков, Министр просвещения РФ Ольга Васильева, ректор МГУ им. М. В. Ломоносова Виктор Садовничий, президент РАН Александр Сергеев и другие — обсудили актуальные проблемы развития науки.
В своем вступительном слове Дмитрий Медведев обозначил серьезную проблему — сегодня государство до сих пор остается главным источником финансирования науки: «Наша экономика пока еще не воспринимает науку как помощника в развитии, поэтому цепочка от перспективной идеи до ее реального внедрения в России, как правило, слишком длинная», — отметил премьер. По его мнению, новые технологии и инновации для экономики и бизнеса — это возможность успешно конкурировать на мировом и внутреннем рынках. «Государство должно не только вкладываться в науку, но так же, как бизнес, давать ученым запрос на открытия, ставить перед ними задачи такого масштаба, которого они достойны», — пояснил Медведев. Он уверен, что если этого не делать, то наша страна будет проигрывать в мировой конкуренции за идеи и технологические решения. Дмитрий Медведев также подчеркнул, что поддержка талантливых ученых, развитие перспективных отраслей науки — это действительно приоритет для государства, и эти слова должны быть не лозунгом, а реальностью. «Россия должна войти в ведущую пятерку стран, которые ведут исследования в ключевых сферах научно-технологического развития. Цель сложная, но в общем достижимая», — отметил он.
По его мнению, новые технологии и инновации для экономики и бизнеса — это возможность успешно конкурировать на мировом и внутреннем рынках. «Государство должно не только вкладываться в науку, но так же, как бизнес, давать ученым запрос на открытия, ставить перед ними задачи такого масштаба, которого они достойны», — пояснил Медведев. Он уверен, что если этого не делать, то наша страна будет проигрывать в мировой конкуренции за идеи и технологические решения. Дмитрий Медведев также подчеркнул, что поддержка талантливых ученых, развитие перспективных отраслей науки — это действительно приоритет для государства, и эти слова должны быть не лозунгом, а реальностью. «Россия должна войти в ведущую пятерку стран, которые ведут исследования в ключевых сферах научно-технологического развития. Цель сложная, но в общем достижимая», — отметил он.
Облегчить путь к достижению этих целей призван национальный проект «Наука», о котором на заседании оргкомитета рассказал Михаил Котюков. Он подчеркнул, что в последние годы благодаря пристальному вниманию государства к развитию исследований и разработок в России уже подготовлена достаточно серьезная база и наблюдается положительная динамика по ключевым направлениям: Россия по итогам 2017 г. уже входит в пятерку стран-лидеров по таким направлениям, как органическая химия, общая математика и ряду общественно-гуманитарных направлений. Кроме того, по словам Котюкова, Россия уже находится в десятке стран по количеству научных публикаций в серьезных международных изданиях.
уже входит в пятерку стран-лидеров по таким направлениям, как органическая химия, общая математика и ряду общественно-гуманитарных направлений. Кроме того, по словам Котюкова, Россия уже находится в десятке стран по количеству научных публикаций в серьезных международных изданиях.
Президент РАН Александр Сергеев отметил большую важность утверждения имени Менделеева за Периодической таблицей химических элементов во всем мире, тем более что по каким-то причинам не все хотят называть ее «таблицей Менделеева». Добиться признания заслуг Менделеева во всем мире и утвердить его имя за таблицей — одна из главных задач на этот год: «Мы в Академии наук считаем, что есть три основные цели, которые Россия должна поставить и решить в 2019 году: первая – чтобы таблицу все стали называть именем Менделеева; вторая — чтобы мы получили наконец Нобелевскую премию; третья — чтобы мы выиграли олимпиаду по химии летом в Париже. То есть — таблица, Нобелевская премия, олимпиада», — пояснил Сергеев.
Открытие Года Периодической системы химических элементов Менделеева продолжилось в Большом зале РАН. Президент РАН и вице-президент Лондонского королевского общества сэр Мартин Полякофф прочитали две лекции о Периодической системе Менделеева. Александр Сергеев рассказал гостям церемонии об истории открытия и создания Периодической системы — от античности до Менделеева.
Президент РАН и вице-президент Лондонского королевского общества сэр Мартин Полякофф прочитали две лекции о Периодической системе Менделеева. Александр Сергеев рассказал гостям церемонии об истории открытия и создания Периодической системы — от античности до Менделеева.
Человек с давних времен стремился привести окружающий его хаос в порядок, и российский химик Дмитрий Иванович Менделеев был далеко не первым ученым, пытавшимся упорядочить известные химические элементы. Первую попытку предпринял немецкий химик Иоганн Дёберейнер, создавший «Триады Дёберейнера» и объединивший таким образом сходные по свойствам элементы в три группы. Затем французский химик Александр де Шанкуртуа создал «Земную спираль», английский ученый Джон Ньюлендс — «Октавы Ньюлендса», немецкий ученый Юлиус Мейер — «Таблицу Мейера».
За 150 лет с момента открытия Менделеевым Периодического закона таблица химических элементов значительно расширилась. Российская наука внесла неоценимый вклад в открытие новых элементов и «заполнение» таблицы. Элементы рутений, самарий, дубний, флеровий, московий и оганессон открыты и синтезированы российскими учеными. Последний из них — оганессон — назван в честь его первооткрывателя, академика Юрия Цолаковича Оганесяна, единственного живущего на планете человека, в честь которого назван химический элемент.
Элементы рутений, самарий, дубний, флеровий, московий и оганессон открыты и синтезированы российскими учеными. Последний из них — оганессон — назван в честь его первооткрывателя, академика Юрия Цолаковича Оганесяна, единственного живущего на планете человека, в честь которого назван химический элемент.
Сэр Мартин Полякофф уже не первый год называет Юрия Оганесяна «супергероем». На церемонии присвоения названий новым химическим элементам, проходившей в Москве в 2017 г., он даже подарил ему супергеройский костюм с вышитыми на нем таблицами Менделеева. Последних у английского химика хранится множество, в разных видах и формах — на галстуках, на рисунках, в виде кубиков, в каждом из которых находится химический элемент таблицы, и даже на волоске самого сэра Мартина тоже есть таблица Менделеева. Это самая маленькая таблица в мире, которая даже вошла в книгу рекордов Гиннеса. Все эти таблицы сэр Полякофф продемонстрировал на своей лекции. Он не переставал убеждать участников церемонии открытия в важности и особой значимости таблицы Менделеева для каждого из нас.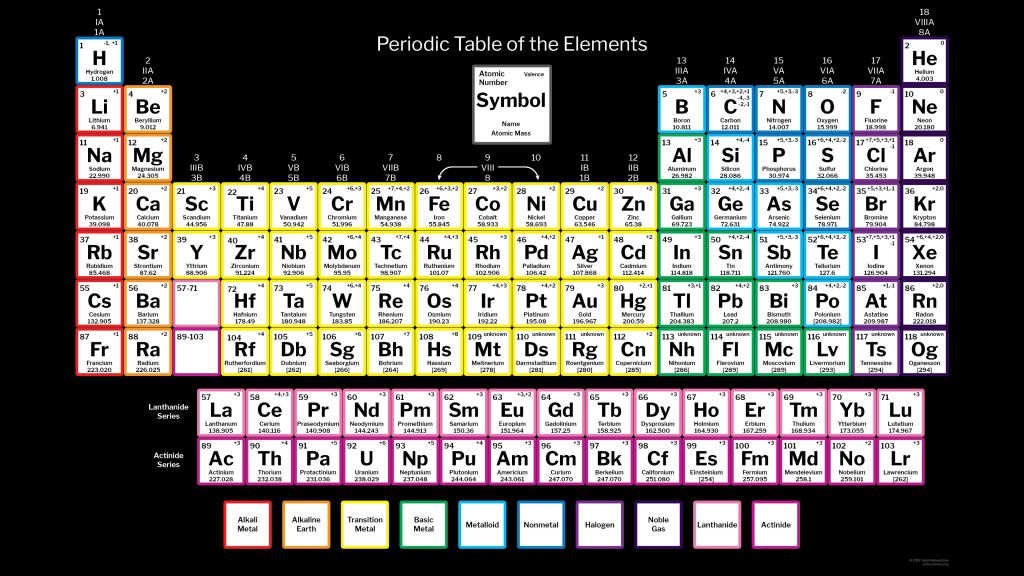 Периодическую таблицу можно увидеть в наши дни во всех химических классах мира.
Периодическую таблицу можно увидеть в наши дни во всех химических классах мира.
Ртуть Hg (Элемент 80) Периодической таблицы
80 Hg (Меркурий)
Карточка Меркурия
Это тяжелый серебристо-белый металл, который иногда называют ртутью.
Ртуть – единственный металл, который находится в жидкой форме при нормальных температурах, и это плохой проводник тепла, , но хороший проводник электричества.
Ртуть является ядом , который легко усваивается через желудочно-кишечный тракт, дыхательные пути или через неповрежденную кожу.
При 20°C воздух, насыщенный парами ртути , содержит концентрацию, превышающую пределы токсичности y, и его токсичность увеличивается с повышением температуры.
Жидкая ртуть
Идентификация
Номер CAS: CAS7439-97-6
Номер CID: CID23931
Класс опасности DOT: 8
Номер DOT: 2809
Номер RTECS000005
Индекс содержания
Основные свойства ртути Произношение: Mur-kyuh-ree
Внешний вид: Серебристый
Массовый номер: 201
Стандартный атомный вес: 200,592 г/моль
Атомный номер (Z): 80
Электроны: Электроны: Электроны:: 200,592 г моль
(Z): 80
Электроны: 200,592 г моль
(Z): 80
Электроны: 200,592 г моль
(Z): 80
: Электроны: 200,592 г
. 80
80
Протоны: 80
Нейтроны: 121
Период: 6
Группа: 12
Блок: d
Категория элемента: Переходный металл
Электроны на оболочке: K2, L8, M18, N32, O18, P2
Электронная конфигурация: 0 60 1s 9 2 с 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 4f 14 5d 10 6s 2
Конфигурация ртутного электрона
Термические свойства ртути Фаза: жидкость
Печание: 234,32 К (-38,82 O C, -37,89 O F)
. С, 674.11 о F)
Температура Дебая: 100 K (-173,15 o C, -279,67 o F)
Температура в тройной точке: 234,31 K (-38,84 o C, -37,912 o C, давление в тройной точке 6 o 1)
5 : 1,65 × 10 -7 кПа
. /моль
Удельная теплоемкость: 139 Дж/(кг К)
Молярная теплоемкость: 27,984 Дж/(моль. К)
К)
Тепловое расширение: 60,4 мкм/(м∙К)
Теплопроводность: 8,30 Вт/(м∙К)
Электропроводность: 1×10 6 См/м
A Удельное электрическое сопротивление: 961 нОм∙м
A Электрический тип: проводник
Критическая точка (сверхпроводящая точка): 4,154 K (-269 o C, -452,2 o F)
A Магнитный тип: Диамагнитный
Магнитная восприимчивость (x моль ): -33,4×10 -6 см 3 /моль
Объемная магнитная восприимчивость: -0,0000284
Массовая магнитная восприимчивость: -2,1×10 6 90 6 -6 9 9 9 9
Molar magnetic susceptibility: -0.421×10 -9 m 3 /mol
Density: 13.534 g/cm 3
Molar volume: 0.0000148213 m 3 /mol
Объемный модуль: 25 ГПа
Индекс преломления: 1. 000933
000933
Скорость звука: 1451 м/с
Состояния окисления: 2 , 1, -2
Валентные электроны: 6S 2
Заряд ион: HG 2+ 2+: 6S 2
.
Ионизационный потенциал атома: 10.39
Энергии ионизации: 1 -й: 1007 KJ.MOL 2 -е: 1810 KJ/MOL 3 -й: 3300 кДж/моль
Ионный радио эмпирический)
Ван-дер-Ваальса: 155 часов 9 минут0011 Ковалентный радиус: 132 ± 5 пм
Заполняющая орбита: 5d 10
Кристаллическая структура: ромбоэдрическая
Параметры сетки: : R_3m
Космическая группа Номер группы: 166
Ромбоэдрал
Реакционная способность ртути Электронигатирование: 2,00 (шкала Полинга)
Валентность: +2
Электронный сродство: 0 кДж/моликовое0002 Половина срока службы: стабильная (бесконечность)
Срок службы: стабильная (бесконечность)
Квантовое число: 1 S 0
Нейтронный поперечный сечение (отрубки): 374
Нейтронный массовый абсорбция: 0,063
Изотопы: 194 HG 1959 958 958 8 8 8 8 8 8 8 8 88 Hg 196 Hg 197 Hg 198 Hg 199 Hg 200 Hg 201 Hg 202 Hg 203 Hg 204 Hg
| Isotope | Численность (%) | Атомная масса г/моль | Период полураспада (т 1/2 ) |
194 рт. | Син | – | 444 г |
| 195 рт.ст. | Син | – | 9,9 ч |
| 196 рт.ст. | 0,15 | 195,964 | Стабильный |
| 197 рт.ст. | Син | – | 64,14 ч |
| 198 рт.ст. | 10.04 | 197,965 | Стабильный |
| 199 рт.ст. | 16,94 | 198,967 | Стабильный |
| 200 рт.ст. | 23.14 | 199,968 | Стабильный |
| 201 рт.ст. | 13,17 | 200,971 | Стабильный |
| 202 рт.ст. | 29,74 | 201,970 | Стабильный |
| 203 рт.ст. | Син | – | 46.61 д |
204 рт. ст. ст. | 6,82 | 203,972 | Стабильный |
Он реагирует в воздух в 350 O C и образуется:
2 HG (L) + O 2 (G) → 2 HG. (оксид ртути (II))
Не реагирует с водой .
Металл реагирует со всеми галогенами и образует дигалогениды ртути:
Hg (ж) + F 2 (г) → HgF 2 (т) [белый] (ртуть (II) фторид)
Hg (л) + Cl 2 (г) → HgCl 2 (т) [белый] (ртуть (II) хлорид)
Hg (л) + Br 2 (г) → HgBr 2 (т) [белый] (ртуть (II) бромид)
Hg (л) + I 2 (г) → HgI 2 (т) [белый] (ртуть (II) йодид)
Hg(ж) осаждается ионами Cl – , образуя:
Hg 2 2+ (водн.) + 2 Cl – (водн.) → Hg 9 9058 2 (т) [белый]
Hg(II) осаждается ионами I – , образуя:
Hg 2+ (водн. ) + 2 I – (водн.) → ) [красный]
) + 2 I – (водн.) → ) [красный]
Осадок растворяется в избытке I – , и образует почти бесцветный тетраиод комплекс ртути:
HgI 2 (т) [красный] + 2 I – (водн.) → [HgI 4 ] 2- (водн.)
Металл не реагирует с неокисляющими кислоты, , но реагирует с концентрированной азотной (HNO 3 ) или серной кислотой (H 2 SO 4 ), и образует соединения ртути (II) вместе с оксидами азота или серы.
Ртуть медленно растворяется в разбавленной азотной кислоте (HNO 3 ), и образует нитрат ртути (I), нитрат ртути (Hg 2 (NO 3 ) 2 ).
2 Hg (л) + 2 HNO 3 (водн.) → Hg 2 (NO 3 ) 2 (водн.) + H 2 (г)
Металл не реагирует с щелочи при нормальных условиях.
Hg (I) в виде Hg 2 2+ реагирует с гидроксидом с образованием:0066 (водный) → Hg 2 O (т) [черный]
Осадок разделяется на HgO и Hg при нагревании:
Hg 2 O (т) → HgO (т) + Hg (ж)
Hg(II) реагирует с гидроксидом OH – при холодных условиях и образует желтый осадок HgO:
Hg 2+ (водн.) + 2 OH желтый] + H 2 O (ж)
Осадок становится красным, при нагревании.
Производство
HG извлекается путем отопления Cinnabar в воздухе и конденсации пары:
HGS + O 2 → HG + SO 2
NAMING: Symbol Hydrargyrum, , происходящее от греческого слова «Hydrargyros» («hydor» для воды и «argyros» для серебра).
Открытие: Древние китайцы и индийцы (до 2000 г. до н.э.)
до н.э.)
Это тяжелый жидкий металл, и из-за его высокой токсичности многие виды использования постепенно прекращаются или пересматриваются.
В настоящее время ртуть в основном используется в качестве катализаторов в химической промышленности, а также в некоторых электрических переключателях и выпрямителях.
Металлическая ртуть используется в промышленности в качестве жидкого электрода в производстве хлора и гидроксида натрия (Cl 2 и едкого натра, NaOH) путем электролиза рассола (вода NaCl).
Из-за своей высокой плотности металл используется в манометрах и барометрах , широко используется в термометрах , и широко используется в термометрах, а из-за его высокой скорости теплового расширения он довольно постоянен в широком диапазоне температура.
Ртуть образует сплавы (называемые амальгамами ) с другими металлами, такими как серебро, золото и олово, где амальгамы с золотом используются для извлечения золота из золотых руд, а с ртутью используется в зубных пломбах.
Vermilion (сульфид ртути, HgS) — это высококачественный ярко-красный пигмент для краски, который очень токсичен, поэтому его следует использовать с большой осторожностью.
Каломель (хлорид ртути, Hg 2 Cl 2 ) используется в качестве слабительного в медицине и в качестве эталона в электрохимических измерениях .
Оксид ртути (оксид ртути, HgO) используется в кожа мази.
Гремучая ртуть (Hg(CNO) 2 ) является первичным взрывчатым веществом , поэтому используется в качестве детонатора.
Красная ртуть может использоваться при создании ядерных бомб и различных систем вооружения.
Сульфат ртути (сульфат ртути, HgSO 4 ) используется в качестве катализатора в органической химии.
Хлорид ртути (коррозионная сулема, HgCl 2 ) представляет собой высокотоксичное соединение, которое используется в качестве инсектицида , в крысином яде и в качестве дезинфицирующего средства.
Металл также используется для изготовления ртутных ламп , рекламных вывесок, ракет, Мезилесов, военных разведывательных площадок и т.д. в окружающей среде даже каждая пища, которую мы едим, содержит небольшое количество ртути.
Ежедневное потребление менее 0,01 мг (миллиграммов) и около 0,3 грамма в течение жизни, но в гораздо более высоких дозах это будет токсично, а одна форма ртути (метилртуть, [CH 3 Hg] + ) особенно очень опасно.
Когда ртуть достигает поверхности воды или почвы, микроорганизмы могут преобразовать ее в метилртуть.
Метилртуть может накапливаться (собираться вместе) в мясе рыбы и быть съеденной людьми, что делает их ill (поражение кишечника, нарушение работы желудка, поражение почек , репродуктивная недостаточность и изменение ДНК и т.д..)
Действует как кумулятивный яд (означает, что попав в организм, накапливается в таких местах : кровь, печень, почки и мозг) и опасные уровни легко достигаются в воздухе.
В виде паров Очень опасен, так как легко проникает в организм.
Важно, чтобы ртуть была обращаться с осторожностью , где контейнеры с ртутью должны быть надежно закрыты и следует избегать утечки, и Если необходимо нагреть ртуть или ее соединения, это следует делать в хорошо вентилируемом капюшоне (головной убор) .
Распространенность ртути0003 HgS ).Металл извлекается путем нагревания киновари в токе воздуха и конденсации паров.
Ежегодное мировое производство составляет около 11 000 тонн.
1 × 10 -7 % (в Universe )
0,000025 % (в метеоритах )
2 × 10 -6 % (в Sun )
6,7 × 100065 -6 % (Sun )
6,7 × 100065 -6 % ( Sun ) В Земной Коре )
5×10 -9 % (В Океанах )
Киноварь Руда
World’s Top 3 producers of Mercury 1) China
2) Kyrgzstan
3) Chile
1) Mexico
2 China
3) Kyrgyzstan
Mercury Price
Pure (99,99%) Цена металла составляет около $ 400-500 за кг (килограмм)
#mercury
. 0004
0004
Ртуть (Hg) — атомный номер 80
Произносится
MER-kyoo-ri
Ртуть (Hg) представляет собой жидкий металл серебристого цвета с атомным номером 80 в периодической таблице. Это переходный металл группы 12. Он имеет символ Hg.
Меркурий был известен людям еще в Древнем Египте, и его название происходит от алхимического движения в честь планеты Меркурий. Его символ Hg происходит от латинского Hydragyrum, что переводится как жидкое серебро. Это токсичный металл, который многие годы использовался в качестве лекарства. Ртуть хорошо проводит электричество и используется в электрических переключателях, а также может использоваться в ядерных реакторах. Он также используется в производстве хлора и золота. Ртуть существует в виде руды в земной коре в рудной киновари. Это жидкий металл при комнатной температуре с температурой плавления -38°С и температурой кипения 356°С.
Загрузите Mercury в виде изображения для печати и с полным масштабированием
Получите бесплатную загрузку здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления ртути?
Температура плавления ртути -38,87°C, то есть при -38,87°C она превратится в жидкость.
Какова температура кипения ртути?
Температура кипения ртути 356,58°C, что означает, что при 356,58°C она превратится в газ.
Что такое электроотрицательность ртути?
Электроотрицательность Меркурия равна 2. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Открыт
Известен древним.
Дата открытия
265 г. до н.э.
Что такое Теплота испарения ртути?
Ртуть имеет теплоту испарения 59,229 кДж/моль.
Применение
Используется в термометрах, барометрах и батареях. Также используется в электрических выключателях и ртутных осветительных приборах.
Источники
Практически вся ртуть поступает из киновари или сульфида ртути (HgS). Некоторые источники красной киновари настолько богаты ртутью, что в случайных образцах можно обнаружить капли элементарной ртути.
Об авторе
Натан М.

Автор
Натан имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Citation
“Mercury”, опубликованная по адресу 30 декабря 2019 г. https://breakeatom.com/elements/mercury
80
Protons
80
Электроны
121
Neutron HG
Атомный вес
200,592
Атомный номер
80
Состояние
Жидкость
Плата.0005
356.58
Unknown
°C
Heat of Vaporization
59.229
Unknown
kJ/mol
Crystal Structure
Rhombohedral
Thermoconductivity
0.0834
Unknown
W/cmK
Shells
2,8,18,32,18,2
Группа
Переходный металл
Период
6
Блок
D Блок
2 Орбитали
6/см омПервый потенциал ионизации
10.