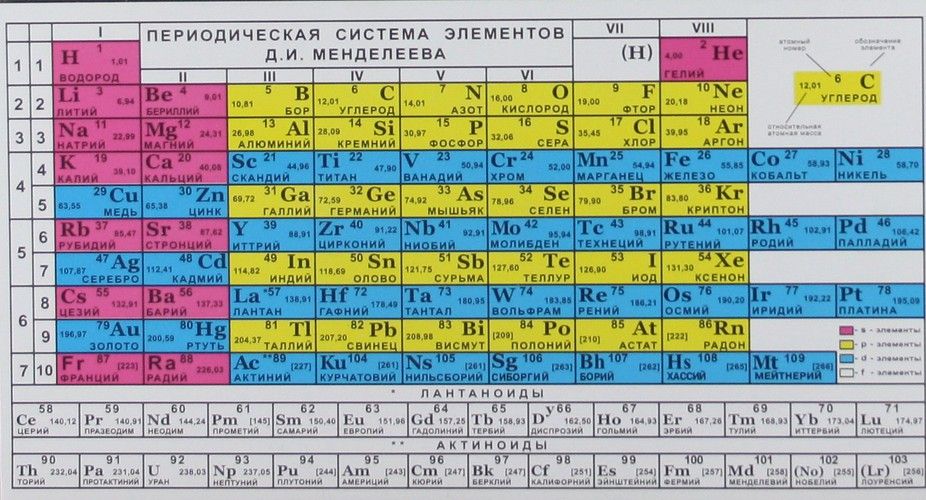
Таблица Менделеева online – I
I
53
7
18
18
8
2
126.9045±1
5s25p5
Иод
| Относительная электроотрицательность (по Полингу): | 2,21 |
| Температура плавления: | 113,5°C |
| Температура кипения: | 184,35°C |
| Теплопроводность: | 0 |
| Плотность: | 4,93 г/см3 |
| Открыт: | в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент |
| Цвет в твёрдом состоянии: | Фиолетово-темно-серый |
| Тип: | Галоген |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f05s25p5 |
| Электронная формула: |
I – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5 I – [Kr] 5s2 4d10 5p5 |
| Валентность: | -1, +1, (+3), (+4), +5, +7 |
| Степени окисления: | -I, 0, +I, V, VII |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 10,44 В 19,131 В 33 В |
Электропроводность в тв. фазе: фазе: | 7,7*10-14 при 273K |
| Ковалентный радиус: | 1,33 Å |
| Атомный объем: | 25,74 см3/моль |
| Атомный радиус: | 1,32 Å |
| Теплота распада: | 7,824 Кдж/моль |
| Теплота парообразования: | 20,752 Кдж/моль |
| Кристаллическая структура: | Орторомбическая. Все углы прямые. Имеется по атому в каждой вершине |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
Избыток массы (кэВ) |
Период полураспада (T1/2) |
Спин и чётность ядра |
Распространённость изотопа в природе (%) |
|---|---|---|---|---|---|---|---|
| Энергия возбуждения (кэВ) | |||||||
| 108I | 53 | 55 | 107,94348(39)# | −52650(360)# | 36(6) мс | 1+# | |
| 53 | 56 | 108,93815(11) | −57610(100) | 103(5) мкс | (5/2+) | ||
| 110I | 53 | 57 | 109,93524(33)# | −60320(310)# | 650(20) мс | 1+# | |
| 111I | 53 | 58 | 110,93028(32)# | −64950(300)# | 2,5(2) с | 5/2+# | |
| 112I | 53 | 59 | 111,92797(23)# | −67100(210)# | 3,42(11) с | 1+# | |
| 113I | 53 | 60 | 112,92364(6) | −71130(50) | 6,6(2) с | 5/2+# | |
| 114I | 53 | 61 | 113,92185(32)# | −72800(300)# | 2,1(2) с | 1+ | |
| 114mI | 265,9(5) | −72530(300)# | 6,2(5) с | (7) | |||
| 115I | 53 | 62 | 114,91805(3) | −76338(29) | 1,3(2) мин | 5/2+# | |
| 116I | 53 | 63 | 115,91681(10) | −77490(100) | 2,91(15) с | 1+ | |
| 116mI | 400(50)# | −77090(110)# | 3,27(16) мкс | (7−) | |||
| 117I | 53 | 64 | 116,91365(3) | −80435(28) | 2,22(4) мин | (5/2)+ | |
| 118I | 53 | 65 | 117,913074(21) | −80971(20) | 13,7(5) мин | 2− | |
| 118mI | 190,1(10) | −80781(20) | 8,5(5) мин | (7−) | |||
| 119I | 53 | 66 | 118,91007(3) | −83766(28) | 19,1(4) мин | 5/2+ | |
| 120I | 53 | 67 | 119,910048(19) | −83790(18) | 81,6(2) мин | 2− | |
| 120m1I | −83717(18) | 228(15) нс | (1+,2+,3+) | ||||
| 120m2I | 320(15) | −83470(23) | 53(4) мин | (7−) | |||
| 121I | 53 | 68 | 120,907367(11) | −86287(10) | 2,12(1) ч | 5/2+ | |
| 121mI | 2376,9(4) | −83910(10) | 9,0(15) мкс | ||||
| 122I | 53 | 69 | 121,907589(6) | −86080(5) | 3,63(6) мин | 1+ | |
| 123I | 53 | 70 | 122,905589(4) | −87943(4) | 13,2235(19) ч | 5/2+ | |
| 124I | 53 | 71 | 123,9062099(25) | −87365,0(24) | 4,1760(3) сут | 2− | |
| 125I | 53 | 72 | 124,9046302(16) | −88836,4(15) | 59,400(10) сут | 5/2+ | |
| 126I | 53 | 73 | 125,905624(4) | −87911(4) | 12,93(5) сут | 2− | |
| 127I | 53 | 74 | 126,904473(4) | −88983(4) | Стабильный | 5/2+ | 100 |
| 128I | 53 | 75 | 127,905809(4) | −87738(4) | 24,99(2) мин | 1+ | |
| 128m1I | −87600(4) | 845(20) нс | 4− | ||||
| 128m2I | 167,367(5) | −87571(4) | 175(15) нс | (6)− | |||
| 129I | 53 | 76 | 128,904988(3) | −88503(3) | 1,57(4)·107 лет | 7/2+ | |
| 130I | 53 | 77 | 129,906674(3) | −86932(3) | 12,36(1) ч | 5+ | |
| 130m1I | −86892(3) | 8,84(6) мин | 2+ | ||||
| 130m2I | 69,5865(7) | 133(7) нс | (6)– | ||||
| 130m3I | 82,3960(19) | 315(15) нс | – | ||||
| 130m4I | 85,1099(10) | 254(4) нс | (6)– | ||||
| 131I | 53 | 78 | 130,9061246(12) | −87444,4(11) | 8,02070(11) сут | 7/2+ | |
| 132I | 53 | 79 | 131,907997(6) | −85700(6) | 2,295(13) ч | 4+ | |
| 132mI | 104(12) | −85595(10) | 1,387(15) ч | (8−) | |||
| 133I | 53 | 80 | 132,907797(5) | −85887(5) | 20,8(1) ч | 7/2+ | |
| 133m1I | 1634,174(17) | −84253(5) | 9(2) с | (19/2−) | |||
| 133m2I | 1729,160(17) | ~170 нс | (15/2−) | ||||
| 134I | 53 | 81 | 133,909744(9) | −84072(8) | 52,5(2) мин | (4)+ | |
| 134mI | 316,49(22) | −83756(8) | 3,52(4) мин | (8)− | |||
| 135I | 53 | 82 | 134,910048(8) | −83790(7) | 6,57(2) ч | 7/2+ | |
| 136I | 53 | 83 | 135,91465(5) | −79500(50) | 83,4(10) с | (1−) | |
| 136mI | 650(120) | −78850(110) | 46,9(10) с | (6−) | |||
| 137I | 53 | 84 | 136,917871(30) | −76503(28) | 24,13(12) с | (7/2+) | |
| 138I | 53 | 85 | 137,92235(9) | −72330(80) | 6,23(3) с | (2−) | |
| 139I | 53 | 86 | 138,92610(3) | −68840(30) | 2,282(10) с | 7/2+# | |
| 140I | 53 | 87 | 139,93100(21)# | −64270(200)# | 860(40) мс | (3)(−#) | |
| 141I | 53 | 88 | 140,93503(21)# | −60520(200)# | 430(20) мс | 7/2+# | |
| 142I | 53 | 89 | 141,94018(43)# | −55720(400)# | ~200 мс | 2−# | |
| 143I | 53 | 90 | 142,94456(43)# | −51640(400)# | 100# мс [>300 нс] | 7/2+# | |
| 144I | 53 | 91 | 143,94999(54)# | −46580(500)# | 50# мс [>300 нс] | 1−# | |
Тот, кто гасит свет.
 Фейнманий и глубины таблицы Менделеева / Хабр
Фейнманий и глубины таблицы Менделеева / ХабрПопробуйте почитайте англоязычные источники по истории химии и поищите в них упоминание таблицы Менделеева. Вы будете удивлены, но все-таки убедитесь, что такая формулировка тщательно избегается. Настойчиво и как-то политкорректно пишут о «периодической системе элементов». С упоминанием не только Менделеева, но и всех причастных, акцентируя роль Мейера, Деберейнера и Шанкуртуа с не меньшим пафосом, чем определяющую роль открытия второго фронта на заключительном этапе Второй мировой войны.
Отдавая должное уважаемым западным партнерам Менделеева и лично Роберту Бунзену, у которого Дмитрий Иванович учился в 1859-1861, отметим, что Менделеев вошел в историю науки не как классификатор известного, подобно Линнею, а как визионер, сумевший спрогнозировать еще не открытые элементы и, что более важно в контексте этой статьи – правильно расположить йод и теллур, несмотря на то, что теллур тяжелее йода.
В настоящее время таблицу Менделеева замыкает оганессон (Og) № 118. Он расположен ровно под радоном (№ 86) и, по логике Менделеева, должен представлять собой благородный газ, так как замыкает седьмой период. Но с завершением этого самого удивительного, эфемерного и взрывоопасного периода, вместившего в себя уран, плутоний, менделевий, флеровий и оганессон, вновь актуализируются вопросы: а где заканчивается таблица Менделеева? И до самого ли ее предела соблюдается периодический закон? Удивительно, но впервые ответ на этот вопрос довольно уверенно дал еще Ричард Фейнман.
Он расположен ровно под радоном (№ 86) и, по логике Менделеева, должен представлять собой благородный газ, так как замыкает седьмой период. Но с завершением этого самого удивительного, эфемерного и взрывоопасного периода, вместившего в себя уран, плутоний, менделевий, флеровий и оганессон, вновь актуализируются вопросы: а где заканчивается таблица Менделеева? И до самого ли ее предела соблюдается периодический закон? Удивительно, но впервые ответ на этот вопрос довольно уверенно дал еще Ричард Фейнман.
При этом он опирался на традиционную модель атома, предложенную Бором. Как известно, в модели Бора ядро атома окружено облаком электронов, и электроны обращаются вокруг ядра лишь по строго определенным разрешенным орбитам. Электрон не может занимать промежуточную орбиту, но может переходить с одной разрешенной орбиты на другую. Такой переход происходит мгновенно с излучением или поглощением кванта энергии и называется «квантовый скачок».
Скорость электрона в конкретном квантовом состоянии вычисляется по следующей формуле
,
где Z – атомный номер, соответствующий количеству протонов в ядре атома и, соответственно, количеству электронов, обращающихся вокруг нейтрального атома. Здесь же
Здесь же n – это квантовое состояние электрона, а — постоянная тонкой структуры. Постоянная тонкой структуры вычисляется по формуле
,
где e – элементарный заряд, h – постоянная Планка, а e0 – диэлектрическая постоянная, также именуемая свободной проницаемостью вакуума.
Соответственно, чем дальше от ядра находится внешняя электронная оболочка атома, тем выше скорость движущегося по ней электрона. Ричард Фейнман вычислил, что при Z = 137 скорость электрона будет чуть ниже, чем скорость света. Если следовать этой логике, элемент с атомным номером 138 существовать не может; в противном случае, его крайний электрон превысил бы скорость света.
Резерфордий и беззаконие
Тем не менее, на практике все оказывается сложнее. Во-первых, в ядрах тяжелых и сверхтяжелых элементов начинают проявляться релятивистские эффекты. Расчеты, прогнозирующие, где может закончиться таблица Менделеева, основаны на теории относительности. При увеличении ядра в нем становится все больше протонов, а значит, возрастает и сила притяжения, воздействующая на электроны. Соответственно, скорость крайних электронов растет, все существеннее приближаясь к скорости света. При таких скоростях электроны становятся «релятивистскими», и свойства этих элементов не вполне объяснимы одним лишь положением элемента в таблице. Некоторые из подобных эффектов заметны невооруженным глазом. Так, в атомах золота электроны обращаются вокруг ядра со скоростью примерно вдвое меньше световой. Из-за этого очертания орбиталей изменяются так, что золото поглощает голубую часть видимого спектра, а остальные фотоны от него отражаются. Мы наблюдаем белый свет минус сине-фиолетовую составляющую, и в результате золото приобретает характерный желто-рыжий блеск, которым выделяется на фоне окружающих его серебристых металлов.
При увеличении ядра в нем становится все больше протонов, а значит, возрастает и сила притяжения, воздействующая на электроны. Соответственно, скорость крайних электронов растет, все существеннее приближаясь к скорости света. При таких скоростях электроны становятся «релятивистскими», и свойства этих элементов не вполне объяснимы одним лишь положением элемента в таблице. Некоторые из подобных эффектов заметны невооруженным глазом. Так, в атомах золота электроны обращаются вокруг ядра со скоростью примерно вдвое меньше световой. Из-за этого очертания орбиталей изменяются так, что золото поглощает голубую часть видимого спектра, а остальные фотоны от него отражаются. Мы наблюдаем белый свет минус сине-фиолетовую составляющую, и в результате золото приобретает характерный желто-рыжий блеск, которым выделяется на фоне окружающих его серебристых металлов.
Еще в 1990-е были поставлены первые эксперименты, показавшие, что резерфордий (104) и дубний (105) проявляют не те свойства, что положены им в соответствии с позициями в периодической системе. Согласно периодическому закону, они должны напоминать по свойствам те элементы, что расположены прямо над ними, соответственно, гафний и тантал. На самом же деле, резерфордий реагирует подобно плутонию, расположенному довольно далеко от него, а дубний – как протактиний. С другой стороны, сиборгий (106) и борий (107) следуют закону, выведенному Менделеевым.
Согласно периодическому закону, они должны напоминать по свойствам те элементы, что расположены прямо над ними, соответственно, гафний и тантал. На самом же деле, резерфордий реагирует подобно плутонию, расположенному довольно далеко от него, а дубний – как протактиний. С другой стороны, сиборгий (106) и борий (107) следуют закону, выведенному Менделеевым.
Дальше – больше. Оказывается, рентгений (111) сближается по свойствам с астатом, а не с золотом, а коперниций (112) тяготеет по свойствам к благородным газам, даже сильнее, чем оганессон (118). Вероятно, теннессин (117) по свойствам скорее похож на галлий, а нихоний (113) сравним со щелочными металлами. Все эти аномалии связаны со все более выраженным проявлением релятивистских эффектов в сверхкрупных атомах.
Немного о корпускулярно-волновом дуализме
Боровская модель атома в той трактовке, согласно которой таблицу должен замыкать элемент № 137, также не вполне соответствует реальному положению вещей. Предмет квантовой физики гораздо сложнее, чем предмет классической; как правило, квантовые феномены не имеют наглядного аналога на макроуровне. Например, в соответствии с законами классической физики, электроны, обращающиеся вокруг ядра, обязаны падать на ядро, а атомы – схлопываться.
Предмет квантовой физики гораздо сложнее, чем предмет классической; как правило, квантовые феномены не имеют наглядного аналога на макроуровне. Например, в соответствии с законами классической физики, электроны, обращающиеся вокруг ядра, обязаны падать на ядро, а атомы – схлопываться.
Казалось бы, само существование атома является опровержением законов физики. Но на самом деле все иначе. Классические законы непоколебимы, но электроны не падают на ядро, поскольку, строго говоря, электрон – не частица. Электрон подчиняется корпускулярно-волновому дуализму, то есть, одновременно проявляет черты частицы и волны, и поэтому не падает на ядро. Тем не менее, даже с учетом корпускулярно-волнового дуализма скорость электрона не может превышать скорость света в вакууме.
Мистер Фейнман собственной персоной
Ричард Фейнман считал, что при атомном числе более Z =137 нейтральный атом существовать не может. Дело в том, что, согласно релятивистскому уравнению Дирака, при больших значениях Z основное энергетическое состояние электрона, ближайшего к ядру, будет выражаться мнимым числом. Однако, такая аргументация предполагает, что ядро является точечным. Если же допустить, что ядро имеет пусть минимальный, но не нулевой физический размер, то таблица Менделеева должна продолжаться до
Однако, такая аргументация предполагает, что ядро является точечным. Если же допустить, что ядро имеет пусть минимальный, но не нулевой физический размер, то таблица Менделеева должна продолжаться до Z≈173.
Что дальше
Считается, что для Z ≈ 173 1s-подоболочка под действием электрического поля ядра «погружается» в отрицательный континуум (море Дирака), что приводит к спонтанному рождению электрон-позитронных пар и, как следствие, к отсутствию нейтральных атомов выше элемента Ust (Унсепттрий) с Z = 173. Атомы с Z > Zcr 173 называются суперкритическими атомами. Предполагается также, что элементы с Z > Zcr могут существовать только в качестве ионов.
Суперкритические атомы не могут быть полностью ионизированы, поскольку на их первой электронной оболочке будет бурно происходить спонтанное рождение пар, при котором из моря Дирака всплывают электрон и позитрон, причем, электрон вплетается в атом, а позитрон улетает. Правда, поле сильного взаимодействия, окружающее атомное ядро, очень короткодействующее, так что принцип запрета Паули не допускает дальнейшего спонтанного рождения пар после заполнения тех оболочек, что погружены в море Дирака. Элементы 173–184 названы слабо суперкритическими атомами, поскольку у них в море Дирака погружена только оболочка
Правда, поле сильного взаимодействия, окружающее атомное ядро, очень короткодействующее, так что принцип запрета Паули не допускает дальнейшего спонтанного рождения пар после заполнения тех оболочек, что погружены в море Дирака. Элементы 173–184 названы слабо суперкритическими атомами, поскольку у них в море Дирака погружена только оболочка 1s; предполагается, что оболочка 2p1/2 будет полностью заполняться около элемента 185, а оболочка 2s – около элемента 245. Пока не удалось экспериментально добиться спонтанного рождения пар, пытаясь собрать суперкритические заряды путем столкновения тяжелых ядер (например, свинца с ураном, что могло бы дать Z = 174; урана с ураном, что дает Z = 184 и урана с калифорнием, что дает Z = 190). Возможно, в финале таблицы Менделеева ключевую роль будет играть ядерная нестабильность, а не нестабильность электронных оболочек.
Наконец, предполагается, что в регионе за Z > 300 может скрываться целый континент стабильности, состоящий из гипотетической кварковой материи (она же – квантово-хромодинамическая материя). Такая материя может состоять из свободных верхних и нижних кварков, а не из кварков, связанных в протоны и нейтроны. Предполагается, что это основное состояние барионной материи, обладающей большей энергией связи на барион, чем ядерная материя. Если такое состояние вещества реально, то, возможно, синтезировать его можно в ходе термоядерных реакций обычных сверхтяжелых ядер. Продукты таких реакций, благодаря высокой энергии связи, должны вполне преодолевать кулоновский барьер.
Такая материя может состоять из свободных верхних и нижних кварков, а не из кварков, связанных в протоны и нейтроны. Предполагается, что это основное состояние барионной материи, обладающей большей энергией связи на барион, чем ядерная материя. Если такое состояние вещества реально, то, возможно, синтезировать его можно в ходе термоядерных реакций обычных сверхтяжелых ядер. Продукты таких реакций, благодаря высокой энергии связи, должны вполне преодолевать кулоновский барьер.
Пока все это теория, и мы, повторимся, успели заполнить лишь 7-й период таблицы Менделеева к 150-летию открытия Периодического Закона (1869-2019). Так или иначе, период полураспада новых тяжелых элементов стремительно сокращается; если у резерфордия-267 он составляет около 1,3 часов, то у рентгения-282 – всего 2,1 минуты, а у оганессона исчисляется сотнями микросекунд. Таким образом, финал близок, а за ним может открыться сиквел или режиссерская версия материального мира. Путь туда лежит через субсветовые орбитали фейнмания.
Йод (I) – Атомный номер 53
Произносится
ГЛАЗ-э-дин
Йод (I) представляет собой фиолетово-серый твердый неметалл. Он имеет атомный номер 53 в периодической таблице. Он расположен в группе 17, галогены. Он имеет символ I.
Йод был открыт в 1811 году Бернаром Куртуа, когда он пытался извлечь хлорид калия из морских водорослей. При добавлении серной кислоты образовался фиолетовый пар, который превратился в темные кристаллы. Это был элемент Йод. Название йода происходит от греческого слова «йодес», что означает «фиолетовый». Йод легко образует соединения с элементами 1 и 2 группы, обычно неокрашенные соединения, и является одним из наименее реакционноспособных галогенов. Йод применяют в медицине, его используют как дезинфицирующее средство в хирургии, а также при лечении щитовидной железы. Иодид серебра широко используется в фотографии, а йодид калия — для очистки ран. В природе йод встречается в основном в морской воде, а морские водоросли являются крупным источником йода для коммерческого использования. Он расположен в группе 17 как неметаллическое твердое вещество. Он имеет температуру плавления 113°С и температуру кипения 184°С.
Он расположен в группе 17 как неметаллическое твердое вещество. Он имеет температуру плавления 113°С и температуру кипения 184°С.
Загрузите изображение йода для печати и масштабирования
Получите бесплатную загрузку здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления йода?
Йод имеет температуру плавления 113,5°C, то есть при 113,5°C он превращается в жидкость.
Какова температура кипения йода?
Йод имеет температуру кипения 184,35°C, что означает, что при 184,35°C он превратится в газ.
Что такое электроотрицательность йода?
Электроотрицательность йода составляет 2,66. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Открыт
Бернаром Куртуа
Дата открытия
1811
Что такое Теплота испарения йода?
Йод имеет теплоту испарения 20,752 кДж/моль.
Применение
Требуется людям в небольших количествах. Когда-то использовался как антисептик, но больше не из-за его ядовитой природы.
Источники
Встречается на суше и в море в виде соединений натрия и калия.
Об авторе
Натан М.
Автор
Натан имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Цитирование
“Йод” Опубликовано 30 декабря 2019 г.. https://breakeatom.com/elements/iodine
53
Protons
53
ЭЛЕКТРОНЫ
74
Нейтроны
.
Состояние
SOLIT
ПЕРЕДЕЛЕНИЕ
Неизвестно
113,5
° C
TOPE
184.35
Неизвестно
° C
184,35
0002 Heat of Vaporization
20. 752
752
Unknown
kJ/mol
Crystal Structure
Orthorhombic
Thermoconductivity
0.00449
Unknown
W/cmK
Shells
2,8,18,18,7
Группа
Галоген
ПЕРИОД
5
Блок
P Блок
Орбитали
[KR] 4D10 5S2 5P5
Коэффициент теплового расширения
96/см омПервый потенциал ионизации
10.4513 V
Второй потенциал ионизации
19.131 V
Третий потенциал ионизации
33.0 В
Ionic Radius
2,20 (-1) Å
Nockdation
2,20 (-1) Å
Nockdation
2,20 (-1) Å
Hoxdation
2,20 (-1). ± 1), 5,7
Параметр решетки
4,79 Å
Параметр решетки 2
–
Параметр решетки 3
–
Орбитальная конфигурация
2,8,18,18,7
0003
Download the Periodic Table
Explore Other Halogens
79. 904
904
35
Br
Bromine
35.453
17
Cl
Chlorine
At
Астатин
18,998
9
F
Фтор
Галогены расположены в группе 17 (формально известной как группа VIIA) слева от инертных газов в периодической таблице. Эти пять токсичных неметаллических элементов составляют группу 17 и состоят из: фтора (F), хлора (Cl), брома (Br), йода (I) и астата (As).
Йод | химический элемент | Британика
йод
Смотреть все СМИ
- Ключевые люди:
- Бернар Куртуа Жозеф-Луи Гей-Люссак сэр Хамфри Дэви Жан-Батист-Андре Дюма Виктор Мейер
- Похожие темы:
- химический элемент галоген дефицит йода йод-131
См. все связанные материалы →
йод (I) , химический элемент, член группы галогенов или группа 17 (группа VIIa) периодической таблицы.
| atomic number | 53 |
|---|---|
| atomic weight | 126.9044 |
| melting point | 113.5 °C (236 °F) |
| boiling point | 184 ° С (363 °F) |
| удельный вес | 4,93 при 20 °C (68 °F) |
| степени окисления | −1, +1, +3, +5, +7 |
| электронная конфигурация | 18-18-7 OR (KR) 5 S 2 4 D 10 5 P 5
9000 29000 2. путем нагревания золы морских водорослей с серной кислотой как побочным продуктом производства селитры. Этот пар конденсировался в черное кристаллическое вещество, которое он назвал «веществом X». В 1813 г. английский химик сэр Хамфри Дэви, проезжавший через Париж по пути в Италию, признал вещество X элементом, аналогичным хлору; он предложил имя
йод от греческого слова ioeides , «фиолетового цвета».
Наличие и распространение
Йод никогда не встречается в природе в несоединенном виде, и его концентрация недостаточна для образования самостоятельных минералов. Он присутствует в морской воде, но умеренно, в виде йодид-иона I – , в количестве примерно 50 мг на метрическую тонну (0,0016 унции на тонну) морской воды. Он также образуется в морских водорослях, устрицах и печени трески. Йодат натрия (NaIO 3 ) содержится в сырой чилийской селитре (нитрат натрия, NaNO 3 ). Организм человека содержит йод в составе соединения тироксина, который вырабатывается в щитовидной железе.
Единственным встречающимся в природе изотопом йода является стабильный йод-127. Исключительно полезным радиоактивным изотопом является йод-131, период полураспада которого составляет восемь дней. Он используется в медицине для наблюдения за работой щитовидной железы, для лечения зоба и рака щитовидной железы, для локализации опухолей головного мозга и печени.