Проблема «нулевых» в работах Менделеева
…Чем более мне приходилось думать о природе химических элементов, тем сильнее я отклонялся как от классического понятия о первичной материи, так и от надежды достичь желаемого постижения природы элементов изучением электрических и световых явлений, и каждый раз настоятельнее и яснее сознавал, что ранее того или сперва дóлжно получить более реальное, чем ныне, представление о «массе» и об «эфире».
Д. И. Менделеев
Портрет Д. И. Менделеева кисти И. Н. Крамского. 1878 год. Идею «химического» эфира, который, по мнению Д. И. Менделеева, тесно связан с периодической системой элементов, учёный вынашивал с 1870-х годов.
Обложка книги «Попытка химического понимания мирового эфира». 1905 год. Фото Р. Г. Чертанова.
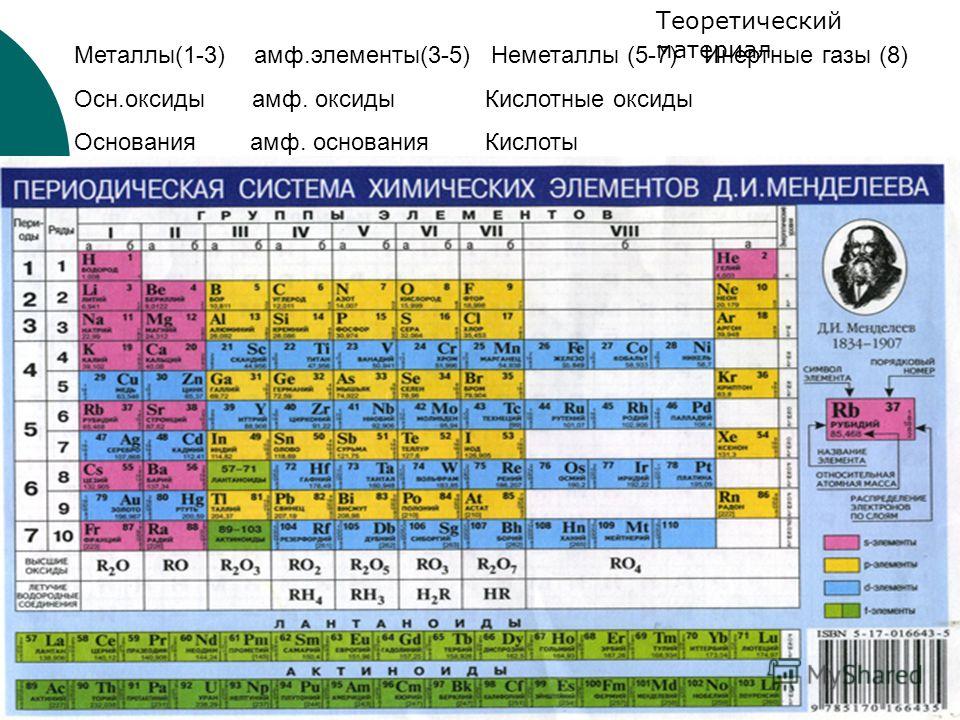
По предложению Уильяма Рамзая Менделеев включает в периодическую таблицу нулевую группу, оставляя место для более лёгких, чем водород, элементов.
Запись, сделанная рукой Д.
‹
›
Открыть в полном размере
В январе 1904 года «Петербургский листок» № 5 по случаю 70-летия Дмитрия Ивановича Менделеева опубликовал с ним интервью. На вопрос, какими научными исследованиями он занят в настоящее время, учёный ответил: «Они направлены исключительно к подтверждению выставленной мною в прошедшем году теории, или, вернее, попытки, химического понимания мирового эфира».
Что это за теория, о которой мы так мало знаем?
Статью «Попытка химического понимания мирового эфира» Д. И. Менделеев закончил в октябре 1902 года, а опубликовал в январе 1903 года в № 1—4 «Вестника и библиотеки самообразования». В мае 1904 года в письме известному астроному Саймону Ньюкомбу он сообщил, что в ближайшее время собирается написать статью «
О сложности химических элементов и об электронах — это понятно современному читателю, но мировой эфир? Сейчас даже школьники знают, что эта идея отброшена наукой. Поэтому, наверное, одна из последних работ Менделеева очень редко комментируется, практически нигде не упоминается да её вообще трудно найти. Во многих научных и учебных библиотеках в многотомных «Сочинениях» Д. И. Менделеева отсутствует том 2, где находится глава «Попытка химического понимания мирового эфира». Иногда даже создаётся впечатление, что как-то стыдливо стараются вымарать эту «курьёзную» работу из наследия учёного. Похоже, многие снисходительно думают, что великий Менделеев на старости лет, возможно, превысил уровень своей компетентности.
Поэтому, наверное, одна из последних работ Менделеева очень редко комментируется, практически нигде не упоминается да её вообще трудно найти. Во многих научных и учебных библиотеках в многотомных «Сочинениях» Д. И. Менделеева отсутствует том 2, где находится глава «Попытка химического понимания мирового эфира». Иногда даже создаётся впечатление, что как-то стыдливо стараются вымарать эту «курьёзную» работу из наследия учёного. Похоже, многие снисходительно думают, что великий Менделеев на старости лет, возможно, превысил уровень своей компетентности.
Но давайте не будем спешить с выводами. Эту «конфузную» теорию Д. И. Менделеев вынашивал почти всю свою творческую жизнь. Через два года после открытия периодической системы (Менделееву не было ещё 40 лет) на оттиске из «Основ химии» его рукой около символа водорода сделана надпись, которую можно расшифровать так: «Легче всех эфир, в миллионы раз». По-видимому, «эфир» представлялся Менделееву наилегчайшим химическим элементом.
«Уже с 70-х годов у меня назойливо засел вопрос: да что же такое эфир в химическом смысле? Он тесно связан с периодическою системою элементов, ею и возбудился во мне, но только ныне я решаюсь говорить об этом».
Итак, химический элемент эфира — элемент эфира — атомарность эфира — дискретность эфира. Это не тот эфир, который отбросила как ненужный костыль современная физика. Откроем словарь:
«Эфир (греч. Aither — гипотетическая материальная среда, заполняющая пространство)… В классической физике под эфиром понималась однородная, механическая, упругая среда, наполняющая абсолютное ньютоновское пространство» (Философский словарь / Ред. М. М. Розенталь. — М., 1975).
В классическом определении эфира — акцент на однородности или непрерывности. Эфир, о котором говорит Менделеев, состоит из элементов, он атомарен, он неоднороден, он прерывен и дискретен. Он имеет структуру.
Интерес Дмитрия Ивановича к проблеме эфира в 1870-е годы тесно связан с периодической системой («ею и возбудился во мне») и последовавшими затем работами по исследованию газов.
Но эти работы не удовлетворяли его: «… представление о мировом эфире, как предельном разрежении паров и газов, не выдерживает даже первых приступов вдумчивости — в силу того, что эфир нельзя представить иначе как веществом, все и всюду проникающим; парам же и газам это не свойственно».
Детальная разработка «химической концепции мирового эфира» началась с открытия инертных газов. Д. И. Менделеев предсказал много новых элементов, но вот инертные газы были неожиданны даже для него. Не сразу он принял это открытие, не без внутренней борьбы, и разошёлся во взглядах с большинством химиков по поводу местонахождения инертных газов в периодической системе. Где они должны быть расположены? Современные химики, не задумываясь, скажут: конечно, в VIII группе. А Менделеев категорически настаивал на существовании нулевой группы.
«Это положение аргоновых аналогов в нулевой группе составляет строго логическое последствие понимания периодического закона», — утверждал Д. И. Менделеев.
И. Менделеев.
Становится понятным, почему Дмитрий Иванович настаивал на существовании нулевой группы, понятны его упоминания о гипотетическом галогене легче фтора; отсюда даже понятен его поиск элемента легче водорода, о существовании которого он давно размышлял: «

Как раз в отстаиваемой им системе с нулевой группой, которую впервые предложил бельгийский учёный Лео Эррера в 1900 году на заседании Бельгийской королевской академии наук (Academie royale de Belgique), водород вроде бы вовсе может быть и не первым, так как перед ним с неизбежностью появляется свободное место для сверхлёгкого элемента — может, это и есть «элемент эфира»?
«Теперь же, когда стало не подлежать ни малейшему сомнению, что перед I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород
В открытом им законе Менделеев пытается с физической стороны понять природу массы как основной характеристики вещества. Выясняя физические основы тяготения (о том, как много сил и времени он уделял этой проблеме, мы тоже мало знаем), тесно связанные с понятием мирового эфира как «передающей» среды, он ищет легчайший элемент. Однако результаты опытов 1870-х годов, сводившихся к тому, чтобы доказать, что «
Однако результаты опытов 1870-х годов, сводившихся к тому, чтобы доказать, что «
В конце жизни в поисках ответа на вопросы, касающиеся глубинных свойств материи, он вновь обращается к «мировому эфиру», с помощью которого пытается проникнуть в природу основного понятия естествознания XIX века (да и ХХ, и даже ХХI веков) — массы, а также дать объяснения новым открытиям и, прежде всего, радиоактивности. Основная мысль Менделеева заключается в следующем: «Реального понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности». Характеризуя мировой эфир, Менделеев считает его, «во-первых, наилегчайшим из всех элементов как по плотности, так и по атомному весу, во-вторых, наибыстрее движущимся газом, в-третьих, наименее способным к образованию с какими-либо другими атомами или частицами определённых сколь-либо прочных соединений и, в-четвёртых, элементом, всюду распространённым и всепроникающим».
Вес атома этого гипотетического элемента X, по расчётам Менделеева, может колебаться в пределах от 5,3×10-11 до 9,6×10-7 (если атомный вес Н равен 1). Для оценки массы гипотетического элемента он привлекает знания из области механики и астрономии. Элемент X получал своё место в периодической системе в нулевом периоде нулевой группы, как легчайший аналог инертных газов. (Менделеев называет этот элемент «ньютонием».) Кроме того, Дмитрий Иванович допускал существование ещё одного элемента легче водорода — элемента Y, корония (предположительно линии корония были зафиксированы в спектре солнечной короны при затмении Солнца в 1869 году; открытие гелия на Земле давало основание считать реальным и существование этого элемента). Вместе с тем Менделеев не раз подчёркивал гипотетичность элементов X и Y и не включал их в таблицы элементов 7-го и 8-го изданий «Основ химии».
Научная требовательность и ответственность в работах Менделеева не нуждаются в комментариях. Но, как мы видим, если того требовала логика поиска, он смело выдвигал самые необычные гипотезы. Все предсказания, сделанные им на основе периодического закона (существование 12 неизвестных в то время элементов, а также исправления атомных масс элементов), блестяще подтвердились.
Но, как мы видим, если того требовала логика поиска, он смело выдвигал самые необычные гипотезы. Все предсказания, сделанные им на основе периодического закона (существование 12 неизвестных в то время элементов, а также исправления атомных масс элементов), блестяще подтвердились.
«Когда я прилагал периодический закон к аналогам бора, алюминия и кремния, я был на 33 года моложе, во мне жила полная уверенность, что рано или поздно предвидимое должно непременно оправдаться, потому что мне всё там было ясно видно. Оправдание пришло скорее, чем я мог надеяться. Тогда я не рисковал, теперь рискую. На это надобна решимость. Она пришла, когда я видел радиоактивные явления… и когда я сознал, что откладывать мне уже невозможно и что, быть может, мои несовершенные мысли наведут кого-нибудь на путь более верный, чем тот возможный, какой представляется моему слабеющему зрению».
Так что же, это первая крупная ошибка, может, даже глубокое заблуждение великого учёного, как сейчас считают очень многие, или всего лишь прискорбное недопонимание гения его малоспособными учениками?
В начале XX века не только Менделеев, но и многие физики и химики верили в существование «эфира». Однако после создания Альбертом Эйнштейном специальной и общей теории относительности эта вера стала угасать. Принято считать, что к 1930-м годам проблема «эфира» уже не существовала, а вопрос об элементах легче водорода отпал сам собой. Но, опять же, отпала проблема классического эфира, эфира однородного, а вот эфир структурный (эфир Менделеева) вполне жив, только называется он сейчас структурным вакуумом или физическим вакуумом Дирака. Так что вопрос только в терминологии.
Однако после создания Альбертом Эйнштейном специальной и общей теории относительности эта вера стала угасать. Принято считать, что к 1930-м годам проблема «эфира» уже не существовала, а вопрос об элементах легче водорода отпал сам собой. Но, опять же, отпала проблема классического эфира, эфира однородного, а вот эфир структурный (эфир Менделеева) вполне жив, только называется он сейчас структурным вакуумом или физическим вакуумом Дирака. Так что вопрос только в терминологии.
Вернёмся к элементам легче водорода. Любому химику известны гомологические ряды и то, как ведут себя их первые члены, особенно первый. Первый всегда особенный. Он всегда сильно выделяется из общего ряда. Водород размещают и в I и в VII группах (он в чём-то подобен и щелочным металлам, и галогенам одновременно). Так вот, водород не похож на первый… В поисках настоящих элементов нулевого периода мы попадаем совсем в другой мир, и похоже, что это мир элементарных частиц.
Понимание химии как науки о качественных изменениях, по мнению многих исследователей, в периодической системе проявляется наиболее отчётливо, а в самом начале системы просто ослепительно ярко. «Распространённейшие в природе простые тела имеют малый атомный вес, а все элементы с малым атомным весом характеризуются резкостью свойств. Они поэтому суть типические элементы», а по мере приближения к «нулевой точке» должны происходить просто фантастически «резкие» качественные скачки, что следует из её сингулярного характера, так как «…здесь не только край системы, но и типические элементы, а потому можно ждать своеобразия и особенностей».
«Распространённейшие в природе простые тела имеют малый атомный вес, а все элементы с малым атомным весом характеризуются резкостью свойств. Они поэтому суть типические элементы», а по мере приближения к «нулевой точке» должны происходить просто фантастически «резкие» качественные скачки, что следует из её сингулярного характера, так как «…здесь не только край системы, но и типические элементы, а потому можно ждать своеобразия и особенностей».
Мы часто говорим о фундаментальности периодического закона, но кажется, что по-настоящему этого всё-таки не понимаем. Повторим Менделеева: «Сущность понятий, вызывающих периодический закон, кроется в общем физико-химическом начале соответствия, превращаемости и эквивалентности сил природы».
В заключение хочется привести слова Дмитрия Ивановича:
«Я и смотрю на свою далёкую от полноты попытку понять природу мирового эфира с реально химической стороны не более, как на выражение суммы накопившихся у меня впечатлений, вырывающихся исключительно лишь по той причине, что мне не хочется, чтобы мысли, навеваемые действительностью, пропадали. Вероятно, что подобные же мысли приходили многим, но, пока они не изложены, они легко и часто исчезают и не развиваются, не влекут за собой постепенного накопления достоверного, которое одно сохраняется. Если в них есть хоть часть природной правды, которую мы всё ищем, попытка моя не напрасна, её разработают, дополнят и поправят, а если моя мысль неверна в основаниях, её изложение, после того или иного вида опровержения, предохранит других от повторения. Другого пути для медленного, но прочного движения вперёд я не знаю».
Вероятно, что подобные же мысли приходили многим, но, пока они не изложены, они легко и часто исчезают и не развиваются, не влекут за собой постепенного накопления достоверного, которое одно сохраняется. Если в них есть хоть часть природной правды, которую мы всё ищем, попытка моя не напрасна, её разработают, дополнят и поправят, а если моя мысль неверна в основаниях, её изложение, после того или иного вида опровержения, предохранит других от повторения. Другого пути для медленного, но прочного движения вперёд я не знаю».
***
ФИЗИЧЕСКИЙ ВАКУУМ — в современном представлении основное состояние квантованных полей, своего рода среда, обладающая нулевыми электрическим зарядом, импульсом, угловым моментом и другими квантовыми числами. Поля имеют минимальную энергию, но подвержены флуктуациям с большой амплитудой. Возникновение квантовых идей привело к созданию универсальной картины единого строения материи. Вместо полей и частиц классической физики теперь рассматривают единые физические объекты — квантовые поля в четырёхмерном пространстве—времени, по одному на каждое «классическое» поле (электрическое, магнитное и пр. ) и на каждый сорт частиц. Например, вакуум Дирака — это поле частиц со спином ½ (электронов, позитронов, мюонов, кварков и пр.). Каждое единичное взаимодействие частиц или полей — результат обмена квантами этих полей в точке пространства—времени. С некоторых точек зрения, физический вакуум проявляет свойства материальной среды, давая повод считать его «современным эфиром».
) и на каждый сорт частиц. Например, вакуум Дирака — это поле частиц со спином ½ (электронов, позитронов, мюонов, кварков и пр.). Каждое единичное взаимодействие частиц или полей — результат обмена квантами этих полей в точке пространства—времени. С некоторых точек зрения, физический вакуум проявляет свойства материальной среды, давая повод считать его «современным эфиром».
Минеральные вещества | Tervisliku toitumise informatsioon
В человеческом организме установлено наличие более 70 химических элементов. Достоверно установлена потребность в более чем 20 биоэлементах. Для обеспечения достаточного количества этих элементов крайне важно, чтобы питание было разнообразным.
Встречающиеся в организме минеральные вещества можно условно разделить на две группы:
- Содержание макроэлементов в организме составляет более 0,01%. Ими являются фосфор (P), кальций (Ca), натрий (Na), калий (K), магний (Mg), сера (S), хлор (Cl) (см Таблица 1).
- Содержание микроэлементов – менее 0,01%, у некоторых даже 0,00001.

Потребность в некоторых микроэлементах установлена, это железо (Fe), цинк (Zn), медь (Cu), йод (I), селен (Se) , марганец (Mn), молибден (Mo), фтор (F), хром (Cr), кобальт (Co), кремний (Si), ванадий (V), бор (B), никель (Ni), мышьяк (As) и олово (Sn).
Помимо них в организме обнаружен целый ряд элементов, функция которых пока не ясна, их появление в организме может быть обусловлено загрязнением окружающей среды и частым соприкосновением с ними. Например, люди, работающие в теплицах, постоянно контактируют с химическими веществами, различные элементы могут быть признаком разного рода заболеваний. В числе таких элементов алюминий (Al), стронций (Sr), барий (Ba), рубидий (Rb), палладий (Pd), бром (Br).
В организм могут попадать и тяжелые, т.е. ядовитые металлы, такие как кадмий (Cd), ртуть (Hg) или свинец (Pb).
Минеральные вещества в нашем организме являются важными компонентами скелета, биологических жидкостей и энзимов и способствуют передаче нервных импульсов.

Люди и животные получают различные биологические элементы из пищи, воды и окружающего воздуха, самостоятельно синтезировать минеральные вещества живые организмы не могут. В растениях минеральные вещества накапливаются из почвы, и их количество зависит от места произрастания и наличия удобрений. В питьевой воде также имеются минеральные вещества, и их содержание зависит от места, откуда получают воду.
Несмотря на то, что человек нуждается в небольших количествах минеральных веществ (макроэлементов в миллиграммах и граммах, микроэлементов – в милли- и микрограммах), в его организме, тем не менее, отсутствуют достаточные запасы минеральных веществ, чтобы нормально перенести их долговременный дефицит. Потребность в минеральных веществах зависит также от возраста, пола и прочих обстоятельств (см Таблица 2). Например, повышенная потребность в железе у женщин связана с менструациями и беременностью, а спортсменам требуется больше натрия, потому что он интенсивно выводится с потом.
Чрезмерные количества минеральных веществ могут привести к сбоям в работе организма, потому что, будучи компонентами биоактивных соединений, они оказывают влияние на регуляторные функции. Получать чрезмерные количества минеральных веществ (за исключением натрия) с пищей практически невозможно, однако это может произойти при чрезмерном употреблении биологически активных добавок и обогащенных минеральными веществами продуктов.
Усвоению минеральных веществ могут препятствовать:
- злоупотребление кофе,
- употребление алкоголя,
- курение,
- некоторые лекарства,
- некоторые противозачаточные таблетки,
- определенные вещества, встречающиеся в некоторых продуктах, например, в ревене и шпинате.
Потери минеральных веществ при тепловой обработке продуктов питания значительно меньше, чем потери витаминов. Однако при рафинировании или очистке часть минеральных веществ удаляется. Поэтому важно есть больше цельнозерновых и нерафинированных продуктов. Минеральные вещества могут образовывать соединения с другими веществами, содержащимися в продуктах питания (например, с оксалатами в ревене), в результате чего организм не может их усвоить.
Минеральные вещества могут образовывать соединения с другими веществами, содержащимися в продуктах питания (например, с оксалатами в ревене), в результате чего организм не может их усвоить.
Таблица 1
Названия и источники важнейших минеральных веществ
Обозначение | Название | Лучшие источники * |
Макроэлементы | ||
Na | натрий | поваренная соль (NaCl), готовая еда, сыр, ржаной хлеб, консервы, мясные продукты, оливки, картофельные чипсы |
K | калий | растительные продукты: сушеные фрукты и ягоды, орехи, семена, топинамбур, картофель, редис, капуста, зеленые овощи, мука «Кама», свёкла, банан, ржаной хлеб, смородина, томаты |
Ca | кальций | молоко и молочные продукты (особенно сыр), миндаль, орехи, семена, рыба (с костями), шпинат |
Mg | магний | орехи, семена, мука «Кама», ржаной хлеб, шпинат, бобовые, греча, цельнозерновые продукты, свинина, говядина и курятина, банан, брокколи |
P | фосфор | семена, орехи, молочные продукты (особенно сыр), печень, птица, говядина, ржаной хлеб, рыба, цельнозерновые продукты, бобовые |
S | сера | продукты с белками, содержащими аминокислоты метионин (зерновые, орехи) и цистеин (мясо, рыба, соевые бобы, зерновые) |
Cl | хлор | поваренная соль |
Микроэлементы | ||
Fe | железо | печень, кровяная колбаса, семечки, яйца, изюм, ржаной хлеб, нежирная говядина и свинина, цельнозерновые продукты, греча, клубника |
Zn | цинк | печень, мясо, мука «Кама», семена, орехи, сыр, ржаной хлеб, бобовые, дары моря (крабы, салака), цельнозерновые продукты, яйца |
Cu | медь | печень, какао-порошок, мясо, бобовые, цельнозерновые продукты, семена, орехи, греча, ржаной хлеб, лосось, авокадо, свёкла, дары моря |
I | йод | йодированная соль, рыба и другие дары моря, сыр, яйца, некоторые виды ржаного хлеба и йогурта |
Se | селен | арахис, печень, рыба и дары моря, семена подсолнечника, мясо |
* Количество, содержащееся в 100 г продукта, покрывает не менее 10% суточной потребности взрослой женщины
Таблица 2
Рекомендуемые в зависимости от возраста суточные нормы потребления важнейших минеральных веществ
Возраст | Натрий, мг | Кальций, мг | Калий, г | Магний, мг | Железо, мг | Цинк, мг | Медь, мг | Йод, мкг | Селен, мкг |
Дети |
|
|
|
|
|
|
|
|
|
6–11 месяцев | до 650 | 550 | 1,1 | 80 | 8 | 5 | 0,3 | 60 | 15 |
12–23 месяца | до 830 | 600 | 1,4 | 85 | 8 | 6 | 0,3 | 90 | 25 |
2–5 лет | до 1580 | 600 | 1,8 | 120 | 8 | 6 | 0,4 | 90 | 30 |
6–9 лет | до 1580 | 700 | 2 | 200 | 9 | 7 | 0,5 | 120 | 30 |
Женщины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 2,9 | 300 | 11 | 8 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
18–30 лет | до 2400 | 900 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
31–60 лет | до 2400 | 800 | 3,1 | 320 | 15 | 9 | 0,9 | 150 | 50 |
61–74 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
> 75 лет | до 2400 | 800 | 3,1 | 320 | 10 | 9 | 0,9 | 150 | 50 |
Беременные | до 2400 | 900 | 3,1 | 360 | 15 | 10 | 1 | 175 | 60 |
Кормящие матери | до 2400 | 900 | 3,1 | 360 | 15 | 11 | 1,3 | 200 | 60 |
Мужчины |
|
|
|
|
|
|
|
|
|
10–13 лет | до 2400 | 900 | 3,3 | 300 | 11 | 11 | 0,7 | 150 | 40 |
14–17 лет | до 2400 | 900 | 3,5 | 380 | 11 | 12 | 0,9 | 150 | 60 |
18–30 лет | до 2400 | 900 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
31–60 лет | до 2400 | 800 | 3,5 | 380 | 10 | 9 | 0,9 | 150 | 60 |
61–74 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
> 75 лет | до 2400 | 800 | 3,5 | 380 | 10 | 10 | 0,9 | 150 | 60 |
* Для 18–20-летних рекомендуемая суточная доза составляет 900 мг кальция и 700 мг фосфора.
** Потребность в железе зависит от потери железа при менструациях. Для женщин в постменопаузе рекомендуемая дневная доза железа составляет 10 мг.
*** Для достижения сбалансированного содержания железа во время беременности в организме женщины должны иметься запасы железа как минимум на 500 мг больше, чем до беременности. В двух последних триместрах беременности, в зависимости от уровня железа в организме, может потребоваться дополнительный прием железа.
**** На самом деле, селена можно потреблять больше указанной в таблице рекомендованной дозы, поскольку селен по-разному всасывается из разных источников и происходит постоянное обеднение им поверхности, т.е. таблицы питательной ценности продуктов «не поспевают» за истинным положением дел (в них зачастую указываются значения больше реальных).
Максимальные разовые безопасные дозы минеральных веществ и пищевых добавок:
| Минеральное вещество | Доза |
|---|---|
| Кальций (мг) | 2500 |
| Фосфор (мг) | 3000 |
| Калий (мг) | 3,7* |
| Железо (мг) | 60 |
| Цинк (мг) | 25 |
| Медь (мг) | 5 |
| Йод (мкг) | 600 |
| Селен (мкг) | 300 |
* Только из биоактивных добавок или обогащенной пищи
Японские физики синтезировали 113-й элемент таблицы Менделеева
Фрагмент таблицы Менделеева
Фото: mnemoniki.
 ru
ruЭтот элемент был впервые получен в 2003 году российскими и американскими физиками в экспериментах по синтезу 115-го элемента, но это открытие еще не признано Международным союзом теоретической и прикладной химии, сообщает РИА Новости.
В природе не существует элементов с атомными номерами (числом протонов в ядре атома) больше 92, то есть тяжелее урана. Более тяжелые элементы, например, плутоний, могут нарабатываться в атомных реакторах, а элементы тяжелее 100-го (фермия) можно получать только на ускорителях, путем бомбардировки мишени тяжелыми ионами. При слиянии ядер мишени и “снаряда” и возникают ядра нового элемента.
Группа ученых под руководством Косуке Морит в статье, опубликованной в Journal of Physical Society of Japan, описывают результаты многолетних экспериментов на линейном ускорителе, расположенном в городе Вако в окрестностях Токио. С 2003 года исследователи пытались получить 113-й элемент, бомбардируя на ускорителе мишень из висмута-209 пучком ионов цинка-70, разогнанных до одной десятой скорости света и висмута.
В результате им удалось зафиксировать три цепочки распада, соответствующие событию рождения 113-го элемента -23 июля 2004 года, 2 апреля 2005 года и 12 августа 2012 года. Время жизни ядра нового элемента составило от 4,9 до 0,3 миллисекунды.
Как считают японские ученые, их открытие может стать основанием для Международного союза теоретической и прикладной химии признать их открытие. В таком случае японские ученые впервые в истории получат право дать название новому элементу.
Однако для признания требуется независимое подтверждение – эксперимент должен быть повторен в другой лаборатории или в перекрестной реакции.
“Это выдающийся результат, но воспроизвести его будет крайне трудно, поскольку регистрируется примерно одно событие в год, а перекрестных реакций не существует”, – сказал комментируя открытие, Андрей Попеко, заместитель директора Лаборатории имени Флерова Объединенного института ядерных исследований в Дубне.
Специалисты этой лаборатории совместно с американскими коллегами в 2003 году впервые получили 113-й элемент. Ядра этого элемента рождались в качестве “побочного продукта” эксперимента по синтезу 115-го элемента. Тогда 115-й элемент был получен в реакции слияния ядер америция-243 и кальция-48. При распаде 115-й превращался в 113-й, который, в свою очередь, распадался на более легкие ядра. Этот результат был официально опубликован в научном журнале Physical Review C в начале февраля 2004 года. В сентябре того же года японские ученые опубликовали сообщение о первом событии рождения 113-го элемента в реакции висмута и цинка.
Ядра этого элемента рождались в качестве “побочного продукта” эксперимента по синтезу 115-го элемента. Тогда 115-й элемент был получен в реакции слияния ядер америция-243 и кальция-48. При распаде 115-й превращался в 113-й, который, в свою очередь, распадался на более легкие ядра. Этот результат был официально опубликован в научном журнале Physical Review C в начале февраля 2004 года. В сентябре того же года японские ученые опубликовали сообщение о первом событии рождения 113-го элемента в реакции висмута и цинка.
Позже российские ученые сообщили, что им удалось получить 113-й элемент в эксперименте по синтезу 117-го элемента. В июне нынешнего года ученые из Дубны подали заявку в Международный союз по теоретической и прикладной химии на признание 113, 115, 117 и 118 элементы – все они были впервые синтезированы в ОИЯИ.
Ситуация
Дорожники Кубани – за ударный труд на российской технике
На исходе сентября, в преддверии Дня работников дорожного хозяйства, Министерство транспорта и дорожного хозяйства Краснодарского края совместно с Союзом дорожников Кубани организовало выставку дорожной техники российского производства.
Город Weekend
Стены. Смальта. Вторая половина ХХ века
Романтизация прошлого – явление не новое, меняется только эпоха воздыхания. То ли в ответ на западный ретрофутуризм, то ли из-за очарования атмосферных брежневок и хрущевок, покоряющих социальные сети, советская эстетика крепко взялась за нашу современную культуру (нет, не наоборот). Кто-то скучает по времени, в котором даже не жил, другие тянутся к обрывкам своего детства. Ну, или «Осколкам прошлого», если хотите. Выставка-исследование с таким названием открылась в Краснодаре 20 сентября.
Ситуация Weekend
«Новый сезон», или как начинающие кинематографисты покорили зрителей
Первый фестиваль онлайн-кинотеатров «Новый сезон», проходивший на «Розе Хутор» с 18 по 23 сентября, подошел к концу. О том, какими наградами он завершился рассказывает корреспондент «Югополиса»
О том, какими наградами он завершился рассказывает корреспондент «Югополиса»
иттербий | химический элемент | Британика
иттербий
Посмотреть все СМИ
- Ключевые люди:
- Жан-Шарль Галиссар де Мариньяк
- Похожие темы:
- химический элемент редкоземельный элемент
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
иттербий (Yb) , химический элемент, редкоземельный металл лантанидного ряда периодической таблицы.
Иттербий — самый летучий редкоземельный металл. Это мягкий, ковкий металл серебристого цвета, который слегка тускнеет при хранении на воздухе, поэтому его следует хранить в вакууме или в инертной атмосфере, когда требуется длительное хранение. На воздухе медленно окисляется с образованием Yb 2 O 3 ; металл легко растворяется в разбавленных кислотах, за исключением плавиковой кислоты (HF), в которой защитный слой YbF 3 образуется на поверхности и препятствует дальнейшей химической реакции.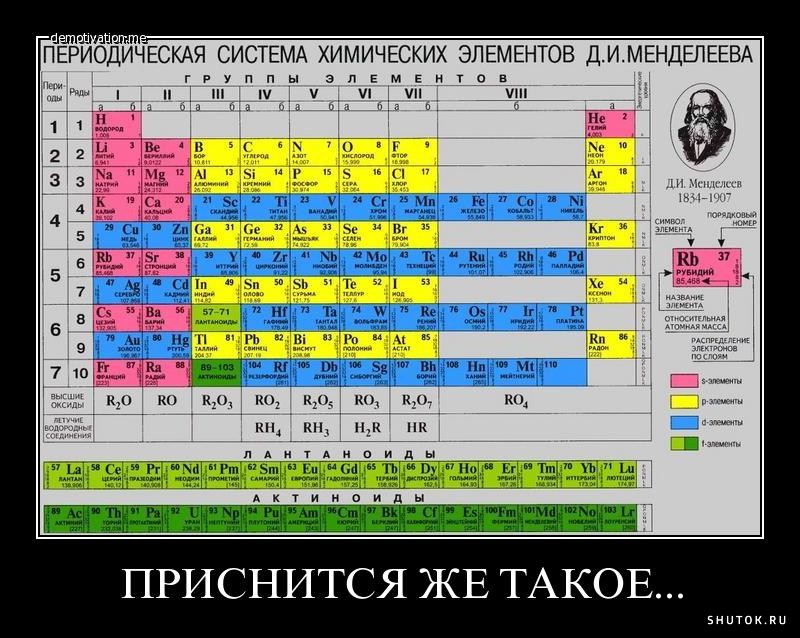 Иттербий слабо парамагнетичен, имеет самую низкую магнитную восприимчивость среди всех редкоземельных металлов.
Иттербий слабо парамагнетичен, имеет самую низкую магнитную восприимчивость среди всех редкоземельных металлов.
Britannica Викторина
118 Названий и символов периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Первый концентрат иттербия был получен в 1878 году швейцарским химиком Жаном-Шарлем Галиссаром де Мариньяком и назван им в честь города Иттербю в Швеции, где он (и первый открытый редкоземельный элемент иттрий) был обнаружен. Французский химик Жорж Урбен и австрийский химик Карл Ауэр фон Вельсбах независимо друг от друга продемонстрировали в 1907–1908 годах, что земля Мариньяка состоит из двух оксидов, которые Урбен назвал неоиттербией и лютецией. Элементы теперь известны как иттербий и лютеций. Иттербий относится к менее распространенным редкоземельным элементам. Он содержится в незначительных количествах во многих редкоземельных минералах, таких как латеритные глины, ксенотим и эвксенит, а также в продуктах ядерного деления.
Он содержится в незначительных количествах во многих редкоземельных минералах, таких как латеритные глины, ксенотим и эвксенит, а также в продуктах ядерного деления.
Природный иттербий состоит из семи стабильных изотопов: иттербия-174 (32,0 процента), иттербия-172 (21,7 процента), иттербия-173 (16,1 процента), иттербия-171 (14,1 процента), иттербия-176 (13 процентов), иттербий-170 (3 процента) и иттербий-168 (0,1 процента). Не считая ядерных изомеров, было охарактеризовано в общей сложности 27 радиоактивных изотопов Yb с массой от 148 до 181 с периодом полураспада от 409 миллисекунд (иттербий-154) до 32,018 дней (иттербий-169).
Иттербий отделяют от других редкоземельных элементов методами экстракции растворителем-растворителем или ионообменными методами. Элементарный металл получают металлотермическим восстановлением его оксида Yb 2 O 3 металлическим лантаном с последующей вакуумной перегонкой для дальнейшей очистки металла. Иттербий существует в трех аллотропных (структурных) формах. α-фаза, которая существует при температуре ниже 7 ° C (45 ° F), является гексагональной с плотной упаковкой с a = 3,8799 Å и c = 6,3859.Å при комнатной температуре. β-фаза имеет кубическую гранецентрированную форму с a = 5,4848 Å, и это нормальная структура при комнатной температуре. γ-фаза является объемно-центрированной кубической с a = 4,44 Å при 763 ° C (1405 ° F). Иттербий имеет самую низкую температуру кипения среди редкоземельных металлов.
α-фаза, которая существует при температуре ниже 7 ° C (45 ° F), является гексагональной с плотной упаковкой с a = 3,8799 Å и c = 6,3859.Å при комнатной температуре. β-фаза имеет кубическую гранецентрированную форму с a = 5,4848 Å, и это нормальная структура при комнатной температуре. γ-фаза является объемно-центрированной кубической с a = 4,44 Å при 763 ° C (1405 ° F). Иттербий имеет самую низкую температуру кипения среди редкоземельных металлов.
Этот элемент не имеет практического применения, кроме исследований. Радиоактивный изотоп Yb 169 является источником жесткого рентгеновского излучения, используемого в портативных рентгенографических устройствах. Он используется в качестве легирующей примеси в различных оптических материалах, включая линзы. Этот металл используется в датчиках давления, потому что его удельное электрическое сопротивление сильно зависит от давления.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Подпишитесь сейчас
Иттербий, как и европий, является двухвалентным металлом. Соединение иттербия в степени окисления +2 впервые было получено в 1929 г. В.К. Клемм и В. Шут, восстановившие трихлорид иттербия YbCl 3 до дихлорида иттербия YbCl 2 водородом. Ион Yb 2+ также был получен электролитическим восстановлением или обработкой соли Yb 3+ амальгамой натрия. Элемент образует серию бледно-зеленых Yb 2+ соли, такие как сульфат, дибромид, гидроксид и карбонат иттербия. Бледно-зеленый ион иттербия Yb 2+ нестабилен в водном растворе и легко восстанавливает воду, высвобождая водород; он менее стабилен, чем сопоставимый ион европия, Eu 2+ , и более стабилен, чем ион самария Sm 2+ . В преобладающей степени окисления +3 иттербий образует ряд белых солей, включая трисульфат и тринитрат; полуторный оксид также белый.
| atomic number | 70 |
|---|---|
| atomic weight | 173. 04 04 |
| melting point | 819 °C (1,506 °F) |
| boiling point | 1,196 °C (2185 °F) |
| удельный вес | 6,966 (24 °C, или 75 °F) |
| степени окисления | +2, +3 | [Xe]4 f 14 6 s 2 |
Эта статья была недавно пересмотрена и обновлена Эриком Грегерсеном.
Иттербий Yb (элемент 70) Периодической таблицы
70 Yb (иттербий)
Иллюстрация иттербия
Иттербий — мягкий, ковкий и довольно пластичный элемент с ярким серебристым блеском.
Хранить в закрытых емкостях для защиты от воздуха и влаги.
Легко разрушается и растворяется в разбавленных и концентрированных минеральных кислотах, медленно реагирует с водой.
YTTERBIUM
Иттербийский металл (99,95% чистота)
Идентификация
CAS Номер: 7440-64-4
.
Внешний вид: серебристо-белый; с бледно-желтым оттенком
Массовый номер: 173
Стандарт Атомный вес: 173,045 г/моль
Электроны: 70
Протоны: 70
Нейтроны: 103
Атомный номер (Z): 70
Период: 6
Блок: f Electron configuration: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 4f 14 6s 2
Электронная конфигурация иттербия
Термические свойства иттербия Фаза: твердое вещество
Петиция: 1097 K (824 O C, 1515 O F)
Philling Point: 1469 K (1196 O C)
. )
Теплота плавления: 7,66 кДж/моль
Теплота испарения: 129 кДж/моль
Молярная теплоемкость: 26,74 Дж/(моль.К)
Тепловое расширение: β, поли: 26,3 мкм/(м∙К)
Теплопроводность: 38,5 Вт/(м∙K)
Электрическая проводимость: 3,6 × 10 6
Селектрическое сопротивление: β, поли: 0,250 мкм ∙ м
Селектрический тип: Проводник
Smagneticepemble: SameTible SemAble: 1,010174
SMAGNETICEST: APTERSIBALE: 1,0174
. (x mol ): +249×10 -6 cm 3
(x mol ): +249×10 -6 cm 3
Volume magnetic susceptibility: 0.0000388
Mass magnetic susceptibility: 5.9×10 -9 m 3 /kg
Molar magnetic susceptibility: 1.02× 10 -9 M 3 /моль
Плотность: 6,90 г/см 3 (в твердого веществе) 6,21 г/См 3 (в жидкости)
MOLAR 3 MOLAR 3 MOLAR3. 3 /моль
Модуль Юнга: β-форма: 24 ГПа
Модуль сдвига: β-форма: 9,9 ГПа
Объемный модуль: β-форма: 31 ГПа
Коэффициент Пуассона: β-форма: 0,207 твердость: 340-440 МПа
Скорость звука: 1590 м/с
Состояния окисления: 3 , 2,1
Валентные электроны: 4F 14 6S 2
. : 603,4 кДж.моль 2-й: 1174,8 кДж/моль 3-й: 2417 кДж/моль 4-й: 4202,9 кДж/моль
Ионный радиус: 85,8 пм
Атомный радиус: 242 пм (Ван-дер-Ваальс)
Ковалентный радиус: 187±8 пм
Заполнение Орбитальная: 4f 14
Кристаллическая структура: Гранецентрированная кубическая (β, при комнатной температуре), Объемноцентрированная кубическая (γ, At 795 o C), гексагональная плотноупакованная (α, At -13 o C)
Углы решетки: π/2, π/2, π/2
Постоянная решетки: 548,47, 548,47, 548,47 пм )
Гексагональная закрытая упаковка (HCP)
Реакционная способность иттербия ЭЛЕКТРОНЕГОВАНСКАЯ ДОСТУПА: Фоинг. 1 S 0
1 S 0
Нейтронный поперечный сечение (отрубки): 35
. Абсорбция нейтрона: 0,0076
Изотопы: 166 YB 168 YB 169 YB 170 YB 1719139 YB 170 YB 171919
| Изотоп | Численность (%) | Атомная масса г/моль | Период полураспада (т 1/2 ) |
| 166 Ыб | Син | – | 56,7 ч |
| 168 Ыб | 0,13 | 167,934 | Стабильный |
| 169 Ыб | Син | – | 32. 026 д 026 д |
| 170 Ыб | 3,023 | 169,935 | Стабильный |
| 171 Ыб | 14,22 | 170,936 | Стабильный |
| 172 Ыб | 21,75 | 171,936 | Стабильный |
| 173 Ыб | 16.10 | 172.938 | Стабильный |
| 174 Ыб | 31,90 | 173,938 | Стабильный |
| 175 Ыб | Син | – | 4.185 д |
| 176 Ыб | 12,89 | 175,943 | Стабильный |
| 177 лб | Син | – | 1,911 ч |
Химические реакции
Металл медленно тускнеет на воздухе и легко сгорает с образованием оксида иттербия (lll):
4 Yb + 3 O 2 → 2 Yb 2 O 3
Медленно2 реагирует с холодной водой и 9002 6 с горячей водой (форма гидроксида иттербия (lll) и газообразного водорода):
2 Yb (т) + 6 H 2 O (ж) → 2 Yb(OH) 3 (водн. ) + 3 H 2 (g)
) + 3 H 2 (g)
Металл реагирует со всеми галогенами с образованием галогенидов иттербия (lll):
2 Yb (т) + 3 F 2 (г) → 2 YbF 3 (т) [белый] (фторид иттербия (lll) )
2 Yb (т) + 3 Cl 2 (г) → 2 YbCl 3 (т) [белый] (Иттербия (lll) хлорид)
2 Yb(т) + 3 Br 2 (г) → 2 YbBr 3 (т) [белый] (Иттербий (lll) бромид)
2 Yb(s) + 3 I 2 (g) → 2 YbI 3 (s) [белый] (иттербия (lll) йодид)
Легко растворяется в разбавленной серной кислоте с образованием растворов, содержащих иттербий (lll) ионы (бесцветные):
2 Yb (т) + 3 H 2 SO 4 (водн.) + 18 H 2 O (л) → 2 [Yb(H 2 O) 9 ] (водн. 2+ 3+ ) + 3 SO 4 2– (AQ) + 3 H 2 (G)
NAMING: после Ytterby (Village In Sweden), где это было 40015. Открытие: Жан Шарль Галиссар де Мариньяк (1878 г.)
Открытие: Жан Шарль Галиссар де Мариньяк (1878 г.)
Первое выделение: Карл Ауэр фон Вельсбах (1906)
Металлический иттербий можно использовать для улучшения измельчения зерна, прочности и других механических свойств нержавеющей стали.
Один изотоп использовался в качестве замены источника радиации для переносного рентгеновского аппарата в тех случаях, когда электричество недоступно.
Используется в запоминающих устройствах и перестраиваемых лазерах .
Может также использоваться в качестве промышленного катализатора и из-за низкой токсичности он все чаще используется для замены других катализаторов, которые считаются слишком токсичными и загрязняющими окружающую среду.
Некоторые сплавы иттербия использовались в стоматологии .
Биологическая роль: Обладает низкой токсичностью.
Наиболее часто в промышленных масштабах извлекается из монацитового песка ( ~0,03% иттербия).
Может быть извлечен путем ионного обмена и экстракции растворителем.
Ежегодное мировое производство составляет около 50 тонн в год.
2 × 10 -7 % (в Universe )
1 × 10 -7 % (в Sun )
1,8 × 100061 -5 % (в метеоритах )
8×10 -11 % (В океанах ) 3 крупнейших мировых производителя
1) Китай
2) Россия
3) Малайзия
1) Китай 1). #ytterbium More Elements FlashCards Atomic number 70 Atomic mass 173.04 g.mol -1 Электроотрицательность по Полингу 1.1 Плотность 7 g.cm -3 at 20°C Melting point 824 °C Boiling point 1466 °C Vanderwaals Radius Неизвестно Ионовый радиус ANTOKNIT0093 Isotopes 9 Electronic shell [ Xe ] 4f 14 6s 2 Energy of second ionisation 602,4 кДж. Энергия второй ионизации Energy of third ionisation 2472.3 kJ.mol -1 Standard potential – 2.27 V Открыт Жаном де Мариньяком в 1878 г. Иттербий — мягкий, ковкий и довольно пластичный элемент с ярко-серебристым блеском. Редкоземельный элемент, легко подвергается воздействию и растворению минеральными кислотами, медленно реагирует с водой и окисляется на воздухе. Оксид образует защитный слой на поверхности. Соединения иттербия встречаются редко. Применение Иттербий иногда ассоциируется с иттрием или другими родственными элементами и используется в некоторых сталях. Его металл можно использовать для улучшения измельчения зерна, прочности и других механических свойств нержавеющей стали. Иттербий не играет биологической роли, но было замечено, что его соли стимулируют обмен веществ.
2) ) USA
) USA Иттербий (Yb) – Химические свойства, воздействие на здоровье и окружающую среду
 моль -1
моль -1 9172003 кДж.моль0061 -1  Некоторые сплавы иттербия использовались в стоматологии. Один изотоп иттербия использовался в качестве заменителя источника излучения для портативного рентгеновского аппарата, когда электричество не было доступно. Как и другие редкоземельные элементы, его можно использовать для легирования люминофоров, керамических конденсаторов и других электронных устройств, и он может даже действовать как промышленный катализатор.
Некоторые сплавы иттербия использовались в стоматологии. Один изотоп иттербия использовался в качестве заменителя источника излучения для портативного рентгеновского аппарата, когда электричество не было доступно. Как и другие редкоземельные элементы, его можно использовать для легирования люминофоров, керамических конденсаторов и других электронных устройств, и он может даже действовать как промышленный катализатор. Иттербий встречается с другими редкоземельными элементами в нескольких редких минералах, таких как гадолинит, монацит и ксенотим. Природный иттербий представляет собой смесь семи стабильных изотопов. Его чаще всего добывают в промышленных масштабах из монацитового песка (~ 0,03% иттербия). Основными районами добычи являются Китай, США, Бразилия, Индия, Шри-Ланка и Австралия, а запасы иттербия оцениваются примерно в миллион тонн. Мировое производство иттербия составляет около 50 тонн в год.