Таблица менделеева – Электронный учебник K-tree
Электронный учебник
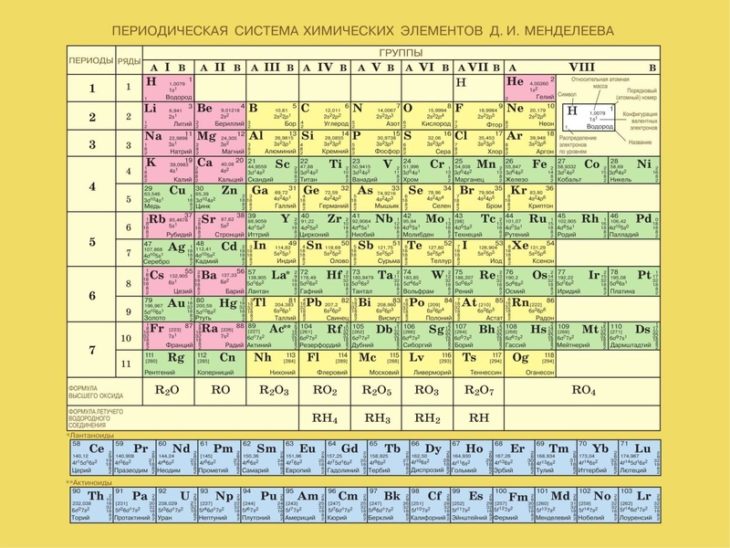
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.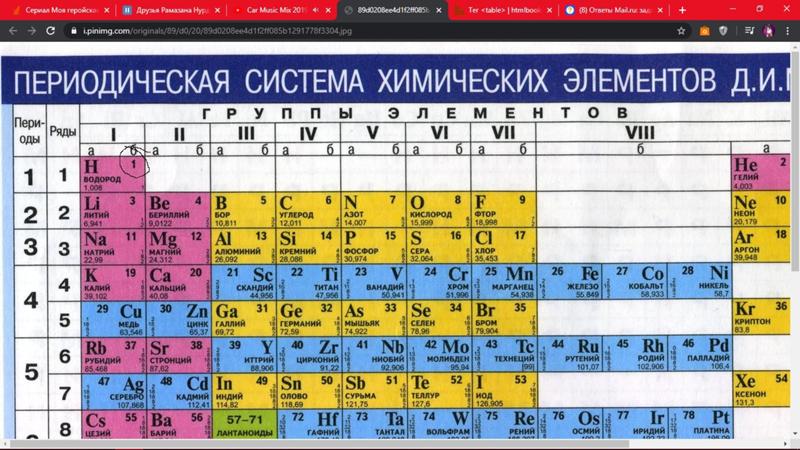
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
118 элементов. Глава 17: от химического оружия до наркоза и спасения от тифа
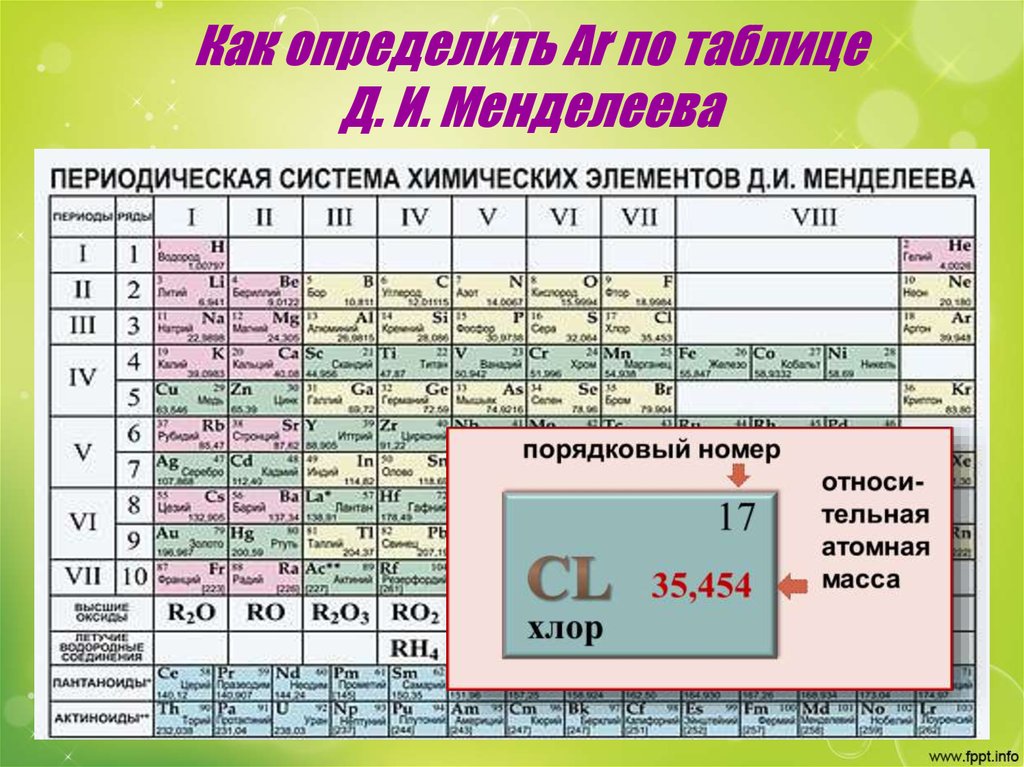
Элемент: хлор (Chlorum)
Химический символ: Cl
Порядковый номер: 17
Год открытия: 1774
Стандартная атомная масса: 35,446
Температура плавления: 171.6 К
Температура кипения: 239.1 К
Плотность при стандартных условиях: 3.21 г/л
Скорость звука в хлоре: 206 м/с
Число стабильных изотопов: 2
Кристаллическая решётка: орторомбическая
С нашим сегодняшним героем автор этих строк познакомился еще в детстве. Когда мне было 13 лет, и химия в школе только начиналась, родители опрометчиво подарили на Новый Год (ровно 30 лет назад) шикарный чешский набор «Юный химик». И ушли к друзьям праздновать. Ну что я вам скажу, хорошо, что это был частный дом на окраине Одессы, с отдельной мини-котельной, где был плиточный пол и можно было ставить химические опыты. Иначе бы мы прожгли бы магнием ковры… Но самая большая опасность нас с братом подстерегала тогда, когда мы взяли кристаллический перманганат калия и насыпали его в соляную кислоту. А потом попробовали понюхать выделявшийся желто-зеленый газ. Не пытайтесь повторить это в домашних условиях, в общем. А мы начнем рассказ о хлоре, как водится – обо всем по порядку.
Когда мне было 13 лет, и химия в школе только начиналась, родители опрометчиво подарили на Новый Год (ровно 30 лет назад) шикарный чешский набор «Юный химик». И ушли к друзьям праздновать. Ну что я вам скажу, хорошо, что это был частный дом на окраине Одессы, с отдельной мини-котельной, где был плиточный пол и можно было ставить химические опыты. Иначе бы мы прожгли бы магнием ковры… Но самая большая опасность нас с братом подстерегала тогда, когда мы взяли кристаллический перманганат калия и насыпали его в соляную кислоту. А потом попробовали понюхать выделявшийся желто-зеленый газ. Не пытайтесь повторить это в домашних условиях, в общем. А мы начнем рассказ о хлоре, как водится – обо всем по порядку.
О том, что соединения хлора известны человечеству с древности, мы уже писали: помните, в главе 11, о натрии, ведь в состав поваренной соли входят два иона – натрий и хлор. Да и кроме галита (минерал поваренной соли) есть еще сильвин с сильвинитом (KCl и его смесь с NaCl), каинит KCl·MgSO4·3Н2О, бишофит MgCl2·6Н2О. Вообще, среди галогенов хлор – самый распространенный в земной коре. Кларк хлора – 0,017%. Кстати, в нас его больше, чем в земной коре: человеческое тело содержит четверть процента ионов хлора (если считать по массе, а не по штукам). «Работа» с ионами хлора при помощи соответствующих ионных каналов – одна из ключевых составляющих молекулярной механики нервной системы.
Вообще, среди галогенов хлор – самый распространенный в земной коре. Кларк хлора – 0,017%. Кстати, в нас его больше, чем в земной коре: человеческое тело содержит четверть процента ионов хлора (если считать по массе, а не по штукам). «Работа» с ионами хлора при помощи соответствующих ионных каналов – одна из ключевых составляющих молекулярной механики нервной системы.
Бишофит
Однако хлор как элемент оставался неизвестным до XIX века. Впрочем, это не значит, что с хлором как с газом человечество не было знакомо до сэра Хэмфри Дэви, который распознал химический элемент хлор в 1808 году.
Дело в том, что как минимум с 1200 года алхимики имели дело с царской водкой. Даже школьники знают, что эта смесь соляной и азотной кислот в молярном соотношении 3 к 1 растворяет даже золото (разумеется, алхимики понятия не имели о молях и классический состав рассчитывается в объемных долях). И многие из них в курсе, что здесь происходит не растворение, а химическая реакция. А параллельно разлагается и сама царская водка:
А параллельно разлагается и сама царская водка:
HNO3 + 3 HCl →NOCl + Cl2 + 2 H2O
Кстати, именно поэтому обычно царскую водку и готовят сразу перед применением, потом она быстро желтеет как раз из-за выделившегося хлора.
Но вернемся к нашему хлору, а точнее – к его истории. Мы точно знаем, что где-то около 1630 года хлор как газ (а не как желтое окрашивание царской водки) получил фламандский химик и врач Ян Баптист ван Гельмонт. Кстати, любопытное совпадение: человек, получивший хлор в виде газа, впервые придумал и само слово «газ». Да-да, именно ван Гельмонт ввел его в науку, переделав греческое слово χάος (впрочем, другие источники утверждают, что хаос тут ни при чём, а всему виной – geist или ghost по-английски. То есть «дух» или «призрак»). Кстати, забегая вперед, скажем, что хлор – один из пяти всего лишь элементов, которые образуют двухатомные газы. И последний по порядку в таблице Менделеева после водорода, азота, кислорода и фтора.
Ян Баптист ван Гельмонт
Но ни ван Гельмонт, ни безвестные алхимики первооткрывателями хлора не считаются. Потому что они не распознали ни самостоятельное вещество, ни тем более, химический элемент. Поэтому честь открытия нашего сегодняшнего героя безусловно принадлежит Карлу Вильгельму Шееле – хотя и он не распознал химического элемента в том, что получил.
Карл Шееле
Однако первый шаг в понимании природы хлора за два года до Шееле сделал другой великий химик, о котором мы тоже уже много писали: Джозеф Пристли. В 1772 году он подействовав чистой серной кислотой на морскую соль, получил бесцветный газ, который, растворяясь в воде, давал кислоту. Раствор-то был известным – еще около 800 года нашей эры соляную кислоту открыл арабский алхимик Абу Абдаллах Джабир ибн Хайян аль-Азди ас-Суфи, известный европейцам под именем Гебер, автор ртутно-серной теории происхождения металлов.
Джабир ибн Хайян
Но теперь это вещество получил свое название. Раз muria на латыни – «рассол», то и кислота стала муриевой. Кстати, именно под таким названием она и осталась в русском – «муриевая» и «соляная». Название дал еще один великий химик – Антуан Лоран Лавуазье (такое ощущение, что в конце XVIII – начале XIX века всю химию делало десятка полтора человек). В английском языке в итоге устоялось «хлороводородная кислота», а вот гомеопаты продолжают продавать лекарства с «памятью» об Acidum Muriaticum. В науке же «мураты» остались как архаичное название гидрохлоридов – «солей» аминов и соляной кислоты R1R2R3NH+Cl–.
Раз muria на латыни – «рассол», то и кислота стала муриевой. Кстати, именно под таким названием она и осталась в русском – «муриевая» и «соляная». Название дал еще один великий химик – Антуан Лоран Лавуазье (такое ощущение, что в конце XVIII – начале XIX века всю химию делало десятка полтора человек). В английском языке в итоге устоялось «хлороводородная кислота», а вот гомеопаты продолжают продавать лекарства с «памятью» об Acidum Muriaticum. В науке же «мураты» остались как архаичное название гидрохлоридов – «солей» аминов и соляной кислоты R1R2R3NH+Cl–.
Итак, Шееле получил хлор взаимодействием минерала пиролюзита (оксида марганца) с муриевой кислотой. Почти та же реакция, которую мы провели с братом (оксид четырехвалентного марганца тоже представляет собой достаточно сильный окислитель). Шееле тоже отметил прекрасный запах новоиспеченного газа (похожий на запах царской водки, только более сильный и резкий), отметил и то, что он обесцвечивает окрашенные ткани. Но Шееле не понял, что перед ним – простое вещество. Тогда он решил, что оксид марганца забирает у муриевой кислоты флогистон и назвал газ дефлогистонизированной муриевой кислотой. Как оказалось – зря. Впрочем, Лавуазье и Клод Луи Бертолле тоже ошиблись, решив, что газ содержит некий элемент, мурий – и представляет собой его оксид.
Но Шееле не понял, что перед ним – простое вещество. Тогда он решил, что оксид марганца забирает у муриевой кислоты флогистон и назвал газ дефлогистонизированной муриевой кислотой. Как оказалось – зря. Впрочем, Лавуазье и Клод Луи Бертолле тоже ошиблись, решив, что газ содержит некий элемент, мурий – и представляет собой его оксид.
Клод Луи Бертолле
Неудивительно было ошибиться, ведь в 1785 году Бертолле (многие знают его фамилию по разлагающейся со взрывом бертоллетовой соли KClO3, а технологи рады ему за появление первого промышленного отбеливателя – того же хлора) установил, что в водном растворе хлора появляется муриевая кислота, а из раствора выделяется кислород. Кто же знал, что реакция идет несколько сложнее?
Cl2+H2O=HCl+HClO
2HClO=2HCl+O2
В итоге еще четверть века все химики мира пытались выделить мурий в чистом виде. Еще в 1809 году Жозеф Гей-Люссак и Луи Жак Тенар пытались «вытащить» кислород из «оксида мурия» прогоняя хлор над углем в раскаленной фарфоровой трубке, стандартном способе восстановления оксидов. Тщетно.
Тщетно.
За два года до того сэр Хэмфри Дэви сумел выделить «оксигенированный мурий» электролизом поваренной соли. Действуя им на металлы, Дэви тоже получал соли – те же самые хлориды, которые получались при взаимодействии металлов с муриевой кислотой. Три года тщетных попыток выделить мурий – и наконец-то до Дэви дошло: покойный Лавуазье и живой пока еще Бертолле тоже могут ошибаться – и перед ним обыкновенное простое вещество, новый химический элемент. Дэви назвал его хлорическим газом или хлорином, поскольку по-гречески χλωροζ – «желто-зеленый».
Сэр Хэмфри Дэви
Никакой фантазии! Кстати, слово chlorine так и осталось в английском языке, и автор этих строк вместе со своим коллегой Алексеем Водовозовым регулярно подавляют в себе желание применить этот газ против журналистов, которые пишут о том, что в Сирии бородатые террористы применили боевое отравляющее вещество хлорин. Отметим, что химический элемент мурий и символ «М» окончательно исчезли из химии только в 1840-х годах – настолько силен был авторитет Лавуазье.
Неорганическая химия хлора очень непроста. Даже в школе учат, что бывающий в степени окисления от -1 до +7 хлор образует огромное количество кислот, из которых безусловно запоминалась только соляная – раствор хлороводорода в воде. А там – поди запомни, какая из них хлорная, какая хлористая, какая хлорноватая, а какая – хлорноватистая. И, готовясь к олимпиадам, мы записывали в тетрадке: HClO – хлорноватистая, соли – гипохлориты; HClO2 – хлористая, соли – хлориты, HClO3 – хлорноватая кислота, соли – хлораты, HClO4 – хлорная кислота и соли – перхлораты.
HClO4
Но самое, пожалуй, интересное в химии хлора (а также йода и брома) – это способность к образованию галогенных связей. Не слышали? Неудивительно, эти взаимодействия были открыты не так давно, и в школе их точно не проходят (впрочем, насколько я помню – не проходили их мы и в курсе неорганической химии Одесского университета, впрочем – это было неудивительно, курс неорганики и введения в специальность нам читал декан. На его лекцию, посвященную углероду и метану, приходили все курсы – потому что каждый раз структура метана оказывалась разной).
На его лекцию, посвященную углероду и метану, приходили все курсы – потому что каждый раз структура метана оказывалась разной).
Вот как описывает галогенные связи один из известных специалистов по ним в России, новосибирский химик Сергей Адонин: «Представим себе, что у нас есть атом галогена. При определенных условиях (достаточно хорошо поляризуемая электронная плотность – если это иод, например, либо если есть сильные акцепторы электронов, стягивающие ЭП с атома) электронная плотность как бы перестает быть сферической. По сути, она приобретает тороидальное строение, а в центре образуется дельта плюс, именуемый сигма-дыркой, а по краям – дельта минус. И вот в эту «дырку» поставляется пара электронов с другого атома, например – с азота, или с другого галогена. Образуется галогенная связь, которая, пусть и сопоставима по энергии с водородной и гораздо слабее ковалентной, но все же достаточно значима».
Кстати, именно галогенные связи обнаружены и в твердом хлоре, и в полигалогенид-анионах, например – вот в таком [Cl8]2-. Впрочем, кому интересно, тот может прочитать и официальное определение галогеновой связи от IUPAC, составленное одним из пионеров этой области, миланцем Пиеранджело Метранголо.
Впрочем, кому интересно, тот может прочитать и официальное определение галогеновой связи от IUPAC, составленное одним из пионеров этой области, миланцем Пиеранджело Метранголо.
Твердый хлор
Когда хлор – безусловное зло
Когда началась вторая мировая война, в истории нашего героя (в смысле – хлора) началась новая, отвратительная страница. И связана эта страница с нобелевским (впрочем, на начало войны еще нет) лауреатом по химии Фрицем Габером, уже прославившимся на то время технологией синтеза аммиака из азота и водорода. Автор уже описывал эту историю, но в главе о хлоре ее нельзя не процитировать.
Фриц Габер
С самого начала Первой мировой войны, 1914 года, химик работал в Военно-химическом департаменте Германии. Ему поручили создать отравляющий газ для военного применения. Говорят, что Габер на самом деле не был монстром, войну ненавидел и хотел всего лишь, чтобы она закончилась быстрее, ведь в траншеях гибло неимоверное количество солдат. Причем не столько от пуль и снарядов, сколько от антисанитарии и сопутствующих ей болезней. Но, как и в случае с изобретателями ядерного оружия, благими намерениями оказалась вымощена дорога в ад. Габер со своими сотрудниками разработал метод производства хлора в качестве отравляющего вещества, которое немцы решили испытать под Ипром.
Причем не столько от пуль и снарядов, сколько от антисанитарии и сопутствующих ей болезней. Но, как и в случае с изобретателями ядерного оружия, благими намерениями оказалась вымощена дорога в ад. Габер со своими сотрудниками разработал метод производства хлора в качестве отравляющего вещества, которое немцы решили испытать под Ипром.
Одним из главных преимуществ хлора была его дешевизна и доступность (газа было много в отходах немецкой промышленности), а также то, что газ был достаточно тяжел: он не поднимался вверх, а стлался по земле, как раз над окопами, где засели вражеские солдаты.
22 апреля 1915 года Габер лично контролировал первое удачное применение оружия массового поражения на фронте. Ветер дул в сторону французских позиций, и началась газовая атака.
«Лица, руки людей были глянцевого серо-черного цвета, рты открыты, глаза покрыты свинцовой глазурью, все вокруг металось, кружилось, борясь за жизнь. Зрелище было пугающим, все эти ужасные почерневшие лица, стенавшие и молящие о помощи… Воздействие газа заключается в заполнении легких водянистой слизистой жидкостью, которая постепенно заполняет все легкие, из-за этого происходит удушение, вследствие чего люди умирали в течение одного или двух дней», — вспоминали очевидцы событий.
Судьба наказала Габера почти мгновенно. Через десять дней после этой атаки Клара Иммервар выстрелила в себя из револьвера. Единственным известием о смерти Клары стало сообщение в провинциальной газете Grunewald-Zeitung: «жена доктора Г. из Далема, который в данный момент находится на фронте, покончила с жизнью, выстрелив в себя. Причины этого поступка несчастной женщины неизвестны».
Клара Иммервар
Слухов и домыслов было много, но, вероятнее всего, последней каплей для пацифистки Иммервар стало то, что и она сама, помогая мужу, помогла убить более трех тысяч человек (а если верить германской прессе, то и все пять). Печально, но в 1946 году покончил с собой и единственный сын Габера и Клары.
1918-1919 годы стали, пожалуй, самыми странными в жизни Фрица Габера: с одной стороны, поражение Германии, осуждение множества коллег из Англии и Франции (хотя, можно подумать, там химическое оружие не делали), тяжелейшая депрессия. С другой стороны, пока еще любимая новая жена и решение Нобелевского комитета, символизирующее то, что возможность массового производства аммиака перевесила тысячи погибших от химического оружия. Габер стал лауреатом Нобелевскеой премии по химии 1918 года (ее присудили в 1919 году).
Габер стал лауреатом Нобелевскеой премии по химии 1918 года (ее присудили в 1919 году).
Входит хлор в состав и еще двух самых знаменитых боевых отравляющих веществ: иприта, который впервые применили там же, на Ипре, 12 июля 1917 года и фосгена – COCl2. Но мы уже не будем о них рассказывать, иначе наша статья превратится в книжку.
Иприт
Любопытно, что использовать чистый хлор во благо начали гораздо раньше: еще до того, как мурий окончательно исчез со страниц книг по химии.
В 1831 году химик Фридлиб Фердинанд Рунге, первооткрыватель фенола (1834) и кофеина (1819) сказал новое слово в борьбе с холерой: вместо уксуса и сернистого газа в качестве дезинфекции он предложил использовать хлор. Увы, эта ипостась хлора не очень прижилась, передав свои функции хлорке, а вот военная осталась до сих пор.
Фридлиб Фердинанд Рунге
Чем тренировался на кошках герой Вицина
Важных соединений хлора существует огромное множество, как органических, так и неорганических. Какие-то известны давно, какие-то – несколько десятилетий. Среди них есть совсем маленькие молекулы (или смеси – например, хлорка или хлорная известь, которая представляет собой смесь Ca(OCl)2·CaCl2·Ca(OH)2·2H2O), – и огромные полимеры, например, поливинилхлорид, он же ПВХ. Но мы, пожалуй, расскажем еще о двух заметных соединениях. И первое из них, несмотря на то, что уже много лет не используется, как наркоз, до сих пор остается символом вещества, которое способно быстро «отключить» человека.
Какие-то известны давно, какие-то – несколько десятилетий. Среди них есть совсем маленькие молекулы (или смеси – например, хлорка или хлорная известь, которая представляет собой смесь Ca(OCl)2·CaCl2·Ca(OH)2·2H2O), – и огромные полимеры, например, поливинилхлорид, он же ПВХ. Но мы, пожалуй, расскажем еще о двух заметных соединениях. И первое из них, несмотря на то, что уже много лет не используется, как наркоз, до сих пор остается символом вещества, которое способно быстро «отключить» человека.
Фрагмент молекулы ПВХ
Любопытно, что хлороформ, или трихлорметан получили одновременно (ну, или почти одновременно) сразу несколько химиков около 1831 года. Важнее другое – в 1842 году доктор Роберт Мортимер Гловер, сооснователь Парижского медицинского общества, открыл свойства хлороформа как анестетика, введя его в шею собаке.
Хлороформ
Затем шотландец Джеймс Янг Симпсон в 1847 году показал, что при помощи хлороформа можно усыплять людей (в опытах на своих друзьях). Впервые хлороформ на человеке испытали 4 ноября (Симпсон попробовал вдыхать его сам и усыпил двух друзей-докторов на вечеринке). Неделю спустя другой шотландец, Фрэнсис Броуди Имлах выполнил роль анестезиолога и использовал хлороформ в качестве наркоза при удалении зуба Джеймсом Дарси Моррисоном. Так днем 11 ноября 1847 года началась эра хлороформного наркоза.
Впервые хлороформ на человеке испытали 4 ноября (Симпсон попробовал вдыхать его сам и усыпил двух друзей-докторов на вечеринке). Неделю спустя другой шотландец, Фрэнсис Броуди Имлах выполнил роль анестезиолога и использовал хлороформ в качестве наркоза при удалении зуба Джеймсом Дарси Моррисоном. Так днем 11 ноября 1847 года началась эра хлороформного наркоза.
Джеймс Янг Симпсон
Кстати, по иронии судьбы, первооткрыватель хлороформной анестезии, доктор Гловер умер в 1859 году от передозировки хлороформом, как наркоман. Если не считать другого пионера анестезии, Горацио Уэллса, который переезал себе бедренную артерию, предварительно обезболив себя вдыханием хлороформа, Гловер стал первой жертвой этого вещества.
Но, конечно же, могучая поступь хлороформа как наркоза, началась в 1853 году, когда Джон Сноу использовал хлороформ во время восьмых родов королевы Виктории. Позже он обобщил свой опыт в книге On Chloroform and Other Anesthetics (National Library of Medicine, Bethesda, MD, 1858). В интервале между 1865 и 1920 годами от 80 до 95%наркозов выполнялось при помощи хлороформа. Однако потом рост применения веселящего газа (который и поныне служит для этих целей), улучшение технологий управления наркозом и открытие в 1932 году неингаляционного гексобарбитала свело более опасный хлороформ на нет – в клинической практике.
В интервале между 1865 и 1920 годами от 80 до 95%наркозов выполнялось при помощи хлороформа. Однако потом рост применения веселящего газа (который и поныне служит для этих целей), улучшение технологий управления наркозом и открытие в 1932 году неингаляционного гексобарбитала свело более опасный хлороформ на нет – в клинической практике.
Иллюстрация из книги Сноу
Известны многочисленные случаи применения хлороформа преступниками – в особенности в конце XIX века, и минимум два из них связаны с Холмсом. Точнее, с Холмсами – один из эпизодов описан в рассказе Конан-Дойля «Случай с переводчиком», а второй – с американским доктором Генри Говардом Холмсом, серийным убийцей, на счету которого минимум 27 жертв. Очень часто хлороформ использовали для «бытовых» убийств – так его жертвой стал знаменитый бизнесмен Уильям Марш Райс, который основал Университет Райса в Хьюстоне. Его нашли мертвым дома и поначалу решили, что он просто умер во сне, однако расследование показало, что умер-то он действительно во сне, но под действием хлороформа. Убийцей оказались собственные дворецкий и камердинер Райса.
Убийцей оказались собственные дворецкий и камердинер Райса.
Уильям Марш Райс
Ну и, конечно, кто из нас не помнит эпизод из фильма «Операция Ы или другие приключения Шурика», где Трус, который должен вывести из строя «бабулю-божий одуванчик» тоже готовится пустить в ход хлороформ и после неудачных попыток «потренироваться» на Балбесе и Бывалом тренируется на фарфоровых кошках. Тоже криминальное употребление!
Нобелевская премия и Юрий Шевчук
Еще одно органическое вещество, в состав которого входит пять атомов хлора, принесло его популяризатору Нобелевскую премию – по физиологии или медицине. Хотя Пауль Мюллер вообще не был ни физиологом, ни медиком, но жизней он спас – немерянно. А заодно и придумал название группы для Юрия Шевчука. Автор этих строк писал историю Нобелевки 1948 года, но напомним некоторые моменты.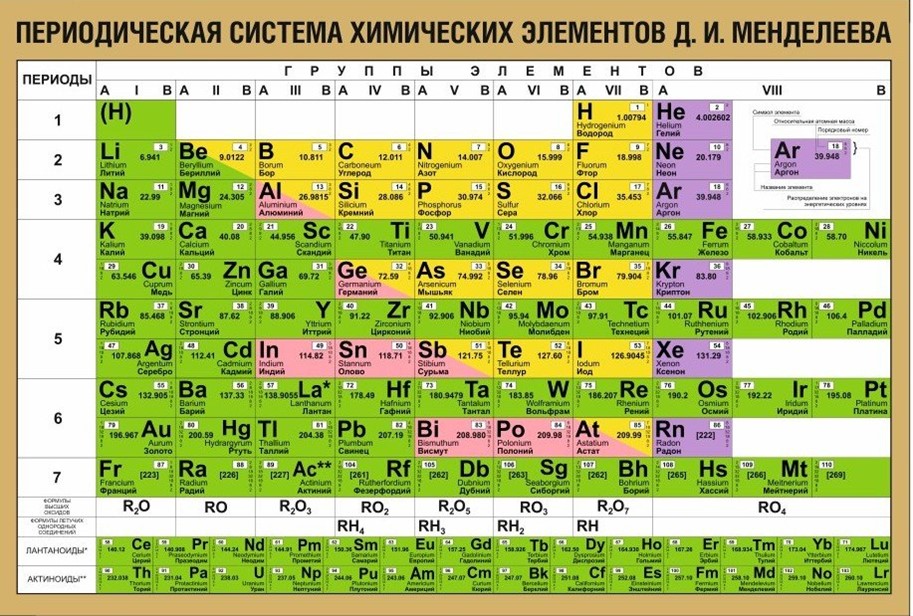
Мюллер работал в фармацевтической и химической компании J.R. Geigy AG. Сейчас мы ее знаем под названием Novartis. В 1935 году его «бросили» на новое направление – поиск инсектицидов. Проблема была вот в чем: все доступные вещества, которые убивали вредителей сельскохозяйственных растений, в то время делились на три части.
Пауль Герман Мюллер
Первые неплохо убивали насекомых, но удорожали продукты до невозможности. Вторые были дешевыми, но очень избирательными и слаботоксичными. Были еще мышьякосодержащие. Они были дешевыми и насекомых убивали шикарно, но параллельно убивали и людей, что для сельского хозяйства не подходило (отметим, что и вся современная боевая фосфорорганика, вплоть до «Новичка», выросла именно из инсектицидов).
Мюллер отважно начал синтезировать новые вещества. Поиск был почти абсолютно свободным. Нужно было создать устойчивое вещество, которое бы быстро убивало насекомых, а для человека было бы токсичным лишь в той дозе, которая намного превышает рабочие. Постепенным приближением в 1939 году Мюллер дошел до вещества, которое правильно называть 1,1,1-трихлор-2,2-бис(4-хлорфенил)этан, но проще — дихлордифенилтрихлорметилметан. Он же ДДТ.
Постепенным приближением в 1939 году Мюллер дошел до вещества, которое правильно называть 1,1,1-трихлор-2,2-бис(4-хлорфенил)этан, но проще — дихлордифенилтрихлорметилметан. Он же ДДТ.
ДДТ
Само вещество впервые синтезировал в 1873 году 24-летний студент будущего нобелевского лауреата Адольфа фон Байера, австриец Оттмар Цейдлер (здесь можно почитать статью, в которой он излагал свои результаты). Как это часто бывает, синтезировал и забыл. Ни свойства вещества, ни формы кристаллов Цейдлер не описал, известна была только температура плавления (105 °C).
Мюллер же искал инсектициды, поэтому весьма быстро увидел, что ДДТ для насекомых — контактный яд. Попадая на тело животного, вещество даже в крошечных концентрациях действует на его нервную систему и убивает его. J.R. Geigy AG моментально поняла свою выгоду, запатентовала инсектицид и начала зарабатывать большие деньги на том, что продавала дуст сельхозкомпаниям. Да, дуст и ДДТ — это одно и то же. В СССР инсектицид чаще всего продавали в порошкообразном состоянии, и от английской маркировки — dust («пыль») — и пошло это его распространенное название.
При чем же тут Нобелевская премия по физиологии и медицине, спросите вы? Ответим: она была вручена в 1948 году в полном соответствии с завещанием Альфреда Нобеля, который просил награждать тех, кто принесет максимальную пользу человечеству. В случае с медициной речь идет, конечно же, о спасенных жизнях. Потому что ДДТ убивал не только колорадского жука и других вредителей сельхозугодий, но и платяную вошь – переносчика сыпного тифа. И именно ДДТ смог остановить эпидемии этого страшного заболевания. Ограничить малярию, уничтожая личинок малярийного комара и самого анофелеса тоже во многом удалось при помощи этого вещества.
Текст: Алексей Паевский
Хлор | Использование, свойства и факты
хлор
Посмотреть все СМИ
- Ключевые люди:
- Карл Вильгельм Шееле Майкл Фарадей сэр Хамфри Дэви
- Похожие темы:
- химический элемент галоген отбеливать дефицит хлора хлор-36
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
хлор (Cl) , химический элемент, второй по легкости член галогенных элементов или группы 17 (группа VIIa) периодической таблицы.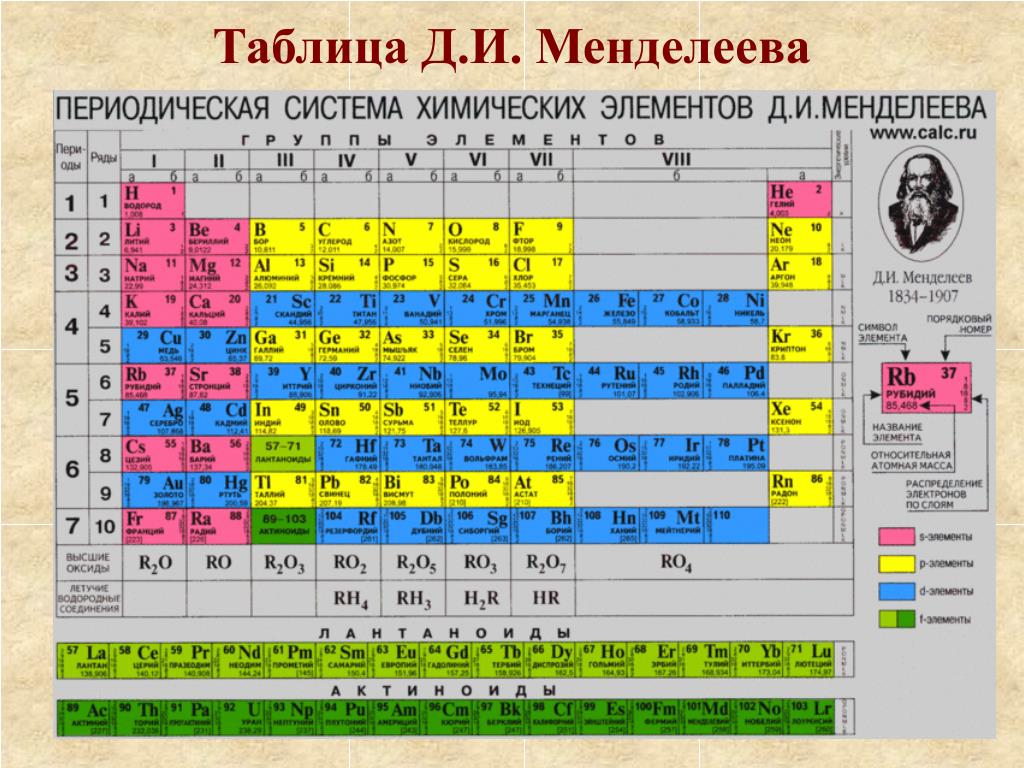
| атомный номер | 17 |
|---|---|
| атомный вес | 35.446 to 35.457 |
| melting point | −103 °C (−153 °F) |
| boiling point | −34 °C (−29 °F) |
| density (1 atm, 0 °C или 32 °F) | 3,214 г/литр (0,429 унции/галлон) |
| степени окисления | −1, +1, +3, +5, +7 |
| электронная конфигурация | |
История
Каменная соль (поваренная соль, или хлорид натрия) известна уже несколько тысяч лет. Это основная составляющая солей, растворенных в морской воде, из которой ее получали в Древнем Египте путем выпаривания. Во времена Римской империи солдатам частично платили солью ( салариум , корень современного слова зарплата ). В 1648 году немецкий химик Иоганн Рудольф Глаубер получил сильную кислоту, которую он назвал соляным спиртом, нагревая влажную соль в угольной печи и конденсируя пары в ресивере. Позже он получил тот же продукт, который теперь известен как соляная кислота, путем нагревания соли с серной кислотой.
Это основная составляющая солей, растворенных в морской воде, из которой ее получали в Древнем Египте путем выпаривания. Во времена Римской империи солдатам частично платили солью ( салариум , корень современного слова зарплата ). В 1648 году немецкий химик Иоганн Рудольф Глаубер получил сильную кислоту, которую он назвал соляным спиртом, нагревая влажную соль в угольной печи и конденсируя пары в ресивере. Позже он получил тот же продукт, который теперь известен как соляная кислота, путем нагревания соли с серной кислотой.
В 1774 году шведский химик Карл Вильгельм Шееле обработал порошкообразный черный оксид марганца соляной кислотой и получил зеленовато-желтоватый газ, который не смог распознать как элемент. Истинная природа газа как элемента была установлена в 1810 году английским химиком Хамфри Дэви, который позже назвал его хлором (от греческого chloros , что означает «желтовато-зеленый») и дал объяснение его отбеливающему действию.
Возникновение и распространение
Помимо очень небольшого количества свободного хлора (Cl) в вулканических газах, хлор обычно встречается только в виде химических соединений. Он составляет 0,017 процента земной коры. Природный хлор представляет собой смесь двух стабильных изотопов: хлора-35 (75,53%) и хлора-37 (24,47%). Наиболее распространенным соединением хлора является хлорид натрия, который встречается в природе в виде кристаллической каменной соли, часто обесцвеченной примесями. Хлорид натрия также присутствует в морской воде, средняя концентрация которой составляет около 2 процентов этой соли. Некоторые моря, не имеющие выхода к морю, такие как Каспийское море, Мертвое море и Большое Соленое озеро в штате Юта, содержат до 33 процентов растворенной соли. Небольшие количества хлорида натрия присутствуют в крови и в молоке. Другими хлорсодержащими минералами являются сильвит (хлорид калия [KCl]), бишофит (MgCl 2 ∙6H 2 O), карналлит (KCl∙MgCl 2 ∙6H 2 O) и каинит (KCl∙MgSO 4 ∙3H 2 O 9). Он содержится в эвапоритовых минералах, таких как хлорапатит и содалит. В желудке присутствует свободная соляная кислота.
Он составляет 0,017 процента земной коры. Природный хлор представляет собой смесь двух стабильных изотопов: хлора-35 (75,53%) и хлора-37 (24,47%). Наиболее распространенным соединением хлора является хлорид натрия, который встречается в природе в виде кристаллической каменной соли, часто обесцвеченной примесями. Хлорид натрия также присутствует в морской воде, средняя концентрация которой составляет около 2 процентов этой соли. Некоторые моря, не имеющие выхода к морю, такие как Каспийское море, Мертвое море и Большое Соленое озеро в штате Юта, содержат до 33 процентов растворенной соли. Небольшие количества хлорида натрия присутствуют в крови и в молоке. Другими хлорсодержащими минералами являются сильвит (хлорид калия [KCl]), бишофит (MgCl 2 ∙6H 2 O), карналлит (KCl∙MgCl 2 ∙6H 2 O) и каинит (KCl∙MgSO 4 ∙3H 2 O 9). Он содержится в эвапоритовых минералах, таких как хлорапатит и содалит. В желудке присутствует свободная соляная кислота.
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
Современные отложения соли, должно быть, образовались в результате испарения доисторических морей, при этом сначала кристаллизовались соли с наименьшей растворимостью в воде, а затем соли с большей растворимостью. Поскольку хлорид калия лучше растворим в воде, чем хлорид натрия, некоторые залежи каменной соли, например, в Штассфурте, Германия, были покрыты слоем хлорида калия. Чтобы получить доступ к хлориду натрия, сначала удаляют калийную соль, важную как удобрение.
Cl Информация об элементе хлора: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура хлора
Структура твердого состояния хлора Орторомбическая с центром в основании .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые представляют собой длины ребер ячеек. Константы решетки (a, b и c)
| A | B | C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 622,35 PM | 445.61 | 817,85 PM | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | π/2 |
The positions of the atoms inside the unit cell are described by the set атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными). Штаты
Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными). Штаты
| Атомный номер | 17 | ||
| Число электронов (без заряда) | 17 | ||
| Number of Protons | 17 | ||
| Mass Number | 35 | ||
| Number of Neutrons | 18 | ||
| Shell structure (Electrons per energy level) | 2, 8, 7 | ||
| Электронная конфигурация | [NE] 3S2 3P5 | ||
| Валентные электроны | 3S2 3P5 | ||
| Валентность) | 5 | ||
| (валентность) | 5 | (валентность) | 5 | (валентность)0033 | Основные степени окисления | -1, 1, 3, 5, 7 |
| Степени окисления | -1, 1, 2, 3, 4, 5, 6, 7 | 90 Symbol0383 A Числа) | 2 P 3/2 |
Atomic Model of Hlorine Electrons Over Energy
.

Сокращенная электронная конфигурация основного состояния нейтрального атома хлора: [Ne] 3s2 3p5. Часть конфигурации хлора, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ne]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3s2 3p5, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального хлора
Полная электронная конфигурация основного состояния атома хлора. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p5
Электроны заполнены атомными орбиталями в порядке, определяемом принципом Ауфбау, принципом запрета Паули и правилом Хунда.
 …
…Атомная структура хлора
Атомный радиус хлора составляет 79 пм, а его ковалентный радиус равен 99 пм.
| Вычисленный атомный радиус | 79 пм (0,79Å) |
| Эмпирический радиус | 100 вечера (1 Å) |
| 22.4129 CM3/Мол | |
| 366.4129 CM3/моль | 366.4129 CM3/моль | . Van der waals радиус | 175 вечера |
| Нейтронный сечение | 35,3 |
| Абсорбция нейтрона | 0,033 |
 0145
0145Хлор Химические свойства: Энергия ионизации хлора и сродство к электрону
Сродство к электрону хлора составляет 349 кДж/моль.
| Valence | 5 |
| Electronegativity | 3.16 |
| ElectronAffinity | 349 kJ/mol |
Ionization Energy of Chlorine
Refer to table below for Ionization energies of Chlorine
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 1251.2 |
| 2nd | 2298 |
| 3rd | 3822 |
| 4th | 5158.6 |
| 5th | 6542 |
| 6th | 9362 |
| 7th | 11018 |
| 8th | 33604 |
| 9th | 38600 |
| 10th | 43961 |
| 11th | 51068 |
| 12th | 57119 |
| 13th | 63363 |
| 14th | 72341 |
| 15th | 78095 |
| 16th | 352994 |
| 17th | 380760 |
Хлор.
 0099
0099Refer to below table for Chlorine Physical Properties
| Density | 0.003214 g/cm3 |
| Molar Volume | 22.4129 cm3/mol |
Elastic Properties
| Young Modulus | – | ||
| Модуль сдвига | – | ||
| Модуль объемного сжатия | 1,1 ГПа | ||
| Коэффициент Пуассона | 7 – | 7 – | 70037 |
Hardness of Chlorine – Tests to Measure of Hardness of Element
| Mohs Hardness | – |
| Vickers Hardness | – |
| Brinell Hardness | – |
Chlorine Электрические свойства
Хлор является проводником электричества. Электрические свойства хлора
Электрическая проводимость 9 см. в таблице ниже. 0037 0037 | 0,01 с/м |
| Устойчивость | 100 М ω |
| (Сверхпроводящая точка | – |
Хлорина и кондиционер. )
Хлор Магнитные свойства
| Магнитный тип | Диамагнитный |
| Curie Point | – |
| Mass Magnetic Susceptibility | -7.2e-9 m3/kg |
| Molar Magnetic Susceptibility | -5.11e-10 m3/mol |
| Volume Magnetic Susceptibility | -2,31E -8 |
Оптические свойства хлора
| Индекс преломления | 1.000773 |
| Скорость звука | 206 м/с |
Термические свойства хлора – энтузиазм и термодинамика
. См. Таблицу ниже для термических свойств. 101.55°C, -150.78999999999996 °F)
См. Таблицу ниже для термических свойств. 101.55°C, -150.78999999999996 °F)
Enthalpies of Chlorine
| Heat of Fusion | 3.2 kJ/mol |
| Heat of Vaporization | 10.2 kJ/mol |
| Heat горения | – |
Изотопы хлора. Ядерные свойства хлора
Хлор состоит из 24 изотопов, содержащих от 28 до 51 нуклона. Хлор имеет 2 стабильных естественных изотопа.
Изотопы хлора – Встречающиеся в природе стабильные изотопы: 35Cl, 37Cl.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode |
|---|---|---|---|---|---|---|
| 28Cl | 17 | 11 | 28 | Synthetic | ||
| 29Cl | 17 | 12 | 29 | Синтетика | ||
| 30Cl | 17 | 13 | 30 | Synthetic | ||
| 31Cl | 17 | 14 | 31 | Synthetic | ||
| 32Cl | 17 | 15 | 32 | Synthetic | ||
| 33Cl | 17 | 16 | Synthetic | |||
| 34Cl | 17 | 17 | 34 | Synthetic | ||
| 35Cl | 17 | 18 | 35 | 75. |

