Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Селен химический элемент. Чем является селен металлом или неметаллом.
Содержание
- Что такое селен
- История элемента
- Происхождение названия
- Нахождение в природе и получение
- Кристаллическая структура селена
- Кристаллографические свойства
- Электронная схема селена
- Степень окисления селена
- Важнейшие соединения:
- Ионы селена
- Физические свойства
- Химические свойства
- Применение
- Биологическая роль
- Изотопы
- Оптические свойства
- Интересные опыты над селеном
- Наличие селена в организме человека
- Физиологическое действие
- Общий характер воздействия селена и его соединений
- Отравление
- Действие на кожу
- Лечение дефицита селена
- Топ-10 продуктов питания с высоким содержанием селена
Что такое селен
Селен (элемент Selenium) – это химический элемент, аналог серы, который относится к 16 группе (согласно более ранней классификации – к 6-й) таблицы Менделеева. Атомный номер элемента – 34, а атомная масса составляет 78,96. Элемент проявляет преимущественно неметаллические свойства. В природе селен – это комплекс, состоящий из шести изотопов, как правило, сопутствует сере. То есть встречается в местах добычи серы. Итак, загадочный селен — что это такое и чем он так ценен? Он обладает множеством полезных свойств.
Атомный номер элемента – 34, а атомная масса составляет 78,96. Элемент проявляет преимущественно неметаллические свойства. В природе селен – это комплекс, состоящий из шести изотопов, как правило, сопутствует сере. То есть встречается в местах добычи серы. Итак, загадочный селен — что это такое и чем он так ценен? Он обладает множеством полезных свойств.
История элемента
Элемент был открыт Й. Я. Берцелиусом в 1817 году. Шведский химик и минералог проводил опыты с серной кислотой вместе с Я. Г. Ганом. Учёные обнаружили в веществе красновато-коричневый осадок с редечным запахом, который тогда служил определением присутствия теллура. Берцелиус решил исследовать осадок, надеясь обнаружить новый металл. После изучения этого явления он смог выявить неизвестное вещество, которое по свойствам напоминало теллур. Поскольку второй элемент был назван в честь Земли, химик назвал новый элемент Selenium (селен), что переводится с латинского «Луна».
В 1873 году Уиллоуби Смит доказал, что электрическое сопротивление элемента зависит от освещённости. Через несколько лет были разработаны первые продукты в виде ячеек на основе селена, которые использовали в фотофоне, созданном А. Г. Беллом. С помощью химического элемента можно было изменять электропроводимость световых лучей, которые отражались от зеркала под влиянием звука. Полезное свойство селена позволило использовать его в разных измерителях освещённости.
Через несколько лет были разработаны первые продукты в виде ячеек на основе селена, которые использовали в фотофоне, созданном А. Г. Беллом. С помощью химического элемента можно было изменять электропроводимость световых лучей, которые отражались от зеркала под влиянием звука. Полезное свойство селена позволило использовать его в разных измерителях освещённости.
В первой половине XX века начали производить выпрямители на основе этого элемента, которые заменили медно-закисные изделия. Полупроводниковые диоды широко использовали до 1970-х годов.
Когда начали происходить массовые отравления работников на селеновых заводах и животных, поедавших траву около этих предприятий, люди поняли, что химический элемент токсичен. В середине прошлого века учёные раскрыли биологическое значение вещества для живых организмов.
Происхождение названия
Название происходит от греч.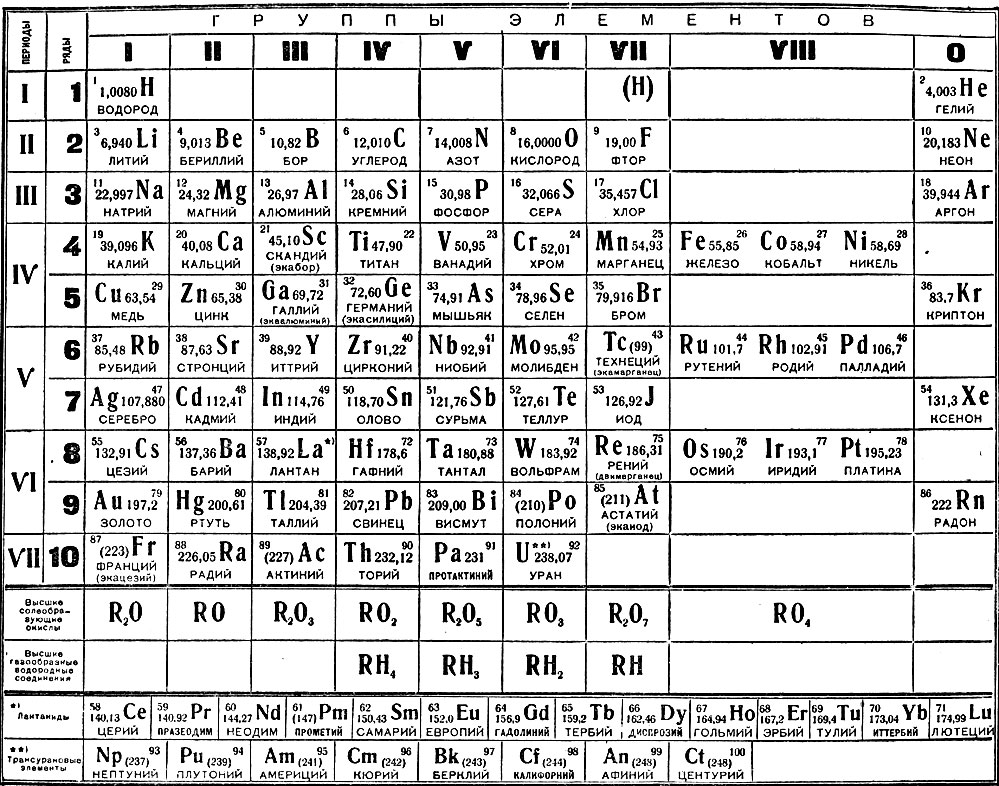 σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
Нахождение в природе и получение
Неметалл в объёме 500 мг/т содержится в земной коре. Основные черты вещества можно определить по близкому отношению ионных радиусов селена и серы. С «лунным» элементом образуются 37 минералов, включая ашавалит, гуанахуатит, клаусталит, платинит, тиманнит и хастит. Селен в виде самородков встречается довольно редко. Его минералы можно найти чаще, но добывают материал в основном из сульфидов. В этих соединениях объём неметалла варьируется в пределах чисел 7−100 г/т. В морской воде концентрация вещества составляет 0,4 мкг/л.
Основным источником неметалла выступают шламы свинцовых камер и пыль, которая образуется при обжиге сульфидов с соответствующим веществом. Сырьё обрабатывают концентрированной серной кислотой с нитратом натрия. В результате реакции образуется селенистая кислота с формулой h3SeO3 и в небольшом объёме селеновая кислота (h3SeO4).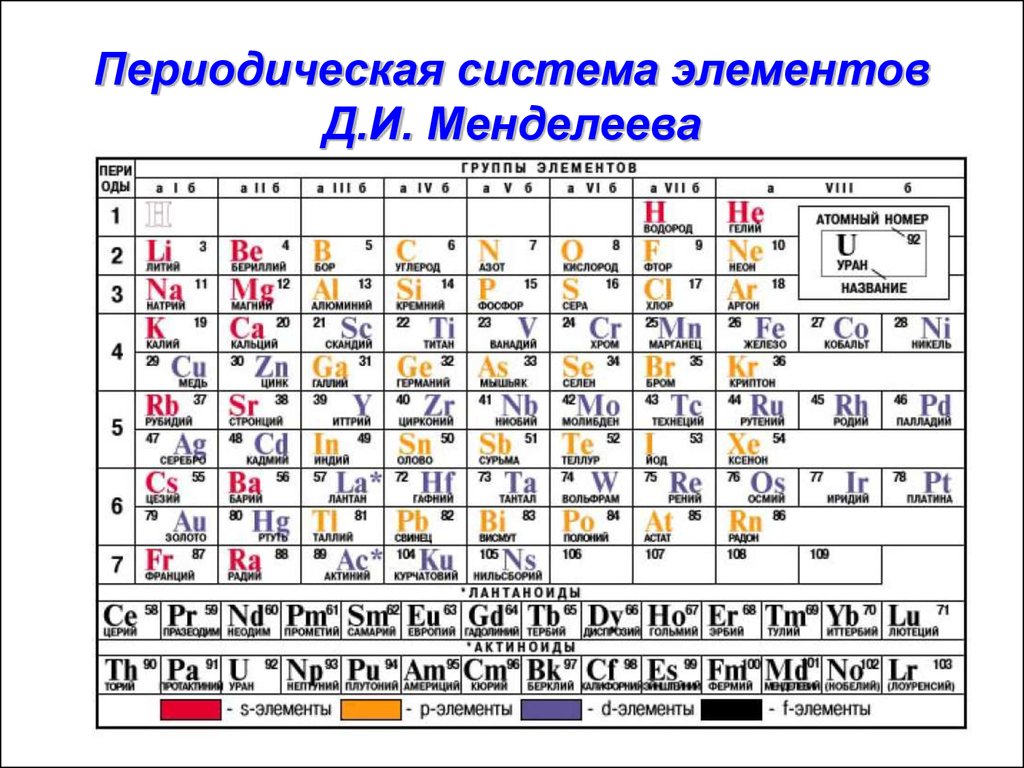 Затем селенистую кислоту обрабатывают сернистым газом и получают элементарный селен и серную кислоту.
Затем селенистую кислоту обрабатывают сернистым газом и получают элементарный селен и серную кислоту.
Чтобы очистить полученный осадок, его сжигают в кислороде, который насыщают парами азотной кислоты. В результате получается чистый диоксид селена. В раствор SeO2 добавляют соляную кислоту, а затем пропускают через него сернистый газ, осаждая нужный элемент. Полученное вещество переплавляют, фильтруют через стеклоткань или активированный уголь. Последняя стадия очистки элемента подразумевает дистилляцию в вакууме.
Кристаллическая структура селена
Существует две модификации селена:
1. Кристаллическая (моноклинный селен a- и b-форм, гексагональный селен g-формы).
2. Аморфная (порошкообразная, коллоидная и стекловидная формы селена).
Модификация аморфный красного цвета селен – это одна из неустойчивых модификаций элемента. Порошкообразная и коллоидная формы селена получаются путем восстановления вещества из раствора селенистой кислоты h3SeO3.
Черный стекловидный селен можно получить путём нагревания элемента любой модификации до температуры 220 градусов Цельсия с быстрым охлаждением. Гексагональный селен имеет серый цвет. Эту модификацию, наиболее устойчивую термодинамически, можно получить также путем нагревания до температуры плавления с дальнейшим охлаждением до температуры 180-210 градусов Цельсия. Необходимо некоторое время выдерживать такой температурный режим.
Кристаллографические свойства
| Точечная группа | 3 2 – трапецоэдральный |
| Пространственная группа | P31 2 1 |
| Сингония | тригональная |
| Параметры ячейки | a = 4.3662Å, c = 4.9536Å |
Электронная схема селена
Se: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4
Короткая запись:
Se: [Ar]4s2 3d10 4p4
Одинаковую электронную конфигурацию имеют атом селена и +1Br, +2Kr
Порядок заполнения оболочек атома селена (Se) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.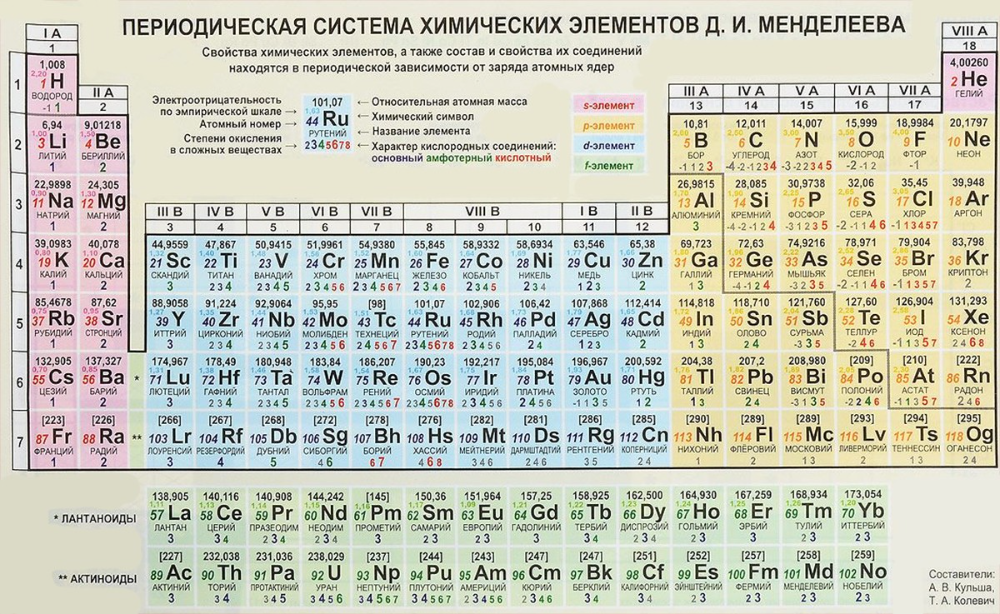
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Селен имеет 34 электрона, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
4 электрона на 4p-подуровне
Степень окисления селена
Атомы селена в соединениях имеют степени окисления 6, 4, 2, 1, -2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Важнейшие соединения:
Для селена наиболее характерны степени окисления -2, +4, +6.
Оксид селена(IV) SeO2 — белые блестящие кристаллы с полимерной молекулой (SeOsub>2)sub>n , tпл. 350°С. Пары имеют желтовато-зеленый цвет и обладают запахом гнилой редьки Легко растворяется в воде с образованием h3SeO3.
350°С. Пары имеют желтовато-зеленый цвет и обладают запахом гнилой редьки Легко растворяется в воде с образованием h3SeO3.
Селенистая кислота, h3SeO3 — белые ромбические кристаллы.Обладает большой гигроскопичностью. Хорошо растворима в воде. Неустойчива, при нагревании выше 70°С распадается на воду и оксид селена(IV). Соли — селениты.
Селенит натрия, Na2SeO3 – бесцветные кристаллы, tпл. 711°С. Гигроскопичен, хорошо растворим в воде. При нагревании в инертной атмосфере разлагается на оксиды. При нагревании на воздухе окисляется до селената: 2Na2SeO3 + O2 = 2Na2SeO4
Оксид селена(VI) SeO3 — — бесцветные кристаллы, tпл. 121°С. Гигроскопичен, с водой реагирует с большим тепловыделением и образованием h3SeO4. Сильный окислитель, бурно реагирует с органическими веществами
Селеновая кислота, h3SeO4 — бесцветное кристаллическое вещество, хорошо растворимое в воде. Ядовита, гигроскопична, является сильным окислителем. Селеновая кислота — одно из немногих соединений, при нагревании растворяющих золото, образуя красно-желтый раствор селената золота(III).
2Au + 6h3SeO4 = Au2(SeO4)3 + 3h3SeO3 + 3h3O
Селенаты — соли селеновой кислоты. Селенат натрия Na2SeO4 — кристаллы ромбической сингонии; tпл. 730 °С. Получают нейтрализацией кислоты оксидом, гидроксидом или карбонатом натрия или окислением селенита натрия. Мало растворим в воде, ниже 32 °С кристаллизуется из водных растворов в виде декагидрата Na2SeO4·10h3O
Селеноводород, h3Se — бесцветный горючий газ с неприятным запахом. Самое токсичное соединение селена. На воздухе легко окисляется при обычной температуре до свободного селена. Также до свободного селена окисляется хлором, бромом и иодом. При горении в воздухе или кислороде образуется оксид селена(IV) и вода. Более сильная кислота, чем h3S.
Селениды — соединения селена с металлами. Кристаллические вещества, часто с металлическим блеском. Существуют моноселениды состава М2Se, MSe; полиселениды М2Sеn (кроме Li), где n = 2-6; гидроселениды MHSe. Кислородом воздуха окисляются до селена: 2Na2Sen + O2 + 2h3O = 2n Se + 4NaOH
Ионы селена
6+Se 4+Se 2+Se 1+Se 2-Se Se 0
Физические свойства
Монокристаллический селен (99,9999 %)
Твёрдый селен имеет несколько аллотропных модификаций:
- Серый селен (γ-Se, «металлический селен») — наиболее устойчивая модификация с гексагональной кристаллической решёткой;
- Красный кристаллический селен — три моноклинные модификации: оранжево-красный α-Se, тёмно-красный β-Se, красный γ-Se;
- Красный аморфный селен;
- Чёрный стекловидный селен.

При нагревании серого селена он даёт серый же расплав, а при дальнейшем нагревании испаряется с образованием коричневых паров. При резком охлаждении паров селен конденсируется в виде красной аллотропной модификации.
Химические свойства
Селен — аналог серы и проявляет степени окисления −2 (h3Se), +4 (SeO2) и +6 (h3SeO4). Однако, в отличие от серы, соединения селена в степени окисления +6 — сильнейшие окислители, а соединения селена (−2) — гораздо более сильные восстановители, чем соответствующие соединения серы.
Простое вещество селен гораздо менее активно химически, чем сера. Так, в отличие от серы, селен не способен гореть на воздухе самостоятельно. Окислить селен удаётся только при дополнительном нагревании, при котором он медленно горит синим пламенем, превращаясь в двуокись SeO2. Со щелочными металлами селен реагирует (весьма бурно), только будучи расплавленным.
В отличие от SO2, SeO2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (SeO2 + h3O → h3SeO3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO3), получают селеновую кислоту h3SeO4, более сильную, чем серная.
Получить селенистую кислоту (SeO2 + h3O → h3SeO3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO3), получают селеновую кислоту h3SeO4, более сильную, чем серная.
Применение
- Одним из важнейших направлений его технологии, добычи и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль. Эта роль селена постоянно растёт, растёт спрос и цены (отсюда дефицит этого элемента).
В современной технологии полупроводников применяются селениды многих элементов, например селениды олова, свинца, висмута, сурьмы, селениды лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
- Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз).
- Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.

- В медицине, а также в сельском хозяйстве используют микродобавки селена к лекарственным средствам, витаминным препаратам, БАД, и т. п.
Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл, Ливерморская национальная лаборатория им. Лоуренса, Ливермор, США).
Биологическая роль
Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина.
Микроэлемент, но большинство соединений достаточно токсично (селеноводород, селеновая и селенистая кислота) даже в средних концентрациях.
Изотопы
В природе существует 6 изотопов селена (74Se, 76Se, 77Se, 78Se, 80Se и 82Se), из них пять, насколько это известно, стабильны, а один (82Se) испытывает двойной бета-распад с периодом полураспада 9,7×1019 лет. Кроме того, искусственно созданы ещё 24 радиоактивных изотопа (а также 9 метастабильных возбуждённых состояний) в диапазоне массовых чисел от 65 до 94.
Периоды полураспада некоторых радиоактивных изотопов селена:
Изотоп Распространённость в природе, % Период полураспада
| 73Se | — | 7,1 час. |
| 74Se | 0,87 | — |
| 75Se | — | 120,4 сут. |
| 76Se | 9,02 | — |
| 77Se | 7,58 | — |
| 77mSe | — | 17,5 сек. |
| 78Se | 23,52 | — |
| 79Se | — | 6,5·104 лет |
| 79mSe | — | 3,91 мин. |
| 80Se | 49,82 | — |
| 81Se | — | 18,6 мин. |
| 81mSe | — | 62 мин. |
| 82Se | 9,19 | — |
| 83mSe | — | 69 сек. |
| 83Se | — | 25 мин. |
Оптические свойства
| Тип | одноосный (+) |
| Показатели преломления | nω = 3. 000 nε = 4.040 000 nε = 4.040 |
| Максимальное двулучепреломление | δ = 1.040 |
| Оптический рельеф | очень высокий |
| Оптическая анизотропия | очень сильная |
| Цвет в отраженном свете | белый в воздухе, более темный белый до серовато- коричневого в иммерсии, красный напросвет |
| Плеохроизм | видимый от кремово-белого до коричневого |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
Интересные опыты над селеном
Перед тем, как начинать опыты с этим элементом, стоит помнить, что любые соединения с селеном ядовиты, поэтому необходимо принимать все меры безопасности, к примеру, надевать защитные средства и проводить реакции в вытяжном шкафу.
Цвет селена проявляется в ходе приятной глазу реакции. Если через колбу с селенистой кислотой пропустить сернистый газ, который является хорошим восстановителем, то полученный раствор станет желтым, потом оранжевым и в итоге — кроваво-красным.
Слабый раствор даст возможность получить аморфный коллоидный селен. В случае, если концентрация селенистой кислоты будет высокой, то в ходе реакции будет оседать от красного до тёмно-бордового оттенка порошок. Это будет аморфный порошкообразный селен элементарной формы.
Для того, чтобы привести вещество в стеклообразное состояние, необходимо его нагреть и резко охладить. Цвет изменится на черный, а вот красный оттенок можно будет заметить, только если смотреть на просвет.
Кристаллический моноклинный селен получить будет немного сложнее. Для этого нужно взять небольшое количество красного порошка и перемешать с сероуглеродом. К сосуду со смесью необходимо подключить обратный холодильник и кипятить в течение 2 часов. Вскоре начнет образовываться светло-оранжевая жидкость с лёгким зеленым оттенком, которую нужно будет медленно испарить в ёмкости под фильтровальной бумагой.
Наличие селена в организме человека
Наш организм содержит приблизительно 10-14 миллиграммов этого вещества, которое сосредоточено в большей степени в таких органах, как печень, почки, сердце, селезенка, яички и семенные канатики у мужчин, а также в ядрах клеток.
Потребность человеческого организма в таком микроэлементе как селен невысока. Всего 55-70 микрограммов для взрослых. Предельной суточной дозой считается 400 микрограммов. Тем не менее есть болезнь, называемая болезнь Кешана, которая возникает при дефиците этого элемента. Примерно до 60-х годов селен считался ядовитым веществом, которое оказывает негативное воздействие на организм человека. Но после детального исследования были сделаны обратные выводы.
Часто при выявлении патологического содержания селена врачи могут назначать специальные препараты, содержащие комбинацию цинк-селен-магний, вещества, которые в комплексе восполнят недостаточность его в организме. Разумеется, не исключая продукты, которые содержат селен.
Физиологическое действие
Микроэлемент (массовая доля в организме 10–5–10–7%).В организм человека селен поступает с пищей (55–110 мг в год). Концентрируется в печени и почках. При больших дозах в первую очередь накапливается в ногтях и волосах, основу которых составляют серосодержащие аминокислоты. Атомы селена замещают атомы серы:R–S–S_–R + 2Se = R–Se–Se_–R + 2SВ малых количествах селен должен содержаться в пище цыплят, телят, ягнят и кроликов. Селен входит в состав активных центров ферментов: формиатдегидрогеназы, глутатионредуктазы и глутатионпероксидазы, в активном центре которой содержится остаток аминокислоты — селеноцистеина:Селен способен предохранять организм от отравления ртутью и кадмием, так как связывает их. Существует взаимосвязь между высоким содержанием селена в рационе и низкой смертностью от рака.Пары селена ядовиты. ПДК аморфного селена в воздухе 2 мг/м3, SeO2, Na2SeO3 — 0, 1 мг/м3. ПДК селена в воде 0, 01 мг/м3.
Атомы селена замещают атомы серы:R–S–S_–R + 2Se = R–Se–Se_–R + 2SВ малых количествах селен должен содержаться в пище цыплят, телят, ягнят и кроликов. Селен входит в состав активных центров ферментов: формиатдегидрогеназы, глутатионредуктазы и глутатионпероксидазы, в активном центре которой содержится остаток аминокислоты — селеноцистеина:Селен способен предохранять организм от отравления ртутью и кадмием, так как связывает их. Существует взаимосвязь между высоким содержанием селена в рационе и низкой смертностью от рака.Пары селена ядовиты. ПДК аморфного селена в воздухе 2 мг/м3, SeO2, Na2SeO3 — 0, 1 мг/м3. ПДК селена в воде 0, 01 мг/м3.
Общий характер воздействия селена и его соединений
Селен и его соединения ядовиты , по характеру действия несколько напоминает мышьяк; обладает политропным действием с преимущественным поражением печени, почек и ЦНС. Свободный селен менее ядовит. Из неорганических соединений селена наиболее токсичными являются селеноводород, диоксид селена (ЛД50 = 1,5 мг/кг, крысы, интратрахеально) и селениты натрия (ЛД50 = 2,25 мг/кг, кролик, перорально) и лития (ЛД50 = 8,7 мг/кг, крысы, перорально). Особенно токсичен селеноводород, однако, ввиду его отвратительного запаха, ощущаемого даже в ничтожных концентрациях (0,005 мг/л), удаётся избежать отравлений. Органические соединения селена, такие как алкил- или арил-производные (например, диметилселен, метилэтилселен или дифенилселен), являются сильнейшими нервными ядами, с очень отвратительными запахами; так, порог восприятия для диэтилселена составляет 0,0064 мкг/л.
Особенно токсичен селеноводород, однако, ввиду его отвратительного запаха, ощущаемого даже в ничтожных концентрациях (0,005 мг/л), удаётся избежать отравлений. Органические соединения селена, такие как алкил- или арил-производные (например, диметилселен, метилэтилселен или дифенилселен), являются сильнейшими нервными ядами, с очень отвратительными запахами; так, порог восприятия для диэтилселена составляет 0,0064 мкг/л.
Отравление
Приём металлического порошкового селена в количестве 1 грамма перорально вызывает боль в животе в течение двух суток и учащённый стул; со временем симптомы проходят.
Действие на кожу
Соли селена при непосредственном соприкосновении с кожей вызывают ожоги и дерматиты. Диоксид селена при контакте с кожей способен вызывать резкую боль и онемение. При попадании на слизистые оболочки соединения селена могут вызывать раздражение и покраснение, при попадании в глаза резкую боль, слезотечение и конъюнктивит.
Лечение дефицита селена
В основе коррекции гипоселеноза лежит сбалансированная диета и прием селенсодержащих биологических добавок к пище. Из продуктов питания в рацион рекомендуется включать рыбу и морепродукты, мясо домашних животных и птицы, орехи, крупы, брокколи, шпинат, грибы, яйца, молочную продукцию, чеснок. Суточная норма поступления Se составляет 50-70 мкг.
Из продуктов питания в рацион рекомендуется включать рыбу и морепродукты, мясо домашних животных и птицы, орехи, крупы, брокколи, шпинат, грибы, яйца, молочную продукцию, чеснок. Суточная норма поступления Se составляет 50-70 мкг.
Биодобавки селена назначаются в качестве монопрепаратов или (при наличии сопутствующего дефицита других микроэлементов и витаминов) ‒ в виде витаминно-минеральных комплексов. Одним из подходов, призванных ликвидировать селенодефицит в эндемичных районах, является обогащение селеном продуктов питания (поваренной соли, молока, хлеба и др.), питьевой воды.
Топ-10 продуктов питания с высоким содержанием селена
- Рекордсменом по содержанию этого нутриента среди других продуктов питания является бразильский орех. Всего пара его зерен подарят около 50 мкг селена (почти 100% рекомендованной суточной дозы).
- На втором месте расположился желтоперый тунец, порция которого (около 85 г) содержит 92 мкг селена (более 100% рекомендованной суточной дозы).

- В такой же порции филе палтуса (в готовом виде) содержится 47 мкг (67% суточной дозы).
- Баночка консервированных сардин (85 г) скрывает 45 мкг (64% суточной дозы).
- В 85 г говядины находится 33 мкг этого микроэлемента (47% суточной дозы).
- В таком же количестве баранины — около 31 мкг (44%).
- Аналогичная порция говяжьей печени позволяет получить 28 мкг селена (40%).
- В 85 г курицы — 22 мкг (31%).
- Одно большое куриное яйцо дарит человеку 15 мкг (21% суточной дозы) данного вещества.
- В одной чашке шпината найдется 11 мкг селена (16%).
Профилактика рекомендует планировать меню на неделю так, чтобы ежедневно питание включало 2-3 продукта из приведенного выше списка. Это поможет укрепить иммунитет, оптимизировать функцию щитовидной железы, противостоять многим болезням.
Источники
- https://FB.ru/article/225459/selen—chto-eto-takoe-himicheskiy-element-selen-primenenie-selena
- https://nauka.club/khimiya/selen.
 html
html - https://chem.ru/selen.html
- https://mineralpro.ru/minerals/selen/
- https://k-tree.ru/tools/chemistry/periodic.php?element=Se
- http://www.kontren.narod.ru/x_el/info34.htm
- https://dic.academic.ru/dic.nsf/ruwiki/6666
- http://himsnab-spb.ru/article/ps/se/
- https://megabook.ru/article/%D0%A1%D0%B5%D0%BB%D0%B5%D0%BD
- https://wiki2.org/ru/%D0%A1%D0%B5%D0%BB%D0%B5%D0%BD
- https://www.KrasotaiMedicina.ru/diseases/zabolevanija_gastroenterologia/selenium-deficiency
- https://MedAboutMe.ru/articles/profilaktika_defitsita_selena/
Ваша оценка?
Петр Иваныч
Возможно этот человек ответит на ваши вопросы
Задать вопрос
Периодическая таблица элементов: Лос-Аламосская национальная лаборатория
Вернуться к списку элементов
| Атомный номер: | 34 | Атомный радиус: | 190 часов (Ван-дер-Ваальс) |
| Атомный символ: | Se | Температура плавления: | 221 °С |
| Атомный вес: | 78,96 | Температура кипения: | 685 °С |
| Электронная конфигурация: | [Ar]4s 2 3d 10 4p 4 | Степени окисления: | 6 , 5, 4 , 3, 2 , 1,[2] −1, −2 (сильнокислотный оксид) |
История
От греческого слова Селена, луна. Открыт Берцелиусом в 1817 году, который обнаружил, что он связан с теллуром (названным в честь земли).
Открыт Берцелиусом в 1817 году, который обнаружил, что он связан с теллуром (названным в честь земли).
Производство
Селен содержится в нескольких редких минералах, таких как круксит и клаусталит. В прошлые годы его получали из колошниковой пыли, остающейся при переработке сульфидных руд меди, но в настоящее время источником большей части селена в мире является анодный металл с заводов по электролитическому рафинированию меди. Селен извлекают путем обжига ила с содой или серной кислотой или путем плавки с содой и селитрой.
Свойства
Селен существует в нескольких аллотропных формах, хотя общепризнанными являются три. Селен может быть получен как с аморфной, так и с кристаллической структурой. Цвет аморфного селена красный (в виде порошка) или черный (в стекловидном виде). Кристаллический моноклинный селен темно-красного цвета; кристаллический гексагональный селен, наиболее стабильная разновидность, представляет собой металлический серый цвет.
Селен проявляет как фотогальваническое действие, при котором свет непосредственно преобразуется в электричество, так и фотопроводящее действие, при котором электрическое сопротивление уменьшается при увеличении освещенности. Эти свойства делают селен полезным в производстве фотоэлементов и экспонометров для использования в фотографии, а также солнечных элементов. Селен также способен преобразовывать переменный ток. электричество в постоянный ток и широко используется в выпрямителях. Ниже точки плавления селен является полупроводником p-типа и имеет множество применений в электронных и твердотельных приложениях.
Эти свойства делают селен полезным в производстве фотоэлементов и экспонометров для использования в фотографии, а также солнечных элементов. Селен также способен преобразовывать переменный ток. электричество в постоянный ток и широко используется в выпрямителях. Ниже точки плавления селен является полупроводником p-типа и имеет множество применений в электронных и твердотельных приложениях.
Элементарный селен считается практически нетоксичным и считается важным микроэлементом; однако селеноводород и другие соединения селена чрезвычайно токсичны и по своим физиологическим реакциям напоминают мышьяк.
Изотопы
В природе селен содержит шесть стабильных изотопов. Были охарактеризованы пятнадцать других изотопов. Этот элемент является членом семейства серы и напоминает серу как в ее различных формах, так и в ее соединениях.
Применение
Селен используется в ксерографии для воспроизведения и копирования документов, писем и т. д. Он используется в стекольной промышленности для обесцвечивания стекла и изготовления стекол и эмалей рубинового цвета. Он также используется в качестве фотографического тонера и в качестве добавки к нержавеющей стали.
Он также используется в качестве фотографического тонера и в качестве добавки к нержавеющей стали.
Обращение с
Селенид водорода в концентрации 1,5 ppm непереносим для человека. Селен встречается в некоторых твердых телах в количествах, достаточных для того, чтобы оказывать серьезное воздействие на животных, питающихся растениями, такими как локовид, выращиваемый на таких почвах. Воздействие соединений селена (в виде Se) в воздухе не должно превышать 0,2 мг/м 3 (8-часовая средневзвешенная по времени – 40-часовая рабочая неделя).
Селен (Se) – Периодическая таблица (информация об элементе и многое другое)
Это СУПЕР простое руководство по элементу селена.
На самом деле, приведенная ниже таблица представляет собой идеальное информационное окно (которое дает вам все подробности об элементе селена в периодической таблице).
Давайте закончим это очень быстро.
Selenium Element (Se) Information| Appearance | Hexagonal selenium is: Metallic-grey , Monoclinic selenium is: Deep red | |
| State (at STP ) | Solid | |
| Позиция в таблице Менделеева | Группа: 16 , Период: 4, Блок: 7 9 00058 99 | Nonmetals |
| Atomic number or Protons | 34 | |
| Neutrons | 45 | |
| Electrons | 34 | |
| Symbol | Se | |
| Атомная масса | 78,971 u | |
| Расположение электронов or Bohr model | 2, 8, 18, 6 | |
| Electronic configuration | [Ar] 3d 10 4s 2 4p 4 | |
| Atomic RADIUS | 190 Пикометры (Radius Van Der Waals) | |
| Валентные электроны | 6 | |
| 1ST Ионная энергия | 9. 752 eV 752 eV | |
| Electronegativity | 2.55 (Pauling scale) | |
| Crystal structure | HEX (Hexagonal) | |
| Melting point | 494 K or 221 °C or 430 ° F | |
| Точка кипячения | 958 К или 685 ° C или 1265 ° F | |
| Плотность | 4,82 г/см 3 | 0005 | Основной изотоп | 80 Se |
| Кто открыл Селен и когда? | Jöns Jakob Berzelius и Johann Gottlieb Gahn (в 1817 г.) | |
| CAS № | 7482-49-2 |
. Посмотреть единая деталь об элементах из этой единственной интерактивной периодической таблицы.
Посещение ➢ Периодическая таблица
Селена в периодической таблицеЭлемент селена находится в Группа 16 и ПЕРИОД 4 и ПЕРИОД 4 и ПЕРИОД 4 . Селен это p-block элемент и относится к группе Неметаллы – кислородная группа (также известные как халькогены).
Нажмите на элементы выше (в периодической таблице), чтобы увидеть их информацию, или посетите интерактивную периодическую таблицу (в которой показаны названия, символ, атомная масса, конфигурация электронов, расположение электронов и т. д. всех элементов )
д. всех элементов )
Нажмите на элементы выше (в периодической таблице), чтобы увидеть информацию о них
←Перейти к: Элемент мышьяк (As) – Периодическая таблица
→Перейти к: Элемент бром (Br) – Периодическая таблица
Селен является неметаллом.
Верно и то, что селен проявляет некоторые свойства металлоидов.
Но по свойствам металлоидов селен проявляет только 24% свойств металлоидов.
И большинство его свойств сходны со свойствами неметаллов.
Какие свойства проявляет селен?
Несколько металлических свойств:Гексагональный селен серого цвета имеет блестящий металлический вид.
Серый селен блестящий металлик. Он также имеет хорошую электропроводность по сравнению с моноклинным селеном (темно-красного цвета).
(Примечание: Гексагональный селен и моноклинный селен — две разные аллотропные формы селена)
Кроме того, селен может быть вытянут в тонкие нити, когда он расплавлен и вязкий.
Селен является хрупким по своей природе, что свидетельствует о его неметаллических характеристиках.
Если мы видим электропроводность высокоочищенного селена, то она очень меньше (и похожа на таковую у брома).
Селен показывает более высокую электроотрицательность, как и неметаллы.
Также в большинстве химических реакций селен получает электроны, превращаясь в отрицательно заряженные ионы (Se 2-). Это означает, что его химические свойства аналогичны свойствам неметаллов.
Таким образом, большинство химических свойств селена такие же, как у неметаллов.
Следовательно, селен классифицируется как неметалл в периодической таблице.
См. также: Периодическая таблица с металлами, неметаллами и металлоидами (изображение с надписью) .
Почему селен назван в честь Луны? В 1817 году Йонс Якоб Берцелиус предложил название «селен» для недавно открытого элемента.
Но вот вопрос;
Почему он предложил это имя и откуда это имя?
Шведские химики Йонс Якоб Берцелиус и Иоганн Готлиб Ган изучали некоторые химические вещества для получения серной кислоты.
Во время этого исследования они обнаружили какую-то примесь и подумали, что это теллур.
Позже они поняли, что ошибались.
Это был не теллур, но они нашли новый элемент, который был чем-то похож на теллур.
Но теллур был открыт уже за 30 лет до открытия этого нового элемента.
Йонс Якоб Берцелиус предложил название «селен» для этого недавно открытого элемента.
Это название произошло от греческого слова «Селена», что означает «луна».
Ранее открытый элемент (теллур) был назван в честь латинского слова «Tellus», что означает «земля».
Свойства вновь открытого элемента (селена) были аналогичны свойствам теллура.
Так же, как земля и луна, селен и теллур идут рука об руку.
Таким образом, в 1817 году Йонс Якоб Берцелиус предложил название нового элемента как селен на основе греческого слова «Селена», что означает «луна».
Селен находится в группе 16 , потому что он имеет 6 валентных электронов.
Селен находится в периоде 4 , потому что он имеет 4 оболочек или орбит.
Теперь я объясню вам идеальную причину, по которой селен находится в группе 16, почему он находится в периоде 4, а также почему он находится в p-блоке?
Давайте рассмотрим причины по порядку.
Почему селен находится в группе 16?Знаете ли вы, сколько электронов может разместиться на первой оболочке, второй оболочке, третьей оболочке, четвертой оболочке и т. д.?
Вот таблица, показывающая способность орбит удерживать электроны.
Количество электронов в оболочках.
| Орбита/оболочка (n) | Макс. электронов Эта орбита может удерживать электронов Эта орбита может удерживать |
| K Shell, n = 1 | 2 × 1² = 2 |
| L Shell, n = 2 | 2 × 2² = 8 |
| M Shell, n = n = n = 8 | |
| м. 3 | 2 × 3² = 18 |
| Корпус N, n = 4 | 2 × 4² = 32 |
Таким образом,
- 1-я оболочка может содержать 2 электрона.
- 2-я оболочка может содержать 8 электронов.
- 3-я оболочка может содержать 18 электронов.
- 4-я оболочка может содержать 32 электрона.
Теперь атомный номер селена (Se) равен 34 .
Следовательно, элемент селена имеет расположение электронов 2, 8, 18, 6.
Такое расположение электронов указывает на то, что самая внешняя орбита селена (Se) имеет 6 электронов.
Следовательно, он находится в группе 16.
Почему Selenium находится в периоде 4?Позвольте задать вам вопрос.
Сколько оболочек у селена?
Это 4. Верно?
Вы уже видели это в модели бора элемента селена в таблице выше.
Из модели Бора можно найти, что количество орбит или оболочек в атоме селена равно 4.
Следовательно, поскольку селен имеет 4 орбиты, он находится в периоде 4 Периодической таблицы.
См. также: Периодическая таблица с электронами на оболочку (Изображение)
Почему селен находится в p-блоке?Прежде чем узнать эту причину, прежде всего простой вопрос к вам.
Как определить расположение элементов по блокам?
Простой ответ: Элементы будут лежать в блоках s, p, d или f, это будет полностью зависеть от подоболочки, в которую войдет последний электрон.
Например;
Электронная конфигурация селена [Ar] 3d 10 4s 2 4p 4 .
Итак, последний электрон селена попадает на p-подоболочку или p-орбиталь.
Следовательно, селен является элементом р-блока.
Интересные факты о селенеНиже приведены интересные факты об элементе селен.
- Йонс Якоб Берцелиус предложил название нового элемента как селен на основе греческого слова «Селена», что означает «луна».
- Селен является неметаллом и имеет различные цвета и кристаллическую структуру (как и большинство неметаллов). Например, гексагональный селен имеет металлический серый цвет, а моноклинный селен имеет темно-красный цвет.
- Ежегодно во всем мире извлекается 2000 тонн элемента селена.
- Александр Грэм Белл использовал селен в 1879 году для изготовления фотофона.
- Большая часть селена производится в Германии, а большая часть селена потребляется в Китае для промышленных целей. (Источник)
- Около 50% произведенного селена используется в производстве стекла.
Позвольте мне рассказать вам, как эта Интерактивная таблица Менделеева поможет вам в учебе.
