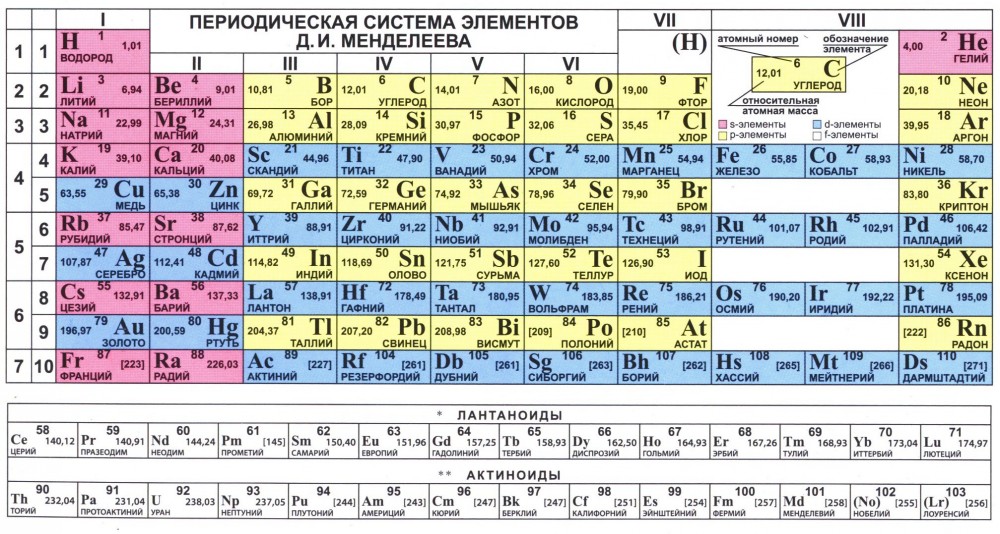
Таблица Менделеева online – Sr
Sr
38
2
8
18
8
2
87,62±1
5s2
Стронций
| Относительная электроотрицательность (по Полингу): | 0,99 |
| Температура плавления: | 660,37°C |
| Температура кипения: | 2519°C |
| Теплопроводность: | 221 |
| Плотность: | 2,702 г/см3 |
| Открыт: | Ганс Кристиан Эрстед |
| Цвет в твёрдом состоянии: | Серебристый |
| Тип: | Металл |
| Орбитали: | 1s22s22p63s23p1 |
| Электронная формула: |
Sr – 1s2 2s2 2p6 3s2 3p6 4s2 3d Sr – [Kr] 5s2 |
| Валентность: | +2 |
| Степени окисления: | 0, + II |
| Сверхпроводящее состояние при температуре: | 1,175 К |
| Потенциалы ионизации: | 5,986 В 18,828 В 28,447 В |
Электропроводность в тв. фазе: фазе: |
38,2*106 при 273K |
| Ковалентный радиус: | 1,18 Å |
| Атомный объем: | 10 см3/моль |
| Атомный радиус: | 1,82 Å |
| Теплота распада: | 10,79 КДж/моль |
| Теплота парообразования: | 293,4 КДж/моль |
| Кристаллическая структура: | Гранецентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре каждой грани |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
полураспада (T1/2) |
Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 73Sr | 38 | 35 | 72,96597 | 25 мс | 1/2- |
| 74Sr | 38 | 36 | 73,95631 | 50 мс | 0+ |
| 75Sr | 38 | 37 | 74,94995 | 88 мс | 3/2- |
| 76Sr | 38 | 38 | 75,94177 | 0+ | |
| 77Sr | 38 | 39 | 76,937945 | 9,0 с | 5/2+ |
| 78Sr | 38 | 40 | 77,932180 | 159 с | 0+ |
| 79Sr | 38 | 41 | 78,929708 | 2,25 мин | 3/2- |
| 80Sr | 38 | 42 | 79,924521 | 106,3 мин | 0+ |
| 81Sr | 38 | 43 | 80,923212 | 22,3 мин | |
| 82Sr | 38 | 44 | 81,918402 | 25,36 сут | 0+ |
| 83Sr | 38 | 45 | 82,917557 | 32,41 ч | 7/2+ |
| 83mSr | 259,15 кэВ | 4,95 с | 1/2- | ||
| 84Sr | 38 | 46 | 83,913425 | стабилен | 0+ |
| 85Sr | 38 | 47 | 84,912933 | 64,853 сут | 9/2+ |
| 85mSr | 67,63 мин | 1/2- | |||
| 86Sr | 38 | 48 | 85,9092602 | стабилен | 0+ |
| 86mSr | 2,95568 МэВ | 455 нс | 8+ | ||
| 87Sr | 38 | 49 | 86,9088771 | стабилен | 9/2+ |
| 87mSr | 388,533 кэВ | 2,815 ч | 1/2- | ||
| 88Sr | 38 | 50 | 87,9056121 | стабилен | 0+ |
| 89 |
38 | 51 | 88,9074507 | 50,57 сут | 5/2+ |
| 90Sr | 38 | 52 | 89,907738 | 28,90 лет | 0+ |
| 91Sr | 38 | 53 | 90,910203 | 9,63 ч | 5/2+ |
| 92Sr | 38 | 54 | 91,911038 | 2,66 ч | 0+ |
| 93Sr | 38 | 55 | 92,914026 | 7,423 мин | 5/2+ |
| 94Sr | 38 | 93,915361 | 75,3 с | 0+ | |
| 95Sr | 38 | 57 | 94,919359 | 23,90 с | 1/2+ |
| 96Sr | 38 | 58 | 95,921697 | 1,07 с | 0+ |
| 97Sr | 38 | 59 | 96,926153 | 429 мс | 1/2+ |
| 97m1Sr | 308,13 кэВ | 170 нс | 7/2+ | ||
| 97m2Sr | 830,8 кэВ | 11/2- | |||
| 98Sr | 38 | 60 | 97,928453 | 653 мс | 0+ |
| 99Sr | 38 | 61 | 98,93324 | 269 мс | 3/2+ |
| 100Sr | 38 | 62 | 99,93535 | 202 мс | 0+ |
| 101Sr | 38 | 63 | 100,94052 | 118 мс | 5/2- |
| 102Sr | 38 | 64 | 101,94302 | 69 мс | 0+ |
| 103Sr | 38 | 65 | 102,94895 | 50 мс | |
| 104Sr | 38 | 66 | 103,95233 | 30 мс | 0+ |
| 105Sr | 38 | 67 | 104,95858 | 20 мс | |
Стронций
|
Стронций |
|
|---|---|
| Атомный номер |
38 |
| Внешний вид простого вещества |
ковкий, серебристо-белый металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
87,62 а. |
| Радиус атома |
215 пм |
|
Энергия ионизации (первый электрон) |
549,0 (5,69) кДж/моль (эВ) |
| Электронная конфигурация |
[Kr] 5s2 |
| Химические свойства | |
| Ковалентный радиус |
191 пм |
| Радиус иона |
(+2e) 112 пм |
|
Электроотрицательность (по Полингу) |
0,95 |
| Электродный потенциал |
0 |
| Степени окисления |
2 |
| Термодинамические свойства простого вещества | |
| Плотность |
2,54 г/см³ |
| Молярная теплоёмкость |
26,79 Дж/(K·моль) |
| Теплопроводность |
(35,4) Вт/(м·K) |
| Температура плавления |
1 042 K |
| Теплота плавления |
9,20 кДж/моль |
| Температура кипения |
1657 K |
| Теплота испарения |
144 кДж/моль |
| Молярный объём |
33,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая гранецентрированая |
| Параметры решётки |
6,080 Å |
| Отношение c/a | — |
| Температура Дебая |
147 K |
| Sr | 38 |
| 87,62 | |
| [Kr]5s2 | |
| Стронций | |
Стронций — элемент главной подгруппы второй группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 38. Обозначается символом Sr (лат. Strontium). Простое вещество стронций (CAS-номер: 7440-24-6) — мягкий, ковкий и пластичный щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью, на воздухе быстро реагирует с влагой и кислородом, покрываясь жёлтой оксидной плёнкой.
И. Менделеева, с атомным номером 38. Обозначается символом Sr (лат. Strontium). Простое вещество стронций (CAS-номер: 7440-24-6) — мягкий, ковкий и пластичный щёлочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью, на воздухе быстро реагирует с влагой и кислородом, покрываясь жёлтой оксидной плёнкой.
История и происхождение названия
Новый элемент обнаружили в минерале стронцианите, найденном в 1764 году в свинцовом руднике близ шотландской деревни Строншиан, давшей впоследствии название новому элементу. Присутствие в этом минерале оксида нового металла было установлено почти через 30 лет Уильямом Крюйкшенком и Адером Кроуфордом. Выделен в чистом виде сэром Хемфри Дэви в 1808 году.
Присутствие в природе
Содержание в земной коре — 0,384 % в свободном виде стронций не встречается. Он входит в состав около 40 минералов. Из них наиболее важный — целестин SrSO4. Добывают также стронцианит SrCO3. Эти два минерала имеют промышленное значение.
Эти два минерала имеют промышленное значение.
Стронций содержится в морской воде (0,1 мг/л), в почвах (0,035 масс%).
В природе стронций встречается в виде смеси 4 стабильных изотопов 84Sr (0,56 %), 86Sr (9,86 %), 87Sr (7,02 %), 88Sr (82,56 %).
Получение Стронция
Три способа получения металлического стронция:
— термическое разложение некоторых соединений
— электролиз
— восстановление оксида или хлорида
Основным промышленным способом получения металлического стронция является термическое восстановление его оксида алюминием. Далее полученный стронций очищается возгонкой.
Электролитическое получение стронция электролизом расплава смеси SrCl2 и NaCl не получило широкого распространения из-за малого выхода по току и загрязнения стронция примесями.
При термическом разложении гидрида или нитрида стронция образуется мелкодисперсный стронций, склонный к легкому воспламенению.
Физические свойства
Стронций — мягкий серебристо-белый металл, обладает ковкостью и пластичностью, легко режется ножом.
Полиморфен — известны три его модификации. До 215оС устойчива кубическая гранецентрированная модификация (α-Sr), между 215 и 605оС — гексагональная (β-Sr), выше 605оС — кубическая объемно-центрированная модификация (γ-Sr).
Температура плавления — 768оС, Температура кипения — 1390оС.
Химические свойства
Стронций в своих соединениях всегда проявляет валентность +2. По свойствам стронций близок к кальцию и барию, занимая промежуточное положение между ними.
В электрохимическом ряду напряжений стронций находится среди наиболее активных металлов (его нормальный электродный потенциал равен −2,89 В. Энергично реагирует с водой, образуя гидроксид:
- Sr + 2H2O = Sr(OH)2 + H2↑
Взаимодействует с кислотами, вытесняет тяжелые металлы из их солей. С концентрированными кислотами (H2SO4, HNO3) реагирует слабо.
С концентрированными кислотами (H2SO4, HNO3) реагирует слабо.
Металлический стронций быстро окисляется на воздухе, образуя желтоватую плёнку, в которой помимо оксида SrO всегда присутствуют пероксид SrO2 и нитрид Sr3N2. При нагревании на воздухе загорается, порошкообразный стронций на воздухе склонен к самовоспламенению.
Энергично реагирует с неметаллами — серой, фосфором, галогенами. Взаимодействует с водородом (выше 200оС), азотом (выше 400оС). Практически не реагирует с щелочами.
При высоких температурах реагирует с CO2, образуя карбид:
- 5Sr + 2CO2 = SrC2 + 4SrO
Легкорастворимы соли стронция с анионами Cl–, I–, NO3–. Соли с анионами F–, SO42-, CO32-, PO43- малорастворимы.
Применение
Основные области применения стронция и его химических соединений — это радиоэлектронная промышленность, пиротехника, металлургия, пищевая промышленность.
Металлургия
Стронций применяется для легирования меди и некоторых ее сплавов, для введения в аккумуляторные свинцовые сплавы, для обессеривания чугуна, меди и сталей.
Металлотермия
Стронций чистотой 99,99—99,999 % применяется для восстановления урана.
Магнитные материалы
Магнитотвердые ферриты стронция — широкоупотребительные материалы для производства постоянных магнитов.
Пиротехника
В пиротехнике применяются карбонат, нитрат, перхлорат стронция для окрашивания пламени в кирпично-красный цвет. Сплав магний-стронций обладает сильнейшими пирофорными свойствами и находит применение в пиротехнике для зажигательных и сигнальных составов.
Изотопы
Радиоактивный 90Sr (период полураспада 28,9 лет) применяется в производстве радиоизотопных источников тока в виде титаната стронция (плотность 4,8 г/см³, а энерговыделение около 0,54 Вт/см³).
Атомноводородная энергетика
Уранат стронция играет важную роль при получении водорода (стронций-уранатный цикл, Лос-Аламос, США) термохимическим способом (атомно-водородная энергетика), и в частности разрабатываются способы непосредственного деления ядер урана в составе ураната стронция для получения тепла при разложении воды на водород и кислород.
Высокотемпературная сверхпроводимость
Оксид стронция применяется в качестве компонента сверхпроводящих керамик.
Химические источники тока
Фторид стронция используется в качестве компонента твердотельных фторионных аккумуляторных батарей с громадной энергоемкостью и энергоплотностью.
Сплавы стронция с оловом и свинцом применяются для отливки токоотводов аккумуляторных батарей. Сплавы стронций-кадмий для анодов гальванических элементов.
Биологическая роль
Влияние на организм человека
Не следует путать действие на организм человека природного (нерадиоактивного, малотоксичного и более того, широко используемого для лечения остеопороза) и радиоактивных изотопов стронция. Изотоп стронция 90Sr является радиоактивным с периодом полураспада 28.9 лет. 90Sr претерпевает β-распад, переходя в радиоактивный 90Y (период полураспада 64 ч.) Полный распад стронция-90, попавшего в окружающую среду, произойдет лишь через несколько сотен лет. 90Sr образуется при ядерных взрывах и выбросах с АЭС. По химическим реакциям радиоактивный и нерадиоактивные изотопы стронция практически не отличаются. Стронций природный — составная часть микроорганизмов, растений и животных. Независимо от пути и ритма поступления в организм растворимые соединения стронция накапливаются в скелете. В мягких тканях задерживается менее 1 %. Путь поступления влияет на величину отложения стронция в скелете. На поведение стронция в организме оказывает влияние вид, пол, возраст, а также беременность, и другие факторы. Например, в скелете мужчин отложения выше, чем в скелете женщин. Стронций является аналогом кальция. Стронций с большой скоростью накапливается в организме детей до четырехлетнего возраста, когда идет активное формирование костной ткани.
Изотоп стронция 90Sr является радиоактивным с периодом полураспада 28.9 лет. 90Sr претерпевает β-распад, переходя в радиоактивный 90Y (период полураспада 64 ч.) Полный распад стронция-90, попавшего в окружающую среду, произойдет лишь через несколько сотен лет. 90Sr образуется при ядерных взрывах и выбросах с АЭС. По химическим реакциям радиоактивный и нерадиоактивные изотопы стронция практически не отличаются. Стронций природный — составная часть микроорганизмов, растений и животных. Независимо от пути и ритма поступления в организм растворимые соединения стронция накапливаются в скелете. В мягких тканях задерживается менее 1 %. Путь поступления влияет на величину отложения стронция в скелете. На поведение стронция в организме оказывает влияние вид, пол, возраст, а также беременность, и другие факторы. Например, в скелете мужчин отложения выше, чем в скелете женщин. Стронций является аналогом кальция. Стронций с большой скоростью накапливается в организме детей до четырехлетнего возраста, когда идет активное формирование костной ткани. Обмен стронция изменяется при некоторых заболеваниях органов пищеварения и сердечно-сосудистой системы. Пути попадания:
Обмен стронция изменяется при некоторых заболеваниях органов пищеварения и сердечно-сосудистой системы. Пути попадания:
- вода (предельно допустимая концентрация стронция в воде в РФ — 8 мг/л, а в США — 4 мг/л)
- пища (томаты, свёкла, укроп, петрушка, редька, редис, лук, капуста, ячмень, рожь, пшеница)
- интратрахеальное поступление
- через кожу (накожное)
- ингаляционное (через воздух)
- из растений или через животных стронций-90 может непосредственно перейти в организм человека.
-
люди работа которых связана со стронцием (в медицине радиоактивный стронций используют в качестве аппликаторов при лечении кожных и глазных болезней. Основные области применения природного стронция — это радиоэлектронная промышленность, пиротехника, металлургия, металлотермия, пищевая промышленность, пр-во магнитных материалов, радиоактивного — пр-во атомных электрических батарей.
 атомно-водородная энергетика, радиоизотопные термоэлектрические генераторы и др.)
атомно-водородная энергетика, радиоизотопные термоэлектрические генераторы и др.)
Влияние нерадиоактивного стронция проявляется крайне редко и только при воздействии других факторов (дефицит кальция и витамина Д, неполноценное питание, нарушения соотношения микроэлементов таких как барий, молибден, селен и др.). Тогда он может вызывать у детей «стронциевый рахит» и «уровскую болезнь» — поражение и деформация суставов, задержка роста и другие нарушения Напротив, радиоактивный стронций практически всегда негативно воздействует на организм человека:
- откладывается в скелете (костях), поражает костную ткань и костный мозг, что приводит к развитию лучевой болезни, опухолей кроветворной ткани и костей.
- вызывает лейкемию и злокачественные опухоли (рак) костей, а также поражение печени и мозга
Изотопы
-
Изотопы стронция
Стронций-90
-
Стронций-90
Изотоп стронция 90Sr является радиоактивным с периодом полураспада 28,79 лет. 90Sr претерпевает β-распад, переходя в радиоактивный иттрий 90Y (период полураспада 64 часа). 90Sr образуется при ядерных взрывах и выбросах с АЭС.
90Sr претерпевает β-распад, переходя в радиоактивный иттрий 90Y (период полураспада 64 часа). 90Sr образуется при ядерных взрывах и выбросах с АЭС.
Стронций является аналогом кальция и способен прочно откладываться в костях. Длительное радиационное воздействие 90Sr и 90Y поражает костную ткань и костный мозг, что приводит к развитию лучевой болезни, опухолей кроветворной ткани и костей.
стронций | химический элемент | Британика
стронций
См. все СМИ
- Связанные темы:
- химический элемент щелочноземельный металл стронций-90
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
стронций (Sr) , химический элемент, один из щелочноземельных металлов группы 2 (IIa) периодической таблицы. Он используется в качестве ингредиента в красных сигнальных ракетах и люминофорах и представляет собой основную опасность для здоровья при радиоактивных осадках.
| atomic number | 38 |
|---|---|
| atomic weight | 87.62 |
| melting point | 769 °C (1,416 °F) |
| boiling point | 1,384 ° C (2523 °F) |
| удельный вес | 2,63 |
| степень окисления | +2 |
| электронная конфигурация Kr 90 6 0 [0]0068 2 |
Возникновение, свойства и использование
Стронций — мягкий металл, похожий на свинец, и в свежем виде имеет серебристый блеск. Он быстро реагирует на воздухе, приобретая желтоватый цвет; следовательно, он должен быть защищен от кислорода для хранения. В природе бесплатно не встречается. Хотя он широко распространен вместе с кальцием, есть только две основные руды только стронция: целестин (SrSO 4 ) и стронцианит (SrCO 3 9). 0080 ).
0080 ).
Минерал из свинцового рудника недалеко от деревни Стронтиан в Аргайл, Шотландия, первоначально был ошибочно идентифицирован как тип карбоната бария, но Адэр Кроуфорд и Уильям Круикшенк в 1789 году отметили, что это, вероятно, другое вещество. Химик Томас Чарльз Хоуп назвал новый минерал стронтитами в честь деревни, а соответствующую «землю» (оксид стронция, SrO) соответственно назвали стронцием. Металл был выделен (1808 г.) сэром Хамфри Дэви, который провел электролиз смеси влажного гидроксида или хлорида с оксидом ртути с использованием ртутного катода, а затем выпарил ртуть из полученной амальгамы. Он использовал основу слова стронция для формирования названия элемента.
Его космическое содержание оценивается в 18,9 атомов (по шкале, где содержание кремния = 10 6 атомов). Он составляет около 0,04 процента земной коры. Наиболее важным коммерческим источником стронция является целестин; более двух третей мировых поставок приходится на Китай, а Испания и Мексика поставляют большую часть остатка. Стронций в виде стержней может быть получен контактно-катодным методом электролиза, при котором охлажденный железный стержень, действующий как катод, едва касается поверхности расплавленной смеси хлоридов калия и стронция и приподнимается по мере затвердевания стронция на Это. Металлический стронций можно также получить восстановлением оксида алюминием. Этот металл податлив и пластичен, он хорошо проводит электричество, но элементарный стронций используется относительно редко. Один из них используется в качестве легирующей добавки для алюминия или магния в литых блоках двигателей и колесах; стронций улучшает обрабатываемость и сопротивление ползучести металла.
Стронций в виде стержней может быть получен контактно-катодным методом электролиза, при котором охлажденный железный стержень, действующий как катод, едва касается поверхности расплавленной смеси хлоридов калия и стронция и приподнимается по мере затвердевания стронция на Это. Металлический стронций можно также получить восстановлением оксида алюминием. Этот металл податлив и пластичен, он хорошо проводит электричество, но элементарный стронций используется относительно редко. Один из них используется в качестве легирующей добавки для алюминия или магния в литых блоках двигателей и колесах; стронций улучшает обрабатываемость и сопротивление ползучести металла.
Встречающийся в природе стронций представляет собой смесь четырех стабильных изотопов: стронций-88 (82,6%), стронций-86 (9,9%), стронций-87 (7,0%) и стронций-84 (0,56%). В зависимости от местоположения соотношение стронция-87 и стронция-86 может различаться более чем в 5 раз. Это изменение используется при датировании геологических образцов и при определении происхождения скелетов и глиняных артефактов. В результате ядерных реакций было получено около 16 синтетических радиоактивных изотопов, из которых самым долгоживущим является стронций-9.0 (период полураспада 28,9 года). Этот изотоп, образующийся при ядерных взрывах, считается наиболее опасным компонентом радиоактивных осадков. Из-за своего химического сходства с кальцием он усваивается костями и зубами, где продолжает выбрасывать электроны, вызывающие радиационное поражение, повреждая костный мозг, нарушая процесс образования новых клеток крови и, возможно, вызывая рак. Однако в контролируемых условиях он использовался для лечения некоторых поверхностных видов рака и рака костей. Он также используется в качестве источника в толщиномерах и в радиоизотопных термоэлектрических генераторах, где теплота его радиоактивного распада преобразуется в электричество для долгоживущих и легких источников энергии в навигационных буях, удаленных метеорологических станциях и космических кораблях. Стронций-89используется при лечении рака костей, поскольку воздействует на костные ткани, доставляет бета-излучение, а затем распадается в течение нескольких месяцев (период полураспада 51 день).
В результате ядерных реакций было получено около 16 синтетических радиоактивных изотопов, из которых самым долгоживущим является стронций-9.0 (период полураспада 28,9 года). Этот изотоп, образующийся при ядерных взрывах, считается наиболее опасным компонентом радиоактивных осадков. Из-за своего химического сходства с кальцием он усваивается костями и зубами, где продолжает выбрасывать электроны, вызывающие радиационное поражение, повреждая костный мозг, нарушая процесс образования новых клеток крови и, возможно, вызывая рак. Однако в контролируемых условиях он использовался для лечения некоторых поверхностных видов рака и рака костей. Он также используется в качестве источника в толщиномерах и в радиоизотопных термоэлектрических генераторах, где теплота его радиоактивного распада преобразуется в электричество для долгоживущих и легких источников энергии в навигационных буях, удаленных метеорологических станциях и космических кораблях. Стронций-89используется при лечении рака костей, поскольку воздействует на костные ткани, доставляет бета-излучение, а затем распадается в течение нескольких месяцев (период полураспада 51 день).
Стронций не является важным элементом для высших форм жизни, и его соли, как правило, нетоксичны. То же свойство «поиска костей», которое делает стронций-90 опасным, успешно используется в добавках стронция для увеличения плотности и роста костей.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Соединения
В целом химический состав стронция очень похож на химический состав кальция. В своих соединениях стронций имеет исключительную степень окисления +2, как ион Sr 2+ . Металл является активным восстановителем и легко реагирует с галогенами, кислородом и серой с образованием галогенидов, оксидов и сульфидов.
Соединения стронция имеют довольно ограниченную коммерческую ценность, поскольку соответствующие соединения кальция и бария обычно служат той же цели, но дешевле. Однако некоторые из них нашли применение в промышленности и других местах. В настоящее время нет замены ярко-малиновому цвету солей стронция, таких как нитрат стронция, Sr(NO 3 ) 2 и хлорат стронция, Sr(ClO 3 ) 2 , в фейерверках, сигнальных ракетах и трассирующих боеприпасах. Около 5-10% всего производства Стронция расходуется на пиротехнику. Гидроксид стронция, Sr(OH) 2 , иногда используется для извлечения сахара из мелассы, поскольку он образует растворимый сахарид, из которого сахар может быть легко регенерирован под действием двуокиси углерода. Моносульфид стронция, SrS, используется в качестве средства для удаления волос и в качестве компонента люминофоров для электролюминесцентных устройств и светящихся красок.
Около 5-10% всего производства Стронция расходуется на пиротехнику. Гидроксид стронция, Sr(OH) 2 , иногда используется для извлечения сахара из мелассы, поскольку он образует растворимый сахарид, из которого сахар может быть легко регенерирован под действием двуокиси углерода. Моносульфид стронция, SrS, используется в качестве средства для удаления волос и в качестве компонента люминофоров для электролюминесцентных устройств и светящихся красок.
Ферриты стронция включают семейство соединений общей формулы SrFe x O y , образующихся в результате высокотемпературной (1000–1300 °C, или 1800–2400 °F) реакции между SrCO 3
Стронций
Зона данных | Открытие | Факты | Внешний вид и характеристики | Использование | Изобилие и изотопы | Ссылки
38
Sr
87. 62
62
Химический элемент стронций относится к щелочноземельным металлам. Он был открыт в 1790 году Адэром Кроуфордом.
Зона данных
| Классификация: | Стронций – щелочноземельный металл |
| Цвет: | серебристый |
| Атомный вес: | 87,62 |
| Состояние: | твердый |
| Температура плавления: | 777 или С, 1050 К |
| Точка кипения: | 1380 или С, 1653 К |
| Электроны: | 38 |
| Протоны: | 38 |
| Нейтроны в наиболее распространенном изотопе: | 50 |
| Электронные оболочки: | 2,8,18,8,2 |
| Электронная конфигурация: | [Кр] 5 с 2 |
| Плотность @ 20 или C: | 2,6 г/см 3 |
Реакции, Соединения, Радиусы, Проводимости”>Показать больше, в том числе: Теплота, Энергия, Окисление,
Реакции, Соединения, Радиусы, Проводимости
| Атомный объем: | 33,7 см 3 /моль |
| Структура: | ccp: плотно упакованный кубический |
| Твердость: | 1,5 месяца |
| Удельная теплоемкость | 0,30 Дж г -1 К -1 |
| Теплота плавления | 8,30 кДж моль -1 |
| Теплота распыления | 164 кДж моль -1 |
| Теплота парообразования | 144,0 кДж моль -1 |
| 1 ст энергия ионизации | 549,5 кДж моль -1 |
| 2 nd энергия ионизации | 1064,2 кДж моль -1 |
| 3 rd энергия ионизации | 4138 кДж моль -1 |
| Сродство к электрону | 5 кДж моль -1 |
| Минимальная степень окисления | 0 |
Мин. общее окисление нет. общее окисление нет. | 0 |
| Максимальная степень окисления | 2 |
| Макс. общее окисление нет. | 2 |
| Электроотрицательность (шкала Полинга) | 0,95 |
| Объем поляризуемости | 27,6 Å 3 |
| Реакция с воздухом | энергичный, ⇒ SrO, Sr 2 N 3 |
| Реакция с 15 M HNO 3 | энергичный, ⇒ H 2 , Sr(NO 3 ) 2 |
| Реакция с 6 М HCl | энергичный, ⇒ H 2 , SrCl 2 |
| Реакция с 6 М раствором NaOH | энергичный, ⇒ нет |
| Оксид(ы) | SrO, SrO 2 (пероксид стронция) |
| Гидрид(ы) | SrH 2 |
| Хлориды | SrCl 2 |
| Атомный радиус | 200 часов |
| Ионный радиус (1+ ион) | – |
| Ионный радиус (2+ ион) | 132 вечера |
| Ионный радиус (3+ ион) | – |
| Ионный радиус (1-ион) | – |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 35,4 Вт·м -1 К -1 |
| Электропроводность | 5 x 10 6 S m -1 |
| Температура замерзания/плавления: | 777 или С, 1050 К |
Стронций. Фото Матиаса Цеппера.
Фото Матиаса Цеппера.
Открытие стронция
Доктор Дуг Стюарт
Стронций был признан новым элементом в 1790, когда Адэр Кроуфорд проанализировал образец минерала из свинцовой шахты недалеко от Стронтиана, Шотландия. До этого ученые считали стронций и барий одним и тем же элементом, и признавали существование только бария.
Минерал получил свое название от шотландского города и назывался стронцианит (карбонат стронция).
Металлический стронций был впервые выделен в 1808 году сэром Хамфри Дэви, работавшим в Лондоне, с помощью электролиза.
Дэви построил очень большую батарею из 600 пластин, которую он использовал для пропускания электричества через соли, разрушая их для выделения новых элементов.
Он смешал оксид магния в пасту с (вероятно) сульфатом стронция. Он сделал углубление в пасте и поместил туда металлическую ртуть, которая служила электродом. В качестве противоэлектрода использовалась платина.
При пропускании через пасту электричества на ртутном электроде образовывалась амальгама стронция и ртути.
Дэви удалил ртуть из амальгамы, нагрев ее, чтобы остался металлический стронций. (1), (2) .
Дэви назвал этот элемент стронцием в честь минерала, из которого он был получен.
Дэви впервые открыл или выделил несколько щелочных и щелочноземельных металлов, включая калий, натрий, барий, кальций и магний.
Нитрат стронция окрашивает пиротехнические устройства в красный цвет. Стронций является источником красного цвета.
Металлический стронций горит на воздухе характерным красным пламенем, образуя смесь оксида и нитрида стронция.
Самые точные в мире атомные часы, основанные на атомах стронция, не будут ни отставать, ни отставать ни на секунду за более чем 200 миллионов лет.
Внешний вид и характеристики
Вредное воздействие:
Нерадиоактивные изотопы стронция считаются нетоксичными.
Характеристики:
Стронций — мягкий серебристый металл. На разрезе быстро приобретает желтоватый цвет из-за образования оксида стронция (стронция, SrO). Мелкодисперсный металлический стронций достаточно реактивен, чтобы самовозгораться на воздухе.
Он быстро реагирует с водой (но не бурно, как металлы группы 1) с образованием гидроксида стронция и газообразного водорода.
Стронций и его соединения горят малиновым пламенем и используются в фейерверках.
Соседство стронция в периодической таблице
Стронций является щелочноземельным металлом группы 2. Обычно он существует в виде двухвалентного иона Sr 2+ в своих соединениях. Химический состав стронция очень похож на химический состав кальция, который находится над ним в группе 2.
Использование стронция
Стронций используется для производства стекла (электронно-лучевых трубок) для цветных телевизоров. Он также используется в производстве ферритовых керамических магнитов и при рафинировании цинка.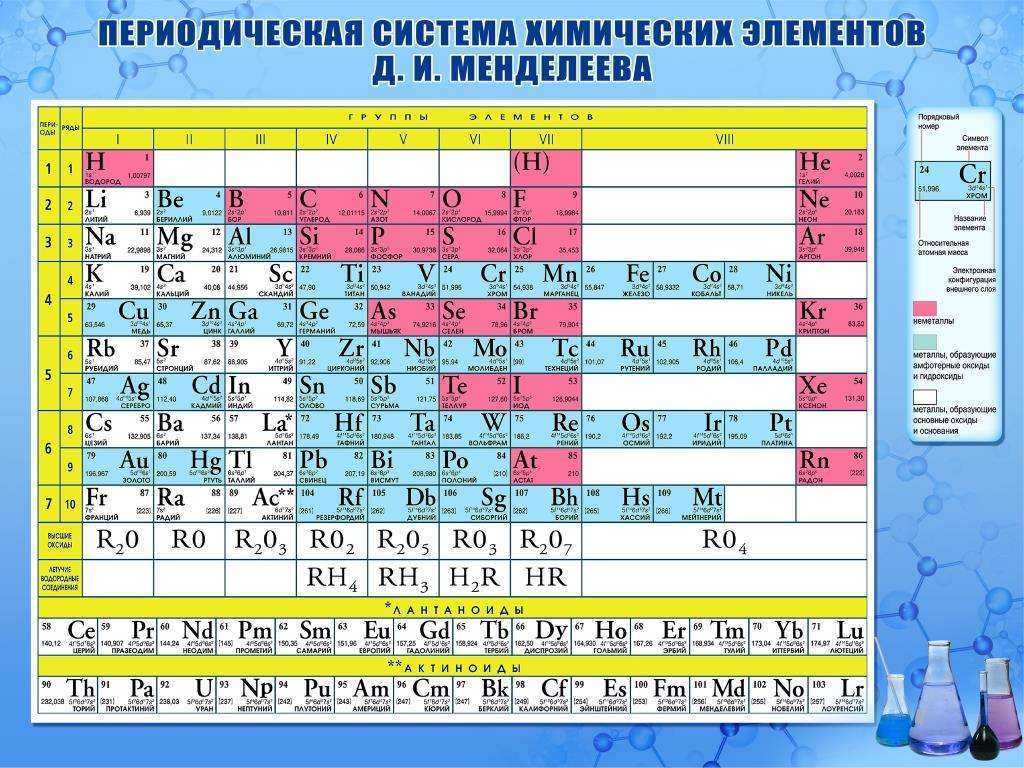
Самые точные в мире атомные часы с точностью до одной секунды за 200 миллионов лет были разработаны с использованием атомов стронция.
Соли стронция используются в ракетах и фейерверках для получения малинового цвета.
Хлорид стронция используется в зубной пасте для чувствительных зубов.
Оксид стронция используется для улучшения качества керамических глазурей.
Изотоп 90 Sr является одним из лучших известных долгоживущих бета-излучателей высокой энергии. Он используется в терапии рака.
Изобилие и изотопы
Изобилие в земной коре: 370 частей на миллион по весу, 87 частей на миллион по молям
Изобилие в Солнечной системе: 50 частей на миллиард по весу, 0,7 частей на миллиард по молям
Стоимость, чистая: 100 долларов за 100 г
Стоимость, объем: $ за 100 г
Источник: Стронций никогда не встречается в природе в свободном виде. Основными стронциевыми рудами являются целестин (сульфат стронция, SrSO 4 ) и стронцианит (карбонат стронция, SrCO 3 ). Основным промышленным процессом производства металлического стронция является восстановление оксида стронция алюминием.
Основным промышленным процессом производства металлического стронция является восстановление оксида стронция алюминием.
Изотопы: Стронций имеет 28 изотопов с известными периодами полураспада с массовыми числами от 75 до 102. Встречающийся в природе стронций представляет собой смесь своих четырех стабильных изотопов, и они находятся в указанных процентах: 84 Sr (0,6%) , 86 Sr (9,9%), 87 Sr (7,0%) и 88 Sr (82,6%).
Каталожные номера
- Мэри Эльвира Уикс, Открытие элементов. , Журнал химического образования (июнь 1932 г.), стр. 1046.
- Т. К. Кеньон, Наука и знаменитости: восходящая звезда Хамфри Дэви, журнал Chemical Heritage (выпуск 2008/9).
Процитировать эту страницу
Для онлайн-ссылки скопируйте и вставьте одно из следующего:
Strontium
или

 е. м. (г/моль)
е. м. (г/моль)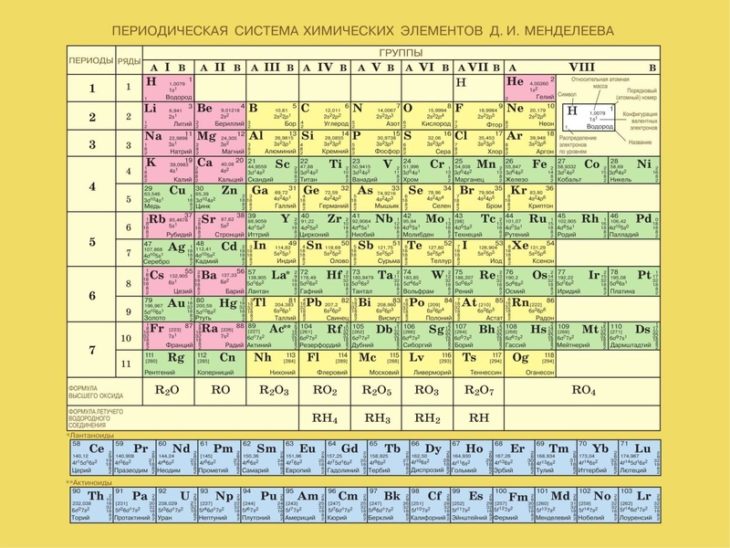 атомно-водородная энергетика, радиоизотопные термоэлектрические генераторы и др.)
атомно-водородная энергетика, радиоизотопные термоэлектрические генераторы и др.)