Сколько таблиц химических элементов существует на самом деле?
В 1869 году Дмитрий Менделеев представил коллегам из Русского химического общества совершенно новую версию периодической таблицы элементов. С того самого момента прошло 150 лет. Но Дмитрий Иванович не единственный, кто сумел организовать элементы таким образом, чтобы они показали всю сложность устройства мироздания и материи. Большое количество исследователей со всего мира пробовали свои силы в классификации и организации 63 элементов, известных на тот момент. Напомним, что на сегодняшний день обнаружено по крайней мере 118 элементов, включая попытки переставить их в самые странные и необычные таблицы. Из этой статьи вы узнаете, насколько необычной может предстать перед нами всем знакомая и привычная таблица.
Перед вами классификация химических элементов, устанавливающая зависимость различных свойств элементов от их заряда атомного ядра.
Напомним, что таблица химических элементов Дмитрия Ивановича Менделеева представлена в виде периодического закона. Его современная формулировка звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер. На момент написания статьи опубликовано свыше 500 вариантов периодической системы классификации химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. По решению ООН 2019 год был провозглашен Международным годом Периодической таблицы химических элементов.
Его современная формулировка звучит так: свойства элементов находятся в периодической зависимости от заряда их атомных ядер. На момент написания статьи опубликовано свыше 500 вариантов периодической системы классификации химических элементов, что связано с попытками поиска решения некоторых частных проблем ее структуры. По решению ООН 2019 год был провозглашен Международным годом Периодической таблицы химических элементов.
Содержание
- 1 Периодическая таблица Д.И. Менделеева
- 2 «Башня» из химических элементов
- 3 Спираль из химических элементов
- 4 Цветок Менделеева
- 5 Лента периодических химических элементов
Периодическая таблица Д.И. Менделеева
Вне зависимости от того, любите вы или ненавидите ее, перед вами оригинальная периодическая таблица Менделеева и, скорее всего, вы всегда ее узнаете. Эта система классификации химических элементов знакома нам с детства и упорядочена по атомному номеру, электронной конфигурации. Необхдимо отметить, что она слабо зависит от химических свойств элементов как таковых. В этой версии таблицы меньше элементов, но зато в ней оставлено место для большего количества еще не открытых элементов, что – как показали годы исследований – оказалось разумным предположением русского ученого.
Необхдимо отметить, что она слабо зависит от химических свойств элементов как таковых. В этой версии таблицы меньше элементов, но зато в ней оставлено место для большего количества еще не открытых элементов, что – как показали годы исследований – оказалось разумным предположением русского ученого.
Всем знакомая периодическая таблица химических элементов Д.И. Менделеева
«Башня» из химических элементов
Периодическая таблица ADOMAH разработанная в 2006 году Валерием Циммерманом. Вместо того, чтобы основываться на атомных числах, систематизирована вокруг четырех квантовых чисел электронной конфигурации, эти четыре числа используются для описания расположения и движения электронов внутри атома. Идея берет свое начало из более старой таблицы инженера и биолога Чарльза Джанета, согласно статье, опубликованной на портале Science Alert. Его работа перестраивала элементы в соответствии с орбитальным заполнением – основной вероятностью нахождения электрона на определенном расстоянии от ядра атома.
Так выглядит периодическая система ADOMAH
Еще больше интересных статей о физике, химии и новостях мировой науки, читайте на нашем канале в Google News
Спираль из химических элементов
Спиральная таблица химических элементов, созданная в 1964 году химиком Теодором Бенфеем, выглядит очень красиво. Начиная с середины спирали с водородом, она закручивается наружу в порядке атомных номеров, прежде чем разветвляется на переходные металлы, лантаноиды, актиниды и до сих пор не открытые суперактиниды.
Спираль
Цветок Менделеева
Сочетание химических эелемнтов может поражать воображение, особенно если взглянуть на него под другим углом
Примечательно, что в этой периодической таблице нет ни водорода, ни гелия. Первая, окрашенная в бирюзовый цвет секция (или лепесток) содержит щелочные металлы спереди и щелочноземельные металлы позади. Другие лепестки, в свою очередь, содержат остальные элементы, сгруппированные по присущим им качествам.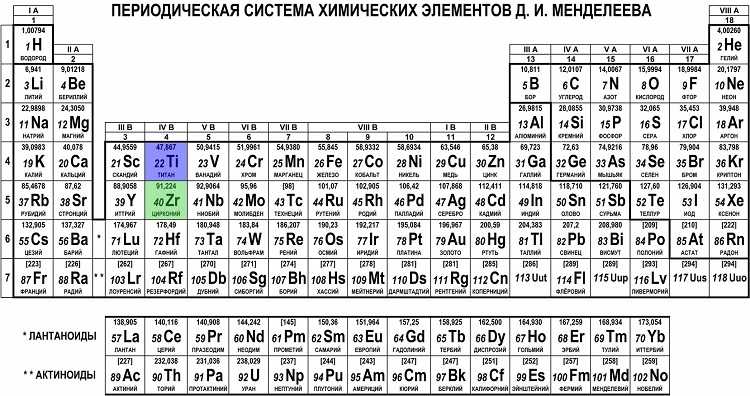
Лента периодических химических элементов
Ниже вы можете увидеть движущуюся вариацию: Названная периодической таблицей скрученная лента, таблица создана Джеймсом Франклином Хайдом в 1975 году. Хайд был химиком, изучающим кремниевую органику, а потому уделил кремнию центральное место в таблице (в бежевой секции в середине двух кругов), подчеркнув, крепкую связь этого элемента с многими другими в таблице.
В периодической системе химических элементов для каждого элемента указывается его символ, название, порядковый номер и значение относительной атомной массы.
Перед вами таблица химических элементов и их взаимодействий
Однако, таблица все еще начинается в центре правого круга с водородом, прежде чем спирально выйти в различные группы. Множество цветов подчеркивают периодические отношения элементов. Красивые изгибы делают это одним из наших любимых вариантов, но это также довольно интенсивно. Для практического рассмотрения вещей ознакомьтесь с этой периодической таблицей, которая рассказывает вам, как использовать эти элементы.
Наука химияНаучные исследованияХимические элементы металлы
Для отправки комментария вы должны или
Сколько «Периодических систем химических элементов» существует в природе? | Культура
Сегодня можно спорить до хрипоты: произошло это великое открытие непосредственно во сне, во время глубокой медитации или за завтраком, или еще как-то. Говорят, что сам Дмитрий Иванович очень не любил, когда ему задавали этот вопрос: «Как Вы изобрели Периодическую систему?» Обычно он отмалчивался и только один раз не выдержал и заявил: «Я над ней, может быть, 20 лет размышлял, а вы думаете: сидел и вдруг… готово!»
Коллеги Менделеева поняли не сразу
Мало кто знает, что это открытие не вызвало повышенного интереса у современников. Спустя несколько дней, 6 марта 1869 года, на заседании Русского химического общества (созданного за три месяца до описываемых событий), Менделеев хотел выступить с подробным докладом о том, что он, собственно, открыл.
Николай Александрович был довольно известным ученым. Забегая вперед, могу сказать, что уже спустя два года, в 1871-м, он написал учебник «Аналитическая химия», который выдержал 16 изданий (последнее — ровно через 60 лет после первого). На заседании Меншуткин постарался провести «презентацию» идеи Менделеева на высшем уровне, но его речь не вызвала никакого интереса у собратьев-химиков. И только спустя несколько дней, когда Менделеев выздоровел и встретился с коллегами, профессор Савченков заметил: «Ваша таблица, батенька, очень уж смахивает на периодическую таблицу элементов Одлинга. Придумайте что-то свое…»
А кто такой Одлинг? «Ну вот, с этого и начнем…»
По большому счету, все началось даже не с Уильяма Одлинга.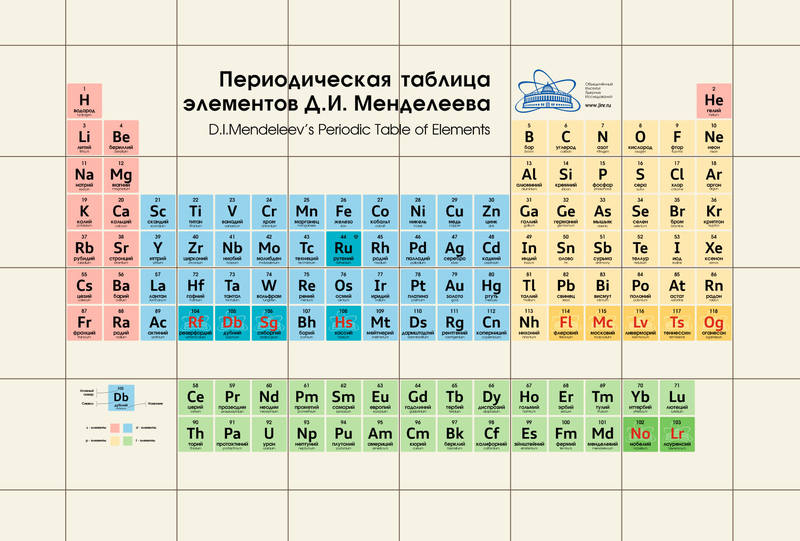 Первую успешную попытку систематизации химических элементов задолго до Одлинга предпринял немецкий химик Иеремия-Вениамин Рихтер. В 1793 году он предложил расположить все известные на тот момент химические элементы в ряд по возрастанию их атомной массы.
Первую успешную попытку систематизации химических элементов задолго до Одлинга предпринял немецкий химик Иеремия-Вениамин Рихтер. В 1793 году он предложил расположить все известные на тот момент химические элементы в ряд по возрастанию их атомной массы.
Прошла еще почти четверть века, пока другой немецкий химик Иоганн Вольфганг Дёберейнер, хороший друг философа Иоганна Гёте, не обнаружил, что масса среднего из трех сходных по массе элементов равна примерно среднему арифметическому атомных масс двух соседних элементов. Всего таких триад оказалось три: литий — натрий — калий; сера — селен — теллур; хлор — бром — йод.
Следующим «открывателем» новой системы стал русский химик Герман Иванович Гесс (скорее всего, обрусевший немец). В изданном в 1849 году (за 20 лет до открытия Менделеева) учебнике «Основания чистой химии» он определил четыре группы элементов-неметаллов, причем к уже известным двум связкам Дёберейнера он добавил еще две: углерод — бор — кремний; азот — фосфор — мышьяк.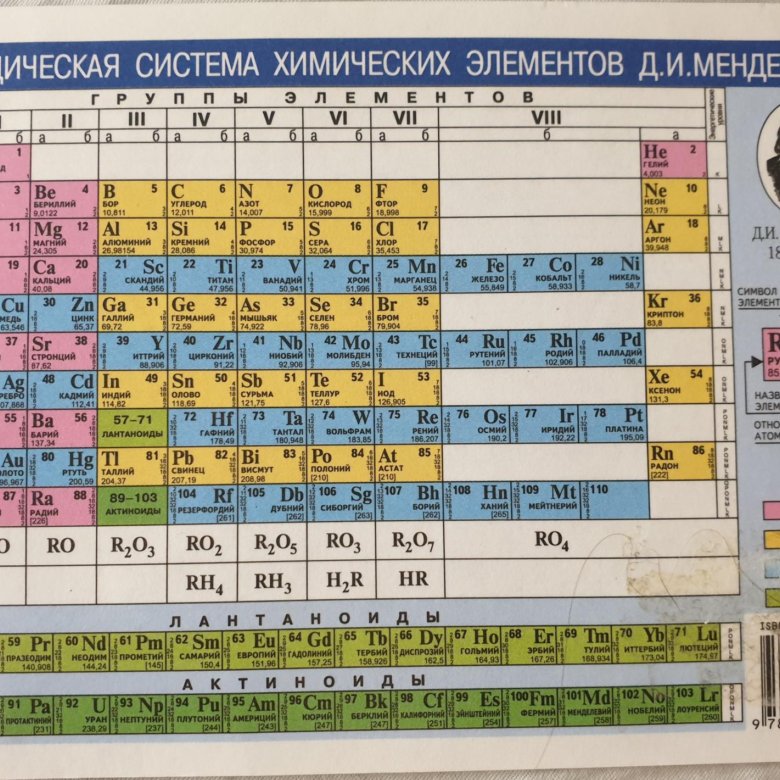
Бег по спирали
Новую попытку расположить химические элементы в определенной последовательности изложил в 1862 году французский ученый А. Э. Бегье де Шанкуртуа. Он связал свойства элементов с функцией чисел и расположил все вокруг цилиндра по спирали. Соответственно, и его таблица получила название «Земная спираль». Но она была известна в достаточно узком кругу, тот же Дмитрий Иванович Менделеев о «спирали» Бегье де Шанкуртуа ничего не слышал.
Через два года после француза, в 1864 году, английский химик Джон Александер Рейна Ньюлендс предложил свою квалификацию, его таблица получила название «системы октав».
Примерно в одно время с Ньюлендсом, в 1864 году, немецкий химик Юлиус-Лотар Мейер в своей книге «Современные теории химии и их значения для химической статики» привел таблицу, в которой элементы были расположены в порядке увеличения их атомных масс. В таблице он разместил 42 элемента из 63 известных к тому времени.
И наконец, мы добрались до Уильяма Одлинга, который в период с 1857 по 1868 годы предложил сразу несколько вариантов периодической системы химических элементов. И удостоился того, что Дмитрий Иванович Менделеев назвал его работы «начатками периодической системы».
И удостоился того, что Дмитрий Иванович Менделеев назвал его работы «начатками периодической системы».
Между тем свой окончательный вариант система, предложенная великим русским химиком, обрела только в 1870 году. Но это вовсе не означает, что на этом творческие изыски оказались законченными. Были попытки изобрести свою систему и после Менделеева. Но его таблица оказалась самой удобной, понятной и емкой.
Когда людей начали травить мышьяком?
И в заключение немного о самих химических элементах. Интересно проследить за историей их открытия. Самыми древними, с которыми человечество познакомилось еще до нашей эры, являются 11 элементов: золото, серебро, свинец, медь, олово, железо, углерод, сурьма, ртуть, цинк и сера.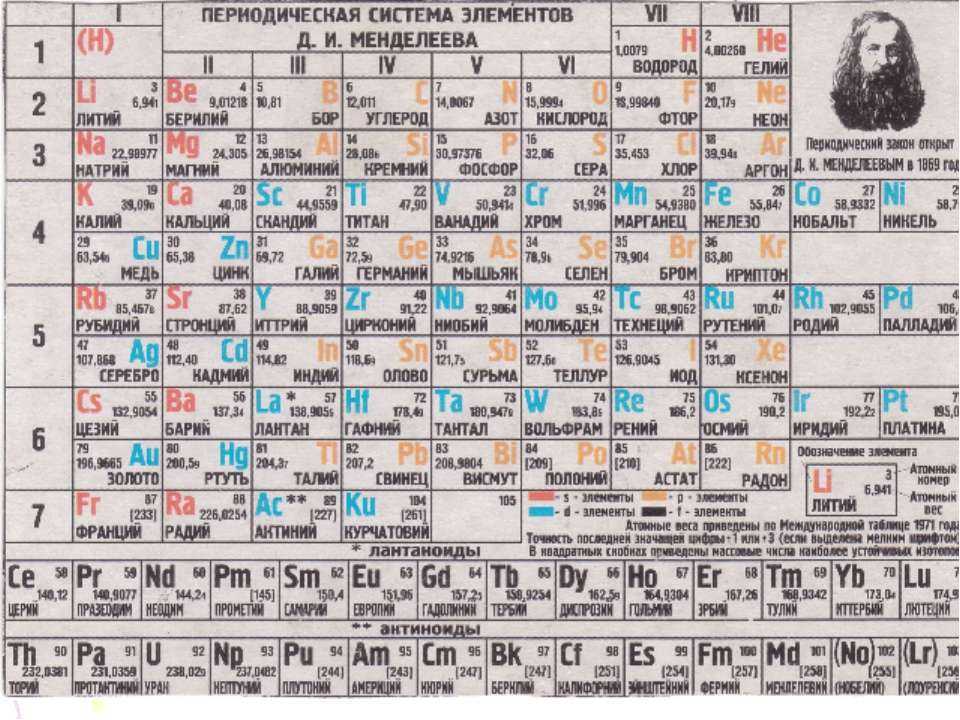
Мышьяком начали травить людей только в средние века, потому что открыли его примерно в 1250 году. На два века позже — висмут, и в 1669 году — фосфор.
Ровно 20 химических элементов подарил человечеству XVIII век. Все началось с открытия кобальта в 1735 году и закончилось в 1797 году с открытием хрома. Между ними в порядке открытия расположились: платина, никель, водород, азот, кислород, марганец, фтор, хлор, барий, молибден, вольфрам, теллур, уран, цирконий, стронций, иттрий, титан, бериллий.
Все остальное появилось в периодической системе в XIX и XX веках. К примеру, алюминий был открыт в 1825 году, а гелий в 1895-м.
Не могу не привести названия последних четырех химических элементов, открытых уже в XXI веке. Что приятно, все они открыты российскими учеными Объединенного института ядерных исследований в Дубне. Вот только название у них — врагу не пожелаешь: унунгексий, унуноктий, унунтрий, унунпентий. Самых эмоциональных читателей «Школы жизни» я призываю не оригинальничать и не называть сыновей этими именами. Еще не время…
Что приятно, все они открыты российскими учеными Объединенного института ядерных исследований в Дубне. Вот только название у них — врагу не пожелаешь: унунгексий, унуноктий, унунтрий, унунпентий. Самых эмоциональных читателей «Школы жизни» я призываю не оригинальничать и не называть сыновей этими именами. Еще не время…
И, наконец, интересный факт на «закуску». Как вы думаете, чем ответили за океаном на изобретение Периодической системы? В тот же самый день, 1 марта 1869 года, в США впервые выпустили почтовые марки с картинками. Такой вот день случился 140 лет назад…
Теги: история, химия, наука, Дмитрий Менделеев, интересный факт, система, периодическая таблица элементов
Сколько на данный момент известно элементов в таблице Менделеева?
Содержание
- – Сколько известно химических элементов на 2019 год?
- – Сколько химических элементов сейчас известно?
- – Как Менделеев открыл периодическую таблицу?
- – Какой самый новый элемент таблицы Менделеева?
- – Сколько известно химических элементов 2020?
- – Как называют таблицу Менделеева за границей?
- – Какое число химических элементов металлов известно?
- – Как называется группа газов в таблице химических элементов?
- – Что открыл Менделеев в географии?
- – Кто на самом деле придумал периодическую таблицу?
- – Зачем Менделеев создал таблицу?
- – Кто изобрёл периодическую таблицу химических элементов?
- – Сколько химических элементов открыто на данный момент?
- – Какой химический элемент назван в честь нашей страны?
- – Что такое элемент 118?
Менделеева” – первая классическая короткая форма Периодической системы химических элементов. Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118).
Современная Периодическая система химических элементов включает 118 элементов. За последние 50 лет таблица Менделеева пополнилась семнадцатью новыми элементами (102-118).
Сколько известно химических элементов на 2019 год?
Ко времени открытия закона было известно лишь 63 элемента, на сегодняшний день в периодической таблице – 118 химических элементов. В настоящее время используются длинный и короткий варианты Периодической системы химических элементов Д. И. Менделеева.
Сколько химических элементов сейчас известно?
По состоянию на 2016 год известно 118 химических элементов. 94 из них встречаются в природе (некоторые лишь в микроколичествах), а остальные 24 искусственно синтезированы.
Как Менделеев открыл периодическую таблицу?
13 марта 1869 года Менделеев закончил составление таблицы. Суть открытия Менделеева заключалась в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически. … Ученый предсказал открытие нескольких новых химических элементов и описал их химические свойства.
… Ученый предсказал открытие нескольких новых химических элементов и описал их химические свойства.
Какой самый новый элемент таблицы Менделеева?
В результате итогов стоит ждать не раньше, чем к середине 2021 года. Предыдущий 118-й элемент таблицы Менделеева носит имя оганесон (Og) – он назван в 2016 году честь академика Оганесяна, автора основополагающих научных работ по синтезу новых элементов.
Сколько известно химических элементов 2020?
Современная Периодическая система химических элементов включает 118 элементов.
Как называют таблицу Менделеева за границей?
Во многих странах Европы, в Соединенных Штатах Америки и в Канаде систему Менделеева чаще всего называют просто «Периодическая таблица», а ее автора и вовсе не упоминают. В этих государствах официально не признают тот факт, что данное открытие первым сделал именно русский ученый.
Какое число химических элементов металлов известно?
Из 118 химических элементов, открытых на 2019 год, к металлам часто относят (единого общепринятого химического определения нет, например, полуметаллы и полупроводники не всегда относят к металлам):
Как называется группа газов в таблице химических элементов?
Галогены (галоиды) — элементы седьмой группы: F, Cl, Br, I, At, Ts. Инертные газы (благородные газы) — элементы восьмой группы: He, Ne, Ar, Kr, Xe, Rn, Og.
Что открыл Менделеев в географии?
Дмитрий Иванович Менделеев/Изобретения
Кто на самом деле придумал периодическую таблицу?
Менделеевым в 1869 году и установившего зависимость свойств элементов от их атомного веса (в современных терминах, от атомной массы). Первоначальный вариант был разработан Д. И. Менделеевым в 1869, и приведен к традиционному графическому виду в 1871 году.
Первоначальный вариант был разработан Д. И. Менделеевым в 1869, и приведен к традиционному графическому виду в 1871 году.
Зачем Менделеев создал таблицу?
В 1869 году Менделеев опубликовал свою схему периодической таблицы в журнале Русского химического общества и разослал извещение об открытии ведущим ученым мира. … Суть открытия Менделеева в том, что с ростом атомной массы химические свойства элементов меняются не монотонно, а периодически.
Кто изобрёл периодическую таблицу химических элементов?
Периодическая система химических элементов/Изобретатели
Сколько химических элементов открыто на данный момент?
Юрий Оганесян: Капельная модель предсказывала, что их не более ста. С её точки зрения есть предел существования новых элементов. Сегодня их открыто 118.
Сегодня их открыто 118.
Какой химический элемент назван в честь нашей страны?
Первооткрыватель элемента К. К. Клаус назвал рутений в честь России (Ruthenia — латинское название Руси). Название «рутений» было предложено в 1828 году Г.
Что такое элемент 118?
Оганесо́н (лат. Oganesson, Og), ранее был известен под временными названиями унуно́ктий (лат. Ununoctium, Uuo) или э́ка-радо́н — химический элемент восемнадцатой группы (по устаревшей классификации — главной подгруппы восьмой группы), седьмого периода периодической системы химических элементов, атомный номер — 118.
Интересные материалы:
Какие силы были у Зачарованных?
Какие сладости стоит попробовать в Турции?
Какие слои населения поддерживали деятельность Александра Невского а какие нет?
Какие службы можно отключить в виндовс 10?
Какие соки совместимы?
Какие сорта орхидей долго цветут?
Какие сорта винограда Кишмиш?
Какие сословия существовали в начале 20 века?
Какие специальности являются военно учетными?
Какие специи любит форель?
Вопрос ученому: есть ли предел у таблицы Менделеева?
Прочтений: 7493Томск
Редакция vtomske.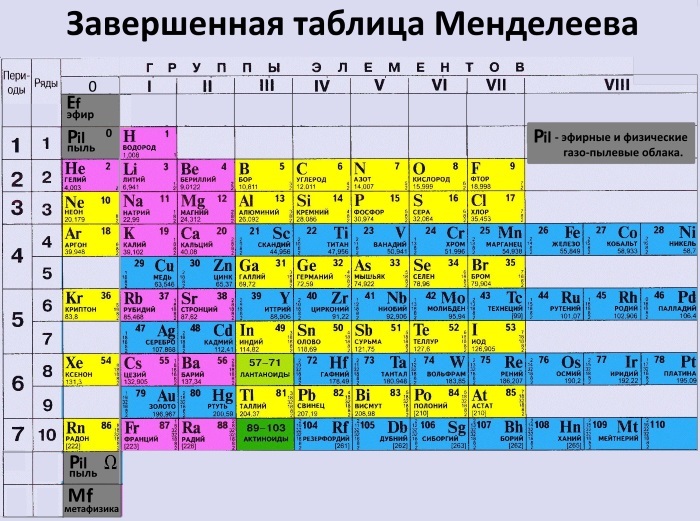 ru
ruСюжет:
Вопрос ученому
Depositphotos/Albert Tica
«Флеровий, ливерморий, дармштадтий, рентгений — то и дело в лентах новостей в Интернете появляются любопытные имена «новоселов» в периодической таблице Менделеева. Говорят, что она содержит уже гораздо больше ста химических элементов. Часть из них обнаружили в природе, остальные искусственно получены в результате ядерных реакций», — пишет посетитель нашего портала Евгений. Так есть ли предел у таблицы Менделеева? Этот вопрос мы адресовали кандидату химических наук, директору центра коллективного пользования сорбционных и каталитических исследований ТГУ Олегу Магаеву. Напоминаем, если вам есть, что спросить у ученых, пишите в комментарии или на почту [email protected]. Ваши вопросы мы зададим экспертам в самых разных областях науки и опубликуем на портале.
Олег Магаев, кандидат химических наук, директор центра коллективного пользования сорбционных и каталитических исследований ТГУ:
— Всем известно, что таблица химических элементов была составлена выдающимся русским ученым Дмитрием Ивановичем Менделеевым, который прославился не только как химик, но и как экономист, геолог, педагог, плотник и во многих других сферах деятельности. Тем не менее, периодический закон химических элементов, как один из основных законов мироздания, стал, безусловно, наиболее известным открытием Менделеева.
Тем не менее, периодический закон химических элементов, как один из основных законов мироздания, стал, безусловно, наиболее известным открытием Менделеева.
Таблица представляет собой классификацию химических элементов, устанавливающую зависимость свойств элементов от заряда атомного ядра. По сути, это графическое выражение периодического закона, установленного Менделеевым. Первоначально таблица строилась так, что отображала свойства элемента от его атомного веса. Впоследствии было предложено множество ее различных начертаний. Современный вариант представляет собой двухмерную таблицу, в которой столбцы определяют основные физико-химические свойства, а строки — периоды, подобные друг другу.
К моменту создания таблицы было открыто 63 химических элемента. Со временем все пробелы были устранены, и, казалось, система элементов приобрела завершенный вид. Однако прогресс в области ядерной физики открыл новые горизонты: искусственно синтезируемые химические элементы начали отодвигать границу периодической системы в область все больших значений атомных номеров.
На данный момент в таблице официально зарегистрировано 118 элементов. Но проблема в том, что элементы с большими атомными номерами нестабильны и имеют малый срок существования. Поэтому элементы с номерами больше 90 — фактически лабораторные, в природе они не встречаются. Срок жизни некоторых их них не превышает долей секунды!
Прийти к единому мнению о том, как далеко может зайти этот процесс, ученые, разумеется, не могут — есть как ярые сторонники, настаивающие на существовании предела, как и те, кто полагает, что границ познания нет. Что касается практической стороны вопроса, то в современном научном мире сложно уловить ориентир. Элементы, открытые лет десять назад, вполне реальны — сейчас же, гипотетически, мы можем открывать новые элементы еще сколько угодно. Но здесь встает самый главный вопрос — для чего? Если с целью пополнить таблицу и показать, что мы развиваем ядерный синтез, — это одно. А если мы хотим, чтобы это можно было применить и использовать в реальной практике, — то уже совсем другая история.
Если говорить об официальных таблицах элементов, используемых в европейских странах, сейчас в них фигурирует не больше 104-106 элементов — это максимум. Кстати, в последнее время в российских школьных учебниках химии все чаще встречаются довольно модернизированные таблицы, систематизация которых весьма далека от классического варианта. В дальнейшем, когда ребята становятся студентами и приходят обучаться в стены высших учебных заведений, у них возникает большая путаница.
Сама же процедура признания нового элемента довольна сложна. Одним из ключевых требований является то, что открытие должно быть перепроверено, экспериментально подтверждено двумя-тремя независимыми научными группами. В мире есть не так много лабораторий, сотрудникам которых удалось синтезировать один или даже несколько новых элементов. И в первую очередь, одну из лидирующих позиций здесь занимают российские исследователи — ученые объединенного института ядерных исследований в Дубне.
Подписывайтесь на наш канал в Яндекс. Дзен, чтобы не пропускать самое интересное
Дзен, чтобы не пропускать самое интересное
Самое обсуждаемое
Владимир Мазур прокомментировал частичную мобилизацию81
Теперь без прогулок: массовое задержание людей прошло в центре Томска75
Госдума приняла закон о введении понятий «мобилизация» и «военное положение» в УК73
Путин объявил о частичной мобилизации в России63
«Обними меня, если тебе тоже страшно»: акция против мобилизации прошла в Томске61
Военком не раскрыл число людей, которых планируется мобилизовать в Томской области57
Шойгу рассказал, как в России будет проходить частичная мобилизация52
Тарифы на коммунальные услуги повысят второй раз за год45
Загрязненные пометом 52 гектара земли нашли в Томском районе. Возбуждено уголовное дело40
Кто подлежит частичной мобилизации и что означают категории годности к службе?32
химические элементы, периоды, группы, номер соответствия, закон, строение, свойства
Свойства элементов позволяют объединять их в соответствующие группы.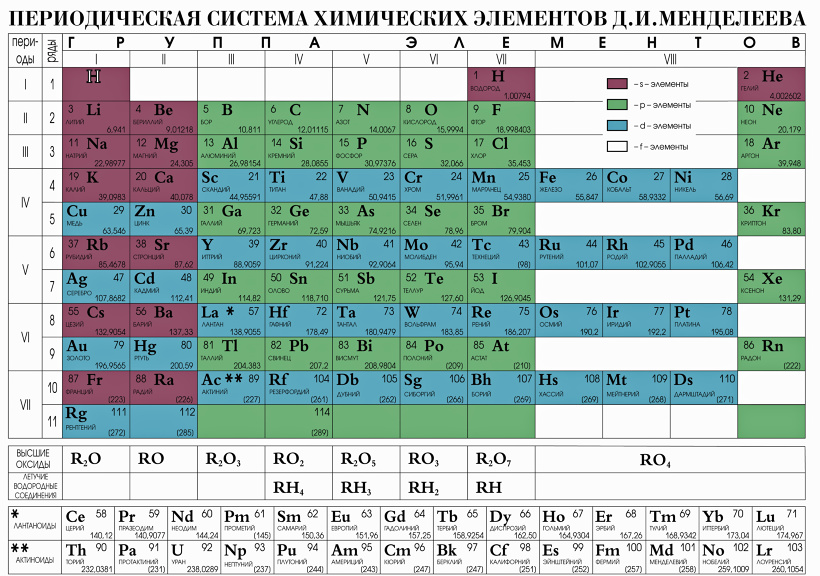 Периодическая система Менделеева – таблица, в которой химические элементы классифицируются по различным свойствам в зависимости от заряда атомного ядра. Это графическое изображение периодического закона, который известный ученый Д. И. Менделеев открыл в 1869 году. Первая таблица содержала всего 60 элементов. Сейчас ее расширили, чтобы поместить 118 элементов.
Периодическая система Менделеева – таблица, в которой химические элементы классифицируются по различным свойствам в зависимости от заряда атомного ядра. Это графическое изображение периодического закона, который известный ученый Д. И. Менделеев открыл в 1869 году. Первая таблица содержала всего 60 элементов. Сейчас ее расширили, чтобы поместить 118 элементов.
Периодический закон: история открытия
К середине 19 века ученые открыли 63 химических элемента. Многие светлые умы предпринимали попытки найти какую-либо закономерность между ними, но успехов до этого времени не достиг никто. В 1829 году Дёберейнер открыл и опубликовал так называемый «закон триад». Его суть – атомный вес многих элементов близок к среднему значению 2 других элементов, которые близки к нему по свойствам. Опираясь на этот закон первую попытку расположить элементы в порядке возрастания их атомного веса предпринял А. Э. Шанкуртуа. Произошло это в 1862 году. Но модели расположения, которые он представил, не заинтересовали научную общественность.
Следующую попытку предпринял Д. А. Ньюланденс. Его модель имела название «закон октав». Она несколько напоминала таблицу Менделеева. Но научные деятели ее также не приняли, так как сам автор пытался найти в ней мистическую музыкальную гармонию. В это же время были предприняты еще несколько попыток систематизации, но они также успехом не увенчались.
Лишь в 1869 году Д. И. Менделеев в журнале Русского химического общества опубликовал свою первую схему периодической системы. Сущность открытия заключалась в том, что с ростом атомной массы элементов их свойства меняются не хаотично и монотонно, а периодически. После некоторого числа элементов с одинаковыми свойствами, расположенными по возрастанию атомного веса, свойства вновь начинают повторятся. В 1871 году Менделеев на основе всех этих данных смог сформулировать свой Периодический закон. Научную достоверность его подтвердили в 1875-1886 годах.
Существует легенда, что свою таблицу ученый увидел во сне. А проснувшись, просто ее записал и представил как открытие.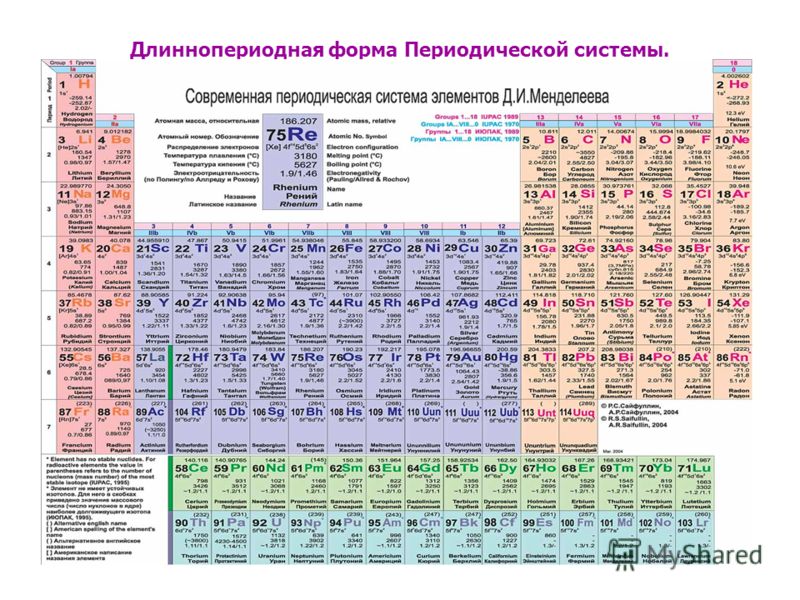 На это сам химик сказал, что:«Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». На самом деле открытие заняло у него очень много времени.
На это сам химик сказал, что:«Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». На самом деле открытие заняло у него очень много времени.
Сам Дмитрий Иванович Менделеев был не только химиком, как предполагают многие люди. Он был еще и физиком, экологом, геологом, экономистом, приборостроителем и даже педагогом. За всю свою жизнь от провел во многих областях науки. Но именно открытие одного из фундаментальных законов природы принесло ему известность не только в научных кругах, но и среди обычных людей.
Смелости мысли Менделеева можно только позавидовать. Ученый решился опубликовать свой труд, чтобы представить его общественности. Если смотреть на это с одной стороны, то первоначальная таблица содержала много пустых клеток, так как еще не были открыты элементы, известные людям сейчас. Но с другой стороны, ученый предположил, что атомный вес некоторых элементов измерили неправильно, так как в противном случае они бы не вписались в созданную систему. И здесь от оказался прав
И здесь от оказался прав
Первоначальный вариант был более прост и отражал то, что существует в природе. То есть она никаким образом не объясняла, почему все должно быть так, как предположил ученый. И только позже, когда появилась квантовая механика и принцип запрета Паули, науке стал понятен смысл расположения элементов в представленной системе.
Элементы включая уран существуют в природе. Можно назвать их натуральными. Все последующие, начиная с 93 номера – это искусственные, которые ученые создали в лаборатории. Самый большой номер на сегодняшний день – 118.
Периодическая система Менделеева
Периодическая таблица элементов была составлена Д. И. Менделеевым во второй половине XIX века. Система объединяет все элементы по возрастанию атомного веса, причем, все они расставлены так, что их свойства изменяются периодическим образом.
Периодическая система в химии свела в единую систему все существующие элементы, прежде считавшиеся отдельными веществами.
На основании изучения периодической системы были предсказаны, а впоследствии — синтезированы новые вещества. Значение этого открытия для науки невозможно переоценить, оно опередило свое время и дало толчок к развитию химии.
Значение этого открытия для науки невозможно переоценить, оно опередило свое время и дало толчок к развитию химии.
Существует три распространенных варианта системы, которые условно именуются «короткая», «длинная» и «сверхдлинная». Основной считается длинная, она утверждена официально.
Что такое период
Периодическая система содержит 7 периодов. Они представлены графически в виде горизонтальных строк. При этом, период имеет одну или две строки, называемые рядами. Каждый последующий элемент отличается от предыдущего возрастанием заряда ядра (количества электронов) на единицу.
Если не усложнять, период — это горизонтальная строка. Каждый из них начинается металлом и заканчивается инертным газом. Собственно, это и создает периодичность. Первый, второй и третий периоды — неполные, они называются малыми и содержат соответственно 2, 8 и 8 элементов. Остальные — полные, они имеют по 18.
Что такое группа
Группа — это вертикальный столбец в периодической системе Менделеева, содержащий элементы с одинаковым электронным строением или, говоря проще, с одинаковой высшей валентностью. Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Официально утвержденная длинная таблица содержит 18 групп, которые начинаются со щелочных металлов и заканчиваются инертными газами.
Каждая группа имеет название, облегчающее поиск или классификацию. Усиливаются металлические свойства по направлению сверху-вниз. Это связано с увеличением количества атомных орбит — чем их больше, тем слабее электронные связи, что делает выраженной кристаллическую решетку.
Металлы в периодической системе Менделеева
Металлы в периодической системе Менделеева имеют преобладающее количество, список их обширен. Они характеризуются общими признаками, по свойствам неоднородны и делятся на группы. Некоторые из них имеют мало общего с металлами в физическом смысле, а иные существуют только доли секунды и в природе не встречаются (на планете Земля), поскольку созданы, точнее, вычислены и подтверждены в лабораторных условиях, искусственно. Каждая группа в системе Менделеева имеет собственные признаки, название и заметно отличается от других. Особенно это различие выражено у первой группы.
Положение металлов
Элементы в системе Менделеева расположены по увеличению атомной массы или количества электронов и протонов. Их свойства изменяются периодически, поэтому аккуратного размещения по принципу «один к одному» в таблице нет. Чтобы определить металлы по периодической системе Менделеева придуман специальный прием: условно по местам соединения элементов проводится диагональная линия от Бора до Полония (или до Астата). Те, что слева — металлы, справа — неметаллы. Но есть исключения — Германий и Сурьма.
[stop] Это работает только в длинной системе, на коротком варианте периодической таблицы Менделеева многие металлы оказываются справа.[/stop]
Такая «методика» — своего рода шпаргалка, она придумана для упрощения процесса запоминания.
Читайте также: Каково содержание кислорода в воздухе: процентный состав и норма
Общие физические свойства
Существуют общие физические свойства металлов. К ним относятся:
- Пластичность.

- Характерный блеск.
- Электропроводность.
- Теплопроводность.
- Все, кроме ртути, находятся в твердом состоянии.
Их свойства различаются. Например, ртуть занимает особенное положение. Она при обычных условиях находится в жидком состоянии, не имеет кристаллической решетки, наличию которой обязаны особенностями другие металлы. Свойства последних в этом случае условны, с ними ртуть роднят в большей степени химические характеристики.
[warning] Элементы первой группы системы Менделеева, щелочные металлы, в чистом виде не встречаются, находясь в составе различных соединений.[/warning]
Самый мягкий металл в природе — цезий — относится к этой группе. Некоторые источники утверждают, что на самом деле, самым мягким является калий. Это сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе — будучи выделенным в результате химической реакции они быстро окисляются или вступают в реакцию.
Вторая группа — щелочноземельные — намного ближе к основным группам. Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку имеют рыхлую рассыпчатую структуру. Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает, замещаясь неметаллами. Последняя состоит из инертных (или благородных) газов.
Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку имеют рыхлую рассыпчатую структуру. Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает, замещаясь неметаллами. Последняя состоит из инертных (или благородных) газов.
Определение металлов и неметаллов в таблице Менделеева. Простые и сложные вещества:
Простые вещества:
Соотношение металлов и неметаллов в периодической системе Менделеева перевешивает в пользу первых. Такое положение свидетельствует о том, что они объединены слишком широко и требуют подробной классификации, что признается научным сообществом.
Читайте также: Основной закон Гесса и следствия из него
Число протонов нейтронов электронов в атоме элемента (Таблица)
Число протонов нейтронов и электронов в атоме химического элемента (изотопа) можно определить, зная порядковый номер элемента в периодической таблице Менделеева и его атомную массу:
— Число протонов = число электронов = порядковый номер элемента
— Число нейтронов = атомная масса – число протонов
Вычислим число нейтронов в атоме на примере кислорода 16O:
16 – 8 = 8 (в кислороде 8 нейтронов)
Таблица число протонов нейтронов электронов в атоме химического элемента
Справочная таблица содержит список элементов (изотопов) и их число протонов, нейтронов и электронов, а также атомную массу изотопа.
| Элемент, изотоп | Число протонов (= электронов) | Число нейтронов | Атомная масса изотопа |
| 1H | 1 | 0 | 1,0078 |
| 2H | 1 | 1 | 2,0141 |
| 3He | 2 | 1 | 3,0160 |
| 4He | 2 | 2 | 4,0026 |
| 6Li | 3 | 3 | 6,0151 |
| 7Li | 3 | 4 | 7,0160 |
| 9Be | 4 | 5 | 9,0122 |
| 10B | 5 | 5 | 10,0129 |
| 11B | 5 | 6 | 11,0093 |
| 12C | 6 | 6 | 12,0000 |
| 13C | 6 | 7 | 13,0034 |
| 14N | 7 | 7 | 14,0031 |
| 15N | 7 | 8 | 15,0001 |
| 16O | 8 | 8 | 15,9949 |
| 17O | 8 | 9 | 16,9991 |
| 18O | 8 | 10 | 17,9992 |
| 19F | 9 | 10 | 18,9984 |
| 20Ne | 10 | 10 | 19,9924 |
| 21Ne | 10 | 11 | 20,9938 |
| 22Ne | 10 | 12 | 21,9914 |
| 23Na | 11 | 12 | 22,9898 |
| 24Mg | 12 | 12 | 23,9850 |
| 25Mg | 12 | 13 | 24,9858 |
| 26Mg | 12 | 14 | 25,9826 |
| 27Al | 13 | 14 | 26,9815 |
| 28Si | 14 | 14 | 27,9769 |
| 29Si | 14 | 15 | 28,9765 |
| 30Si | 14 | 16 | 29,9738 |
| 31P | 15 | 16 | 30,9738 |
| 32S | 16 | 16 | 31,9721 |
| 33S | 16 | 17 | 32,9715 |
| 34S | 16 | 18 | 33,9679 |
| 36S | 16 | 20 | 35,9671 |
| 35Cl | 17 | 18 | 34,9689 |
| 37Cl | 17 | 20 | 36,9659 |
| 36Ar | 18 | 18 | 35,9675 |
| 38Ar | 18 | 20 | 37,9627 |
| 40Ar | 18 | 22 | 39,9624 |
| 39K | 19 | 20 | 38,9637 |
| 40K* | 19 | 21 | 39,9640 |
| 41K | 19 | 22 | 40,9618 |
| 40Ca | 20 | 20 | 39,9626 |
| 42Ca | 20 | 22 | 41,9586 |
| 43Ca | 20 | 23 | 42,9588 |
| 44Ca | 20 | 24 | 43,9555 |
| 46Ca | 20 | 26 | 45,9537 |
| 48Ca* | 20 | 28 | 47,9525 |
| 45Sc | 21 | 24 | 44,9559 |
| 46Ti | 22 | 24 | 45,9526 |
| 47Ti | 22 | 25 | 46,9518 |
| 48Ti | 22 | 26 | 47,9479 |
| 49Ti | 22 | 27 | 48,9479 |
| 50Ti | 22 | 28 | 49,9448 |
| 50V* | 23 | 27 | 49,9472 |
| 51V | 23 | 28 | 50,9440 |
| 50Cr | 24 | 26 | 49,9460 |
| 52Cr | 24 | 28 | 51,9405 |
| 53Cr | 24 | 29 | 52,9406 |
| 54Cr | 24 | 30 | 53,9389 |
| 55Mn | 25 | 30 | 54,9380 |
| 54Fe | 26 | 28 | 53,9396 |
| 56Fe | 26 | 30 | 55,9349 |
| 57Fe | 26 | 31 | 56,9354 |
| 58Fe | 26 | 32 | 57,9333 |
| 59Co | 27 | 32 | 58,9332 |
| 58Ni | 28 | 30 | 57,9353 |
| 60Ni | 28 | 32 | 59,9308 |
| 61Ni | 28 | 33 | 60,9311 |
| 62Ni | 28 | 34 | 61,9283 |
| 64Ni | 28 | 36 | 63,9280 |
| 63Cu | 29 | 34 | 62,9296 |
| 65Cu | 29 | 36 | 64,9278 |
| 64Zn | 30 | 34 | 63,9291 |
| 66Zn | 30 | 36 | 65,9260 |
| 67Zn | 30 | 37 | 66,9271 |
| 68Zn | 30 | 38 | 67,9248 |
| 70Zn | 30 | 40 | 69,9253 |
| 69Ga | 31 | 38 | 68,9256 |
| 71Ga | 31 | 40 | 70,9247 |
| 70Ge | 32 | 38 | 69,9242 |
| 72Ge | 32 | 40 | 71,9221 |
| 73Ge | 32 | 41 | 72,9235 |
| 74Ge | 32 | 42 | 73,9212 |
| 75As | 33 | 42 | 74,9216 |
| 74Se | 34 | 40 | 73,9225 |
| 76Se | 34 | 42 | 75,9192 |
| 77Se | 34 | 43 | 76,9199 |
| 78Se | 34 | 44 | 77,9173 |
| 80Se | 34 | 46 | 79,9165 |
| 82Se * | 34 | 48 | 81,9167 |
| 79Br | 35 | 44 | 78,9183 |
| 81Br | 35 | 46 | 80,9163 |
| 78Kr * | 36 | 42 | 77,9204 |
| 80Kr | 36 | 44 | 79,9164 |
| 82Kr | 36 | 46 | 81,9135 |
| 83Kr | 36 | 47 | 82,9141 |
| 84Kr | 36 | 48 | 83,9115 |
| 86Kr | 36 | 50 | 85,9106 |
| 85Rb | 37 | 48 | 84,9118 |
| 87Rb* | 37 | 50 | 86,9092 |
| 84Sr | 38 | 46 | 83,9134 |
| 86Sr | 38 | 48 | 85,9093 |
| 87Sr | 38 | 49 | 86,9089 |
| 88Sr | 38 | 50 | 87,9056 |
| 89Y | 39 | 50 | 88,9058 |
| 90Zr | 40 | 50 | 89,9047 |
| 91Zr | 40 | 51 | 90,9056 |
| 92Zr | 40 | 52 | 91,9050 |
| 94Zr | 40 | 54 | 93,9063 |
| 93Nb | 41 | 52 | 92,9064 |
| 92Mo | 42 | 50 | 91,9068 |
| 94Mo | 42 | 52 | 93,9051 |
| 95Mo | 42 | 53 | 94,9058 |
| 96Mo | 42 | 54 | 95,9047 |
| 97Mo | 42 | 55 | 96,9060 |
| 98Mo | 42 | 56 | 97,9054 |
| 100Mo* | 42 | 58 | 99,9075 |
| 96Ru | 44 | 52 | 95,9076 |
| 98Ru | 44 | 54 | 97,9053 |
| 99Ru | 44 | 55 | 98,9059 |
| 100Ru | 44 | 56 | 99,9042 |
| 101Ru | 44 | 57 | 100,9056 |
| 102Ru | 44 | 58 | 101,9043 |
| 104Ru | 44 | 60 | 103,9054 |
| 103Rh | 45 | 58 | 102,9055 |
| 102Pd | 46 | 56 | 101,9056 |
| 104Pd | 46 | 58 | 103,9040 |
| 105Pd | 46 | 59 | 104,9051 |
| 106Pd | 46 | 60 | 105,9035 |
| 108Pd | 46 | 62 | 107,9039 |
| 110Pd | 46 | 64 | 109,9052 |
| 107Ag | 47 | 60 | 106,9051 |
| 109Ag | 47 | 62 | 108,9048 |
| 106Cd | 48 | 58 | 105,9065 |
| 108Cd | 48 | 60 | 107,9042 |
| 110Cd | 48 | 62 | 109,9030 |
| 111Cd | 48 | 63 | 110,9042 |
| 112Cd | 48 | 64 | 111,9028 |
| 113Cd* | 48 | 65 | 112,9044 |
| 114Cd | 48 | 66 | 113,9034 |
| 116Cd* | 48 | 68 | 115,9048 |
| 113In | 49 | 64 | 112,9041 |
| 115In* | 49 | 66 | 114,9039 |
| 112Sn | 50 | 62 | 111,9048 |
| 114Sn | 50 | 64 | 113,9028 |
| 115Sn | 50 | 65 | 114,9033 |
| 116Sn | 50 | 66 | 115,9017 |
| 117Sn | 50 | 67 | 116,9030 |
| 118Sn | 50 | 68 | 117,9016 |
| 119Sn | 50 | 69 | 118,9033 |
| 120Sn | 50 | 70 | 119,9022 |
| 122Sn | 50 | 72 | 121,9034 |
| 124Sn | 50 | 74 | 123,9053 |
| 121Sb | 51 | 70 | 120,9038 |
| 123Sb | 51 | 72 | 122,9042 |
| 120Te | 52 | 68 | 119,9040 |
| 122Te | 52 | 70 | 121,9030 |
| 123Te | 52 | 71 | 122,9043 |
| 124Te | 52 | 72 | 123,9028 |
| 125Te | 52 | 73 | 124,9044 |
| 126Te | 52 | 74 | 125,9033 |
| 128Te* | 52 | 76 | 127,9045 |
| 130Te* | 52 | 78 | 129,9062 |
| 127I | 53 | 74 | 126,9045 |
| 124Xe* | 54 | 70 | 123,9059 |
| 126Xe | 54 | 72 | 125,9043 |
| 128Xe | 54 | 74 | 127,9035 |
| 129Xe | 54 | 75 | 128,9048 |
| 130Xe | 54 | 76 | 129,9035 |
| 131Xe | 54 | 77 | 130,9051 |
| 132Xe | 54 | 78 | 131,9042 |
| 134Xe | 54 | 80 | 133,9054 |
| 136Xe* | 54 | 82 | 135,9072 |
| 133Cs | 55 | 78 | 132,9055 |
| 130Ba* | 56 | 74 | 129,9063 |
| 132Ba | 56 | 76 | 131,9051 |
| 134Ba | 56 | 78 | 133,9045 |
| 135Ba | 56 | 79 | 134,9057 |
| 136Ba | 56 | 80 | 135,9046 |
| 137Ba | 56 | 81 | 136,9058 |
| 138Ba | 56 | 82 | 137,9052 |
| 138La* | 57 | 81 | 137,9071 |
| 139La | 57 | 82 | 138,9064 |
| 136Ce | 58 | 78 | 135,9072 |
| 138Ce | 58 | 80 | 137,9060 |
| 140Ce | 58 | 82 | 139,9054 |
| 142Ce | 58 | 84 | 141,9092 |
| 141Pr | 59 | 82 | 140,9077 |
| 142Nd | 60 | 82 | 141,9077 |
| 143Nd | 60 | 83 | 142,9098 |
| 144Nd* | 60 | 84 | 143,9101 |
| 145Nd | 60 | 85 | 144,9126 |
| 146Nd | 60 | 86 | 145,9131 |
| 148Nd | 60 | 88 | 147,9169 |
| 150Nd* | 60 | 90 | 149,9209 |
| 144Sm | 62 | 82 | 143,9120 |
| 147Sm* | 62 | 85 | 146,9149 |
| 148Sm* | 62 | 86 | 147,9148 |
| 149Sm | 62 | 87 | 148,9172 |
| 150Sm | 62 | 88 | 149,9173 |
| 152Sm | 62 | 90 | 151,9197 |
| 154Sm | 62 | 92 | 153,9222 |
| 151Eu* | 63 | 88 | 150,9199 |
| 153Eu | 63 | 90 | 152,9212 |
| 152Gd* | 64 | 88 | 151,9198 |
| 154Gd | 64 | 90 | 153,9209 |
| 155Gd | 64 | 91 | 154,9226 |
| 156Gd | 64 | 92 | 155,9221 |
| 157Gd | 64 | 93 | 156,9240 |
| 158Gd | 64 | 94 | 157,9241 |
| 160Gd | 64 | 96 | 159,9271 |
| 159Tb | 65 | 94 | 158,9253 |
| 156Dy | 66 | 90 | 155,9243 |
| 158Dy | 66 | 92 | 157,9244 |
| 160Dy | 66 | 94 | 159,9252 |
| 161Dy | 66 | 95 | 160,9269 |
| 162Dy | 66 | 96 | 161,9268 |
| 163Dy | 66 | 97 | 162,9287 |
| 164Dy | 66 | 98 | 163,9292 |
| 165Ho | 67 | 98 | 164,9303 |
| 162Er | 68 | 94 | 161,9288 |
| 164Er | 68 | 96 | 163,9292 |
| 166Er | 68 | 98 | 165,9303 |
| 167Er | 68 | 99 | 166,9320 |
| 168Er | 68 | 100 | 167,9324 |
| 170Er | 68 | 102 | 169,9355 |
| 169Tm | 69 | 100 | 168,9342 |
| 168Yb | 70 | 98 | 167,9339 |
| 170Yb | 70 | 100 | 169,9348 |
| 171Yb | 70 | 101 | 170,9363 |
| 172Yb | 70 | 102 | 171,9364 |
| 173Yb | 70 | 103 | 172,9382 |
| 174Yb | 70 | 104 | 173,9389 |
| 176Yb | 70 | 106 | 175,9426 |
| 175Lu | 71 | 104 | 174,9408 |
| 176Lu* | 71 | 105 | 175,9427 |
| 174Hf* | 72 | 102 | 173,9400 |
| 176Hf | 72 | 104 | 175,9414 |
| 177Hf | 72 | 105 | 176,9432 |
| 178Hf | 72 | 106 | 177,9437 |
| 179Hf | 72 | 107 | 178,9458 |
| 180Hf | 72 | 108 | 179,9466 |
| 181Ta | 73 | 108 | 180,9480 |
| 180W* | 74 | 106 | 179,9467 |
| 182W | 74 | 108 | 181,9482 |
| 183W | 74 | 109 | 182,9502 |
| 184W | 74 | 110 | 183,9509 |
| 186W | 74 | 112 | 185,9544 |
| 185Re | 75 | 110 | 184,9530 |
| 187Re* | 75 | 112 | 186,9558 |
| 184Os | 76 | 108 | 183,9525 |
| 186Os* | 76 | 110 | 185,9538 |
| 187Os | 76 | 111 | 186,9558 |
| 188Os | 76 | 112 | 187,9558 |
| 189Os | 76 | 113 | 188,9581 |
| 190Os | 76 | 114 | 188,9581 |
| 192Os | 76 | 116 | 191,9615 |
| 191Ir | 77 | 114 | 190,9606 |
| 193Ir | 77 | 116 | 191,9626 |
| 190Pt* | 78 | 112 | 189,9599 |
| 192Pt | 78 | 114 | 191,9610 |
| 194Pt | 78 | 116 | 193,9627 |
| 195Pt | 78 | 117 | 194,9648 |
| 196Pt | 78 | 118 | 195,9650 |
| 198Pt | 78 | 120 | 197,9679 |
| 197Au | 79 | 118 | 196,9666 |
| 196Hg | 80 | 116 | 195,9658 |
| 198Hg | 80 | 118 | 197,9668 |
| 199Hg | 80 | 119 | 198,9683 |
| 200Hg | 80 | 120 | 199,9683 |
| 201Hg | 80 | 121 | 200,9703 |
| 202Hg | 80 | 122 | 201,9706 |
| 204Hg | 80 | 124 | 203,9735 |
| 203Tl | 81 | 122 | 202,9723 |
| 205Tl | 81 | 124 | 204,9744 |
| 204Pb | 82 | 122 | 203,9730 |
| 206Pb | 82 | 124 | 205,9745 |
| 207Pb | 82 | 125 | 206,9759 |
| 208Pb | 82 | 126 | 207,9767 |
| 209Bi* | 83 | 126 | 208,9804 |
| 232Th* | 90 | 142 | 232,0381 |
| 235U* | 92 | 143 | 235,0439 |
* это нестабильные изотопы и с большим периодом полураспада, который равняется возрасту Вселенной.
Всегда полезная периодическая таблица химии отмечает большой день рождения
Квадраты, висящие на стене, выглядят как зубчатая стена из букв алфавита. Буквы не образуют слова. Колонки неровные. Эта таблица — икона химии — известна как Периодическая таблица элементов. Дмитрий Менделеев (MEN-duh-LAY-ev), русский ученый, работающий в Санкт-Петербурге, предложил раннюю версию. Это было 150 лет назад. Тем не менее, даже сегодня эта диаграмма помогает ученым понять атомы и молекулы, из которых состоит наша Вселенная.
Элементы — строительные блоки всей материи. Их атомы соединяются вместе, образуя буквально все — нас, воздух, которым мы дышим, организмы, которые делят наш мир, и каждую другую молекулу газа или частицу массы, встречающуюся во всей нашей Вселенной.
Строки и столбцы периодической таблицы отображают так называемый периодический закон . Он утверждает, что общие черты химических элементов регулярно повторяются по мере того, как элементы становятся больше. Эти закономерности связывают элементы со сходным химическим поведением и помогают химикам понять, как атомы реагируют на образование молекул. То, как выстраиваются строки и столбцы в этой таблице, указывает на общие черты между группами связанных элементов. Понимание этих взаимосвязей помогает химикам создавать новые соединения. Это также помогает им понять, как устроена жизнь. Это даже помогает им предсказать, как поведут себя новые материалы.
Эти закономерности связывают элементы со сходным химическим поведением и помогают химикам понять, как атомы реагируют на образование молекул. То, как выстраиваются строки и столбцы в этой таблице, указывает на общие черты между группами связанных элементов. Понимание этих взаимосвязей помогает химикам создавать новые соединения. Это также помогает им понять, как устроена жизнь. Это даже помогает им предсказать, как поведут себя новые материалы.
В 1869 году Дмитрий Менделеев, русский химик, предложил периодический закон и свою первую периодическую таблицу. Он опубликовал эту периодическую таблицу два года спустя в учебнике Основы химии ( Основы химии ). Ряд строк показывает, что химия периодична, что означает, что определенные свойства повторяются. Основываясь на повторяющихся шаблонах, он оставил промежутки для четырех элементов, которые, как он ожидал, будут существовать. В течение 10 лет ученые обнаружат три из них.
Дмитрий Менделеев/Институт Истории Науки
Но известная таблица Менделеева далеко не единственная таблица Менделеева. Ученые построили их множество, некоторые из них имеют самые разные формы. Химики разработали некоторые из них. Ученые и преподаватели в других областях разработали другие.
Ученые построили их множество, некоторые из них имеют самые разные формы. Химики разработали некоторые из них. Ученые и преподаватели в других областях разработали другие.
«Альтернативные формы полезны, потому что они иллюстрируют различные аспекты науки», — отмечает Кармен Джунта. Он работает химиком в колледже Ле Мойн в Сиракузах, штат Нью-Йорк. По его словам, эти менее традиционные периодические таблицы позволяют не только выделить некоторые особенности химии, но и лучше сфокусировать на них внимание.
Педагоги и родители, подпишитесь на шпаргалку
Еженедельные обновления, которые помогут вам использовать Science News Explores в учебной среде
Спасибо за регистрацию!
При регистрации возникла проблема.
В 2019 году мир празднует периодическую таблицу во всех ее формах и то, как она помогает организовать и понять строительные блоки нашей вселенной.
Это элементарно Сразу после Большого взрыва Вселенная состояла только из водорода и гелия — двух самых легких элементов. Гравитация свела эти атомы во все большем количестве. В конце концов это создаст плотные раскаленные печи, известные нам как звезды. В центре этих звезд интенсивное давление сливало атомные ядра — центры атомов — создавая более крупные ядра.
Гравитация свела эти атомы во все большем количестве. В конце концов это создаст плотные раскаленные печи, известные нам как звезды. В центре этих звезд интенсивное давление сливало атомные ядра — центры атомов — создавая более крупные ядра.
Медленно выковывает более крупные и тяжелые элементы. Они включали углерод, элемент, необходимый для всей жизни, какой мы ее знаем. Эти звездные кузницы также образовывали кислород, необходимый нам для дыхания.
Создание элементов крупнее железа требовало еще большей космической огневой мощи. Тяжелые атомные ядра образовались в результате взрыва массивных умирающих звезд. Эти сверхновых с силой столкнули более мелкие элементы друг с другом.
В своей периодической таблице 1869 года Менделеев расположил элементы в порядке возрастания массы. Он был одним из первых ученых, которые поняли, что в химии есть повторяющиеся закономерности. По мере того, как элементы становятся больше, некоторые их свойства со временем повторяются. Некоторые элементы предпочитают вступать в реакцию, приобретая положительный заряд. Некоторые предпочитают быть заряженными отрицательно. Такие закономерности позволили ученым предвидеть, будут ли, и если да, то каким образом, объединяться различные типы элементов.
Некоторые элементы предпочитают вступать в реакцию, приобретая положительный заряд. Некоторые предпочитают быть заряженными отрицательно. Такие закономерности позволили ученым предвидеть, будут ли, и если да, то каким образом, объединяться различные типы элементов.
В своем исследовательском журнале Менделеев писал, что идея этой таблицы пришла ему во сне. Он начал со скандала. Но когда химические свойства повторились, он начал новый ряд. Он выстроил элементы с похожим поведением в столбцы. Он оставил пробелы. Он полагал, что эти дыры отмечают элементы, которые, вероятно, существовали, но еще не были обнаружены.
Когда он опубликовал эту таблицу, Менделеев предсказал свойства и массы четырех новых элементов. В конце концов все четыре были обнаружены — три всего за 10 лет.
Самая ранняя спираль была разработана французским геологом Александром-Эмилем Бегуйе де Шанкуртуа в 1862 году. В ней не было «рядов». Вместо этого все элементы намотаны на цилиндр одной длинной линией.
Александр-Эмиль Бегуйе де Шанкуртуа/Wikimedia Commons
Александр-Эмиль Бегуйе де Шанкуртуа был французским геологом. За семь лет до знаменитой таблицы Менделеев создал спиральную «таблицу». Он расположил элементы в порядке атомного веса. Он показал повторяющиеся периоды. Однако он не показывал разрывов между строками. Вместо этого он намотал свою длинную тонкую диаграмму на цилиндр. Таким образом, каждый ряд перетекал в следующий. И похожие элементы выстроились друг над другом аккуратными столбиками.
Другие ученые составили аналогичные карты. Вскоре усилия по организации всех известных элементов росли как снежный ком. По мере развития всех этих графиков один из них стал доминировать. Это тот, который сегодня можно увидеть в классах и учебниках по всему миру.
Каждый из 118 известных элементов имеет свой химический символ — одну или две буквы, гордо представляющие название элемента из его поля в периодической таблице. Некоторые из этих сокращений очевидны, например, H для водорода или C для углерода. Другие восходят к древним временам. Например, символом натрия является Na. Почему? На латыни название натрия — 9.0007 натрий .
Другие восходят к древним временам. Например, символом натрия является Na. Почему? На латыни название натрия — 9.0007 натрий .
Каждое поле в таблице имеет целое число, обычно в верхнем левом углу. Называемый атомным номером, он показывает, сколько протонов или положительно заряженных частиц упаковано в ядро элемента. Это ядро также включает нейтроны (частицы с массой, но без заряда). Ядро окружает облако гораздо меньших отрицательно заряженных электронов.
Нижнее число в квадрате диаграммы для каждого элемента включает цифры после запятой. Это значение представляет собой атомную массу элемента. Он представляет собой среднюю массу атома этого элемента.
Периодическая таблица проста, мощна и продолжает давать новые эксперименты, говорит Эрик Шерри. Он преподает химию в Калифорнийском университете в Лос-Анджелесе. Он также пишет книги о периодической таблице. Он описывает принципы организации периодической таблицы как «абсолютно важное открытие».
Двойные башни стали доминировать Наиболее распространенную сегодня периодическую таблицу иногда называют версией «башни-близнецы». Водород (H) венчает высокую башню слева. Гелий (He) возглавляет правую башню.
Водород (H) венчает высокую башню слева. Гелий (He) возглавляет правую башню.
Периодический круглый стол расставляет элементы из массива дерева. Он разработан, чтобы показать, как электроны расположены по шаблонам внутри каждого элемента. В этой древовидной конструкции периоды роста становятся частью более широких дисков. Одинаковые элементы накладываются друг на друга. Вы можете удалить каждый слой, чтобы просмотреть элементы в каждой «строке».
Гэри Кац/Институт истории науки
Чем больше атомы, тем они сложнее. В этих диаграммах период в периодической таблице относится к ряду элементов, демонстрирующих некоторый повторяющийся цикл. В таблице ширина строки, также называемая периодом, определяется таким образом, чтобы сохранялся шаблон поведения элементов в столбце. Шаблон сначала повторяется в двух элементах, так что ширина строки составляет два элемента. Затем узор повторяется в восьми элементах. И по мере того, как элементы становятся больше, отмечает Шерри, «периоды становятся все длиннее и длиннее» — в конце концов с 18 элементами, а затем с 32.
Более длинные и большие периоды могут сделать базу тяжелых элементов этой таблицы неуклюже широкой. Чтобы обойти это, диаграмма башен-близнецов обычно вытягивает часть двух нижних строк. Он размещает эти элементы внизу страницы, почти как сноски. Эти нижние ряды содержат группы элементов, известных как лантаноиды (LAN-tha-nydes) и актиноиды (AK-tih-nydes).
Актиниды включают самые новые и самые крупные элементы. Многие из них радиоактивны и не встречаются в природе. Физики вместо этого создают их в лабораториях, бомбардируя более мелкие элементы друг друга. Эти радиоактивные сверхтяжелые элементы также сверхнестабильны. Это означает, что они распадаются на более мелкие элементы за доли секунды.
Чем они полезны Периодическая таблица может служить своего рода книгой рецептов. Диаграмма показывает, как элементы связаны друг с другом. Таким образом, расположение элемента на столе говорит химику, как он может или не может взаимодействовать с другими ингредиентами. Часто к таким полезным признакам относятся его масса, температура кипения и другие важные данные.
Часто к таким полезным признакам относятся его масса, температура кипения и другие важные данные.
Расположение стола помогает химикам решать задачи. Например, химики могут захотеть создать новое соединение с характеристиками, подобными уже существующему, только лучше. Поэтому они могут искать замену с аналогичными характеристиками, начиная с другого элемента из того же столбца таблицы.
Настоящий подарок от этих таблиц, по словам Бриджит Ван Тиггелен, заключается в том, что они «собирают всю информацию в одном месте, а также обучают и делятся ею». Историк, она работает европейским директором Института истории науки в Филадельфии, штат Пенсильвания,
. У схемы башен-близнецов много преимуществ, говорит Марк Лич. Он работает химиком в Англии в Манчестерском столичном университете. Он утверждает, что ни одна другая таблица не может так хорошо отображать повторяющиеся шаблоны, в то же время включая другие функции.
Например, все металлы слева. Неметаллы болтаются справа. Эта диаграмма также показывает, как изменяется размер атома и насколько легко он может отдать электрон. Такие черты важны для понимания того, как атомы будут действовать, реагировать и соединяться с другими, образуя молекулы.
Эта диаграмма также показывает, как изменяется размер атома и насколько легко он может отдать электрон. Такие черты важны для понимания того, как атомы будут действовать, реагировать и соединяться с другими, образуя молекулы.
Альтернатива Роя Александра таблице башен-близнецов разрезала ряды на полосы. Когда он соединил их вместе, он создал трехмерную версию периодической таблицы. Она также оказалась почти идентичной той, что была создана физиком Георгием Гамовым четверть века назад.
Рой Александр
Но схема башен-близнецов не идеальна.
Химики часто спорят, например, о том, куда поместить водород и гелий. А плоская двумерная таблица на самом деле не показывает, как строки соединяются друг с другом. Когда вы подходите к концу одного ряда, Шерри говорит: «У вас возникает ощущение, что вы как бы падаете».
Рой Александр работал строителем выставок. Ему не понравилось, как резко обрываются ряды стола в башне-близнеце. Поэтому в 1965 году он разрезал традиционную таблицу Менделеева на полоски. Затем он соединил их вместе, создав 3D-версию.
Затем он соединил их вместе, создав 3D-версию.
Много лет спустя он узнал, что физик Джордж Гамов построил почти идентичную таблицу в 1940-х годах. Александр вспоминает: «Удивительно, насколько это похоже на мой патентный рисунок».
Учет все более крупных периодовКогда Бегуйе де Шанкуртуа впервые создал свою периодическую таблицу, многие крупнейшие элементы еще не были открыты. По мере того, как элементы становятся больше, общие черты повторяются реже. В конце концов, более длинные строки с элементами лантанидов и актинидов сделали традиционную диаграмму неуклюже широкой.
Трехмерная таблица может включать эти более длинные строки, просто делая спираль шире. Чтобы проиллюстрировать это, канадский химик Фернандо Дюфур разработал ElemenTree (см. фото). Он сделал каждый период шестиугольным слоем, содержащим все элементы, которые обычно появляются в одной строке на диаграмме-близнеце. Подобные элементы по-прежнему выстраиваются вертикально.
Канадский химик Фернандо Дюфур разработал ElemenTree, показанное здесь, для обработки все более крупных «строк» в виде кольца в этой трехмерной периодической «таблице».
Ingenium/Канадский музей науки и техники/Ingenium
Но стол в форме дерева — не единственный трехмерный ответ. В 1950-х учитель химии Дженни Клаусон использовала цилиндр вместо своего стола. Но вместо того, чтобы выпячивать лишние элементы, она пододвинула некоторые из них к центру.
Еще одна проблема с таблицей башен-близнецов заключается в том, куда поместить водород и гелий. Например, водород иногда действует больше как металл. Он потеряет свой электрон и привлечет отрицательно заряженные ионы. В других случаях он действует как неметалл и захватывает лишний электрон и становится отрицательно заряженным. Тогда он действует больше как фтор или хлор и поглощает положительные ионы.
Чтобы объяснить это, химик Теодор Бенфей в 1960-х создал плоский спиральный стол. Он поместил водород и гелий в центр большого синего круга. Каждая из трех внешних спиц внутри круга представляет собой группу подобных элементов. Чтобы включить более крупные элементы и растущие периодические циклы, он добавил террасы, выпирающие из круга. К ним относятся переходные металлы, лантаниды и актиноиды.
Каждая из трех внешних спиц внутри круга представляет собой группу подобных элементов. Чтобы включить более крупные элементы и растущие периодические циклы, он добавил террасы, выпирающие из круга. К ним относятся переходные металлы, лантаниды и актиноиды.
Плоский стол типа башен-близнецов удобно повесить на стену или распечатать в книге. Однако Лич добавляет: «На самом деле нет никаких причин, по которым периодическая таблица не была бы трехмерной».
Веселье и игры?Одно из последних дополнений к растущей библиотеке периодических таблиц принадлежит Европейскому химическому обществу, или ECS. Компания ECS, базирующаяся в Брюсселе, Бельгия, стремится привлечь внимание к относительной нехватке многих важных элементов. Отмечается, что для изготовления типичного сотового телефона требуется 30 элементов. И многие из этих элементов не являются широко доступными.
Одна из новейших таблиц была разработана Европейским химическим обществом. Он показывает каждый «блок» на диаграмме, размер которого соответствует его относительному изобилию или дефициту на Земле. Таблица, показанная здесь на английском языке, также имеет версии на 32 других языках, включая галисийский, иврит, шотландский гэльский, русский и китайский (мандарин).
Таблица, показанная здесь на английском языке, также имеет версии на 32 других языках, включая галисийский, иврит, шотландский гэльский, русский и китайский (мандарин).
Европейское химическое общество (CC BY-ND)
«[Нам] нужно внимательно следить за нашими тенденциями к выбрасыванию и неправильной переработке таких предметов», — утверждает ECS. «Если не будут найдены решения, мы рискуем увидеть, что многие природные элементы, из которых состоит окружающий нас мир, иссякнут — будь то из-за ограниченных запасов, их расположения в зонах конфликтов или нашей неспособности полностью их переработать».
ECS признает, что эта новая таблица «наводит на размышления». И это не случайно. Он хочет, чтобы люди понимали ценность того, чтобы не тратить впустую «исчезающие элементы». В нем говорится, что каждый должен «задаваться вопросом, действительно ли необходимы обновления для наших телефонов и других электронных устройств». И когда наша электроника умирает, говорится в нем, «мы должны убедиться, что мы перерабатываем», чтобы относительно дефицитные элементы «не попали на свалки или не загрязнили окружающую среду».
Классные вопросы
Чтобы узнать, как люди используют элементы, ECS разработала бесплатную онлайн-видеоигру: Elementary Escapades.
Есть много места для новых периодических таблиц, говорит Лич из Манчестера. На самом деле, он сделал хобби собирать новые и размещать их в Интернете. Он также всегда в поиске старых. «Вероятно, я получаю новую каждую неделю», — говорит он.
Шерри также поручил ученикам разработать новые. «Каждый из них, — говорит он, — имеет какую-то свою маленькую добродетель».
Силовые слова
Подробнее о сильных словахактиниды Серия из 15 металлических элементов, все они радиоактивны и, следовательно, токсичны. Они, как правило, показаны ниже семи верхних строк в обычной периодической таблице элементов. Их атомные номера варьируются от 89 (актиний) до 103 (лоуренсий). Первым обнаруженным актинидом и до сих пор наиболее известным примером является уран (атомный номер 92).
атом Основная единица химического элемента. Атомы состоят из плотного ядра, содержащего положительно заряженные протоны и незаряженные нейтроны. Вокруг ядра вращается облако отрицательно заряженных электронов.
Атомы состоят из плотного ядра, содержащего положительно заряженные протоны и незаряженные нейтроны. Вокруг ядра вращается облако отрицательно заряженных электронов.
поведение То, как что-то, часто человек или другой организм, действует по отношению к другим или ведет себя.
химический Вещество, состоящее из двух или более атомов, которые соединяются (связываются) в фиксированной пропорции и структуре. Например, вода — это химическое вещество, образующееся при соединении двух атомов водорода с одним атомом кислорода. Его химическая формула H 2 O. Химический также может быть прилагательным для описания свойств материалов, которые являются результатом различных реакций между различными соединениями.
химия Область науки, изучающая состав, структуру и свойства веществ и их взаимодействие. Ученые используют эти знания для изучения незнакомых веществ, для воспроизведения большого количества полезных веществ или для разработки и создания новых и полезных веществ. (о соединениях) Химия также используется как термин для обозначения рецепта соединения, способа его получения или некоторых его свойств. Люди, которые работают в этой области, известны как химики.
(о соединениях) Химия также используется как термин для обозначения рецепта соединения, способа его получения или некоторых его свойств. Люди, которые работают в этой области, известны как химики.
соединение (часто используется как синоним химического вещества) Соединение – это вещество, образующееся при соединении (связи) двух или более химических элементов в фиксированных пропорциях. Например, вода представляет собой соединение, состоящее из двух атомов водорода, связанных с одним атомом кислорода. Его химический символ — H 2 O.
база данных Организованный набор связанных данных.
развитие Появляться или возникать естественным путем или в результате вмешательства человека, например, путем производства.
электрон Отрицательно заряженная частица, обычно вращающаяся вокруг внешних областей атома; также носитель электричества внутри твердых тел.
элемент Стандартный блок некоторой более крупной структуры. (в химии) Каждое из более чем ста веществ, для которых наименьшая единица каждого из них – один атом. Примеры включают водород, кислород, углерод, литий и уран.
(в химии) Каждое из более чем ста веществ, для которых наименьшая единица каждого из них – один атом. Примеры включают водород, кислород, углерод, литий и уран.
гелий Инертный газ, который является самым легким представителем ряда инертных газов. Гелий может стать твердым при температуре -272 градуса по Цельсию (-458 градусов по Фаренгейту).
водород Самый легкий элемент во Вселенной. В виде газа он бесцветен, не имеет запаха и легко воспламеняется. Это неотъемлемая часть многих видов топлива, жиров и химических веществ, из которых состоят живые ткани. Он состоит из одного протона (который служит его ядром), вокруг которого вращается один электрон.
лантаноиды Серия из 15 элементов металлов. Они, как правило, показаны ниже семи верхних строк в обычной периодической таблице элементов. Их атомные номера варьируются от 57 (лантан) до 71 (лютеций). Лантаноиды были первым выделенным гадолинитом, минералом, найденным в Иттербю, Швеция, в 1787 году. Название этого города дало начало названию иттербий (атомный номер 70). Лантанидные элементы относятся к группе редкоземельных металлов.
Название этого города дало начало названию иттербий (атомный номер 70). Лантанидные элементы относятся к группе редкоземельных металлов.
масса Число, показывающее, насколько объект сопротивляется ускорению и замедлению. По сути, это мера того, из какого количества материи состоит этот объект.
металл Что-то, что хорошо проводит электричество, имеет тенденцию быть блестящим (отражающим) и податливым (это означает, что ему можно придать форму с помощью тепла, а не слишком большого усилия или давления).
молекула Электрически нейтральная группа атомов, представляющая минимально возможное количество химического соединения. Молекулы могут состоять из атомов одного или разных типов. Например, кислород в воздухе состоит из двух атомов кислорода (O 2 ), но вода состоит из двух атомов водорода и одного атома кислорода (H 2 O).
физик Ученый, изучающий природу и свойства материи и энергии.
радиоактивный Прилагательное, описывающее нестабильные элементы, такие как определенные формы (изотопы) урана и плутония. О таких элементах говорят, что они нестабильны, потому что их ядро теряет энергию, уносимую фотонами и/или часто одной или несколькими субатомными частицами. Это излучение энергии происходит в результате процесса, известного как радиоактивный распад.
синтез (v. synthetic) Производство вещества путем объединения более простых химических строительных блоков.
черта Характерная черта чего-либо.
трехмерный Прилагательное для чего-то, что имеет характеристики, которые можно описать в трех измерениях — обычно называемые высотой, шириной и длиной.
двухмерный Прилагательное, обозначающее что-либо в плоском мире, означающее, что оно имеет характеристики, которые можно описать только в двух измерениях — ширине и длине.
Цитаты
Блог: Oxford University Press. Эрик Шерри. Поздравляю с полувековой годовщиной периодической таблицы элементов. 29 января 2019 г.
Веб-сайт: Международный год Периодической таблицы ЮНЕСКО. 2019.
Веб-сайт : Институт истории науки. Международный год Периодической таблицы ЮНЕСКО.
Журнал: Т. Бенфей. Биография периодической спирали: от журнала химии через промышленность к маятнику Фуко. Вестник истории химии. Том. 34, № 2, 2009, с. 141.
База данных: Интернет-база данных периодических таблиц, составленная Марком Р. Личем.
Книга: Мазурс, Эдуард Г. Графические изображения периодической системы за сто лет. (первое изд. 1957 г., 2 и изд. 1974 г.), The University of Alabama Press,
Journal: JE Clausen. Космическая модель периодической системы элементов. Журнал химического образования. Том. 29, 1 мая 1952 г., с. 250. doi: 10.1021/ed029p250.
Том. 29, 1 мая 1952 г., с. 250. doi: 10.1021/ed029p250.
Wordfind
периодическая таблица | Определение, элементы, группы, сборы, тенденции и факты
таблица Менделеева
Просмотреть все СМИ
- Ключевые люди:
- Дмитрий Менделеев Лотар Мейер Поль-Эмиль Лекок де Буабодран
- Похожие темы:
- химический элемент атом группа периодический закон период
Просмотреть весь связанный контент →
Популярные вопросы
Что такое периодическая таблица?
Периодическая таблица представляет собой табличный массив химических элементов, упорядоченных по атомному номеру, от элемента с наименьшим атомным номером, водорода, до элемента с наибольшим атомным номером, оганесона. Атомный номер элемента — это число протонов в ядре атома этого элемента. У водорода 1 протон, у оганесона 118.
Что общего у групп периодической таблицы?
Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18. Элементы в группе имеют очень похожие химические свойства, которые возникают из-за количества присутствующих валентных электронов, то есть количества электронов в внешняя оболочка атома.
Элементы в группе имеют очень похожие химические свойства, которые возникают из-за количества присутствующих валентных электронов, то есть количества электронов в внешняя оболочка атома.
Откуда взялась периодическая таблица?
Расположение элементов в периодической таблице определяется электронной конфигурацией элементов. Из-за принципа запрета Паули не более двух электронов могут занимать одну и ту же орбиталь. Первый ряд периодической таблицы состоит всего из двух элементов, водорода и гелия. Чем больше у атомов электронов, тем больше у них орбит, доступных для заполнения, и, таким образом, строки содержат больше элементов в нижней части таблицы.
Почему таблица Менделеева делится?
Периодическая таблица имеет две строки внизу, которые обычно отделены от основной части таблицы. Эти ряды содержат элементы лантаноидного и актиноидного рядов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (актиний до лоуренсия) соответственно. Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Для этого нет никаких научных оснований. Это просто сделано для того, чтобы сделать таблицу более компактной.
Сводка
Прочтите краткий обзор этой темы
периодическая таблица , полная периодическая таблица элементов , в химии упорядоченный массив всех химических элементов в порядке возрастания атомного номера, т. е. общее количество протонов в атомном ядре. Когда химические элементы расположены таким образом, в их свойствах возникает повторяющаяся закономерность, называемая «периодическим законом», при которой элементы в одном столбце (группе) обладают сходными свойствами. Первоначальное открытие, которое сделал Д.И. Менделеев в середине 19ХХ века, сыграл неоценимую роль в развитии химии.
Изучите периодический закон химии, чтобы понять свойства элементов и то, как они связаны друг с другом их атомных номеров, целые числа которых равны положительным электрическим зарядам атомных ядер, выраженным в электронных единицах. В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронной структуры атомов и молекул. Это разъяснение повысило ценность закона, который сегодня используется так же часто, как и в начале 20-го века, когда он выражал единственную известную взаимосвязь между элементами.
История периодического закона
Узнайте, как устроена таблица Менделеева
Просмотреть все видео к этой статье В первые годы 19 века наблюдалось бурное развитие аналитической химии — искусства различать различные химические вещества — и, как следствие, накопление обширных знаний о химических и физических свойствах как элементов, так и соединений. Это быстрое распространение химических знаний вскоре вызвало необходимость классификации, ибо на классификации химических знаний основана не только систематизированная литература по химии, но и лабораторное искусство, с помощью которого химия как живая наука передается от одного поколения химиков к другому. Отношения между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отставала от классификации соединений. Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Отношения между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отставала от классификации соединений. Фактически, среди химиков не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общеупотребительными.
Дж.В. Доберейнер в 1817 году показал, что совокупный вес, то есть атомный вес, стронция находится посередине между весами кальция и бария, а несколько лет спустя он показал, что существуют и другие подобные «триады» (хлор, бром и йод [галогены] и литий, натрий и калий [щелочные металлы]). Ж.-Б.-А. Дюма, Л. Гмелин, Э. Ленссен, Макс фон Петтенкофер и Дж. П. Кук расширили предположения Доберейнера между 1827 и 1858 годами, показав, что подобные отношения простираются дальше, чем триады элементов: фтор добавляется к галогенам, а магний — к щелочноземельным. металлы, в то время как кислород, сера, селен и теллур были отнесены к одному семейству, а азот, фосфор, мышьяк, сурьма и висмут – к другому семейству элементов.
Britannica Викторина
118 Названий и символов периодической таблицы Викторина
Периодическая таблица состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Позднее были предприняты попытки показать, что атомные веса элементов могут быть выражены арифметической функцией, и в 1862 г. А.-Э.-Б. де Шанкуртуа предложил классификацию элементов, основанную на новых значениях атомных весов, данных системой Станислао Канниццаро 1858 года. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород. Получившаяся винтовая кривая перенесла тесно связанные элементы в соответствующие точки цилиндра, расположенные выше или ниже друг друга, и, следовательно, он предположил, что «свойства элементов — это свойства чисел» — замечательное предсказание в свете современных знаний.
Классификация элементов
В 1864 г. Я.А.Р. Ньюлендс предложил классифицировать элементы в порядке увеличения атомного веса, при этом элементам присваивались порядковые номера от единицы и вверх, и они были разделены на семь групп, обладающих свойствами, тесно связанными с первыми семью из известных тогда элементов: водород, литий, бериллий, бор, углерод. , азот и кислород. Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Затем, в 1869 г., в результате обширной корреляции свойств и атомных весов элементов, с особым вниманием к валентности (то есть числу одинарных связей, которые может образовать элемент), Менделеев предложил периодическую закон, согласно которому «элементы, расположенные по величине атомного веса, обнаруживают периодическое изменение свойств». Лотар Мейер независимо пришел к аналогичному заключению, опубликованному после выхода статьи Менделеева.
Как читать периодическую таблицу элементов
Revolutionized поддерживается читателями. Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Узнайте больше здесь.
Периодическая таблица элементов содержит строительные блоки, из которых состоят объекты в нашем мире. Вода представляет собой комбинацию атомов водорода и кислорода. Атомы углерода есть во всех живых существах. По состоянию на 2016 год периодическая таблица содержит 118 уникальных элементов. Ученые пытаются создавать новые элементы с помощью акселерометров частиц, но это может оказаться сложным процессом. Как только вы познакомитесь с ключом элемента, расположением и структурой, вам будет легко читать периодическую таблицу.
Что такое ключ элемента?
Поле, содержащее информацию о каждом элементе, называется ключом элемента. Каждый ключ содержит название элемента, уникальный символ, атомный вес и атомный номер. Кислород, например, имеет атомный номер 8, атомный вес 15,996 и уникальный символ O. . О чем говорит нам каждый из этих разделов ключа элемента?
. О чем говорит нам каждый из этих разделов ключа элемента?
Атомный номер
Атомный номер элемента позволяет узнать, сколько протонов содержится в ядре и сколько электронов вращается вокруг него. В случае с кислородом это говорит о том, что в центре каждого атома есть восемь положительных протонов и восемь отрицательных электронов, вращающихся вокруг него. Каждому элементу периодической таблицы присвоен атомный номер. Он не только позволяет считать протоны и электроны, но и определяет место элемента в таблице.
Атомная масса
Атомная масса — это число, расположенное в нижней части ключа элемента. Это число представляет собой среднюю массу изотопов элемента, включая все электроны, протоны и нейтроны. Изотопы имеют одинаковое количество протонов, но разное количество нейтронов.
Ученые создали элементы с 93 по 118 в лаборатории. Эти искусственные элементы не существуют в природе и не существуют дольше нескольких миллисекунд за раз. Атомный вес этих элементов основан на элементе, который просуществовал дольше всего, когда он был создан. Будущие исследования могут изменить указанный атомный вес этих элементов.
Эти искусственные элементы не существуют в природе и не существуют дольше нескольких миллисекунд за раз. Атомный вес этих элементов основан на элементе, который просуществовал дольше всего, когда он был создан. Будущие исследования могут изменить указанный атомный вес этих элементов.
Символ атома
Наконец, имя элемента определяет символ атома. В большинстве случаев, как кислород или углерод, это просто первая буква названия элемента. В других, таких как калий или ртуть, ученым приходится оглянуться назад в историю. Калий имеет обозначение K из-за своего неолатинского названия — Kalium. Ртуть имеет обозначение Hg из-за своего греческого названия — Hydrargyrum, что означает «жидкое серебро». Серебро между тем имеет обозначение Ag , по латинскому названию — Argentum, которое позже стало французским словом для того же цвета: argent. Сколько элементов вы можете угадать, просто взглянув на их атомный символ?
Классификация элементов помогает читать периодическую таблицу
Структура периодической таблицы может показаться случайному наблюдателю странной, но ее дизайн служит определенной цели. Каждый элемент расположен в соответствии с его атомным весом и номером. Вертикальные столбцы групп , а горизонтальные строки периодов .
Каждый элемент расположен в соответствии с его атомным весом и номером. Вертикальные столбцы групп , а горизонтальные строки периодов .
Группа
Элементы сгруппированы в столбцы на основе их химических свойств. Каждая колонка обозначается римской цифрой или, в современных таблицах, арабской цифрой. Это количество электронов, которые элемент имеет на своей внешней оболочке, которые известны как валентные электроны.
Валентные электроны — это количество электронов, которое элемент имеет в наличии для связи с другими элементами для образования молекул.
Группа 1 состоит из щелочных металлов — таких веществ, как натрий, калий и цезий, которые не так плотны, как другие металлы, и обладают высокой реакционной способностью. Некоторые из них даже взрываются при контакте с водой или воздухом.
Группа 2 включает щелочноземельные металлы, такие как кальций и магний, которые легко связываются. Их атомы меньше, чем в группе 1.
Их атомы меньше, чем в группе 1.
Группы с 3 по 12 — это переходные металлы. Эта группа составляет большую часть таблицы Менделеева. В крайнем правом углу вы найдете некоторые металлы, а также металлоиды и неметаллы. Наиболее распространенными неметаллами являются группа 17, галогены и группа 18, благородные газы, которые ни с чем не связываются.
Хотите узнать больше об одной из этих групп? Ознакомьтесь с нашей серией «Повседневное использование элементов», чтобы узнать больше о свойствах, характеристиках и распространенном использовании группы:
Щелочные металлы | Щелочноземельные металлы | Переходные металлы | Актиниды | Лантаниды | Основные металлы | Металлоиды | Неметаллы | Галогены | Благородные газы
Период
Ядро каждого элемента окружено оболочкой, которая может содержать только определенное количество электронов. Элементы в периодической таблице разбиты на строки в зависимости от количества имеющихся у них оболочек.
Неон находится во втором ряду или точке, что означает, что у него две оболочки. Первая оболочка может содержать только два электрона, а вторая оболочка может содержать до восьми электронов, всего 10.
Первая оболочка может содержать только два электрона, а вторая оболочка может содержать до восьми электронов, всего 10.
В нижней части периодической таблицы находятся лантаноиды и актиноиды. У всех лантаноидов атомный номер больше, чем у лантана, и почти все они представляют собой мягкие серебристые металлы. Актиниды находятся в самом нижнем ряду периодической таблицы, и все они имеют атомные номера выше, чем у актиния. Каждый из этих элементов очень радиоактивен.
Цветовое кодирование
Чтобы облегчить чтение периодической таблицы, современные версии включают цветовое кодирование. Каждый цвет разбивает элементы на разные группы. Элементы с 57 по 71 и с 89 по 103 расположены в отдельных строках, чтобы улучшить читаемость.
Периодические тренды
Как только вы научитесь читать периодическую таблицу, вам станет легче видеть представленные в ней тренды. Например, если вы будете следовать таблице слева направо, вы увидите, что электроотрицательность увеличивается. Электроотрицательность возникает, когда валентная оболочка, несущая электроны, заполнена менее чем наполовину.
Электроотрицательность возникает, когда валентная оболочка, несущая электроны, заполнена менее чем наполовину.
Движение сверху вниз показывает уменьшение электроотрицательности. Это не относится к инертным газам, которые всегда имеют полную валентную оболочку, а также к лантаноидам и актиноидам в нижней части таблицы.
Движение справа налево показывает увеличение атомного радиуса или расстояния между ядром элемента и его валентными оболочками. Элементы группы 1 имеют наибольший радиус, а благородные газы — наименьший.
Этот радиус также увеличивается по мере продвижения от верхней части таблицы к нижней. Движение в этом направлении также показывает увеличение металлических характеристик — чем левее вы перемещаетесь по диаграмме, тем более металлическими становятся элементы. Благородные газы, которые явно неметаллические, находятся в крайнем правом углу, а щелочные металлы — в крайнем левом.
Используя приведенное выше руководство, вы сможете легко и быстро прочитать периодическую таблицу!
Почему таблица Менделеева выглядит именно так? Ознакомьтесь с моей последней статьей
Кто создал периодическую таблицу и почему? , чтобы увидеть, как выглядели исторические таблицы Менделеева. Вы не поверите, какими разными они были! Эта статья впервые опубликована 27.10.2017. Впервые мы обновили его 18 февраля 2019 г., чтобы включить больше информации о периодической таблице, ее классификациях и тенденциях. Статья так же обновлена 23.12.2019улучшить оформление рубрики и 10.07.2020 добавить недостающие ресурсы об актинидах и лантаноидах .
Вы не поверите, какими разными они были! Эта статья впервые опубликована 27.10.2017. Впервые мы обновили его 18 февраля 2019 г., чтобы включить больше информации о периодической таблице, ее классификациях и тенденциях. Статья так же обновлена 23.12.2019улучшить оформление рубрики и 10.07.2020 добавить недостающие ресурсы об актинидах и лантаноидах .Revolutionized поддерживается читателями. Когда вы покупаете по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Узнайте больше здесь.
Периодическая таблица элементов — ИЮПАК
Последний выпуск Периодической таблицы (от 4 мая 2022 г.) включает самые последние сокращенные стандартные значения атомного веса, опубликованные Комиссией ИЮПАК по изотопному содержанию и атомному весу (CIAAW). , составленный как часть Таблицы стандартных атомных весов 2021 г. . Для элементов, у которых отсутствуют изотопы с характерным изотопным содержанием в природных земных образцах, массовое число нуклида с самым длинным подтвержденным периодом полураспада указано в квадратных скобках. См. PAC (AOP, 4 мая 2022 г.; https://doi.org/10.1515/pac-2019).-0603) для получения полной информации или посетите сайт Commission II.1 @ciaaw.org
См. PAC (AOP, 4 мая 2022 г.; https://doi.org/10.1515/pac-2019).-0603) для получения полной информации или посетите сайт Commission II.1 @ciaaw.org
Загрузите версию в формате PDF (размер Letter или A4) или A3 (PDF) или см. более ранние версии
Ознакомьтесь со SPECIAL Chem Int Январь 2019 г. — Международный год Периодической таблицы (МГПТ) — при участии Яна Ридейка, Натальи Тарасовой, Г.Дж. Ли, Сигурд Хофманн, Эрик Шерри, Юрис Мейя, Норман Э. Холден, Тайлер Б. Коплен, Питер Махаффи, Ян Миллс, Роберто Марквардт и другие.
Периодическая таблица элементов и изотопов IUPAC (IPTEI) для образовательного сообщества
— следуйте проекту IUPAC 2007-038-3-200 и последующему проекту 2014-024-1-200
— читайте «Атомные массы: нет Longer Constants of Nature», Chem Int 33(2), 10–15 (2011), https://doi.org/10.1515/ci.2011.33.2.10
— ознакомьтесь с интерактивной версией на iupac.org/isotopes- материя (или см. выпуск)
выпуск)
– Узнайте больше, почему изотопы имеют значение! https://iupac.org/100/stories/why-isotopes-matter/
— Ознакомьтесь с последним поэлементным обзором IPTEI, включая таблицу всех известных стабильных и радиоактивных изотопов для каждого элемента и примеры практического применения изотопных измерений и технологий https://iupac.org/iptei/
— Доступ по адресу http: //ciaaw.org/periodic-table-isotopes.htm полное разрешение этой таблицы в формате PDF (предоставлено Королевским центром визуализации в науке).
Благодаря своей работе, связанной с химическими элементами, ИЮПАК может выпускать обновленную периодическую таблицу. Участие IUPAC охватывает различные аспекты таблицы и данных, которые она раскрывает, и несколько отчетов и рекомендаций, некоторые из которых совсем недавно, свидетельствуют об этом вкладе.
В частности, ИЮПАК непосредственно участвует в следующем:
- установление критериев для открытия нового элемента
- определение структуры временного имени и символа
- оценка требований, приводящих к проверке и присвоению открытия элемента
- координирует присвоение имени новому элементу, включает исследовательскую лабораторию и допускает общественное обсуждение
- создание точных правил для как назвать новый элемент
- определение групп 1-18 и собирательных имен
- определение того, какие элементы относятся к группе 3
- регулярный пересмотр стандартных атомных весов
Таблица принадлежит вам, чтобы использовать . Подробная информация о последнем выпуске представлена выше . Подробная информация ниже содержит несколько ссылок на журнал IUPAC в Pure and Applied Chemistry 9.0008 ( PAC ) и журнал Chemistry International ( CI ).
Подробная информация о последнем выпуске представлена выше . Подробная информация ниже содержит несколько ссылок на журнал IUPAC в Pure and Applied Chemistry 9.0008 ( PAC ) и журнал Chemistry International ( CI ).
- Критерии открытия нового элемента
Оценка того, был ли элемент «обнаружен», — непростая задача. При рассмотрении профилей открытия трансфермиевых элементов в начале 90-х годов IUPAC и IUPAP установили ряд критериев, которые должны быть выполнены для признания открытия элемента. Подробности в PAC 1991, Vol. 63, № 6, стр. 879-886 (https://doi.org/10.1351/pac199163060879) и PAC 1993, Vol. 65, № 8, стр. 1757-1814 (https://doi.org/10.1351/pac199365081757)
В ноябре 2018 г. IUPAC/IUPAP выпустил предварительный отчет ОБ ОТКРЫТИИ НОВЫХ ЭЛЕМЕНТОВ. Представлены критерии и рекомендации по установлению приоритета открытия потенциальных новых элементов. — узнать больше
— узнать больше
- Временное название и условное обозначение
Несмотря на то, что элемент может быть заявлен, до того, как заявление будет подтверждено и до того, как элемент будет официально назван, элемент имеет временное имя и символ. Соответствующие рекомендации, устанавливающие эту систематическую номенклатуру, были опубликованы в 1978 г.; см. PAC 1979, Vol. 51, № 2, стр. 381-384; https://doi.org/10.1351/pac197951020381
В результате именно так в марте 2016 года 113-й элемент был назван унунтрием или с символом Uut.
История трехбуквенных символов изложена в статье, подготовленной Ларсом Эрстрёмом и Норманом Холденом и опубликованной в Chem Int 2016, Vol. 38, № 2, с. 4-8; https://doi.org/10.1515/ci-2016-0204
- Проверка и назначение обнаружения элемента
Заявления об открытии новых элементов время от времени появляются в научной литературе. IUPAC вместе с IUPAP участвует в оценке этих заявлений. В результате выпускаются технические отчеты IUPAC, в которых анализируются все соответствующие ссылки и признаются лаборатории(и), заявления которых соответствуют согласованным критериям.
IUPAC вместе с IUPAP участвует в оценке этих заявлений. В результате выпускаются технические отчеты IUPAC, в которых анализируются все соответствующие ссылки и признаются лаборатории(и), заявления которых соответствуют согласованным критериям.
В 2016 году было выпущено два таких отчета, которые охватывают элементы 113, 115, 117 и элемент 118; См. PAC 2016, Vol. 88, № 1-2, стр. 139-153; https://doi.org/10.1515/pac-2015-0502 и PAC 2016, Vol. 88, № 1-2, стр. 155-160; https://doi.org/10.1515/pac-2015-0501
- Именование нового элемента
После проверки обнаружения нового элемента и присвоения приоритета его обнаружения можно начинать процесс именования. Лаборатории, которой поручено открытие, предлагается предложить название и условное обозначение. Затем IUPAC рассмотрит предложение и, если оно будет согласовано, после дополнительного 5-месячного публичного рассмотрения, формализует название. Самый последний пример таких рекомендаций был опубликован в 2012 году и касался названий и символов элементов 114 и 116; См. PAC 2012, Том. 84, № 7, стр. 1669-1672; https://doi.org/10.1351/PAC-REC-11-12-03
Самый последний пример таких рекомендаций был опубликован в 2012 году и касался названий и символов элементов 114 и 116; См. PAC 2012, Том. 84, № 7, стр. 1669-1672; https://doi.org/10.1351/PAC-REC-11-12-03
Краткий обзор текущих процедур опубликован в недавней статье Джона Кориша; См. CI 2016, Vol. 38, № 2, стр. 9-11; https://doi.org/10.1515/ci-2016-0205
8 июня 2016 г. IUPAC опубликовал предварительные названия для последних 4 элементов 113, 115, 117 и 118 — см. объявил утвержденные названия и символы — см. релиз.
Для размышлений об опыте именования элементов в 2016 г. см. Chem Int , апрель 2017 г., стр. 30–21, автор Ян Ридейк; https://doi.org/10.1515/CI-2017-0222
См. Архивы с более ранним компиляцией и ссылками
- 99 2
-
-
- 7
- Группы 1-18 и собирательные имена
- Группа 3
- Стандартные атомные веса
- 7
- 7
- 7
Опять же, у IUPAC есть набор рекомендаций, определяющих, какое имя может носить элемент.
 И корень, и окончание должны соответствовать согласованным рекомендациям. Подробные рекомендации были опубликованы в 2002 г., а пересмотренная версия опубликована в 2016 г. для лучшего учета элементов в группах 17 и 18. См. 9.0007 PAC 2002, Том. 74, № 5, стр. 787-791; https://doi.org/10.1351/pac200274050787 и PAC 2016, Vol. 88, № 4, стр. 401-405 https://doi.org/10.1515/pac-2015-0802 (или https://iupac.org/project/2015-031-1-200)
И корень, и окончание должны соответствовать согласованным рекомендациям. Подробные рекомендации были опубликованы в 2002 г., а пересмотренная версия опубликована в 2016 г. для лучшего учета элементов в группах 17 и 18. См. 9.0007 PAC 2002, Том. 74, № 5, стр. 787-791; https://doi.org/10.1351/pac200274050787 и PAC 2016, Vol. 88, № 4, стр. 401-405 https://doi.org/10.1515/pac-2015-0802 (или https://iupac.org/project/2015-031-1-200)С 1988 г. IUPAC рекомендовал просто нумеровать группы (, т.е. . столбцы) от 1 до 18. ( PAC 1988, Vol. 60, No. орг/10.1351/pac198860030431)
Лантаноиды и актиноиды являются собирательными названиями, также рекомендованными IUPAC. Лантаноиды (от La до Lu) предпочтительнее лантанидов, и хотя лантаноид означает «подобный лантану» и поэтому не должен включать лантан, лантан, тем не менее, стал широко использоваться.
 Актиноиды включают от Ac до Lr.
Актиноиды включают от Ac до Lr. Время от времени обсуждался вопрос о том, какие именно элементы должны быть помещены в группу 3. Недавно был инициирован проект IUPAC для решения этого вопроса. Будет ли группа 3 состоять из Sc, Y, Lu и Lr или она будет состоять из Sc, Y, La и Ac?
Оставайтесь с нами и смотрите https://iupac.org/project/2015-039-2-200 и CI 2016, Vol. 38, № 2, стр. 22-23; https://doi.org/10.1515/ci-2016-0213
Одной из задач Комиссии по содержанию изотопов и атомному весу (CIAAW) является периодический пересмотр определений атомного веса. Самый последний отчет «Стандартные атомные веса элементов 2021» был опубликован в PAC в мае 2022 г. (AOP от 4 мая 2022 г.; https://doi.org/10.1515/pac-2019-0603)
Комиссия была создана в 1899 г. (да, в 1899 г.) Отделение неорганической химии ИЮПАК.
 (см. www.ciaaw.org) Он также регулярно рассматривает изотопные составы элементов; последняя компиляция также опубликована в PAC в марте 2016 г. ( PAC 2016, том 88, № 3, стр. 293–306; https://doi.org/10.1515/pac-2015-0503)
(см. www.ciaaw.org) Он также регулярно рассматривает изотопные составы элементов; последняя компиляция также опубликована в PAC в марте 2016 г. ( PAC 2016, том 88, № 3, стр. 293–306; https://doi.org/10.1515/pac-2015-0503)
.Ваш для использования
Хотя ИЮПАК не рекомендует конкретную форму периодической таблицы, т.е. . 18-колоночный или 32-колоночный формат, представленная здесь версия имеет обычную длинную форму и может использоваться вами.
Ознакомьтесь с предыдущими версиями.
Сколько элементов Периодической таблицы элементов встречается в природе?
`;
Ответ на вопрос, сколько объектов периодической таблицы элементов встречается в природе, на самом деле немного сложен.
 Общепринятое мнение гласит, что первые 92 элемента, от элемента 1, водорода, до элемента 92, урана, встречаются в природе, но на самом деле некоторые из этих элементов очень нестабильны, и их можно было наблюдать только тогда, когда они были созданы искусственно. Некоторые люди считают, что элементы 93 (нептуний) и 94 (плутоний) также должны быть включены в список встречающихся в природе элементов. В результате от 94 до 88 элементов являются «естественными», в зависимости от используемого определения.
Общепринятое мнение гласит, что первые 92 элемента, от элемента 1, водорода, до элемента 92, урана, встречаются в природе, но на самом деле некоторые из этих элементов очень нестабильны, и их можно было наблюдать только тогда, когда они были созданы искусственно. Некоторые люди считают, что элементы 93 (нептуний) и 94 (плутоний) также должны быть включены в список встречающихся в природе элементов. В результате от 94 до 88 элементов являются «естественными», в зависимости от используемого определения.Элементы считаются «естественно встречающимися», когда их можно найти в природе, а не создавать в лаборатории, и многие изображения периодической таблицы элементов включают разделительную линию между природными и искусственно созданными элементами.
 Некоторые встречающиеся в природе элементы имеют очень нестабильные изотопы или короткие периоды полураспада, поэтому они существуют на Земле лишь периодически и в очень небольших количествах. Некоторые люди считают, что, думая о периодической таблице, такие элементы не следует рассматривать как «естественно встречающиеся», тем более что они наблюдаются только как прямой результат человеческой деятельности. Другие утверждают, что, хотя в любой момент времени можно наблюдать лишь небольшие количества, они являются «естественными», потому что они может возникать спонтанно.
Некоторые встречающиеся в природе элементы имеют очень нестабильные изотопы или короткие периоды полураспада, поэтому они существуют на Земле лишь периодически и в очень небольших количествах. Некоторые люди считают, что, думая о периодической таблице, такие элементы не следует рассматривать как «естественно встречающиеся», тем более что они наблюдаются только как прямой результат человеческой деятельности. Другие утверждают, что, хотя в любой момент времени можно наблюдать лишь небольшие количества, они являются «естественными», потому что они может возникать спонтанно.Сомнительные элементы: элемент 43, технеций; элемент 61, прометий; элемент 85, астат; и элемент 87, франций.
 Элементы 43 и 61 несколько необычны, так как они окружены стабильными элементами, но их наблюдали только в контролируемых лабораторных условиях. Элементы 85 и 87 действительно появляются в природе, но ненадолго и очень редко, что затрудняет установление естественного внешнего вида этих застенчивых элементов.
Элементы 43 и 61 несколько необычны, так как они окружены стабильными элементами, но их наблюдали только в контролируемых лабораторных условиях. Элементы 85 и 87 действительно появляются в природе, но ненадолго и очень редко, что затрудняет установление естественного внешнего вида этих застенчивых элементов.Если все четыре сомнительных элемента вычеркнуты из списка «встречающихся в природе» элементов, останется либо 90 или 88 встречающихся в природе элементов, в зависимости от того, включены ли в список нептуний и плутоний. Некоторые люди также включают астат и франций, увеличивая общее количество до 92 или 90.
 Наиболее часто упоминаемое число — «92», которое можно рассматривать как первые 92 элемента в периодической таблице или первые 94 элемента минус 43 и 61, в зависимости от того, насколько сложными люди хотят быть.
Наиболее часто упоминаемое число — «92», которое можно рассматривать как первые 92 элемента в периодической таблице или первые 94 элемента минус 43 и 61, в зависимости от того, насколько сложными люди хотят быть.Людям важно помнить, что при взгляде на периодическую таблицу элементов «встречающийся в природе» не обязательно означает «обильный». Многие встречающиеся в природе элементы на самом деле довольно редки, хотя некоторые из них когда-то были более распространены. Уровни элементов также меняются в зависимости от того, где находится человек; гелий, например, редко встречается на Земле, но в изобилии вокруг Солнца.
Мэри МакМахон
С тех пор как несколько лет назад Мэри начала работать над сайтом, она приняла захватывающая задача быть исследователем и писателем AllTheScience. Мэри имеет степень по гуманитарным наукам в Годдард-колледже и проводит свободное время за чтением, приготовлением пищи и прогулками на свежем воздухе.
Мэри МакМахонС тех пор, как несколько лет назад она начала работать на сайте, Мэри приняла захватывающая задача быть исследователем и писателем AllTheScience.
 Мэри имеет степень по гуманитарным наукам в Годдард-колледже и
проводит свободное время за чтением, приготовлением пищи и прогулками на свежем воздухе.
Мэри имеет степень по гуманитарным наукам в Годдард-колледже и
проводит свободное время за чтением, приготовлением пищи и прогулками на свежем воздухе.В поисках идеальной периодической таблицы
Любой, кто посещал уроки естествознания в старшей школе, вероятно, может представить образ периодической таблицы элементов, внушительный набор разноцветных строк и столбцов, в котором упорядочены все известные химические элементы. Этот знакомый способ отображения строительных блоков Вселенной, безусловно, является самым распространенным, но это всего лишь один из бесчисленных возможных вариантов. И в поисках идеала химики предложили более 1000 других.
Версия, которую мы все знаем, обычно восходит к Дмитрию Менделееву, русскому химику, который считается главным первооткрывателем закона, давшего название таблице: периодичность.
 Центральным в нашем понимании химии является тот факт, что определенные химические свойства повторяются регулярно или периодически по мере того, как вы проходите ряд элементов. Каждый из этих элементов отличается от остальных своим атомным номером: сколько протонов находится в одном из его атомов. Элементы одного и того же столбца или «группы» в современной таблице выглядят и ведут себя одинаково.
Центральным в нашем понимании химии является тот факт, что определенные химические свойства повторяются регулярно или периодически по мере того, как вы проходите ряд элементов. Каждый из этих элементов отличается от остальных своим атомным номером: сколько протонов находится в одном из его атомов. Элементы одного и того же столбца или «группы» в современной таблице выглядят и ведут себя одинаково.В 1869 году, когда Менделеев опубликовал первую из своих многочисленных таблиц, он организовал ее таким образом, что просвечивали эти отношения между элементами. Прогрессия похожа на движение вверх по октавам на фортепиано, где каждая клавиша имеет сходство с другими через определенные промежутки времени. «Конечно, эти заметки не идентичны», — говорит Эрик Шерри, химик и философ химии из Калифорнийского университета в Лос-Анджелесе. «Но любой, у кого есть половина музыкального слуха, может сказать, что это одна и та же нота».
Менделеев больше, чем кто-либо из его современников, обладал «слухом» к элементам.
 Хотя ученые 19-го века знали лишь о нескольких десятках элементов (теперь ученые знают колоссальные 118), его прозрения, основанные на закономерностях, позволили ему сделать точные прогнозы относительно тех, которые еще предстоит открыть. Полтора века спустя, говорит Шерри, современная таблица, созданная на основе его изобретения, остается «конечным объектом для классификации».
Хотя ученые 19-го века знали лишь о нескольких десятках элементов (теперь ученые знают колоссальные 118), его прозрения, основанные на закономерностях, позволили ему сделать точные прогнозы относительно тех, которые еще предстоит открыть. Полтора века спустя, говорит Шерри, современная таблица, созданная на основе его изобретения, остается «конечным объектом для классификации».Российская марка, около 2009 г., изображает Дмитрия Менделеева на праздновании 175-летия со дня его рождения. (Фото: Ольга Попова/Shutterstock)
Загадочные периоды
Но Менделеев не был ни первым, ни последним словом в представлении о периодичности. Всего за несколько лет до этого французский геолог Александр-Эмиль Бегуйе де Шанкуртуа опубликовал свою собственную интерпретацию: сложную модель, в которой элементы располагались вдоль винтовой линии, огибающей цилиндр. В том же 1860-х годах английский химик Джон Ньюлендс первым упорядочил элементы по атомному весу — стратегия, которой Менделеев и другие следовали до начала 19 века.
 00-х годов, когда открытие атомных чисел представило более точную меру. И пока Менделеев трудился над своей таблицей, немецкий химик по имени Лотар Мейер был занят созданием удивительно похожей таблицы.
00-х годов, когда открытие атомных чисел представило более точную меру. И пока Менделеев трудился над своей таблицей, немецкий химик по имени Лотар Мейер был занят созданием удивительно похожей таблицы.Как правило, они были представлены в восьми колонках, потому что модели поведения, казалось, повторялись через каждые восемь элементов. Например, фтор (атомный номер 9) и хлор (атомный номер 17) непосредственно под ним являются высокореактивными газами. Но при ближайшем рассмотрении более тяжелые элементы вообще не следуют этой тенденции — после двух наборов по восемь элементов шаблон разнесен на 18 элементов; и после двух подходов по 18, с интервалом 32 элемента. Конструкции менделеевской эпохи так радикально отличаются от наших, потому что их изобретатели просто не могли понять механизм, лежащий в основе этой периодичности.
Благодаря датскому физику Нильсу Бору мы теперь знаем, что эти последовательности на самом деле определяются количеством электронов в одном атоме каждого элемента.
 Конфигурация этих электронов в самом внешнем слое атома, его валентной оболочке, объясняет умопомрачительное разнообразие химических реакций, которые могут происходить, когда они смешиваются с электронами атомов другого элемента. (И хлор, и фтор имеют по семь электронов на своих валентных оболочках.) Строки, расположенные дальше по периодической таблице, длиннее, потому что они содержат элементы с более крупными валентными оболочками и, следовательно, большим количеством электронов.
Конфигурация этих электронов в самом внешнем слое атома, его валентной оболочке, объясняет умопомрачительное разнообразие химических реакций, которые могут происходить, когда они смешиваются с электронами атомов другого элемента. (И хлор, и фтор имеют по семь электронов на своих валентных оболочках.) Строки, расположенные дальше по периодической таблице, длиннее, потому что они содержат элементы с более крупными валентными оболочками и, следовательно, большим количеством электронов.(Источник: Nerdist72/Shutterstock)
С появлением современной физики в начале 20-го века консенсус был основан на таблице из 18 столбцов. Это позволило разместить длинные четвертый и пятый периоды и переместить еще более длинные шестой и седьмой периоды, чтобы весь дисплей мог поместиться на одной странице. «Есть всевозможные социологические и исторические причины, по которым этот проект прижился», — говорит Шерри. Кажется, он удовлетворяет почти всех… хотя несколько стран, в том числе родина Менделеева, придерживаются версии с восемью столбцами.

Тем не менее, при всех достоинствах статус-кво имеет и недостатки. Наиболее очевидно, что он асимметричен; он улавливает периодичность элементов, но с первого взгляда это трудно определить. «Это неуклюжая форма с любой точки зрения», — говорит Шерри, указывая, в частности, на непослушный дуэт, который возглавляет список. «Всегда было несколько загадочно, что в обычной таблице Менделеева эти два элемента, водород и гелий, торчат, как башенки на башне». Между тем, так называемый f-блок, опущенный вниз, чтобы таблица имела разумную длину, выглядит как раздражающая сноска.
Стремление к совершенству
На протяжении десятилетий, несмотря на то, что 18-колоночная таблица широко использовалась в основных книгах по химии, некоторые ученые пытались ее улучшить. Латвийский химик Эдвард Мазурс собрал сотни, но некоторые из них заслуживают особого внимания. Например, в 1964 году немецкий химик Теодор Бенфей создал то, что часто называют «периодической улиткой». Его прекрасное спиралевидное детище подчеркивает непрерывность элементов, в отличие от резких разрывов в стандартной таблице, и выделяет место для еще не открытых суперактинидов.

“Периодическая улитка” Теодора Бенфея. (Источник: Wikimedia Commons, Alison Mackey/Discover)
И зачем ограничиваться двумя измерениями? Фернандо Дюфур, канадский химик, посвятил десятилетия совершенствованию своего ElemenTree, трехмерной структуры, похожей на сосну, в которой каждый период отмечен новым уровнем «ветвей». Его цитируют, говоря, что «третье измерение [для таблицы Менделеева] – это не вариант, а необходимость». Этот дизайн также выделяет больше взаимосвязей между элементами, чем версия с 18 столбцами, указывая связи по всем трем осям.
Более свежий ответ поступил от Валери Циммермана, американского инженера, который в 2006 году создал то, что он смело называет «идеальным расположением элементов». Известная как таблица ADOMAH, она представляет собой башню и организована вокруг четырех квантовых чисел, которые в совокупности описывают свойства электронных орбиталей и помогают предсказать конфигурацию электронов. Циммерман даже выткал эмблему на свитере.

Его таблица на самом деле получена из, возможно, самой популярной из всех альтернатив: левого шага. Первоначально предложено французским инженером Шарлем Жане в 1929, этот вдохновлен верой в глубокий порядок и симметрию природы. И для этого нужно лишь слегка перетасовать 18 столбцов — самое главное, переместив самый дальний левый столбец к правому краю. Перестроенный таким образом, неустойчивый горизонт превращается в аккуратную лестницу.
Помимо эстетического улучшения, этот вариант нравится физикам, потому что лучше соответствует порядку, в котором обычно заполняются электронные оболочки. Но многие химики отказываются от левого шага, потому что он смешивает гелий (который обычно остается сам по себе) с группой высокореактивных элементов. В этом смысле это кажется противоречащим всему, за что выступает периодичность. Гэри Катс, американский химик и сторонник левого шага, писал в 2001 году, что сочувственные обзоры «давно похоронены в литературе. Сегодняшние писатели, похоже, либо не знают о них, либо не хотят их признавать».

Периодическая таблица левого шага Чарльза Джанет. (Источник: Марк Р. Лич/The INTERNET Database of Periodic Tables)
Несколько видных голосов все еще говорят в его пользу. Шерри, со своей стороны, является фанатом и отмечает, что противоречивая позиция гелия еще может быть подтверждена — в 2017 году было обнаружено, что предположительно благородный газ образует стабильное соединение с натрием при высоком давлении. «В наши дни большой интерес вызывает этот стол, — говорит он. Однако в обозримом будущем 18-колоночная версия будет доминировать. Шерри недавно возглавил группу, которой было поручено внести изменения в Международный союз теоретической и прикладной химии, и сказал, что левый шаг даже не обсуждался. «Мы еще не осмелились рекомендовать это».
Будущее периодической таблицы
Имеет ли какое-то значение, в конце концов, то, как мы визуализируем периодическую таблицу? Шерри может видеть аргумент с обеих сторон. В своем заключительном слове во время лекции Zoom в марте он сказал: «На самом деле не имеет значения, представляем ли мы это как спираль, как часы, как плоский стол или как трехмерную пирамиду или что-то еще, потому что это одно и то же».

-
-

