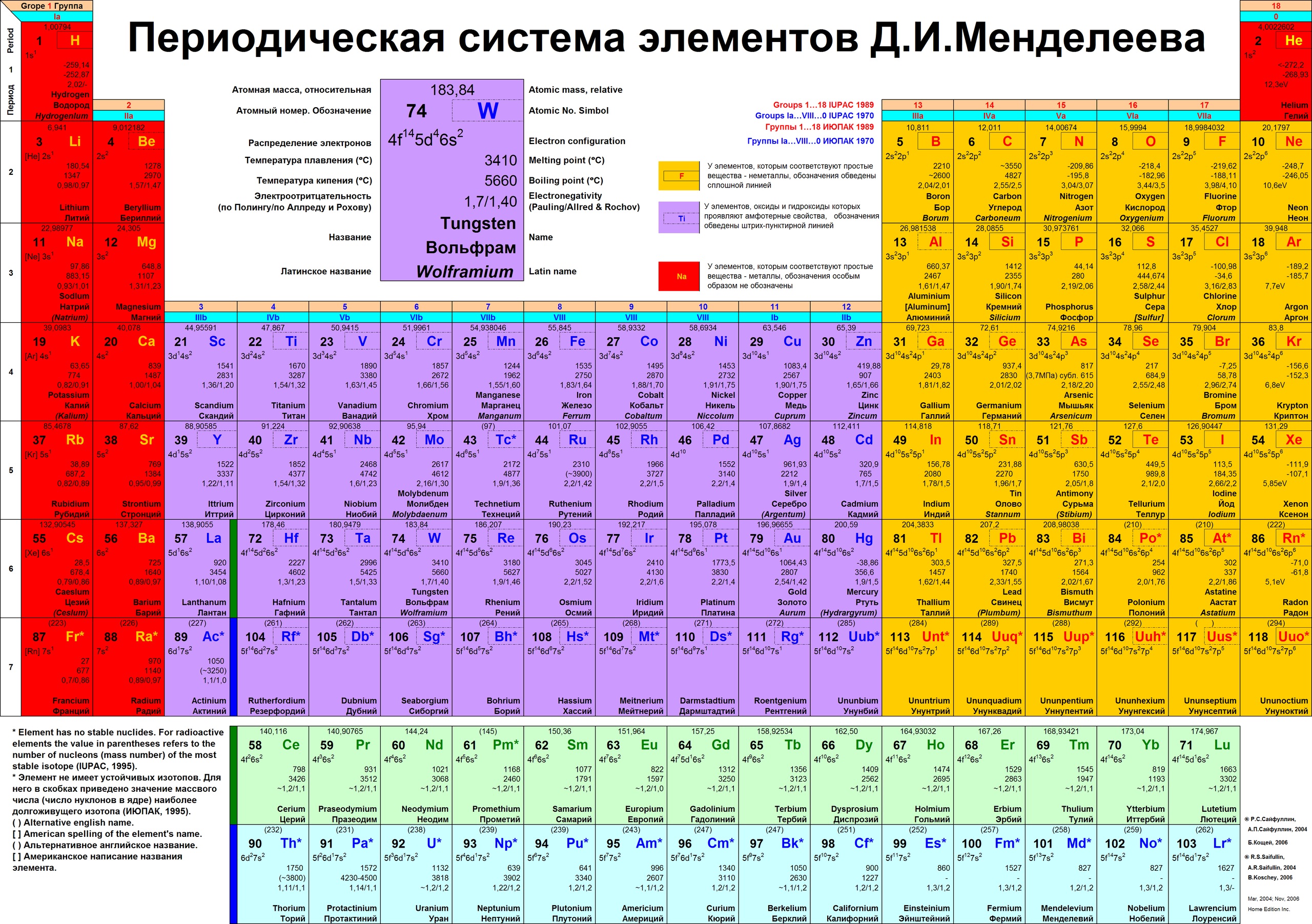
Второй период периодической системы – это… Что такое Второй период периодической системы?
Ко второ́му пери́оду периоди́ческой систе́мы относятся элементы второй строки (или второго периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в химических свойствах элементов при увеличении атомного числа: новая строка начинается тогда, когда химические свойства повторяются, что означает, что элементы с аналогичными свойствами попадают в один и тот же вертикальный столбец. Второй период содержит больше элементов, чем предыдущий, в него входят: литий, бериллий, бор, углерод, азот, кислород, фтор и неон. Данное положение объясняется современной теорией строения атома.
Элементы
Литий
Литий (Li) является химическим элементом с атомным номером 3, встречающимся в двух изотопах: 6Li и 7Li. При нормальной температуре и давлении литий — это серебристо-белый, мягкий щелочной металл с высокой реакционной способностью.
Согласно теории, Li является одним из немногих элементов, синтезированных в результате Большого Взрыва, вследствие чего его относят к списку изначальных элементов. Литий стоит на 33 месте среди самых распространённых элементов на Земле,[3] встречаясь в концентрациях от 20 до 70 миллионных долей по весу,[4] но из-за его высокой реакционной способности в природе он встречается только в виде соединений. Наиболее богатым источником литий-содержащих соединений являются гранитные пегматиты, а также сподумен и петалит, которые являются наиболее коммерчески целесообразными источниками этого элемента.
Наиболее богатым источником литий-содержащих соединений являются гранитные пегматиты, а также сподумен и петалит, которые являются наиболее коммерчески целесообразными источниками этого элемента.
Соли лития используются в фармакологической промышленности как лекарственное средство для стабилизации настроения.[5][6] Они используются также при лечении биполярного расстройства, где играют определённую роль в лечении депрессии и мании, и могут уменьшить шансы суицида.[7] Наиболее распространёнными из применяемых соединений лития являются карбонат лития Li2CO3, цитрат лития Li3C6H5O7, сульфат лития Li2SO4 и оротат лития LiC5
 [1]
[1]Бериллий
Бериллий (Be) является химическим элементом с атомным номером 4, существующем в виде 9Be. При нормальной температуре и давлении бериллий является твёрдым, лёгким, хрупким, двухвалентным щёлочноземельным металлом серо-стального цвета, с плотностью 1,85 г/см−3
Небольшое количество атомов бериллия было синтезировано во время Большого Взрыва, хотя большинство из них распались или участвовали в дальнейшем в атомных реакциях при создания более крупных ядер, таких как углерод, азот и кислород.
Благодаря высокой жёсткости, легкому весу и стабильности размеров в широком диапазоне температур, металлический бериллий используется в качестве конструкционного материала в авиации, ракетной технике и спутниковой связи. [8] Он используется в качестве легирующей добавки в бериллиевой бронзе, которая используется в электрических компонентах ввиду её высокой электро- и теплопроводности.[9] Листы бериллия используются в рентгеновских детекторах для фильтрации видимого света и пропуска только рентгеновских лучей.
[8] Он используется в качестве легирующей добавки в бериллиевой бронзе, которая используется в электрических компонентах ввиду её высокой электро- и теплопроводности.[9] Листы бериллия используются в рентгеновских детекторах для фильтрации видимого света и пропуска только рентгеновских лучей.
Бериллий и его соединения отнесены Международным агентством по изучению рака к 1 группе канцерогенов. Они обладают канцерогенными свойствами как для людей, так и для животных.[11] Хронический бериллиоз является лёгочным, гранулематозным заболеванием большого круга кровообращения, вызванным воздействием бериллия. Приблизительно 1% – 15% людей чувствительны к бериллию, и у них могут развиться воспалительные реакции дыхательной системы и кожи, которые называются хронической бериллиевой болезнью или бериллиозом.
Бор
Основная статья: БорБор (B) является химическим элементом с атомным номером 5, существующем в виде  Бор имеет плотность 2.34−3.[13]
Бор имеет плотность 2.34−3.[13]
 Небольшое количество чистого бора можно получить путём термического разложения метила бора BBr3 в газообразном водороде над горячей проволокой из тантала, который действует в качестве катализатора.[13] Коммерчески наиболее важными источниками бора являются: пентагидрат тетрабората натрия Na
Небольшое количество чистого бора можно получить путём термического разложения метила бора BBr3 в газообразном водороде над горячей проволокой из тантала, который действует в качестве катализатора.[13] Коммерчески наиболее важными источниками бора являются: пентагидрат тетрабората натрия Na [14]
[14]Бор является одним из важнейших микроэлементов растений, необходимый для создания и роста прочных клеточных мембран, деления клеток, развития семян и плодов, транспортировки сахар и развития гормонов.[18][19] Однако концентрация его в почве более 1.0 мд может вызвать некроз листьев и плохой рост. Уровень около 0.8 мд может вызвать эти же симптомы у растений особенно чувствительных к бору. У большинства растений, даже не слишком чуствительных к наличию бора в почве, признаки отравления бором появляются при уровне выше 1.8 мд.[14] В организме животных бор является ультраразличимым элементом (англ.). В диете человека ежедневный приём составляет 2.1-4.3 мг бора в день на килограмм массы тела.[20] Он также используется как добавка для профилактики и лечения остеопороза и артрита.[21]
Углерод
Углерод (C) является химическим элементом с атомным номером 6, встречающемся в природе в виде 12C, 13C и 14C. [22] При нормальной температуре и давлении углерод является твёрдым веществом, существующем в различных аллотропных формах, наиболее распространенными из которых являются графит, алмаз, фуллерены и аморфный углерод.[22] Графит — мягкий, матово-чёрный полуметалл с гексагональной кристаллической решёткой, с очень хорошими проводящими и термодинамически стабильными свойствами. Алмаз имеет весьма прозрачные бесцветные кристаллы с кубической решёткой и с плохими проводящими свойствами, он является самым твёрдым из известных естественных минералов и имеет самый высокий показатель преломления среди всех драгоценных камней. В отличие от структур алмаза и графита типа кристаллической решётки, фуллерены, названные в честь Ричарда Бакминстера Фуллера, являются веществами, архитектура которых напоминает молекулы. Есть несколько различных фуллеренов, наиболее известным из которых является «бакминстерфуллерен» C60, название которого также связано с именем Ричарда Бакминстера Фуллера.
[22] При нормальной температуре и давлении углерод является твёрдым веществом, существующем в различных аллотропных формах, наиболее распространенными из которых являются графит, алмаз, фуллерены и аморфный углерод.[22] Графит — мягкий, матово-чёрный полуметалл с гексагональной кристаллической решёткой, с очень хорошими проводящими и термодинамически стабильными свойствами. Алмаз имеет весьма прозрачные бесцветные кристаллы с кубической решёткой и с плохими проводящими свойствами, он является самым твёрдым из известных естественных минералов и имеет самый высокий показатель преломления среди всех драгоценных камней. В отличие от структур алмаза и графита типа кристаллической решётки, фуллерены, названные в честь Ричарда Бакминстера Фуллера, являются веществами, архитектура которых напоминает молекулы. Есть несколько различных фуллеренов, наиболее известным из которых является «бакминстерфуллерен» C60, название которого также связано с именем Ричарда Бакминстера Фуллера. Пространственная структура этого фуллерена напоминает геодезический купол, изобретённый Фуллером. О фуллеренах известно пока немного, они являются предметом интенсивных исследований.[22] Существует также аморфный углерод, который не имеет кристаллической структуры.[23] В минералогии этот термин используется для ссылки на сажу и уголь, хотя они не являются строго аморфными, поскольку содержат небольшое количество графита или алмаза.[24][25] Наиболее распространённым изотопом углерода является 12C с шестью протонами и шестью нейтронами (98,9% от общего количества).[26] Стабилен также изотоп 13C с шестью протонами и семью нейтронами (1,1%).[26] Ничтожные количества 14C также встречаются в природе, но этот изотоп является радиоактивным и распадается с периодом полураспада 5730 лет. Он используется в методе радиоуглеродного датирования.[27] Искусственно синтезированы также другие изотопы углерода.
Пространственная структура этого фуллерена напоминает геодезический купол, изобретённый Фуллером. О фуллеренах известно пока немного, они являются предметом интенсивных исследований.[22] Существует также аморфный углерод, который не имеет кристаллической структуры.[23] В минералогии этот термин используется для ссылки на сажу и уголь, хотя они не являются строго аморфными, поскольку содержат небольшое количество графита или алмаза.[24][25] Наиболее распространённым изотопом углерода является 12C с шестью протонами и шестью нейтронами (98,9% от общего количества).[26] Стабилен также изотоп 13C с шестью протонами и семью нейтронами (1,1%).[26] Ничтожные количества 14C также встречаются в природе, но этот изотоп является радиоактивным и распадается с периодом полураспада 5730 лет. Он используется в методе радиоуглеродного датирования.[27] Искусственно синтезированы также другие изотопы углерода. Углерод образует ковалентные связи с другими неметаллами со степенью окисления -4, -2, +2 и +4.[22]
Углерод образует ковалентные связи с другими неметаллами со степенью окисления -4, -2, +2 и +4.[22]
Углерод является четвёртым по распространённости элементом во Вселенной по массе после водорода, гелия и кислорода,[28] вторым в организме человека по массе после кислорода[29] и третьим по числу атомов.[30] Существует чуть ли не бесконечное число соединений, содержащих углерод, благодаря способности углерода к образованию стабильной связи C — С.[31][32] Простейшими углеродосодержащими молекулами являются углеводороды,[31] которые включают углерод и водород, хотя иногда они содержат в функциональных группах и другие элементы. Углеводороды используются в качестве топлива, для производства пластмасс и в нефтехимии. Все органические соединения, необходимые для жизни, содержат по меньшей мере один атом углерода.[31][32] В соединении с кислородом и водородом углерод может образовывать многие группы важных биологических соединений,[32] включая сахара, лигнаны, хитины, спирты, жиры и ароматические эфиры, каротиноиды и терпены. С азотом он образует алкалоиды, а с добавлением серы формирует антибиотики, аминокислоты и резину. С добавлением фосфора к этим элементам углерод формирует ДНК и РНК, химические коды носителей жизни, и аденозинтрифосфаты (АТФ), являющиеся наиболее важными переносчиками энергии для молекул во всех живых клетках.[32]
С азотом он образует алкалоиды, а с добавлением серы формирует антибиотики, аминокислоты и резину. С добавлением фосфора к этим элементам углерод формирует ДНК и РНК, химические коды носителей жизни, и аденозинтрифосфаты (АТФ), являющиеся наиболее важными переносчиками энергии для молекул во всех живых клетках.[32]
Азот
Азот (N) является химическим элементом с атомным номером семь и атомной массой 14,00674. При стандартных условиях азот в природе представляет собой инертный двухатомный газ без цвета, вкуса и запаха, составляющий 78,08% от объёма атмосферы Земли. Азот был открыт как составная компонента воздуха шотландским врачом Даниэлем Резерфордом в 1772 году.[33] В природе он встречается в виде двух изотопов: азот-14 и азот-15.[34]
Многие важные для промышленности вещества, такие как аммиак, азотная кислота, органические нитраты (ракетное топливо, взрывчатые вещества) и цианиды, содержат азот. В химии элементарного азота преобладает чрезвычайно сильная химическая связь, в результате чего возникают трудности как для организмов, так и при промышленном производстве в разрушении этой связи при преобразовании молекулы N2 в полезные соединения. Но в то же время такое успешное преобразование вызывает потом высвобождение большого количества энергии, если такие соединения сжечь, взорвать или другим способом преобразовать азот обратно в газообразное двухатомное состояние.
Но в то же время такое успешное преобразование вызывает потом высвобождение большого количества энергии, если такие соединения сжечь, взорвать или другим способом преобразовать азот обратно в газообразное двухатомное состояние.
Азот присутствет во всех живых организмах, а круговорот азота описывает движение элемента из воздуха в биосферу и органические соединения, и затем обратно в атмосферу. Искусственно произведённые нитраты являются ключевыми ингредиентами промышленных удобрений, а также основными загрязняющими веществами при возникновении эвтрофикации водных систем. Азот является составной частью аминокислот, а, следовательно, белков и нуклеиновых кислот (ДНК и РНК). Он находится в химической структуре практически всех нейротрансмиттеров и является определяющим компонентом алкалоидов и биологических молекул, производимых многими организмами.[35]
Кислород
Кислород (O) является химическим элементом с атомным номером 8, встречающемся в природе в виде 16O, 17O and 18O, среди которых самым распространённым изотопом является 16O. [36]
[36]
Фтор
Фтор (F) является химическим элементом с атомным номером 9, имеющем единственный стабильный изотоп 19F.[37]
Неон
Неон (Ne) является химическим элементом с атомным номером 10, встречающемся в природе в виде 20Ne, 21Ne and 22Ne.[38]
Примечания
- ↑ 1 2 Lithium at WebElements.
- ↑ 1 2 Isotopes of Lithium. Berkley Lab, The Isotopes Project. Архивировано из первоисточника 31 июля 2012. Проверено 21 апреля 2008.
- ↑ Krebs Robert E. The History and Use of Our Earth’s Chemical Elements: A Reference Guide. — Westport, Conn.: Greenwood Press, 2006. — P. 47–50. — ISBN 0-313-33438-2
- ↑ 1 2 Kamienski et al. “Lithium and lithium compounds”.
 Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. Published online 2004. DOI:10.1002/0471238961.1209200811011309.a01.pub2
Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. Published online 2004. DOI:10.1002/0471238961.1209200811011309.a01.pub2 - ↑ Cade J. F. J. (1949). «Lithium salts in the treatment of psychotic excitement» (PDF). Medical Journal of Australia 2 (10): 349–52. PMID 18142718.
- ↑ P. B. Mitchell,D. Hadzi-Pavlovic (2000). «Lithium treatment for bipolar disorder» (PDF). Bulletin of the World Health Organization 78 (4): 515–7. PMID 10885179.
- ↑ Baldessarini RJ, Tondo L, Davis P, Pompili M, Goodwin FK, Hennen J (October 2006). «Decreased risk of suicides and attempts during long-term lithium treatment: a meta-analytic review.». Bipolar disorders 8 (5 Pt 2): 625–39. DOI:10.1111/j.1399-5618.2006.00344.x. PMID 17042835.
- ↑ 1 2 3 4 5 Beryllium at WebElements.

- ↑ Standards and properties of beryllium copper.
- ↑ Information about beryllium tweeters.
- ↑ IARC Monograph, Volume 58. International Agency for Research on Cancer (1993). Архивировано из первоисточника 31 июля 2012.
- ↑ Information about chronic beryllium disease.
- ↑ 1 2 3 Boron at WebElements.
- ↑ 1 2 3 Properties of boron.
- ↑ W.T.M.L. Fernando, L.C. O’Brien, P.F. Bernath Fourier Transform Spectroscopy: B4Σ−−X4Σ− (PDF). University of Arizona, Tucson. Архивировано из первоисточника 31 июля 2012.
- ↑ K.Q. Zhang, B.Guo, V. Braun, M. Dulick, P.F. Bernath Infrared Emission Spectroscopy of BF and AIF (PDF). University of Waterloo, Waterloo, Ontario. Архивировано из первоисточника 31 июля 2012.

- ↑ Compound Descriptions: B2F4. Landol Börnstein Substance/Property Index.
- ↑ Functions of Boron in Plant Nutrition (PDF). U.S. Borax Inc..(недоступная ссылка — история)
- ↑ Blevins, Dale G.; Lukaszewski, Krystyna M. (1998). «Functions of Boron in Plant Nutrition». Annual Review of Plant Physiology and Plant Molecular Biology 49: 481–500. DOI:10.1146/annurev.arplant.49.1.481. PMID 15012243.
- ↑ Zook EG and Lehman J. (1965). «850-5». J. Assoc. Off Agric. Chem 48.
- ↑ Boron. PDRhealth. Архивировано из первоисточника 24 мая 2008. Проверено 18 сентября 2008.
- ↑ 1 2 3 4 Carbon at WebElements.
- ↑ Amorphous carbon // IUPAC Compendium of Chemical Terminology. — 2nd. — International Union of Pure and Applied Chemistry, 1997.

- ↑ Vander Wal, R. (May 1996). «Soot Precursor Material: Spatial Location via Simultaneous LIF-LII Imaging and Characterization via TEM» (PDF). NASA Contractor Report (198469).
- ↑ diamond-like carbon films // IUPAC Compendium of Chemical Terminology. — 2nd. — International Union of Pure and Applied Chemistry, 1997.
- ↑ 1 2 Presentation about isotopes by Mahananda Dasgupta of the Department of Nuclear Physics at Australian National University.
- ↑ Plastino, W.; Kaihola, L.; Bartolomei, P.; Bella, F. (2001). «Cosmic Background Reduction In The Radiocarbon Measurement By Scintillation Spectrometry At The Underground Laboratory Of Gran Sasso» (PDF). Radiocarbon 43 (2A): 157–161.
- ↑ Ten most abundant elements in the universe, taken from The Top 10 of Everything, 2006, Russell Ash, page 10.
- ↑ Chang Raymond Chemistry, Ninth Edition.
 — McGraw-Hill, 2007. — P. 52. — ISBN 0-07-110595-6
— McGraw-Hill, 2007. — P. 52. — ISBN 0-07-110595-6 - ↑ Freitas Jr. Robert A. Nanomedicine,. — Landes Bioscience, 1999. — P. Tables 3-1 & 3-2. — ISBN 1570596808
- ↑ 1 2 3 Structure and Nomenclature of Hydrocarbons. Purdue University. Архивировано из первоисточника 31 июля 2012.
- ↑ 1 2 3 4 Alberts Bruce Molecular Biology of the Cell. — Garland Science.
- ↑ Lavoisier, Antoine Laurent Elements of chemistry, in a new systematic order: containing all the modern discoveries. — Courier Dover Publications, 1965. — P. 15.
- ↑ Nitrogen at WebElements.
- ↑ Rakov Vladimir A. Lightning: Physics and Effects. — Cambridge University Press, 2007. — P. 508. — ISBN 9780521035415
- ↑ Oxygen Nuclides / Isotopes.
 EnvironmentalChemistry.com.
EnvironmentalChemistry.com. - ↑ National Nuclear Data Center NuDat 2.1 database – fluorine-19. Brookhaven National Laboratory. Архивировано из первоисточника 31 июля 2012.
- ↑ Neon: Isotopes. Softciências. Архивировано из первоисточника 31 июля 2012.
Ссылки
Общественный смотр знаний по теме “Строение атома. Химический элемент”
Пусть зимний день с метелями
Не навевает грусть –
Таблицу Менделеева
Я знаю наизусть.
Зачем я ее выучил?
Могу сказать зачем.
В ней стройность и величие
Любимейших поэм,
Без многословья книжного
В ней смысла торжество,
И элемента лишнего
В ней нет ни одного.
В ней пробужденье дерева
И вешних льдинок хруст.
Таблицу Менделеева
Я знаю наизусть.(Н.Глазков)
Читая Менделеева
Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах.
Все – от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий.
Вокруг тебя творится мир живой:
Входи в него, вдыхай, руками трогай.
Ты знаешь газ легчайший водород.
В соединеньи с кислородом – это
Июньский дождь от всех своих щедрот,
Сентябрьские туманы на рассветах.
Кипит железо, серебро, сурьма
И темно-бурые растворы брома,
И кажется Вселенная сама
Одной лабораторией огромной.
Тут мало оптикой поможешь глазу,
Тут мысль пытливая всего верней.
Пылинку и увидишь-то не сразу –
Глубины мирозданья скрыты в ней.
Будь то вода, что поле оросила,
Будь то железо, медь или гранит –
Все страшную космическую силу,
Закованную в атомы хранит. (С.Щипачев)
Цель урока (образовательная): закрепить знания учащихся о составе атома, атомного ядра, об электронной оболочке атома, электронных и графических формулах, уметь характеризовать химический элемент по его положению в ПСХЭ Д.И.Менделеева.
Цель урока (воспитательная): показать единство материального мира. Патриотическое воспитание.
Цель урока (развивающая): подготовить учащихся к восприятию и изучению следующих тем курса 8-го класса (данная тема является основополагающей).
Оборудование: таблицы, ПСХЭ Д.И.Менделеева, модели «Строение атома».
Организационный момент.
Сегодня впервые у вас проводится урок-зачёт в форме общественного смотра знаний (ОСЗ). Цель ОСЗ – перечислить.
Цель ОСЗ – перечислить.
Проверять знания будут ученики 10-го класса (консультанты).
Председатель жюри – классный руководитель 8-го класса.
Все виды работ делаются на листочках, в правом углу пишется номер (из журнала).
Разминка по понятиям.
Разминку проводят ученики 3-го ряда (нападающие), отвечают ученики 1-го, 2-го ряда (защитники):
- Химический элемент
- Формы существования химического элемента
- Атом
- Протон
- Нейтрон
- Электрон
- Массовое число
- Изотоп
- Завершённый внешний уровень
- Незавершённый внешний уровень
- Внешний уровень
(За каждый правильный ответ – 1 балл, а ученик, задающий вопрос – 0,5 балла). Итак, разминка завершилась, ученики повторили основные понятия темы.
Домашняя творческая работа (сдать).
Домом, где живут химические элементы является Периодическая система химических элементов, создателем её является гениальный русский учёный Д. И.Менделеев.
И.Менделеев.
Вы подготовили стихи (смотри эпиграфы).
Рассказываем о строении Периодической системы химических элементов Д.И. Менделеева.
Открываем печатную тетрадь стр.13, упр.4.
4. Определите химические элементы по их положению в таблице Д. И. Менделеева. Запишите их названия, из первых букв которых вы составите название одного из элементов 4-го периода
(Приложение 1).
а) 5-й период, главная подгруппа VI |
|
|
|
|
|
|
б) 5-й период, главная подгруппа III группа |
|
|
|
|
|
в) 6-й период, главная подгруппа III группа |
|
|
|
|
|
|
г) 2-й период, главная подгруппа V группа |
|
|
|
|
д) 3-й период, главная подгруппа I группа |
|
|
|
|
|
|
Подобно этому заданию, составить свои 5 вопросов с ответами – адрес химического элемента (номер группы, период, номер квартиры), сдать консультантам.
- Строение атома (Приложение 2).
- Рассказать о строении атома.
- Как вычислить протоны, нейтроны, электроны, заряд ядра (Приложение 3).
- У доски расписать строение атома селена.
- Далее по вариантам.
I вариант
Элемент № 12
II вариант
Элемент № 15
Продолжаем разбирать строение атома.
- Как и где располагаются электроны в атоме.
- Как подсчитать число энергетических уровней.
- Число электронов на каждом уровне.
I вариант
Печатная тетрадь, упр. 3, стр. 21
Подчеркните электронные схемы, соответствующие атомам химических элементов второго периода Периодической таблицы Д. |
а) 2ē, 8ē, 2ē |
У |
б) 2ē, 5ē |
С |
|
в) 2ē, 2ē |
Е |
|
г) 2ē, 8ē, 8ē, 2ē |
С |
|
д) 2ē, 8ē |
Р |
|
е) 2ē |
Т |
|
ж) 2ē, 7ē |
А |
(Приложение 4).
II вариант
Печатная тетрадь, упр. 5, стр. 22
|
Подчеркните электронные схемы, соответствующие атомам химических элементов главной подгруппы II группы Периодической таблицы Д. И. Менделеева. Из букв, соответствующих правильным ответам, вы составите название одного из химических элементов VII группы |
а) 2ē, 1 ē |
У |
б) 2 ē, 8 ē, 2ē |
Ф |
|
в) 2ē |
И |
|
г) 2ē |
Т |
|
д) 2ē, 6ē |
Х |
|
е) 2ē, 2ē |
О |
|
ж) 2ē, 8ē, 18ē, 8ē, 2ē |
Р |
(Приложение 5).
Сдать печатные тетради.
Составление электронных и графических формул.
Вначале у доски все вместе составляем электронную и графическую формулы элемента № 11. Далее самостоятельно.
I вариант
Элемент № 8
II вариант
Элемент № 7.
Таким образом, повторили составление электронных и графических формул атомов химических элементов.
Характеристика химического элемента.
Теперь всё приводим в систему и даём полную характеристику элемента на основании его положения в Периодической системе химических элементов Д.И. Менделеева.
I вариант
Элемент № 6
II вариант
Элемент № 3.
И так, завершением урока стала полная характеристика химического элемента. Пока консультанты подсчитывают баллы, задаём вопросы из ваших кроссвордов.
Зачётный лист ученика (№ по журналу)
Д/З. (кроссворд) |
Адрес хим. элемента |
Строение атома |
Печатная тетрадь |
Электронные и графические формулы |
Хар-ка хим. элемента |
Прочие баллы |
Всего |
Оценка |
|
|
|
|
|
|
|
|
|
Оценки выставляются в соответствии со следующими критериями:
“5” – 28–30 баллов
“4” – 22–27 баллов
“3” – 16–21 баллов
“2” – ниже 16 баллов
Библиографический список
Учебная литература
- Габриелян, О.
 С. Химия 8 класс. Учеб. для общеобразоват. Учеб. заведений. – М.: Дрофа, 2005. – 208 с.
С. Химия 8 класс. Учеб. для общеобразоват. Учеб. заведений. – М.: Дрофа, 2005. – 208 с. - Габриелян, О.С., Якушова, А.В. Химия 8 класс: Рабочая тетрадь к учебнику О.С. Габриеляна «Химия. 8» / О.С. Габриелян, А.В. Яшукова. – М.: Дрофа, 2005. – 176 с.
- ЦОР, выполненные учителем информатики МОУ СОШ № 37 г. Ульяновска, Ямкиной Е.В. http://mir-predmetov.narod.ru/
Валентные электроны второго периода элементы
У элементов второго периода периодической системы внешняя (валентная) электронная оболочка состоит только из [c.75] Правило октета играет очень важную роль при составлении льюисовых структурных формул. Для неметаллических элементов второго периода В, С, N, О, F) исключения из этого правила крайне редки. Нетрудно объяснить, почему это так. Атомы элементов второго периода имеют устойчивые 2s- и 2р-орбитали, и магическое число 8 соответствует завершенной валентной конфигурации 2s”2p .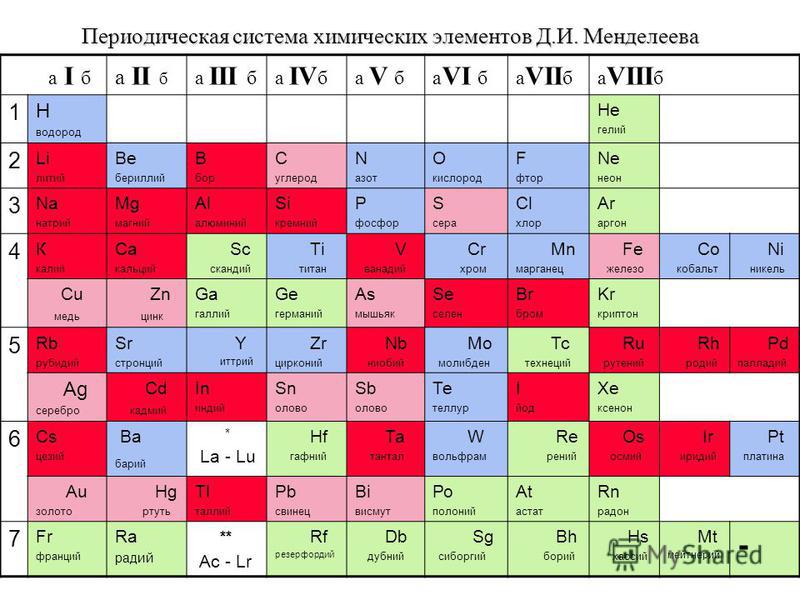 Добавление новых электронов к такой замкнутой оболочке невозможно, потому что следующие доступные для заселения электронами атомные орбитали у элементов второго периода-это расположенные намного выше по энергии 3 -орбитали. [c.475]
Добавление новых электронов к такой замкнутой оболочке невозможно, потому что следующие доступные для заселения электронами атомные орбитали у элементов второго периода-это расположенные намного выше по энергии 3 -орбитали. [c.475]
На примере Н2 и р2 можно понять, что происходит во многих молекулах, где электронные пары образуют связи, в результате чего каждый атом, приобретает замкнутую электронную оболочку. Для построения замкнутой электронной оболочки атому водорода требуются два электрона, которые заполнят его валентную Ь-орбиталь. Каждому атому элемента второго периода требуется для создания замкнутой электронной оболочки восемь- электронов (восьмерка октет), потому что на 2х- и 2р-орбиталях размещается до восьми электронов (2 “2р ). Это требование получило название правила октета. В примере с молекулой 2 каждый атом Р после образования связи оказывается окруженным восемью электронами. [c.
 467]
467]Гибридизация в молекулах аммиака и воды. Мы вкратце обсудили геометрическое строение соединений бериллия, бора и углерода, пользуясь концепцией гибридизации. При дальнейшем движении по периоду вправо мы переходим к соединениям азота и кислорода, геометрия которых уже обсуждалась в рамках чистых р-орбиталей. Такое рассмотрение нельзя признать целиком удовлетворительным, если помнить, что экспериментальные значения валентных углов в молекулах HgN (107°18 ) и Н О (104°ЗГ) больше, чем между чистыми р-орбиталями (90°). С другой стороны, экспериментальные величины гораздо ближе к 109°28 — тетраэдрическому углу при sp -гибридизации связей. Так возникла идея о существовании общей для всех элементов второго периода гибридизации атомных s- и р-орбиталей. В применении к молекулам HgN и HjO это выглядит так, как показано на рис. III. 15. Октет электронов вокруг каждого центрального атома располагается на четырех sp -гибридных орбиталях, причем в моле- [c.183]
Рассмотренные примеры показывают, что атомы обладают разнообразными возможностями для образования ковалентных связей. Последние могут создаваться и за счет неспаренных электронов невозбужденного атома, и за счет неспаренных электронов, появляющихся в результате возбуждения атома ( распаривания электронных пар), и, наконец, по донорно-акцепторному способу. Тем не менее, общее число ковалентных связей, которые способен образовать данный атом, ограничено. Оно определяется общим числом валентных орбита-лей, т. е. тех орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Квантовомеханический расчет показывает, что к подобным орбиталям принадлежат s- и р-орбитали внешнего электронного слоя и -орбитали предшествующего слоя в некоторых случаях, как мы видели на примерах атомов хлора и серы, в качестве валентных орбиталей могут использоваться и d-орбитали внешнего слоя. Атомы всех элементов второго периода имеют во внешнем электронном слое четыре орбитали при отсутствии (i-орбиталей в предыдущем слое. Следовательно, на валентных орбиталях этих атомов может разместиться не более восьми электронов.
Последние могут создаваться и за счет неспаренных электронов невозбужденного атома, и за счет неспаренных электронов, появляющихся в результате возбуждения атома ( распаривания электронных пар), и, наконец, по донорно-акцепторному способу. Тем не менее, общее число ковалентных связей, которые способен образовать данный атом, ограничено. Оно определяется общим числом валентных орбита-лей, т. е. тех орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Квантовомеханический расчет показывает, что к подобным орбиталям принадлежат s- и р-орбитали внешнего электронного слоя и -орбитали предшествующего слоя в некоторых случаях, как мы видели на примерах атомов хлора и серы, в качестве валентных орбиталей могут использоваться и d-орбитали внешнего слоя. Атомы всех элементов второго периода имеют во внешнем электронном слое четыре орбитали при отсутствии (i-орбиталей в предыдущем слое. Следовательно, на валентных орбиталях этих атомов может разместиться не более восьми электронов. Это означает, что максимальная ковалентность элементов второго периода равна четырем. Атомы элементов третьего и последующих периодов могут использовать для образования ковалентных связей не только s- и р-, но также и d-орбитали. Известны соединения d-элементов, в которых в образовании ковалентных связей [c.125]
Это означает, что максимальная ковалентность элементов второго периода равна четырем. Атомы элементов третьего и последующих периодов могут использовать для образования ковалентных связей не только s- и р-, но также и d-орбитали. Известны соединения d-элементов, в которых в образовании ковалентных связей [c.125]
Проведенный выше обзор валентности элементов второго периода периодической системы позволяет понять причину отличия этих элемеитов от других. Особенно сильно это отличие выражено у трех элементов — азота, кислорода и фтора. Кроме особенностей,. обусловленных малым радиусом атомов и ионов, отличия данных элементов связаны также и с тем, что их внешние электроны находятся во втором слое, в котором имеются только четыре квантовые ячейки. Поэтому данные элементы не могут проявлять высокие валентности, которые известны для их аналогов. [c.83]
Льюисовыми структурами (валентаыми структурами, валентными схемами) называются графические электронные формулы молекул и комплексных ионов, где для обозначения обобществленных между атомами связьшающих электронных пар (связей) используются прямые линии (валентные штрихи), а для обозначения неподеленных пар электронов используются две точки. Для молекул и комплексных ионов, содержащих только элементы первого и второго периодов, наилучшие льюисовы структуры характеризуются тем, что в них каждый атом окружен таким же числом электронов, как атом благородного газа, ближайшего к данному элементу по периодической системе. Это означает, что атом Н должен быть окружен двумя электронами (одна электронная пара, как у Не), а атомы неметаллических элементов второго периода (В, С, К, О, Г) должны быть окружены восемью электронами (четыре электронные пары, как у 1 е). Поскольку восемь электронов образуют замкнутую конфигуращ1Ю 2х 2р , правило записи льюисовых структур требует окружать каждый атом элемента второго периода октетом (восьмеркой) электронов, и поэтому называется правилом октета. [c.501]
Для молекул и комплексных ионов, содержащих только элементы первого и второго периодов, наилучшие льюисовы структуры характеризуются тем, что в них каждый атом окружен таким же числом электронов, как атом благородного газа, ближайшего к данному элементу по периодической системе. Это означает, что атом Н должен быть окружен двумя электронами (одна электронная пара, как у Не), а атомы неметаллических элементов второго периода (В, С, К, О, Г) должны быть окружены восемью электронами (четыре электронные пары, как у 1 е). Поскольку восемь электронов образуют замкнутую конфигуращ1Ю 2х 2р , правило записи льюисовых структур требует окружать каждый атом элемента второго периода октетом (восьмеркой) электронов, и поэтому называется правилом октета. [c.501]
ПИЯХ с кислородом, следовательно, можно ожидать, что азот пятивалентен в таких соединениях, как азотная кислота ННОз и азотный ангидрид МоОд. Поскольку, однако, азот является самым типичным неметаллом среди элементов V группы и одним из наиболее характерных неметаллов вообще, связь между атомами азота и кислорода должна носить по преимуществу ковалентный характер. По теории ковалентной связи соединение атомов в. молекулы осуществляется за счет образования общих электронных пар из неспаренных электронов различных атомов. Валентность элементов равна числу неспаренных электронов у атомов соединяющихся элементов. Поскольку же максимальное число неспаренных электронов у атомов элементов второго периода не может превышать четырех, то и максимальная валентность всех элементов этого периода, включая азот, не должна быть выше четырех. [c.78]
По теории ковалентной связи соединение атомов в. молекулы осуществляется за счет образования общих электронных пар из неспаренных электронов различных атомов. Валентность элементов равна числу неспаренных электронов у атомов соединяющихся элементов. Поскольку же максимальное число неспаренных электронов у атомов элементов второго периода не может превышать четырех, то и максимальная валентность всех элементов этого периода, включая азот, не должна быть выше четырех. [c.78]
Элементы 2-го периода периодической системы имеют только 4 валентных АО (одна 2з- и три 2р-), поэтому их максимальная ковалентность равна 4. Число валентных электронов в атомах элементов, расположенных в периоде левее углерода, меньше числа АО, а в атомах элементов, расположенных правее, наоборот, больше. Поэтому первые могут быть акцепторами, а вторые — донорами электронных пар. В своем обычном валентном состоянии атом углерода имеет 4 неспаренных электрона, что совпадает с числом валентных АО, поэтому связей по донорно-акцептор-ному механизму он не образует. [c.115]
[c.115]
У всех элементов, находящихся в одной и той же подгруппе периодической системы, строение внешних электронных оболочек одинаково, поэтому в свойствах таких элементов наблюдается наибольшее сходство, хотя металлические свойства в группе сверху вниз нарастают. Характер изменения свойств в группах элементов в данном случае определяется главным образом изменением радиусов атомов. Однако необходимо обратить внимание на следующее. При переходе в группе от второго к третьему периоду свойства элементов меняются настолько резко, что объяснить это одним лишь изменением радиуса атома нельзя. Например, кислород бывает только двухвалентным, а сера и все остальные элементы данной подгруппы могут иметь валентность 2, 4 и 6. Для фтора характерна исключительно одновалентность, в то время как хлор и остальные галогены могут быть 1-, 3-, 5- и 7-валентными. Такое изменение свойств при переходе от второго к третьему периоду обусловлено некоторыми особенностями структуры внешних электронных оболочек атомов элементов второго периода, с [c. 62]
62]
Говоря современным языком, с каждой из четырех сторон вокруг символа химического элемента можно ассоциировать одну из четырех орбиталей х, Р учетом количества валентных электронов атомы элементов второго периода, например, можно изобразить так [c.465]
Бериллий. В молекуле бериллия, Всг, четыре валентных электрона. Два из них спарены на связывающей молекулярной орбитали а , а два-на разрыхляющей а. Такая электронная конфигурация означает отсутствие эффективного числа связей, что согласуется с опытными данными – в отличие от устойчивых двухатомных молекул элементов второго периода молекула Вб2 не существует. [c.525]
Таким образом, второй период каждого этапа является, с одной стороны, продолжением, а с другой — повторением первого. В этом и заключается суть диалектического повторения, названного Б. М. Кедровым “повторением на новом более высоком уровне”. Координатой, определяющей “высоту этого уровня и является последовательный (накопительный) рост числа протонов, нейтронов и электронов в атомах вида (химического элемента). На спиральной модели Системы химических элементов хорошо видна искусственность деления валентных групп на главную и побочную в табличном варианте. В генетически иерархической структуре естественной системы атомов нет предпосылок для этого. [c.170]
На спиральной модели Системы химических элементов хорошо видна искусственность деления валентных групп на главную и побочную в табличном варианте. В генетически иерархической структуре естественной системы атомов нет предпосылок для этого. [c.170]
Для всех З лементов, кроме элементов подгруппы ЗВ, цинка и кадмия, характерна переменная валентность. У элементов, стоящих в первой половине периодов до подгруппы 7В включительно, максимальная валентность соответствует номеру подгруппы (все -электроны холостые). Во второй половине только для 5 элементов (Ни, Оз, 2п, Сс1 и Hg) осуществляется максимальная валентность, а для 10 элементов она не проявляется или (для элементов подгруппы меди) превышает номер подгруппы. [c.431]
Рассмотрим с этих позиций ковалентность атомов элементов второго и частично третьего периодов периодической системы. В связи с тем, что в образовании химической связи принимают участие главным образом валентные электроны, то нагляднее рассматривать электронные конфигурации только внешних электронных оболочек атомов. [c.120]
[c.120]
Обратимся к элементам, расположенным в периодической системе ниже второго периода. Одна из особенностей этих элементов, отличающая их от элементов второго периода, заключается в том, что у них внешние (валентные) электронные оболочки содержат больше 4 орбиталей, минимум 9 орбиталей в третьем периоде. Вспомним, что на внешней электронной оболочке любого элемента не может быть больше 8 электронов, которые у атома в основном (не возбужденном) состоянии могут занять только 4 орбитали 5 и р. Все остальные орбитали ( , / и т. д.), которые имеются на внешних оболочках атомов элементов, начиная- с третьего периода, будут вакантными. Наличием таких вакантных орбиталей можно объяснить валентности элементов, расположенных ниже второго периода. [c.75]
Первоначальная шкала электроотрицательностей Полинга была выбрана таким образом, чтобы элементам второго периода от углерода до фтора соответствовали значения от 2,5 до 4,0, изменяясь на 0,5 при переходе к каждому следующему элементу. Значения электроотрицательности элементов в этой шкале приведены на рис. 6.9 в виде диаграммы. Размеры кружков на этой диаграмме отвечают относительным радиусам атомов, а расположение элементов приблизительно воспроизводит форму таблицы периодической системы однако положения элементов в пределах периодов смещены так, чтобы соответствовать их значениям электроотрицательностей в указанной шкале. Вследствие этого элементы, принадлежащие к одной группе периодической системы, располагаются на диаграмме не по вертикальным колонкам. Со времени появления первоначальной шкалы Полинга значения энергий разрыва химических связей, на которых она была основана, в результате уточнения подверглись значительным изменениям. Результаты пересчета электроотрицательностей элементов по методу Полинга с подстановкой новых значений энергий связи представлены в табл. 6.5. Общий ход изменения электроотрицательности соответствует тому, чего и можно было ожидать для элементов одного периода или одной группы электроотрицательность возрастает при уменьшении размеров атома.
Значения электроотрицательности элементов в этой шкале приведены на рис. 6.9 в виде диаграммы. Размеры кружков на этой диаграмме отвечают относительным радиусам атомов, а расположение элементов приблизительно воспроизводит форму таблицы периодической системы однако положения элементов в пределах периодов смещены так, чтобы соответствовать их значениям электроотрицательностей в указанной шкале. Вследствие этого элементы, принадлежащие к одной группе периодической системы, располагаются на диаграмме не по вертикальным колонкам. Со времени появления первоначальной шкалы Полинга значения энергий разрыва химических связей, на которых она была основана, в результате уточнения подверглись значительным изменениям. Результаты пересчета электроотрицательностей элементов по методу Полинга с подстановкой новых значений энергий связи представлены в табл. 6.5. Общий ход изменения электроотрицательности соответствует тому, чего и можно было ожидать для элементов одного периода или одной группы электроотрицательность возрастает при уменьшении размеров атома. Водород, который, строго говоря, не принадлежит ни к одной из групп, имеет приблизительно такую же электроотрицательность, как бор. Следует также отметить, что электроотрицательность металлов первой, второй и третьей групп возрастает при увеличении числа валентных электронов. В дальнейшем будет показано, каким образом на основании учета этих закономерностей можно судить о характере связи атомов в молекулах. [c.104]
Водород, который, строго говоря, не принадлежит ни к одной из групп, имеет приблизительно такую же электроотрицательность, как бор. Следует также отметить, что электроотрицательность металлов первой, второй и третьей групп возрастает при увеличении числа валентных электронов. В дальнейшем будет показано, каким образом на основании учета этих закономерностей можно судить о характере связи атомов в молекулах. [c.104]
Для того чтобы объяснить эти аномалии, необходимо сделать ряд допущений, некоторые из которых уже были введены и обоснованы ранее. Так, неподеленная пара электронов, которая занимает довольно большую диффузную орбиталь, оказывает большее отталкивающее действие на другие пары электронов, чем связываю щие пары, которые занимают более ограниченные двухцентровые орбитали (рис. 6-3). Валентный уровень атомов элементов второго периода (Т1—Не) заполнен, когда он содержит четыре пары электронов, тогда как валентный уровень атомов элементов третьего н последующих периодов может содержать и более четырех пар электронов. Когда заполненные орбитали соприкасаются, силы Паули возрастают очень быстро, так как они изменяются обратно пропорционально межэлектронному расстоянию в некоторой высокой степени . [c.225]
Когда заполненные орбитали соприкасаются, силы Паули возрастают очень быстро, так как они изменяются обратно пропорционально межэлектронному расстоянию в некоторой высокой степени . [c.225]
Рассмотрим электронные конфигурации и валентности элементов второго периода в нормальном и возбужденном состоянии (табл. 9). [c.82]
СВЯЗЬ, а какие являются неподеленными. Неподеленные электроны (либо один, либо пара) составляют часть внешней оболочки только одного атома, а электроны, участвующие в образовании ковалентной связи между двумя атомами, являются частью внешней оболочки обоих этих атомов. Атомы элементов второго периода (В, С, Ы, О, Р) могут максимально иметь восемь валентных электронов] обычно так и происходит, хотя известны случаи, когда число валентных электронов у элемента второго периода равно шести или семи. В тех случаях, когда возможно построение структур обоих типов, т. е. с шестью или семью электронами вокруг атома второго периода, с одной стороны, и с октетом электронов — с другой, реализуются последние структуры, так как обычно они имеют более низкую энергию. Например, этилен имеет структуру [c.27]
Например, этилен имеет структуру [c.27]
В соответствии с методом ВС валентность атома равна числу его одиночных электронов. С этой позиции валентности атомов элементов второго периода системы элементов Д. И.” Менделеева объясняют следующим образом. Первый энергетический уровень заполнен (1х ) и не может внести вклад в валентность атома. Ответственными за образование химических связей у атомов этих элементов являются электроны второго (внешнего) уровня [c.48]
Из спиновой теории валентности вытекает, что образовать ковалентную связь способны только неспаренные электроны. Они и определяют число связей данного атома с другими, а следовательно, и валентность [10, стр. 158]. Рассмотрим валентность элементов второго периода системы элементов, пользуясь табл. 7. [c.90]
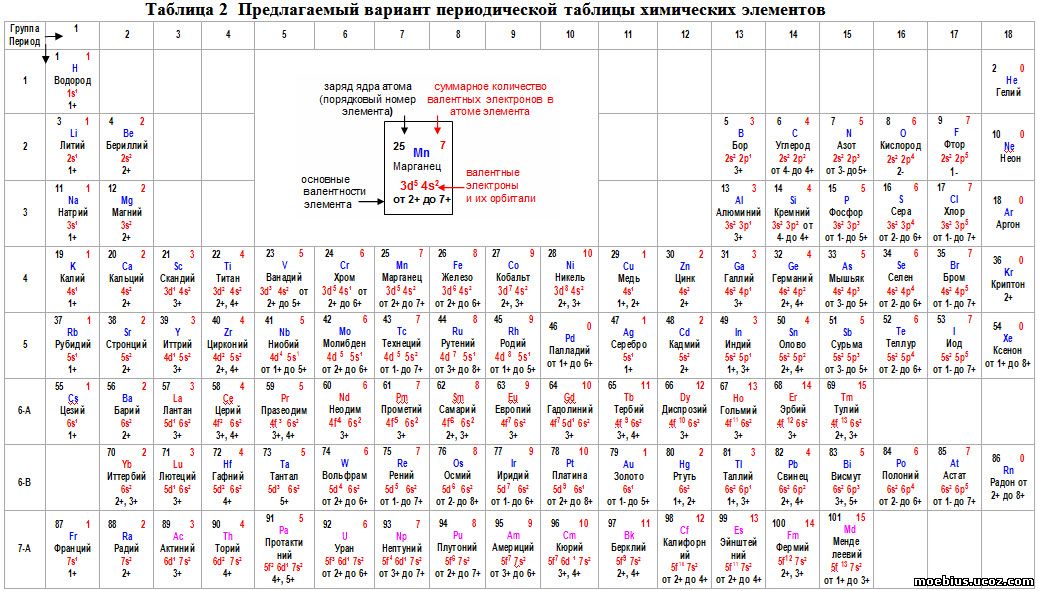
В атоме следующего за цинком галлия начинается заполнение 4р-состояния, которое заканчивается в криптоне (2=36) Кг (1) (2) (3) (4s)2(4p) . Таким образом, третий период (Na—Аг) имеет, как и второй, восемь элементов, а четвертый (К—Кг), — восемнадцать. В атомах от S до Си происходит заполнение Зс -оболочки. Атомы с незаполненными оболочками обладают многими общими чертами. Как указывалось, З -оболочка имеет десять мест. При ее незаполненности, т. е. наличии большого числа свободных мест, появляется возможность различного расположения электронов внутри оболочки, и следовательно, возможность изменения валентности. Наибольшая валентность (7) проявляется у марганца, в атоме которого имеется пять З -электронов. При этом все Зс -электроны занимают пять различных -состояний с ненасыщенными спинами, а один из 45-электронов переходит в 4р-состояние. [c.317]
В атомах от S до Си происходит заполнение Зс -оболочки. Атомы с незаполненными оболочками обладают многими общими чертами. Как указывалось, З -оболочка имеет десять мест. При ее незаполненности, т. е. наличии большого числа свободных мест, появляется возможность различного расположения электронов внутри оболочки, и следовательно, возможность изменения валентности. Наибольшая валентность (7) проявляется у марганца, в атоме которого имеется пять З -электронов. При этом все Зс -электроны занимают пять различных -состояний с ненасыщенными спинами, а один из 45-электронов переходит в 4р-состояние. [c.317]
Для элементов, родственных представленным, электронные конфигурации те же, за исключением более высоких значений квантового числа п. Так, сера, родственная кислороду, входящая во второй период, имеет конфигурацию валентных электронов Зз Зр. [c.117]
На валентный электрон в атомах элементов группы 1А (Е1, К, Се) действует эффективный заряд ядра приблизительно одинаковой величины. В случае лития этот заряд несколько меньше, чем для остальных элементов группы 1А, главным образом из-за того, что предшествующий валентному энергетический уровень занят всего двумя электронами. Эта особенность характерна и для других элементов второго периода и отличает их от других элементов соответствующих групп. Обращает на себя внимание большое отличие величин 2эфф для Е и Р, принадлежащих ко второму периоду. Это отличие показывает, насколько слабо экранирование электронами, находящимися на том же энергетическом уровне, что и рассматриваемый электрон именно это обстоятельство и приводит к уменьшению размеров атомов при переходе слева направо вдоль одного периода. [c.97]
В случае лития этот заряд несколько меньше, чем для остальных элементов группы 1А, главным образом из-за того, что предшествующий валентному энергетический уровень занят всего двумя электронами. Эта особенность характерна и для других элементов второго периода и отличает их от других элементов соответствующих групп. Обращает на себя внимание большое отличие величин 2эфф для Е и Р, принадлежащих ко второму периоду. Это отличие показывает, насколько слабо экранирование электронами, находящимися на том же энергетическом уровне, что и рассматриваемый электрон именно это обстоятельство и приводит к уменьшению размеров атомов при переходе слева направо вдоль одного периода. [c.97]
Группы нумеруются двояко группы – и р-элементов римскими числами с литерой А , а -элементов — с литерой В . Номер группы соответствует числу внешних или валентных электронов в атоме. Элементы /-типа—лантаноиды (58—71) и актиноиды (90—103)—характеризуются переменной валентностью, первые от двух до четырех, а вторые — от двух до семи (недавно в СССР получены семивалентные соединения нептуния и плутония). Они представля10т два семейства и не отнесены к каким-либо группам. Элементы групп кобальта и никеля, проявляющие валентность от двух до шести, но не выше, включены условно в УИ1В-группу, хотя для этого нет убедительных оснований. Их иногда, вместе с элементами группы железа, называют триадами, так как в каждом периоде (4-, 5- и [c.81]
Они представля10т два семейства и не отнесены к каким-либо группам. Элементы групп кобальта и никеля, проявляющие валентность от двух до шести, но не выше, включены условно в УИ1В-группу, хотя для этого нет убедительных оснований. Их иногда, вместе с элементами группы железа, называют триадами, так как в каждом периоде (4-, 5- и [c.81]
Самый внещний электрон в атоме каждого элемента третьего периода связан менее прочно, чем самый внешний электрон в атоме соответствующего элемента-аналога из предшествующего периода, потому что электроны с п = Ъ находятся дальше от ядра, чем электроны с п = 2. Вследствие этого первая энергия ионизации для элементов третьего периода (с валентными электронами на уровне п = 3) оказывается меньше, чем у соответствующих элементов второго периода (с п = 2). Когда завершается заполнение 35- и Зр-орбиталей, снова образуется чрезвычайно устойчивая электронная конфигурация благородного газа аргона, Аг. [c.396]
Бор, углерод и азот принадлежат к числу элементов второго периода и имеют сходные размеры. Они отличаются по числу валентных электронов бор обладает тремя валентными электронами, углерод-четырьмя, а азот-пятью. Кремний – элемент третьего периода.-попобно углероду, имеет четыре валентных электрона, но они находятся на один главный энергетический уровень дальше от ядра и характеризуются главным квантовым числом 3, а не 2. Под своими валентными электронами [c.270]
Они отличаются по числу валентных электронов бор обладает тремя валентными электронами, углерод-четырьмя, а азот-пятью. Кремний – элемент третьего периода.-попобно углероду, имеет четыре валентных электрона, но они находятся на один главный энергетический уровень дальше от ядра и характеризуются главным квантовым числом 3, а не 2. Под своими валентными электронами [c.270]
Атом бора имеет три валентных электрона и четыре валентные орбитали. Обычно он использует три орбитали, образуя 5р -гибриды в таких соединениях, как ВРз- Углерод имеет четыре валентных электрона и четыре орбитали. За исключением тех случаев, когда он образует кратные связи, эти орбитали используются для 5р -гибридизации. Атом азота имеет пять валентных электронов и четыре орбитали. Как правило, он образует три связи с другими атомами в структурах с тетраэдрической конфигурацией, а четвертая гибридная 5р -орбиталь у него занята неподеленной электронной парой (разд. 13-3). Углерод и азот способны образовывать двойные и тройные связи в результате я-перекры-вания, обсуждавшегося в разд. 13-4. По сравнению с длиной простой связи длина двойных связей, образуемых этими элементами, сокращается на 13%, а длина тройных связей-на 22%. Прочность кратной связи повыщается благодаря наличию электронов на связывающей молекулярной п-орбитали, возникающей в результате перекрывания атомных я-ор-биталей. Но перекрывание я-типа между орбиталями становится достаточно больщим для возникновения связи только при близком расположении атомов. По этой причине 81 и другие элементы третьего и следующих периодов неспособны образовывать кратные связи. Кремний имеет 10 внутренних электронов по сравнению с 2 в атомах С и N. Отталкивание этих внутренних электронов не позволяет двум атомам 81 сблизиться настолько, насколько это необходимо для достаточного я-перекрывания р-орбиталей и возникновения двойных связей. Несмотря на все попытки химиков синтезировать соединения со связями 81=81 и 81=С, ни одна из них до сих пор не увенчалась успехом. За небольшими исключениями, образование двойных и тройных связей ограничено элементами второго периода, в атомах которых число внутренних электронов не превышает 2.
13-4. По сравнению с длиной простой связи длина двойных связей, образуемых этими элементами, сокращается на 13%, а длина тройных связей-на 22%. Прочность кратной связи повыщается благодаря наличию электронов на связывающей молекулярной п-орбитали, возникающей в результате перекрывания атомных я-ор-биталей. Но перекрывание я-типа между орбиталями становится достаточно больщим для возникновения связи только при близком расположении атомов. По этой причине 81 и другие элементы третьего и следующих периодов неспособны образовывать кратные связи. Кремний имеет 10 внутренних электронов по сравнению с 2 в атомах С и N. Отталкивание этих внутренних электронов не позволяет двум атомам 81 сблизиться настолько, насколько это необходимо для достаточного я-перекрывания р-орбиталей и возникновения двойных связей. Несмотря на все попытки химиков синтезировать соединения со связями 81=81 и 81=С, ни одна из них до сих пор не увенчалась успехом. За небольшими исключениями, образование двойных и тройных связей ограничено элементами второго периода, в атомах которых число внутренних электронов не превышает 2. Исключения, к числу которых относятся 8=0, Р=0 и 81=0, объясняются перекрыванием между р- и -орбиталями, этот вопрос будет рассмотрен в разделе, посвященном кремнию. [c.271]
Исключения, к числу которых относятся 8=0, Р=0 и 81=0, объясняются перекрыванием между р- и -орбиталями, этот вопрос будет рассмотрен в разделе, посвященном кремнию. [c.271]
Эта тенденция также ослш евагт при увеличении номера периода. Электроотрицательности у лития и у бериллия (второй период) отличаются сильнее, чем у натрия и магния (третий период). Электроотрицательности у фтора и у хлора (второй и третий периоды) отличаются сильнее, чем у хлора и у брома (третий и четвертый периоды). Следует отметить, чю атомы инертных газов имеют полностью заполненный валентный з ровень, поэтому они не проявляют тенденции оттягивать на себя электроны. Таким образом, сказанное вьипе относится к элементам групп с 1 по 7, но не относится к элементам восьмой группы. Если теперь посмотреть внимательно на расположение элементов в Периодической системе, то станет ясно, почему именно фтор и еет самую высокую электроотрицательность. Огносительная электроотрицатсльиость некоторых химических элементов представлена в ряду на форзаце. [c.52]
Направленность ковалентной связи. Как указано выше, ковалентная связь имеет направленность. Квантовомеханическое объяснение направ.1енности ковалентной связи основано на учете формы различных орбиталей. Здесь отметим, что атомы элементов второго и последующих периодов можно рассматривать как состоящие из остова, содержащего внутренние электронные слои, и внешних (валентных) электронов, которые вносят основной вклад в образование химической связи. Поэтому далее при описании строения молекул принимаем во внимание только орбитали валентных электронов. [c.90]
Мы уже обсуждали (гл. 6) факторы, определяющие форму неорга нических молекул, составленных из атомов переходных элементов. Главным образом это — размер и заряд центрального иона, наличие свободной электронной пары, возможность расширения валентного уровня сверхоктета, являющегося предельным для элементов второго периода, способность к образованию л -связей. стерические требования к группам, связанным с центральным атомом, и, вероятно, важнее всего принцип запрета Паули. Если рассматривать центральный атом со сферической симметрией, характерной для комплексов металлов, не имеющих свободных электронных пар, следует ожидать, и это действительно обнаруживается, правильные формы. Молекулы с координационными числами 2, 3, 4, 5, 6, 7 и 8 характеризуются следующими структура, чи линейной, треугольной, правильной тетраэдрической, тригональной бипирамидой, октаэдрической, пятиугольной бипирамидой и квадратной (архимедовой) антипризмой. Можно сказать, что всякий раз, когда электронный уровень атома переходного элемента, не принимающий участия в связи, будет иметь сферическую симметрию, структура таких комплексов будет правильной, определяемой только координационным числом. Можно вы писать электронные конфигурации, которые приводят к правильным симметричным комплексам. Для наиболее распространенных координационных чисел 6 и 4 имеют место следующие конфигу рации [c.282]
Второй период образует атомы от до Ne. В направлении — Ке растет эффективный заряд ядра, в связи с чем уменьшаются размеры атомов (см. Гшах), возрастает потенциал ионизации и осуществляется, начиная с В, переход к неметаллам. Потенциал ионизации отражает не только рост в ряду —Ке, но и особенности электронных конфигураций потенциал ионизации у бора ниже, чем у бериллия. Это указывает на упрочнение заполненных нодоболочек ( у бериллия). Более высокий потенциал ионизации азота по сравнению с кислородом указывает на повышенную прочность конфигурации р , в которой каждая орбиталь занята одним / -электроном. Аналогичные соотношения наблюдаются и в следующем периоде у соседей Mg—А1 и Р—5. У атомов второго периода отрыв электрона с внутреннего Ь -слоя требует такого высокого ПИ (75,62 эВ уже у лития), что в химических и оптических процес–сах участвуют только внешни электроны. Сродство к электрону в ряду Ы—Р имеет тенденцию к возрастанию. Но у берилжя оболочка заполнена, и сродство к электрону эндотермично так же, как и у гелия (1л ). Обладая самым высоким потенциалом ионизации ю всех неметаллов и высоким сродством к электрону, фтор является наиболее электроотрицательным элементом в периодической системе. Для атома неона СЭ (Ке)=—0,22 эВ. Оболочка з р атома Ке, электронный октет, характеризуется суммарным нулевым спином и нулевым орбитальным моментом (терм 5о). Все это, вместе с высоким потенциалом ионизации и отрицательным сродством к электрону, обусловливает инертность неона. Такая же з р конфигурация внешнего слоя характерна для вСех элементов нулевой группы. Исследования последних лет показывают, что 1 п, Хе,Кг и Аг дают химические соединения со фтором и кислородом. Очевидно, что з р конфигурация не влечет как непременное следствие химической инертности. Все атомы со спаренными электронами (терм о) — диамагниты (Не, Ве, Ке и т. д.). Конфигурации внешнего электронного слоя у атомов 2-го и 3-го периодов, стоящих в одних и тех же группах, одинаковы, чем объясняется близость химических свойств элементов, стоящих в одних и тех же группах (сравните Ка иЬ1 в табл. 5). Но наблюдается и различие элементы второго периода обладают постоянной валентностью, а третьего — переменной. Это связано с тем, что у атомов третьего периода есть вакантные -состояния в третьем квантовом слое, а во втором слое таких соединений нет. [c.62]
Валентный уровень элементов второго периода заполняется четырьмя электронными парами, поэтому для их соединений АХ4, АХзЕ, АХ2Е2 угол связи существенно не отклоняется от значений 109,5°. [c.112]
Кислород — элемент с порядковым номером 8, его относительная атомная масса 15,999ж1 . Находится во втором периоде, в главной подгруппе VI группы. Электронное строение атома кислорода и его валентные возможности рассмотрены выше. [c.355]
Вор входит в главную подгруппу III группы периодической системы элементов и имеет электронную конфигурацию ls 2s 2p под ним расположен алюминий. Во втором периоде при переходе от бора к углероду радиусы ромов уменьшаются, а в IV группе при переходе от углерода к кремнию — увеличиваются. Поэтому радиусы атомов бора и кремния близки. Бор существенно отличается от алюминия и обнаруживает большое сходство с кремнием. Бор образует три ковалентные связи с атомами других элементов. В зависимости от природы последних атом бора может образовать еще одну до-норноакцепторную связь, предоставляя р-орбиталь для электронной пары другого атома. Таким образом, бор в соединениях проявляет валентность, равную трем, или ковалентность, равную четырем. [c.368]
Установлено [liebmanJ. F.,J. hem. Edu ., 50, 831(1973)], что сумма первых потенциалов ионизации для непереходных элементов любого периода, у которых общее число валентных электронов равно восьми, поразительно мало изменяется в пределах периода. Например, для второго периода [c.107]
Расположите элементы второго периода в возрастающем классе по химии 11 CBSE
Подсказка: В современной периодической таблице элементы расположены в порядке возрастания их атомных номеров. Мы знаем, что энергия, выделяемая при добавлении одного электрона к нейтральному газообразному атому в его основном состоянии, известна как сродство к электрону. Когда электрон присоединяется к нейтральному газообразному атому, атом образует анион. Полное решение:
Мы знаем, что энергия, выделяемая при добавлении одного электрона к нейтральному газообразному атому в его основном состоянии, называется сродством к электрону.Когда электрон присоединяется к нейтральному газообразному атому, атом образует анион.
Элементы второго периода таблицы Менделеева следующие:
Литий $ \ left ({{\ text {Li}}} \ right) $, бериллий $ \ left ({{\ text {Be}}} \ right) $, бор $ \ left ({\ text {B}} \ right) $, углерод $ \ left ({\ text {C}} \ right) $, азот $ \ left ({\ text {N}} \ right) $, кислород $ \ left ({\ text {O}} \ right) $, фтор $ \ left ({\ text {F}} \ right) $ и неон $ \ left ({{\ text {Ne }}} \ right) $.
В периодической таблице тенденция сродства к электрону заключается в том, что сродство к электрону увеличивается по мере того, как мы перемещаемся слева направо по периоду.3} $, который имеет наполовину заполненную валентную p-орбиталь, что приводит к более низкому сродству к электрону.
Таким образом, порядок возрастания сродства к электрону следующий:
\ [{\ text {Ne}} <{\ text {N}} <{\ text {Be}} <{\ text {Li}} <{\ text {B}} <{\ text {C}} <{\ text {O}} <{\ text {F}} \]
Элементы, которые не следуют тенденции, – это бериллий $ \ left ({{ \ text {Be}}} \ right) $, азот $ \ left ({\ text {N}} \ right) $ и неон $ \ left ({{\ text {Ne}}} \ right) $.
Примечание: В периодической таблице при перемещении слева направо через период размер атома уменьшается.По мере уменьшения размера атома сродство к электрону увеличивается. Это связано с тем, что по мере уменьшения размера атома эффективный ядерный заряд, испытываемый валентными электронами, увеличивается, и становится легче добавить электрон.
Первый период периодической таблицы состоит из 2 элементов. Во втором периоде 6 элементов. Как дела
Открыть главное меню
Поиск в Википедии
Элемент периода 2
РедактироватьСмотреть страницу
Прочитать на другом языке
Период 2 в периодической таблице
Водород
Гелий
Литий
Бериллий
Бор
Карбон
Азот
Кислород
Фтор
Неон
Натрий
Магний
Алюминий
Кремний
Фосфор
Сера
Хлор
Сера
Хлор 9004
Аргон
Калий
Калий
Аргон
Калий
Калий Ванадий
Хром
Марганец
Железо
Кобальт
Никель
Медь
Цинк
Галлий
Германий
Мышьяк
Селен
Рубид
Бром
Селен
Бром
Бром
Иттрий
Цирконий
Ниобий
Молибден
Технеций
Рутений
Родий
Палладий
Серебро
Кадмий
Антимий
Индий
Индий
Индий
Индий
Цезий
Барий
Лантан
Церий
Празеодим
Неодим
Прометий
Самарий
Европий
Гадолиний
Тербий
Гадолиний
Диспрозий
Тербий
Диспрозий
Диспрозий
Диспрозий
Гафний
Тантал
Вольфрам
Рений
Осмий
Иридий
Платина
Золото
Ртуть (элемент)
Таллий
Свинец
Висмут
Астатин
Радон
Франций
Радий
Актиний
Торий
Протактиний
Уран
Нептуний
Плутоний
Америций
Кюрий
Америций
Кюрий
0
Америций
Кюрий
0 Менделевий
Нобелиум
Лоуренсий
Резерфордиум
Дубний
Сиборгий
Борий
Калий
Мейтнерий
Дармштадций
Мейтнерий
Дармштадций
Рентгениций
8 Мосх18
Рентгений
8 Coentgenium
8
Рентгениций
8 Coentgenium
8
Оганессон
Элемент периода 2 – это один из химических элементов во второй строке (или периоде) периодической таблицы химических элементов.Таблица Менделеева выстроена в ряды, чтобы проиллюстрировать повторяющиеся (периодические) тенденции в химическом поведении элементов по мере увеличения их атомного номера; новая строка начинается, когда химическое поведение начинает повторяться, создавая столбцы элементов с аналогичными свойствами.
Второй период содержит элементы литий, бериллий, бор, углерод, азот, кислород, фтор и неон. Эту ситуацию можно объяснить современными теориями строения атома. В квантовомеханическом описании атомной структуры этот период соответствует заполнению 2s- и 2p-орбиталей.Элементы периода 2 подчиняются правилу октетов в том смысле, что им нужно восемь электронов для завершения своей валентной оболочки. Максимальное количество электронов, которое могут вместить эти элементы, составляет десять, два на орбитали 1s, два на орбитали 2s и шесть на орбитали 2p.
Если задана электронная конфигурация, то
НОМЕР ПЕРИОДА – Количество оболочек в атоме элемента.
НОМЕР ГРУППЫ – Зависит от количества валентных электронов. Если валентные электроны равны 1, номер группы равен количеству валентных электронов:
1 Валентный электрон – Группа 1
2 Валентных электрона – Группа 2
От 3 до 8 валентных электронов – Добавьте «10» к валентным электронам к получить номер группы элемента.
Примеры –
Магний (Mg) – Атомный номер 12
Электронная конфигурация: 2, 8, 2
Номер периода = Количество оболочек = 3
Номер группы = Валентные электроны = 2
2. Хлор (Cl ) – Атомный номер 17
Электронная конфигурация: 2, 8, 7
Номер периода = Количество оболочек = 3
Номер группы = Валентные электроны + «10» = 17
периодов таблицы Менделеева | Fun Science
Современная таблица Менделеева была построена русским химиком Дмитрием Менделеевым в 1869 году.Современная периодическая таблица состоит из горизонтальных строк, называемых периодами , и вертикальных столбцов, называемых группами . Они обсуждаются ниже:
Периоды в современной таблице Менделеева
Период может быть определен как горизонтальная строка в периодической таблице. С точки зрения электронной структуры атома, период представляет собой последовательность элементов, атомы которых имеют одинаковое количество электронных оболочек, то есть главное квантовое число (n).Каждый последующий период в периодической таблице связан с заполнением следующего более высокого основного энергетического уровня (n = 1, n = 2, n = 3 и т. Д.). Есть , семь периодов , и каждый период начинается с другого главного кванта. количество.
Если читать по периоду слева направо, количество электронов во внешней оболочке или подоболочке элемента увеличивается.
Элементы периода 1
Первый период, соответствующий n = 1, уникален, потому что он содержит только два элемента.Первая энергетическая оболочка (K) имеет только одну орбиталь (то есть 1s), которая может вместить только два электрона. Это означает, что элементов может быть только два. Водород (1s 1 ) и гелий (1s 2 ).
Период 2 элемента
Второй период содержит 8 элементов, потому что для n = 2 есть четыре орбитали (одна 2s и три 2p) во второй энергетической оболочке (L). В целом, эти четыре орбитали имеют емкость восемь электронов, и, следовательно, период секунды содержит восемь элементов .Он начинается с лития (Z = 3), в котором один электрон входит на 2s-орбиталь. Период заканчивается неоном (Z = 10), в котором завершена вторая оболочка (2s 2 2p 6 ).
Период 3 элемента
Этот период содержит восемь элементов от натрия (Z = 11) до аргона (Z = 18).
Период 4 элемента
В четвертом периоде восемнадцать элементов от калия (Z = 19) до криптона (Z = 36). В этот период мы сталкиваемся с элементами, которые включают заполнение трехмерных орбиталей.Они известны как переходная серия элементов . Это начинается со скандия (Z = 21), который имеет электронную конфигурацию 3d 1 4s 2 , и заканчивается цинком (Z = 30) с полностью заполненными трехмерными орбиталями, имеющими электронную конфигурацию 3d 10 4s 2 .
Период 5 элементов
Пятый период, как и четвертый период, также состоит из 18 элементов. Он начинается рубидием (Z = 37) с заполнением 5s-орбитали и заканчивается ксеноном (Z = 54) с заполнением 5p-орбиталей.Этот период также содержит 10 элементов серии 4d переходов, начиная с иттрия (Z = 39).
Период 6 элементов
Шестой период содержит 32 элемента (Z = от 55 до 86). В дополнение к 10 элементам переходной серии 5d, этот период содержит 14 элементов, которые включают заполнение 4f-орбиталей, начиная от церия (Z = 58) до лютеция (Z = 71). Серии элементов называются сериями внутренних переходов или серией лантаноидов , серией .
Период 7 элементов
Седьмой период аналогичен шестому периоду.Хотя ожидается, что в нем будет 32 элемента, этот период является неполным и в настоящее время содержит только 29 элементов. Ожидается, что этот период закончится на элементе с атомным номером 118, который принадлежит к семейству благородных газов. В этот период также входят 14 элементов, включающих заполнение 5f орбиталей, начиная с актиния (Z = 89). Это также называется серией внутренних переходов 5f- или серией актиноидов .
Первые три периода, содержащие 2, 8 и 8 элементов соответственно, называются короткими периодами , следующие три периода, содержащие 18, 18 и 32 элемента соответственно, называются длинными периодами .
Какой 2 элемент в таблице Менделеева? – Реабилитацияrobotics.net
Какой 2 элемент в таблице Менделеева?
Химия: список элементов периодической таблицы, отсортированный по: Атомному номеру
| № | Атомный вес | Имя |
|---|---|---|
| 1 | 1,008 | Водород |
| 2 | 4,003 | Гелий |
| 3 | 6.941 | Литий |
| 4 | 9.012 | Бериллий |
Что является первым элементом 2-го периода таблицы Менделеева?
Первый период таблицы Менделеева – короткий, состоящий всего из двух элементов, водорода и гелия. Литий, атомный номер 3, начинается второй период, в котором 8 элементов.
Сколько элементов во 2 периоде?
восемь элементов
Где находится период 2 в таблице Менделеева?
Период 2, или второй период, относится ко второй строке сверху в таблице Менделеева.
Что общего у Периода 2?
Все элементы периода имеют одинаковое количество атомных орбиталей. Например, каждый элемент в верхнем ряду (первый период) имеет одну орбиталь для своих электронов. Все элементы во втором ряду (второй период) имеют две орбитали для своих электронов. По мере продвижения по таблице каждая строка добавляет орбиталь.
Какие 9 семейств периодической таблицы?
- Группы также известны как семьи.Семьи – это имена, представляющие каждую группу.
- Существует 9 различных семейств, и это:
- Щелочные металлы.
- Щелочноземельные металлы.
- Переходные металлы.
- Бор.
- Карбон.
- Азот.
Сколько металлов в группе 14?
шесть
Что такое A и B в периодической таблице?
Элементы расположены в периодической таблице по реакционной способности. Столбцы с буквой B (с IB по VIIIB) называются переходными элементами.Столбцы с буквой A (от IA до VIIIA) называются элементами основной группы. Элементы также можно разделить на две основные группы: металлы и неметаллы.
Почему первые три строки периодической таблицы расположены именно так?
Строки называются периодами. Элементы в ряд расположены по возрастанию атомного номера. Столбцы называются группами и представляют элементы, которые имеют аналогичные химические свойства из-за того же количества электронов в их последней оболочке.
Почему элементы расположены в строках и столбцах?
Химические элементы расположены в порядке возрастания атомного номера. Горизонтальные строки называются периодами, а вертикальные столбцы – группами. Элементы одной группы имеют схожие химические свойства. Это потому, что у них одинаковое количество внешних электронов и одинаковая валентность.
Что означают строки и столбцы в периодической таблице?
Вертикальные столбцы в периодической таблице называются группами или семьями из-за схожего химического поведения.Все члены семейства элементов имеют одинаковое количество валентных электронов и сходные химические свойства. Горизонтальные ряды периодической таблицы называются периодами.
Как определяется химический символ элемента?
Число протонов определяет, что это за элемент, а также определяет химическое поведение элемента. Атомный символ: атомный символ (или символ элемента) – это аббревиатура, выбранная для обозначения элемента («C» для углерода, «H» для водорода и «O» для кислорода и т. Д.). Два других типа – протоны и нейтроны.
| Второй период содержит элементы литий, бериллий, бор, углерод, азот, кислород, фтор и неон | Третий период содержит восемь элементы: натрий, магний, алюминий, кремний, фосфор, сера, хлор и аргон |
| Этот период соответствует наполнению 2s и 2p орбиталей.Элементы периода 2 подчиняются правилу октетов в том смысле, что они нужно восемь электронов, чтобы завершить свою валентную оболочку. Максимальное количество электронов, которые могут вместить эти элементы, десять, два на орбитали 1с, два на орбитали 2s и шесть на орбитали 2p 3Li щелочь металл [He] 2s1 4Be щелочной земляной металл [He] 2s2 5B Металлоид [He] 2с2 2п1 6C Многоатомный неметалл [He] 2s2 2p2 7 N Двухатомный неметалл [He] 2s2 2p3 8 O Двухатомный неметалл [He] 2s2 2p4 9 F Двухатомный неметалл [He] 2s2 2p5 10 Ne Благородный газ [He] 2s2 2p6 | Первые два, натрий и магний, являются членами s-блока периодической таблицы, в то время как другие члены p-блока.Обратите внимание, что есть трехмерная подоболочка, но ее нет. заполнены до периода 4, что придает периодической таблице ее характерную форму из «двух строк за раз». 11 Na щелочи металл [Ne] 3s1 12 Mg Щелочноземельный металл [Ne] 3s2 13 Al Постпереходный металл [Ne] 3s2 3p1 14 Si Металлоид [Ne] 3s2 3p2 15 P Многоатомный неметалл [Ne] 3s2 3p3 16 S Многоатомный неметалл [Ne] 3s2 3p4 17 Cl Двухатомный неметалл [Ne] 3s2 3p5 18 Ar Благородный газ [Ne] 3s2 3p6 |
| С увеличением атомного номера атомный радиус элементов уменьшается, электроотрицательность увеличивается, а ионизация энергия увеличивается | Как атомный номер элементов в периоде 3 увеличивается, атомный радиус уменьшается, электроотрицательность увеличивается.и энергия ионизации увеличивается |
| В этот период меньше металлов | В этот период больше металлов |
| Все элементы периода могут образовывать двухатомные молекулы, кроме бериллия и неона, т.е. иметь больше двухатомных молекул | В этот период больше многоатомных молекул |
| В этот период менее стабильные изотопы | У всех элементов есть хотя бы одна стабильная изотоп, т.е иметь более стабильные изотопы |
Части Периодической таблицы
Данные взяты из John Emsley, The Elements , 3rd edition. Оксфорд: Clarendon Press, 1998.
Атомный радиус – это расстояние от ядра атом к крайние электроны.Поскольку орбитали вокруг атома равны определяется в терминах распределения вероятностей в квантовой механике, и не имеют фиксированные границы, определить, где «останавливается» атом, не очень просто. Путем сравнения длин связей количество репрезентативных соединений элемента, средний размер для большинства атомов можно определить.
Атомный радиус можно определить и другими способами. Радиус Ван-дер-Ваальса (также известный как несвязывающий атомный радиус ) – это радиус атома, который не связан с другими атомами; это определяется путем измерения расстояния между атомными ядрами, которые в прямом, но не связывающем контакте друг с другом в кристалле решетка.Ковалентный атомный радиус (также известный как атомный радиус связи ) для металлов определяется половина расстояния между двумя соседними атомами в металлическом кристалл, или половина расстояния между одинаково связанными атомами для неметаллы.
К сожалению, определить радиус для каждый элемент периодической таблицы одинаков, и следовательно, иногда бывает трудно сравнивать разные наборы данных.В таблице выше большинство атомных Указанные радиусы являются средними атомными радиусами, а для галогенов (Группа 7A) и благородных газов (группа 8A) используется ковалентный радиус.
Радиусы атомов в периодической таблице изменяются предсказуемым образом. Как видно на рисунках ниже, атомный радиус увеличивается. сверху вниз в группе , а убывает слева направо прямо через период .Таким образом, гелий – самый маленький элемент, а франций – самый крупный.
- Сверху вниз в группе, орбитали, соответствующие более высокие значения главного квантового числа ( n ) добавлены, которые в среднем находятся дальше от ядра, таким образом заставляя размер атома увеличиваться.
- Слева направо в течение периода больше протонов добавляется к ядру, но добавляемые электроны добавляются к валентной оболочке, а не к нижнему уровни энергии.По мере того, как к ядру добавляется больше протонов, электроны в валентной оболочке ощущают более высокую эффективность . ядерный заряд – сумма зарядов на протонах в ядро и заряды на внутренних, остовных электронах. (См. Рисунок ниже.) Таким образом, валентные электроны удерживаются более плотно, и размер атома сокращается через период.
На следующих диаграммах показаны общие тенденции изменения радиусов. атомов:
Аномальные периодические свойства элементов второго периода
Что такое аномальные периодические свойства?
Все элементы по-своему особенные, даже если есть определенные тенденции, которые ученые наблюдали на протяжении многих лет.Элементы, принадлежащие второму периоду, проявляют периодические свойства, которые особенно аномальны.
Давайте сначала посмотрим на элементы, принадлежащие ко второму периоду:
Диагональная связь
Было замечено, что литий, бериллий, бор, углерод, азот, кислород и фтор имеют несколько иные периодические свойства, чем остальные. элементов, относящихся к группе 1, 2, 13-17 соответственно. Например, литий и бериллий образуют ковалентные соединения, тогда как остальные члены групп 1 и 2 образуют ионные соединения.Кроме того, оксид, который образуется бериллием, когда он реагирует с кислородом, имеет амфотерную природу, в отличие от других элементов группы 2, которые образуют основные оксиды. Еще один пример – углерод, который может образовывать стабильные множественные связи, тогда как двойные связи Si = Si не очень распространены.
Итак, четко установлено, что элементы второго периода разные. Фактически, они демонстрируют периодические свойства, которые аналогичны второму элементу следующей группы (то есть литий аналогичен магнию, а бериллий – алюминию), или, другими словами, они имеют диагональное соотношение.
Причины аномальных периодических свойств
Причины различий в периодических свойствах и, следовательно, в химическом поведении:
- Малый размер этих атомов
- Высокая электроотрицательность
- Большое отношение заряда к радиусу
- Эти элементы также имеют только 4 доступные валентные орбитали (2s и 2p) для связывания по сравнению с 9 доступными (3s, 3p и 3d) для других членов соответствующих групп, поэтому их максимальная ковалентность равна 4.(Вот почему бор может образовывать только [BF 4 ] – , тогда как алюминий может образовывать [AlF 6 ] 3- ).
Это причины аномальных периодических свойств элементов второго периода, но есть и несколько других нормальных тенденций в периодической таблице.
Рекомендуемые видео
Часто задаваемые вопросы – FAQ
Что такое аномальная пара элементов?
Аномальные пары – это те пары элементов, которые не подчиняются возрастающему порядку атомных масс.Менделеев поместил эти элементы в свойствах, а не в порядке возрастания их атомной массы, согласно сходству.
Каковы аномальные свойства азота?
Азот небольшой, сильно электроотрицательный, имеет высокую энергию для ионизации, а отсутствие валентных электронов в d-орбитальном кислороде указывает на аномальное поведение. Азот является двухатомным, в то время как для других он многоатомен. Азот – это газ, а другие – сильные.
Какие элементы моста приводят в пример?
Элементы моста – это объекты, принадлежащие циклу 2 таблицы Менделеева.Они названы так, потому что они диагонально идентичны по свойствам, т.е. элементы периода 2 проявляют сходство с элементами следующей категории периода 3, а именно литий-магний; бериллий; алюминий; бор кремний и т. д.
Какие 7 периодов периодической таблицы?
Цикл представляет собой горизонтальный ряд периодической таблицы. Таблица Менделеева включает семь возрастов, каждая из которых начинается в крайнем левом углу.

 Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. Published online 2004. DOI:10.1002/0471238961.1209200811011309.a01.pub2
Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons, Inc. Published online 2004. DOI:10.1002/0471238961.1209200811011309.a01.pub2
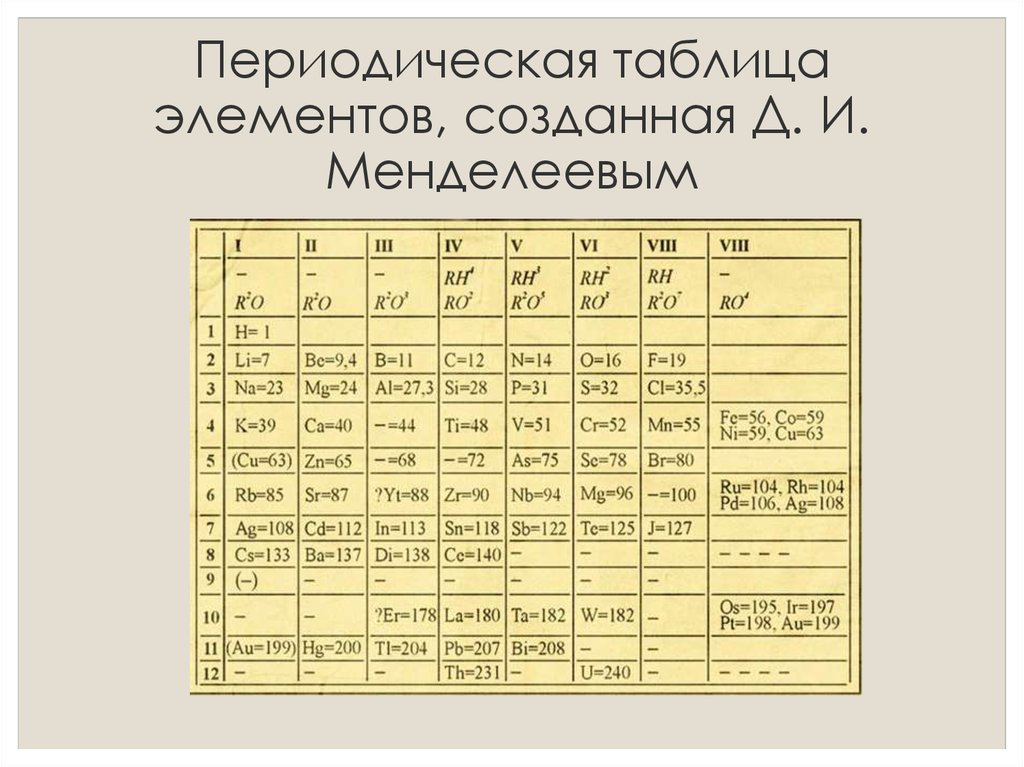

 — McGraw-Hill, 2007. — P. 52. — ISBN 0-07-110595-6
— McGraw-Hill, 2007. — P. 52. — ISBN 0-07-110595-6 EnvironmentalChemistry.com.
EnvironmentalChemistry.com.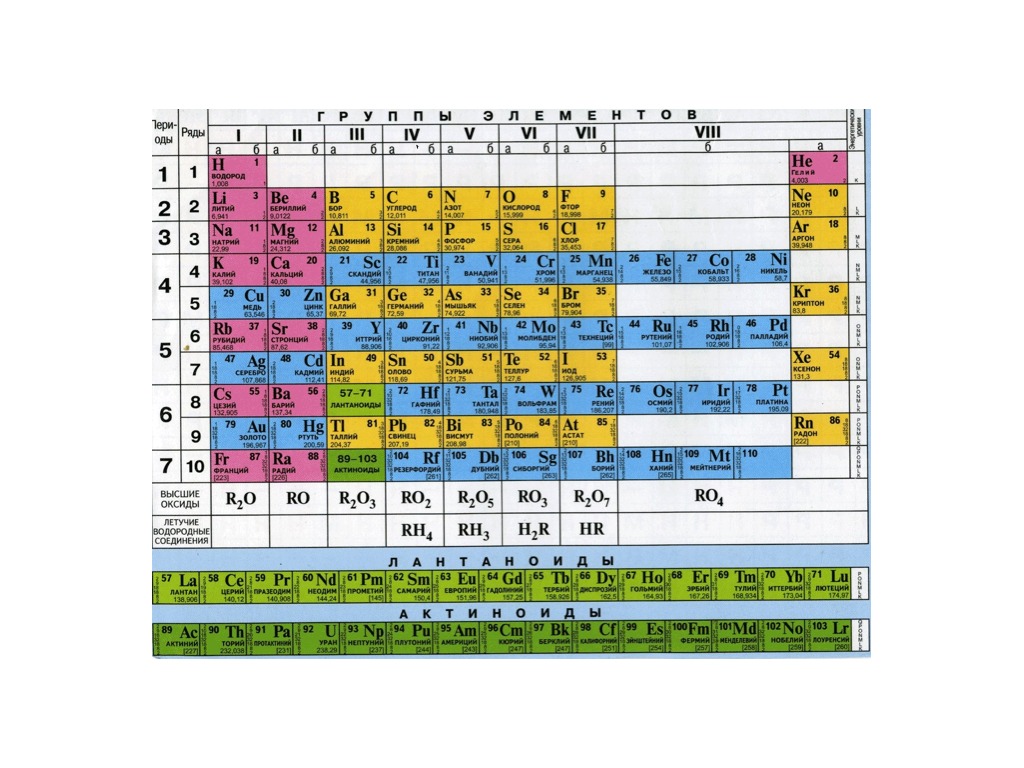 (Н.Глазков)
(Н.Глазков)
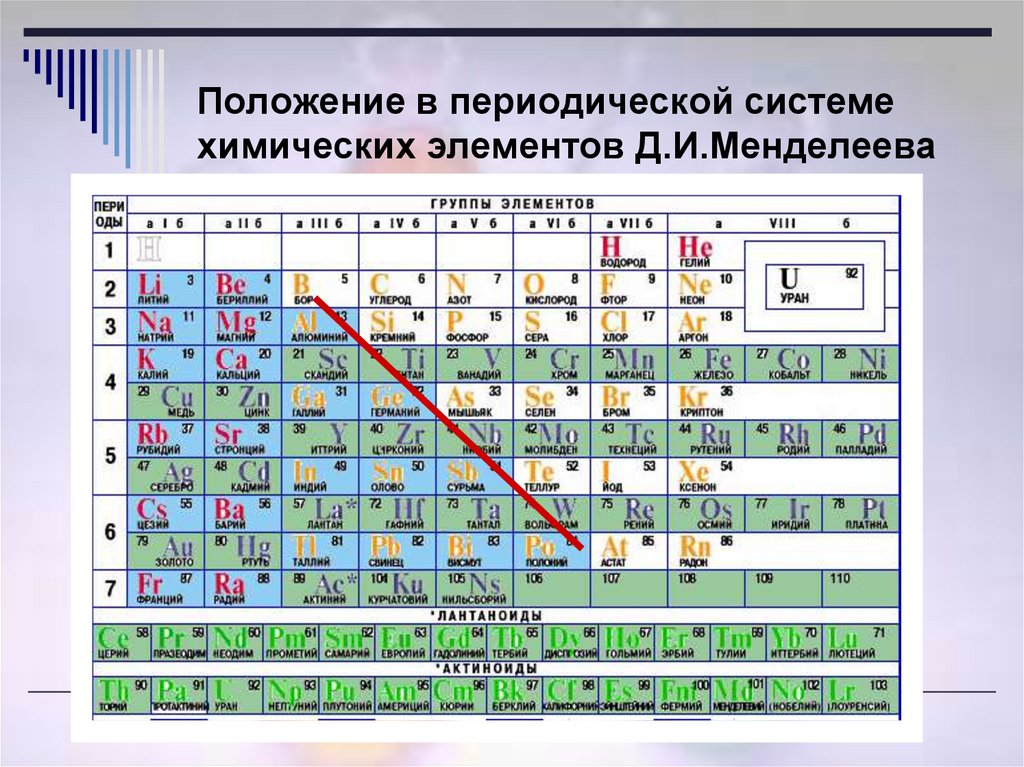 И. Менделеева. Из букв, соответствующих правильным ответам, вы составите название одного из химических элементов третьего периода
И. Менделеева. Из букв, соответствующих правильным ответам, вы составите название одного из химических элементов третьего периода С. Химия 8 класс. Учеб. для общеобразоват. Учеб. заведений. – М.: Дрофа, 2005. – 208 с.
С. Химия 8 класс. Учеб. для общеобразоват. Учеб. заведений. – М.: Дрофа, 2005. – 208 с.