| Относительная электроотрицательность (по Полингу): | |
| Температура плавления: | 822°C |
| Температура кипения: | 1527°C |
| Теплопроводность: | 0 |
| Плотность: | 5,259 г/см3 |
| Открыт: | Е. Демарсе |
| Цвет в твёрдом состоянии: | Серебристо-белый |
| Тип: | Редкоземельный |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f75s25p65d05f06s2 |
| Электронная формула: |
Eu – 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 4f7 6s2 Eu – [Xe] 4f7 6s2 |
| Валентность: | (+2), +3 |
| Степени окисления: | 0, +II, III |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 11,245 В 24,926 В |
Электропроводность в тв. фазе: фазе: |
1,23*106 при 298K |
| Ковалентный радиус: | 1,85 Å |
| Атомный объем: | 28,9 см3/моль |
| Атомный радиус: | 2,56 Å |
| Теплота распада: | 9,21 Кдж/моль |
| Теплота парообразования: | 143,5 Кдж/моль |
| Кристаллическая структура: | Объемоцентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре куба |
химический элемент Европий Europium — “Химическая продукция”
Что такое
Европий, europium, характеристики, свойстваЕвропий — это химический элемент Eu химический элемент с атомным номером 63 и атомной массой 151,964(1) а. е. м., относящийся к группе лантаноидов, а также относящийся к группе редкоземельных элементов.
Европий класс химических элементов
Элемент Eu — относится к группе, классу хим элементов (ягкий серебристо-белый металл, легко окисляющийся на воздухе)
Элемент Eu свойство химического элемента Европий Europium
Основные характеристики и свойства элемента Eu…, его параметры.
Нахождение в природе
Месторождения
Европий входит в состав лантаноидов, которые часто встречаются в США, Казахстанe, России, Австралии, Бразилии, Индии, Скандинавии. Крупнейшее в мире месторождение европия находится в Кении. Значительны запасы в глубоководном месторождении редкоземельных минералов у тихоокеанского острова Минамитори в исключительной экономической зоне Японии.
Получение
Металлический европий получают восстановлением Eu 2 O3 в вакууме лантаном или углеродом, а также электролизом расплава EuCl 3 .
Кристаллическая структура европия при нормальных условиях. а=4,581 Å
Физические свойства
Кристаллическая структура европия при давлении свыше 12,5 ГПа.
Европий в чистом виде представляет собой, как и другие лантаноиды , мягкий серебристо-белый металл . Он имеет необычно низкие плотность (5,243 г/см3), температуру плавления (826 °C) и температуру кипения (1440 °C) по сравнению со своими соседями по периодической системе элементов гадолинием и самарием . Эти величины противоречат явлению лантаноидного сжатия из-за влияния электронной конфигурации атома европия [Xe] 4f 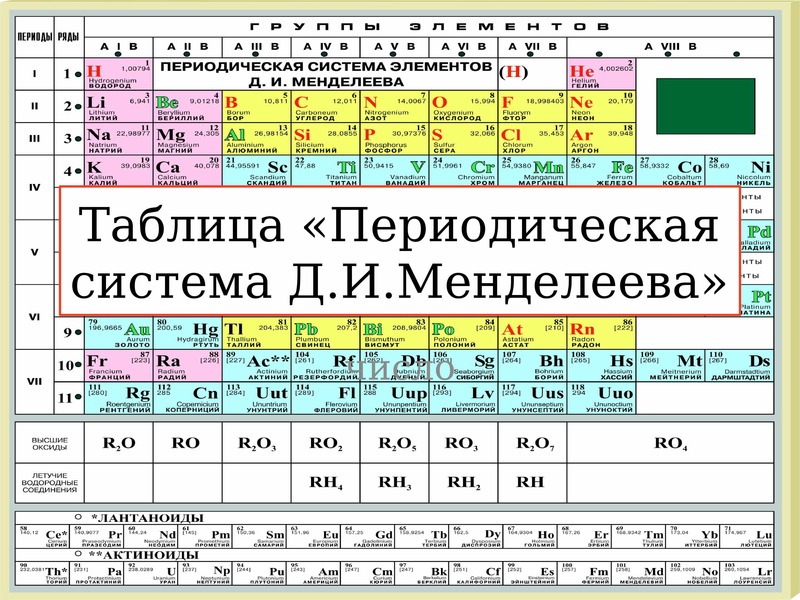
При этом последовательность модификаций при возрастании давления отличается от такой последовательности у других лантаноидов, что наблюдается также и у иттербия .
Первый фазовый переход происходит при давлении свыше 12,5 ГПа, при этом европий образует гексагональную кристаллическую решетку с параметрами a = 2,41 Å и c = 5,45 Å. При давлении свыше 18 ГПа европий образует аналогичную гексагональную кристаллическую решетку с более плотной упаковкой. Ионы европия, встроенные в кристаллическую решетку некоторых соединений, способны вызывать интенсивную флуоресценцию, причем длина волны излучаемого света зависит от степени окисления ионов европия. Eu 
Изотопы
Природный европий состоит из двух изотопов, 151 Eu и 153 Eu, в соотношении примерно 1:1. Европий-153 имеет природную распространённость 52,2 %, он стабилен. Изотоп европий-151 составляет 47,8 % природного европия. Недавно была обнаружена его слабая альфа-радиоактивность с периодом полураспада около 5×10 18 лет, что соответствует примерно 1 распаду за 2 минуты в килограмме природного европия. Кроме этого природного радиоизотопа, созданы и исследованы 35 искусственных радиоизотопов европия, среди которых наиболее устойчивы
Химические свойства
Европий является типичным активным металлом и вступает в реакции с большинством неметаллов. Европий в группе лантаноидов имеет максимальную реакционную способность. На воздухе быстро окисляется, на поверхности металла всегда есть оксидная пленка. Хранят в банках или ампулах под слоем жидкого парафина или в керосине. При нагревании на воздухе до температуры 180 °C воспламеняется и горит с образованием оксида европия (III).
Европий в группе лантаноидов имеет максимальную реакционную способность. На воздухе быстро окисляется, на поверхности металла всегда есть оксидная пленка. Хранят в банках или ампулах под слоем жидкого парафина или в керосине. При нагревании на воздухе до температуры 180 °C воспламеняется и горит с образованием оксида европия (III).
Очень активен, может вытеснять из растворов солей почти все металлы. В соединениях, как и большинство РЗЭ, проявляет преимущественно степень окисления +3, при определённых условиях (например, электрохимическим восстановлением, восстановлением амальгамой цинка и др.) можно получить степень окисления +2. Также при изменении окислительно-восстановительных условий возможно получение степени окисления +2 и +3, что соответствует оксиду с химической формулой Eu 
Применение
Ядерная энергетика
Европий используется в ядерной энергетике в качестве поглотителя нейтронов (в основном окись европия , гексаборид и борат европия ) в атомных реакторах , но окись постепенно «выгорает», и по срокам эксплуатации уступает карбиду бора в 1,5 раза (хотя имеет преимущество в почти полном отсутствии газовыделения и распухания в мощном потоке нейтронов, например, реактор БН-600 ). Сечение захвата тепловых нейтронов европием (природной смесью изотопов) составляет около 4500 барн , самым активным в отношении захвата нейтронов является европий-151 (9200 барн).
Атомно-водородная энергетика
Оксид европия применяется при термохимическом разложении воды в атомно-водородной энергетике (европий-стронций-йодидный цикл).
Лазерные материалы
Ионы европия служат для генерации лазерного излучения в видимой области спектра с длиной волны 0,61 мкм (оранжевые лучи), поэтому оксид европия используется для создания твердотельных, и менее распространённых жидкостных лазеров.
Электроника
Европий является легирующей примесью в моносульфиде самария (термоэлектрогенераторы), а также как легирующий компонент для синтеза алмазоподобного (сверхтвердого) нитрида углерода .
Силицид европия в виде тонких пленок находит применение в интегральной микроэлектронике .
Моноокись европия , а также сплав моноокиси европия и моноокиси самария применяются в виде тонких пленок в качестве магнитных полупроводниковых материалов для функциональной электроники и, в частности, МДП-электроники.
Люминофоры
- Европий — непременная составляющая люминофоров, используемых в электронно-лучевых и плазменных цветных экранах.
- Купюры евро защищены от подделок люминофорами на основе европия.
- Вольфрамат европия — люминофор, используемый в микроэлектронике.
- Легированный европием борат стронция используется как люминофор в лампах чёрного света .
Медицина
Катионы европия используются в медицинской диагностике в качестве флуоресцентных зондов. Радиоактивные изотопы европия применяются при лечении некоторых форм рака.
Радиоактивные изотопы европия применяются при лечении некоторых форм рака.
Другие сферы применения
- Интенсивно изучаются светочувствительные соединения европия с бромом, хлором и иодом.
- Европий-154 обладает большой мощностью тепловыделения при радиоактивном распаде и предложен в качестве источника в радиоизотопных источниках энергии.
Влияние на качество воды
В реакциях с водой европий химически ведет себя как кальций. При уровнях рН ниже 6 европий способен мигрировать в воде в ионном виде. При более высоких уровнях рН европий образует плохо растворимые и, соответственно, менее подвижные гидроксиды. При контакте с кислородом воздуха происходит дальнейшее окисление до Eu 2 O3 . Максимально наблюдаемые концентрации европия в природных маломинерализованных водах составляют менее 1 мкг/л (в морской воде — 1,1⋅10 −6 мг/л). Влияние на качество воды при таких концентрациях представляется незначительным. Предельно допустимая концентрация (ПДК) в воде нормируется только российскими нормами и равна (для питьевой воды) 0,3 мг/л.
Пути поступления в организм
Вероятность попадания европия в организм человека представляется незначительной. Возможно поступление европия в организм с водой в микроскопических количествах. Нельзя исключать вероятности и других путей попадания в организм у людей, сталкивающихся с соединениями европия на производстве.
Потенциальная опасность для здоровья
Европий относится к малотоксичным элементам. Нет какой-либо информации о последствиях воздействия европия на организм человека.
Физиологическое значение
На данный момент нет данных о какой-либо биологической роли европия в организме человека.
формула химического элемента Европий Europium
Химическая формула Европия:
Атомы Европий Europium химических элементов
Атомы Europium хим. элемента
Europium Европий ядро строение
Строение ядра химического элемента Europium — Eu,
История открытия Европий Europium
Открытие элемента Europium — Первыми спектральные линии, отнесённые впоследствии к европию, наблюдали Крукс (1886) и Лекок де Буабодран (1892). Демарсе обнаружил полосу спектра элемента в самариевой земле в 1896 году, а в 1901 году смог выделить элемент, описал его и дал ему название в честь Европы.
Демарсе обнаружил полосу спектра элемента в самариевой земле в 1896 году, а в 1901 году смог выделить элемент, описал его и дал ему название в честь Европы.
Европий Europium происхождение названия
Откуда произошло название Europium …
Распространённость Европий Europium
Как любой хим. элемент имеет свою распространенность в природе, Eu …
Получение Европий Europium
Europium — получение элемента
Физические свойства Европий Europium
Основные свойства Europium
Изотопы Europium Европий
Наличие и определение изотопов Europium
Eu свойства изотопов Европий Europium
…
Химические свойства Европий Europium
Определение химических свойств Europium
Меры предосторожности Европий Europium
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Europium
Стоимость Европий Europium
Рыночная стоимость Eu, цена Европий Europium Европий является одним из самых дорогих лантаноидов. В 2014 году цена металлического европия ЕВМ-1 составляла от 800 до 2000 долларов США за кг, а оксида европия чистотой 99,9 % — около 500 долларов за кг.
В 2014 году цена металлического европия ЕВМ-1 составляла от 800 до 2000 долларов США за кг, а оксида европия чистотой 99,9 % — около 500 долларов за кг.
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент Eu
ЕВРОПИЙ (лат. Europium) – Лантаноиды – Элементы – Каталог статей
Химический элемент таблицы Менделеева, металл.
Символ элемента: Eu.
Атомный номер: 63.
Положение в таблице: 6-й период, группа – IIIB(3).
Относительная атомная масса: 151,96.
Степени окисления: +3, реже +2.
Валентности: II,III.
Электроотрицательность: 1.
Электронная конфигурация: [Xe]4 s 2p 6 d10 f7 5s2 p6 6s2.
Состоит из двух стабильных изотопов 151 Eu (47,82%) и 153 Eu (52,18%).
Строение атома
Число электронов: 63.
Число протонов: 63.
Радиус нейтрального атома 0,202 нм, радиус иона Eu 2+— 0,131 нм, иона Eu3+ — 0,109 нм. Энергии последовательной ионизации атома 5,664, 11,25, 24,70, 42,65 эВ.
История открытия
Европий открыт Э. Демарсе в 1886. Название элемент получил в 1901 по названию континента. Металлический европий был впервые получен в 1937 году.
Нахождение в природе
Содержание европия в земной коре 1,310-4 %, в морской воде 1,110 -6 мг/л. Входит в состав минералов монацита, лопарита, бастнезита и других.
Получение
Металлический европий получают восстановлением Eu2О3 в вакууме лантаном или углеродом, а также электролизом расплава EuСl3 .
Физические и химические свойства
Европий — серебристо-серый металл. Решетка кубическая типа a -Fe, а = 0,4582 нм. Температура плавления 826°C, температура кипения 1559°C, плотность 5,245 кг/дм3 .
На воздухе европий покрывается пленкой оксидов и гидратированных карбонатов. При небольшом нагревании окисляется быстро. При слабом нагревании реагирует с галогенами, азотом и водородом. С водой и минеральными кислотами реагирует при комнатной температуре.
Оксид Eu2О3 обладает основными свойствами, ему отвечает сильное основание Eu(ОН)3 . При взаимодействии Eu и Eu2О3 , а также при взаимодействии оксигалогенидов трехвалентного европия с гидридом лития LiH образуется оксид европия(II) EuО. Этому оксиду отвечает основание Eu(ОН)2 .
Применение
Применяют как поглотитель нейтронов в ядерной технике, активатор люминофоров красного свечения, используемых в цветном телевидении. 155 Eu — в медицинской диагностике.
=3>
Европий – 63 элемент таблицы Менделеева
Последний редкоземельный элемент цериевой подгруппы – европий – так же, как и его соседи по таблице Менделеева, входит в число наиболее сильных поглотителей тепловых нейтронов. На этом базируется его применение в атомной технике и технике защиты от излучений.
На этом базируется его применение в атомной технике и технике защиты от излучений.
В качестве материала противонейтронной защиты элемент №63 интересен тем, что его природные изотопы 151Eu и 153Eu, поглощая нейтроны, превращаются в изотопы, у которых почти так же велико сечение захвата тепловых нейтронов. Радиоактивный европий, полученный в атомных реакторах, использовали при лечении некоторых форм рака. Важное значение приобрел европий как активатор люминофоров. В частности, окись, оксисульфид и ортованадат иттрия YVO4, используемые для получения красного цвета на телевизионных экранах, активируются микропримесями европия. Имеют практическое значение и другие люминофоры, активированные европием. Основу их составляют сульфиды цинка и стронция, фториды натрия и кальция, силикаты кальция и бария.
Известно, что европием, отделенным от других лантаноидов, пытались легировать некоторые специальные сплавы, в частности сплавы на основе циркония.
Элемент №63 не во всем подобен другим редкоземельным элементам. Европий – самый легкий из лантаноидов, его плотность всего 5,245 г/см3. У европия же наибольшие из всех лантаноидов атомный радиус и атомный объем. С этими «аномалиями» свойств элемента №63 некоторые исследователи связывают и тот факт, что из всех редкоземельных элементов европий – наименее устойчивый к корродирующему действию влажного воздуха и воды.
Европий – самый легкий из лантаноидов, его плотность всего 5,245 г/см3. У европия же наибольшие из всех лантаноидов атомный радиус и атомный объем. С этими «аномалиями» свойств элемента №63 некоторые исследователи связывают и тот факт, что из всех редкоземельных элементов европий – наименее устойчивый к корродирующему действию влажного воздуха и воды.
Реагируя с водой, европий образует растворимое соединение Eu(OH)2 · 2h3O. Оно желтого цвета, но при хранении постепенно белеет. По-видимому, здесь происходит дальнейшее окисление кислородом воздуха до Eu2O3.
Как мы уже знаем, в соединениях европий бывает двух- и трехвалентным. Большинство его соединений – белого цвета обычно с кремовым, розоватым или светло-оранжевым оттенком. Соединения европия с хлором и бромом светочувствительны.
Как известно, трехвалентные ионы многих лантаноидов могут быть использованы, подобно иону Cr3+ в рубине, для возбуждения лазерного излучения. Но из всех их только ион Eu3+ дает излучение в воспринимаемой человеческим глазом части спектра. Луч европиевого лазера – оранжевый.
Луч европиевого лазера – оранжевый.
физические и химические свойства элемента
Использование и свойства элемента Европий
Объяснение изображения
Дизайн основан на флаге Европейского Союза и денежном символе.
Внешность
Мягкий серебристый металл, который быстро тускнеет и вступает в реакцию с водой.
Использует
Европий используется при печати банкнот евро. Он светится красным в ультрафиолетовом свете, и подделки можно обнаружить по его отсутствию.Лампочки с низким энергопотреблением содержат немного европия, чтобы обеспечить более естественный свет за счет уравновешивания голубого (холодного) света с небольшим количеством красного (теплого) света.Европий отлично поглощает нейтроны, что делает его ценным в управляющих стержнях ядерных реакторов. Пластик, легированный европием, использовался в качестве материала для лазеров. Он также используется для изготовления тонких сверхпроводящих сплавов.
Биологическая роль
Европий не имеет известной биологической роли. Обладает низкой токсичностью.
Обладает низкой токсичностью.
Природное изобилие
Как и другие лантаноиды, европий в основном содержится в минералах монаците и бастнезите. Его можно приготовить из этих минералов. Однако обычным методом приготовления является нагревание оксида европия (III) с избытком лантана в вакууме.
Химические свойства
| Атомный радиус, несвязанный (Å) | 2.35 | Ковалентный радиус (Å) | 1,83 |
| Сродство к электрону (кДж моль -1 ) | 83,363 | Электроотрицательность (шкала Полинга) | Неизвестно |
| Энергия ионизационной (кДж моль -1 ) | 1- й 547,1092- й 1085,463- й2404,414 чт 4119,95 чт -6 чт -7 чт -8 чт- |
Состояния окисления и изотопы Европий
| Общие состояния окисления | 3 , 2 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 151 Eu | 150. 920 920 | 47,81 | > 1.7×10 18 лет | ||
| 153 Eu | 152,921 | 52,19 | – | – |
Данные о давлении и температуре
| Удельная теплоемкость (Дж кг −1 K −1 ) | 182 | Модуль Юнга (ГПа) | 18,2 | |||||||
| Модуль сдвига (ГПа) | 7.9 | Объемный модуль (ГПа) | 8,3 | |||||||
| Давление газа | ||||||||||
| Температура (K) | 400600800100012001400160018002000 г. 22002400 22002400 | |||||||||
| 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 г. | 2200 | 2400 |
| Давление (Па) | -1,74 х 10-50,10919,4——- | |||||||||
| – | 1,74 х 10-5 | 0,109 | 19,4 | – | – | – | – | – | – | – |
Европий, свойства атома, химические и физические свойства
Европий, свойства атома, химические и физические свойства.

Eu 63 Европий
151,964(1) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f7 5s2 5p6 6s2
Европий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 63. Расположен в 3-й группе (по старой классификации — побочной подгруппе третьей группы), шестом периоде периодической системы. Относится к группе лантаноидов.
Атом и молекула европия. Формула европия. Строение атома европия
Изотопы и модификации европия
Свойства европия (таблица): температура, плотность, давление и пр.
Физические свойства европия
Химические свойства европия. Взаимодействие европия. Химические реакции с европием
Получение европия
Применение европия
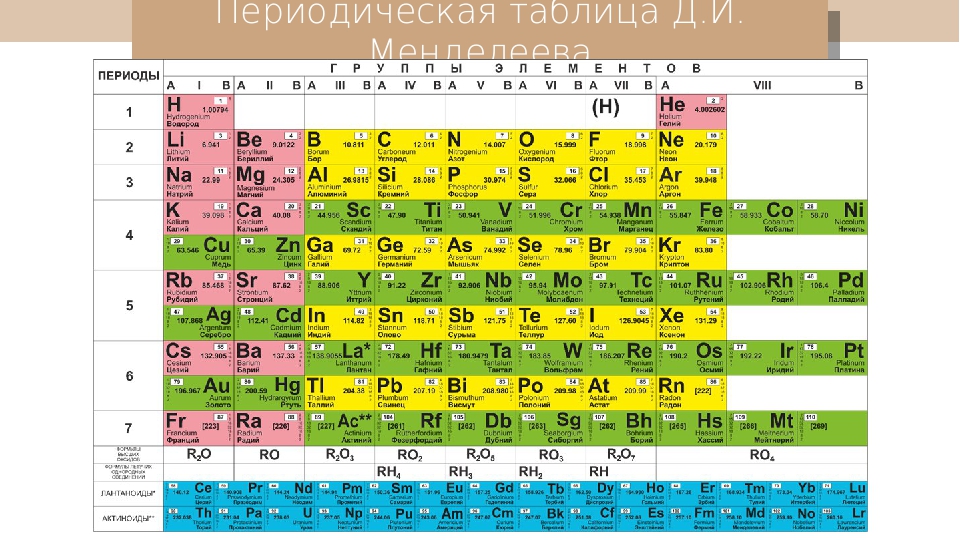
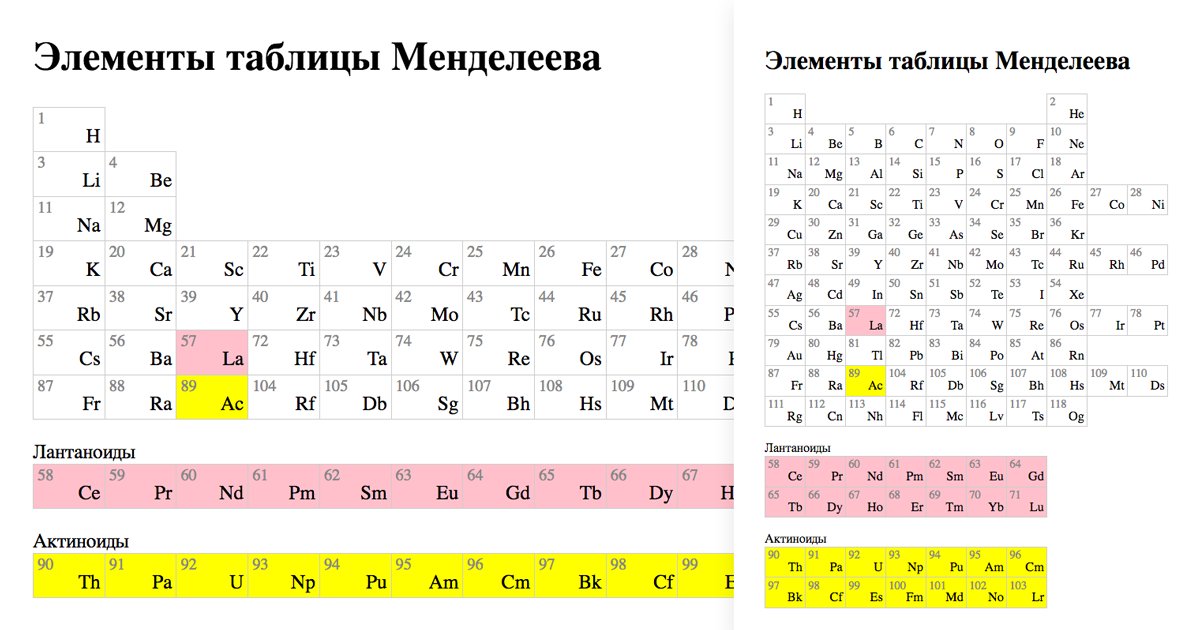
Таблица химических элементов Д.И. Менделеева
Атом и молекула европия.
 Формула европия. Строение атома европия:
Формула европия. Строение атома европия:Европий (лат. Europium, назван в честь Европы) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Eu и атомным номером 63. Расположен в 3-й группе (по старой классификации – побочной подгруппе третьей группы), шестом периоде периодической системы.
Европий – металл. Относится к редкоземельным элементам, а также к группе переходных металлов и к лантаноидам.
Как простое вещество европий при нормальных условиях представляет собой мягкий, серебристо-белый металл.
Молекула европия одноатомна.
Химическая формула европия Eu.
Электронная конфигурация атома европия 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f7 5s2 5p6 6s2. Потенциал ионизации (первый электрон) атома европия равен 547,11 кДж/моль (5,670385(5) эВ).
Строение атома европия. Атом европия состоит из положительно заряженного ядра (+63), вокруг которого по шести оболочкам движется 63 электрона. При этом 61 электрон находится на внутреннем уровне, а 2 электрона – на внешнем. Поскольку европий расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и пятая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлены s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома европия на 4f-орбитали находятся семь неспаренных электронов. На внешнем энергетическом уровне атома европия на 6s-орбитали находятся два спаренных электрона. В свою очередь ядро атома европия состоит из 63 протонов и 89 нейтронов. Европий относится к элементам f-семейства.
На внутреннем энергетическом уровне атома европия на 4f-орбитали находятся семь неспаренных электронов. На внешнем энергетическом уровне атома европия на 6s-орбитали находятся два спаренных электрона. В свою очередь ядро атома европия состоит из 63 протонов и 89 нейтронов. Европий относится к элементам f-семейства.
Радиус атома европия (вычисленный) составляет 231 пм.
Атомная масса атома европия составляет 151,964(1) а. е. м.
Содержание европия в земной коре составляет 0,00018 %, в морской воде и океане – 1,3×10–11 %.
Изотопы и модификации европия:
Свойства европия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Европий |
| 102 | Прежнее название | |
| 103 | Латинское название | Europium |
| 104 | Английское название | Europium |
| 105 | Символ | Eu |
| 106 | Атомный номер (номер в таблице) | 63 |
| 107 | Тип | Металл |
| 108 | Группа | Лантаноид. Переходный, редкоземельный металл Переходный, редкоземельный металл |
| 109 | Открыт | Эжен-Анатоль Демарсе, Франция, 1879 г. |
| 110 | Год открытия | 1879 г. |
| 111 | Внешний вид и пр. | Мягкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | 168Er |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00018 % |
| 120 | Содержание в морях и океанах (по массе) | 1,3·10-11 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 5,0·10-8 % |
| 123 | Содержание в метеоритах (по массе) | 5,9·10-6 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 151,964(1) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f7 5s2 5p6 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N25 O8 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 231 пм |
| 205 | Эмпирический радиус атома* | 185 пм |
| 206 | Ковалентный радиус* | 198 пм |
| 207 | Радиус иона (кристаллический) | Eu2+ 131 (6) пм, Eu3+ 108,7 (6) пм, 121 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 63 электрона, 63 протона, 89 нейтронов |
| 210 | Семейство (блок) | элемент f-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 3-я группа (по старой классификации – побочная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | +1, +2, +3 |
| 302 | Валентность | II, III |
| 303 | Электроотрицательность | 1,2 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 547,11 кДж/моль (5,670385(5) эВ) |
| 305 | Электродный потенциал | Eu2+ + 2e– → Eu, Eo = -3,395 В, Eu3+ + e– → Eu2+, Eo = -0,429 В |
| 306 | Энергия сродства атома к электрону | 50 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 5,264 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 5,13 г/см3 (при температуре плавления 826 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления | 826 °C (1099 K, 1519 °F) |
| 403 | Температура кипения* | 1529 °C (1802 K, 2784 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 9,21 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 176 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,171 Дж/г·K (при 0 °C) |
| 410 | Молярная теплоёмкость* | 27,66 Дж/(K·моль) |
| 411 | Молярный объём | 28,9 см³/моль |
| 412 | Теплопроводность | 13,9 Вт/(м·К) (при стандартных условиях), 13,9 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 4,581 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-53-1 |
Примечание:
205* Эмпирический радиус атома европия согласно [1] и [3] составляет 180 пм и 199 пм соответственно.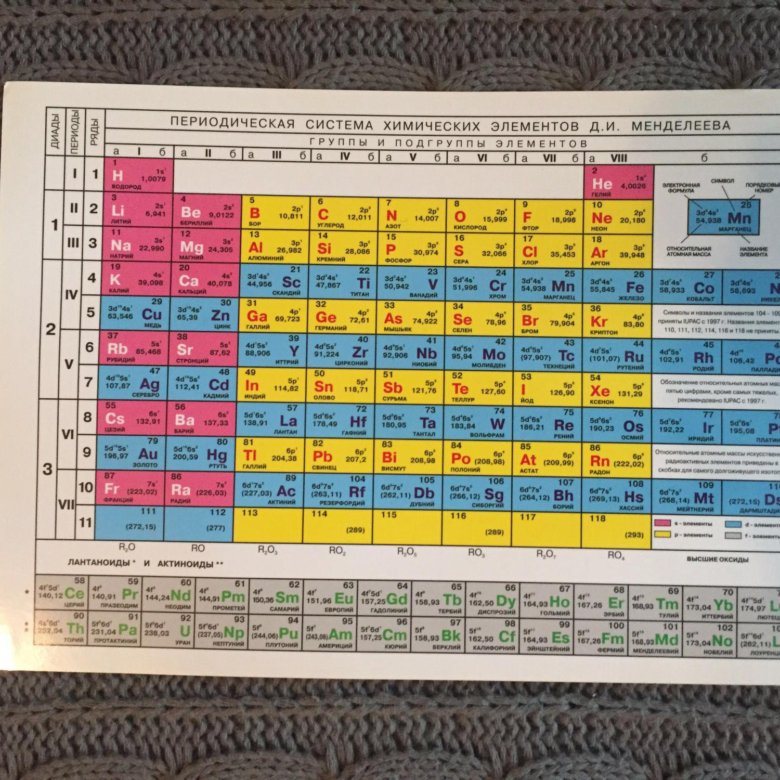
206* Ковалентный радиус европия согласно [1] и [3] составляет 198±6 пм и 185 пм соответственно.
401* Плотность европия согласно [3] и [4] составляет 5,243 г/см3 (при 0 °C, состояние вещества – твердое тело) и 5,24 г/см3 (при 20 °C, состояние вещества – твердое тело) соответственно.
403* Температура кипения европия согласно [4] составляет 1560 °C (1833,15 K, 2840 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) европия согласно [4] составляет 9,2 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) европия согласно [4] составляет 147 кДж/моль.
410* Молярная теплоёмкость европия согласно [3] составляет 27,656 Дж/(K·моль).
Физические свойства европия:
Химические свойства европия. Взаимодействие европия. Химические реакции с европием:
Получение европия:
Применение европия:
Таблица химических элементов Д.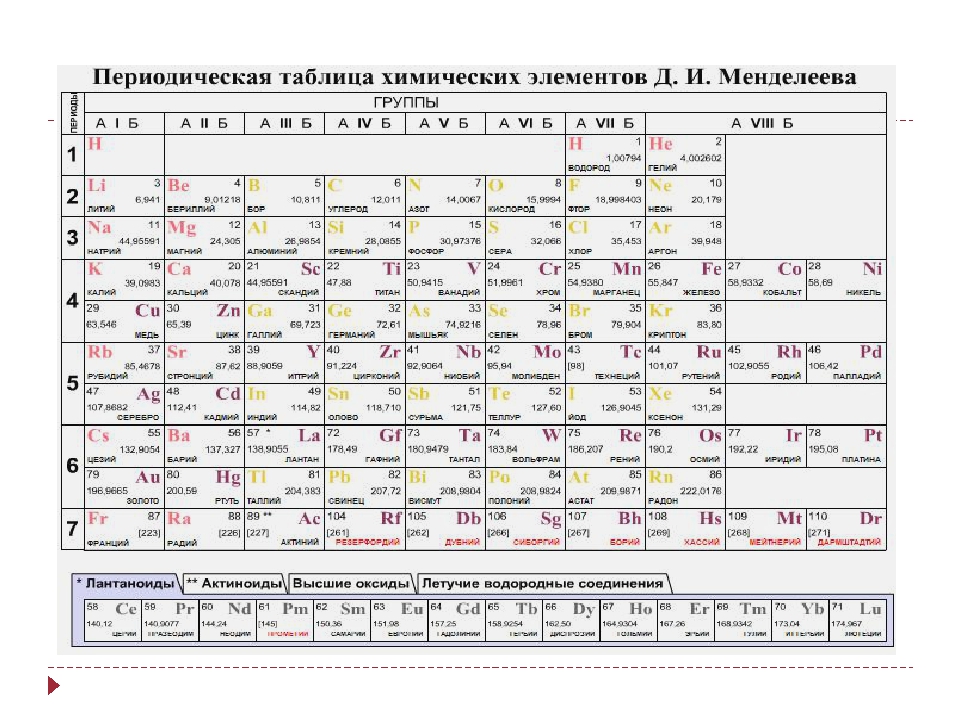 И. Менделеева
И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34.
 Селен
Селен - 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67.
 Гольмий
Гольмий - 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100.
 Фермий
Фермий - 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Europium
- https://de.wikipedia.org/wiki/Europium
- https://ru.wikipedia.org/wiki/Европий
- http://chemister.ru/Database/properties.php?dbid=1&id=272
- https://chemicalstudy.ru/evropiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.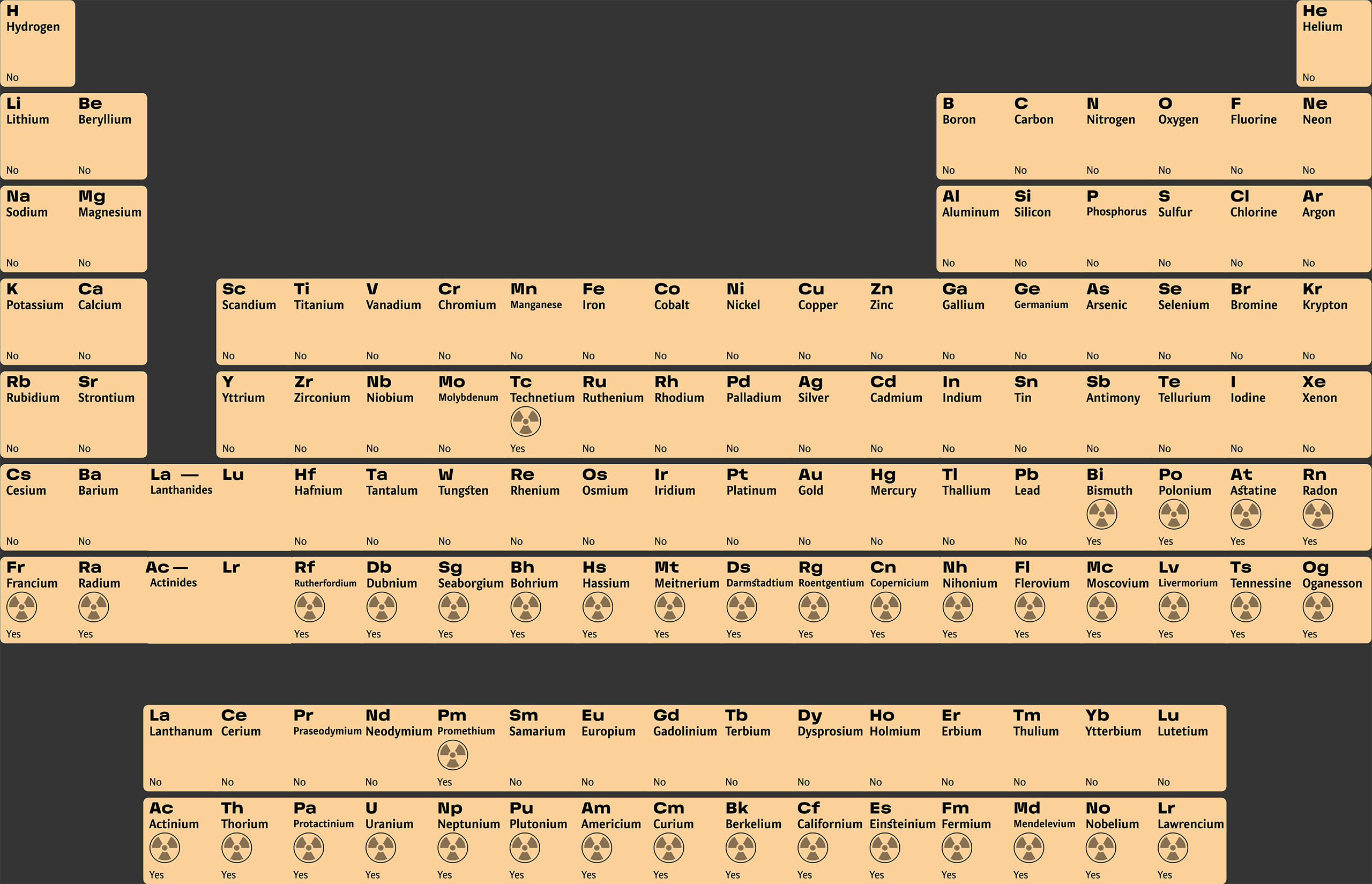 pexels.com, https://pixabay.com
pexels.com, https://pixabay.com
карта сайта
европий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле европия европий
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 701
gaz.wiki – gaz.wiki
- Main page
Languages
- Deutsch
- Français
- Nederlands
- Русский
- Italiano
- Español
- Polski
- Português
- Norsk
- Suomen kieli
- Magyar
- Čeština
- Türkçe
- Dansk
- Română
- Svenska
Europium – Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: европий
(Promo)
Вы слушаете химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе мы раскрываем происхождение элемента, который поместил красный цвет в цветной телевизор, а также породил ряд с Францией, так что я полагаю, что там ничего нет необычное там.
Брайан Клегг
Многие страны отмечены в периодической таблице Менделеева. Есть америций, германий, полоний и франций, и это лишь некоторые из них. Обычно эти топонимы отражают, где работал их первооткрыватель.Но, несмотря на количество элементов, впервые выделенных в Англии – десять из них были обнаружены только в Королевском институте в Лондоне – Англия, Юнайтедкиндиум или Бриттания не существует. Однако есть европий, допускающий возможность открытия британским исследователем.
Европий – это лантаноид, один из тех незнакомых элементов, которые не входят в основную структуру периодической таблицы Менделеева. Имея атомный номер 63, он обитает в линейке элементов, которые численно сжимаются между барием и гафнием.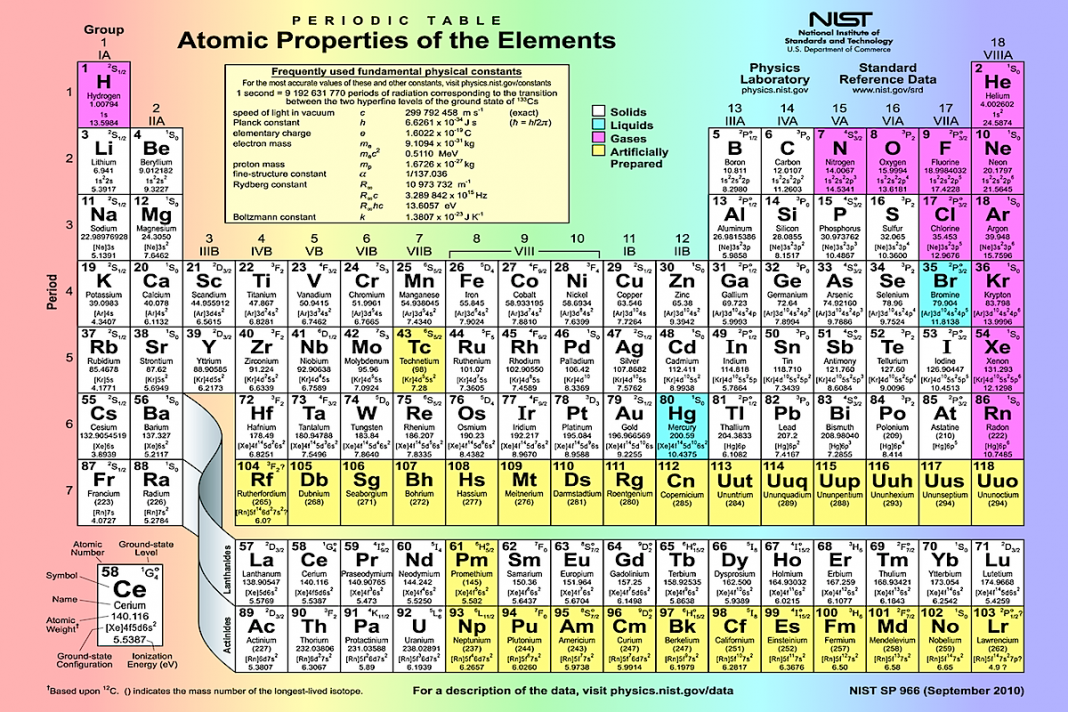 Наряду со скандием и иттрием их иногда называют редкоземельными элементами – что-то неправильное, поскольку они не так уж редки, но минералы, которые они были первоначально обнаружены в , были редкими , отсюда и название.
Наряду со скандием и иттрием их иногда называют редкоземельными элементами – что-то неправильное, поскольку они не так уж редки, но минералы, которые они были первоначально обнаружены в , были редкими , отсюда и название.
Европий был не столько обнаружен, сколько нащупан. Британским связным здесь является английский ученый сэр Уильям Крукс, который работал как в области химии, так и физики. Крукса, вероятно, больше всего помнят за его работу с газоразрядными трубками. Он исследовал (научный термин для «возиться с чем-то») эффект подачи высокого напряжения на два электрода внутри трубки с высасыванием большей части воздуха. Это вызвало неземное свечение на стекле на конце трубки. Крукс назвал этот эффект катодным лучом.В конечном итоге было показано, что это вызвано потоком электронов, а трубка Крукса была предком традиционных телевизионных экранов и компьютерных мониторов.
Но Крукс также был активным химиком. Он открыл элемент таллий, и некоторые приписывают открытие нашей сегодняшней темы – европия. В конце 1880-х годов Крукс заметил новое направление в спектроскопическом анализе минерала, содержащего иттербий и самарий. Спектроскопия – это метод, который позволяет анализировать материал путем измерения различных цветов света, который поглощается им или излучается при нагревании, давая уникальный визуальный отпечаток.Крукс полагал, что он обнаружил новый элемент – так что в некотором смысле открыл европий, но так и не изолировал его.
В конце 1880-х годов Крукс заметил новое направление в спектроскопическом анализе минерала, содержащего иттербий и самарий. Спектроскопия – это метод, который позволяет анализировать материал путем измерения различных цветов света, который поглощается им или излучается при нагревании, давая уникальный визуальный отпечаток.Крукс полагал, что он обнаружил новый элемент – так что в некотором смысле открыл европий, но так и не изолировал его.
Другие признают французских первооткрывателей – или Поль Лекок де Буабодран, плодовитый исследователь новых элементов, который также определил ряд новых линий пару лет спустя, или окончательно Эжен-Анатоль Демарсе, который произвел соль европия в 1901 году (это потребовалось еще много лет, чтобы добраться до чистого металла). Его определенно назвал Демарсей, что неудивительно, поскольку ни один англичанин времен Крукса не считал себя европейцем.
Это хороший пример того, как научные открытия не являются шаблонными. Эксперт-историк Патрисия Фара проводит параллель между открытиями европия и пенициллина. Мы обычно награждаем за обнаружение этой жизненно важной формы Александру Флемингу, который обнаружил ее, но не стал заниматься ею дальше, а не команде, выделившей пенициллин. Но для европия многие историки разыгрывают события наоборот, игнорируя Флеминга европия, Уильяма Крукса.
Мы обычно награждаем за обнаружение этой жизненно важной формы Александру Флемингу, который обнаружил ее, но не стал заниматься ею дальше, а не команде, выделившей пенициллин. Но для европия многие историки разыгрывают события наоборот, игнорируя Флеминга европия, Уильяма Крукса.
Даже если Крукс не первооткрыватель, он все равно играет роль в истории европия из-за электронно-лучевых трубок.Если вы слушаете этот подкаст на компьютере с традиционным цветным монитором, европий улучшит ваше представление о веб-сайте Chemistry World. Когда впервые были разработаны цветные телевизоры, красные пиксели были относительно слабыми, что означало, что весь цветовой спектр должен был оставаться приглушенным. Но люминофор, легированный европием, оказался гораздо лучшим и ярким источником красного цвета и до сих пор присутствует в большинстве сохранившихся мониторов и телевизоров, предшествующих революции плоских экранов.
Допинг – это своего рода специальность для европия.Легирование включает добавление относительно небольшого количества материала к другому для изменения его свойств. Часто это роль европия в люминофорах, материалах, используемых для обеспечения свечения при стимуляции электронами в телевизорах или ультрафиолетом в люминесцентных лампах. Помимо красного свечения от версии европия с валентностью три, его соли с валентностью две производят голубое сияние. Это и в сочетании с третьим люминофором для получения белого света в компактных люминесцентных лампах.
Часто это роль европия в люминофорах, материалах, используемых для обеспечения свечения при стимуляции электронами в телевизорах или ультрафиолетом в люминесцентных лампах. Помимо красного свечения от версии европия с валентностью три, его соли с валентностью две производят голубое сияние. Это и в сочетании с третьим люминофором для получения белого света в компактных люминесцентных лампах.
Еще одна фосфоресцирующая роль европия, название которой особенно уместно, – это знак защиты от подделки на банкнотах евро.Европий также стоит за действием минерала, который дает нам слово «флуоресцентный». При флуоресценции материал поглощает свет относительно высокой энергии, например ультрафиолетовый, и излучает более низкую частоту в видимом диапазоне, что делает вещество неестественно ярким. Тот же тип европия, который отвечает за синий люминофор в флуоресцентных лампах, присутствует в некоторых вариантах минерального флюорита, и именно его голубое свечение привело к тому, что слово флуоресцентный произошло от названия минерала.
Хотя технически европий является металлом, ему не хватает привычного металлического блеска, потому что он очень легко окисляется. Этот серебристо-белый материал никогда не встречается в свободном состоянии. Если он не вступает в реакцию с воздухом, он растворяется в воде с образованием гидроксида. Европий также является отличным поглотителем нейтронов, что делает его интересной возможностью для гашения ядерных реакторов путем улавливания паразитных нейтронов, хотя до настоящего времени он не получил широкого распространения.
Итак, это европий – вещество, придающее цвет люминофорам.Как-то уместно, что открытие европия, элемента, названного в честь европейского континента, стало предметом спора между Англией и Францией. Некоторые вещи, кажется, никогда не изменятся.
Крис Смит
Брайан Клегг с историей о европии, элементе, который заставляет вас видеть красный цвет, или, по крайней мере, на старомодном экране телевизора. На следующей неделе – внутренняя история элемента, который просто не хотел быть обнаруженным.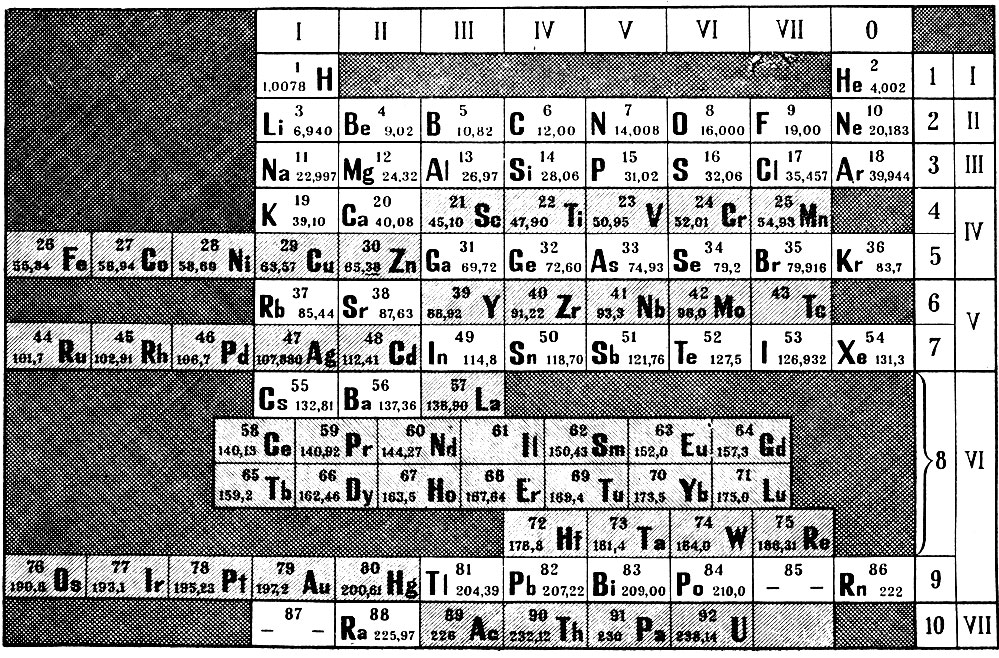
Крис Орвиг
Ванадий, переходный металл первого ряда в Периодической таблице, представляет собой элемент загадки.Мало того, что он был впервые перевезен двести лет назад из Мексики и потерян в результате кораблекрушения вместе со всеми соответствующими лабораторными записями великого немецкого ученого барона фон Гумбольдта, но и несколько раз требовал открытия под такими известными именами, как Велер, Берцелиус и дель Рио (которого фактически отговорили от его притязаний в 1805 году).
Крис Смит
Но почему и кто в конечном итоге открыл ванадий и что мы с ним делаем сегодня. Чтобы узнать это, присоединяйтесь к Крису Орвигу, который расскажет о химии в ее стихии на следующей неделе.Я Крис Смит, спасибо за внимание и до свидания.
(Промо)
(Окончание промо)
Дефицит элементов – Периодическая таблица EuChemS
Смартфон, который вы можете использовать прямо сейчас для просмотра этой уникальной таблицы Менделеева, состоит примерно из 30 элементов, более половины из которых могут вызывать беспокойство в ближайшие годы из-за растущего дефицита.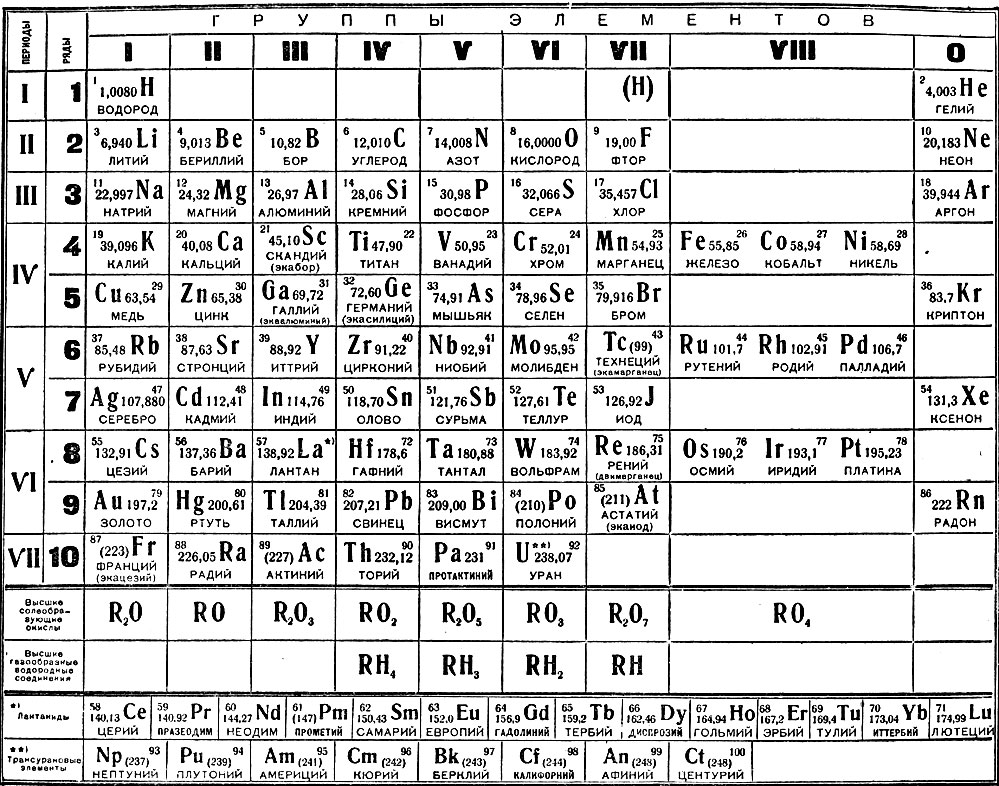 Невозможно переоценить проблему нехватки элементов.В связи с тем, что только в Европейском союзе ежемесячно выбрасывается или заменяется около 10 миллионов смартфонов, нам необходимо внимательно изучить нашу склонность к выбрасыванию и ненадлежащей переработке таких предметов. Если не будут предложены решения, мы рискуем увидеть, что многие природные элементы, из которых состоит окружающий нас мир, закончатся – будь то из-за ограниченных запасов, их расположения в зонах конфликтов или нашей неспособности полностью их переработать.
Невозможно переоценить проблему нехватки элементов.В связи с тем, что только в Европейском союзе ежемесячно выбрасывается или заменяется около 10 миллионов смартфонов, нам необходимо внимательно изучить нашу склонность к выбрасыванию и ненадлежащей переработке таких предметов. Если не будут предложены решения, мы рискуем увидеть, что многие природные элементы, из которых состоит окружающий нас мир, закончатся – будь то из-за ограниченных запасов, их расположения в зонах конфликтов или нашей неспособности полностью их переработать.
Защита находящихся под угрозой элементов должна быть достигнута на нескольких уровнях.Как частные лица, мы должны задаться вопросом, действительно ли необходимы обновления наших телефонов и других электронных устройств, и мы должны убедиться, что мы правильно перерабатываем, чтобы старая электроника не попала на свалки и не загрязнила окружающую среду. На политическом уровне мы должны увидеть большее признание дефицита элементов риска, и необходимо предпринять шаги для поддержки более эффективных методов утилизации и эффективной экономики замкнутого цикла. Кроме того, необходимо учитывать вопросы прозрачности и этики, чтобы избежать нарушения прав человека, а также позволить гражданам делать осознанный выбор при покупке смартфонов или другой электроники, поскольку многие элементы, которые нам необходимы в нашей электронике, импортируются из зон конфликтов. .
2019 год объявлен Международным годом Периодической таблицы Менделеева (IYPT2019), и Европейское химическое общество EuChemS надеется, что эта уникальная и заставляющая задуматься Периодическая таблица приведет к размышлениям и, в конечном итоге, к действиям. В течение следующего года мы представим избранные статьи о конкретных элементах, их статусе под угрозой исчезновения и последствиях этого для окружающего нас мира.
Периодическая таблица доступна для бесплатного скачивания. Обратите внимание, что работа находится под лицензией Creative Commons Attribution NoDerivs CC BY-ND .Его можно скачать на других языках ниже. Если вы химик, который хочет использовать Периодическую таблицу EuChemS на своем родном языке, а этот перевод недоступен, посетите страницу Переводы Периодической таблицы и следуйте инструкциям по отправке нового перевода.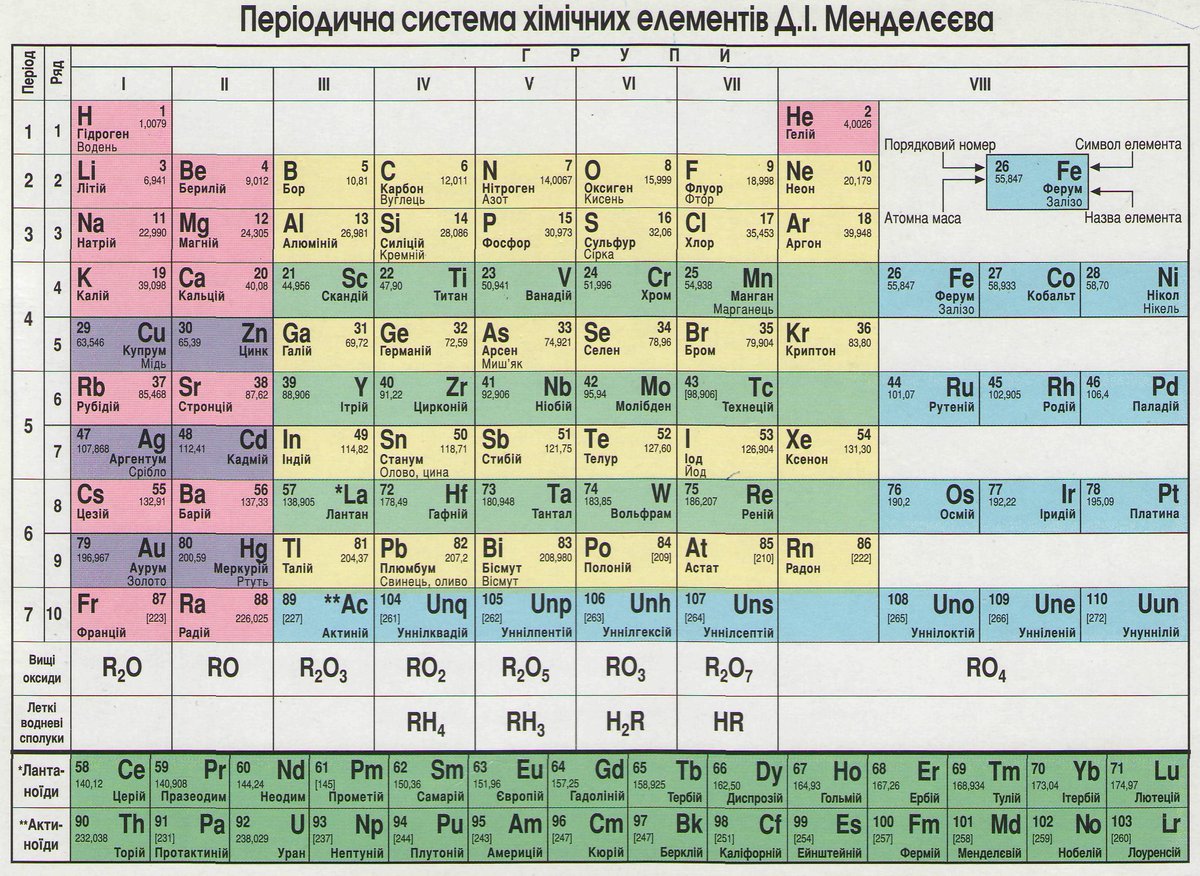
, в которых более подробно объясняется, как была разработана Периодическая таблица, доступны для загрузки здесь.
Заметки для учителей доступны для загрузки здесь.
Сыграйте в видеоигру EuChemS «Elemental Escapades!» Онлайн здесь!
Распространяйте информацию и помогите защитить находящиеся под угрозой исчезновения элементы! Поделитесь в Twitter, Facebook и LinkedIn и следите за беседой через #elementscarcity & # IYPT2019.
фактов о европии | Живая наука
Атомный номер: 63 Атомный символ: Eu Атомный вес: 151.964
Точка плавления: 1512 F (822 C) Точка кипения: 2784 F (1529 C)
Происхождение названия : названо в честь Европы.
Discovery : В 1890 году французский химик Поль-Эмиль Лекок де Буабодран извлек фракции этого элемента из самариево-гадолиниевых концентратов, у которых были искровые спектральные линии, не относящиеся к самарию или гадолинию.
Однако другому французскому химику, Эжену-Анатолю Демарка, обычно приписывают открытие элемента, поскольку он в конечном итоге произвел относительно чистую форму редкоземельного металла в 1901 году. лет, что металл был изолирован.
Свойства европия
Европий, член группы элементов лантаноидов, воспламеняется при температуре воздуха от 302 до 356 F (от 150 до 180 C), что характерно для всех других редкоземельных металлов, за исключением лантан.Европий можно легко формовать или придавать ему форму, и он почти такой же твердый, как свинец. Это самый реактивный из редкоземельных металлов, он быстро окисляется на воздухе и, как и кальций, быстро и активно реагирует с водой. [См. Периодическую таблицу элементов]
Источники европия
Европий можно найти в рудах бастнасита и монацита.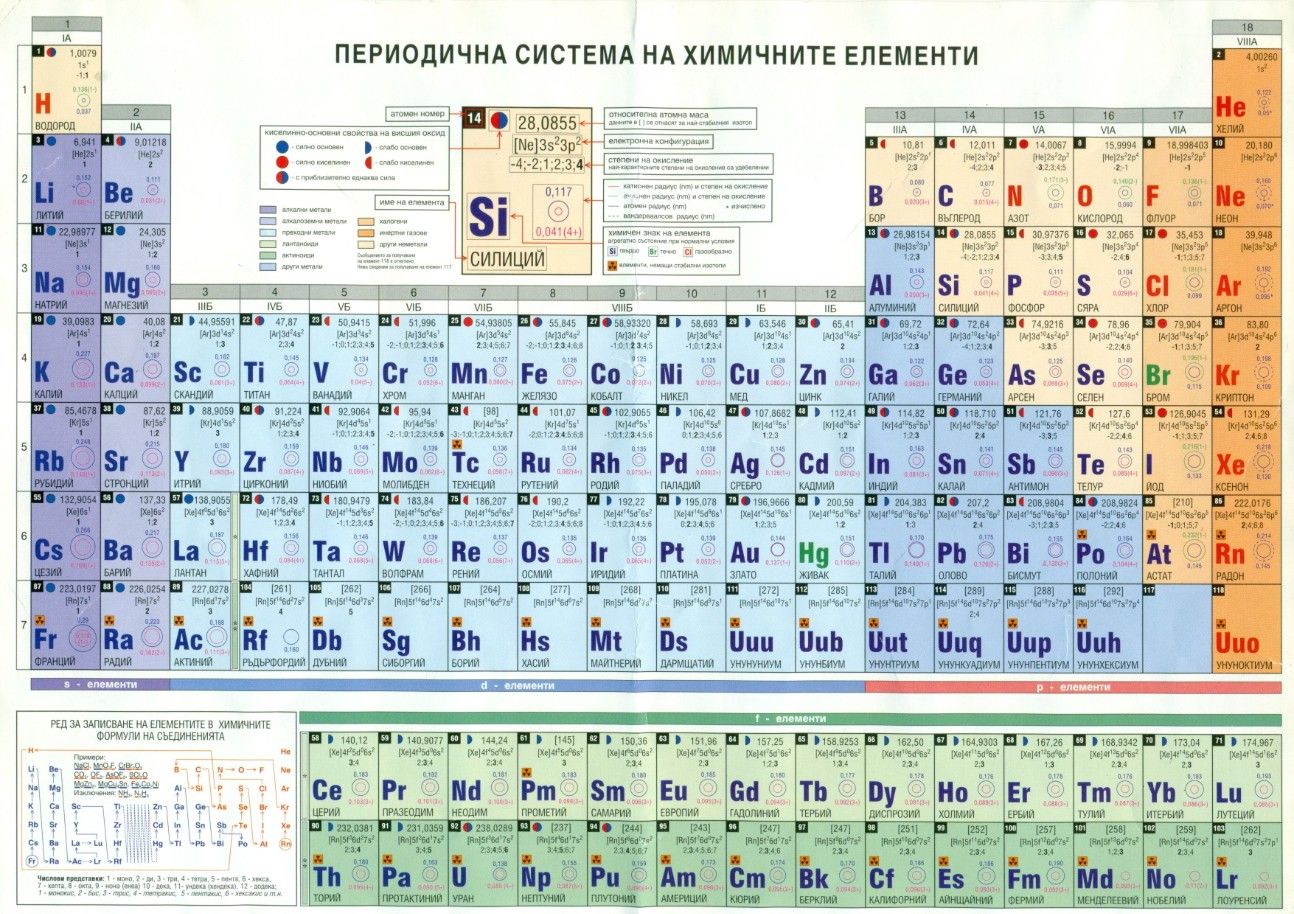 Этот элемент также был идентифицирован на солнце и некоторых звездах.
Этот элемент также был идентифицирован на солнце и некоторых звездах.
Европий получают путем смешивания оксида европия (Eu 2 O 3 ) с 10-процентным избытком металлического лантана и нагревания смеси в высоком вакууме.Во время процесса на стенках емкости осаждается серебристо-белое металлическое вещество, содержащее европий.
Использование европия
Лазерный материал является побочным продуктом легированного европием пластика. Стоимость производства была значительно снижена за счет разработки специальных процессов и методов ионного обмена.
В настоящее время известно 17 изотопов, некоторые из которых изучаются для использования в приложениях ядерного контроля, поскольку они являются хорошими поглотителями нейтронов.
(Источник: Лос-Аламосская национальная лаборатория)
Eu Информация об элементе европия: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История европия
Элемент европий был открыт Эженом-Анатолем Демарсе в год. 1901 г. во Франции
.
Европий
получил свое название от Европы
1901 г. во Франции
.
Европий
получил свое название от Европы
Присутствие европия: изобилие в природе и вокруг нас
В таблице ниже показано содержание европия во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура европия
Твердотельная структура европия – Body-Center Cubic.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| и | б | с |
|---|---|---|
458. 1 1 | 458,1 | 458,1 вечера |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства европия
Атомы европия имеют 63 электрона и структура электронной оболочки [2, 8, 18, 25, 8, 2] с символом атомного термина (квантовые числа) 8 S 7/2 .
Оболочечная структура европия – количество электронов на энергию уровень
| n | с | с. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 10 | 7 |
| 5 | O | 2 | 6 | ||
| 6 | -п. | 2 |
Основное состояние электронной конфигурации европия – нейтраль Атом европия
Электронная конфигурация нейтрального атома европия в основном состоянии [Xe] 4f7 6s2.Часть конфигурации европия, эквивалентная благородному газу предыдущий период сокращенно обозначается как [Xe]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используются сокращенные обозначения. валентные электроны 4f7 6s2, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального европия
Полная электронная конфигурация в основном состоянии для атома европия, несокращенная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f7 6s2
Атомная структура европия
Атомный радиус европия составляет 231 пм, а его ковалентный радиус – N / A.
Атомный спектр европия
Европий Химические свойства: Энергии ионизации европия и сродство к электрону
Сродство к электрону европия составляет 50 кДж / моль.
Энергия ионизации европия.
Энергии ионизации европия
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 547.1 |
| 2 | 1085 |
| 3 | 2404 |
| 4 | 4120 |
Физические свойства европия
Физические свойства европия
см. В таблице ниже.
В таблице ниже.| Плотность | 5.244 г / см3 |
| Молярный объем | 28.978 642 2578 см3 |
Эластичные свойства
Твердость европия – Испытания для измерения твердости элемента
Электрические свойства европия
Европий – проводник электричества. Ссылаться на стол ниже электрические свойства европия
Теплопроводность и теплопроводность европия
Магнитные свойства европия
Оптические свойства европия
Акустические свойства европия
Тепловые свойства европия – энтальпии и термодинамика
Термические свойства европия
см. В таблице ниже.
В таблице ниже.Энтальпии европия
Изотопы европия – ядерные свойства европия
Изотопы родия.Встречающийся в природе европий имеет 2 стабильных изотопа – 151Eu, 153Eu.
| Изотоп | Масса изотопа | % изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 130Eu | ||||
| 131Eu | ||||
| 132Eu | ||||
| 133Eu | ||||
| 134Eu | ||||
| 135Eu | ||||
| 136Eu | ||||
| 137Eu | ||||
| 138Eu | ||||
| 139Eu | ||||
| 140Eu | ||||
| 141Eu | ||||
| 142Eu | ||||
| 143Eu | ||||
| 144Eu | ||||
| 145Eu | ||||
| 146Eu | ||||
| 147Eu | ||||
| 148Eu | ||||
| 149Eu | ||||
| 150Eu | ||||
| 151Eu | 47. 81% 81% | Стабильный | N / A | |
| 152Eu | ||||
| 153Eu | 52. 19% 19% | Стабильный | N / A | |
| 154Eu | ||||
| 155Eu | ||||
| 156Eu | ||||
| 157Eu | ||||
| 158Eu | ||||
| 159Eu | ||||
| 160Eu | ||||
| 161Eu | ||||
| 162Eu | ||||
| 163Eu | ||||
| 164Eu | ||||
| 165Eu | ||||
| 166Eu | ||||
| 167Eu |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Частей Периодической таблицы
Лантаноиды , элементы 58-71, следуют за лантаном в периодическая таблица.Они имеют электронную конфигурацию 4 f x 5 d 1 6 s 2 . Лантаноиды все химически очень похожи, так как каждый дополнительный электрон добавляется к нижележащая орбиталь 4 f , тем самым не влияя на валентность оболочка. Большинство этих элементов являются реактивными, блестящими, серебристо-белые металлы и обычно встречаются в соединениях в +3 степень окисления (от потери 5 d 1 6 s 2 электронов), хотя известны другие степени окисления.
Из-за их химического сходства часто очень трудно (и дорого) для получения лантаноидов в их чистой металлической форме. Чаще всего они встречаются в монаците и монацитовом песке, руде содержащие фосфатные соли лантаноидов [(Ce, La, Th, Nd, Y) PO 4 ], и бастнасит и гидроксилбастнасит, которые содержат карбонат и фторидные соли [(Ce, La, Y) CO 3 F], [(Ce, La, Nd) CO 3 (OH, F)]. В обеих этих рудах наиболее распространены лантан и церий. элементов, хотя они содержат все лантаноиды в различных концентрации (кроме прометия).
Лантаноиды часто используются в смеси под названием мишметалл (По-немецки «смешанный металл»), который состоит из 50% церия, 25% лантана, с остальные 25% составляют смесь остальных лантаноидов. Этот сплав используется для упрочнения некоторых сталей, в легких кремнях и в качестве «геттер» в вакууме, чтобы реагировать и удалять следовые газы.
Церий (Ce, Z = 58)
Церий – мягкий, податливый и пластичный серый металл. это назван в честь астероида Церера (который был назван в честь римской богини сельского хозяйства), который был открыт в 1801 году, за два года до открытие элемента, которое, по мнению некоторых астрономов, могло быть достаточно большой, чтобы считаться планетой. Это самый распространенный из “редкоземельные” элементы с концентрацией 68 ppm в земных корка, что делает его 25-м по содержанию элементом.Он находится в руды церит [(La, Ce, Ca) 9 (Mg, Fe) (SiO 4 ) 6 [(SiO 3 ) (OH)] (OH) 3 ], алланит или ортит [(Ca, Ce, La, Y) 2 (Al, Fe) 3 (SiO 4 ) 3 (OH)], рабдофан [(Ce, La, Nd) PO 4 H 2 O] и синхизит [Ca (Ce, La, Nd, Y) (CO 3 ) 2 F], но его основными источниками являются бастнасит, гидроксилбастнасит и монацит. и монацитовый песок (см. введение).
Церий окисляется во влажном воздухе и быстро реагирует в горячей воде. Наиболее распространенные степени окисления: +3 и +4, хотя известны и другие степени окисления, такие как +8.
Оксид церия (IV), CeO 2 , используется в качестве абразива для полировки. стекло, используемое в линзах и дисплеях с ЭЛТ, а также для продления срока службы стекло и улучшить его цветовую дисперсию. Соли церия также используются в высокоинтенсивных углеродных лампах. Церий также используется в каталитических нейтрализаторах, где он способствует окислению непрореагировавшие углеводороды и при восстановлении оксидов азота.Церий (III) сульфид, Ce 2 S 3 , все чаще используется в качестве красный пигмент вместо токсичных солей кадмия.
Хотя церий, по-видимому, не играет никакой биологической роли, небольшой количество церия присутствует в фосфате кальция костей.
Празеодим (Pr, Z = 59)
Празеодим – мягкий, податливый и пластичный серебристо-белый металл. Его название происходит от греческих слов prasios и didymos , что означает «зеленый близнец». Это имя было присвоено элементу, когда он был поняли, что “дидимий”, элемент, выделенный вместе с лантаном из церийсодержащая руда, на самом деле состояла из двух элементов, которые были переименованы в как празеодим («зеленый двойник») и неодим («новый близнец»). Его концентрация в земной коре составляет 9,5 частей на миллион, что делает ее 39-й по величине обильный элемент.Встречается в рудах монацита и бастнасита. (см. введение).
Празеодим медленно реагирует на воздухе с образованием зеленого оксидного покрытия; он очень реактивен в воде. Наиболее распространенная степень окисления +3.
Соли празеодима используются для производства стекла желтого цвета, в том числе желтое “дидимиевое” стекло, используемое в защитных очках сварщика, которое защищает сварщиков от инфракрасного излучения. Он также используется в угольных электродах для прожекторы, прожекторы и освещение, используемое в киностудиях.Празеодим также используется в магнии. сплавы, используемые в авиационных двигателях. Миш-метал (см. Введение) содержал около 5% празеодима.
Неодим (Nd, Z = 60)
Неодим – мягкий, податливый и пластичный серебристо-белый металл. Его название происходит от греческих слов neos и didymos , что означает «новый близнец». Это имя было присвоено элементу, когда он был поняли, что “дидимий”, элемент, выделенный вместе с лантаном из церийсодержащая руда, на самом деле состояла из двух элементов, которые были переименованы в как празеодим («зеленый двойник») и неодим («новый близнец»).это обнаружен в земной коре в концентрации 38 частей на миллион, что делает его 27-й по распространенности элемент. Встречается в основном в рудах монацита. и бастнасайте (см. введение).
Неодим легко окисляется как на воздухе, так и в воде. В своем соединений, он обычно находится в степени окисления +3, хотя +2 и +4 степени окисления также встречаются.
Неодим используется для упрочнения сплавов магния.Это также легированы железом и бором для изготовления магнитов NIB, которые чрезвычайно сильные постоянные магниты. (Иногда их называют “редкими земные магниты »или« неодимовые магниты »). Соли неодима используются для сделать цветное стекло, от фиолетового до винно-красного, и найти вместе с празеодимом в защитном стекле очков сварщика. Миш-металл (см. Введение) содержит около 18% неодима.
Прометий (Pm, Z = 61)
Прометий – нестабильный радиоактивный элемент, который встречается только на Земля в ничтожных количествах в урановых рудах.Его существование было подозреваемый в течение некоторого времени, потому что не было известного элемента с 61 протонов в его ядре, но не было общепринятых отчетов его открытия до 1945 года, когда он был изолирован исследователями, разделение и очистка продуктов деления урана в Ок-Ридже Национальная лаборатория в Ок-Ридже, Теннесси. Он назван в честь греческого бога Прометея, который украл огонь у богов и отдал его человечеству, и был наказан будучи прикованным к скале, и его печень съедал орел каждый день.
Самый стабильный изотоп элемента, прометий-145, имеет период полураспада 17,7 лет; Прометий-146 имеет период полураспада всего 5,53 года, в то время как Прометий-147 – 2,62 года. Есть ряд других изотопов, но у большинства из них период полураспада меньше более 30 секунд. Прометий содержится в уране в следовых количествах. руды, но из-за ее нестабильности никогда не накапливается выше концентрация около пикограмма (10 -12 г) на тонну руды. Спектральные линии прометия наблюдались также у некоторых звезд. Прометий излучает бета-частицы, а в присутствии элементов высших атомный вес может стимулировать выброс рентгеновских лучей. Может быть произведен искусственно путем бомбардировки неодима-146 нейтронами до образуют неодим-147, который распадается на прометий-147 и бета-частицу.
Поскольку прометий очень нестабилен, он имеет несколько практических применений, но он используется как излучатель бета-частиц для толщиномеров, используемых для измерение толщины стальных листов, некоторые светящиеся синие и зеленые краски, а также в миниатюрных батареях, используемых в управляемых ракетах и кардиостимуляторы.
Самарий (Sm, Z = 62)
Самарий – металл серебристого цвета. Он назван в честь минерала самарскита, из которого он был впервые получен. Он присутствует в земной коре. в концентрации 8 частей на миллион, что делает его 40-м наиболее распространенным элементом. Его получают из руды монацита (см. Введение), которая содержит до 3% самария; он также встречается в бастнасите.
Самарий устойчив в сухом воздухе, но окисляется во влажном воздухе и воспламеняется. при нагревании до 150С.В своем соединений, он обычно находится в степенях окисления +2 или +3. Самарий используется в сплавах с кобальтом для создания сильных постоянных магнитов. которые обладают высоким сопротивлением размагничиванию. Он также используется в угольно-дуговые лампы, используемые в киностудиях, как поглотители нейтронов в ядерные реакторы, а также в оптическом стекле для поглощения инфракрасного света. Миш-металл содержит около 1% самария.
Европий (Eu, Z = 63)
Европий – мягкий серебристо-белый металл.Он назван в честь европейского континента. Он содержится в земной коре в концентрации 2 ppm, что делает его 50-й по численности элемент. Его получают из рудного монацита. (см. введение), который содержит до 2,8% самария; это также найдено в бастнасите.
Европий является наиболее реактивным из лантаноидов, легко окисляется в воздух и вода, и воспламеняется при нагревании до 180С. В своих соединениях он обычно находится в степени окисления +2 или +3.
Европий используется в составе красного люминофора в электронно-лучевых трубках телевизоров. и компьютерные мониторы. Он также используется в люминесцентных лампах для добавления синий компонент к свету (из Eu 2+ ), придавая более естественный свет.
Гадолиний (Gd, Z = 64)
Гадолиний – мягкий, пластичный серебристо-белый металл. Он назван для минерала гадолинита, первого минерала, содержащего редкоземельные элементы, подлежащие обнаружению; гадолинит был назван в честь Йохана Гадолин, шведский химик, который первым исследовал это.Нашлось в земной коре с концентрацией 8 частей на миллион, что делает его 41-м по величине обильный элемент. Его получают из рудного монацита и бастнасит (см. введение).
Гадолиний относительно стабилен в сухом воздухе, но окисляется во влажном воздухе. и растворяется в воде и кислотах. В своих соединениях это обычно находится в степени окисления +3. Гадолиний обладает большей способностью поглощать нейтроны, чем любой другой элемент, в первую очередь изотопов Gd-155 и Gd-157.Он магнитный. Используется в сплавах с сталь для улучшения обрабатываемости и устойчивости к окислению при высоких температурах. Сплавы гадолиния используются для изготовления магнитов. которые используются во многих электронных устройствах, таких как видеомагнитофоны, магнитные диски и компакт-диски. Соединения гадолиния являются используется в качестве контрастного вещества в магнитно-резонансной томографии для усиления контраст между различными тканями, что облегчает обнаружение рака. Гадолиний обладает очень высокой способностью поглощать тепловые нейтроны, что делает его идеальным для использовать в управлении стержни в атомных электрогенераторах; оксид гадолиния смешивается с урановые топливные таблетки в ядерных реакторах с концентрацией около 5%.
Тербий (Tb, Z = 65)
Тербий – мягкий, пластичный серебристо-серый металл. Он назван в честь шведская деревня Иттерби, а также иттрий, эрбий и иттербий.Он находится в земной коре в концентрации 1 ppm, что делает его 57-м наиболее распространенным элементом. Получается из руда монацита (см. введение), которая содержит около 0,05% тербия; он также содержится в бастнасите, который содержит около 0,02% тербия.
Тербий очень медленно окисляется на воздухе и растворяется в воде. В его соединения, он обычно находится в степени окисления +3. Тербий используется для изготовления магнитострикционных сплавов, которые удлиняют или укорачиваются под воздействием магнитного поля.Тербий используется в твердотельные устройства и лазеры. Его оксид используется в зеленом люминофоре. в электронно-лучевых трубках и люминесцентных лампах.
Диспрозий (Dy, Z = 66)
Диспрозий – мягкий серебристый металл. Он назван в честь греческого слова dysprositos , что означает «трудно добраться», потому что Первый образец элемента был получен из загрязненного оксида гольмия после трудоемкая последовательность растворения в кислоте и осаждения аммиаком. Он содержится в земной коре в концентрации 6 частей на миллион, что делает его 42-й по распространенности элемент. Встречается в рудах монацита и бастнасит (см. введение).
Диспрозий умеренно реакционноспособен, окисляется на воздухе и растворяется. быстро в холодной воде. В составе его обычно встречается в +3 степень окисления. Потому что диспрозий – один из самых сильных магнитные элементы, он используется при изготовлении некоторых постоянных магниты.В форме иозида диспрозия, DyI 3 , это Используется в галогенных лампах для создания света белого цвета. Диспрозий также используется для поглощения нейтронов в ядерных реакторах и в дозиметры для измерения воздействия радиации.
Гольмий (Ho, Z = 67)
Гольмий – мягкий, податливый серебристый металл. Он назван в честь Holmia , Латинское название Стокгольма, Швеция.Он находится в земной коре. с концентрацией 1,4 ppm, что делает его 55-м наиболее распространенным элементом. Его получают из руды монацита (см. Введение), которая содержит до 0,5% самария; он также встречается в бастнасите.
Гольмий довольно инертен, но медленно окисляется на воздухе и в воде. и растворяется в кислотах. В составе его обычно встречается в +3 степень окисления. Потому что гольмий – один из самых сильных магнитные элементы, он используется при изготовлении некоторых постоянных магниты.
Эрбий (Er, Z = 68)
Эрбий – мягкий, податливый серебристый металл. Он назван в честь шведская деревня Иттерби, как и иттрий, тербий и иттербий. назван в честь шведского городка Иттерби. Его получают из рудного монацита и бастнасита (см. Введение), так как а также ксенотим [фосфат итрия, YPO 4 , с некоторыми следами элементы] и эвксенит [(Y, Ca, Ce, U, Th) (Nb, Ta, Ti) 2 O 6 ].
Эрбий очень медленно реагирует с кислородом и водой. В своем соединений, он обычно находится в степени окисления +3. Эрбий используется в некоторых защитных очках для поглощения инфракрасного света. Оксид эрбия, Eb 2 O 3 , используется для придания розового цвета стеклу и фарфор.
Тулий (Tm, Z = 69)
Тулий – мягкий, податливый и пластичный металл серебристого цвета.это назван в честь Thule , древнее название Скандинавии. Он находится в Земная кора с концентрацией 0,50 ppm, что делает ее 61-й по величине обильный элемент. Его получают из рудного монацита (см. введение), который содержит около 0,002% тулия; это также находится в бастнасит, содержащий около 0,0008% тулия.
Тулий очень медленно тускнеет на воздухе. В своих соединениях это обычно находится в степени окисления +3.Тулий используется в некоторых дозиметры радиации.
Иттербий (Yb, Z = 70)
Иттербий – ковкий и пластичный металл серебристого цвета. Он назван после шведской деревни Иттерби, а также иттрий, тербий и иттрий. Он находится в земной коре в концентрации 3 ppm, что делает его 43 наиболее распространенным элементом. Получается из руда монацита (см. введение), которая содержит около 0.1% иттербия; Это также встречается в бастнасите, который содержит около 0,0006% иттербия.
Иттербий медленно окисляется на воздухе, но в отличие от большинства других переходных металлов оксид не отслаивается от поверхности, а образует защитный слой, служащий барьером для дальнейшего окисления. В его соединения, он обычно находится в степени окисления +3. Иттербий используется в качестве легирующего агента в некоторых нержавеющих сталях, используемых в стоматологические инструменты.
Лютеций (Lu, Z = 71)
Лютеций – серебристо-белый твердый и плотный металл. Он назван в честь Lutecia , древнее слово для обозначения Парижа. Он находится в Земная кора с концентрацией 0,5 частей на миллион, что делает ее 60-й по величине элемент. Его получают из рудного монацита (см. Введение), который содержит около 0,003% лютеция. Из-за его редкости и сложность отделения лютеция от других элементов, металлический лютеций очень дорого – почти в шесть раз дороже золота и платины.
Лютеций, в отличие от большинства лантаноидов, устойчив к окислению в воздух. В своих соединениях он обычно находится в степени окисления +3. Соединения лютеция используются в качестве катализаторов при крекинге нефти и в детекторах для позитронно-эмиссионной томографии (ПЭТ).
Список литературы
Джон Эмсли, The Elements , 3-е издание. Оксфорд: Clarendon Press, 1998.
Джон Эмсли, Природные строительные блоки: Руководство по элементам Z-Z . Оксфорд: Оксфордский университет Press, 2001.
Дэвид Л. Хейзерман, Исследование Химические элементы и их соединения . Нью-Йорк: TAB Книги, 1992.
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните рядом со значением выше, чтобы просмотреть полную информацию о цитировании этой записи)
Андерс, Эдвард и Николас Гревесс.«Изобилие элементов:
Метеоритные и солнечные. “Geochimica et Cosmochimica Acta”, том 53, номер 1, 1989, стр. 197–214. Doi: 10.1016 /
Campbell, JL “Выходы флуоресценции и Костер– Кронига Вероятности для
субоболочки Atomic L. Часть II: Возвращение к подоболочке L1. “Атомные данные и таблицы ядерных данных, том 95, номер 1, 2009 г., стр. 115–124. Doi: 10.1016 /
Campbell, JL” Флуоресценция Урожайность и вероятности Костера – Кронига для
субоболочки Atomic L.”Атомные данные и таблицы ядерных данных, том 85, номер 2, 2003 г., стр. 291–315. Doi: 10.1016 /
Кардарелли, Франсуа. Справочник по материалам: краткое содержание” Настольный справочник, 2-е издание. Лондон: Springer – Verlag, 2008.
Клементи, Э., Д. Л. Раймонди и В. П. Рейнхардт. «Константы экранирования атомов от функций SCF. II. Атомы с 37-86 электронами». Журнал химической физики, том 47, номер 4, 1967, стр. 1300–1307. DOI: 10,1063 /
Коэн, Э. Ричард, Дэвид Р. Лид и Джордж Л. Тригг, редакторы. Настольный справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации ИЮПАК 2005. Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверрия, Эдуард Кремадес, Флавиа Барраган и Сантьяго.«Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. DOI: 10.1039 /
Дэвис В. Т. и Дж. С. Томпсон. «Экспериментальное исследование атомарного аниона европия». Журнал физики B: атомная, молекулярная и оптическая физика, том 37, номер 9, 2004 г., стр. 1961–1965. DOI: 10.1088 /
де Подеста, Майкл. Понимание свойств материи, 2-е издание.Лондон: Тейлор и Фрэнсис, 2002.
Дебессай, М., Т. Мацуока, Дж. Дж. Хэмлин, Дж. С. Шиллинг и К. Симидзу.
«Индуцированное давлением сверхпроводящее состояние металлического европия при низких температурах». Physical Review Letters, том 102, номер 19, 2009 г., стр. С 197002–1 до 197002–4. DOI: 10.1103 /
Дронсковски, Ричард. Вычислительная химия твердотельных материалов. Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Эмсли, Джон.Строительные блоки природы: руководство по элементам от А до Я. Оксфорд: Издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание. Oxford: Oxford University Press, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С. Ширли с помощниками редакторов Корал М. Бэглин, С. Ю. Фрэнк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc., 1996.
Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание.Оксфорд: Баттерворт-Хайнеманн, 1997.
Гвин Уильямс. Энергии связи электронов. http: //
Хо, К. Ю., Р. У. Пауэлл и П. Э. Лили. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 3, приложение 1, 1974 г., стр. С I – 1 по I – 796.
Хорват, А. Л. «Критическая температура элементов и периодическая система.”Journal of Chemical Education, volume 50, number 5, 1973, pp. 335–336. Doi: 10.1021 /
Huheey, James E., Ellen A. Keiter, and Richard L. Keiter. Неорганическая химия: принципы Структура и реакционная способность, 4-е издание. Нью-Йорк: HarperCollins College Publishers, 1993.
Ihde, Aaron J. The Development of Modern Chemistry. New York: Dover Publications, Inc., 1984.
младший, Элберт Дж. Литтл и Марк М. Джонс. “Полная таблица электроотрицательностей.”Журнал химического образования, том 37, номер 5, 1960 г., стр. 231–233. DOI: 10.1021 /
Киттель, Чарльз. Введение в физику твердого тела, 8-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Конингс, Руди Дж. М. и Ондрей Бенеш. «Термодинамические свойства f-элементов и их соединений. I. Лантаниды и актиниды металлов». Справочный журнал физических и химических данных, том 39, номер 4, 2010 г., стр. 043102–1–043102–47.DOI: 10.1063 /
Краузе, М. О. «Атомные радиационные и безызлучательные выходы для K и L. Оболочки. “Journal of Physical and Chemical Reference Data”, том 8, номер 2, 1979, стр. 307–327.
Кунеш, Дж., И Р. Ласковски. “Основное магнитное состояние и поверхность Ферми ОЦК Eu.” Physical Обзор B, том 70, номер 17, 2004 г., стр. 174415–1–174415–6. Doi: 10.1103 /
Li, Y.-H., and JE Schoonmaker. “Химический состав и минералогия Морские отложения.”pp. 1–36 в” Отложениях, диагенезе и осадочных породах “. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Либофф, Ричард Л. Введение в Quantum Механика, 3-е издание. Ридинг, Массачусетс: Addison Wesley Longman, Inc., 1998.
Лиде, Дэвид Р., редактор. CRC Справочник по химии и физике, 88-е издание. Бока-Ратон, Флорида: Taylor & Francis Group, 2008.
Мануэль, О., редактор. Происхождение элементов в Солнечной системе: последствия наблюдений после 1957 года.Нью-Йорк: Kluwer Academic Publishers, 2000.
Marshall, James L. Discovery of the Elements: A Search для Основных Принципов Вселенной, 2-е издание. Бостон, Массачусетс: Pearson Custom Publishing, 2002.
Мартин У. К. «Электронная структура элементов». Европейский физический журнал C – Частицы и поля, том 15, номер 1–4, 2000 г., стр. 78–79. DOI: 10.1007 /
Мартин В. К., Ромуальд Залубас и Люси Хаган. Уровни атомной энергии – редкоземельные элементы.Вашингтон, округ Колумбия: Национальное бюро стандартов, 1978.
МакДонаф, У. Ф. “Композиционная модель ядра Земли”. стр. 547–568 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Mechtly, Eugene A. «Свойства материалов». pp. 4–1–4–33 в Справочных данных для инженеров: радио, электроника, компьютер и связь. Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Woburn, MA: Butterworth-Heinemann, 2002. doi: 10.1016 /
Miessler, Gary L.и Дональд А. Тарр. Неорганическая химия, 3-е издание. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2004.
Нэгл, Джеффри К. «Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112, номер 12, 1990 г., стр. 4741–4747. DOI: 10.1021 /
Орем, У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия». С. 191–222 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Palme, H., and H. Beer. «Метеориты и состав солнечной фотосферы». стр. 204–206 в книге Ландольта – Бернштейна – Группа VI: Астрономия и астрофизика. Под редакцией Х. Х. Фойгта. Нью-Йорк: Springer – Verlag, 1993. doi: 10.1007 /
Пальме, Х. и Хью Сент-К. О’Нил. «Космохимические оценки состава мантии». стр. 1–38 в «Мантия и ядро». Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Полинг, Линус. Природа химической связи, 3-е издание.Итака, Нью-Йорк: издательство Корнельского университета, 1960.
Пекка Пююккё. Самосогласованный, ковалент 2009 года
Радиусы. http: //
Pyykkö, Pekka, and Michiko Atsumi. «Ковалентные радиусы молекул с двойной связью для элементов Li-E112». Химия – европейский журнал,
том 15, номер 46, 2009 г., стр. 12770–12779. DOI: 10.1002 / 2
Pyykkö, Pekka и Michiko Atsumi.«Молекулярные ковалентные радиусы одинарной связи для элементов 1-118». Химия – европейский журнал,
том 15, номер 1, 2009 г., стр. 186–197. DOI: 10.1002 /
Рингнес, Виви. «Происхождение названий химических элементов». Журнал химического образования, том 66, номер 9, 1989 г.,
С. 731–738. DOI: 10.1021 /
Рорер, Грегори С. Структура и связь в кристаллических материалах. Кембридж: Cambridge University Press, 2001.
Самсонов Г.В., редактор. Справочник по физико-химическому Свойства элементов. Нью-Йорк: Plenum Publishing Corporation, 1968.
Sansonetti, J. E., and W. C. Martin. «Справочник по основным данным атомной спектроскопии». Справочный журнал физических и химических данных, том 34, номер 4, 2005 г., стр. 1559–2259. DOI: 10.1063 /
Шеннон Р. Д. «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta Crystallographica Раздел A, том 32, номер 5, 1976 г., стр.751–767. DOI: 10.1107 /
Силби, Роберт Дж., Роберт А. Олберти и Мунги Г. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Сингман, Чарльз Н. “Атомный объем и аллотропия элементов”. Журнал химического образования, том 61, номер 2, 1984 г., стр. 137–142. DOI: 10.1021 /
Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал
Химическая физика, том 41, номер 10, 1964 г., стр.3199–3204. doi: 10.1063 /
Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга». Журнал химии
Образование, том 67, номер 11, 1990 г., стр. 911–914. DOI: 10.1021 /
Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии. Кембридж: Кембриджский университет Press, 1990.
Стюарт Г. Р. “Измерение низкотемпературной удельной теплоемкости.”Review of Scientific Instruments, том 54, номер 1, 1983 г., стр. 1–11. Doi: 10.1063 /
Стюарт, Г. Р. “Измерение низкотемпературной удельной теплоемкости”. Обзор научных инструментов, том 54, номер 1, 1983 г., стр. 1–11. DOI: 10.1063 /
Тари, А. Низкая удельная теплоемкость вещества Температуры. Лондон: Imperial College Press, 2003.
Вайнштейн, Борис К., Владимир М. Фридкин и Владимир Л. Инденбом. Структура кристаллов, 2-е издание.Современная кристаллография 2. Под ред. Б. К. Вайнштейна, А. А. Чернова, Л. А. Шувалова. Берлин: Springer-Verlag, 1995.
Фойгт, Х. Х., редактор. Ландольт – Бёрнштейн — Астрономия и астрофизика VI группы. Берлин: Springer – Verlag, 1993.
Waber, J. T., and Don T. Cromer. «Радиусы орбит атомов и ионов». Журнал химической физики, том 42, номер 12, 1965, стр. 4116–4123. DOI: 10.1063 /
Вагман, Дональд Д., Уильям Х. Эванс, Вивиан Б. Паркер, Ричард Х.Шумм, Ива Халоу, Сильвия М. Бейли, Кеннет Л. Черни и Ральф Л. Наттолл. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 11, приложение 2, 1982 г., стр. 2–1–2–392.
Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э.
Троски и Джошуа Дж. Пирсон. «Проценты скрининга на основе эффективного ядерного заряда Слейтера как универсальный инструмент для обучения периодическим тенденциям». Журнал химического образования, том 78, номер 5, 2001 г., стр.635–639. DOI: 10.1021 /
Weeks, Мэри Эльвира и Генри М. Лестер. Открытие Стихий, 7-е издание. Истон, Пенсильвания: журнал химического образования, 1968.
Визер, Майкл Э. и Тайлер Б. Коплен. «Атомный вес элементов 2009 (Технический отчет IUPAC)». Чистая и прикладная химия, том 83, номер 2, 2011 г., стр. 359–396. DOI: 10.1351 /
Yaws, Карл Л. «Плотность жидкости в элементах». Химическая инженерия, том 114, номер 12, 2007 г., стр.44–46.
Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws. Хьюстон, Техас: Gulf Publishing Company, 2005.
Европий-валентных электронов | Валентность европия (Eu) Точечная диаграмма
Изучите валентных электронов европия здесь и сделайте шаг вперед в понимании этого элемента. В статье будут далее раскрыты другие соответствующие факты, связанные с элементом. Европий – химический элемент из периодической таблицы химии.Элемент имеет атомный номер 63 и символ представляет собой Eu. Это химический элемент с наиболее реактивными свойствами лантаноидов. Химический элемент настолько мягкий по своей структуре, что на нем легко могут появиться вмятины от простого прикосновения.
Сколько валентных электронов имеет
европий ?Это один из редкоземельных элементов, который добывают вместе с другими минералами. Итак, европий не имеет свободной формы в природе и является побочным продуктом некоторых минералов.
Европий доступен в незначительных количествах в составе монацита, ксенотима, лопарита и т. Д.Он имеет отделенную структуру в виде белого блестящего металла. Этот элемент сравнительно нетоксичен по своей природе, следовательно, безопасен для воздействия на человека. Таким образом, безопасные свойства этого элемента делают его еще более полезным в коммерческой сфере.
Европий имеет очень ограниченное применение в данном сценарии, так как он все еще находится на стадии исследования. Его можно использовать в качестве легирующей добавки в некоторых очках и лазерах. Кроме того, телевизоры и другие подобные экраны также содержат некоторую часть европия. Некоторые микросхемы квантовой памяти также содержат элемент европий.
Точечная диаграмма электронов валентности европияЧто ж, читатели могут здесь определить валентные электроны европия с помощью точечной диаграммы. Диаграмма – полезный инструмент для изучения валентных электронов химических элементов. Точечная диаграмма в основном рисует точки вокруг символа Европия. Эти точки на самом деле являются преобладающими валентными электронами элемента.
