Фтор F в Таблице Менделеева. Химический элемент, галоген
Фтор – самый сильный окислитель среди простых веществ (состоящих из атомов одного элемента). Он является первым представителем галогенов. Первое поныне известное соединение фтора флюорит (плавиковый шпат) CaF2 описано в конце XV века под названием «флюор». Это соединение фтора крайне занимательно по своим свойствам, впрочем как и любое вещество в химии. Данный минерал состоит на 95% из фторида кальция (CaF2) и на 5% из диоксида кремния (SiO2, кварца), вдобавок, кристалл обладает большой вариативностью цветов – от бесцветного и белого до желтого, оранжевого, бурого, синего, фиолетового и малинового. Всё это объясняется разной пропорцией составляющих, что меняет длину поглощаемых и отражаемых от материала волн. Начиная с 1990-х годов, флюор стал основным источников фтора, также в настоящее время он используется как компонент металлургических флюсов, эмалей, керамики, лазерных и оптических материалов (например, в объективах фотокамер). Фторид кальция является безвредным для человека веществом, в силу того, что он не растворяется в воде.
Фторид кальция является безвредным для человека веществом, в силу того, что он не растворяется в воде.
Открытие фтора
Фтор был предсказан в 1810 году как отдельный элемент периодической системы, однако из-за крайней агрессивности этого газа, долгое время попытки многих химиков оканчивались неудачей, и даже трагедией. “Научный штурм” длился 75 лет, и наконец в 1886 году, молекулярный фтор был получен Анри Муассаном путем пропускания тока через фтороводород(HF). Для фтора характерна степень окисления только (минус 1).
До вышеописанного события, в 1771 году Карл Шееле получил плавиковую кислоту (кислота представляет собой пары фтороводорода, растворенные в воде). Эта кислота использовалась главными героями сериала “Breaking Bad”,- Уолтером Уайтом и Джесси Пинкманом при “химическом расщеплении” трупов (сезон 1, серия 2). Плавиковую кислоту хранят только(!) в полиэтиленовых ёмкостях. Плавиковая кислота используется: для синтеза фтористой сурьмы; при гравировании по стеклу; при белении и выщелачивании мебельного камыша.
Химические свойства и применение фтора
Соли фтора используют в зубных пастах как микроэлементы, необходимые для организма. Также углеводороды с содержанием фтора используются в медицине как кровозаменители. Также фтор входит в другие сильные окислители, такие как фторид ксенона 6 (XeF6) или фторид азота 3 (NF3), последний является бесцветным ядовитым газом, растворимым в воде и относительно инертным при нормальных условиях, но при повышенной температуре является черезвычайно активным окислителем и сильным фторирующем агентом. Трифторид азота используют при получении углеводородов, в частности для тетрафторида углерода (CF4), т.к. при фторировании парафинов (алканов) на свету реакция течет по свободно-радикальному механизму и образуются несколько продуктов. Только у фтора нет оксидов, т.к. из-за его электроотрицательности (способность атома химического элемента, находясь в молекуле, притягивать к себе общие электронные пары, или, другими словами, оттягивать к себе электроны других атомов) в реакции с кислородом он образует фторид кислорода OF2 и диоксифторид O2F2. Многие вещества, не горящие при нормальных условиях способны гореть в среде фтора, например, вода воспламеняется даже при комнатной температуре в его среде, образуя при горении красивое синее пламя, свет которого схож с солями меди и кальция при том же самом горении. Или же огнеупорный асбест в среде фтора горит не хуже бумаги, притом заметим, что последняя в свою очередь моментально вспыхивает и сгорает в среде, напоминая горение нитроцеллюлозы (целлюлозы, обработанной азотной кислотой) в атмосфере воздуха.
Многие вещества, не горящие при нормальных условиях способны гореть в среде фтора, например, вода воспламеняется даже при комнатной температуре в его среде, образуя при горении красивое синее пламя, свет которого схож с солями меди и кальция при том же самом горении. Или же огнеупорный асбест в среде фтора горит не хуже бумаги, притом заметим, что последняя в свою очередь моментально вспыхивает и сгорает в среде, напоминая горение нитроцеллюлозы (целлюлозы, обработанной азотной кислотой) в атмосфере воздуха.
Фторид натрия
Фторид натрия (NaF) является сходным по строению, кристаллической решетке с хлоридом натрия (NaCl), который является обычной поваренной солью, используемой повсеместно. Но(!) фторид натрия является крайне токсичным веществом, уступая лишь дихромату аммония ((NH4)2Cr2O7) в токсичности. Этот фторид является основным компонентом некоторых крысиных ядов. Он также опасен и для других животных, в том числе и человека, способен вызывать раковые опухоли (например, саркому Юинга), остеопороз, помимо того он разрушает эмаль зубов, которая является одной из самых прочных образований в теле человека.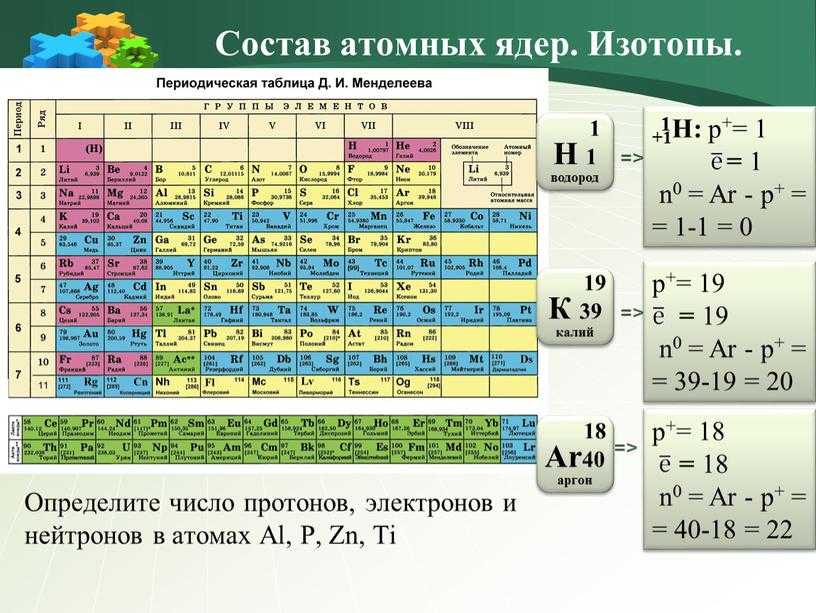
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Грозный элемент фтор | Периодическая таблица
Элемент фтор
Все знакомы с элементом фтором — может быть, потому, что он содержится в предметах домашнего обихода, таких как зубная паста, или, может быть, просто потому, что фтор — чрезвычайно опасный элемент. Этот галогенный элемент является самым легким в своей группе и является самым распространенным элементом в земной коре.
При комнатной температуре этот неметаллический элемент существует в виде газа и обладает способностью образовывать двухатомные молекулы. Хотя на бледный желто-зеленый цвет фтора интересно смотреть, важно держаться подальше от этого бурно реактивного газа. Давайте узнаем больше об этом терроризирующем элементе.
Интересные факты о фторе
- Основными районами добычи флюорита являются Китай, Мексика и Западная Европа.
- Фтор не производился в коммерческих целях до Второй мировой войны, когда он был использован для изготовления атомных бомб.
- Heinz Maier Leibnitz Research Neutron Source — это мощный источник нейтронов. С его помощью была открыта структура твердого фтора. Это большой прорыв из-за многих неудачных попыток раскрыть кристаллическую структуру твердого тела. При попытке использовать рентгеновские лучи для достижения этой цели в 1968, это закончилось взрывом.
- Этот газообразный элемент представляет собой твердое вещество только при температуре -220°C.

- Если вы когда-нибудь окажетесь в зоне возгорания фтора, не теряйте времени, бегая за водой или огнетушителем. Это только усугубит пожар. Обязательно потушите источник фтора, так как это единственный эффективный способ борьбы с огнем.
- Название происходит от латинского слова «fluere», что означает «течь», поскольку в качестве флюса использовался минерал fluorspa, CaF2.
Фтор в периодической таблице
Элемент фтор имеет атомный символ F и атомный номер 9. Он находится в верхней части группы галогенов, группа 17, справа от кислорода и слева от элемента неон . Фтор стоит выше хлора в периодической таблице и является самым легким, самым опасным и самым реакционноспособным из всех галогенов.
Атом фтора имеет электронную конфигурацию из [He] 2s 2 2p 5 или 1s 2 2s 2 2p 5 и это самый электроотрицательный элемент в периодической таблице с электроотрицательностью 3,98.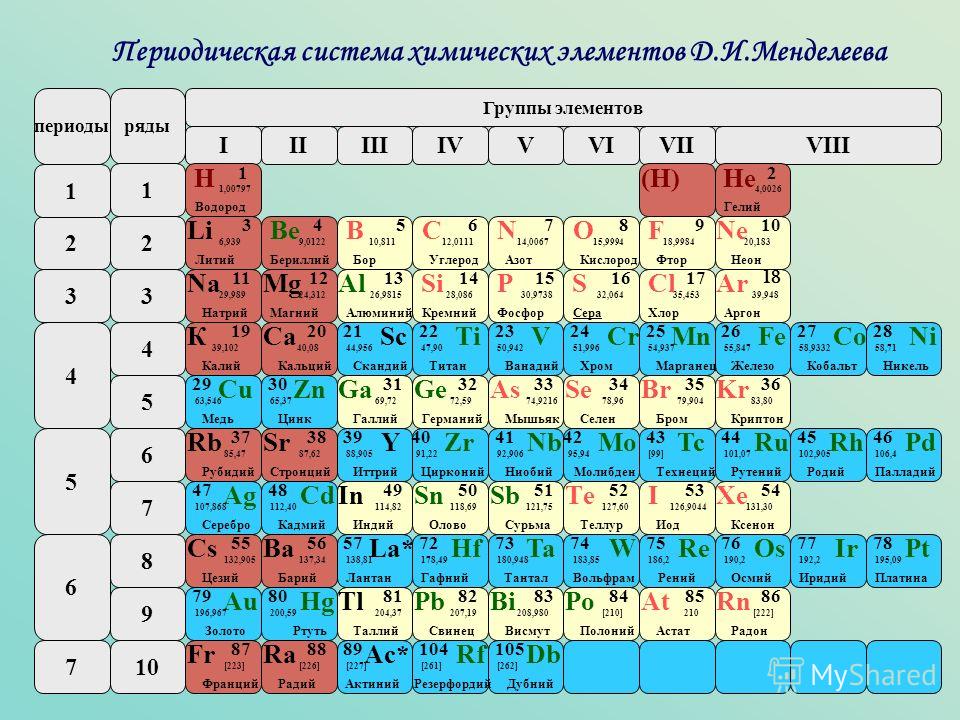 Он с силой оторвет электрон почти от любого другого атома, и его очень трудно изолировать.
Он с силой оторвет электрон почти от любого другого атома, и его очень трудно изолировать.
Фтор имеет 7 валентных электронов . Ему нужен всего лишь еще 1 электрон, чтобы завершить свою вторую оболочку, поэтому он такой реактивный и электроотрицательный.
Кислота или нет?
Существует множество соединений, в которых присутствует фтор, включая фтористоводородную кислоту (HF). Узнав о периодических тенденциях, разумно предположить, что HF будет сильной кислотой. Еще одна причина предполагать его сильную кислотность — поведение орбиталей атомов фтора и водорода, поскольку они перекрывают друг друга.
Однако HF на удивление является слабой кислотой с pKa 3,1. Это происходит просто из-за маленького иона фтора F – . Поэтому все его отрицательные заряды концентрируются к центру. При попадании в воду HF первоначально диссоциирует до примерно завершений. После диссоциации HF начнет вступать в другие реакции с собой и водой.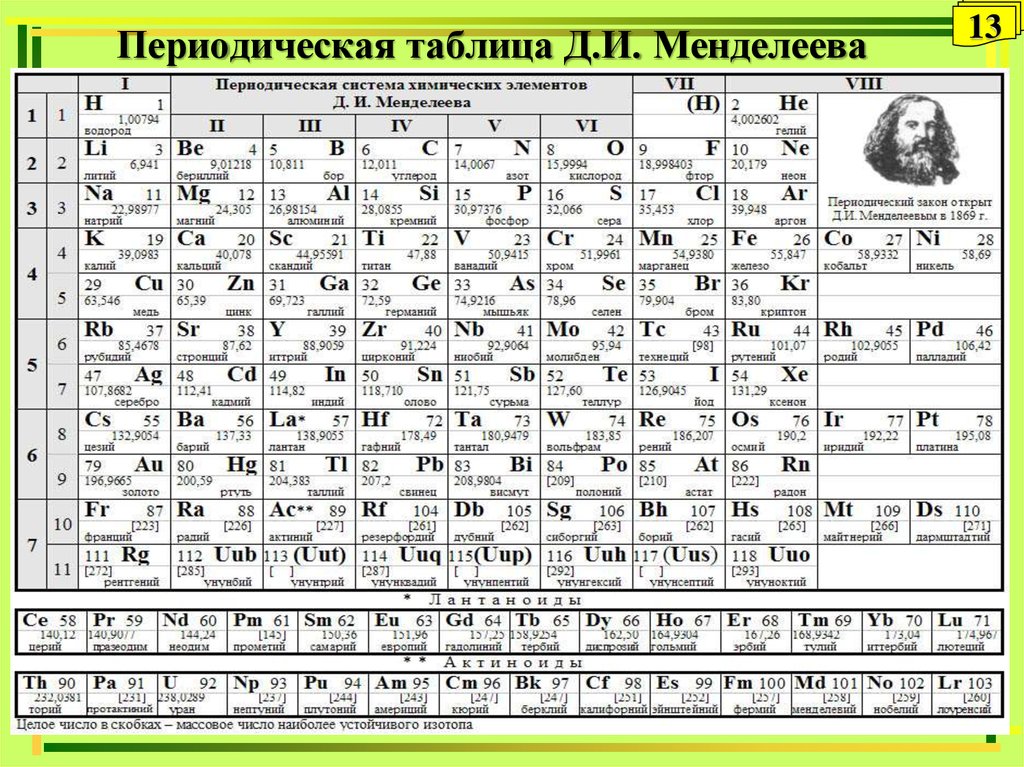 Чем больше воды, тем слабее становится ВЧ. Катион гидроксония и F – объединяются, образуя H 3 O + , что снизит кислотность HF.
Чем больше воды, тем слабее становится ВЧ. Катион гидроксония и F – объединяются, образуя H 3 O + , что снизит кислотность HF.
Несмотря на то, что HF является слабой кислотой, она обладает высокой коррозионной активностью даже по отношению к стеклу. Поэтому безопаснее хранить его в пластиковой таре. Кроме того, HF вызывает онемение ваших нервов, поэтому, если химик не знает о его токсичности, он или она могут не знать, что нужно обращаться за помощью при контакте с ним.
Опасно! Опасность!
Газообразный фтор присутствует в окружающей среде в очень низких концентрациях. Кроме того, он почти никогда не бывает в чистом элементарном состоянии из-за его высокой реакционной способности. Элемент существует во многих различных соединениях, которые различаются по токсичности. Однако общее правило заключается в том, что чем больше растворимость соединения, тем более оно токсично для человека из-за того, что оно легко всасывается. Кратковременное воздействие этого газа вызовет раздражение глаз, кожи и легких. При более высоких концентрациях газ ухудшит ваше дыхание и может в конечном итоге привести к смерти.
При более высоких концентрациях газ ухудшит ваше дыхание и может в конечном итоге привести к смерти.
Фтор является одним из самых агрессивных элементов, поэтому его следует остерегаться. В своей газовой форме он чрезвычайно токсичен из-за своей бурной реакции. Кроме того, элемент трудно изолировать без риска взрыва.
Как защитить себя
Теперь, когда мы отпугнули себя от желания приближаться к этому элементу, я собираюсь рассказать вам, как вы можете защитить себя от него. Просто убедитесь, что вы носите автономный дыхательный аппарат и что он закрывает ваши все лицо . Кроме того, при работе со фтором убедитесь, что пространство находится в режиме «давление-требование» или в режиме положительного давления. Легко, верно?
Применение фтора в современном мире
Как может быть использован такой агрессивный элемент, как фтор? Давай выясним.
Фтор — отличный ядерный материал и отличный электрический изолятор. Это делает его идеальным для производства атомных электростанций и электрических опор. Кроме того, фтор используется при производстве полупроводниковых устройств — электронных компонентов, в которых используется полупроводниковый материал. И молекулярный, и атомарный фтор выполняет эту роль и используется для плазменного травления и производства плоских дисплеев.
Кроме того, фтор используется при производстве полупроводниковых устройств — электронных компонентов, в которых используется полупроводниковый материал. И молекулярный, и атомарный фтор выполняет эту роль и используется для плазменного травления и производства плоских дисплеев.
Одним из наиболее важных и распространенных применений газообразного фтора является обогащение урана, при котором металл находится в газообразном состоянии. Газообразное состояние достигается путем получения легко возгоняемого гексафторида урана. При центрифугировании этот пар обогащается, то есть увеличивается концентрация изотопа урана U 235 . Полученный оксид урана избирательно превращается в гексафторид урана, потому что фтор имеет только один встречающийся в природе изотоп. Поэтому гексафторид урана не повлияет на вес конечного продукта. Еще одним преимуществом гексафторида урана является то, что он остается в газообразном состоянии при рабочей температуре.
Благодаря своей высокой реакционной способности фтор может быть использован в качестве ракетного топлива.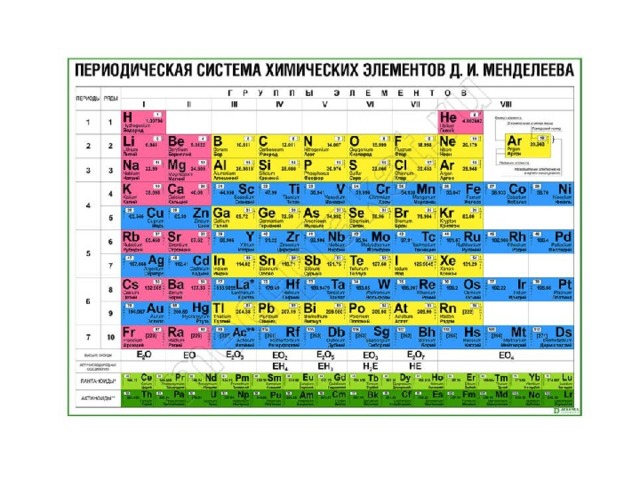 Жидкостные химические ракеты обычно используют топливо и окислитель в качестве топлива. Обычными видами топлива являются керосин, спирт и жидкий водород, а распространенными окислителями, очевидно, является фтор. Что делает фтор таким сильным окислителем? Как уже кратко обсуждалось, фтор представляет собой газ при комнатной температуре и является одним из немногих элементов, находящихся в жидком состоянии при низких температурах. Это, однако, может сделать работу с фтором трудной и опасной, особенно если учесть, насколько он коррозионно-активен и токсичен.
Жидкостные химические ракеты обычно используют топливо и окислитель в качестве топлива. Обычными видами топлива являются керосин, спирт и жидкий водород, а распространенными окислителями, очевидно, является фтор. Что делает фтор таким сильным окислителем? Как уже кратко обсуждалось, фтор представляет собой газ при комнатной температуре и является одним из немногих элементов, находящихся в жидком состоянии при низких температурах. Это, однако, может сделать работу с фтором трудной и опасной, особенно если учесть, насколько он коррозионно-активен и токсичен.
Более практическое применение
Соединения фтора имеют более практическое применение. Многие предметы, содержащие соединения фтора, вероятно, находятся в ваших собственных домах:
С раннего возраста нас учат не брать в рот ничего опасного. Однако, если вы хотите более белые зубы, вам, возможно, придется. Ведь ~ красота это боль~. Зубная паста с фтором содержит фтор в качестве активного ингредиента.
Фторид представляет собой соединение, получаемое из солей элементарного фтора в сочетании с минералами почвы или горных пород.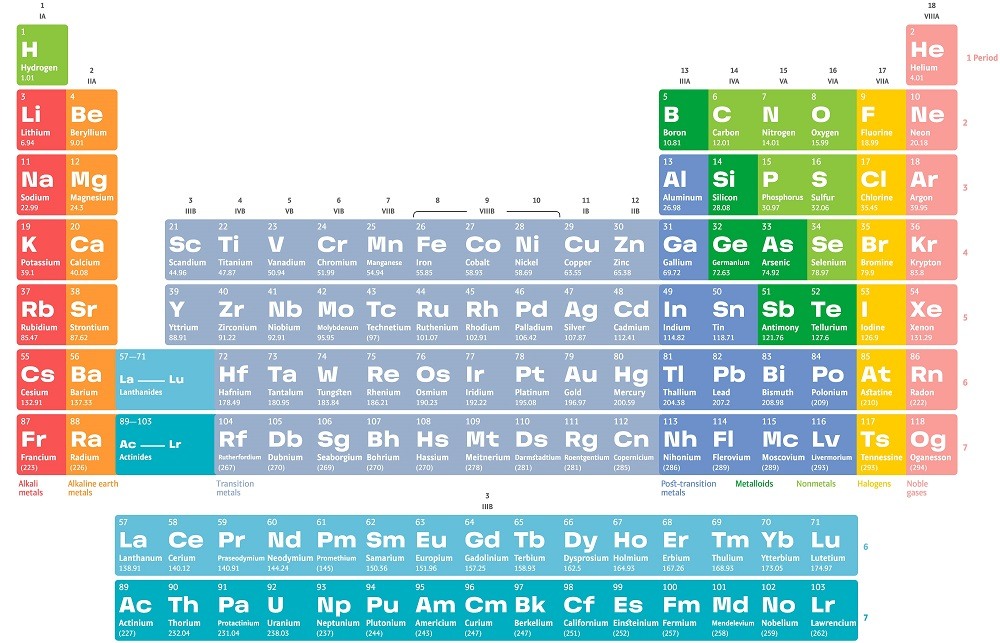 Он естественным образом содержится в костях и зубах человека, поэтому использование зубной пасты с фтором безопасно и точно не взорвется во рту. Зубная паста с фтором популярна, потому что она укрепляет зубную эмаль и эффективно борется с кариесом. Содержащий бактерии налет на зубах производит кислую слюну при кормлении сахаром во рту. Это ослабляет зубную эмаль. Фтор может помочь защитить от кислой слюны. Более того, фтор связывается с ионами кальция и фосфата в эмали, образуя фторапатит, который делает зубы твердыми. Фтор даже добавляют в воду для защиты от кариеса. Фторирование воды включает в себя добавление в воду очень низких уровней фтора, чтобы обеспечить постоянную защиту зубов.
Он естественным образом содержится в костях и зубах человека, поэтому использование зубной пасты с фтором безопасно и точно не взорвется во рту. Зубная паста с фтором популярна, потому что она укрепляет зубную эмаль и эффективно борется с кариесом. Содержащий бактерии налет на зубах производит кислую слюну при кормлении сахаром во рту. Это ослабляет зубную эмаль. Фтор может помочь защитить от кислой слюны. Более того, фтор связывается с ионами кальция и фосфата в эмали, образуя фторапатит, который делает зубы твердыми. Фтор даже добавляют в воду для защиты от кариеса. Фторирование воды включает в себя добавление в воду очень низких уровней фтора, чтобы обеспечить постоянную защиту зубов.
Гексафторид серы, SF 6 , представляет собой бесцветный искусственный парниковый газ. Прямой контакт с этим газом вызывает обморожение, поэтому старайтесь избегать контакта с ним. В остальном SF 6 является негорючим и нереактивным (при комнатной температуре). Его химическая стабильность делает его отличным электрическим изолятором и охлаждающей средой. Он содержится в холодильниках, кондиционерах и огнетушителях.
Он содержится в холодильниках, кондиционерах и огнетушителях.
История фтора
Реакции фтора
Фтор является наиболее химически активным и электроотрицательным элементом. Он имеет значение электроотрицательности 3,9.8, который говорит нам о небольшом атомном размере фтора и его высоком сродстве к электрону. Фтор быстро атакует любой металл, с которым столкнется. Вместо того, чтобы называть все элементы, с которыми фтор будет реагировать с , гораздо быстрее будет просто назвать те, с которыми реагирует , а не : аргон, гелий и неон. Фтор является кислотой Льюиса в слабых кислотах, что, как мы узнали, делает его акцептором электронов. Более того, это сильный окислитель, содержащий семь отрицательно заряженных валентных электронов, которые очень сильно связываются с другими положительными протонами с образованием анионов F – .
Некоторые металлы, такие как никель, медь и алюминий, плохо реагируют с фтором. Хранение фтора может быть затруднено из-за его агрессивности. Однако, когда никель вступает в контакт с фтором, он мгновенно покрывается слоем фторида, который мы называем пассивирующим слоем фторида никеля (II) (NiF 2 ). Этот слой защищает никель от любого дальнейшего воздействия. Медь и алюминий не будут реагировать с фтором при комнатной температуре, а будут реагировать только при высоких температурах. Однако фтор очень бурно реагирует со всеми органическими веществами.
Хранение фтора может быть затруднено из-за его агрессивности. Однако, когда никель вступает в контакт с фтором, он мгновенно покрывается слоем фторида, который мы называем пассивирующим слоем фторида никеля (II) (NiF 2 ). Этот слой защищает никель от любого дальнейшего воздействия. Медь и алюминий не будут реагировать с фтором при комнатной температуре, а будут реагировать только при высоких температурах. Однако фтор очень бурно реагирует со всеми органическими веществами.
Изоляция фтора
Как мы узнали, элементарный фтор довольно опасен. Однако при электролизе раствора гидрофторида калия в безводной плавиковой кислоте фтор можно «легко» получить. Причина, по которой чистая плавиковая кислота не используется, заключается в том, что она не является электрическим проводником. В результате ионы гидроксида превращаются в ионы кислорода. Смешивание гидродифторида калия и фтороводорода обеспечивает низкие рабочие температуры 86,85 °C и, следовательно, снижает потребность в хорошей изоляции элементов.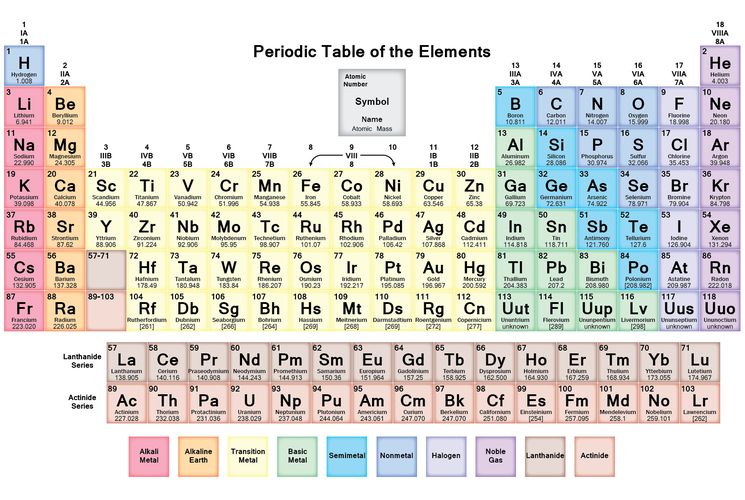 Электродная ячейка содержит анод из твердого коррозионностойкого углерода, а катоды изготовлены из прочной стали. По окончании процесса электролиза образуется газообразный фтор.
Электродная ячейка содержит анод из твердого коррозионностойкого углерода, а катоды изготовлены из прочной стали. По окончании процесса электролиза образуется газообразный фтор.
Химия фтора и соединения
Степени окисления
Фтор имеет очень сильное сродство к электронам, и фтор всегда имеет степень окисления -1. когда он образует соединения.
Плавиковая кислота
Одним из наиболее известных соединений фтора является фтористоводородная кислота, раствор фтористого водорода с формулой HF. Это очень агрессивная и опасная кислота. Это также технически слабая кислота, что означает, что ее Ka невелика. Его можно получить, соединив фторид кальция и серную кислоту. Он очень опасен, легко обжигает и проникает в кожу и может вас убить. Гидроксид кальция — отличный способ его нейтрализовать.
Гексафторид урана
Гексафторид урана, UF 6 , представляет собой белое кристаллическое твердое вещество и является одним из наиболее важных соединений фтора, поскольку он используется для разделения изотопов урана – U-235 и U-238. Его молекула имеет красивую восьмигранную форму. При 56,5°C он сразу же сублимируется в плотный ядовитый газ. Он производит фтористоводородную кислоту при контакте с водой, что привело к гибели 2 человек в 1944 году. В стальных цилиндрах в Кентукки, Огайо и Теннесси хранится 686 000 тонн обедненного гексафторида урана, количество которого ошеломляет. в течение 21 века.
Его молекула имеет красивую восьмигранную форму. При 56,5°C он сразу же сублимируется в плотный ядовитый газ. Он производит фтористоводородную кислоту при контакте с водой, что привело к гибели 2 человек в 1944 году. В стальных цилиндрах в Кентукки, Огайо и Теннесси хранится 686 000 тонн обедненного гексафторида урана, количество которого ошеломляет. в течение 21 века.
Токсичность фторид-иона
В очень малых количествах фторид-ион или бифторид-ион HF 2 – может проникать в организм человека без долгосрочных последствий. Вот почему он используется в зубной пасте. Однако, как только вы начинаете получать более 100 мг, ионы фтора и бифторида опасны, и даже несколько граммов могут быть смертельными.
Физические свойства фторсодержащего элемента
- Символ фтора: F
- Температура плавления: 53,48 К; −2190,67°С; −363,41°F
- Температура кипения: 85,04 К; -188,11°С; −306,6 ° F
- Плотность: 0,001553 г/см 3
- Атомный вес: 18,998
- Атомная номера:
- Электронигатирование: 3,98
- Классификация: Галген .
- Изотопы: 19 F — единственный стабильный и встречающийся в природе изотоп
- Встречается в природе в минералах: 0,054%
- Токсичность: Токсично и реактивно
 : [He] 2s 2 2p 5
: [He] 2s 2 2p 5 Где я могу это купить?
Газообразный фтор чрезвычайно токсичен, и вы, вероятно, не хотите, чтобы он был в вашем доме.
Подробнее
Узнайте разницу между кислотой и щелочью. Узнайте, как замечательные химики, такие как Алан Кац, работают с такими опасными химическими веществами.
Фтор (F) – Химические свойства, воздействие на здоровье и окружающую среду
- Дом
- Периодическая таблица
- Элементы
- Fluorine
|
|
Фтор Фтор — одновалентный ядовитый газообразный галоген бледно-желто-зеленого цвета, наиболее химически активный и электроотрицательный из всех элементов. Фтор легко образует соединения с большинством других элементов, даже с благородными газами криптоном, ксеноном и радоном. Он настолько реактивен, что стекло, металлы и даже вода, а также другие вещества горят ярким пламенем в струе газообразного фтора. Области применения Атомарный фтор и молекулярный фтор используются для плазменного травления в производстве полупроводников, производстве плоских дисплеев и МЭМ. Фтор в окружающей среде Ежегодная мировая добыча минерала флюорита составляет около 4 миллионов тонн, а запасы полезных ископаемых составляют около 120 миллионов тонн. 
|


 998403 g.mol -1
998403 g.mol -1  моль -1
моль -1 
 Основными районами добычи флюорита являются Китай, Мексика и Западная Европа.
Основными районами добычи флюорита являются Китай, Мексика и Западная Европа.  Попадая в почву, фтор прочно связывается с частицами почвы. В окружающей среде фтор не разрушается; он может только изменить форму.
Попадая в почву, фтор прочно связывается с частицами почвы. В окружающей среде фтор не разрушается; он может только изменить форму.