Занимательные факты о молекулах | Занимательные факты по физике (7 класс):
Еще в 1647 году француз П. Гассенди высказал предположение, что атомы объединяются в небольшие группы, для которых он же придумал название – “молекулы” (уменьшительное от лат. moles – масса). “Молекула” – в буквальном переводе “массочка”.
Молекула – наименьшая частица какого-либо сложного вещества – может состоять из одинаковых или различных атомов. Причем число атомов в ней бывает от двух до десятков тысяч. Например, в молекулах газа водорода два атома водорода, а в молекуле глюкозы (фруктовый сахар) 24 атома (12 атомов водорода, по 6 атомов углерода и кислорода).
Нет совершенно одинаковых людей, а молекулы одного и того же вещества абсолютны одинаковы. Зато молекулы разных веществ различны.
Молекулы очень малы. Молекула во столько раз меньше яблока среднего размера, во сколько яблоко меньше земного шара. Они, как и атомы, в простые микроскопы не видны. Только в современные, очень сильные микроскопы можно “увидеть” молекулы.
Так как молекулы чрезвычайно малы, то в любом предмете их великое множество. Даже маленькая песчинка состоит из 20 миллионов миллиардов атомов!
Ботаник Р. Броун в 1827 году случайно сделал очень важное открытие, наглядно показавшее никогда не прекращающееся движение молекул. Однажды он решил рассмотреть под микроскопом пыльцу растений. Капнул на стеклышко воды, размешал в ней пыльцу и поместил под объектив микроскопа. Взглянув в окуляр, он увидел, что пыльца беспорядочно перемещается, и ее движение можно было наблюдать в любое время. Такое движение мелких частичек впоследствии назвали “броуновским движением”. Ученые объяснили видимое в микроскоп движение пыльцы невидимым движением молекул. Невидимые молекулы воды, беспорядочно двигаясь, толкают с разных сторон легкие частицы пыльцы и заставляют их тоже беспорядочно перемещаться.
Движение молекул подтверждает и явление диффузии (от лат. diffusio – распространение). Оно заключается в том, что молекулы одного вещества, двигаясь, могут проникать между молекулами другого. Например, с диффузией связано распространение запаха духов. С увеличением температуры диффузия происходит быстрее, потому что молекулы начинают быстрее двигаться.
Например, с диффузией связано распространение запаха духов. С увеличением температуры диффузия происходит быстрее, потому что молекулы начинают быстрее двигаться.
Главной молекулой живой природы по праву считается молекула ДНК (дезоксирибонуклеиновая кислота). Она передает из поколения в поколение наследственные признаки. Исследованиями ее сложного устройства занимаются генетики и микробиологи, находящиеся сейчас на пороге великих открытий.
Занимательная информация
1. Пыль – это частица, состоящая из квадриллиона атомов.
2. Атом водорода имеет самую наименьшую массу среди других атомов, кроме атома урана, чья масса превышает массу водорода в 238 раз.
3. Соединив воедино четыреста миллиардов песчинок, получится диаметр земного шара. При помещении же в мешок этого количества, вес его составит одну тонну.
4. Человеческий организм состоит из квадриллиона бактерий, вес которых всего пару килограммов.
5. Величина бактерии не более 5 микрон.
6. Вирусы меньше от бактерий в сто тысяч раз.
7. Чтобы обогнуть земной шар, нужно четыреста триллионов вирусных бактерий. Световому лучу для преодоления такого расстояния потребуется почти сорок лет.
8. Молекула воды имеет размер 10-10 м, в стакане емкостью 250 мл будет 10 септиллионов молекул.
9. Одна крупинка соли содержит квинтиллион атомов.
10. Плотность человеческих волос составляет от 15 до 20 штук на один квадратный миллиметр.
11. Атом невозможно увидеть в обычный микроскоп, но можно увидеть в электронный микроскоп.
12. Охлаждение атомов учёными выполнялось неоднократно, но удалось провести снижение температуры непосредственно молекул. В качестве исследуемых элементов использовались молекулы монофторида стронция. Это химическое соединение выбрано ввиду его малой колебательности при внешних возмущениях. При понижении температуры до сверхнизких значений вещество начинает проявлять квантовые свойства, о природе которых у человечества недостаточно сведений. Удалось достичь температуры величиной 0,3 кельвин, проведённые расчеты подтверждают факт возможности достижения ещё более низких температур.
15 самых интригующих фактов об атомах
Все во Вселенной — от ядра Земли до самых дальних галактик — состоит из атомов. Это фундаментальная единица элемента.
К настоящему времени было идентифицировано 118 элементов (все они перечислены в периодической таблице).
Слово “атом”, означающее “неделимый”, происходит от древнегреческого слова “ἄτομος”. Древнегреческие философы считали, что атом невозможно разделить на что-то меньшее. Однако ученые доказали этот факт неправильно в начале 20 века, когда они открыли субатомные частицы (электроны, протоны, нейтроны).
Ниже мы перечислили некоторые из наиболее интригующих фактов об атомах, которые только сделают вас умнее. Так что давайте начнем с самого короткого и простого.
1. Состав атомов
Каждый атом содержит одно ядро [в центре] и один или несколько электронов. Ядро обычно состоит из равного числа протонов и нейтронов, вместе называемых нуклонами.
2. Ядро содержит почти всю массу
Ядро, расположенное в центре атома, составляет более 99,9 % его массы, но занимает лишь одну триллионную его общего объема. Таким образом, большая часть пространства внутри атома пуста.
Таким образом, большая часть пространства внутри атома пуста.
3. Электроны чрезвычайно малы
Электрон является наиболее активным компонентом атома, но он почти ничего не вносит в массу атома. Например, в атоме водорода масса электрона составляет всего 0,0005 массы ядра.
4. Атом может иметь электрический заряд
Электроны несут отрицательный заряд, протоны несут положительный заряд, а нейтроны не имеют электрического заряда. Атом электрически нейтрален, если он имеет одинаковое количество электронов и протонов.
Однако, если атом имеет меньше или больше протонов, чем электронов, он имеет общий положительный или отрицательный заряд (известный как Ион).
5. Что удерживает протоны и нейтроны вместе?
Ядерная сила удерживает протоны и нейтроны вместе в ядре атома. Электроны притягиваются к протонам другой силой, называемой электромагнитной силой, которая слабее ядерной силы.
Эта ядерная сила примерно в 1038 раз сильнее гравитационной, но действует только в очень малых масштабах.
6. 94 Атома естественного происхождения на Земле
Из 118 известных атомов 94 встречаются в природе, хотя некоторые встречаются в незначительных количествах. Остальные 24 были синтезированы только в лабораториях или ядерных реакторах.
7. Каждый атом уникален
Каждый атом содержит определенное количество протонов в ядре. Например, все атомы натрия содержат 11 протонов, а все атомы серебра содержат 47 протонов.
Изотоп элемента определяется числом нейтронов, а магнитные характеристики зависят от количества электронов в атоме.
8. Самый большой и самый маленький атом
Самым большим элементом (по размеру) является Франций, но поскольку он крайне нестабилен, предпочтение отдается Цезию. У него большая валентная оболочка и относительно менее эффективный заряд ядра.
Наименьший элемент – гелий, первый в группе благородных газов в периодической таблице. Его атомный радиус примерно в 9 раз меньше диаметра цезия.
Иллюстрация атома гелия | Предоставлено: Викимедиа.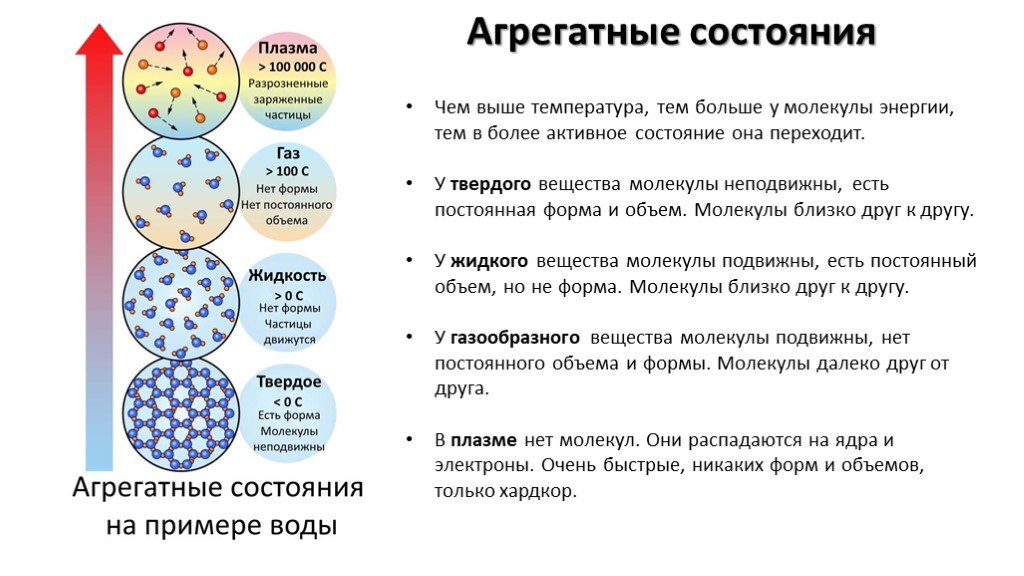
9. Самый тяжелый и легкий атом
Оганессон – самый тяжелый элемент (по атомной массе), открытый в 2002 году. Это первый благородный газ, который удивительно химически активен и проявляет очень необычные физические и химические свойства.
Оганессон, однако, является самым тяжелым синтетическим химическим элементом. Самым тяжелым природным элементом является Уран с атомным весом 238,029.
Элемент, который имеет самый легкий атом-это водород. У него есть только один протон, обращающийся вокруг одного электрона. Его самый распространенный изотоп, известный как Протий, состоит из одного протона и нулевых нейтронов.
10. Возможно ли преобразовать один элемент в другой?
В некоторых экстремальных условиях электромагнитная сила (которая отталкивает электроны и протоны) преодолевает сильную ядерную силу, выбрасывая нуклоны из атомного ядра и оставляя после себя совершенно другой элемент. Это именно то, что происходит при делении ядер.
Однако этот процесс [распада] является дорогостоящим и опасным.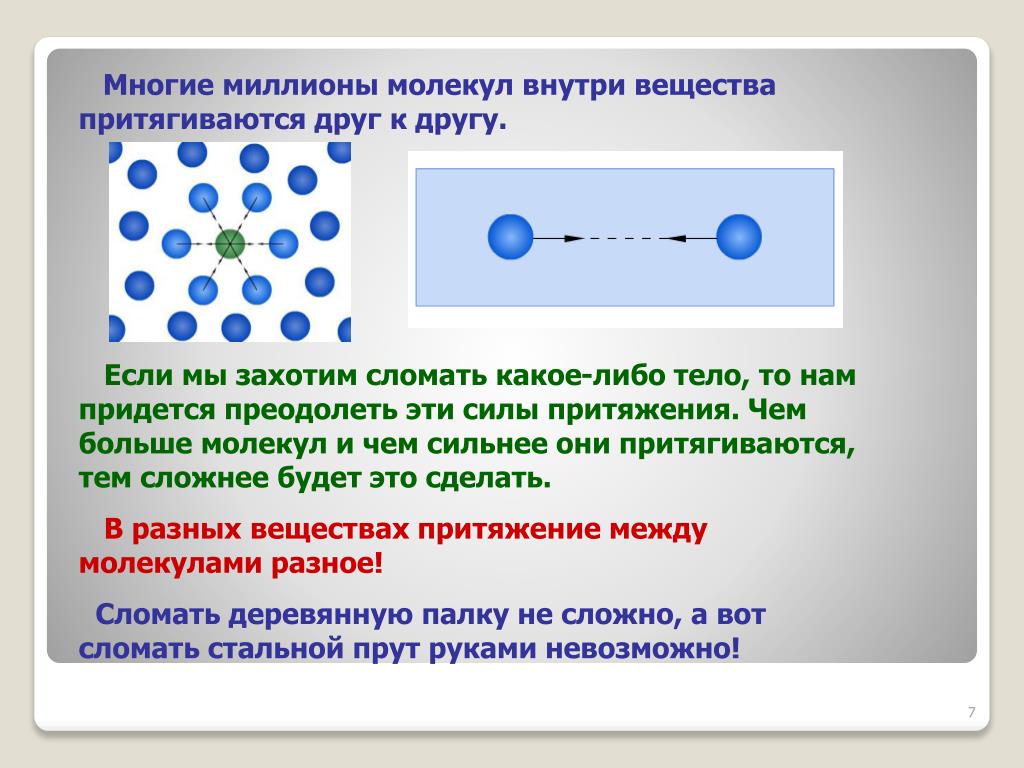 Ученые пока не смогли безопасно генерировать энергию с помощью ядерного деления.
Ученые пока не смогли безопасно генерировать энергию с помощью ядерного деления.
11. Атомы в человеческом теле
Тело человека весом 70 кг состоит из 7 × 10 27 атомов. Три атома (водород, кислород и углерод) составляют до 99 процентов от общего количества.
Что еще интереснее, 98 процентов этих атомов обновляются каждый год, даже не подозревая об этом. Самая быстро меняющаяся молекула – это вода: почти 50 процентов молекул воды в организме заменяются каждые 8 дней.
Более того, человеческий волос – 100 нанометров в поперечнике – состоит из миллиона атомов углерода.
12. Сколько атомов существует во Вселенной?
Наблюдаемая вселенная огромна: она охватывает приблизительно 93 миллиарда световых лет. Согласно теоретической оценке, в нашей вселенной насчитывается от 1078 до 1082 атомов.
Это не какой-то выдуманный номер. Расчеты основаны на достоверных данных (что мы знаем о вселенной). Однако между этими оценками существует огромная разница, что говорит о значительной степени ошибки.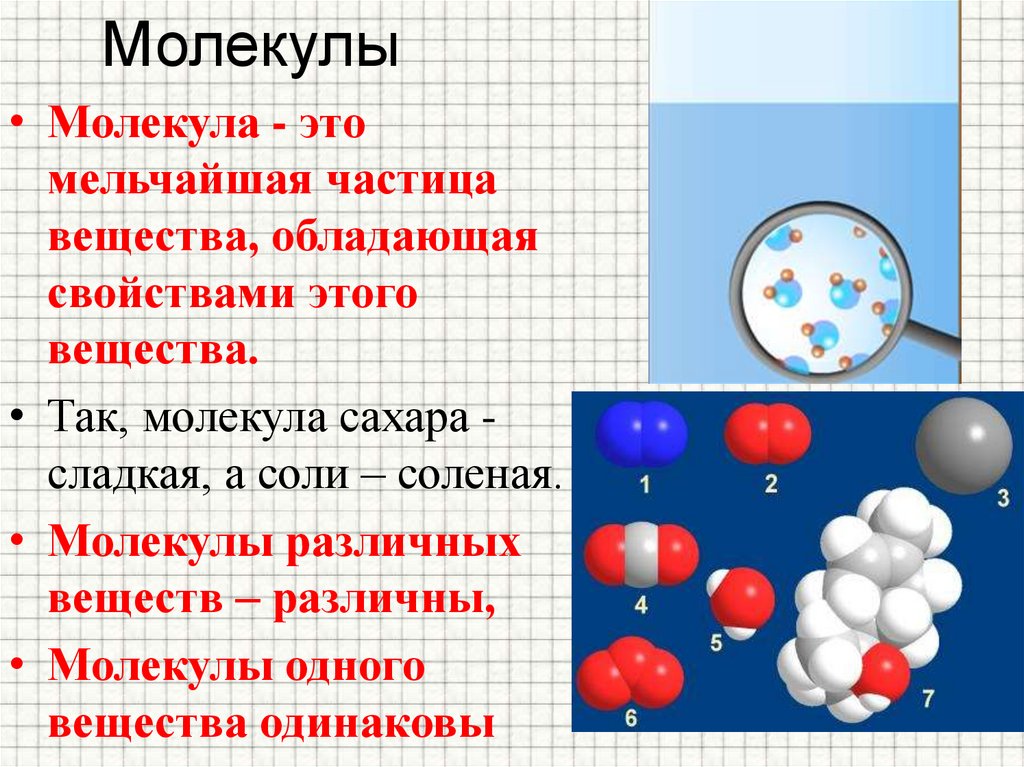 Более точные цифры будут доступны, когда мы узнаем больше о космосе.
Более точные цифры будут доступны, когда мы узнаем больше о космосе.
13. Радиоактивные атомы
В нестабильном атоме силы неуравновешенны. В этом случае атомное ядро содержит избыток либо протонов, либо нейтронов. Атом пытается достичь стабильного состояния, выбрасывая свои дополнительные частицы или высвобождая энергию в других формах. Элементы, содержащие такие нестабильные ядра, называются радиоактивными.
Фермий, например, является радиоактивным элементом: его самый стабильный изотоп (Fm-257) имеет период полураспада 100,5 суток.
14. Видя атомы
Поскольку атомы невероятно малы по сравнению с длиной волны видимого света, их нельзя наблюдать даже с самым мощным в мире оптическим микроскопом.
Сканирующий туннельный микроскоп захватывает атомы кремния на поверхности кристаллического карбида кремнияВот почему ученые используют микроскоп другого типа, известный как сканирующий туннельный микроскоп. Он может обеспечить боковое разрешение 0,1 нм и разрешение по глубине 0,01 нм, что достаточно для изображения отдельных атомов в материалах.
15. Квантовая природа атомных свойств
Электрон совершает мгновенный “квантовый скачок” с одного энергетического уровня на другойПоскольку атомы чрезвычайно малы по размеру, они проявляют квантовые свойства, поэтому предсказание их поведения с применением классической физики всегда приведет к неверным результатам.
Когда электрон прыгает с одного энергетического уровня (орбиты) на другой, он не перемещается в пространстве между ними. Вместо этого он исчезает с одной орбиты, а затем сразу же появляется на другой орбите.
Чтобы лучше описать и оценить их поведение, несколько атомных моделей включили в себя законы квантовой физики.
Молекула | Определение, примеры, структуры и факты
представления молекулярной структуры
Просмотреть все средства массовой информации
- Ключевые люди:
- Дж. Фрейзер Стоддарт Джозеф Лошмидт Курт Вютрих Бернард Феринга Герберт А. Хауптман
- Похожие темы:
- радикальный биомолекула конфигурация конформация гомоядерная молекула
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
молекула , группа из двух или более атомов, которые образуют наименьшую идентифицируемую единицу, на которую можно разделить чистое вещество, сохраняя при этом состав и химические свойства этого вещества.
Характеристики молекул
Деление образца вещества на все более мелкие части не приводит ни к изменению его состава, ни к химическим свойствам до тех пор, пока не будут получены части, состоящие из отдельных молекул. Дальнейшее подразделение вещества приводит к еще более мелким частям, которые обычно отличаются от исходного вещества по составу и всегда отличаются от него химическими свойствами. На этой последней стадии фрагментации химические связи, удерживающие атомы в молекуле, разрываются.
Атомы состоят из одного ядра с положительным зарядом, окруженного облаком отрицательно заряженных электронов. Когда атомы близко подходят друг к другу, электронные облака взаимодействуют друг с другом и с ядрами. Если это взаимодействие таково, что общая энергия системы снижается, то атомы связываются вместе, образуя молекулу. Таким образом, со структурной точки зрения молекула состоит из скопления атомов, удерживаемых вместе валентными силами. Двухатомные молекулы содержат два атома, которые химически связаны. Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (СО), то составляют гетероядерную двухатомную молекулу. Молекулы, содержащие более двух атомов, называются многоатомными, например, двуокись углерода (CO 2 ) и вода (H 2 O). Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (СО), то составляют гетероядерную двухатомную молекулу. Молекулы, содержащие более двух атомов, называются многоатомными, например, двуокись углерода (CO 2 ) и вода (H 2 O). Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Молекулярная связь
Отношение числа атомов, которые могут быть связаны друг с другом для образования молекул, является фиксированным; например, каждая молекула воды содержит два атома водорода и один атом кислорода. Именно эта особенность отличает химические соединения от растворов и других механических смесей. Таким образом, водород и кислород могут присутствовать в любых пропорциях в механических смесях, но при искровом разряде они будут соединяться только в определенных пропорциях, образуя химическое соединение вода (H 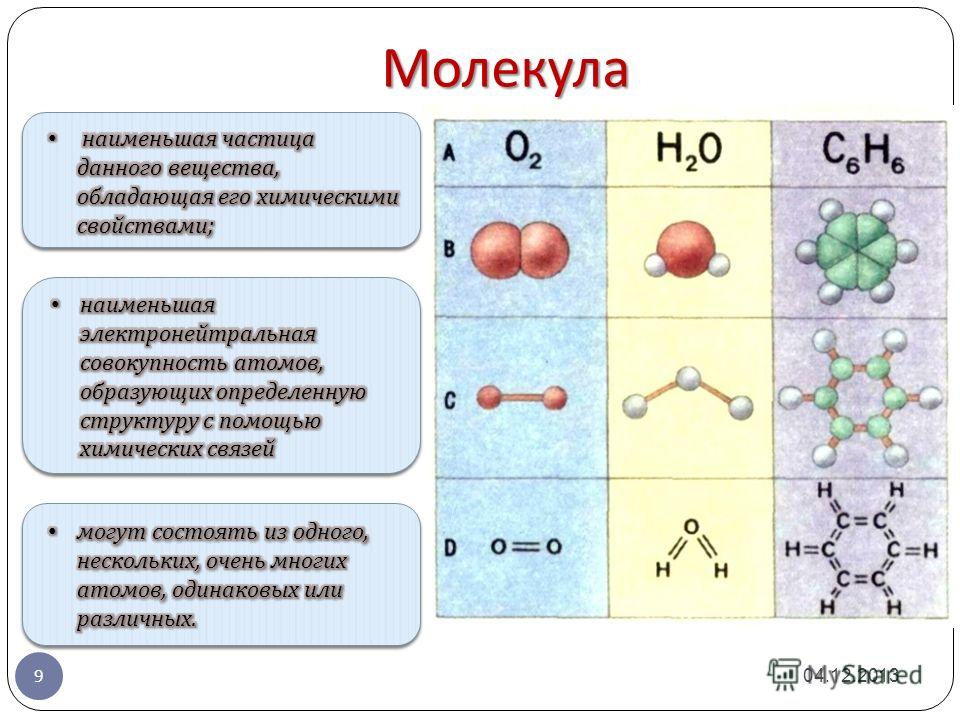 Возможно, что одни и те же виды атомов соединяются в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода могут химически соединиться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически соединиться с двумя атомами кислорода с образованием молекулы перекиси водорода (H
Возможно, что одни и те же виды атомов соединяются в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода могут химически соединиться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически соединиться с двумя атомами кислорода с образованием молекулы перекиси водорода (H
Не все вещества состоят из отдельных молекулярных единиц. Хлорид натрия (поваренная соль), например, состоит из ионов натрия и ионов хлора, расположенных в решетке так, что каждый ион натрия окружен шестью равноудаленными ионами хлора, а каждый ион хлора окружен шестью равноудаленными ионами натрия.
Молекулы удерживаются вместе общими электронными парами или ковалентными связями. Такие связи являются направленными, что означает, что атомы занимают определенное положение относительно друг друга, чтобы максимизировать силу связи. В результате каждая молекула имеет определенную, достаточно жесткую структуру или пространственное распределение ее атомов. Структурная химия занимается валентностью, которая определяет, как атомы соединяются в определенных соотношениях и как это связано с направлениями и длинами связей. Свойства молекул коррелируют с их строением; например, молекула воды структурно изогнута и поэтому имеет дипольный момент, тогда как молекула углекислого газа является линейной и не имеет дипольного момента.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться сейчас
Молекула | Определение, примеры, структуры и факты
представления молекулярной структуры
Просмотреть все средства массовой информации
- Дж. Фрейзер Стоддарт Джозеф Лошмидт Курт Вютрих Бернард Феринга Герберт А. Хауптман
- Похожие темы:
- радикальный биомолекула конфигурация конформация гомоядерная молекула
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
молекула , группа из двух или более атомов, которые образуют наименьшую идентифицируемую единицу, на которую можно разделить чистое вещество, сохраняя при этом состав и химические свойства этого вещества.
Характеристики молекул
Деление образца вещества на все более мелкие части не приводит ни к изменению его состава, ни к химическим свойствам до тех пор, пока не будут получены части, состоящие из отдельных молекул. Дальнейшее подразделение вещества приводит к еще более мелким частям, которые обычно отличаются от исходного вещества по составу и всегда отличаются от него химическими свойствами. На этой последней стадии фрагментации химические связи, удерживающие атомы в молекуле, разрываются.
Атомы состоят из одного ядра с положительным зарядом, окруженного облаком отрицательно заряженных электронов. Когда атомы близко подходят друг к другу, электронные облака взаимодействуют друг с другом и с ядрами. Если это взаимодействие таково, что общая энергия системы снижается, то атомы связываются вместе, образуя молекулу. Таким образом, со структурной точки зрения молекула состоит из скопления атомов, удерживаемых вместе валентными силами. Двухатомные молекулы содержат два атома, которые химически связаны. Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (СО), то составляют гетероядерную двухатомную молекулу. Молекулы, содержащие более двух атомов, называются многоатомными, например, двуокись углерода (CO 2 ) и вода (H 2 O). Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (СО), то составляют гетероядерную двухатомную молекулу. Молекулы, содержащие более двух атомов, называются многоатомными, например, двуокись углерода (CO 2 ) и вода (H 2 O). Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Молекулярная связь
 Возможно, что одни и те же виды атомов соединяются в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода могут химически соединиться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически соединиться с двумя атомами кислорода с образованием молекулы перекиси водорода (H
Возможно, что одни и те же виды атомов соединяются в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода могут химически соединиться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически соединиться с двумя атомами кислорода с образованием молекулы перекиси водорода (H Не все вещества состоят из отдельных молекулярных единиц. Хлорид натрия (поваренная соль), например, состоит из ионов натрия и ионов хлора, расположенных в решетке так, что каждый ион натрия окружен шестью равноудаленными ионами хлора, а каждый ион хлора окружен шестью равноудаленными ионами натрия. Силы, действующие между любым натрием и любым соседним ионом хлора, равны. Следовательно, не существует отдельного агрегата, идентифицируемого как молекула хлорида натрия. Следовательно, в хлориде натрия и во всех твердых телах подобного рода понятие химической молекулы не имеет значения. Поэтому формула такого соединения дается как простейшее соотношение атомов, называемое формульной единицей, в случае хлорида натрия — NaCl.
Силы, действующие между любым натрием и любым соседним ионом хлора, равны. Следовательно, не существует отдельного агрегата, идентифицируемого как молекула хлорида натрия. Следовательно, в хлориде натрия и во всех твердых телах подобного рода понятие химической молекулы не имеет значения. Поэтому формула такого соединения дается как простейшее соотношение атомов, называемое формульной единицей, в случае хлорида натрия — NaCl.
Молекулы удерживаются вместе общими электронными парами или ковалентными связями. Такие связи являются направленными, что означает, что атомы занимают определенное положение относительно друг друга, чтобы максимизировать силу связи. В результате каждая молекула имеет определенную, достаточно жесткую структуру или пространственное распределение ее атомов. Структурная химия занимается валентностью, которая определяет, как атомы соединяются в определенных соотношениях и как это связано с направлениями и длинами связей. Свойства молекул коррелируют с их строением; например, молекула воды структурно изогнута и поэтому имеет дипольный момент, тогда как молекула углекислого газа является линейной и не имеет дипольного момента.
