Это интересно – Молекулярная физика
Молекулярная физика часто ассоциируется со скучной и сложной темой. Но зачастую мы даже не осознаем, сколько физических явлений мы видим и используем в нашей повседневной жизни. Физика может быть довольно интересной. Вместо того чтобы говорить о сложных уравнениях мы расскажем вам о забавных, интересных и полезных фактах из физики. ФИЗИКАМ УДАЛОСЬ ОХЛАДИТЬ МОЛЕКУЛЫ ПОЧТИ ДО АБСОЛЮТНОГО НУЛЯ Ученые смогли охладить молекулы монофторида стронция практически до абсолютного нуля «одним махом». Физики описали использованную ими технологию в статье в журнале Nature. В отличие от молекул и атомов, находящихся при комнатной температуре, вещество, охлажденное до температур, близких к абсолютному нулю (минус 273,15 градуса Цельсия, или 0 градусов кельвина), начинает демонстрировать квантовые свойства (у нагретой материи они «забиваются» тепловыми эффектами). Физики часто охлаждают атомы, используя лазер – атомы поглощают фотоны, а затем испускают их. При многократном повторении этого процесса атомы постепенно теряют свою кинетическую энергию, то есть охлаждаются. Для молекул такой метод до сих пор не применялся – они более тяжелые и хуже теряют энергию. Кроме того, в молекулах «лишняя» энергия запасается в связях между атомами, а также во вращательных движениях молекулы целиком.
В итоге авторам удалось охладить молекулы до 300 микрокельвинов (микрокельвин – это одна миллионная кельвина). В начале 2010 года другой коллектив исследователей, работая с охлажденными до сверхнизких температур молекулами калия и рубидия, смог непосредственно пронаблюдать квантово-механические эффекты. http://fizfaka.net/physics-world/physics-world/264-fizikam-abs-0-temp.html Еще немного фактов…
Атом Все окружающие нас предметы состоят из атомов. Атомы настолько малы, что за время, пока мы дописываем это предложение могло бы образоваться 100 00 атомов. На самом деле первым о существование атомов заговорили греки еще 2400 лет назад. Но идея об атомах пришла и ушла и к ней не возвращались до 1808 года, когда Джон Дэлтон показал на опыте, что атомы действительно существуют. Атомы входят в состав молекул предметов, которыми мы пользуемся каждый день, которое мы трогаем и видим. Твердые тела и жидкости Твердые тела жесткие, поскольку их молекулы плотно удерживают друг друга: здесь молекулы выстроены в прямой ряд. Молекулы твердых тел не могут двигаться вокруг друг друга, поэтому они считаются неподвижными (хотя их атомы постоянно колеблются). В жидкости, с другой стороны, молекулы тоже плотно держаться друг за друга, но не настолько сильно как в твердых телах, поэтому они могут двигаться вокруг и изменять форму. Однако, жидкость невозможно сжать. Молекулы газа слабо связаны друг с другом, поэтому они могут распространяться и заполнять пространство. Кроме того, молекулы газа могут сжиматься до более мелких размеров. Любопытно, но стекло не является твердым телом. В действительности стекло-это жидкость, но оно настолько вязкое, что мы не можем заметить как оно течет.
|
10 фактов о воде
Андрей Калиничев
«Троицкий вариант — Наука» №10(254), 22 мая 2018 года
1. Вода — единственное химическое вещество, которое широко распространено в естественных условиях на поверхности Земли во всех трех агрегатных состояниях: жидком, твердом и газообразном.
2. Общеизвестно, что примерно 71% земной поверхности покрыто океанами, в которых содержится около 96,5% всей воды на планете, или 1,4 × 1018 тонн. Остальная вода на поверхности сохраняется в полярных льдах, горных ледниках, в реках и озерах, а также в подземных источниках и резервуарах.
Остальная вода на поверхности сохраняется в полярных льдах, горных ледниках, в реках и озерах, а также в подземных источниках и резервуарах.
3. Гораздо менее известно, что такое же, если не большее, количество воды находится глубоко в мантии Земли, причем в основном не в виде молекул H2O, а в кристаллической решетке номинально безводных мантийных минералов в виде дефектов, состоящих из ионов Н+ или ОН−.
4. Озеро Байкал — самый большой резервуар пресной воды на планете: 23 600 км3. Озеро Верхнее — наибольшее в системе Великих озер Северной Америки — в два раза уступает Байкалу по объему (11 600 км3), но зато в 2,5 раза больше Байкала по площади и является в этом смысле самым большим пресноводным озером на Земле.
5. Как и у большинства жидкостей, плотность воды при охлаждении увеличивается. Однако, в отличие от большинства жидкостей, плотность замерзшей воды — льда — меньше, чем плотность жидкой воды в равновесии с этим льдом.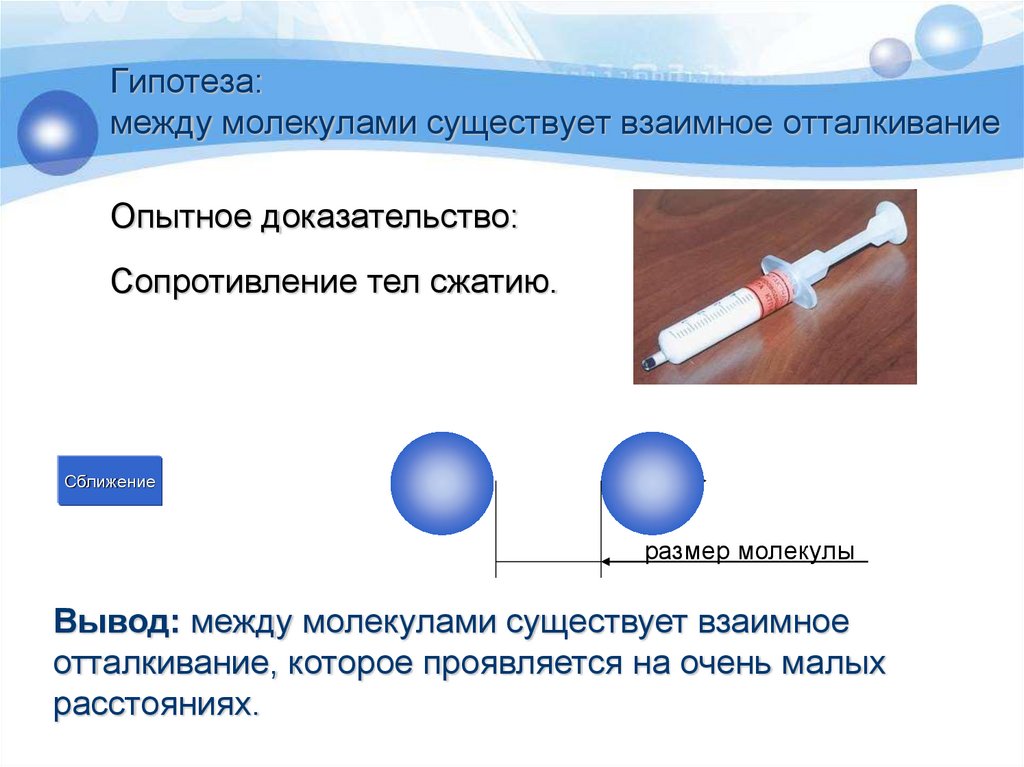 Такое аномальное поведение приводит к наличию максимума плотности воды при температуре около 4°С, что чрезвычайно важно для жизни на Земле. Если бы вода была наиболее плотной при замерзании, то зимой озера и реки промерзали бы не от поверхности вглубь, а от дна к поверхности, при этом погибала бы вся плавучая живность.
Такое аномальное поведение приводит к наличию максимума плотности воды при температуре около 4°С, что чрезвычайно важно для жизни на Земле. Если бы вода была наиболее плотной при замерзании, то зимой озера и реки промерзали бы не от поверхности вглубь, а от дна к поверхности, при этом погибала бы вся плавучая живность.
6. Известно около 18 кристаллических модификаций льда — тоже своеобразный рекорд. Ученые до сих пор открывают всё новые твердые фазы Н2О и спорят об их точном числе. Некоторые из этих структур льда устойчивы только при очень высоких давлениях и не плавятся даже при 1000°С, если давление превышает несколько сотен тысяч атмосфер.
7. Многие аномальные свойства воды объясняются наличием водородных связей между ее молекулами. Структура отдельной молекулы воды — Н2О — довольно проста: вследствие гибридизации молекулярных орбиталей две составляющие ее О—Н связи (каждая — длиной около 0,1 нанометра) расположены друг к другу под углом примерно 104°. Близость этого угла к тетраэдрическому (109,5°) и характерное неравномерное распределение электронной плотности внутри молекул Н2О позволяет им легко образовывать водородные связи (Н-связи) со своими четырьмя ближайшими соседями. Атомы водорода выступают при этом донорами, а атом кислорода служит акцептором в среднем двух таких связей. Молекулы воды, связанные такими сетками Н-связей, образуют трехмерные структуры, представляющие собой более или менее крупные фрагменты локально упорядоченной алмазоподобной тетраэдрической кристаллической решетки (см. рис.). В кристалле обычного льда такая решетка близка к идеальной, а в жидкой воде при нормальных условиях структура этих небольших тетраэдрических молекулярных кластеров может быть искажена и быстро меняется со временем.
Близость этого угла к тетраэдрическому (109,5°) и характерное неравномерное распределение электронной плотности внутри молекул Н2О позволяет им легко образовывать водородные связи (Н-связи) со своими четырьмя ближайшими соседями. Атомы водорода выступают при этом донорами, а атом кислорода служит акцептором в среднем двух таких связей. Молекулы воды, связанные такими сетками Н-связей, образуют трехмерные структуры, представляющие собой более или менее крупные фрагменты локально упорядоченной алмазоподобной тетраэдрической кристаллической решетки (см. рис.). В кристалле обычного льда такая решетка близка к идеальной, а в жидкой воде при нормальных условиях структура этих небольших тетраэдрических молекулярных кластеров может быть искажена и быстро меняется со временем.
8. Энергия даже самых сильных водородных О···Н связей между молекулами в 10 раз слабее энергии составляющих отдельную молекулу ковалентных О—Н связей, поэтому трехмерная сетка Н-связей в воде постоянно разрывается и реорганизуется в новые похожие структуры просто в результате теплового движения молекул. Время жизни одной Н-связи очень коротко — всего порядка пикосекунды (10−12 с). Таким образом, об особой структуре воды и о «памяти воды» можно говорить, только имея в виду их крайнюю недолговечность.
Время жизни одной Н-связи очень коротко — всего порядка пикосекунды (10−12 с). Таким образом, об особой структуре воды и о «памяти воды» можно говорить, только имея в виду их крайнюю недолговечность.
9. С другой стороны, энергия водородных связей между молекулами Н2О гораздо выше энергии обычных межмолекулярных взаимодействий. Это приводит к так называемому гидрофобному эффекту, когда молекулы, которые слабо взаимодействуют с водой, склонны собираться вместе, минимизируя таким образом поверхность контакта (капельки масла в воде) и давая возможность молекулам Н2О создавать наибольшее количество Н-связей.
10. Внутримолекулярные и межмолекулярные водородные связи и гидрофобный эффект обеспечивают также особые структуру и функции трех важнейших типов макромолекул в живой природе: протеинов, нуклеиновых кислот и углеводов. Так, двойная спиральная структура молекулы ДНК чрезвычайно устойчиво сохраняется благодаря водородным связям между отдельными комплементарными азотистыми основаниями — элементами структуры ДНК, где в качестве акцептора Н-связи выступают не только атомы кислорода, но и атомы азота.
фактов о молекулах | Изучите важные термины и понятия
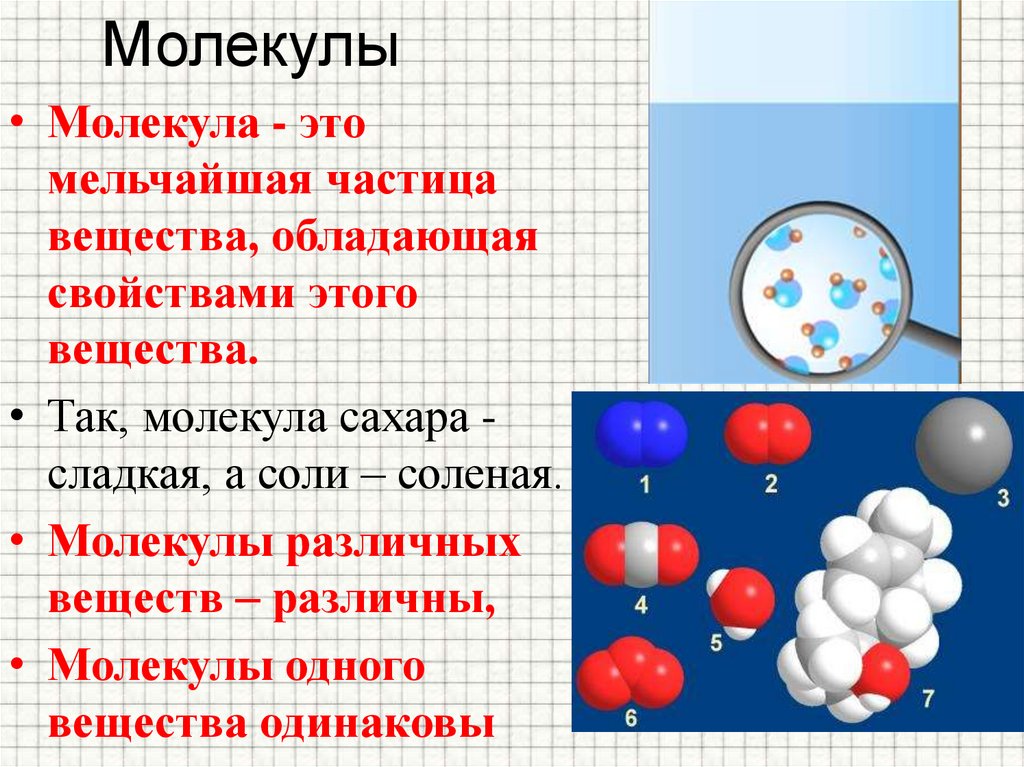
Молекулы представляют собой комбинацию одного или нескольких одинаковых или разных атомов. Все вокруг нас состоит из различных комбинаций молекул, мы сами состоим из молекул. Человеческое тело в основном состоит из молекул воды, но помимо этого в нашем организме есть несколько других типов молекул. Пища, которую мы едим, представляет собой форму больших сложных молекул, которые в нашем теле распадаются на более мелкие и простые молекулы. Кровь, которая действует как проводящая часть нашего тела, состоит из миллионов клеток, известных как эритроциты. которые представляют собой молекулы, состоящие из атомов железа.
Некоторые забавные факты о молекулах
Человеческое тело состоит из молекул
Различные формы молекул
\[{\rm{C}}{{\rm{H}}_{\rm{4}}}\ ]- метан
Молекула метана
\[{{\rm{H}}_{\rm{2}}}{\rm{O}}\] – вода
\[{{\rm{H} }_{\rm{2}}}\] – водород
\[{{\rm{O}}_{\rm{2}}}\] – Кислород
Молекула кислорода
Комплекс молекулы, состоящие из более чем одного типа атомов, называются составными молекулами.

Атомы в молекуле связаны между собой химическими связями, которые могут быть двух типов: ионные связи и ковалентные связи.
Ионная связь – это когда один атом отдает свои дополнительные электроны, а другой атом принимает электроны, таким образом образуя связь, тогда как ковалентная связь – это когда электроны распределяются между атомами без отдачи или получения электронов.
Ионные и ковалентные связи между атомами
Интересные факты об атомах и молекулах
Атомы, образующие молекулы
Расщепление воды: реакция разложения а именно электроны, протоны и нейтроны.
Самым распространенным атомом во Вселенной является атом водорода.
На сегодняшний день мы обнаружили более 100 различных типов атомов, они перечислены в так называемой периодической таблице.
Периодическая таблица
Интересные факты о молекулах воды
Молекула воды обозначается символом \[{{\rm{H}}_{\rm{2}}}{\rm{O} }\] состоит из двух атомов водорода и кислорода.
Это пример сложной молекулы.
Несколько молекул воды также связаны друг с другом так называемой водородной связью.
Водородная связь между молекулами воды
Молекулы воды в трех состояниях вещества
Лед, плавающий на поверхности воды.
Примеры вопросов
Укажите, верны или неверны следующие предложения:
Атом – первичная, неразрушимая субстанция в природе.
Ответ: Неверно, атом можно разделить на субчастицы, такие как электроны, протоны и нейтроны.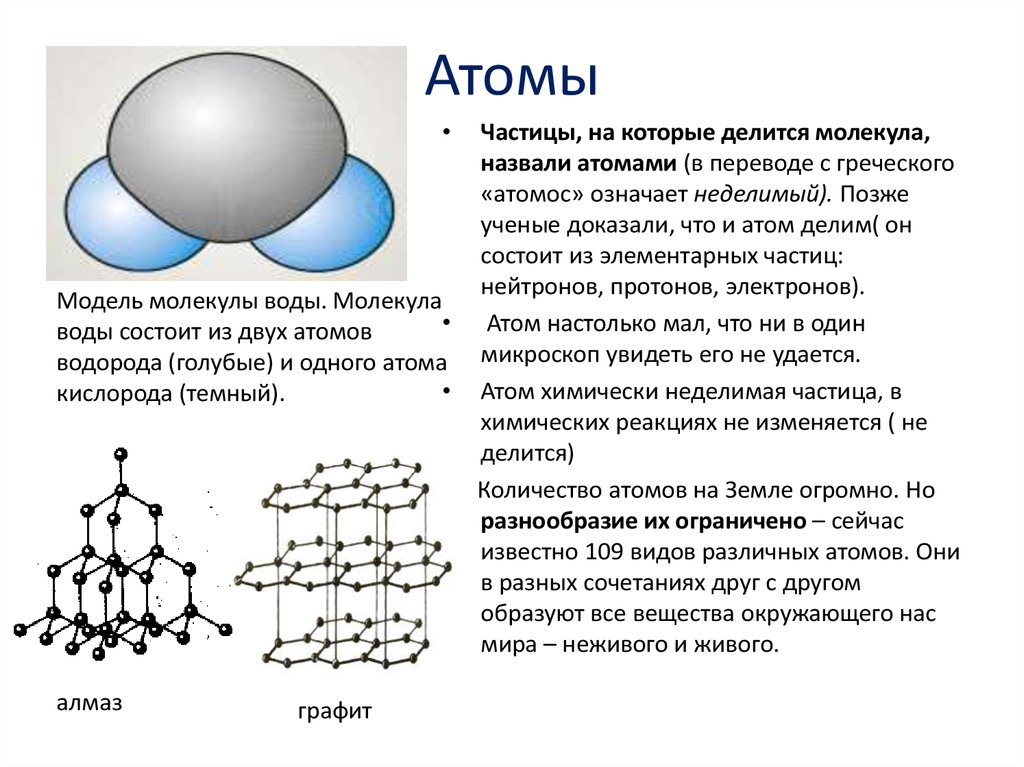
Лед плотнее воды
Ответ: Ложь, лед не плотнее воды, поэтому он плавает на воде.
Вода может существовать во всех трех агрегатных состояниях.
Ответ: Верно, он может существовать во всех трех состояниях воды в виде воды, льда и пара.
Молекула также может состоять из атомов, которые не являются подобными
Ответ: Да, эти типы молекул известны как сложные молекулы.
2. Укажите связь между атомом, молекулой и соединением.
Ответ: Два или более атома соединяются вместе, образуя молекулу, аналогично две или более молекулы соединяются вместе, образуя соединение.
Связь между атомами, молекулами и соединениями.
Учись, делая
Дополните данные утверждения, заполнив пропуски подходящими словами:
Атомы объединяются, чтобы сформировать ___________.
Ответ: Молекула
Метан молекулярно ________.
Ответ: \[{\rm{C}}{{\rm{H}}_{\rm{4}}}\]
Наши тела состоят из _________.
Ответ: молекулы
Молекулы, распадающиеся на атомы, называются ________.
Ответ: Реакция разложения
Химические связи могут быть _______ или ________.
Ответ: ионный, ковалентный.
Лед _______ на воде.
Ответ: поплавки.
Резюме
Два или более атома соединяются вместе, образуя молекулу с помощью химических связей, которые могут быть либо ионными, либо ковалентными по своей природе. Следовательно, молекула распадается на свои компоненты, которые являются атомами, и это называется реакцией разложения. Молекула воды представляет собой сложную молекулу, состоящую из двух атомов водорода и одного атома кислорода.
молекула
В химии молекула определяется как достаточно стабильная электрически нейтральная группа, состоящая по крайней мере из двух атомов в определенном расположении, удерживаемых вместе сильными химическими связями. [1] [2] В органической химии и биохимии термин молекула используется менее строго, а также применяется к заряженным органическим молекулам и биомолекулам. Молекулы отличаются от многоатомных ионов в строгом смысле.
Молекулы отличаются от многоатомных ионов в строгом смысле.
Это определение эволюционировало по мере расширения знаний о структуре молекул. Более ранние определения были менее точными, определяя молекулы как мельчайшие частицы чистых химических веществ, которые все еще сохраняют свой состав и химические свойства. [3] Это определение часто не соответствует действительности, поскольку в обычном опыте многие вещества, такие как горные породы, соли и металлы, состоят из атомов или ионов, а не из молекул.
В кинетической теории газов термин 9Молекула 0198 часто используется для любых газообразных частиц независимо от их состава. [4] В соответствии с этим определением благородные газы также будут считаться молекулами , несмотря на то, что они состоят из одного несвязанного атома.
Дополнительные рекомендуемые знания
Содержимое
|
История
Основная статья: История молекулы
Термин «молекула », от французского molécule , означающего «чрезвычайно мельчайшая частица», был придуман французским философом Рене Декартом в 1620-х годах. Хотя существование молекул было признано многими химиками с начала 19В результате законов Дальтона об определенных и кратных пропорциях (1803–1808) и закона Авогадро (1811) возникло некоторое сопротивление среди позитивистов и физиков, таких как Мах, Больцман, Максвелл и Гиббс, которые считали молекулы просто удобными. математические конструкции. Работа Перрена о броуновском движении (1911 г.) считается окончательным доказательством существования молекул.
В молекуле по крайней мере два атома соединены общими парами электронов в ковалентной связи. Он может состоять из атомов того же химического элемента, что и кислород (O 2 ), или различных элементов, таких как вода (H 2 O). Атомы и комплексы, связанные нековалентными связями, такими как водородные связи или ионные связи, обычно не считаются отдельными молекулами.
Типичная молекула не может быть определена для ионных (соли) и ковалентных кристаллов (сетчатых твердых тел), которые состоят из повторяющихся элементарных ячеек, вытянутых либо в плоскости (например, в графите), либо в трех измерениях (например, в алмазе или натрии). хлористый).
Наука о молекулах называется молекулярная химия или молекулярная физика , в зависимости от направленности. Молекулярная химия изучает законы взаимодействия между молекулами, приводящие к образованию и разрыву химических связей, а молекулярная физика — законы, управляющие их строением и свойствами.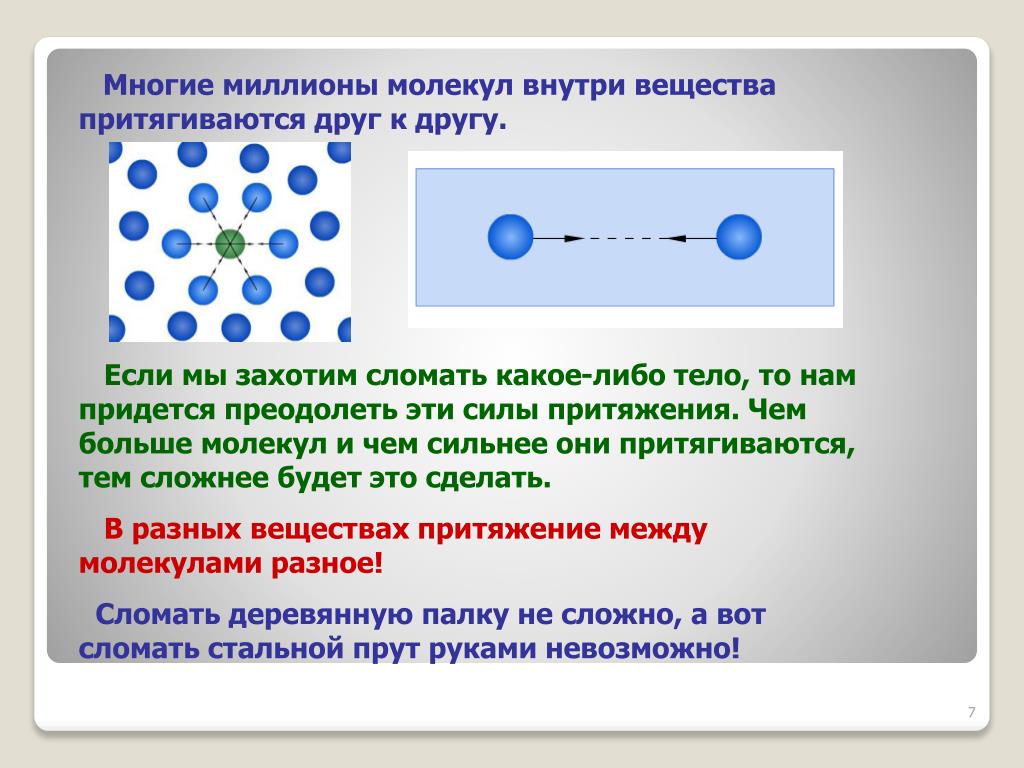
Молекулярный размер
Большинство молекул слишком малы, чтобы их можно было увидеть невооруженным глазом, но есть и исключения. ДНК, макромолекула, может достигать макроскопических размеров, как и молекулы многих полимеров. Самая маленькая молекула – это двухатомный водород (H  Отдельные молекулы обычно нельзя наблюдать в свете (как отмечалось выше), но небольшие молекулы и даже очертания отдельных атомов можно в некоторых случаях проследить с помощью атомно-силового микроскопа. Некоторые из самых больших молекул являются макромолекулами или супермолекулами.
Отдельные молекулы обычно нельзя наблюдать в свете (как отмечалось выше), но небольшие молекулы и даже очертания отдельных атомов можно в некоторых случаях проследить с помощью атомно-силового микроскопа. Некоторые из самых больших молекул являются макромолекулами или супермолекулами.
Радиус
Эффективный молекулярный радиус — это размер молекулы в растворе. [5] . Таблица селективности проницаемости для различных веществ содержит примеры.
Молекулярная формула
Эмпирическая формула молекулы представляет собой простейшее целочисленное соотношение химических элементов, составляющих соединение. Например, вода в чистом виде всегда состоит из водорода и кислорода в соотношении 2:1, а этиловый спирт или этанол всегда состоит из углерода, водорода и кислорода в соотношении 2:6:1. Однако это не определяет однозначно тип молекулы – например, диметиловый эфир имеет то же соотношение, что и этанол. Молекулы с одинаковыми атомами в разном расположении называются изомерами.
Молекулярная масса может быть рассчитана по химической формуле и выражается в условных атомных единицах массы, равных 1/12 массы нейтрального атома углерода-12 ( 12 изотопа C). Для сетчатых твердых частиц в стехиометрических расчетах используется термин формульная единица.
Молекулярная геометрия
Основная статья: Молекулярная геометрия
Молекулы имеют фиксированную равновесную геометрию — длины связей и углы, вокруг которых они непрерывно колеблются посредством колебательных и вращательных движений. Чистое вещество состоит из молекул с одинаковой средней геометрической структурой. Химическая формула и структура молекулы являются двумя важными факторами, определяющими ее свойства, особенно ее реакционную способность. Изомеры имеют общую химическую формулу, но обычно имеют очень разные свойства из-за своей различной структуры. Стереоизомеры, особый тип изомеров, могут иметь очень похожие физико-химические свойства и в то же время очень разную биохимическую активность.
Изомеры имеют общую химическую формулу, но обычно имеют очень разные свойства из-за своей различной структуры. Стереоизомеры, особый тип изомеров, могут иметь очень похожие физико-химические свойства и в то же время очень разную биохимическую активность.
Молекулярная теория
Есть четыре факта о молекулах. Эти факты таковы:
1. Вся материя состоит из мельчайших частиц, называемых молекулами.
2. Между молекулами есть промежутки.
3. Молекулы постоянно движутся.
4. Молекулы притягиваются друг к другу.
Вместе эти утверждения образуют Молекулярную теорию , одну из фундаментальных теорий в физике и химии.
Молекулярная спектроскопия
Основная статья: Спектроскопия
Молекулярная спектроскопия
Зондирующий сигнал, используемый в спектроскопии, может представлять собой электромагнитную волну или пучок частиц (электронов, позитронов и т. д.) Молекулярный отклик может состоять из поглощения сигнала (абсорбционная спектроскопия), испускания другого сигнала (эмиссионная спектроскопия), фрагментации или химические изменения.
Спектроскопия признана мощным инструментом исследования микроскопических свойств молекул, в частности их энергетических уровней. Чтобы извлечь максимальную микроскопическую информацию из экспериментальных результатов, спектроскопию часто сочетают с химическими расчетами.
Теоретические аспекты
Изучение молекул молекулярной физикой и теоретической химией в значительной степени основано на квантовой механике и имеет важное значение для понимания химической связи. Простейшей из молекул является молекула-ион водорода, H 2 + , а простейшей из всех химических связей является одноэлектронная связь. H 2 + состоит из двух положительно заряженных протонов и одного отрицательно заряженного электрона, связанных обменом фотонами, что означает, что уравнение Шрёдингера для системы может быть решено легче из-за отсутствия электрон-электронного отталкивания.
Пытаясь строго определить, является ли расположение атомов «достаточно стабильным», чтобы его можно было считать молекулой, ИЮПАК предполагает, что оно «должно соответствовать углублению на поверхности потенциальной энергии, достаточно глубокому, чтобы ограничить хотя бы одно колебательное состояние». . [1] Это определение не зависит от характера взаимодействия между атомами, а только от силы взаимодействия. Фактически, он включает слабосвязанные частицы, которые традиционно не считались бы молекулами, такие как димер гелия He 9.0268 2 , который имеет одно колебательное связанное состояние, но настолько слабо связан, что его можно наблюдать только при очень низких температурах.
Этимология
Согласно Merriam-Webster и Online Etymology Dictionary, слово «молекула» происходит от латинского «moles» или небольшой единицы массы.
- Молекула (1794) – “чрезвычайно мельчайшая частица”, от фр. молекула (1678), из Mod.L. молекула , тусклый. родинок Л. “масса, барьер”. Сначала неясный смысл; мода на это слово (использовавшееся до конца 18 века только в латинской форме) восходит к философии Декарта.
См. также
- Молекулярное моделирование
- Ковалентная связь
- Двухатомная молекула
- История молекулы
- Молекулярная геометрия
- Молекулярный гамильтониан
- Молекулярная орбиталь
- Неполярная молекула
- Полярная молекула
- Список молекул см. в Перечне соединений.
- Список молекул в межзвездном пространстве
Каталожные номера
9 Полинг, Линус (1970). Общая химия . Нью-Йорк: Dover Publications, Inc. ISBN 0-486-65622-5 .Эббин, Даррелл, Д. (1990). Общая химия, 3-е изд. . Бостон: Houghton Mifflin Co.



 Расчеты показывают, что использованная учеными технология позволяет понизить их температуру до еще более низких значений.
Расчеты показывают, что использованная учеными технология позволяет понизить их температуру до еще более низких значений. То есть, если самолет сможет пройти путь за три часа, то вы прибудете в тоже время, в которое отбыли.
То есть, если самолет сможет пройти путь за три часа, то вы прибудете в тоже время, в которое отбыли. В одной песчинке настолько много атомов, что их количество можно сравнить с числом самих песчинок на пляже.
В одной песчинке настолько много атомов, что их количество можно сравнить с числом самих песчинок на пляже. 
 В итоге система не может принять единую упорядоченную форму, но стремится быть максимально однородной.
В итоге система не может принять единую упорядоченную форму, но стремится быть максимально однородной. 1 Радиус
1 Радиус