Фармакогенетика – презентация, доклад, проект
Вы можете изучить и скачать доклад-презентацию на тему Фармакогенетика. Презентация на заданную тему содержит 30 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас – поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!
Презентации» Медицина» Фармакогенетика
Слайды и текст этой презентации
Слайд 1
Описание слайда:
Слайд 2
Описание слайда:
ПЛАН ЛЕКЦИИ
1.Определение понятий (фармакотипирование, генотипирование, фармакогенетика, фармакогеномика)
2.Метаболим лекарств
3.Фазы детоксикации
4.Химические реакции биотрансформации
5. Индукция ферментов биотрансформации
6.Генетический полиморфизм ферментов
7.Взаимодействие цитохромов с лекарствами
8.Генетический полиморфизм и фармакотерапия
9.Чиповый метод анализа генетического полиморфизма
Индукция ферментов биотрансформации
6.Генетический полиморфизм ферментов
7.Взаимодействие цитохромов с лекарствами
8.Генетический полиморфизм и фармакотерапия
9.Чиповый метод анализа генетического полиморфизма
Слайд 3
Описание слайда:
ИCТОРИЯ ФАРМАКОГЕНЕТИКИ
1932 – Описаны семейные случаи гемолитической анемии при применении примаквина.
1957 – Признание генетической природы индивидуальной чувствительности к лекарствам (А. Мотульский, В. Калов).
1958 – Введение термина «фармакогенетика» (Ф.Фогель).
1962 – Издание первой книги по фармакогенетике – (В Калов).
1977 –Установление генетической природы (полиморфизмом гена CYP2D6) скорости метаболизма противитуберкулезного препарата дебризоквина.
1980 -Установление связи между токсичностью меркаптопурина и дефицитом фермента тиопуринтрансферазы.
Слайд 4
Описание слайда:
Слайд 5
Описание слайда:
ОРГАНИЗМ И ЛЕКАРСТВО Фармакокинетика – абсорбция, распределение, метаболизм и выведение лекарства Фармакодинамика – взаимоотношение между концентрацией, местом действия и эффектом Фенотипирование лекарства- прямой метод определения активности лекарства по фармакокинетике субстрата Генотипирование – анализ полиморфизмов генов, определяющих метаболизм лекарства Генетическая гетерогенность – генный полиморфизм Фармакогенетика – индивидуальная реакция на лекарства Фармакогеномика – союз функциональной геномики и молекулярной фармакологии
Слайд 6
Описание слайда:
Фенотипические эффекты лекарств в
зависимости от функции генов
фармакокинетики и фармакодинамики
.
Слайд 7
Описание слайда:
Метаболизм лекарств Лекарства с высоким печеночным клиренсом: аминазин, аспирин,кортизон, ,морфин, резерпин, метопролол, метилтестостерон, и др. Лекарства с низким печеночным клиренсом: теофеллин, парацетомол По скорости метаболизма лекарств различают: «Экстенсивные » метаболизаторы- норма «Медленные» метаболизаторы – сниженная «Быстрые или сверхактивные» метаболизаторы
Слайд 8
Описание слайда:
ФАЗЫ ДЕТОКСИКАЦИИ Фаза 1 Несинтетические реакции (пролекарство – лекарство) Оксидазы со смешанной функцией Реакции восстановления и гидролиза Фаза II Синтетические реакции Коньюгация ЛС через метаболически активные радикалы (фазы I) Возможен метаболизм ЛС только за счет ферментов Фазы I или Фазы II
Слайд 9
Описание слайда:
Описание слайда:
Слайд 11
Описание слайда:
Слайд 12
Описание слайда:
Слайд 13
Описание слайда:
Индукция ферментов метаболизма
1. Фенобарбиталовый путь – активация промотора в регуляторной области гена
Аутоиндукция – сам ксенобиотик активатор фермента
2.Рифампицин-дексаметазоновый тип – взаимодействие индуктора с рецепторами-регуляторами транскрипции
3. Этаноловый тип –стабилизация молекулы фермента метаболизма путем образования комплекса с некоторыми ксенобиотиками
Фенобарбиталовый путь – активация промотора в регуляторной области гена
Аутоиндукция – сам ксенобиотик активатор фермента
2.Рифампицин-дексаметазоновый тип – взаимодействие индуктора с рецепторами-регуляторами транскрипции
3. Этаноловый тип –стабилизация молекулы фермента метаболизма путем образования комплекса с некоторыми ксенобиотиками
Слайд 14
Описание слайда:
Слайд 15
Описание слайда:
Слайд 16
Описание слайда:
Описание слайда:
Слайд 18
Описание слайда:
Слайд 19
Описание слайда:
Генетические механизмы индивидуальной чувствительности к лекарствам ФАРМАКОКИНЕТИЧЕСКИЕ: изменение абсорбции – инотиазид – NAT2 превращение в активную форму кодеин –морфин –CYP 2D6 системные особенности метаболизма конкуренция препаратов за фермент индукция ферментов метаболизма индукция/ингибирование пищевыми продуктами ФРАМАКОДИНАМИЧЕСКИЕ: поступление /выведение препарата из клетки изменения в белках рецепторах
Слайд 20
Описание слайда:
Слайд 21
Описание слайда:
Слайд 22
Описание слайда:
Слайд 23
Описание слайда:
ФАРМАГЕН-БИОЧИП 14 мутаций в 8 генах метаболизма Блок 1 CYP1A1 – C4887A A4889G T6235C CYP2D6 – G1934A DelA2637 Блок 2 GSTM1 – 0/0 0/+ +/+ GSTT1 – 0/0 0/+ +/+ Блок-3 NAT2 – 481C>T 590 G>A 895G>A MTHFR – C677T Блок 4 СYP2C9 – C430T C61075T CYP2C19 – G681A
Слайд 24
Описание слайда:
Слайд 25
Описание слайда:
ЭФФЕКТИВНОСТЬ ЛЕЧЕНИЯ ЭНДОМЕТРИОЗА
ГЕНЕТИЧЕСКИЕ МАРКЕРЫ НЕЭФФЕКТИВНОСТИ
МЕДИКАМЕНТОЗНОЙ ( ГОРМОНАЛЬНОЙ)
ТЕРАПИИ 1.
Слайд 26
Описание слайда:
Ген Thiopurine S-methyltransferase (TPMT) локализован на хромосоме 6p22.3 и состоит из 9 интронов и 10 экзонов. Белковый продукт гена TPMT инактивирует противоопухолевые препараты: меркаптопурин, азатиопурин, тиогуанин. 1 из 300 европейцев является гомозиготой по аллелю с очень низкой ферментной активностью по данному локусу. ~ 10 % индивидов – гетерозиготы по аллелю со средней белковой активностью. ~ 89% людей – гомозиготы по аллелю с высокой белковой активностью.
Слайд 27
Описание слайда:
Слайд 28
Описание слайда:
Слайд 29
Описание слайда:
Персонифицированная медицина Москва, Общественная палата
Слайд 30
Описание слайда:
Tags Фармакогенетика
Похожие презентации
Презентация успешно отправлена!
Ошибка! Введите корректный Email!
Презентация на тему: КЛИНИЧЕСКАЯ
ФАРМАКОГЕНЕТИКА.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ
ГЕНЕТИЧЕСКИХ ФАКТОРОВ В
ФАРМАКОКИНЕТИКЕ И ФАРМАКОДИНАМИКЕ ЛС.
ВЫПОЛНИЛ: СТУДЕНТ 5 КУРСА ГРУППЫ ЛД2А-С14
МОРКОВКИН СЕРГЕЙ МАКСИМОВИЧ
КЛИНИЧЕСКАЯ ФАРМАКОГЕНЕТИКА
Фармакогенетика — раздел фармакологии, изучающий роль генетических факторов в формировании фармакологического ответа организма человека на ЛС. Предмет фармакогенетики — наследственные различия, выражающиеся в определённом фармакологическом ответе на ЛС. Фармакогенетика возникла на стыке фармакологии и генетики. Любые спонтанные изменения (мутации) в генах, контролирующих синтез белков, участвующих в процессах фармакокинетики и/или фармакодинамики ЛС, приводят к изменению фармакологического ответа. Подобные мутации могут, передаваясь из поколения в поколение, распространяться в популяции. Существование в популяции различных аллельных вариантов одного и того же гена называют генетическим полиморфизмом, а гены, для которых известен множественный аллелизм, — полиморфными маркёрами. В последние два десятилетия методами ПЦР стало возможно выявление и диагностирование полиморфных маркёров у пациентов (генотипирование).
В последние два десятилетия методами ПЦР стало возможно выявление и диагностирование полиморфных маркёров у пациентов (генотипирование).
КЛИНИЧЕСКАЯ ФАРМАКОГЕНЕТИКА
Методы генотипирования позволяют прогнозировать фармакологический ответ на ЛС, следовательно повысить эффективность и безопасность его применения, так как при выявлении соответствующего аллельного варианта необходима коррекция режима дозирования препарата, пути введения или его замена. В настоящее время в развитых странах разрабатывают и внедряют генетические микрочипы, позволяющие выявлять одновременно целые серии мутантных аллелей, ответственных за изменение фармакологического ответа. Разработка и внедрение подобных методов — основная задача нового направления клинической фармакологии — фармакогеномики. В связи с тем, что отдельные полиморфные маркёры одновременно ассоциированы как с изменением фармакокинетики и фармакодинамики ЛС, так и с рядом заболеваний (например, онкологическими, болезнью Паркинсона, атеросклерозом), фармакогенетические исследования способствуют более полному пониманию их этиологии и патогенеза.
ГЕНЕТИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ФАРМАКОКИНЕТИКУ
Генетические факторы оказывают влияние на все этапы фармакокинетики ЛС. Наибольшее клиническое значение имеет генетический полиморфизм ферментов метаболизма ЛС, характерный для ферментов как фазы I (например, изоферментов цитохрома Р450, дигидропиримидин дигидрогеназы, бутирилхолинэстеразы), так и фазы II (N-ацетилтрансферазы, тиопурин S-метилтрансферазы, эпоксид гидролазы и др.) метаболизма ЛС. Он обусловлен мутациями в генах ферментов, метаболизирующих ЛС, что приводит к синтезу ферментов с изменённой активностью. В результате скорость метаболизма ЛС уменьшается или увеличивается. В зависимости от скорости метаболизма ЛС в популяции населения выделяют
ГЕНЕТИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ФАРМАКОКИНЕТИКУ
•Активные метаболизаторы — люди, у которых активность ферментов, участвующих в метаболизме ЛС, не изменена (большинство населения).
•«Медленные» метаболизаторы — носители мутаций гена того или иного фермента метаболизма ЛС, приводящих либо к синтезу «дефектного» (с низкой активностью) фермента, либо полному прекращению его синтеза. Это приводит к кумуляции ЛС в организме, поэтому пациентам этой группы ЛС следует назначать в меньшей дозе.
Это приводит к кумуляции ЛС в организме, поэтому пациентам этой группы ЛС следует назначать в меньшей дозе.
•«Сверхактивные», или «быстрые», метаболизаторы — носители мутаций гена того или иного фермента метаболизма,
приводящих к синтезу фермента с высокой активностью, что приводит к более выраженному снижению концентрации ЛС в крови. Следовательно, для пациентов этой группы назначаемая
РАСПРОСТРАНЁННОСТЬ «МЕДЛЕННЫХ» И «БЫСТРЫХ» МЕТАБОЛИЗАТОРОВ В ЗАВИСИМОСТИ ОТ ФЕРМЕНТОВ МЕТАБОЛИЗМА ЛС
КЛИНИЧЕСКИ ЗНАЧИМЫЙ ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ИЗОФЕРМЕНТА ЦИТОХРОМА Р450
•СУР2D6 участвует в метаболизме нейролептиков, антидепрессантов, В-адреноблокаторов.
•СУР2С9 участвует в метаболизме многих НПВС, фенитоина, пероральных гипогликемических средств (производных сульфонилмочевины), варфарина.
•СУР2С19 участвует в метаболизме имипрамина, диазепама, барбитуратов, вальпроевой кислоты, противомалярийных препаратов.
•СУР2А6 метаболизирует небольшое количество ЛС, например участвует в превращении никотина в кетинин, 7- гидроксилировании циклофосфамида и ифосфамида, а также в метаболизме ритонавира.
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ДИГИДРОПИРИМИДИН ДИГИДРОГЕНАЗЫ (ДПДГ)
•Физиологическая функция ДПДГ — восстановление урацила и тимидина до В- аланина (т.е. первая реакция трёхэтапного метаболизма этих соединений). ДПДГ
— основной фермент, метаболизирующий фторурацил, широко применяемый в составе комбинированной химиотерапии злокачественных новообразований. При низкой активности ДПДГ (наследуется по аутосомно-рецессивному типу) увеличивается Т1/2 фторурацила с 8-22 мин (нормальные значения) до 160 мин. Чем ниже активность ДПДГ, тем тяжелее побочные эффекты фторурацила (нейротоксичность, кардиотоксичность). Наиболее распространённые мутации гена ДПДГ, ответственные за снижение активности этого фермента, — делеция в положении 165, замена гуанилового нуклеотида на адениловый в положении 14 и сочетание двух этих мутаций. Повышенную чувствительность к фторурацилу выявляют не только у гомозигот, но и у гетерозигот по мутантным аллелям гена ДПДГ. Внедрение методов фенотипирования и генотипирования ДПДГ в клиническую практику позволит повысить безопасность химиотерапии фторурацилом.
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ БУТИРИЛХОЛИНЭСТЕРАЗЫ (ПСЕВДОХОЛИНЭСТЕРАЗЫ)
Физиологическая функция бутирилхолинэстеразы — гидролиз ацетилхолина.
Существуют 3 различных мутации, которые в гомозиготном состоянии приводят к повышенной чувствительности к суксаметонию, либо с повышенной чувствительности к суксаметонию с коротким периодом апное (до 30 минут)
Фенотипирование бутирилхолинэстеразы для определения её сниженной активности осуществляют с помощью «дибукаинового теста», основанного на торможении активности фермента дибукаином в стандартных условиях. Результат теста представляют в виде «дибукаинового числа», равного степени подавления фермента, выраженной в процентах. При нормальной активности бутирилхолинэстеразы дибукаиновое число равно 80%, у гомозигот по мутантным аллелям, определяющим сниженную активность фермента, оно составляет 20%, у гетерозигот по этим аллелям — 60%.
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ПАРАОКСОНАЗЫ (АРОМАТИЧЕСКОЙ ЭСТЕРАЗЫ)
•Параоксоназа — фермент из группы арилэстераз. Название фермента определяется его способностью метаболизировать параоксон — антихолинэстеразный препарат, применяемый местно для лечения глаукомы. Параоксоназа также участвует в эфирном гидролизе фосфорорганических соединений, карбаматов, эфиров уксусной кислоты. Носители мутации параоксоназы GLN192ARG, особенно гомозиготы, более чувствительны к действию фосфорорганических соединений. Эта мутация наиболее распространена у японцев (41,4%), что обусловило большое количество жертв при применении зарина при террористическом акте в Токийском метро в марте 1995 г.
Название фермента определяется его способностью метаболизировать параоксон — антихолинэстеразный препарат, применяемый местно для лечения глаукомы. Параоксоназа также участвует в эфирном гидролизе фосфорорганических соединений, карбаматов, эфиров уксусной кислоты. Носители мутации параоксоназы GLN192ARG, особенно гомозиготы, более чувствительны к действию фосфорорганических соединений. Эта мутация наиболее распространена у японцев (41,4%), что обусловило большое количество жертв при применении зарина при террористическом акте в Токийском метро в марте 1995 г.
Введение в фармакогенетику | AACC.org
Автор: Пинг Ван // Дата: 22 мая 2013 г. // Источник: Совет стажеров на английском языке
СЛАЙДЫ
Загрузить слайды (pdf)
СТЕНОК
Скачать стенограмму (pdf)
Слайд 1:
Здравствуйте, меня зовут Пинг Ван. Я директор отделения клинической химии в Методистской больнице в Хьюстоне, штат Техас, и доцент Медицинского колледжа Вейла Корнелла. Добро пожаловать в эту жемчужину лабораторной медицины по теме «Введение в фармакогенетику».
Слайд 2:
В этой презентации я сначала представлю концепцию фармакогенетики. Традиционный способ дозирования лекарств имеет свои ограничения, о чем свидетельствует распространенность побочных реакций на лекарства и ограниченная эффективность лекарств. Это приводит нас к преимуществам дозирования на основе фармакогенетики. Затем я расскажу о влиянии генетики на метаболизм и действие лекарств.
Сначала вводятся понятия фармакокинетики и фармакодинамики, за которыми следуют общие гены, участвующие в фармакогенетике. Я кратко рассмотрю фармакогенетические биомаркеры на одобренных FDA этикетках лекарств, а затем расскажу о современных методологиях тестирования, используемых в этой области. Наконец, я хотел бы познакомить вас с несколькими онлайн-ресурсами, которые я считаю ценными, если вы хотите узнать больше о фармакогенетике.
Слайд 3:
Традиционный метод дозирования методом проб и ошибок имеет существенные ограничения. Одно из таких ограничений демонстрируется распространенностью побочных реакций на лекарства. По данным метааналитического исследования, на побочные реакции на лекарственные препараты (или НЛР) приходится 3–11% всех госпитализаций в США. Общее количество ADR оценивается в 2 миллиона случаев в год, среди которых 110 000 случаев со смертельным исходом. Они являются 4-6-й основной причиной смерти в Соединенных Штатах.
Слайд 4:
На этом слайде показан неполный список лекарств, которые были изъяты с рынка США из-за тяжелых побочных реакций на лекарства. Примеры включают талидомид, фенформин, буформин, фен-фен и т. д. Вопрос, который следует задать, заключается в том, поможет ли целевое введение лекарств или дозировка, основанная на генетике конкретного пациента, избежать отмены.
Примеры включают талидомид, фенформин, буформин, фен-фен и т. д. Вопрос, который следует задать, заключается в том, поможет ли целевое введение лекарств или дозировка, основанная на генетике конкретного пациента, избежать отмены.
Слайд 5:
Ограничения традиционных способов дозирования лекарств также демонстрируются ограниченной эффективностью лекарств в различных классах лекарств. Как показано ниже, частота ответа пациентов на противораковые препараты составляет около 25%. Частота ответа на селективные ингибиторы серотонина составляет около 62%. На лекарства от астмы, диабета или мигрени частота ответа составляет от 50 до 60%.
Slide 6:
Фармакогенетика, или иногда взаимозаменяемая с фармакогеномикой, представляет собой науку, изучающую вариации в генах, определяющие реакцию на лекарства. В широком смысле генетическая изменчивость может передаваться по наследству или приобретаться. Классическая фармакогенетика имеет дело с унаследованными зародышевыми вариациями, в то время как фармакогенетика в широком смысле также включает приобретенные соматические вариации опухолей, поскольку и то, и другое может диктовать реакцию на лекарства, особенно реакцию на противораковую терапию.
Фармакогенетика исследует способы использования этих вариаций для прогнозирования того, будет ли у конкретного пациента хороший ответ, плохой ответ или вообще не будет ответа на лекарство. В некоторых случаях это также может помочь определить, какую дозу препарата следует дать человеку. Цель состоит в том, чтобы дать правильному пациенту правильное лекарство в нужное время и в правильной дозе.
Генетические вариации, о которых мы здесь говорим, включают однонуклеотидные полиморфизмы, или SNP, вставки, делеции, дупликации и транслокации.
Слайд 7:
Генетические вариации, перечисленные на предыдущем слайде, используются для определения генотипа и гаплотипа человека по этому конкретному интересующему гену. Было бы полезно ввести и дать определение этим двум понятиям, поскольку они занимают центральное место в дисциплине фармакогенетики.
Генотип относится к специфической аллели, наследуемой в генном локусе. Например, ген CYP2C9 или цитохром P450 2C9 имеет однонуклеотидный полиморфизм, или SNP, в нуклеотидном номере 430, который может быть заменен на T из более распространенного C. Это описывается как c.430C, за которым следует стрелка, затем 9Таким образом, 0015 T. CYP2C9 имеет два возможных генотипа в этом локусе: c.430 C и c. 430т. Распространенность каждого генотипа может различаться у разных этнических групп. Исторически сложилось так, что в процессе исследования вариантов CYP450 разным аллелям присваивались разные обозначения «*». Номенклатура генов цитохрома P450 теперь определяется комитетом, и к ней можно получить доступ в Интернете. Веб-сайт соотносит каждый аллель, обозначенный «*», с его генетическими вариациями и оригинальной литературой, описывающей их. Веб-адрес указан на слайде 16, слайд «Ресурсы по фармакогенетике».
Это описывается как c.430C, за которым следует стрелка, затем 9Таким образом, 0015 T. CYP2C9 имеет два возможных генотипа в этом локусе: c.430 C и c. 430т. Распространенность каждого генотипа может различаться у разных этнических групп. Исторически сложилось так, что в процессе исследования вариантов CYP450 разным аллелям присваивались разные обозначения «*». Номенклатура генов цитохрома P450 теперь определяется комитетом, и к ней можно получить доступ в Интернете. Веб-сайт соотносит каждый аллель, обозначенный «*», с его генетическими вариациями и оригинальной литературой, описывающей их. Веб-адрес указан на слайде 16, слайд «Ресурсы по фармакогенетике».
Гаплотип относится к коллективным генотипам ряда тесно связанных локусов на хромосоме. Например, ген VKORC1, или субъединица 1 комплекса эпоксидредуктазы витамина К, имеет в своей последовательности десять полиморфных локусов. Сочетание определенных нуклеотидов в каждом локусе называется гаплотипом. Например, комбинация CCGATCTCTG в каждом из 10 перечисленных локусов называется гаплотипом h2.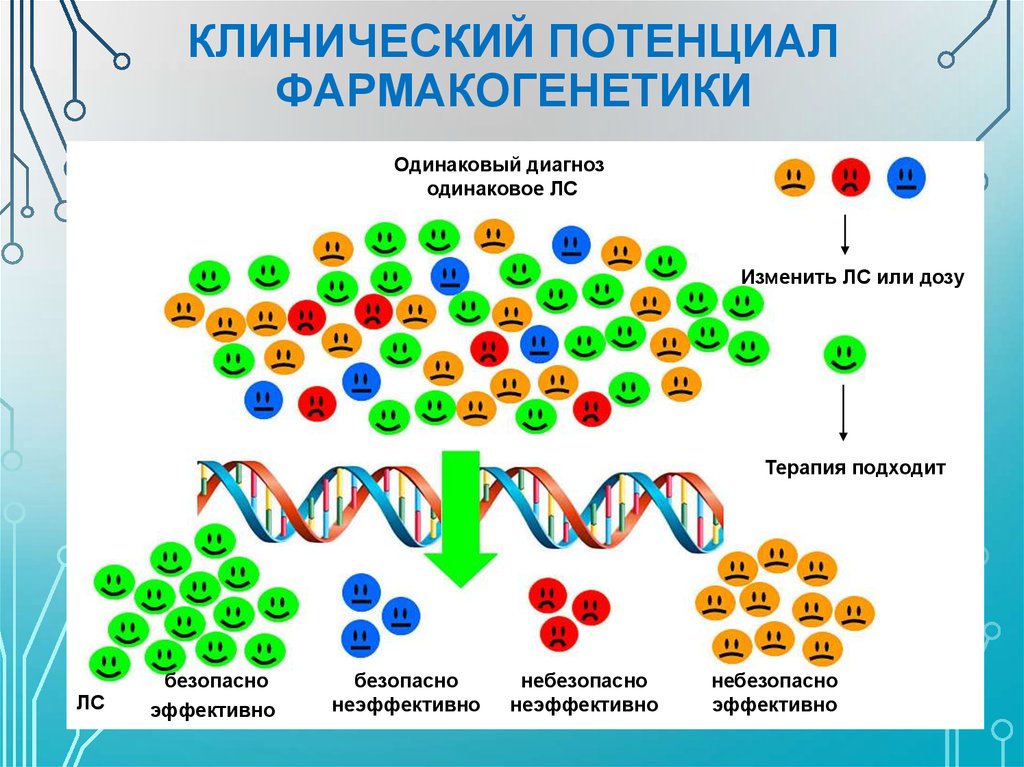 Распространенность каждого гаплотипа может различаться у разных этнических групп.
Распространенность каждого гаплотипа может различаться у разных этнических групп.
Слайд 8:
Выбор и дозирование лекарств на основе фармакогенетики имеет много преимуществ. Это помогает быстрее достичь оптимальной дозы, избегая традиционного метода «проб и ошибок». Это также помогает избегать лекарств, от которых отдельные пациенты будут страдать от серьезных побочных эффектов или не получат пользы. Кроме того, его можно использовать для стратификации пациентов для клинических испытаний. В исследование включаются только пациенты, которые могут дать ответ, что повышает вероятность успеха и ускоряет процесс. Сопутствующая диагностика, которая включает генотипирование пациентов перед назначением лекарств, требуется сегодня для нескольких лекарств. Наконец, снижение побочных эффектов и повышение эффективности лекарств могут помочь повысить вероятность того, что пациенты будут соблюдать назначенные им режимы приема лекарств.
Слайд 9:
На этом слайде показаны примеры сопутствующих диагностических тестов, одобренных FDA для использования перед назначением определенных лекарств. Полный список всех сопутствующих диагностических тестов, одобренных FDA, можно найти на веб-сайте, указанном внизу страницы (http://www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ucm301431.h tm).
Полный список всех сопутствующих диагностических тестов, одобренных FDA, можно найти на веб-сайте, указанном внизу страницы (http://www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ucm301431.h tm).
Слайд 10:
Генетика может влиять на ответ на лекарство, а затем и на клинический результат, влияя на фармакокинетику и/или фармакодинамику лекарства.
Фармакокинетика относится к тому, что человеческий организм делает с лекарством. Это описывается классическим путем ADME: всасывание, распределение, метаболизм и экскреция. В этом процессе важны такие органы, как желудок, кишечник, печень и почки. Генетические вариации в генах, кодирующих переносчики лекарств и метаболизирующие ферменты, могут влиять на функцию и количество кодируемых белков и, таким образом, влиять на концентрацию лекарств, которым подвергается организм.
Фармакодинамика относится к действию препарата на организм человека. Генетические вариации в генах, кодирующих мишени для лекарственных средств, и последующие молекулы, участвующие в механизме действия лекарственного средства, могут влиять на функцию и количество белка и, таким образом, влиять на реакцию на лекарственное средство.
Слайд 11:
На этом слайде я привожу несколько примеров общих генов, часто изучаемых в фармакогенетике. Во-первых, и наиболее часто вовлекаются гены, кодирующие ферменты, метаболизирующие фазу I. Целью фазы I метаболизма является введение или воздействие реактивных или полярных групп на обычно липофильные препараты.
Ферменты фазы I обычно представляют собой ферменты окисления, восстановления и гидролиза. Наиболее важным ферментом фазы I является цитохром P450s. Они представляют собой суперсемейство монооксигеназ, которые обычно окисляют лекарства. Помимо Cyp450, ферменты фазы I также включают эстеразы и гидролазы. Эти реакции могут превращать неактивные пролекарства в активные метаболиты. Например, в случае клопидогрела метаболизирующий фермент цитохром Р450 2С19, вместе с несколькими другими CYP450, необходим для превращения неактивного клопидогреля в его активный метаболит для эффекта ингибирования тромбоцитов. Метаболизм фазы I может также превращать активные лекарства в неактивные метаболиты. Например, CYP2C9 превращает варфарин в его неактивный метаболит, гидроксиварфарин.
Например, CYP2C9 превращает варфарин в его неактивный метаболит, гидроксиварфарин.
Slide 12:
Гены, кодирующие ферменты, метаболизирующие фазу II, также часто используются в фармакогенетике. Метаболизирующие ферменты фазы II представляют собой конъюгирующие ферменты, которые присоединяют глюкуроновую кислоту, сульфат, глутатион, метильные фрагменты и т. д. к продуктам метаболизма фазы I, чтобы сделать метаболиты более водорастворимыми и легко выводимыми из организма. Примерами являются UGT1A1 для иринотекана и TPMT для азатиоприна и 6-меркаптопурина.
Наиболее часто изучаемым геном, кодирующим переносчик лекарств, является ген ABCB1 или MDR1, кодирующий р-гликопротеин. Гены, кодирующие другие ферменты, могут включать гены G6PD и AchE. Примером рецептора лекарственного средства или гена-мишени является VKORC1 для варфарина.
Слайд 13:
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) включило некоторую информацию о фармакогенетике в этикетки утвержденных лекарственных средств. На этом слайде перечислены препараты, этикетки которых указывают на необходимость фармакогенетической характеристики, прежде чем эти препараты можно будет правильно использовать по показаниям. Большинство из этих препаратов являются таргетной терапией рака. Вовлеченные фармакогенетические гены обычно являются мишенями для лекарств, которые характеризуют специфическую молекулярную форму рака. Важно, чтобы фармакогенетическая характеристика опухоли выполнялась до назначения лекарственного лечения. Для некоторых из этих препаратов имеются или разрабатываются клинические рекомендации.
На этом слайде перечислены препараты, этикетки которых указывают на необходимость фармакогенетической характеристики, прежде чем эти препараты можно будет правильно использовать по показаниям. Большинство из этих препаратов являются таргетной терапией рака. Вовлеченные фармакогенетические гены обычно являются мишенями для лекарств, которые характеризуют специфическую молекулярную форму рака. Важно, чтобы фармакогенетическая характеристика опухоли выполнялась до назначения лекарственного лечения. Для некоторых из этих препаратов имеются или разрабатываются клинические рекомендации.
Слайд 14:
В этой таблице перечислены препараты, на этикетках которых рекомендуется дать фармакогенетическую характеристику, чтобы правильно назначать или дозировать препараты во избежание серьезных побочных эффектов. Некоторые из этих неблагоприятных последствий подчеркнуты в виде предупреждений в виде «черных ящиков» на листках-вкладышах. Для некоторых из этих препаратов, таких как варфарин, были разработаны рекомендации по дозировке, позволяющие корректировать дозировку в соответствии с результатами фармакогенетических испытаний и клиническими факторами. Следует полностью избегать применения других препаратов, таких как абакавир, если фармакогенетический результат соответствует определенному генотипу.
Следует полностью избегать применения других препаратов, таких как абакавир, если фармакогенетический результат соответствует определенному генотипу.
Хочу отметить, что эти две таблицы на слайдах 13 и 14 ни в коем случае не являются полным списком всех препаратов с информацией о фармакогенетике на этикетках. Полный список можно найти на веб-сайте FDA, указанном внизу страницы (http://www.fda.gov/drugs/scienceresearch/researchareas/pharmacogenetics/ucm083378.htm).
Слайд 15:
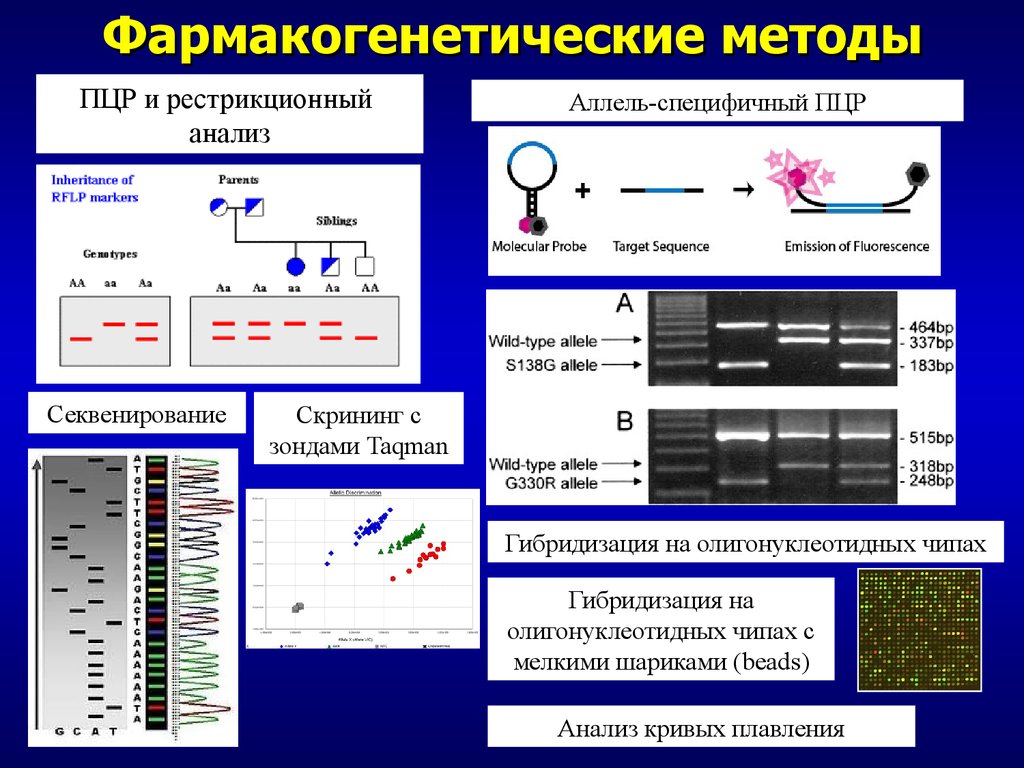
Я хотел бы посвятить этот слайд краткому рассказу о методологиях тестирования в фармакогенетике. Статус метаболизма может быть получен методами фенотипирования, такими как использование зондовых препаратов, вестерн-блоттинг или иммуногистохимия. Они могут выявить функцию и/или количество белка, кодируемого соответствующими генами. В качестве альтернативы мы можем выбрать прямое исследование последовательности ДНК. Флуоресцентная гибридизация in situ может обнаруживать присутствие специфических последовательностей внутри клеток. ПЦР часто используется для амплификации последовательностей-мишеней с последующим расщеплением специфических мутаций ферментами, электрофорезом, аллель-специфической гибридизацией, различными методами секвенирования или масс-спектрометрическим анализом. Флуоресцентные конъюгированные зонды могут использоваться в некоторых технологиях для обнаружения определенных последовательностей ДНК. Многие из этих методов доступны в виде коммерческих анализов. Некоторые из них одобрены FDA и продаются в качестве сопутствующих диагностических тестов для клинического лабораторного использования.
ПЦР часто используется для амплификации последовательностей-мишеней с последующим расщеплением специфических мутаций ферментами, электрофорезом, аллель-специфической гибридизацией, различными методами секвенирования или масс-спектрометрическим анализом. Флуоресцентные конъюгированные зонды могут использоваться в некоторых технологиях для обнаружения определенных последовательностей ДНК. Многие из этих методов доступны в виде коммерческих анализов. Некоторые из них одобрены FDA и продаются в качестве сопутствующих диагностических тестов для клинического лабораторного использования.
Slide 16:
Наконец, я перечислил несколько онлайн-ресурсов, которые я считаю полезными, если вы заинтересованы в получении дополнительной информации о фармакогенетике: ресурсов, включая фармакогенетику (http://www.ncbi.nlm.nih.gov/About/primer/pharm.html).
 pharmgkb.org).
pharmgkb.org).Слайд 17: Ссылки
Слайд 18: Раскрытие информации
Слайд 19: Спасибо от www.TraineeCouncil.org
Спасибо, что присоединились ко мне в этой Жемчужине лабораторной медицины по теме «Введение в фармакогенетику». Я Пин Ван.
Я Пин Ван.
Фармакогеномика: введение и использование в клинической практике
Обзор
. 2020 1 июня; 58 (2): 69-74.
doi: 10.2478/rjim-2020-0001.
Холли Сондерс 1 , Дана Харрис 1 , Рэзван М. Кирилэ 1
принадлежность
- 1 Клиника Мэйо, отделение внутренней медицины, Джексонвилл, Флорида.
- PMID: 32074077
- DOI: 10.2478/rjim-2020-0001
Бесплатная статья
Обзор
Холли Сондерс и др. Ром Дж. Стажер мед. .
Ром Дж. Стажер мед. .
Бесплатная статья
. 2020 1 июня; 58 (2): 69-74.
doi: 10.2478/rjim-2020-0001.
Авторы
Холли Сондерс 1 , Дана Харрис 1 , Рэзван М. Кирилэ 1
принадлежность
- 1 Клиника Мэйо, отделение внутренней медицины, Джексонвилл, Флорида.
- PMID: 32074077
- DOI:
10.
 2478/rjim-2020-0001
2478/rjim-2020-0001
Абстрактный
Фармакогеномика описывает связь между генетическим кодом и вариациями реакции на лекарства или побочными эффектами. Он быстро набирает как интерес, так и доступность. Знание сочетания ген-лекарство для широкого спектра лекарств позволит клиницисту выбрать препараты с наилучшей эффективностью, подходящей дозой и с наименьшей вероятностью серьезных побочных эффектов. Чтобы применять эти знания, практикующие врачи должны быть знакомы с основными принципами фармакодинамики и фармакокинетики, а также с тем, как они связаны с реакцией на лекарство. Как только они будут поняты, то же самое можно будет сделать и с генетическими вариациями, которые приводят к различным фенотипам. Наш обзор объясняет эти концепции и использует примеры часто назначаемых лекарств и их генных пар. В настоящее время руководящие принципы Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) остаются скудными в отношении фармакогеномного тестирования, но, несмотря на это, тестирование непосредственно у потребителя широко доступно.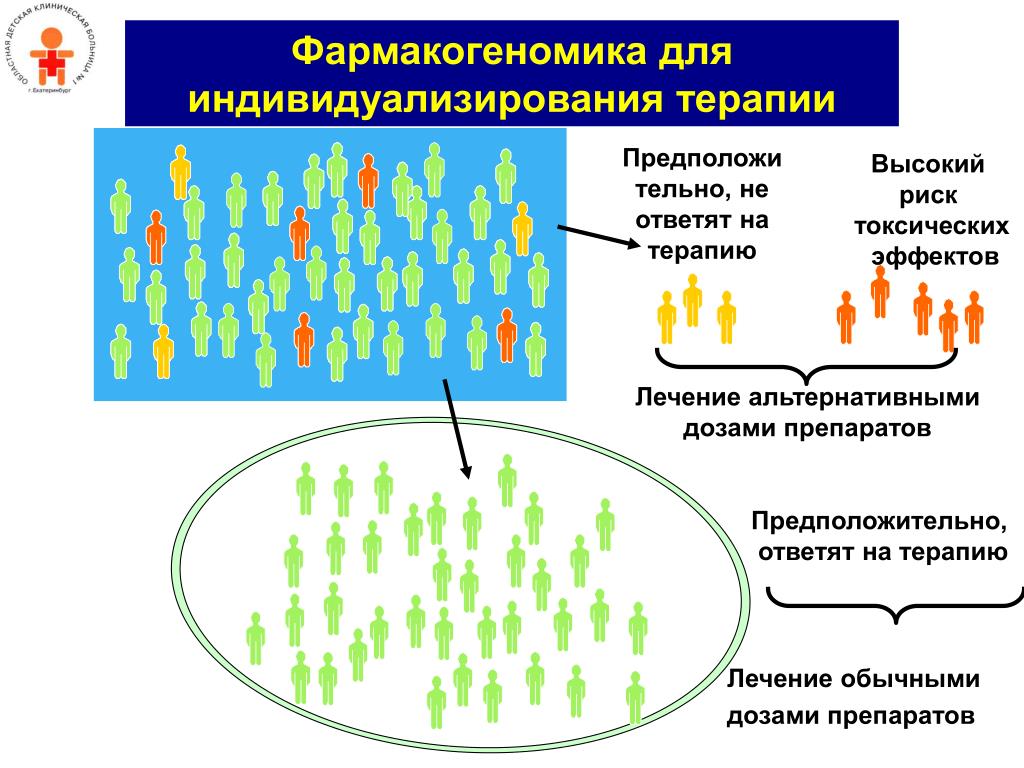 В этом контексте мы подробно расскажем, как интерпретировать фармакогеномный отчет, рассмотрим показания к тестированию, а также его ограничения. Эта информация является шагом вперед к индивидуализированной медицине в надежде на то, что адаптация лекарств и доз к генетической структуре человека позволит предсказать безопасный и эффективный ответ.
В этом контексте мы подробно расскажем, как интерпретировать фармакогеномный отчет, рассмотрим показания к тестированию, а также его ограничения. Эта информация является шагом вперед к индивидуализированной медицине в надежде на то, что адаптация лекарств и доз к генетической структуре человека позволит предсказать безопасный и эффективный ответ.
Ключевые слова: CYP450; клиническая практика; фармакогеномика.
Похожие статьи
Использование фармакогенетики в первичной медико-санитарной помощи.
Мурфин М. Мурфин М. ДЖААПА. 2019 авг;32(8):17-21. doi: 10.1097/01.JAA.0000569772.68575.ac. ДЖААПА. 2019. PMID: 31290773
Фармакогеномика может улучшить назначение психиатрических препаратов.

Наранг П., Джонсон А., Энджа М., Липпманн С. Наранг П. и др. South Med J. 2016 Oct;109(10):628-630. doi: 10.14423/SMJ.00000000000000534. Южный Мед J. 2016. PMID: 27706500
Служба профиля фармакогеномики девяти генов: опыт клиники Мэйо.
Матей Э. Т., Раган А. К., Ойен Л. Дж., Витек К. Р., Аудиа С. Л., Рагаб А. К., Фи-Шредер К. С., Блэк Д. Л., Мойер А. М., Николсон В. Т., Шреста С., Макаллистер Т. М., Синнвелл Д. П., Фобион С. С., Лазаридис К. Н. Матей Э.Т. и др. Pharmacogenomics J. 2022 Feb; 22 (1): 69-74. doi: 10.1038/s41397-021-00258-0. Epub 2021 20 октября. Фармакогеномика Дж. 2022. PMID: 34671112
Генетическая предрасположенность к лекарственному поражению печени.
Стивенс С.