Глава 12. Основные понятия и принципы молекулярно-кинетической теории
В задания ЕГЭ по физике всегда включаются задачи, касающиеся основных принципов молекулярно-кинетической теории. Это задачи, связанные с молекулярной структурой газов, жидкостей и твердых тел, с определением температуры, с методами подсчета числа составляющих тело молекул. В этой главе собраны задачи, связанные с понятиями моля и температуры.
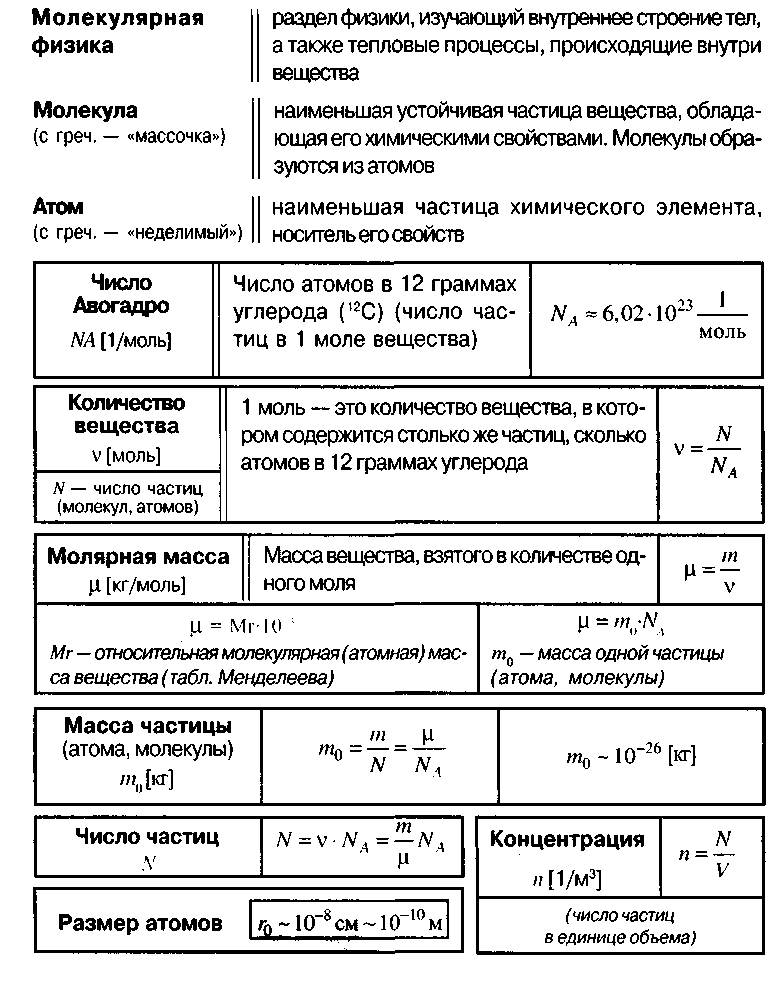
Молем вещества называется такое количество этого вещества, которое содержит приблизительно молекул, причем независимо от того, какое это вещество (точнее ). Приведенное выше число молекул в моле называется числом Авогадро и обозначается как . Как правило, при решении задач считают, что
(12.1) |
Обратим внимание читателя на то, что моль — макроскопическое количество вещества (в переводе с латинского языка — языка средневековой науки — слово moles означает толпа

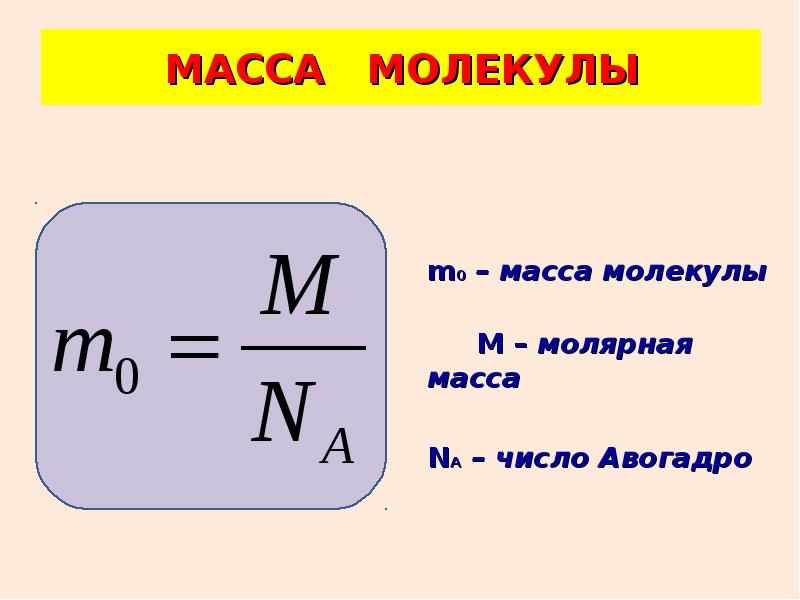
Масса одного моля вещества называется молярной массой этого вещества. И поскольку массы молекул разных веществ — разные, а число молекул в моле разных веществ одинаковое, то молярные массы веществ различны. При этом отношение молярных масс двух веществ равно отношению масс их молекул. Поэтому массы молей пропорциональны массам молекул. Число Авогадро (12.1) было подобрано так, чтобы масса моля, выраженная в граммах, численно совпадала с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Поэтому массы молей различных веществ легко найти из периодической системы химических элементов. Например, в таблице находим, что масса молекулы гелия — 4,0026 а.е.м., следовательно, масса моля гелия — 4,0026 4 г, масса двухатомной молекулы кислорода — 31,986 а.е.м., следовательно, масса моля кислорода — 31,986 32 г.
Необходимо также знать определение температуры. Температура тела — величина, пропорциональная средней кинетической энергии молекулы
(12. |
где — средняя кинетическая энергия молекулы, — абсолютная температура (ее называют также температурой в шкале Кельвина), — постоянная, которая называется постоянной Больцмана. Из формулы (12.2) следует, что температура по шкале Кельвина не может быть отрицательна, ее минимальное значение (абсолютный нуль температуры) достигается, когда все молекулы имеют нулевые кинетические энергии. 1 градус шкалы Кельвина (или просто один Кельвин) совпадает с градусом более привычной в быту шкалы Цельсия, нуль которой определяется как температура плавления льда, а температура 100 отвечает температуре кипения воды при атмосферном давлении. Как показывает опыт, абсолютному нулю температуры отвечает температура . Важнейшее свойство температуры заключается в том, что при приведении тел в тепловой контакт их температуры через некоторое время выровняются и далее (в отсутствие теплообмена с окружающими телами) не будут изменяться. Рассмотрим теперь задачи.
В задаче 12.1.1 правильным ответом правильным ответом является ответ 3, поскольку число молекул в моле не зависит от того, какое это вещество, и равно числу Авогадро.
Поскольку массы молекул разных веществ — разные, одинаковые массы разных веществ содержат различные количества молекул. Найти эти количества можно, зная молярные массы и число Авогадро. Например, в задаче 12.1.2 можно провести такие рассуждения. Водород массой 1 г составляет половину моля, и, следовательно, содержит молекул. Кислород массой 1 г составляет 1/32 часть моля, и, следовательно, содержит молекул. Отсюда находим отношение числа молекул в 1 г водорода к числу молекул в 1 г кислорода: (ответ
Согласно определению число молекул в моле одинаково для любого вещества, причем независимо от того, сколько атомов входят в состав одной молекулы этого вещества. Другими словами, это число не зависит от того, являются ли молекулы одно-, двух-, и т. д. атомными. Поэтому правильный ответ в задаче 12.1.3 — 4.
д. атомными. Поэтому правильный ответ в задаче 12.1.3 — 4.
Поскольку число молекул в моле любого вещества равно числу Авогадро, то для молярной массы любого вещества справедливо соотношение: , где — масса одной молекулы. Отсюда находим в
Чтобы понять, сколько молей содержит та или иная масса вещества, нужно разделить эту массу на молярную массу данного вещества (или число содержащихся в ней молекул на число Авогадро). Поскольку молярная масса гелия равна 4 г/моль, то 10 г гелия в задаче 12.1.5 составляют 4/10 = 2,5 моль (ответ 1).
Для характеристики числа молекул в некоторой массе вещества принято использовать величину, которая называется количество вещества. Эта величина определяется как число молей, составляющих данную массу. Для нахождения количества вещества нужно разделить число молекул этой массы вещества на число Авогадро, (или саму массу на молярную массу данного вещества).
Как указывалась во введении к настоящей главе, молярные массы веществ можно найти по периодической таблице элементов. Масса моля, выраженная в граммах, численно совпадает с массой молекулы, выраженной в атомных единицах массы (а.е.м.). Из приведенной в условии задачи 12.1.7
Связь температуры и средней кинетической энергии молекул определяется формулой (12.2) (задача 12.1.8 – ответ 2).
Температурой плавления льда (и замерзания воды) является температура 0 . Поскольку нуль шкалы Кельвина (абсолютный нуль температуры) в шкале Цельсия составляет –273 (см.
Изменением температуры тела в некотором процессе называется разность его конечной и начальной температур тела . Так как температуры в шкале Цельсия и Кельвина связаны «сдвигом»: , то разность температур в градусах Кельвина и в градусах Цельсия совпадает:
Другими словами, изменение температуры тела одинаково при задании температуры как в шкале Кельвина, так и в шкале Цельсия. Поэтому правильный ответ в задаче 12.1.10 — 2.
Из периодической таблицы элементов имеем для масс атомов: = 1 а. е.м., = 14 а.е.м., = 16 а.е.м. (задача 12.2.2). Отсюда находим массу молекулы азотной кислоты
е.м., = 14 а.е.м., = 16 а.е.м. (задача 12.2.2). Отсюда находим массу молекулы азотной кислоты
Поэтому = 63 г/моль (ответ 4).
Масса одной молекулы углерода = 12 а.е.м. А поскольку моль углерода содержит , то масса моля углерода равна а.е.м. (
Поскольку молярная масса — это характеристика вещества, то, находя эту величину, можно определить вещество. Например, в задаче 12.2.4 плотность газа (масса единицы объема) и концентрация молекул (число молекул в единице объема), очевидно, связаны друг с другом через массу одной молекулы . Умножая правую и левую часть этой формулы на число Авогадро и учитывая, что , получим = 4 г/моль. Поэтому неизвестный газ — гелий (ответ 2).
Используя определение температуры (12.2), получим для средней скорости молекул водорода в задаче 12.2.5
(ответ 3).
Из определения температуры (12.2) следует, что при повышении температуры в 2 раза средняя скорость молекул увеличивается в раз (задача 12.2.6 – ответ 3).
При приведении газов в тепловой контакт их температуры выровняются (задача 12.2.7). Отсюда согласно определению температуры следует, что средние кинетические энергии молекул газов станут равными:
или (ответ 3).
Задача 12.2.8 аналогична предыдущей. Используя определение температуры (12.2) для каждого газа и учитывая, что независимо от того, сколько атомов входит в состав молекулы, в правую часть определения температуры (12.2) входит коэффициент 3/2, получим
где — средняя скорость молекул водорода, — средняя скорость молекул гелия. Поскольку масса молекулы гелия в два раза больше массы молекулы водорода, то
(ответ 2).
Поскольку моль любого вещества содержит одинаковое количество молекул, то для сравнения числа молекул воды и ртути в стакане (задача 12.2.9) можно сравнить число молей. Число молей воды и ртути в стакане найдем из следующих цепочек формул. Воды:
(1) |
Ртути:
(2) |
где и — массы и плотности веществ, — молярные массы, — объем стакана. Сравнивая величины (1) и (2), заключаем
(здесь использованы плотности и молярные массы воды и ртути). Поэтому в стакане ртути больше молекул, чем в стакане воды (ответ 2), причем в 67/55 =1,2 раза.
Сначала обратим внимание читателя, что предложенные в задаче 12.2.10 значения температур и варианты ответов «подталкивают» к выбору ответа , поскольку конечная температура в 5 раз больше начальной. Тем не менее это неправильно, поскольку температуры заданы в градусах Цельсия, а в формулу (12.2), связывающую температуру и среднюю кинетическую энергию молекул, входит абсолютная температура. Поэтому
Тем не менее это неправильно, поскольку температуры заданы в градусах Цельсия, а в формулу (12.2), связывающую температуру и среднюю кинетическую энергию молекул, входит абсолютная температура. Поэтому
(ответ 4).
Количество вещества. Постоянная Авогадро. Молярная масса | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
Отношение количества молекул N в данном теле к количеству атомов NA в 0,012 кг углерода называется количеством вещества:
v = N / NA;
N = vNA.
Количество молекул воды в 1г равняется: N = m / m0 = 1 • 10-3 кг / 30 • 10-27 кг ≈ 3,3 • 1022.
Количество вещества измеряется в молях или киломолях.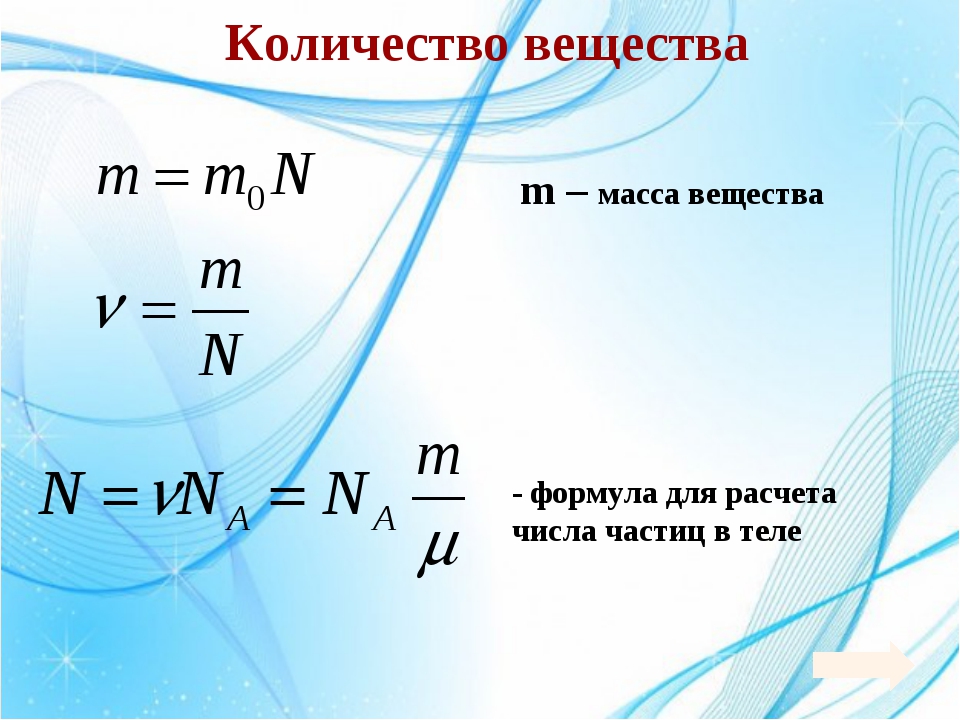 1 кмоль = 103 моль.
1 кмоль = 103 моль.
Моль — это такое количество вещества, которое содержит столько же атомов, молекул или других структурных элементов вещества, сколько атомов содержится в 0,012 кг углерода.
Количество атомов или молекул в 1 моле вещества называют постоянной Авогадро NA. Она одинакова для всех веществ и является фундаментальной константой физики:
NA = 6,022045 • 1023 моль-1.
1 моль кислорода содержится в 32 г кислорода, 1 моль воды — в 18 г воды.
Массу 1 моля вещества называют молярной массой. Согласно определению в СИ она измеряется в кг/моль и равняется произведению массы молекулы на постоянную Авогадро:
M = m0 • NA.
Молярная масса связана с относительной молекулярной массой простым соотношением:
М = Мr г /моль = Мr • 10-3 кг/моль.
Молярная масса воды равна 18 г/моль, или 18 • 10-3 кг/моль
Масса т произвольного количества вещества v определяется из соотношения:
m = m0• N = v • m0 • NA = v • М. Материал с сайта http://worldofschool.ru
На основании формулы v = N / NAи этого соотношения можно получить формулу для расчета общего количества молекул в теле:
N = NA• m / M.
Следовательно, для измерения количества вещества молекулярная физика использует величины, которые упрощают расчеты соответствующих величин,— постоянную Авогадро, молярную массу.
Молекулярная физика доклад
Количество вещества. лекция
Как определяется количество вещества?
В каких единицах измеряется количество вещества?
Чему равен 1 моль?
Что такое молярная масса?
Как вычислить молярную массу для любого вещества?
Число частиц, количество вещества, объём, плотность — урок. Химия, 8–9 класс.
Число частиц (атомов, молекул, протонов, электронов и т. д.) обозначается буквой N.
Пример:
N(O)= \(10000\) — число атомов кислорода равно \(10000\).
N(CO2)= 1025 — число молекул углекислого газа равно 1025.
N(n)= 2 ·1022 — число нейтронов равно 2 ·1022.
Химическое количество вещества — физическая величина, пропорциональная числу частиц, содержащихся в данной порции вещества. Обозначается буквой n. Единица измерения — моль.
Обозначается буквой n. Единица измерения — моль.
\(1\) моль — количество вещества, в котором содержится 6,02⋅1023 частиц.
Величина, равная 6,02⋅1023 моль-1 или 6,02⋅1023 1/моль, называется постоянной Авогадро. Единица в числителе дроби (1/моль) заменяет название частицы вещества.
Пример:
Na(O)= 6,02⋅1023 моль-1 обозначает, что один моль содержит 6,02⋅1023 атомов кислорода.
Na(CO2)= 6,02⋅1023 моль-1 обозначает, что один моль углекислого газа содержит 6,02⋅1023 молекул.
Na(n)= 6,02⋅1023 моль-1 обозначает, что один моль нейтронов содержит 6,02⋅1023 этих частиц.
Объём V измеряется в кубических дециметрах (дм³), кубических метрах (м³), кубических сантиметрах (см³). Применяются также единицы измерения литр (л) и миллилитр (мл).
Обрати внимание!
\(1\) дм³ \(=1\) л, \(1\) см³ \(=1\) мл, \(1\) м³ \(=1000\) дм³ \(=1000\) л, \( 1\) дм³ \(=1000\) см³ \(=1000\) мл.
Молярный объём Vm — это отношение объёма вещества к его химическому количеству. Численно равен объёму одного моля вещества. Единица измерения — дм³/моль.
Для всех газов при нормальных условиях молярный объём равен \(22,4\) дм³/моль.
Плотность обозначается буквой ρ. Измеряется в г/см³, г/мл (для твёрдых веществ и жидкостей), г/дм³ или г/л (для газов).
Часто в химических расчётах применяется плотность жидкой воды. При \(4\) °С она равна \(1\) г/см³ или \(1000\) г/дм³.
Моль. Количество вещества.
Тип задачи: Нахождение количества вещества по числу частиц вещества и определение числа частиц вещества по известному количеству вещества.
|
№ |
Какое количество вещества содержится
|
Задача 2Сколько частиц (атомов или молекул) содержит: |
||
|
а |
а |
в |
||
|
|
12 · 1023молекул |
44,5 · 1023атомов |
О,5 моль железа |
2 моль серы |
|
|
6· 1023молекул |
0,9·1023атомов |
2 моль алюминия |
4 моль кислорода |
|
|
12·1023молекул |
0,15·1023атомов |
3 моль натрия |
0,5 моль азота |
|
|
18·1023молекул |
0,21·1023атомов |
1,5 моль углерода |
3 моль натрия |
|
|
24·1023молекул |
0,27·1023атомов |
2 моль углерода |
5 моль азота |
|
|
30·1023моллекул |
0,33·1023атомов |
10 моль азота |
0,1 моль цинка |
|
|
39·1023молекул |
36·1023атомов |
5 моль хлора |
4 моль алюминия |
|
|
36·1023молекул |
0,45·1023атомов |
3 моль кислорода |
2 моль цинка |
|
|
42·1023молекул |
0,51·1023атомов |
4 моль азота |
1,. |
|
|
48·1023молекул |
0,57·1023атомов |
2 моль кальция |
6 моль брома |
|
|
0,.6·1023молекул |
9·1023атомов |
12 моль брома |
2 моль серебра |
|
|
0,12·1023молекул |
15·1023атомов |
10 моль хлора |
1,5 моль меди |
|
|
0,18·1023молекул |
21·1023атомов |
5 моль водорода |
3 моль железа |
|
|
0,24·1023молекул |
27·1023атомов |
3 моль водорода |
2 моль воды |
|
|
0,3·1023молекул |
33·1023атомов |
4 моль серебра |
3 моль хлора |
|
|
0,36·1023молекул |
39·1023атомов |
2 моль воды |
0,5 моль железа |
|
|
0,42·1023молекул |
45·1023атомов |
4 моль серебра |
2 моль кислорода |
|
|
0,48·1023молекул |
51·1023атомов |
0. |
3 моль серебра |
|
|
0,54·1023молекул |
0,6·1023атомов |
3 моль серы |
1,5 моль цинка |
|
|
9·1023молекул |
42·1023атомов |
5 моль натрия |
2 моль углерода |
|
|
15·1023молекул |
0,12·1023атомов |
0,1 моль хлора |
10 моль меди |
|
|
21·1023молекул |
0,18·1023атомов |
4 моль меди |
5 моль хлора |
|
|
27·1023молекул |
0,24·1023атомов |
2 моль кислорода |
3 моль цинка |
|
|
33·1023молекул |
0,3·1023атомов |
1,5 моль азота |
4 моль ртути |
|
|
39·1023молекул |
0,36·1023атомов |
6 моль магния |
2 моль водорода |
|
|
45·1023молекул |
0,42·1023атомов |
2 моль брома |
12 моль меди |
|
|
51·1023молекул |
0,48·1023атомов |
1. |
10 моль натрия |
|
|
0,6·1023молекул |
54··1023атомов |
3 моль водорода |
5 моль калия |
|
|
24·1023молекул |
9·1023атомов |
3 моль цинка |
2 моль воды |
|
|
3·1023молекул |
3· 1023атомов |
4 моль фтора |
6 моль кальция |
Урок 8.
 количество вещества. молярная масса. молярный объём газазакон авогадро – Химия – 8 класс
количество вещества. молярная масса. молярный объём газазакон авогадро – Химия – 8 класс Количество вещества. Молярная масса. Молярный объем газа. Закон Авогадро
Из курса физики мы знаем о таких физических величинах, как масса, объём и плотность. При помощи этих величин легко характеризовать вещества. Например, мы идём в магазин и покупаем 1 кг сахара или литровую бутылку минеральной воды. Но оказывается, что этих величин недостаточно, если необходимо рассмотреть вещество с точки зрения числа частиц. Сколько молекул сахара содержится в 1 кг сахара? А сколько молекул воды в литровой бутылке? А в одной капле? Ответ на этот вопрос можно получить, если знать ещё об одной физической величине, которая называется количество вещества. Точное число молекул посчитать сложно, но если считать не штуками, а порциями, то задача упрощается. Например, мы никогда не покупаем в магазине спички поштучно, но купив одну порцию спичек – коробок, знаем, что там 100 штук.
 И салфетки мы тоже поштучно не покупаем, но купив пачку салфеток, то есть порцию, мы точно будем знать, сколько штук салфеток мы купили.
И салфетки мы тоже поштучно не покупаем, но купив пачку салфеток, то есть порцию, мы точно будем знать, сколько штук салфеток мы купили.Количество вещества – это порция вещества с определённым числом структурных частиц. Количество вещества принято обозначать греческой буквой ν [ню]. В системе СИ единица измерения количества вещества называется моль. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода, а именно 6*1023 частиц. Это количество является постоянной величиной и называется «постоянная Авогадро». Количество вещества можно определить как отношение числа структурных частиц к числу частиц в одном моле вещества.
Например, количество вещества, которое соответствует 3*1023 атомов железа можно легко рассчитать по этой формуле.
Преобразовав исходную формулу легко определить число структурных частиц по известному количеству вещества: N = v * NA
Своё имя эта постоянная получила в честь Амедео Авогадро, который в 1811 году сделал предположение, которое затем подтвердилось экспериментально и теперь носит имя Закона Авогадро.
 Закон Авогадро: «в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул».
Закон Авогадро: «в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул».Из закона Авогадро следует, что при одинаковых условиях массы газов, содержащие одинаковое число структурных частиц, будут занимать одинаковый объём. При давлении 1 атмосфера и температуре 0 градусов Цельсия 1 моль любого газа занимает объём равный 22, 4 л. Этот объём называется молярный объём. А условия – нормальные условия. Молярный объём обозначается Vm, показывает объём газа количеством 1 моль. При нормальных условиях является постоянной величиной.
При нормальных условиях количество вещества это отношение объёма к молярному объему.
По этой формуле можно определить объём вещества, если известно его количество: V = ν * Vm
Массу вещества количеством 1 моль называют молярной массой, обозначают буквой M. Молярная масса численно равна относительной молекулярной массе. Единица измерения молярной массы г/моль.
Зная массу вещества, легко определить количество вещества.

Найдём количество вещества 5,6 г железа.
Чтобы найти массу вещества по известному количеству преобразуем формулу: m = ν * M
Справочный материал
• Количество вещества ν [ню] – это физическая величина, характеризующая количество однотипных структурных единиц (любые частицы, из которых состоит вещество – атомы, молекулы, ионы и т.д), содержащихся в веществе. Единица измерения количества вещества в Международной системе единиц (СИ) – моль.
• Моль – это единица измерения количества вещества. Один моль вещества содержит столько же структурных частиц, сколько атомов содержится в 12 г углерода.
• Молярная масса (M) – масса вещества количеством один моль. Единица измерения г/моль.
• Нормальные условия (н.у.) – физические условия, определяемые давлением 101325 Па (нормальная атмосфера) и температурой 273,15 К (0 °С).
• Молярный объём (Vm) – объём вещества количеством один моль. Единица измерения л/моль; при н.у. Vm = 22,4 л/моль
• Закон Авогадро – в равных объёмах различных газов при одинаковых условиях (температура и давление) содержится одинаковое количество молекул.
• Постоянная Авогадро (NA) показывает число структурных частиц в веществе количеством один моль.
Формула количества вещества в химии
Определение и формула количества вещества
Моль – количество вещества системы, которое содержит столько определенных структурных звеньев (молекул, атомов, ионов, электронов и т.д.), сколько содержится в 0,012 кг углерода-12.
Масса одного атома 12С равна 12 а.е.м., поэтому число атомов в 12 г изотопа 12С равно:
NA = 12 г / 12 × 1,66057×10-24 г = 1/1,66057×10-24 = 6,0221×10-23.
Таким образом, моль вещества содержит 6,0221×10-23 частиц этого вещества.
Физическую величину NA называют постоянной Авогадро, она имеет размерность [NA] = моль-1. Число 6,0221×10-23 называют числом Авогадро. Таким образом количество вещества будет вычисляться как:
n = N / NA,
где N – число структурных звеньев, а NA — постоянная Авогадро.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным. Поэтому другая формула для вычисления количество вещества выглядит следующим образом:
n = m / M,
где m – масса вещества (г), а М – его молярная масса (г/моль).
Количество вещества газа можно рассчитать при помощи закона Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Следовательно, при нормальных условиях 1 моль различных газов занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа:
Следовательно, при нормальных условиях 1 моль различных газов занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа:
n= V /Vm,
где V – объем газа (л), а Vm – молярный объем (л/моль).
Примеры решения задач
Масса и размеры молекул. Количество вещества
Данная тема будет посвящена решению задач на определение массы молекул и количества вещества.
Задача 1. Вычислите массу одной молекулы кислорода.
РЕШЕНИЕ
Как известно, в одном моле любого вещества содержится одно и то же число молекул — число Авогадро
Если обозначить молярную массу вещества через M, то массу одной молекулы можно определить, как отношение молярной массы вещества и числа Авогадро
Молярная масса молекулы кислорода
Тогда масса 1 молекулы кислорода равна
Ответ: масса одной молекулы кислорода
равна 5,3 ∙ 10−26 кг.
Задача 2. Молярная масса водорода 2 г/моль, а воды — 18 г/моль. Определите отношение числа молекул в 3 г водорода к числу молекул в 9 г воды.
|
ДАНО: |
РЕШЕНИЕ Число молекул в заданной порции любого вещества можно определить, как произведение отношения массы вещества к его молярной массе и числа Авогадро. Тогда число молекул водорода в данной порции: Число молекул воды в данной порции: Тогда |
Ответ: молекул водорода в 3 раза больше, чем молекул воды.
Задача 3. Из открытого стакана за 5 суток полностью испарилось 50 г воды. Сколько молекул в среднем вылетало с поверхности воды за 1 с?
|
ДАНО: |
СИ
|
РЕШЕНИЕ Пусть в стакане содержалось N
молекул воды. Число молекул воды в данной порции: Тогда искомое число молекул |
Ответ: в среднем с поверхности воды за 1 с вылетало 3,9 ∙ 1018 молекул.
Задача 4. Определите число молекул, содержащихся в 36 см3 ртути.
|
ДАНО: |
РЕШЕНИЕ Известно, что число молекул в одном моле любого вещества равно числу Авогадро Для определения числа молекул ртути в заданной порции, необходимо количество молей данного объема ртути умножить на число Авогадро |
Ответ: в 36 см3 ртути содержится 14,7
∙ 1023 молекул.
Задача 5. В озеро, имеющее среднюю глубину 10 м и площадь поверхности 20 км2, бросили кристаллик поваренной соли массой 0,01 г. Сколько молекул этой соли оказалось бы в наперстке воды объемом 2 см3, зачерпнутой из озера, если полагать, что соль, растворившись, равномерно распределилась по всему объему воды в озере?
|
ДАНО: |
СИ
|
РЕШЕНИЕ Запишем формулу, по которой можно рассчитать число молекул соли в данной порции раствора Масса соли в данной порции раствора: Тогда число молекул соли в данной порции раствора: Химическая формула соли NaCl Тогда молярная масса соли равна |
Ответ: в наперстке оказалось бы
порядка 1 млн.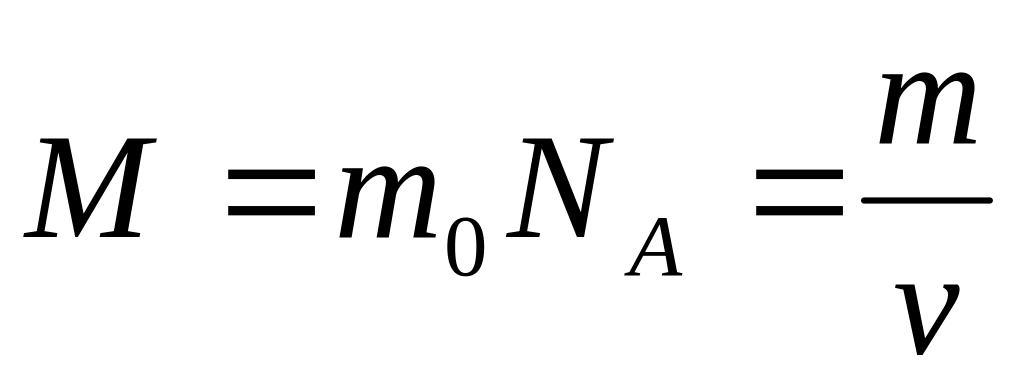 молекул соли.
молекул соли.
Расчет молей и числа частиц Учебное пособие по химии
Ключевые концепции
- 1 моль любого вещества содержит 6.022 × 10 23 частиц.
- 6,022 × 10 23 известно как число Авогадро или константа Авогадро и обозначается символом N A (1)
- N = n × N A
N = количество частиц в веществе
n = количество вещества в молях (моль)
N A = Число Авогардро = 6.022 × 10 23 частиц моль -1
N = n × (6.022 × 10 23 )
- Чтобы найти количество частиц N в веществе:
N = n × N A
N = n × (6.022 × 10 23 )
- Чтобы найти количество вещества в молях, n:
n = N ÷ N A
n = N ÷ (6.022 × 10 23 )
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Вывод и применение уравнения N = n × N
A1 моль чистого вещества содержит N A частиц, или 6,022 × 10 23 частиц.
| Представьте себе ящик, содержащий 1 моль газообразного гелия, He (г), представленный на диаграмме справа как X Эта коробка содержит:
|
|
| Представьте, что мы теперь добавляем еще один моль газообразного гелия, He (g), также представленный на диаграмме справа как X Эта коробка теперь содержит:
|
Количество атомов гелия (N) в коробке равно количеству молей атомов гелия (n), умноженному на число Авогадро (N A ):
N = n × N A
Мы можем использовать это математическое уравнение (математическую формулу или математическое выражение), чтобы найти количество частиц (N) в любом количестве вещества (n), просто умножив количество в молях (n) на число Авогадро (N A ), как показано в таблице ниже:
| n (количество вещества в молях) | × | N A (номер Авогадро) | = | N (количество частиц) |
|---|---|---|---|---|
| 1 моль | × | 6.022 × 10 23 | = | 6.022 × 10 23 частиц |
| 2 моль | × | 6. 022 × 10 23 022 × 10 23 | = | 1,204 × 10 24 частиц |
| 10 моль | × | 6.022 × 10 23 | = | 6.022 × 10 24 частиц |
| 0,5 моль | × | 6.022 × 10 23 | = | 3,011 × 10 23 частиц |
Математическое уравнение N = n × N A можно использовать для определения количества атомов, ионов или молекул в любом количестве (в молях) атомов, ионов или молекул:
- 10 молей из атомов гелия = 10 × (6.022 × 10 23 ) = 6.022 × 10 24 атомов гелия
- 10 моль ионов натрия = 10 × (6.022 × 10 23 ) = 6.022 × 10 24 ионов натрия
- 10 моль молекул воды = 10 × (6.022 × 10 23 ) = 6.022 × 10 24 молекул воды
Математическое уравнение N = n × N A также можно использовать для определения количества атомов каждого элемента в известном количестве (в молях) соединения.
Для соединения с молекулярной формулой X a Y b :
- 1 молекула соединения X a Y b содержит
a атомов элемента X
b атомов элемента Y
- 1 моль соединения X a Y b содержит
a молей атомов элемента X
b молей атомов элемента Y
- н-моль соединения X a Y b содержит
(n × a ) молей атомов элемента X
(n × b ) молей атомов элемента Y
- н-моль соединения X a Y b содержит
(n × a ) × N A атомов элемента X
(n × b ) × N A атомов элемента Y
- н-моль соединения X a Y b содержит
(n × a ) × 6.022 × 10 23 атомов элемента X
(n × b ) × 6.022 × 10 23 атомов элемента Y
Рассмотрим n моль каждого из этих соединений с общей формулой XY 2 .
В приведенной ниже таблице даны моли каждого элемента, присутствующего в соединении, а также показано, как рассчитать количество атомов каждого присутствующего элемента:
| XY 2 формула | n (XY 2 ) моль XY 2 | n (X) моль атомов элемента X | N (X) Число атомов X | n (Y) моль атомов элемента Y | N (Y) Число атомов Y |
|---|---|---|---|---|---|
| CO 2 | n | n × 1 = n моль атомов C | n × N A атомов C | n × 2 = 2n моль атомов O | 2n × N A атомов O |
| НЕТ 2 | n | n × 1 = n моль атомов азота | n × N A атомов N | n × 2 = 2n моль атомов O | 2n × N A атомов O |
| SCl 2 | n | n × 1 = n моль атомов S | n × N A атомов S | n × 2 = 2n моль атомов Cl | 2n × N A атомов Cl |
Если у нас есть 5 моль каждого соединения, например, выше, то мы можем вычислить моль каждого элемента и количество атомов каждого элемента, как показано в таблице ниже:
| XY 2 формула | n (XY 2 ) моль XY 2 | n (X) моль атомов элемента X | N (X) Число атомов X | n (Y) моль атомов элемента Y | N (Y) Число атомов Y |
|---|---|---|---|---|---|
| CO 2 | 5 | 5 × 1 = 5 моль C | 5 × N A C атомов | 5 × 2 = 10 моль O | 10 × N A Атомов O |
| НЕТ 2 | 5 | 5 × 1 = 5 моль N | 5 × N A N атомов | 5 × 2 = 10 моль O | 10 × N A Атомов O |
| SCl 2 | 5 | 5 × 1 = 5 моль S | 5 × N A Атомы S | 5 × 2 = 10 моль Cl | 10 × N A Атомы Cl |
Получение и применение уравнения n = N ÷ N
A (n = N / N A )В предыдущем разделе мы вывели математическое уравнение:
N = n × N A
где:
N = количество частиц, присутствующих в веществе
n = количество частиц в веществе в молях (моль)
N A = число Авогадро = 6. 022 × 10 23 частиц моль -1
022 × 10 23 частиц моль -1
Если мы разделим обе части этого уравнения на N A , как показано ниже:
Мы приходим к уравнению, показанному ниже:
, который мы можем использовать для нахождения молей вещества, если мы знаем, сколько частиц вещества присутствует.
Уравнение n = N / N A можно использовать для расчета:
- моль атомов (n), если вы знаете количество присутствующих атомов (N)
- моль ионов (n), если вы знаете количество присутствующих ионов (N)
- моль молекул (n), если вы знаете количество присутствующих молекул (N)
В таблице ниже показано вычисление молей (n) с учетом количества частиц (N):
| N (количество частиц) | ÷ | N A (номер Авогадро) | = | n (моль частиц) |
|---|---|---|---|---|
| (3.011 × 10 23 ) | ÷ | (6,022 × 10 23 ) | = | 0,5 моль |
| (1,204 × 10 24 ) | ÷ | (6,022 × 10 23 ) | = | 2 моль |
| (6,022 × 10 24 ) | ÷ | (6.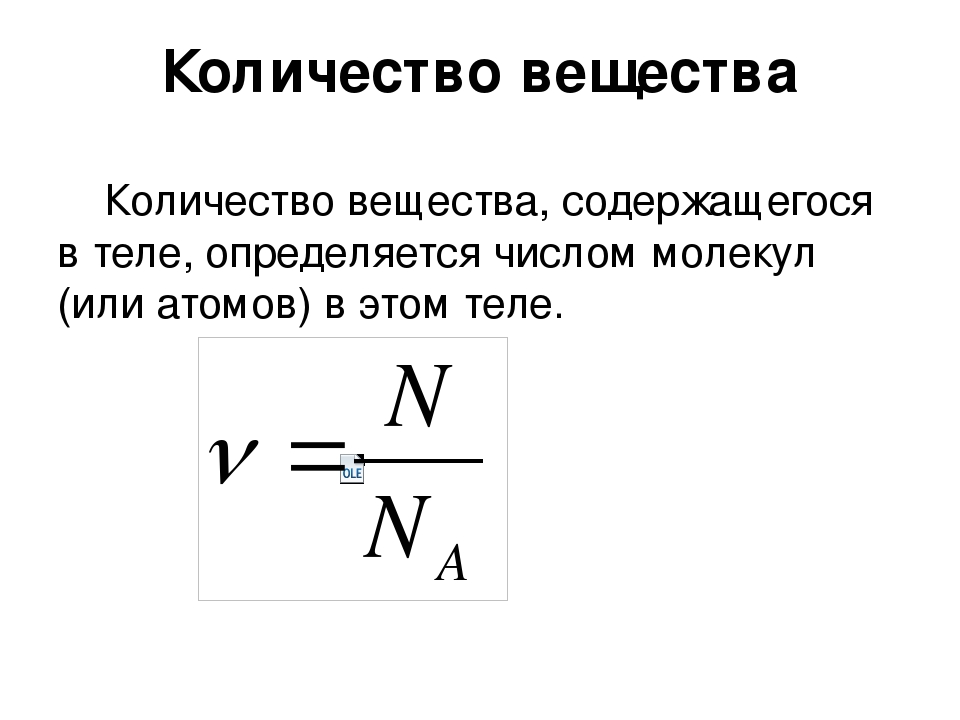 022 × 10 23 ) 022 × 10 23 ) | = | 10 моль |
Если известно, что вещество содержит 3,011 × 10 23 частиц вещества, то количество молей вещества будет (3,011 × 10 23 ) ÷ (6,022 × 10 23 ) = 0,5 моль.
3,011 × 10 23 атома гелия = 0,5 моль из атомов гелия
3,011 × 10 23 ионы натрия = 0.5 моль ионов натрия
3,011 × 10 23 молекулы воды = 0,5 моль из молекул воды
Уравнение n = N ÷ N A также можно использовать для определения количества в молях атомов или ионов в соединении, если вы знаете как молекулярную формулу соединения, так и количество присутствующих молекул соединения.
Для молекул N соединения общей формулы X a Y b :
Рассмотрим следующие примеры, в которых 1.927 × 10 24 молекул соединения общей формулы X 2 Y присутствуют
| X 2 Y формула | Н (X 2 Y) (количество X 2 молекул Y) | N (X) (число атомов элемента X) | n (X) (моль атомов X) | N (Y) (число атомов элемента Y) | n (Y) (моль атомов Y) |
|---|---|---|---|---|---|
| H 2 S | 1. 927 × 10 24 927 × 10 24 | 2 × (1.927 × 10 24 ) атомов H = 3.854 × 10 24 атомов H | (3,854 × 10 24 ) ÷ (6,022 × 10 23 ) = 6,4 моль атомов H | 1 × (1.927 × 10 24 ) атомов S = 1.927 × 10 24 атомов S | (1,927 × 10 24 ) ÷ (6,022 × 10 23 ) = 3,2 моль атомов S |
| H 2 O | 1.927 × 10 24 | 2 × (1.927 × 10 24 ) атомов H = 3.854 × 10 24 атомов H | (3,854 × 10 24 ) ÷ (6,022 × 10 23 ) = 6,4 моль атомов H | 1 × (1.927 × 10 24 ) атомов O = 1.927 × 10 24 атомов O | (1,927 × 10 24 ) ÷ (6,022 × 10 23 ) = 3,2 моль атомов O |
Рабочие примеры расчета числа Крота-Авогадро
Расчет количества частиц (N = n × N
A ) Вопрос 1: Вычислите количество молекул аммиака, NH 3 , в 3. 5 моль аммиака.
5 моль аммиака.
Решение:
- Что вас просят сделать?
Рассчитайте количество молекул аммиака.
N (аммиак) = количество молекул аммиака =?
- Какая информация (данные) дана в вопросе? Молекулярная формула
для аммиака: NH 3
n = количество молекул аммиака в молях = 3.5 моль
- Какая связь между молями частиц и количеством частиц?
N = n × N A где N = количество частиц n = моль частиц N A = Число Авогадро = 6,022 × 10 23 - Напишите уравнение связи между молями молекул аммиака и числом молекул аммиака:
N (NH 3 ) = n (NH 3 ) × N A
= n (NH 3 ) × (6.022 х 10 23 )
- Заменить в значениях и решить для N:
Н (NH 3 ) = 3,5 × (6,022 × 10 23 )
= 2,1 × 10 24 молекул аммиака (NH 3 )
Вопрос 2. Определите количество атомов водорода в 1,5 молях воды, H 2 O, молекул.
Определите количество атомов водорода в 1,5 молях воды, H 2 O, молекул.
Решение:
- Что вас просят сделать?
Рассчитайте количество атомов водорода.
N (атомов H) = количество атомов водорода =?
- Какая информация (данные) дана в вопросе?
Молекулярная формула воды: H 2 O
n (H 2 молекул O) = моль молекул воды = 1,5 моль
- Какая связь между молями частиц и числом частиц?
N = n × N A где N = количество частиц n = моль частиц N A = Число Авогадро = 6.022 × 10 23 - Какая связь между молями молекул воды и числом атомов водорода?
(i) соотношение между молями молекул воды и числом молекул воды:
N (H 2 молекул O) = n (H 2 молекул O) × N A где N (H 2 молекул O) ) = количество молекул воды n (H 2 молекул O) = моль молекул воды = 1.  5 моль
5 мольN A = число Авогадро = 6,022 × 10 23 N (H 2 молекул O) = 1,5 × (6,022 × 10 23 ) = 9,033 × 10 23 (ii) соотношение между числом атомов водорода и числом молекул воды:
Из молекулярной формулы мы видим, что 1 молекула воды состоит из 2 атомов водорода и 1 атома кислорода.
N (атомы H) = 2 × N (H 2 молекул O)
- Подставьте значения и решите уравнение:
N (атомы H) = 2 × N (H 2 молекул O)
= 2 × (9,033 × 10 23 )
= 1,8 × 10 24 атомов водорода
Расчет количества молей вещества (n = N / N
A )Вопрос 1. Проба газа содержит 4,4 × 10 24 молекул углекислого газа.
Сколько молей молекул углекислого газа присутствует в образце?
Решение:
- Что вас просят сделать?
Вычислить моль молекул углекислого газа.

n (молекулы углекислого газа) = моль молекул углекислого газа =?
- Какая информация (данные) дана в вопросе?
N (молекулы углекислого газа) = количество молекул углекислого газа = 4.4 × 10 24 молекул углекислого газа - Какова связь между молями (n) частиц и числом (N) частиц?
n = N
N Aгде N A = число Авогадро = 6,022 × 10 23 - Какова взаимосвязь между молями (n) молекул диоксида углерода и количеством (N) молекул диоксида углерода?
n (молекулы углекислого газа) = N (молекулы углекислого газа)
N A= N (молекулы углекислого газа)
6. 022 × 10 23
022 × 10 23 - Подставьте значения в уравнение и решите:
n (молекулы углекислого газа) = N (молекулы углекислого газа)
6.022 × 10 23= 4.4 × 10 24
6.022 × 10 23= 7,3 молекулы углекислого газа
Вопрос 2. Образец содержит 2,4 × 10 22 молекул газообразного кислорода (O 2 ).
Сколько молей атомов кислорода присутствует в образце?
Решение:
- Что вас просят сделать?
Вычислить моль атомов кислорода.
n (атомы O) = моль атомов кислорода =?
- Какая информация (данные) дана в вопросе?
Молекулярная формула газообразного кислорода: O 2
N (O 2 молекул) = количество молекул кислорода (O 2 ) = 2,4 × 10 22
- Какова связь между молями (n) частиц и числом (N) частиц?
n = N
N A, где N A = число Авогадро = 6.  022 × 10 23
022 × 10 23 - Какова взаимосвязь между молями атомов кислорода n (атомы O) и числом молекул кислорода N (O 2 молекул)?
(i) соотношение между молями атомов кислорода n (атомы O) и числом атомов кислорода N (атомы O)
n (атомы O) = N (атомы O)
N Aгде N A = Число Авогадро = 6.022 × 10 23 (ii) соотношение между числом молекул кислорода N (O 2 молекул) и числом атомов кислорода N (атомов O):
Одна молекула O 2 состоит из 2 атомов кислорода
количество атомов кислорода = 2 × количество молекул кислорода
N (атомов O) = 2 × N (O 2 молекул)
(iii) соотношение между молями атомов кислорода n (атомы O) и числом молекул кислорода N (O 2 молекул):
n (атомы O) = N (атомы O)
N A= 2 × N (O 2 молекул)
N A= 2 × N (O 2 молекул)
6. 022 × 10 23
022 × 10 23 - Подставьте значения и решите уравнение:
n (атомы O) = 2 × N (O 2 молекул)
6.022 × 10 23= 2 × (2.4 × 10 22 )
6.022 × 10 23= 0,080 моль атомов кислорода
Решение проблем с использованием родинок, количества частиц и числа Авогадро
Задача: Биолог изучал действие хлорид-ионов, Cl – , на клетки растений.Бо попросил химика Криса приготовить 1 литр раствора, содержащего 0,50 моль хлорид-ионов, Cl –, растворенных в воде. Раствор также должен содержать равное количество ионов натрия Na + и ионов калия K + . Крис делает раствор, растворяя немного хлорида натрия, NaCl, и хлорида калия, KCl, в 1 литре деионизированной воды.
Крис делает раствор, растворяя немного хлорида натрия, NaCl, и хлорида калия, KCl, в 1 литре деионизированной воды. Сколько ионов натрия присутствует в растворе?
Решение проблемы с использованием модели StoPGoPS для решения проблем:
| СТОП! | Сформулируйте вопрос. | Что вас просят сделать? Определите количество ионов натрия в растворе. N (ионы натрия) = количество ионов натрия =? | ||||||
| ПАУЗА! | План. | Какой химический принцип вам нужно будет применить? Применить стехометрию (N = n × N A ) Какую информацию (данные) вам предоставили? Шаг 1: Рассчитайте количество ионов Cl – в растворе. Предположим, что вода, используемая для приготовления раствора, НЕ содержит ионов хлора, Cl – . Шаг 2: Напишите уравнение для связи между количеством ионов хлорида, ионов натрия и ионов калия. Предположим, что вода, используемая для приготовления раствора, НЕ содержит ионов натрия, Na + , или ионов калия, K + Шаг 3: Решите уравнение, чтобы определить количество ионов натрия. | ||||||
| Вперед! | Следуйте плану. | Шаг 1: Рассчитайте количество ионов Cl – в растворе.Предположим, что вода, используемая для приготовления раствора, НЕ содержит ионов хлора, Cl – . Шаг 2: Напишите уравнение для связи между количеством ионов хлорида, ионов натрия и ионов калия. Предположим, что вода, используемая для приготовления раствора, НЕ содержит ионов натрия, Na + , или ионов калия, K + Шаг 3: Решите уравнение, чтобы определить количество ионов натрия. N (Cl – в растворе) = 2 × N (Na + )
| ||||||
| ПАУЗА! | Поразмышляйте над правдоподобием. | Вы ответили на заданный вопрос? Да, мы определили количество ионов натрия в растворе. Разумно ли ваше решение вопроса? Давайте поработаем в обратном направлении, чтобы увидеть, даст ли рассчитанное нами количество ионов натрия правильное количество молей хлорид-ионов в растворе. | ||||||
| СТОП! | Назовите решение. | Какое количество ионов натрия в растворе? 1,5 × 10 23 ионов натрия в растворе |
Сноски:
(1) Число Авогадро иногда называют числом Лошмидта и обозначают символом L.
вопросов и ответов – Сколько атомов в голове человека?
Сколько атомов в голове человека?
Мы можем вычислить количество атомов в вашей голове, если мы знаем плотность и константу, называемую числом Авогадро. На самом деле это всего лишь оценка, но она будет хорошей. Уравнение довольно простое. Число атомов ЛЮБОГО вещества в объеме:
# атомов = N * (плотность) * объем / (молекулярный вес).
N – постоянная, называемая числом Авогадро, равная 6.022 * 10 23 атомов / моль. Это также может быть количество молекул на моль. В приведенной выше формуле плотность, умноженная на объем, – это просто масса. Если вы знаете, насколько что-то тяжело, каковы его объем и плотность, вы легко можете это сделать.
Начнем с простой задачи. В литре воды 1000 кубических сантиметров. С водой легко, потому что на каждый кубический сантиметр приходится 1 грамм массы. Вода состоит из 2 атомов водорода и одного атома кислорода. Водород имеет атомный вес 1, а кислород – 16.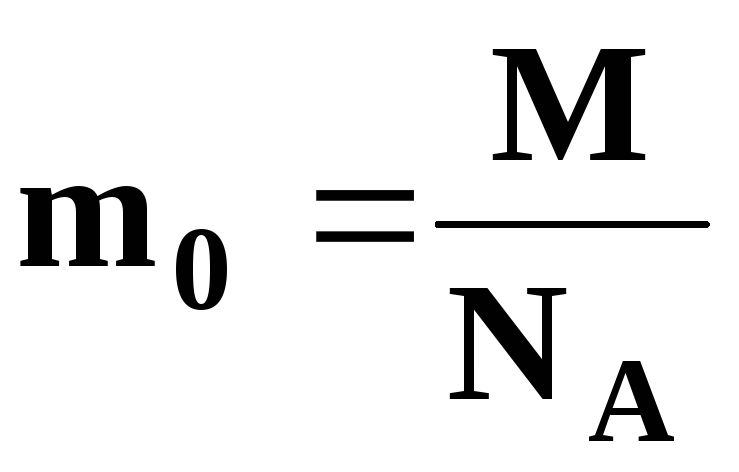 Молекулярная масса воды составляет 18. В литре воды 1000 грамм. Количество молей 1000/18 = 55,556 молей. Таким образом, количество молекул составляет 6,022 * 10 23 * 55,556 = 3,346 * 10 25 молекул. Число атомов в 3 раза больше, потому что каждая молекула состоит из трех атомов, поэтому в литре воды 1,0038 * 10 26 атомов.
Молекулярная масса воды составляет 18. В литре воды 1000 грамм. Количество молей 1000/18 = 55,556 молей. Таким образом, количество молекул составляет 6,022 * 10 23 * 55,556 = 3,346 * 10 25 молекул. Число атомов в 3 раза больше, потому что каждая молекула состоит из трех атомов, поэтому в литре воды 1,0038 * 10 26 атомов.
Теперь мы знаем достаточно, чтобы ответить на ваш вопрос. Типичная человеческая голова весит около 10 – 12 фунтов. В основном мы состоим из воды.Когда вы идете плавать, вы, вероятно, заметили, что почти все плавают, вырывая из воды лишь часть головы. Это наблюдение приведет вас к выводу, что наша плотность очень близка к плотности воды. Вооружившись всем этим, мы можем оценить количество атомов в вашей голове. Фунт составляет 454 грамма, а 10-фунтовая человеческая голова – 4540 граммов. Если я предполагаю, что в среднем мы в основном вода, потому что наша средняя плотность примерно равна плотности воды, то я могу использовать приведенную выше информацию о воде, чтобы получить ответ.
Молей на голову = (4540 граммов) / (18 граммов / моль) = 252,22 моль
Молекул на моль = 6,022 * 10 23 * 252,22 моль = 1,519 * 10 26 молекул
Атомов на голову = 3 * молекулы = 4,56 * 10 26
Это 456 триллионов триллионов атомов!
В заключение остановлюсь на исторической заметке. Авогадро был итальянским физиком, который впервые описал постоянную Авогадро в качестве гипотезы в 1811 году. Он пытался понять, почему в химических реакциях с участием газов наблюдается наблюдение, что одинаковые объемы разных газов имеют одинаковое количество молей.Это подтвердилось даже тогда, когда массы были очень разными. Идея о том, что моль любого вещества имеет одинаковое количество атомов (или молекул), независимо от того, из чего оно состоит, была объяснена Авогадро, и с тех пор его имя закрепилось за его числом.
Автор:
Пол Бриндза, руководитель экспериментального зала A Design (Другие ответы Пол Бриндза)
Количество веществ – Chemistry LibreTexts
Количество веществ в различных единицах
Количество веществ измеряется в единицах массы (г или кг), объема (л) и молях (моль). Взаимное преобразование единиц основано на определениях единиц, а преобразование количеств из г или кг в моль основано на атомных массах элементов.
Взаимное преобразование единиц основано на определениях единиц, а преобразование количеств из г или кг в моль основано на атомных массах элементов.
Атомные массы – это массы одного моля элементов. моль любого элемента имеет число атомов Авогадро (= 6,02×10 23 атомов на моль).
Естественными единицами вещества являются молекулы , которые представляют собой группы атомов, связанных вместе, за исключением одноатомных молекул инертных газов, \ (\ ce {He} \), \ (\ ce {Ne} \), \ (\ ce {Ar} \), \ (\ ce {Kr} \), \ (\ ce {Xe} \) и \ (\ ce {Rn} \).Например, молекулы кислорода, воды и фосфора – это \ (\ ce {O2} \), \ (\ ce {h3O} \) и \ (\ ce {P4} \) соответственно. Эти молекулы имеют 2, 3 и 4 атома соответственно. Масса одного моля вещества называется , молекулярная масса . Атомная и молекулярная масса называется молярной массой .
Выше показано лишь очень небольшое количество примеров. В мире миллионы соединений. Подумайте о некоторых других соединениях, о которых вы знаете, и запишите их формулы.Затем вычислите количество атомов в каждом моле вашего соединения.
В мире миллионы соединений. Подумайте о некоторых других соединениях, о которых вы знаете, и запишите их формулы.Затем вычислите количество атомов в каждом моле вашего соединения.
Различные вещества имеют разную молекулярную массу. Таким образом, равные массы имеют разное количество атомов, молекул или молей. С другой стороны, одинаковое количество молей разных веществ имеет разную массу. Стехиометрические отношения между реагентами и продуктами могут быть сложными в единицах g, но гораздо более простые отношения видны, если мы имеем дело с единицами молей или естественными единицами атомов и молекул.2 +} \) имеет 6.022×10 23 ионов, а моль \ (\ ce {Fe2O3} \) имеет 1.204×10 24 \ (\ ce {Fe} \) и 1.8066×10 24 \ (\ ce {O} \) атомов, всего 3,0×10 24 \ (\ ce {Fe} \) и \ (\ ce {O} \) атомов.
Мольная единица очень важна для химических реакций, так же как и умение переводить массы из г в моль. Количество молей вещества в образце – это масса в граммах, деленная на молярную массу , которая дает количество в молях.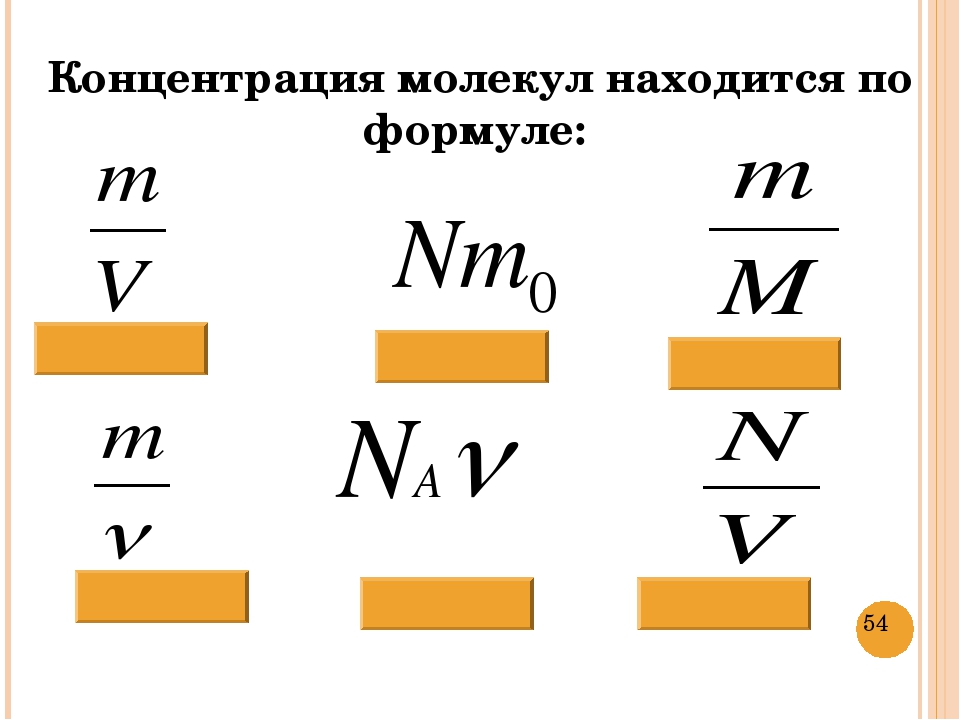
\ (\ mathrm {моль = \ dfrac {масса \ 🙁 г)} {молярная \: масса \: (г / моль)}} \)
Еще одна распространенная мера веществ – это объем.3)} \)
Эти основные формулы являются результатом определения этих терминов.
Вопросы по развитию навыков
Каковы молярные массы элементов водорода (\ (\ ce {H} \)), кислорода (\ (\ ce {O} \)), железа (\ (\ ce {Fe} \)) и золота? (\ (\ ce {Au} \))?
Знайте, где найти: 1.0, 16.0, 55.9, 197
Навык: знать, где найти молярные массы элементов.
- Элемент золото – драгоценный металл.Сколько молей золота содержится в массе 1,0 кг?
1000/197 =?
Навык: для преобразования массы в граммах в моль.
- Литр воды имеет массу 1,0 кг. Сколько молей воды в 1,0 кг?
1000 г / 18 г = 55,6 моль
Навык: Расчет молярных масс молекулярных соединений
- При стандартной температуре и давлении моль газа занимает 22,4 л.
 Если 20% воздуха состоит из кислорода, сколько молей кислорода содержится в 1,0 л?
Если 20% воздуха состоит из кислорода, сколько молей кислорода содержится в 1,0 л?
0,20 моль / 22,4 л = 8,93e-3 моль / л
Навык: экспресс-сумма в объеме.
- Сколько граммов содержится в 8,93e-3 моль кислорода \ (\ ce {O2} \) (молярная масса 32,0)?
32 г / моль * 8,93e-3 моль = 0,286 г
Навык: преобразовать количество в молях в массу в граммах или кг.
Сколько молей \ (\ ce {Fe2O3} \) содержится в 1000 кг оксида? Атомный вес: \ (\ ce {Fe} \) , 55.8, \ (\ ce {O} \) , 16.0.
1000000 г / (159,6 г / моль) = 6265 моль
Навык: преобразование количества из молей в килограммы соединений, представленных химическими формулами.
2.9: Определение массы, молей и количества частиц
Количество молей в системе можно определить с помощью атомной массы элемента, которую можно найти в периодической таблице. Эта масса обычно составляет , в среднем, из обильных форм этого элемента, найденных на Земле.Масса элемента указана как средняя масса всех его изотопов на Земле.
Эта масса обычно составляет , в среднем, из обильных форм этого элемента, найденных на Земле.Масса элемента указана как средняя масса всех его изотопов на Земле.
Приложения Mole
Масса моля вещества называется молярной массой этого вещества. Молярная масса используется для преобразования граммов вещества в моль и часто используется в химии. Молярная масса элемента находится в периодической таблице, и это атомный вес элемента в граммах / моль (г / моль). Если масса вещества известна, можно рассчитать количество молей в веществе.Для преобразования массы вещества в граммы в моль требуется коэффициент преобразования (один моль вещества / молярная масса вещества).
Концепция молей применима и к химическому составу. Например, рассмотрим метан, CH 4 . Эта молекула и ее молекулярная формула показывают, что на моль метана приходится 1 моль углерода и 4 моля водорода. В этом случае моль используется как обычная единица, которую можно применить к соотношению, как показано ниже:
\ [2 \ text {mol H} + 1 \ text {mol O} = 1 \ text {mol} \ ce {h3O} \ nonumber \]
В этой химической реакции моли H и O описывают количество атомов каждого элемента, которые реагируют с образованием 1 моля \ (\ ce {H_2O} \). {23} \]
{23} \]
аналогично высказыванию:
\ [\ text {1 дюжина} = \ text {12 яиц} \]
Довольно сложно представить себе родинку чего-либо, потому что постоянная Авогадро чрезвычайно велика. Например, рассмотрим размер одного зерна пшеницы. Если бы все люди, которые существовали в истории Земли, не делали ничего, кроме подсчета отдельных зерен пшеницы за всю свою жизнь, общее количество подсчитанных зерен пшеницы все равно было бы намного меньше постоянной Авогадро; количество зерен пшеницы, произведенных на протяжении всей истории, даже не приближается к числу Авогадро.
Пример \ (\ PageIndex {1} \): преобразование массы в моли
Сколько молей атомов калия (\ (\ ce {K} \)) содержится в 3,04 граммах чистого металлического калия?
Решение
В этом примере умножьте массу \ (\ ce {K} \) на коэффициент преобразования (обратная молярная масса калия):
\ [\ dfrac {1 \; моль \; K} {39.10 \; граммы \; K} \ nonumber \]
39,10 грамма – это молярная масса одного моля \ (\ ce {K} \); сократить граммы, оставив моли \ (\ ce {K} \):
\ [3. 04 \; \ cancel {g \; K} \ left (\ dfrac {1 \; mol \; K} {39.10 \; \ cancel {g \; K}} \ right) = 0,0778 \; моль \; К \ nonumber \]
04 \; \ cancel {g \; K} \ left (\ dfrac {1 \; mol \; K} {39.10 \; \ cancel {g \; K}} \ right) = 0,0778 \; моль \; К \ nonumber \]
Точно так же, если известны моли вещества, можно определить количество граммов в веществе. Для преобразования молей вещества в граммы требуется коэффициент преобразования молярная масса вещества на один моль вещества . Просто нужно следовать тому же методу, но в противоположном направлении.
Пример \ (\ PageIndex {2} \): преобразование молей в массу
Сколько грамм 10.78 моль кальция (\ (\ ce {Ca} \))?
Решение
Умножьте моль Са на коэффициент преобразования (молярная масса кальция). 40,08 г Са / 1 моль Са , , что затем позволяет сократить количество молей, оставив граммы Са.
\ [10.78 \ cancel {\; mol \; Ca} \ left (\ dfrac {40.08 \; g \; Ca} {1 \; \ cancel {mol \; Ca}} \ right) = 432.1 \; г\; Ca \ nonumber \]
Общее количество атомов в веществе также можно определить, используя соотношение между граммами, молями и атомами. Если дана масса вещества и просят найти количество атомов в веществе, нужно сначала преобразовать массу вещества в граммах в моль, как в Примере \ (\ PageIndex {1} \). Затем количество молей вещества необходимо перевести в атомы. Для преобразования молей вещества в атомы требуется коэффициент преобразования константы Авогадро (6,02214179 × 10 23 ) на один моль вещества . Проверка правильности отмены модулей – хороший способ убедиться, что используется правильный метод.{22} \; атомы \; из\; Na \ nonumber \]
Если дана масса вещества и просят найти количество атомов в веществе, нужно сначала преобразовать массу вещества в граммах в моль, как в Примере \ (\ PageIndex {1} \). Затем количество молей вещества необходимо перевести в атомы. Для преобразования молей вещества в атомы требуется коэффициент преобразования константы Авогадро (6,02214179 × 10 23 ) на один моль вещества . Проверка правильности отмены модулей – хороший способ убедиться, что используется правильный метод.{22} \; атомы \; из\; Na \ nonumber \]
В этом примере умножьте граммы Na на коэффициент преобразования 1 моль Na / 22,98 г Na, где 22,98 г – это молярная масса одного моля Na, что затем позволяет сократить количество граммов, оставив моль Na. Затем умножьте количество молей Na на коэффициент преобразования 6,02214179 × 10 23 атомов Na / 1 моль Na, где 6,02214179 × 10 23 атомов – это количество атомов в одном моль Na (постоянная Авогадро), что затем позволяет аннулировать моли, оставив количество атомов Na.
Используя константу Авогадро, также легко вычислить количество атомов или молекул, присутствующих в веществе (Таблица \ (\ PageIndex {1} \)). Умножая количество молей на константу Авогадро, единицы молей сокращаются, оставляя количество атомов. В следующей таблице приведены ссылки на способы управления этими различными величинами:
| Известная информация | Умножить на | Результат |
|---|---|---|
| Масса вещества (г) | 1 / Молярная масса (моль / г) | Моль вещества |
| Моль вещества (моль) | Константа Авогадро (атомы / моль) | Атомы (или молекулы) |
| Масса вещества (г) | 1 / Молярная масса (моль / г) × постоянная Авогадро (атомы / моль)) | Атомы (или молекулы) |
Пример \ (\ PageIndex {4} \): Масса до молей
Сколько родинок в 3. 00 граммов калия (К)?
00 граммов калия (К)?
Решение
\ [3.00 \; \ cancel {g \; K} \ left (\ dfrac {1 \; mol \; K} {39.10 \; \ cancel {g \; K}} \ right) = 0,0767 \; моль \; К \ nonumber \]
В этом примере умножьте массу K на коэффициент преобразования:
\ [\ dfrac {1 \; моль \; K} {39.10 \; граммы \; K} \ nonumber \]
39,10 грамма – молярная масса одного моля K. Граммы могут быть отменены, оставив моль K.
Пример \ (\ PageIndex {5} \): Отношение молей к массе
Сколько грамм в 10.00 моль кальция (Ca)?
Решение
Это вычисление в примере \ (\ PageIndex {2} \), выполняемое в обратном порядке. Умножьте моль Са на коэффициент преобразования 40,08 г Са / 1 моль Са , , где 40,08 г – молярная масса одного моля Са. Родинки отменяются, в результате остается грамм Ca:
.\ [10.00 \; \ cancel {mol \; Ca} \ left (\ dfrac {40.08 \; g \; Ca} {1 \; \ cancel {mol \; Ca}} \ right) = 400,8 \; граммы \; из \; Ca \ nonumber \]
Число атомов можно также рассчитать, используя Константу Авогадро (6. {23} \; atom \; Na} {1 \; \ cancel {mol \; Na}} \ right) = 7.{22} \; атомы \; из\; \; Na \ nonumber \]
{23} \; atom \; Na} {1 \; \ cancel {mol \; Na}} \ right) = 7.{22} \; атомы \; из\; \; Na \ nonumber \]
| Константа Авогадро
Это число, 6,022 x 10 23 (постоянная Авогадро), фактически определяется на основе количества атомов, присутствующих в 12 г изотопа углерода 12 C. Где 12 г – молярная масса 12 C или, другими словами, масса 1 моля или 6,022 x 10 23 атомов изотопа углерода 12C.
Итак, чтобы рассчитать количество молей любого вещества, присутствующего в образце, мы просто делим данный вес вещества на его молярную массу.
Математически:
\ [n = \ frac {m} {M} \]
Где n – число молей, m – заданная масса, а M – молярная масса.
Вот небольшая карта, которая поможет вам связать количество молей, объем и массу вещества.
Пример: сколько молей содержится в 25,0 граммах воды?
Решение:
Чтобы найти количество молей, нам нужно будет использовать следующую формулу:
\ [n = \ frac {m} {M} \]
Молярная масса, M, H 2 O = 18. 0 г / моль
0 г / моль
Заданная масса, м H 2 O = 25,0 г
Итак, n = 25,0 (г) / 18,0 (г / моль)
Число молей, n = 1,39 моль
Вопрос: Сколько молей содержится в 3,4 x 10 23 молекулах H 2 SO 4 ?
Варианты:
(а) 0,82 моль
(б) 0,01 моль
(в) 5,56 моль
(г) 0,56 моль
Ответ: (г)
Раствор:
1 моль чего угодно = 6.022x 10 23 чего угодно
Чтобы найти здесь количество молей, нам придется разделить данное количество частиц на постоянную Авогадро.
Итак, n = 3,4 x 10 23 / 6,022 x 10 23
Тогда количество родинок, n = 0,56 моль
Использование числа Авогадро – Химия средней школы
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно
или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному ниже агенту. Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам Varsity найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса – изображению, ссылке, тексту и т. д. – относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. – относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему утверждению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
моль | Определение, число и факты
Популярные вопросы
Как определяется родинка?
Моль определяется как 6. 02214076 × 10 23 некоторой химической единицы, будь то атомы, молекулы, ионы или другие.Моль – это удобная единица измерения из-за большого количества атомов, молекул и т. Д. В любом веществе. Изначально моль был определен как количество атомов в 12 граммах углерода-12, но в 2018 году Генеральная конференция по мерам и весам объявила, что с 20 мая 2019 года моль будет составлять всего 6,02214076 × 10 23 некоторого химического вещества. Блок.
02214076 × 10 23 некоторой химической единицы, будь то атомы, молекулы, ионы или другие.Моль – это удобная единица измерения из-за большого количества атомов, молекул и т. Д. В любом веществе. Изначально моль был определен как количество атомов в 12 граммах углерода-12, но в 2018 году Генеральная конференция по мерам и весам объявила, что с 20 мая 2019 года моль будет составлять всего 6,02214076 × 10 23 некоторого химического вещества. Блок.
Как рассчитывается моль?
Если вы хотите узнать, сколько молей материала у вас есть, разделите массу материала на его молярную массу.Молярная масса вещества – это масса в граммах одного моля этого вещества. Эта масса определяется атомным весом химической единицы, из которой состоит это вещество, в атомных единицах массы (а.е.м.). Например, серебро имеет атомный вес 107,8682 а.е.м., поэтому один моль серебра имеет массу 107,8682 грамма.
Какой номер у Авогадро?
Число Авогадро – это количество единиц в одном моль вещества, или 6,02214076 × 10 23 . Это число также называют постоянной Авогадро.Он назван в честь итальянского физика XIX века Амедео Авогадро, который обнаружил, что при одинаковых температуре и давлении два газа с одинаковым объемом имеют одинаковое количество молекул. Французский физик Жан Перрен в начале 20 века назвал количество единиц в моле числом Авогадро.
Это число также называют постоянной Авогадро.Он назван в честь итальянского физика XIX века Амедео Авогадро, который обнаружил, что при одинаковых температуре и давлении два газа с одинаковым объемом имеют одинаковое количество молекул. Французский физик Жан Перрен в начале 20 века назвал количество единиц в моле числом Авогадро.
Какова формула молярной массы?
Молярная масса некоторого вещества – это масса в граммах одного моля этого вещества. Эта масса определяется атомным весом химической единицы, из которой состоит это вещество, в атомных единицах массы (а.е.м.).Например, золото имеет атомный вес 196,967 а.е.м., поэтому масса одного моля золота составляет 196,967 грамма. Для вещества, которое состоит из более чем одного типа атомов, складывается атомный вес отдельных атомов для химической единицы, составляющей это вещество. Вода состоит из двух атомов водорода и одного атома кислорода. Атомный вес одного атома водорода составляет 1,008 а.е. м., а двух атомов – 2,016. Атомный вес одного атома кислорода равен 15,999, поэтому молярная масса воды равна 2.016 + 15,999 = 18,015 грамм.
м., а двух атомов – 2,016. Атомный вес одного атома кислорода равен 15,999, поэтому молярная масса воды равна 2.016 + 15,999 = 18,015 грамм.
Узнайте о концепции закона об идеальном газе.
Обзор того, как число Авогадро используется для измерения количества единиц любого вещества.
Encyclopædia Britannica, Inc. См. Все видео для этой статьимоль , также пишется моль , в химии, стандартная научная единица измерения больших количеств очень малых объектов, таких как атомы, молекулы или другие заданные частицы .
Крот обозначает чрезвычайно большое количество единиц, 6.02214076 × 10 23 . Генеральная конференция по мерам и весам определила моль как это число для Международной системы единиц (СИ), действующей с 20 мая 2019 года. Ранее моль определялся как количество атомов, определяемое экспериментально и обнаруживаемое в 12 граммах углерода. 12. Число единиц в молье также носит название числа Авогадро или постоянной Авогадро в честь итальянского физика Амедео Авогадро (1776–1856). Авогадро предположил, что равные объемы газов в одинаковых условиях содержат одинаковое количество молекул, гипотеза, которая оказалась полезной при определении атомного и молекулярного веса и привела к концепции моль.( См. закон Авогадро.)
Авогадро предположил, что равные объемы газов в одинаковых условиях содержат одинаковое количество молекул, гипотеза, которая оказалась полезной при определении атомного и молекулярного веса и привела к концепции моль.( См. закон Авогадро.)
Число атомов или других частиц в одном моле одинаково для всех веществ. Моль соотносится с массой элемента следующим образом: один моль атомов углерода-12 имеет 6,02214076 × 10 23 атомов и массу 12 граммов. Для сравнения, один моль кислорода по определению состоит из того же количества атомов, что и углерод-12, но его масса составляет 15,999 грамма. Следовательно, кислород имеет большую массу, чем углерод. Это рассуждение также может быть применено к молекулярной массе или массе формулы.
Понятие «моль» помогает поместить количественную информацию о том, что происходит в химическом уравнении, на макроскопический уровень. Например, в химической реакции 2H 2 O → O 2 + 2H 2 два моля воды разлагаются на два моля молекулярного водорода и один моль молекулярного кислорода.

 2)
2) 5 моль меди
5 моль меди ,5 моль азота
,5 моль азота 5 моль хлора
5 моль хлора Тогда, что бы определить, сколь молекул в среднем вылетало за 1 c, необходимо общее число молекул воды разделить на
время, в течение которого вода полностью испарилась
Тогда, что бы определить, сколь молекул в среднем вылетало за 1 c, необходимо общее число молекул воды разделить на
время, в течение которого вода полностью испарилась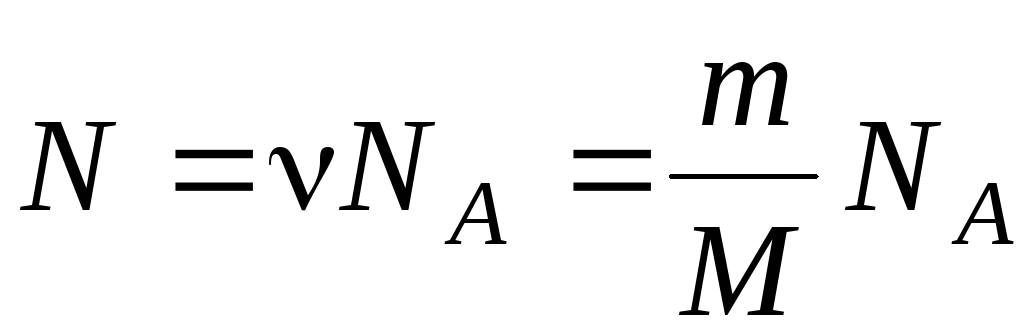 022 × 10 23 ) + (6.022 × 10 23 ) = 2 × (6.022 × 10 23 ) Атомы гелия
022 × 10 23 ) + (6.022 × 10 23 ) = 2 × (6.022 × 10 23 ) Атомы гелия 5 моль
5 моль
 022 × 10 23
022 × 10 23  022 × 10 23
022 × 10 23  022 × 10 23
022 × 10 23 


 5 × 10 23
5 × 10 23  Если 20% воздуха состоит из кислорода, сколько молей кислорода содержится в 1,0 л?
Если 20% воздуха состоит из кислорода, сколько молей кислорода содержится в 1,0 л?