Молекулярная физика и термодинамика
В этом разделе мы переходим к молекулярно-кинетическому описанию идеального газа.
При выводе основного уравнения молекулярно-кинетической теории газов будем считать молекулы маленькими твердыми шариками, в среднем абсолютно упруго и зеркально отражающимися от стенок сосуда. Силы взаимодействия возникают только при соударении молекул друг с другом или со стенками сосуда. Припишем каждой молекуле номер i (i = 1, 2, …, N), где N — полное число молекул в системе.
Прежде чем приступить непосредственно к расчету, поясним, почему в среднем столкновения молекул со стенкой мы не только можем, но — в условиях термодинамического равновесия — обязаны считать абсолютно упругими и зеркальными. «Абсолютно упругими», то есть в среднем скорость молекулы после столкновения со стенкой равна её скорости до столкновения со стенкой. «Зеркальными» означает, что угол отражения молекулы от стенки равен углу падения молекулы на стенку (углы падения и отражения определяются как в оптике: это углы между направлением нормали к стенке и вектором скорости молекулы).
Рис. 1.13. Абсолютно упругое столкновение молекулы со стенкой»
Подчеркнем, что обмен энергией между газом и сосудом не противоречит закону сохранения энергии: сколько получил газ, столько отдала стенка и наоборот. Как будет видно в дальнейшем, такой обмен энергией противоречит второму началу термодинамики. Аналогично доказывается равенство углов падения и отражения. Если они не равны, то между сосудом и газом будет происходить обмен моментом импульса. Проще можно сказать так: произойдет самораскручивание газа в одну сторону, а сосуда — с равным по модулю моментом импульса — в другую, что также вовсе не запрещено законом сохранения момента импульса, но противоречит второму началу термодинамики. Поскольку второе начало термодинамики в данный момент ещё не сформулировано, отметим, что в эксперименте таких процессов никто никогда не видел, а поскольку экспериментальных причин сомневаться в справедливости второго начала термодинамики нет, то и не увидит.
Аналогично доказывается равенство углов падения и отражения. Если они не равны, то между сосудом и газом будет происходить обмен моментом импульса. Проще можно сказать так: произойдет самораскручивание газа в одну сторону, а сосуда — с равным по модулю моментом импульса — в другую, что также вовсе не запрещено законом сохранения момента импульса, но противоречит второму началу термодинамики. Поскольку второе начало термодинамики в данный момент ещё не сформулировано, отметим, что в эксперименте таких процессов никто никогда не видел, а поскольку экспериментальных причин сомневаться в справедливости второго начала термодинамики нет, то и не увидит.
Выше мы всё время подчеркивали: в среднем. Это связано с тем, что «судьба» конкретной индивидуальной молекулы при её столкновении со стенкой сосуда может быть какой угодно. Чтобы это понять надо «спуститься» с макроскопического на микроскопический уровень рассмотрения процесса столкновения молекулы газа со «стенкой». Произнося слово «стенка», мы имеем ввиду границу раздела между газом (разреженное состояние вещества, концентрация частиц ~10
Видео 1.5. Поведение броуновской частицы доказывает, что соударения молекул со стенкой абсолютно упруги и зеркальны лишь в среднем
Претендуя лишь на сугубо качественное описание далеко не всех процессов имеющих место при взаимодействии молекулы газа с твердой или жидкой поверхностью, рассмотрим лишь два возможных случая.
Пусть, к примеру, сосуд железный, тогда около положений равновесия (узлов кристаллической решетки) колеблются ионы железа. Пусть в сосуде воздух, будем следить за некоторой молекулой азота, подлетающей к «стенке». Она столкнется не со стенкой «вообще», а с конкретным ионом железа в составе стенки, на определенной стадии его колебаний. Скорость молекулы относительно стенки это её скорость относительно узлов кристаллической решетки — положений равновесия ионов железа. Если в момент столкновения тот конкретный ион, с которым сталкивается наша молекула, двигался ей навстречу, то, относительная скорость молекулы и иона будет больше, чем молекулы и стенки.
Наконец, подлетающая к стенке молекула может попасть в «междуузелье» — пространство между соседними узлами кристаллической решетки, внедриться в кристаллическую решетку и застрять в неё так прочно, что только достаточно сильный нагрев стенки будет способен «выгнать» её оттуда. Например, на установках типа «Токамак» предназначенных для исследований высокотемпературной плазмы, предусматривают нагрев стенок для их «обезгаживания» — освобождения от налипших на стенки молекул воздуха.
Теперь рассмотрим молекулу с номером i, которая подлетает к стенке сосуда, перпендикулярной оси ОХ, со скоростью и импульсом . При абсолютно упругом и зеркальном отражении молекулы от стенки знак проекции её ее импульса на ось ОХ меняется на противоположный , так что приращение проекции импульса молекулы на ось ОХ равно
а приращение импульса стенки, другими словами, импульс переданный стенке, равен
Рис. 1.14. Отражение молекулы от стенки
Предполагая, что между собой молекулы не сталкиваются, можно утверждать, что молекула после отражения долетит до противоположной стенки, снова отразится и в следующий раз подлетит к той же стенке (рис. 1.14) через время
где — расстояние между стенками, перпендикулярными оси x. Поскольку импульс передается стенке каждые секунд, на стенку со стороны одной молекулы действует средняя сила
|
|
|
 7) 7)
|
(Заметим на будущее, что средние значения величин мы будем обозначать угловыми скобками).
Если в сосуде заключено N молекул, то полная средняя сила F получится суммированием выражения (1.8) по всем молекулам:
При этом, так как все направления равноправны и молекулы в среднем совершенно одинаково отражаются от всех стенок сосуда, то, во-первых, сумма произведений импульсов на скорости представима в виде
где справа написано одинаковое для всех молекул среднее. И, во-вторых:
С другой стороны, среднее значение произведения импульса молекулы на ее скорость определяется как
Поэтому
и выражение для полной средней силы, действующей на стенку со стороны газа, приобретает вид
|
|
|
(1. |
Разделив полную среднюю силу на площадь стенки
|
|
|
(1.9) |
Используем теперь тот факт, что скорость движения молекул даже при температурах в тысячи кельвинов, когда большинство веществ уже переходит в плазменное состояние, составляет всего несколько километров в секунду, то есть о релятивистских эффектах в атомарных и молекулярных газах говорить не приходится, поэтому импульс молекулы , где
|
|
|
(1. |
или
|
|
|
(1.11) |
Здесь — концентрация молекул, <ЕПОСТ> — средняя кинетическая энергия поступательного движения, приходящаяся на одну молекулу. Произведение N<ЕПОСТ> есть полная кинетическая энергия поступательного движения всех молекул газа в данном объеме V.
Быть может, на первый взгляд трудно узнать в соотношениях (1.10–1.11) сходство со знакомым нам уравнением Клапейрона — Менделеева
поэтому слегка преобразуем последнее. Введем новую величину — постоянную Больцмана
Важность этой физической постоянной определяется тем, что с ее помощью устанавливается связь между энергией и температурой, как это видно уже из ее размерности. Далее используем, что
Далее используем, что
— число молей вещества в системе, а NA — число молекул в одном моле, так что nNA равно полному числу частиц в системе. Приходим тогда к следующей форме уравнения Клапейрона — Менделеева:
|
|
|
(1.12) |
Сравнивая (1.10) с (1.12), мы видим, что, в сущности, имеем дело с аналогичным уравнением, если определить абсолютную температуру соотношением
|
|
|
(1. |
Такое определение температуры годится только для систем, состоящих из частиц только с тремя поступательными степенями свободы, во-первых, и если поступательное движение этих частиц точно описывается законами классической, в данном случае «классической» означает — не квантовой механики. Например, оно не применимо для описания колебательного движения ядер в молекулах кислорода и азота (основные компоненты воздуха) при комнатных температурах, не применимо для описания поступательного движения электронов в металлах при любых температурах потому, что и то и другое движения носят квантовый характер и законами классической механики не описываются.
Общее, годное на все случаи жизни, определение температуры будет дано позже на базе первого и второго начал термодинамики, а сейчас отметим следующее.
Температура есть мера интенсивности теплового движения. Температура растет с ростом средней энергии теплового движения. Как будет видно в дальнейшем, этот рост вовсе не обязательно должен быть пропорциональным ростом, как в соотношении (1.13).
Как будет видно в дальнейшем, этот рост вовсе не обязательно должен быть пропорциональным ростом, как в соотношении (1.13).
Видео 1.6. Классическая модель газа с растущей температурой.
Пример. В подземной полости радиусом 100 м проводится подземное испытание ядерного оружия мощностью 50 килотонн. Оценим давление газа в полости и минимальную глубину испытательной шахты, чтобы продукты взрыва не вырвались наружу.
Для решения задачи в приведенной формулировке нам пока не хватает данных. Сначала надо найти полную энергию газа, образовавшегося при взрыве. Намек на ее величину содержится в указании так называемого тротилового эквивалента. По традиции энергию взрыва сравнивают с энергией взрыва тротила. Энергия W взрыва 50-килотонной бомбы эквивалентна энергии взрыва 5⋅104 т = 5⋅107 кг тротила. В справочнике находим, что энергия взрыва 1 кг тротила равна 4,2 МДж. Таким образом, при взрыве этой бомбы выделяется энергия
Таким образом, при взрыве этой бомбы выделяется энергия
Поскольку взрыв происходит в полости, будем считать, что вся эта энергия превратилась в кинетическую энергию продуктов взрыва. Так как нам известен объем полости
то величину давления находим из основного уравнения молекулярно-кинетической теории газов (1.12)
Получим теперь ответ на второй вопрос задачи. Газы не вырвутся наружу, если внешнее давление породы над полостью превышает давление продуктов взрыва. Внешнее давление можно оценить по известной формуле гидростатики
где ρ — плотность породы. Подчеркнем, что эта формула справедлива для газов и жидкостей. Применительно к твердому телу ее можно использовать как оценочную. В справочнике находим, например, плотность гранита ρ = 2600 кг/м3, которую можно взять за основу оценки. Из равенства
находим минимальную глубину шахты h:
В заключение этого раздела сделаем замечание. Мы специально не предполагали с самого начала классической зависимости импульса частицы от ее скорости. Поэтому уравнение (1.9) имеет более широкую область применимости, нежели (1.10). Например, электромагнитное излучение можно представить как совокупность особых частиц (фотонов), движущихся со скоростью света. Поэтому для фотонов
Мы специально не предполагали с самого начала классической зависимости импульса частицы от ее скорости. Поэтому уравнение (1.9) имеет более широкую область применимости, нежели (1.10). Например, электромагнитное излучение можно представить как совокупность особых частиц (фотонов), движущихся со скоростью света. Поэтому для фотонов
где с — скорость света. С другой стороны, энергия фотонов Еgсвязана с их импульсом соотношением
так что уравнение (1.9) приобретает в этом случае вид
|
|
|
(1.14) |
Мы видим, что уравнение состояния идеального газа фотонов отличается числовым множителем в правой части от соответствующего уравнения для газа обычных частиц.
Дополнительная информация
http://marklv.narod.ru/mkt/zpt.htm — Попробуйте решить школьные задачи повышенной трудности (олимпиадные) по молекулярно-кинетической теории и уравнению состояния идеального газа.
Законы идеального газа и уравнение состояния. Примеры решения задач по физике. 10-11 класс
- Подробности
- Просмотров: 592
Задачи по физике – это просто!
Вспомним
1). Если масса газа не меняется:
2). Формулы газовых законов:
3). Если в условиях задачи задан переход из состояния p1V1T1 в состояние p2V2T2, используем формулу:
При этом, если один из параметров const, его можно сократить, и тогда мы получаем одну из формул газовых законов.
3). Если в условиях задачи известны только 2 параметра из трех (p,V,T), используем формулу:
Не забываем
Решать задачи надо всегда в системе СИ!
А теперь к задачам!
Типовые задачи из курса школьной физики по термодинамике на вычисление макропараметров (p,V,T) газа.
Задача 1
Найти массу природного горючего газа объемом 64 м3, считая, что объем указан при нормальных условиях. Молярную массу природного газа считать равной молярной массе метана (СН4).
Задача 2
Воздух объемом 1,45 м3, находящийся при температуре 20oC и давлении 100 кПа, превратили в жидкое состояние. Какой объем займет жидкий воздух, если его плотность 861 кг/м3?
Задача 3
Какое количество вещества содержится в газе, если при давлении 200 кПа и температуре 240 К его объем равен 40 литров?
Задача 4
В одинаковых баллонах при одинаковой температуре находятся водород (H2) и углекислый газ (CO2). Массы газов одинаковы. Какой из газов и во сколько раз производит большее давление на стенки баллона?
Задача 5
Газ при давлении 0,2 МПа и температуре 15оС имеет объем 5 литров. Чему равен объем газа этой массы при нормальных условиях?
Чему равен объем газа этой массы при нормальных условиях?
Задача 6
При температуре 27оС давление газа в закрытом сосуде было 75 кПа. Каким будет давление при температуре -13оС?
Задача 7
В баллоне находится газ под давлением.
Определить, какой объем занимал бы этот газ при нормальных условиях (t=0oC, давление 101 325 Па), если известны объем баллона – V1, температура газа в баллоне – t1, давление газа в баллоне – p1.
Задача 8
Определить давление сжатого воздуха в баллоне, если известны вместимость баллона, температура и масса газа.
Задача 9
В баллоне находится смесь газов (гелий и аргон). Определить давление смеси газов на стенки сосуда, если известны вместимость баллона, температура смеси и масса каждого газа.
Задача 10
Определить молярную массу газа, если известна его плотность и температура при нормальном атмосферном давлении.
Задача 11
Баллон заполнен газом, известны вместимость баллона – V1, температура газа – t1 и давление газа – p1. Какой объем занимал бы этот газ при нормальных условиях (температура t2=0oC, давление р2= 101 325 Па)?
Задача 12
Определить температуру газа по шкале Цельсия, если объем 4 молей газа при давлении 100 кПа составляет 20 литров.
Задача 13
Определить массу воздуха объемом 40 литров при нормальном атмосферном давлении (101325 Па) и температуре 20oC.
Следующая страница «Изопроцессы 10-11 класс»
Назад в раздел «Решение типовых задач по физике»
13.3 Закон идеального газа – Физика колледжа 2e
Цели обучения
К концу этого раздела вы сможете:
- Сформулируйте закон идеального газа в терминах молекул и молей.
- Используйте закон идеального газа для расчета изменения давления, изменения температуры, изменения объема или количества молекул или молей в заданном объеме.

- Используйте число Авогадро для преобразования числа молекул в число молей.
Рисунок 13.16 Воздух внутри этого воздушного шара, летящего над Путраджайей, Малайзия, горячее окружающего воздуха. В результате воздушный шар испытывает выталкивающую силу, толкающую его вверх. (кредит: Кевин Пох, Flickr)
В этом разделе мы продолжаем исследовать тепловое поведение газов. В частности, мы исследуем характеристики атомов и молекул, из которых состоят газы. (Большинство газов, например, азот, N2N2, и кислород, O2O2, состоят из двух или более атомов. Мы будем в основном использовать термин «молекула» при обсуждении газа, потому что этот термин также может применяться к одноатомным газам, таким как гелий. .)
Газы легко сжимаются. Доказательства этого можно увидеть в таблице 13.2, где вы заметите, что газы имеют наибольших коэффициентов объемного расширения. Большие коэффициенты означают, что газы очень быстро расширяются и сжимаются при изменении температуры. Кроме того, вы заметите, что большинство газов расширяются с той же скоростью, что и , или имеют одинаковую ββ. Это поднимает вопрос, почему все газы должны действовать почти одинаково, когда жидкости и твердые тела имеют сильно различающиеся скорости расширения.
Кроме того, вы заметите, что большинство газов расширяются с той же скоростью, что и , или имеют одинаковую ββ. Это поднимает вопрос, почему все газы должны действовать почти одинаково, когда жидкости и твердые тела имеют сильно различающиеся скорости расширения.
Ответ заключается в большом расстоянии друг от друга атомов и молекул в газах по сравнению с их размерами, как показано на рис. 13.17. Поскольку атомы и молекулы имеют большие расстояния, силами между ними можно пренебречь, за исключением случаев, когда они сталкиваются друг с другом во время столкновений. Движение атомов и молекул (при температурах значительно выше температуры кипения) происходит быстро, так что газ занимает весь доступный объем и расширение газов происходит быстро. Напротив, в жидкостях и твердых телах атомы и молекулы расположены ближе друг к другу и весьма чувствительны к силам между ними.
Рисунок
13.17
Как показано, атомы и молекулы в газе обычно далеко друг от друга. Так как силы между ними на этих расстояниях довольно слабы, свойства газа больше зависят от числа атомов в единице объема и от температуры, чем от типа атома.
Так как силы между ними на этих расстояниях довольно слабы, свойства газа больше зависят от числа атомов в единице объема и от температуры, чем от типа атома.
Чтобы получить некоторое представление о том, как связаны друг с другом давление, температура и объем газа, представьте, что происходит, когда вы накачиваете воздух в изначально спущенную шину. Объем шины сначала увеличивается прямо пропорционально количеству впрыскиваемого воздуха без значительного увеличения давления в шине. Как только шина расширяется почти до своего полного размера, стенки ограничивают объемное расширение. Если мы продолжаем накачивать в него воздух, давление возрастает. Давление будет увеличиваться, когда автомобиль движется и шины двигаются. Большинство производителей указывают оптимальное давление в шинах для холодных шин. (См. рис. 13.18.)
Рисунок
13.18
(а) Когда воздух нагнетается в спущенную шину, ее объем сначала увеличивается без значительного увеличения давления. (b) Когда шина заполнена до определенной точки, стенки шины сопротивляются дальнейшему расширению, и давление увеличивается с увеличением количества воздуха. (c) Когда шина накачана, ее давление увеличивается с температурой.
(c) Когда шина накачана, ее давление увеличивается с температурой.
При комнатной температуре столкновениями между атомами и молекулами можно пренебречь. В этом случае газ называется идеальным газом, и в этом случае связь между давлением, объемом и температурой определяется уравнением состояния, называемым законом идеального газа.
Закон идеального газа
Закон идеального газа утверждает, что
PV=NkT,PV=NkT,
13,18
где PP — абсолютное давление газа, VV — занимаемый им объем, NN — число атомов и молекул в газа, TT – его абсолютная температура. Константа kk называется постоянной Больцмана в честь австрийского физика Людвига Больцмана (1844–1906) и имеет значение
k=1,38×10−23 Дж/К.k=1,38×10−23 Дж/К.
13.19
Закон идеального газа можно вывести из основных принципов, но первоначально он был выведен из экспериментальных измерений закона Шарля (объем, занимаемый газом, пропорционален температуре при фиксированном давлении) и из закона Бойля (что для фиксированная температура, произведение PVPV является константой). В модели идеального газа объем, занимаемый его атомами и молекулами, составляет пренебрежимо малую долю VV. Закон идеального газа описывает поведение реальных газов в большинстве условий. (Обратите внимание, например, что NN — это общее число атомов и молекул, не зависящее от типа газа.)
В модели идеального газа объем, занимаемый его атомами и молекулами, составляет пренебрежимо малую долю VV. Закон идеального газа описывает поведение реальных газов в большинстве условий. (Обратите внимание, например, что NN — это общее число атомов и молекул, не зависящее от типа газа.)
Давайте посмотрим, как закон идеального газа согласуется с поведением наполнения шины при медленном накачивании и постоянной температуре. Сначала давление PP практически равно атмосферному давлению, а объем VV увеличивается прямо пропорционально количеству атомов и молекул NN, помещенных в шину. Поскольку объем шины постоянен, уравнение PV=NkTPV=NkT предсказывает, что давление должно увеличиваться пропорционально количеству N атомов и молекул .
Пример 13,6
Расчет изменений давления в связи с изменениями температуры: давление в шинах
Предположим, что шина вашего велосипеда полностью накачана и имеет абсолютное давление 7,00×105 Па7,00×105 Па (манометрическое давление чуть менее 90,0 фунтов/дюйм290,0 фунтов/дюйм2).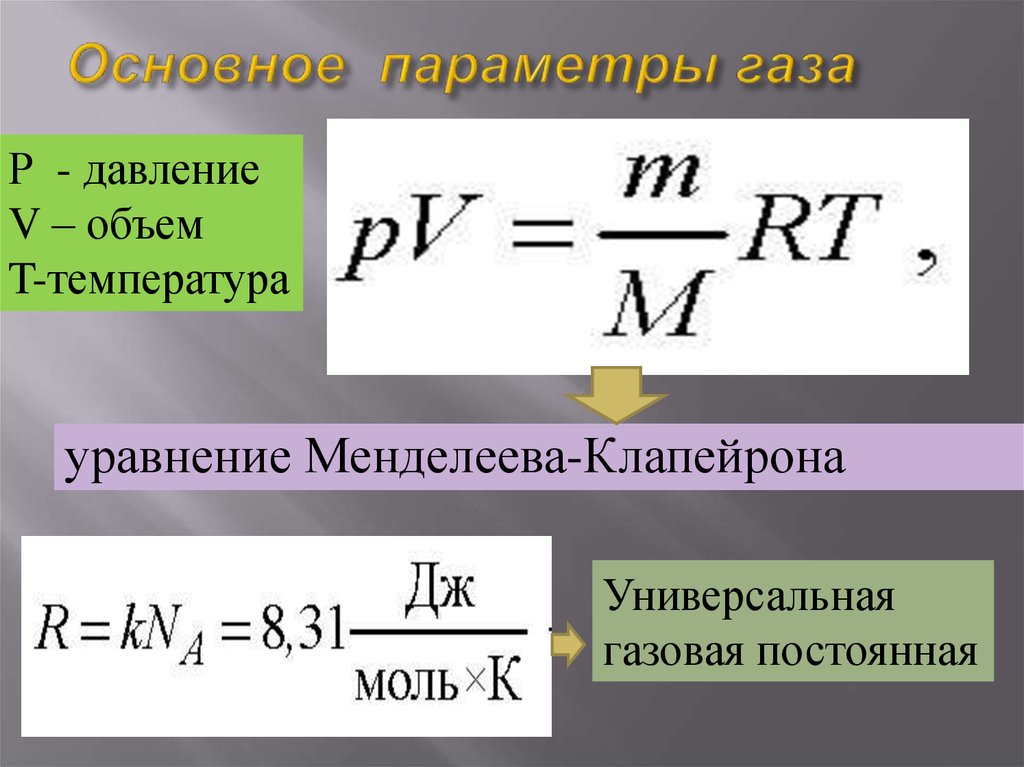 in2) при температуре 18,0ºC18,0ºC. Каково давление после того, как его температура поднялась до 35,0ºC35,0ºC? Предположим, что нет заметных утечек или изменений объема.
in2) при температуре 18,0ºC18,0ºC. Каково давление после того, как его температура поднялась до 35,0ºC35,0ºC? Предположим, что нет заметных утечек или изменений объема.
Стратегия
Давление в шине меняется только из-за изменения температуры. Сначала нам нужно определить, что мы знаем и что мы хотим узнать, а затем определить уравнение, которое нужно решить для неизвестного.
Известно начальное давление P0=7,00×105 Па P0=7,00×105 Па, начальная температура T0=18,0ºCT0=18,0ºC, а конечная температура Tf=35,0ºCTf=35,0ºC. Мы должны найти конечное давление ПфПф. Как мы можем использовать уравнение PV=NkTPV=NkT? Поначалу может показаться, что дано недостаточно информации, ведь объем VV и число атомов NN не указаны. Что мы можем сделать, так это использовать уравнение дважды: P0V0=NkT0P0V0=NkT0 и PfVf=NkTfPfVf=NkTf. Если мы разделим PfVfPfVf от P0V0P0V0 мы можем составить уравнение, которое позволит нам решить для ПфПф.
PfVfP0V0=NfkTfN0kT0PfVfP0V0=NfkTfN0kT0
13. 20
20
Поскольку громкость постоянна, VfVf и V0V0 одинаковы и взаимно компенсируются. То же самое верно для NfNf и N0N0, и kk, который является константой. Следовательно,
PfP0=TfT0.PfP0=TfT0.
13,21
Затем мы можем преобразовать это, чтобы найти PfPf:
Pf=P0TfT0,Pf=P0TfT0,
13,22
, где температура должна быть выражена в кельвинах, поскольку T0T0 и Tf являются абсолютными температурами.
Решение
1. Переведите температуру из градусов Цельсия в градусы Кельвина.
T0=18,0+273 K=291 KTf=35,0+273 K=308 KT0=18,0+273 K=291 KTf=35,0+273 K=308 K
13,23
2. Подставляем известные значения в уравнение.
Pf=P0TfT0=7,00×105 Па308 K291 K=7,41×105PaPf=P0TfT0=7,00×105 Па308 K291 K=7,41×105Па поэтому конечное давление также примерно на 6% больше. Обратите внимание, что абсолютное давление и абсолютная температура должны использоваться в законе идеального газа.
Установление связей: домашний эксперимент — охлаждение воздушного шара
Надуть воздушный шар при комнатной температуре. Оставьте надутый шарик в холодильнике на ночь. Что происходит с воздушным шаром и почему?
Пример 13,7
Расчет количества молекул в кубическом метре газа
Сколько молекул содержится в типичном объекте, например, газе в шине или воде в напитке? Мы можем использовать закон об идеальном газе, чтобы дать нам представление о том, насколько обычно велика NN.
Рассчитайте количество молекул в кубическом метре газа при стандартной температуре и давлении (STP), которые определяются как 0ºC0ºC и атмосферное давление.
Стратегия
Поскольку давление, объем и температура заданы, мы можем использовать закон идеального газа PV=NkTPV=NkT, чтобы найти NN.
Решение
1. Определите известные.
T=0ºC=273 KP=1,01×105 ПаВ=1,00 м3k=1,38×10-23 Дж/КТ=0°C=273 KP=1,01×105 ПаВ=1,00 м3k=1,38×10-23 Дж/К
13,25
2. Определите неизвестное: количество молекул, NN.
Определите неизвестное: количество молекул, NN.
3. Измените закон идеального газа, чтобы решить для NN.
PV=NkTN=PVkTPV=NkTN=PVkT
13,26
4. Подставьте известные значения в уравнение и найдите NN.
N=PVkT=1,01×105 Па1,00 м31,38×10−23 Дж/K273 K=2,68×1025 молекул N=PVkT=1,01×105 Па1,00 м31,38×10−23 Дж/K273 K=2,68× 1025молекул
13,27
Обсуждение
Это число бесспорно велико, учитывая, что газ в основном представляет собой пустое пространство. NN огромен, даже в небольших объемах. Например, 1 см31 см3 газа при СТП имеет 2,68×10192,68×1019 молекул в нем. Еще раз отметим, что NN одинаков для всех типов или смесей газов.
Моль и число Авогадро
Иногда при измерении количества вещества удобно работать с единицей, отличной от молекулы. Моль (сокращенно моль) определяется как количество вещества, которое содержит столько атомов или молекул, сколько атомов содержится ровно в 12 граммах (0,012 кг) углерода-12. Фактическое количество атомов или молекул в одном моле называется числом Авогадро (NA) (NA) по признанию итальянского ученого Амедео Авогадро (1776–1856). Он разработал концепцию моля, основанную на гипотезе о том, что равные объемы газа при одинаковых давлении и температуре содержат одинаковое количество молекул. То есть число не зависит от типа газа. Эта гипотеза подтвердилась, и значение числа Авогадро равно 9.0005
Фактическое количество атомов или молекул в одном моле называется числом Авогадро (NA) (NA) по признанию итальянского ученого Амедео Авогадро (1776–1856). Он разработал концепцию моля, основанную на гипотезе о том, что равные объемы газа при одинаковых давлении и температуре содержат одинаковое количество молекул. То есть число не зависит от типа газа. Эта гипотеза подтвердилась, и значение числа Авогадро равно 9.0005
NA = 6,02 × 1023 моль-1. NA = 6,02 × 1023 моль-1.
13,28
Число Авогадро
Один моль всегда содержит 6,02×10236,02×1023 частиц (атомов или молекул), независимо от элемента или вещества. Моль любого вещества имеет массу в граммах, равную его молекулярной массе, которую можно рассчитать по атомным массам, приведенным в периодической таблице элементов.
NA=6,02×1023моль-1NA=6,02×1023моль-1
13,29
Рисунок
13.19
Насколько велика родинка? На макроскопическом уровне один моль шариков для настольного тенниса покрыл бы Землю на глубину около 40 км.
Проверьте свое понимание
Активным ингредиентом таблетки Тайленол является 325 мг ацетаминофена (C8H9NO2)(C8H9NO2). Найдите количество активных молекул ацетаминофена в одной таблетке.
Решение
Сначала нам нужно рассчитать молярную массу (массу одного моля) ацетаминофена. Для этого нам нужно умножить количество атомов каждого элемента на атомную массу элемента.
(8 моль углерода)(12 грамм/моль)+(9 моль водорода)(1 грамм/моль)+(1 моль азота)(14 грамм/моль)+(2 моль кислорода)(16 грамм/моль) = 151 г (8 моль углерода) (12 г / моль) + (9моль водорода)(1 грамм/моль)+(1 моль азота)(14 грамм/моль)+(2 моль кислорода)(16 грамм/моль)= 151 г
13,30
Затем нам нужно рассчитать количество молей в 325 мг.
325 мг151 грамм/моль1 грамм1000 мг=2,15×10-3 моля 325 мг151 грамм/моль1 грамм1000 мг=2,15×10-3 моля
13,31
Затем используйте число Авогадро для расчета количества молекул.
N=2,15×10-3моль6,02×1023молекул/моль=1,30×1021молекулN=2,15×10-3моль6,02×1023молекул/моль=1,30×1021молекул
13.32
Пример 13,8
Расчет молей на кубический метр и литров на моль
Рассчитайте: (a) количество молей в 1,00 м31,00 м3 газа при нормальных условиях и (b) количество литров газа на моль.
Стратегия и решение
(a) Нас попросили найти количество молей на кубический метр, и из примера 13.7 мы знаем, что количество молекул на кубический метр при STP равно 2,68×10252,68×1025. Количество молей можно найти, разделив количество молекул на число Авогадро. Пусть nn обозначает количество молей,
нмоль/м3=Nмолекул/м36,02×1023молекул/моль=2,68×1025молекул/м36,02×1023молекул/моль=44,5моль/м3.нмоль/м3=Nмолекул/м36,02×1023молекул/моль=2,68×1025молекул /м36,02×1023 молекул/моль=44,5моль/м3.
13,33
(б) Используя полученное значение количества молей в кубическом метре и переведя кубические метры в литры, мы получим
103 л/м344,5моль/м3=22,5л/моль. 103л/м344. 5моль/м3=22,5л/моль.
103л/м344. 5моль/м3=22,5л/моль.
13,34
Обсуждение
Это значение очень близко к принятому значению 22,4 л/моль. Небольшая разница возникает из-за ошибок округления, вызванных использованием трехзначного ввода. Опять же, это число одинаково для всех газов. Другими словами, он не зависит от газа.
(Средний) молярный вес воздуха (приблизительно 80% N2N2 и 20% O2O2 составляет M=28,8 г. M=28,8 г. Таким образом, масса одного кубического метра воздуха составляет 1,28 кг. Если жилое помещение имеет размеры 5 м× 5 м×3 м, 5 м×5 м×3 м, масса воздуха внутри помещения 96 кг, что является типичной массой человека.
Проверьте свое понимание
Плотность воздуха при стандартных условиях (P=1 атм (P=1 атм и T=20°C)T=20°C) составляет 1,28 кг/м31,28 кг/м3. При каком давлении плотность 0,64 кг/м30,64 кг/м3, если температура и число молекул остаются постоянными?
Решение
Лучший способ ответить на этот вопрос — подумать о том, что происходит. Если плотность падает вдвое по сравнению с исходным значением и ни одна молекула не теряется, то объем должен удвоиться. Если мы посмотрим на уравнение PV=NkTPV=NkT, то увидим, что при постоянной температуре давление обратно пропорционально объему. Следовательно, если объем удвоится, давление должно упасть вдвое по сравнению с первоначальным значением, и Pf=0,50 атм. Pf=0,50 атм.
Если плотность падает вдвое по сравнению с исходным значением и ни одна молекула не теряется, то объем должен удвоиться. Если мы посмотрим на уравнение PV=NkTPV=NkT, то увидим, что при постоянной температуре давление обратно пропорционально объему. Следовательно, если объем удвоится, давление должно упасть вдвое по сравнению с первоначальным значением, и Pf=0,50 атм. Pf=0,50 атм.
Закон об идеальном газе, переформулированный с использованием молей
Очень распространенное выражение закона идеального газа использует количество молей nn, а не количество атомов и молекул NN. Начнем с закона идеального газа,
PV=NkT, PV=NkT,
13,35
, умножьте и разделите уравнение на число Авогадро NANA. Это дает
PV=NNANAkT.PV=NNANAkT.
13,36
Обратите внимание, что n=N/NAn=N/NA — количество молей. Определим универсальную газовую постоянную R=NAkR=NAk и получим закон идеального газа в молях.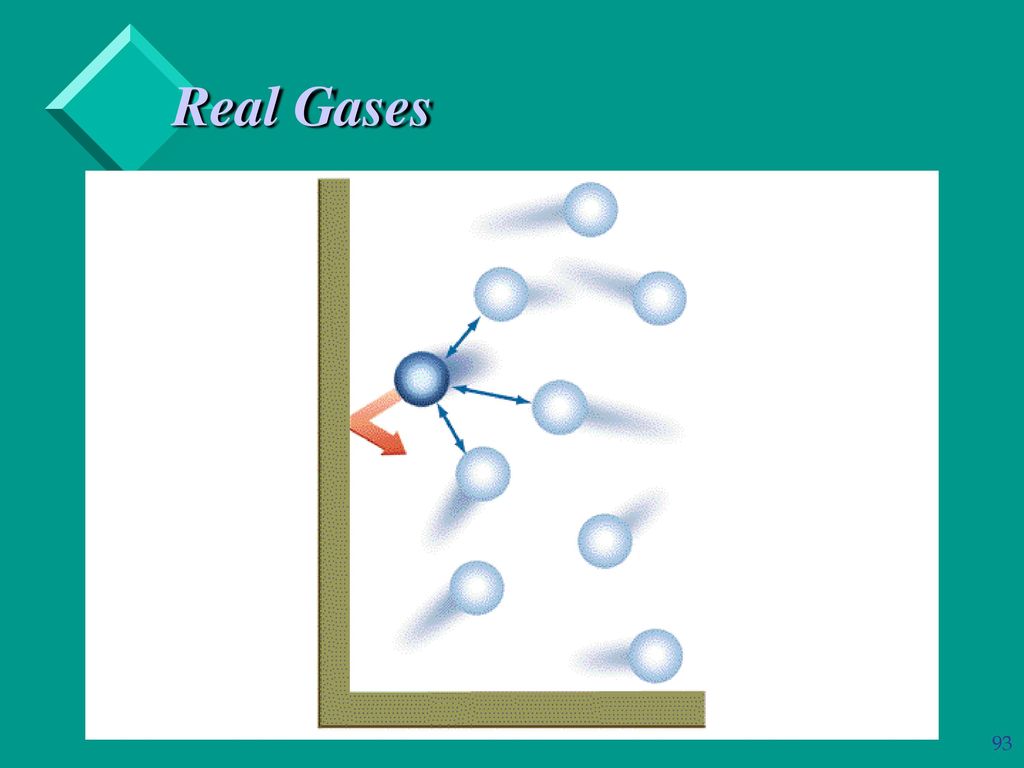
Закон идеального газа (в молях)
Закон идеального газа (в молях) равен
PV=nRT.PV=nRT.
13,37
Числовое значение RR в единицах СИ составляет
R=NAk=6,02×1023моль−11,38×10−23Дж/K=8,31Дж/моль⋅K.R=NAk=6,02×1023моль−11,38×10−23Дж /К=8,31 Дж/моль⋅К.
13,38
В других единицах
R=1,99 кал/моль⋅KR=0,0821 л⋅атм/моль⋅K.R=1,99 кал/моль⋅KR=0,0821 л⋅атм/моль⋅K.
13,39
Вы можете использовать любое значение RR, наиболее удобное для конкретной задачи.
Пример 13,9
Расчет количества молей: газа в велосипедной шине
Сколько молей газа содержится в велосипедной шине объемом 2,00×10–3 м3 (2,00 л), 2,00×10–3 м3 (2,00 л), давление 7,00×105 Па7,00×105 Па (манометрическое давление чуть менее 90,0 фунтов/дюйм290,0 фунтов/дюйм2) и при температуре 18,0ºC18,0ºC?
Стратегия
Определите известные и неизвестные и выберите уравнение для решения неизвестного. В этом случае мы решаем закон идеального газа PV=nRTPV=nRT для количества молей nn.
В этом случае мы решаем закон идеального газа PV=nRTPV=nRT для количества молей nn.
Решение
1. Определите известные.
P=7,00×105ПаВ=2,00×10-3м3T=18,0ºC=291 KR=8,31Дж/моль⋅KP=7,00×105ПаВ=2,00×10-3м3T=18,0ºC=291 KR=8,31Дж/моль⋅K
13,40
2. Переформулируйте уравнение для определения nn и подставьте известные значения.
n=PVRT=7,00×105Па2,00×10-3м38,31Дж/моль⋅K291K= 0,579мольн=PVRT=7,00×105Па2,00×10-3м38,31Дж/мольK291K=0,579моль
13,41
Обсуждение
Наиболее удобным выбором для RR в данном случае является 8,31 Дж/моль⋅К, 8,31 Дж/моль⋅К, поскольку наши известные величины указаны в единицах СИ. Давление и температура получены из начальных условий в примере 13.6, но мы получили бы тот же ответ, если бы использовали окончательные значения.
Закон идеального газа можно рассматривать как еще одно проявление закона сохранения энергии (см. Закон сохранения энергии). Работа, совершаемая над газом, приводит к увеличению его энергии, увеличению давления и/или температуры или уменьшению объема. Это увеличение энергии также можно рассматривать как увеличение внутренней кинетической энергии, учитывая атомы и молекулы газа.
Закон сохранения энергии). Работа, совершаемая над газом, приводит к увеличению его энергии, увеличению давления и/или температуры или уменьшению объема. Это увеличение энергии также можно рассматривать как увеличение внутренней кинетической энергии, учитывая атомы и молекулы газа.
Закон идеального газа и энергия
Теперь рассмотрим роль энергии в поведении газов. Когда вы накачиваете велосипедную шину вручную, вы постоянно прилагаете усилие на расстоянии. Эта энергия идет на повышение давления воздуха внутри шины и повышение температуры насоса и воздуха.
Закон об идеальном газе тесно связан с энергией: единицы измерения с обеих сторон — джоули. Правая часть закона идеального газа в PV=NkTPV=NkT равна NkTNkT. Этот член примерно представляет собой количество поступательной кинетической энергии атомов или молекул NN при абсолютной температуре TT, как мы формально увидим в «Кинетической теории: атомное и молекулярное объяснение давления и температуры». Левая часть закона идеального газа — это PVPV, который также измеряется в джоулях. Из нашего исследования жидкостей мы знаем, что давление — это один из видов потенциальной энергии на единицу объема, поэтому давление, умноженное на объем, — это энергия. Важным моментом является то, что в газе есть энергия, связанная как с его давлением, так и с его объемом. Энергия может изменяться, когда газ совершает работу по мере расширения — это мы исследуем в разделе «Методы теплопередачи» — аналогично тому, что происходит в бензиновых или паровых двигателях и турбинах.
Левая часть закона идеального газа — это PVPV, который также измеряется в джоулях. Из нашего исследования жидкостей мы знаем, что давление — это один из видов потенциальной энергии на единицу объема, поэтому давление, умноженное на объем, — это энергия. Важным моментом является то, что в газе есть энергия, связанная как с его давлением, так и с его объемом. Энергия может изменяться, когда газ совершает работу по мере расширения — это мы исследуем в разделе «Методы теплопередачи» — аналогично тому, что происходит в бензиновых или паровых двигателях и турбинах.
Стратегия решения проблем: закон идеального газа
Шаг 1 Изучите ситуацию, чтобы определить, что речь идет об идеальном газе. Большинство газов почти идеальны.
Шаг 2 Составьте список величин, которые даны или могут быть выведены из поставленной задачи (укажите известные величины). Преобразуйте известные значения в соответствующие единицы СИ (К для температуры, Па для давления, м3 м3 для объема, молекулы для NN и моли для nn).
Шаг 3 Укажите, что именно необходимо определить в задаче (укажите неизвестные величины). Письменный список полезен.
Шаг 4 Определите, известно ли количество молекул или число молей, чтобы решить, какую форму закона идеального газа использовать. Первая форма PV=NkTPV=NkT включает NN, количество атомов или молекул. Вторая форма – PV=nRTPV=nRT и включает nn, количество молей.
Шаг 5 Решите закон идеального газа для определяемой величины (неизвестная величина). Возможно, вам придется взять отношение конечных состояний к начальным состояниям, чтобы исключить неизвестные величины, которые остаются фиксированными.
Шаг 6 Подставьте известные величины вместе с их единицами измерения в соответствующее уравнение и получите численные решения с единицами измерения. Обязательно используйте абсолютную температуру и абсолютное давление.
Шаг 7 Проверьте ответ, чтобы убедиться, что он разумен: Имеет ли он смысл?
Проверьте свое понимание
Жидкости и твердые тела имеют плотность примерно в 1000 раз больше, чем газы. Объясните, как это означает, что расстояния между атомами и молекулами в газах примерно в 10 раз больше, чем размер их атомов и молекул.
Объясните, как это означает, что расстояния между атомами и молекулами в газах примерно в 10 раз больше, чем размер их атомов и молекул.
Решение
Атомы и молекулы находятся близко друг к другу в твердых и жидких телах. В газах они разделены пустым пространством. Таким образом, газы имеют более низкую плотность, чем жидкости и твердые тела. Плотность — это масса на единицу объема, а объем связан с размером тела (например, сферы) в кубе. Таким образом, если расстояние между атомами и молекулами увеличивается в 10 раз, занимаемый объем увеличивается в 1000 раз, а плотность уменьшается в 1000 раз.0001
- Последнее обновление
- Сохранить как PDF
- ID страницы
- 19179
- Дина Жабинская
- UC Davis
Закон идеального газа
Закон идеального газа является хорошим приближением для поведения большинства газов. Слово «идеальный» относится к следующему предположению о газе:
Слово «идеальный» относится к следующему предположению о газе:
- газ состоит из большого числа частиц, движение которых хаотично.
- частицы газа пренебрежимо малы по сравнению с объемом, который занимает газ.
- между частицами нет межмолекулярных сил.
- нет потерь энергии из-за столкновений частиц.
Учитывая вышеописанное предположение, существует важная зависимость между давлением, температурой, объемом и числом частиц в идеальном газе: 9{-23}\; \dfrac{J}{K}\]
и газовая постоянная \(R\):
\[R = 8,314 \dfrac{J}{mol \cdot K}\]
Закон идеального газа гласит, что давление и объем связаны не однозначно, а зависят от температуры. Следовательно, работа, совершаемая при сжатии газа, будет зависеть от того, как изменится температура при изменении давления и объема. То есть для сжатия газа требуется различное количество работы, в зависимости от того, как изменяется температура во время сжатия, в зависимости от того, может ли тепло поступать или не поступать в систему.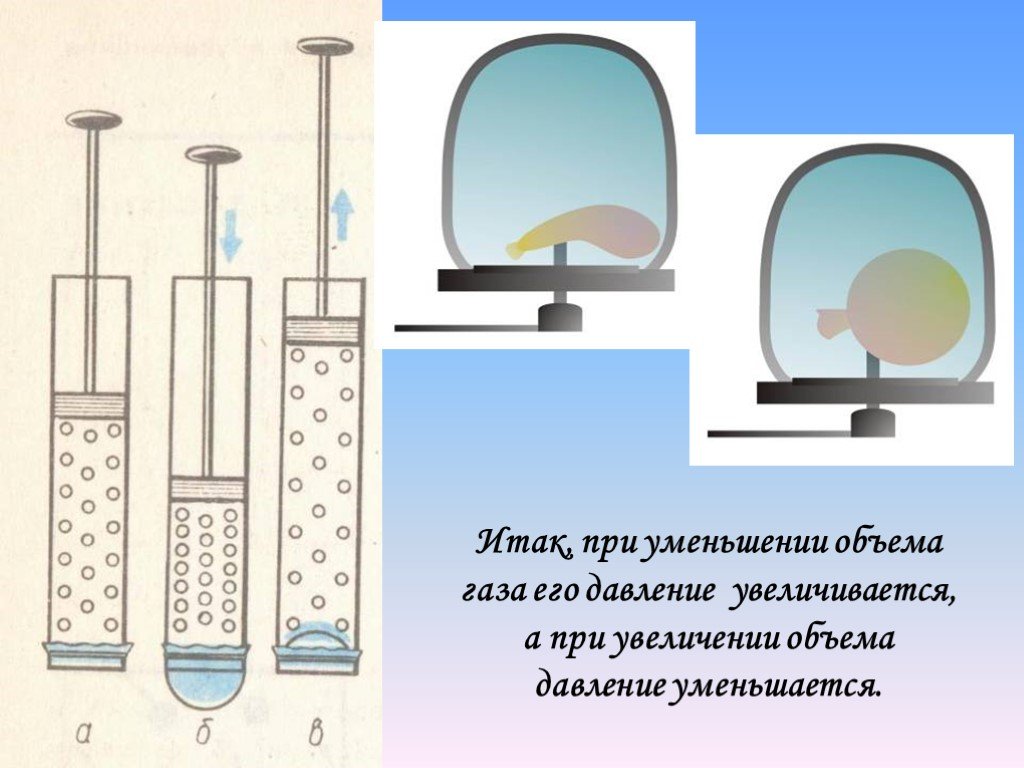 Графики зависимости давления от объема (диаграммы PV), представленные в следующем разделе, и новый способ определения сохранения энергии позволят нам определить вклад работы и тепла в изменения в системах.
Графики зависимости давления от объема (диаграммы PV), представленные в следующем разделе, и новый способ определения сохранения энергии позволят нам определить вклад работы и тепла в изменения в системах.
Идеальный газ соединяет микроскопическое представление о газах с макроскопическим представлением о газах. Температурный член образует мост между корпускулярной моделью тепловой энергии и макроскопической термодинамикой. Температура напрямую связана со значением тепловой энергии через фундаментальное соотношение температуры как меры случайного теплового движения в любом энергетическом режиме при тепловом равновесии, и в то же время видно, что температура прямо пропорциональна давлению газа. .
Теплоемкость идеального газа
В разделе 3.4 мы определили теплоемкость при постоянном объеме. Большинство химических реакций или биологических процессов происходят в открытых контейнерах, где газ может расширяться или сжиматься при постоянном давлении. Предположение о теплоемкости при постоянном объеме заключалось в том, что система не совершала никакой работы. Основываясь на определении из предыдущего раздела, \(W=-\int PdV\), теперь мы можем видеть, что, когда объем не меняется \(dV=0\), работа не выполняется. В эксперименте, где контейнер открыт, мы больше не можем делать такое предположение.
Предположение о теплоемкости при постоянном объеме заключалось в том, что система не совершала никакой работы. Основываясь на определении из предыдущего раздела, \(W=-\int PdV\), теперь мы можем видеть, что, когда объем не меняется \(dV=0\), работа не выполняется. В эксперименте, где контейнер открыт, мы больше не можем делать такое предположение.
Используя закон сохранения энергии, мы знаем, что \(\Delta E_{tot}=Q+W\). В идеальном газе нет межмолекулярных взаимодействий, следовательно, нет изменения энергии связи и при взаимодействии может изменяться только тепловая энергия, \(\Delta E_{tot}=\Delta E_{th}\). Возвращаясь к определению теплоемкости \(C=Q/\Delta T\) и подставляя вместо Q , теплоемкость можно записать как:
\[C=\dfrac{\Delta E_{th }-W}{\Delta T}\]
В уравнении 3.4.10 мы определили теплоемкость при постоянном объеме при \(C_V=\Delta E_{th}/\Delta T\). Таким образом, мы можем записать приведенное выше уравнение как:
\[C=C_V-\dfrac{W}{\Delta T}\]
Для постоянного давления интегральное уравнение для работы упрощается до \(W=-P\Delta V\), и с использованием закона идеального газа Уравнение \ref{Идеальное} приведенное выше уравнение упрощается до:
\[C_P=C_V+nR\]
, где нижний индекс “P” относится к теплоемкости при постоянном давлении.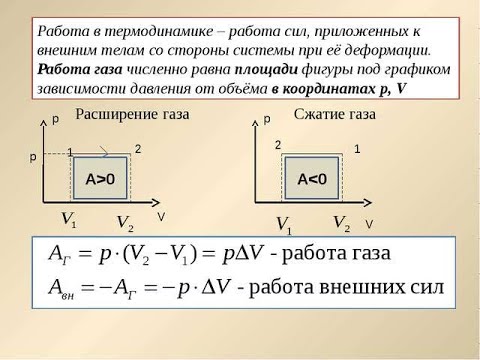

 8)
8) 10)
10) 13)
13)