основные формулы с пояснениями, обозначения давления и объёма
Содержание:
- Что такое молекулярная физика
- Основные величины молекулярной физики и соотношения между ними
-
Формулы с пояснениями и обозначениями, к каким процессам применимы
- Основное уравнение молекулярно-кинетической теории идеального газа
- Уравнение Менделеева-Клапейрона
- Законы физиков Бойля, Гей-Люссака и Шарля
- Закон Дальтона
Содержание
- Что такое молекулярная физика
- Основные величины молекулярной физики и соотношения между ними
-
Формулы с пояснениями и обозначениями, к каким процессам применимы
- Основное уравнение молекулярно-кинетической теории идеального газа
- Уравнение Менделеева-Клапейрона
- Законы физиков Бойля, Гей-Люссака и Шарля
- Закон Дальтона
Что такое молекулярная физика
Молекулярная физика — раздел физики, который изучает физические свойства тел на основе рассмотрения их молекулярного строения.
Свойства любого вещества диктуются особенностями его молекулярного строения. От индивидуальных характеристик строения молекулярной решетки, изменения межмолекулярных связей под воздействием факторов окружающей среды и времени их контакта зависят закономерности тех или иных процессов.
На физические свойства тел могут влиять давление, температура, электромагнитные поля. В результате этого первоначальные свойства предмета частично либо полностью видоизменяются. На практике, выбирая тот или иной состав вещества, обязательно учитывают его поведение при различных условиях эксплуатации: смену фазового состояния, появление поверхностных явлений и т.п.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Дать объяснение кардинальному либо частичному качественному изменению свойств можно только с позиции описания их макроскопических характеристик, вытекающих из микроскопического строения. Проявление законов межмолекулярных связей дают пояснение поведению тел при любых условиях.
Проявление законов межмолекулярных связей дают пояснение поведению тел при любых условиях.
Основные величины молекулярной физики и соотношения между ними
В основе физики, основывающейся на молекулярных особенностях, лежат величины, от них зависящие. Схематически их можно охарактеризовать следующим образом:
- Масса вещества (m).
- Объем (V).
- Плотность (ρ).
- Концентрация (n).
- Число частиц вещества (N).
Основные величины молекулярной физики взаимосвязаны друг с другом посредством следующих математических выражений:
\(\rho=m\div V\)
а значит \(\rho m=\rho\times V\\\)
Если N — число частиц вещества, а mo — масса каждой из них, то общая масса равна:
\(m=N\times mo\\\)
Концентрацию вещества можно высчитать по формуле:
\(n=N\div V\left\{\right\}\\\)
При умножении mo на N получится плотность ρ.
Формулы с пояснениями и обозначениями, к каким процессам применимы
В зависимости от условий окружающей среды вещества могут переходить из одного агрегатного состояния в другое:
- твердое;
- жидкое;
- газообразное.

Исходя из этого, оно проявляет различные свойства, изучение которых — задача молекулярной физики. Ее главной основой является молекулярно-кинетическая теория, рассматривающая тепловое движение молекул и атомов.
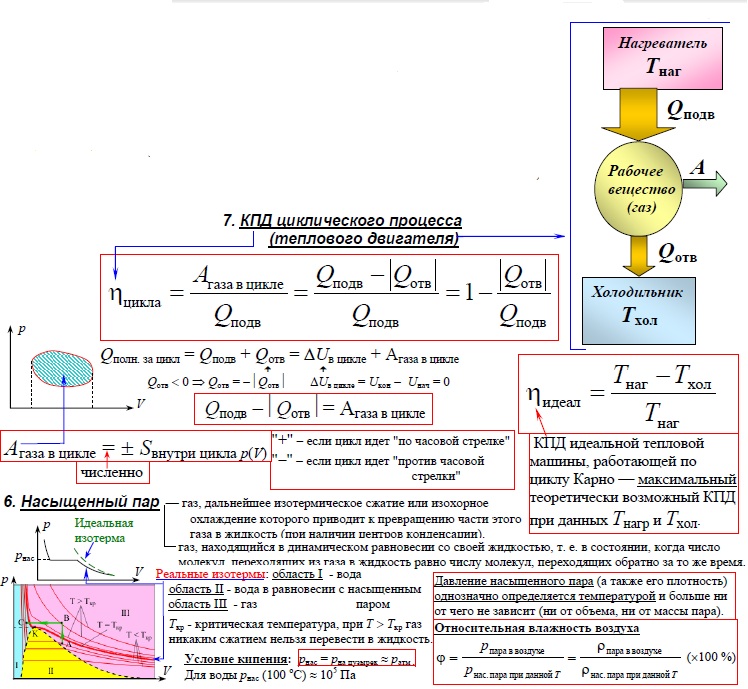
Основное уравнение молекулярно-кинетической теории идеального газа
Основополагающими моментами молекулярно-кинетической теории являются следующие:
- любое вещество имеет молекулярно-атомное строение;
- внутренние микрочастицы находятся в постоянном, хаотическом движении;
- они способны взаимодействовать друг с другом.
Примечание
Атомы, как и молекулы, электрически нейтральны, однако способны становиться положительными или отрицательными ионами, получая элетрозаряд. Тогда они называются катионами и анионами.
Если в обычном состоянии молекулы движутся хаотично (беспорядочно), то с возрастанием температуры увеличивается их кинетическая энергия, они разлетаются, а само вещество постепенно переходит в газообразную стадию.
Характер движения молекул в различных фазах различается. Если в твердой фазе они колеблются вокруг зафиксированных центров, то в жидкостях более свободны и могут осуществлять движение по всему объему. Именно этой особенностью вызывается такое свойство, как текучесть.
Для газообразного состояния характерно значительное превышение размеров расстояния между молекулами, чем их собственные габариты. Поэтому силы взаимодействия между ними невелики. Каждая микрочастица движется беспорядочно, пока не столкнется с себе подобной или стенкой сосуда. Это свойство вызывает способность газа расширяться и распространяться по всему объему сосуда.
Идеальный газ — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах.
Математическое выражение основного уравнения молекулярно-кинетической теории выглядит так:
\(p=1⁄3n\times mo\times V2 кв\)
Где p — давление газа, n — концентрация молекул в единице объема, mo — масса одной молекулы, Vкв — среднеквадратичная скорость молекулы.
Теоретическая суть уравнения заключается в определении зависимости между макротелом (газ, заключенный в сосуд) и его микропараметрами (характер движения молекул и атомов).
Молекула, сталкиваясь со стенкой сосуда, меняет свой импульс, поскольку не только она передает энергию стенке, но и получает противоположно направленный импульс. Это явление объясняют второй и третий законы Ньютона. Сумма всех ударов молекул о стенку создает давление газа.
Уравнение Менделеева-Клапейрона
Из постулатов молекулярно-кинетической теории вытекает уравнение состояния идеального газа:
\(p\times V=v\times R\times T\)
Где p — давление, V — объем, v — скорость движения частиц, R — универсальная газовая постоянная, равная 8,31 Дж/(моль∙К), T — температура
Это уравнение состояния идеального газа. Его открытие принадлежит Клайперону.
Примечание
Первоначально оно было сформулировано для одного моля газообразного вещества, позднее Менделеев установил его справедливость для большего количества молей.
Данное уравнение подразумевает определение параметров идеального газа, находящегося при нормальных условиях (температуре 273 К и давлении 1 атм).
Исходя из анализируемого равенства, известные параметры состояния идеального газа всегда помогут найти искомую величину. В то же время изменение любого из них вызовет коррекцию всех остальных.
Законы физиков Бойля, Гей-Люссака и Шарля
Физические законы, которые объясняют поведение идеального газа и дают возможность определить заданные показатели, носят имена своих открывателей. В зависимости от того, о чем идет речь в задаче, важно правильно выбрать закон, отражающий нужный критерий. Перед тем, как перейти к их характеристике, нужно обозначить следующие термины:
- парциальное давление — P, оказываемое газом, если бы в смеси не присутствовали другие компоненты;
- изотермический процесс — условия с постоянной температурой;
- изобарный процесс — условия с постоянным давлением;
- изохорный — с постоянным объемом.

Примечание
Если в задаче идет речь о количестве молекул применяется закон Авагадро, о смеси газов — закон Дальтона, при постоянном объеме газа — закон Шарля, изобарном процессе — Гей-Люссака, изотермическом — Бойля-Мариотта. При постоянной массе газа действует универсальный закон Клайперона.
Следствием уравнения Клайперона-Менделеева является газовый закон, открытый в 1662 году Р.Бойлем и параллельно — Э.Мариоттом (1676 г). Он гласит, что при постоянных массе и температуре величина, равная произведению давления газа на его объем остается неизменной.
Существует и другая, параллельная первой, формулировка: если температура газа постоянна, то давление его определенной массы обратно пропорционально объему.
Математическая запись выглядит следующим образом:
\(p1\div p2=V2\div V1\)
Закон Гей-Люссака гласит, что объем газа прямо пропорционален его абсолютной температуре. Обязательное условие для данного выражения — постоянное давление (процесс изобарный). Закон был открыт в 1802 году.
Закон был открыт в 1802 году.
В качестве следствия из этого закона в курсе физики приводится заключение, что при постоянных массе и давлении газа соотношение объема и температуры газа остается постоянной величиной.
Для закона Гей-Люссака необходимо соблюдение изобарности процесса и постоянстве массы.
Закон Шарля называют вторым законом Гей-Люссака. В нем идет речь о соотношении температуры и давления идеального газа при постоянном объеме. Закон был открыт в 1787 году Шарлем. Уточнен в 1802 году Гей-Люссаком.
Формулировка закона Шарля: при фиксированных массе и объеме идеального газа давление прямо пропорционально абсолютной температуре идеального газа.
Закон имеет теоретическое подтверждение, поскольку мера средней кинетической энергии вещества — это температура. При ее увеличении частицы сильнее ударяются о стенку сосуда и количество ударов создает более высокое давление.
В качестве следствия из этого закона часто применяется следующее понятие: при постоянных массе и объеме идеального газа отношение его давления к температуре является постоянным. Обязательное условие — изохорность процесса.
Обязательное условие — изохорность процесса.
Для решения задач с помощью газовых законов температура переводится из градусов Цельсия в Кельвины.
Закон Дальтона
Если сосуд заполняется не чистым газом, а смесью нескольких компонентов, то для определения давления на стенки применяется закон Дальтона.
Согласно закону Дальтона, общее давление будет равно сумме давлений каждого из компонентов смеси.
В этом законе вводится термин «парциальное» давление, т.е. то, которое производил бы один из компонентов, если бы был единственным.
Математическое выражение выглядит следующим образом:
p=p1+p2+p3+…pn
Обязательным условием действия этого закона является отсутствие химического взаимодействия между входящими в состав газовой смеси элементами.
Насколько полезной была для вас статья?
У этой статьи пока нет оценок.
Поиск по содержимому
Молекулярная физика: основные формулы определения количества вещества, термодинамики и давления газа
Молекулярная физика изучает свойства тел, руководствуясь поведением отдельных молекул. Все видимые процессы протекают на уровне взаимодействия мельчайших частиц, то, что мы видим невооруженным глазом — лишь следствие этих тонких глубинных связей….
Все видимые процессы протекают на уровне взаимодействия мельчайших частиц, то, что мы видим невооруженным глазом — лишь следствие этих тонких глубинных связей….
Содержание
Основные понятия
Молекулярная физика иногда рассматривается как теоретическое дополнение термодинамики. Возникшая намного раньше, термодинамика занималась изучением перехода тепла в работу, преследуя чисто практические цели. Она не производила теоретического обоснования, описывая лишь результаты опытов. Основные понятия молекулярной физики возникли позже, в XIX веке.
Она изучает взаимодействие тел на молекулярном уровне, руководствуясь статистическим методом, который определяет закономерности в хаотических движениях минимальных частиц – молекул. Молекулярная физика и термодинамика дополняют друг друга, рассматривая процессы с разных точек зрения. При этом термодинамика не касается атомарных процессов, имея дело только с макроскопическими телами, а молекулярная физика, напротив, рассматривает любой процесс именно с точки зрения взаимодействия отдельных структурных единиц.
Все понятия и процессы имеют собственные обозначения и описываются специальными формулами, которые наиболее наглядно представляют взаимодействия и зависимости тех или иных параметров друг от друга. Процессы и явления пересекаются в своих проявлениях, разные формулы могут содержать одни и те же величины и быть выражены разными способами.
Количество вещества
Количество вещества определяет взаимосвязь между весом (массой) и количеством молекул, которые содержит эта масса. Дело в том, что разные вещества при одинаковой массе имеют разное число минимальных частиц. Процессы, проходящие на молекулярном уровне, могут быть поняты только при рассмотрении именно числа атомных единиц, участвующих во взаимодействиях. Единица измерения количества вещества, принятая в системе СИ, — моль.
Внимание! Один моль всегда содержит одинаковое количество минимальных частиц. Это число называется числом (или постоянной) Авогадро и равняется 6,02×1023.
Эта константа используется в случаях, когда для расчетов требуется учитывать микроскопическое строение данного вещества. Иметь дело с количеством молекул сложно, так как придется оперировать огромными числами, поэтому используется моль – число, определяющее количество частиц в единице массы.
Формула, определяющая количество вещества:
Расчет количества вещества производится в разных случаях, используется во многих формулах и является важным значением в молекулярной физике.
Давление газа
Давление газа — важная величина, имеющая не только теоретическое, но и практическое значение. Рассмотрим формулу давления газа, используемую в молекулярной физике, с пояснениями, необходимыми для лучшего понимания.
Для составления формулы придется сделать некоторые упрощения. Молекулы представляют собой сложные системы, имеющие многоступенчатое строение. Для простоты рассмотрим газовые частицы в определенном сосуде как упругие однородные шарики, не взаимодействующие друг с другом (идеальный газ).
Скорость движения минимальных частиц также будем считать одинаковой. Введя такие упрощения, не сильно меняющие истинное положение, можно вывести такое определение: давление газа — это сила, которую оказывают удары молекул газа на стенки сосудов.
При этом, учитывая трехмерность пространства и наличие двух направлений каждого измерения, можно ограничить количество структурных единиц, воздействующих на стенки, как 1/6 часть.
Таким образом, сведя воедино все эти условия и допущения, можем вывести формулу давления газа в идеальных условиях.
Формула выглядит так:
где P — давление газа,
n — концентрация молекул,
K — постоянная Больцмана (1,38×10-23),
Ek — кинетическая энергия молекул газа.
Существует еще один вариант формулы:
P = nkT,
где n — концентрация молекул,
T — абсолютная температура.
Формула объема газа
Объем газа — это пространство, которое занимает данное количество газа в определенных условиях.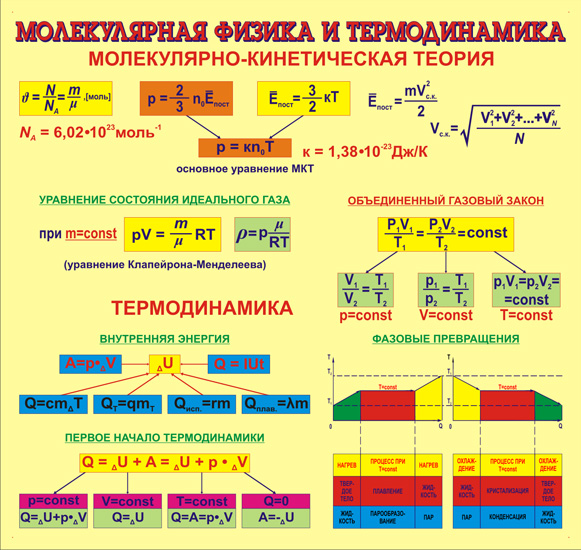 В отличие от твердых тел, имеющих постоянный объем, практически не зависящий от окружающих условий, газ может менять объем в зависимости от давления или температуры.
В отличие от твердых тел, имеющих постоянный объем, практически не зависящий от окружающих условий, газ может менять объем в зависимости от давления или температуры.
Формула объема газа – это уравнение Менделеева-Клапейрона, которое выглядит таким образом:
PV = nRT
где P — давление газа,
V — объем газа,
n — число молей газа,
R — универсальная газовая постоянная,
T — температура газа.
Путем простейших перестановок получаем формулу объема газа:
Важно! Согласно закону Авогадро равные объемы любых газов, помещенные в совершенно одинаковые условия — давление, температура — будут всегда содержать равное количество минимальных частиц.
Кристаллизация
Кристаллизация — это фазовый переход вещества из жидкого в твердое состояние, т.е. процесс, обратный плавлению. Процесс кристаллизации происходит с выделением теплоты, которую требуется отводить от вещества. Температура совпадает с точкой плавления, весь процесс описывается формулой:
Q = λm,
где Q — количество теплоты,
λ — теплота плавления,
M — масса.
Эта формула описывает как кристаллизацию, так и плавление, поскольку они, по сути, являются двумя сторонами одного процесса. Для того чтобы вещество кристаллизовалось, необходимо охладить его до температуры плавления, а затем отвести количество тепла, равное произведению массы на удельную теплоту плавления (λ). Во время кристаллизации температура не меняется.
Существует еще один вариант понимания этого термина — кристаллизация из перенасыщенных растворов. В этом случае причиной перехода становится не только достижение определенной температуры, но и степень насыщения раствора определенным веществом. На определенном этапе количество частиц растворенного вещества становится слишком большим, что вызывает образование мелких монокристалликов. Они присоединяют молекулы из раствора, производя послойный рост. В зависимости от условий роста кристаллы имеют различную форму.
Число молекул
Определить количество частиц, содержащееся в данной массе вещества, проще всего при помощи следующей формулы:
Отсюда выходит, что число молекул равняется:
То есть необходимо прежде всего определить количество вещества, приходящееся на определенную массу.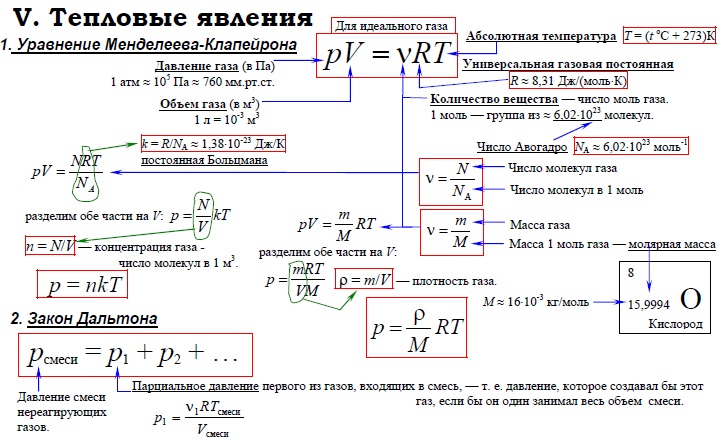 Затем оно умножается на число Авогадро, в результате чего получаем количество структурных единиц. Для соединений подсчет ведется суммированием атомного веса компонентов. Рассмотрим простой пример:
Затем оно умножается на число Авогадро, в результате чего получаем количество структурных единиц. Для соединений подсчет ведется суммированием атомного веса компонентов. Рассмотрим простой пример:
Определим количество молекул воды в 3 граммах. Формула воды (h3O) содержит два атома водорода и один кислорода. Общий атомный вес минимальной частицы воды составит: 1+1+16 = 18 г/моль.
Количество вещества в 3 граммах воды:
3:18= 1/6.
Число молекул:
1/6 × 6 × 1023 = 1023.
Формула массы молекулы
Один моль всегда содержит одинаковое количество минимальных частиц. Следовательно, зная массу моля, можно разделить ее на количество молекул (число Авогадро), получив в результате массу системной единицы.
Следует учесть, что эта формула относится лишь к неорганическим молекулам. Размеры органических молекул намного больше, их величина или вес имеют совсем другие значения.
Молярная масса газа
Молярная масса — это масса в килограммах одного моля вещества. Поскольку в одном моле содержится одинаковое количество структурных единиц, формула молярной массы имеет такой вид:
Поскольку в одном моле содержится одинаковое количество структурных единиц, формула молярной массы имеет такой вид:
M = κ × Mr
где k — коэффициент пропорциональности,
Mr — атомная масса вещества.
Молярная масса газа может быть рассчитана по уравнению Менделеева-Клапейрона:
pV = mRT / M,
из которой можно вывести:
M = mRT / pV
Таким образом, молярная масса газа прямо пропорциональна произведению массы газа на температуру и универсальную газовую постоянную и обратно пропорциональна произведению давления газа и его объема.
Внимание! Следует учесть, что молярная масса газа как элемента может отличаться от газа как вещества, например, молярная масса элемента кислорода (О) равна 16 г/моль, а масса кислорода как вещества (О2) равна 32 г/моль.
Основные положения МКТ.
Физика за 5 минут молекулярная физика
youtube.com/embed/CmSiBO3Vd6E” frameborder=”0″ allowfullscreen=”allowfullscreen”>lt,span data-mce-type=bookmark style=display: inline-block, width: 0px, overflow: hidden, line-height: 0, class=mce_SELRES_startgt,lt,/spangt,Вывод
Формулы, которые содержат молекулярная физика и термодинамика, позволяют вычислить количественные значения всех процессов, происходящих с твердыми веществами и газами. Такие расчеты необходимы как в теоретических изысканиях, так и на практике, поскольку они способствуют решению практических задач.
Молекулярная кинетика | Формулы физики
Количество вещества (моль)
Находить
Известно, что:
νNN_A =
Рассчитать ‘ν’Молярная масса
Находить
Известно, что:
Ммν =
Рассчитать ‘M’Масса молекулы
Находить
Известно, что:
м0мН =
Рассчитать m0Молярная масса
Находить
Известно, что:
Мм0Н_А =
Рассчитать «М»Количество молекул
Находить
Известно, что:
NmN_AM =
Рассчитать ‘N’Формула кинетической теории
Находить
Известно, что:
pnm0v =
Рассчитать pВнутренняя энергия молекул
Находить
Известно, что:
Эмв =
Рассчитать ЕДавление идеального газа
Находить
Известно, что:
pnE =
Рассчитать «p»Концентрация молекул
Находить
Известно, что:
нНВ =
Рассчитать ‘n’Давление газа, объем и средняя кинетическая энергия
Находить
Известно, что:
pVNE =
Рассчитать «p»Газ: давление, объем, температура
Находить
Известно, что:
pVNkT =
Рассчитать pСредняя кинетическая энергия
Находить
Известно, что:
ЭкТ =
Рассчитать «E»Газ: давление, концентрация, температура
Находить
Известно, что:
рнкТ =
Рассчитать «p»Газ: количество вещества, объем
Находить
Известно, что:
νВВ_М =
Рассчитать ‘ν’Среднеквадратичная скорость молекулы газа
Находить
Известно, что:
vkTm0 =
Рассчитать ‘v’Закон идеального газа (уравнение Менделеева – Клапейрона)
Находить
Известно, что:
pVmRTM =
Рассчитать ‘p’Закон идеального газа (уравнение Менделеева-Клапейрона)
Находить
Известно, что:
pVTνR =
Рассчитать pЗакон Бойля и Мариотта (изотермический процесс)
Находить
Известно, что:
p1V1p2V2 =
Рассчитать p1Закон Гей-Люссака (изобарический процесс)
Находить
Известно, что:
В1Т1В2Т2 =
Рассчитать «V1»Тепловое расширение газа
Находить
Известно, что:
VV0αT =
Вычислить ‘V’Закон Шарля (изохорический процесс)
Находить
Известно, что:
p1T1p2T2 =
Рассчитать ‘p1’Температурная зависимость давления газа
Находить
Известно, что:
pp0γT =
Вычислить pМолекулярная формула и ее расчеты Учебное пособие
Молекулярная формула — это выражение, которое помогает определить количество и тип атомов, присутствующих в молекуле вещества. Одним из примеров молекулярной формулы является CO₂.
Одним из примеров молекулярной формулы является CO₂.
ВВЕДЕНИЕ
Вы когда-нибудь задумывались, глядя на химическую реакцию, как она определяется? Большие формулы или изображения будут выглядеть сложными, но если вы знаете молекулярную формулу, она станет очень простой и понятной. Итак, первое, что бросается в глаза, это то, что такое молекулярная формула и как она помогает понять различные, но сложные химические реакции? Давайте копаться в этом!
ЧТО ТАКОЕ МОЛЕКУЛЯРНАЯ ФОРМУЛА?
Прежде чем понять молекулярную формулу, знаете ли вы, что такое молекула? Молекула – это химическое соединение двух атомов. Молекулярная формула молекулярного соединения — это химическая формула, которая показывает количество различных атомов, присутствующих в молекуле. Например, в CO₂ нижний индекс под кислородом показывает, что присутствуют два атома кислорода, тогда как отсутствие нижнего индекса под углеродом показывает, что присутствует только один атом углерода.
Химическая формула может быть записана как:
Молекулярная формула = n (эмпирическая формула)
где n = целое кратное
Также может быть записана как:
n = MM (молярная масса) / EFM (эмпирическая формула молярная масса)
Источник
ЧТО ТАКОЕ ЭМПИРИЧЕСКАЯ ФОРМУЛА?
Эмпирическая формула соединения представляет собой простейшее целочисленное отношение атомов. Его легко определить по процентному составу соединения.
Его легко определить по процентному составу соединения.
Источник
КАК НАЙТИ МОЛЕКУЛЯРНУЮ ФОРМУЛУ ИЗ ЭМПИРИЧЕСКОЙ ФОРМУЛЫ?
Нам нужно знать эмпирическую формулу, чтобы мы могли преобразовать ее в молекулярную формулу. Вам также необходимо знать молярную массу соединения, чтобы получить молекулярную формулу. Вот простые шаги для определения молекулярной формулы:
Шаг 1: Рассчитайте молярную массу эмпирической формулы (EFM).
Шаг 2: Вам необходимо разделить молярную массу соединения на эмпирическую формулу молярной массы (EFM). Результат должен быть целым числом или очень близким к целому числу.
Шаг 3: Вы должны умножить все индексы в эмпирической формуле на целое найденное число. В результате мы получим молекулярную формулу.
ПРИМЕР ЗАДАЧИ НА ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ ФОРМУЛЫ
Эмпирическая формула соединения бора и водорода – Bh4. Его молярная масса составляет 27,7 г/моль. Определите молекулярную формулу соединения.
Определите молекулярную формулу соединения.
Дано: Эмпирическая формула = BH₃
Молярная масса = 27,7 г/моль
Эмпирическая формула молярная масса (EFM) = 13,84 г/моль
Молярная масса / EFM = 27,7 г/моль / 13,84 г/моль = 2
Молекулярная формула = BH₃ × 2 = B₂H₆
Часто задаваемые вопросы:
1. Что такое краткий ответ на молекулярную формулу?
Это химическая формула, которая помогает определить общее количество атомов, присутствующих в молекуле.
2. Что такое эмпирическая и молекулярная формула, с примером?
Эмпирическая формула соединения представляет собой простейшее целочисленное отношение атомов, тогда как молекулярная формула представляет собой общее число атомов, присутствующих в молекуле. Примером эмпирической формулы гексана является C₃H₇, а молекулярной формулой является CO₂.
3. Как найти молекулярную формулу?
Молекулярная формула = n (эмпирическая формула)
где n = целое число, кратное
4. Что такое моль? Объясните на примере?
Что такое моль? Объясните на примере?
Определяется как масса вещества, содержащего 6,023 x 10²³ частиц вещества. Пример: В 12 граммах углерода содержится 12 x 6,023 x 10²³ молей.
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о Молекулярная формула и ее расчеты ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности – мы обещаем, что это сделает учебу намного веселее! 😎
ИСТОЧНИКИ
- Молекулярная формула: https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/section/7.1/primary/lesson/молекулярно-формула-хим/. По состоянию на 28 февраля 2022 г.
- Эмпирическая формула: https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/section/7.2/primary/lesson/empirical-formula-chem/. По состоянию на 28 февраля 2022 г.