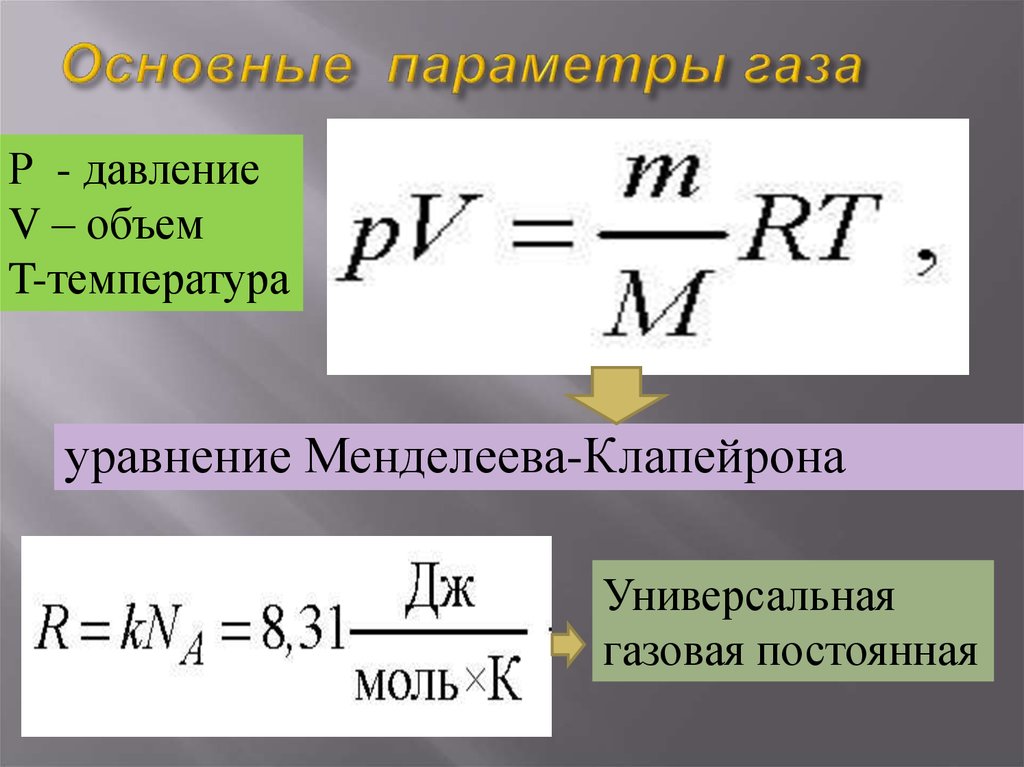
| ГОСТы, СНиПы Карта сайта TehTab.ru Поиск по сайту TehTab.ru | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация/ / Инженерные приемы и понятия / / Связь между давлением, температурой, объемом и количеством молей газа (“массой” газа). Универсальная (молярная) газовая постоянная R. Уравнение Клайперона-Менделеева = уравнение состояния идеального газа.
| |||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | ||||||||||
TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | |||||||||
Уравнение состояния идеального газа. Базовый уровень 10 класс онлайн-подготовка на Ростелеком Лицей
Связь трех параметров состояния идеального газа. Уравнение Менделеева – Клапейрона
Состояние газа однозначно задается тремя макроскопическими параметрами: давлением, объемом и температурой. Мы знаем, что горячий воздух поднимается вверх. С увеличением температуры он становится легче – уменьшается плотность, увеличивается расстояние между молекулами. То есть происходит расширение – увеличение объема. Можно сделать вывод, что объем и температура газа связаны. Если сдавить воздушный шарик, то внутри него увеличится давление. То есть объем газа также связан с давлением. Получается, что давление, объем и температура газа связаны между собой. Попробуем понять, как именно.
Мы работаем с моделью идеального газа, которая описывает реальный газ достаточно точно для решения многих задач. Мы уже получили для идеального газа основное уравнение МКТ, с помощью которого связали давление с микропараметрами – массой и средней скоростью одной молекулы:
Мы уже получили для идеального газа основное уравнение МКТ, с помощью которого связали давление с микропараметрами – массой и средней скоростью одной молекулы:
Это уравнение – решение задачи в модели механики. Мы приняли, что газ состоит из хаотично движущихся молекул – и вычислили, как они действуют на стенку, какое давление создают, когда с ней сталкиваются. Но мы не измеряем скорости и массы отдельных молекул. На макроуровне мы умеем измерять температуру, которую мы связали со средней кинетической энергией молекул, а значит, и с микропараметрами: массой и средней скоростью одной молекулы:
Подставив кинетическую энергию из одного уравнения в другое, получили:
В таком виде применять уравнение для решения задач все еще не удобно. Для измерения давления газа существуют различные приборы (манометры, барометры), для измерения температуры – термометры. Но мы не можем напрямую измерять концентрацию – количество частиц в единице объема. Преобразуем уравнение до удобного вида. Концентрация – это, по определению, :
Концентрация – это, по определению, :
А количество молекул удобнее представить через количество вещества. Мы помним, что в одном моле вещества молекул. Значит, :
Договоримся: чтобы каждый раз не перемножать постоянные величины на , сделаем это один раз, а произведение обозначим :
Это значение назвали универсальной газовой постоянной, почему – станет понятно чуть позже. Умножим обе части уравнения на объем и перепишем:
Получили уравнение, которое связывает три макропараметра идеального газа, которые легко измерить: объем, температуру и давление. И если взять какое-то определенное количество газа , эти три параметра однозначно зададут его состояние, неизвестных в уравнении не останется. Поэтому это уравнение назвали уравнением состояния идеального газа, или иначе уравнением Менделеева – Клапейрона. А на случай, если нам неудобно пользоваться количеством вещества в молях, можно его выразить через массу вещества:
Именно в этом виде его чаще всего и записывают.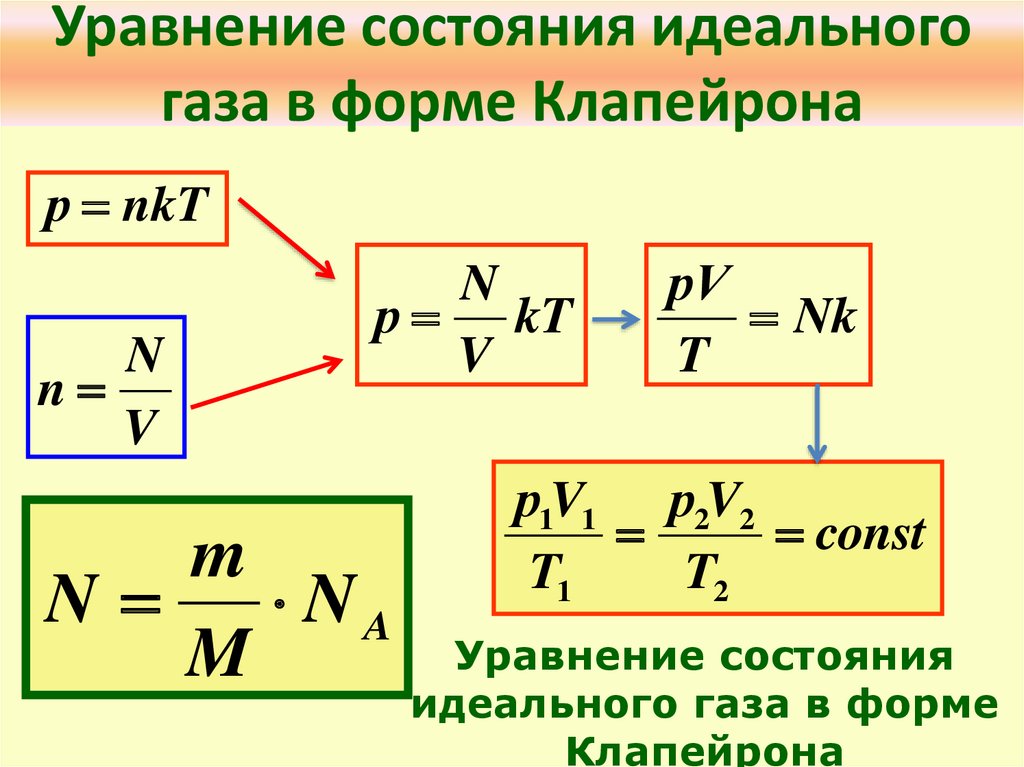 Мы начали с движения молекул, придумали инструменты для его описания, а в итоге получили уравнение, которое связывает поддающиеся непосредственному измерению макропараметры.
Мы начали с движения молекул, придумали инструменты для его описания, а в итоге получили уравнение, которое связывает поддающиеся непосредственному измерению макропараметры.
Решим задачу.
Задача 1. Какое давление должен выдерживать газовый баллон объемом 50 л, чтобы при температуре 25 ˚С в нем можно было хранить 2 кг метана ()?
Анализ условия. В задаче сказано о метане – это газ, в баллоне не создается экстремальных условий, температура комнатная, так что будем описывать его с помощью модели идеального газа. Речь идет о связи трех макропараметров газа, поэтому будем применять уравнение состояния идеального газа.
Физическая часть решения. В условии задана масса газа, поэтому запишем уравнение состояния идеального газа в том виде, в котором есть масса:
Все величины известны, осталось только найти молярную массу метана (ее можно найти, зная состав его молекулы, см. рис. 1), перевести значения величин в СИ и получить ответ. На выборе уравнения физика закончилась, осталось решить простое уравнение. Выразим давление:
Выразим давление:
Рис. 1. Углерод и водород в таблице Менделеева
Молекула метана состоит из одного атома углерода с относительной атомной массой 12 (смотрим в таблице Менделеева) и четырех атомов водорода с относительной атомной массой 1. Тогда:
Будем использовать в СИ:
1 л – это 1 или в СИ . Значит, объем баллона в СИ будет равен .
Температуру выразим в кельвинах:
Вычислим давление:
Получили ответ: давление около 6,2 МПа, что в 62 раза больше атмосферного. Задача решена.
Во многих задачах берется некоторое фиксированное количество газа и рассматривается изменение его состояния. Это значит, что в рамках таких задач количество вещества постоянно (как и масса, смотря в чем выразим). Можно все постоянные перенести в одну часть уравнения, а три изменяющихся параметра состояния – в другую:
или
Если взять 1 моль любого газа (одноатомного аргона, углекислого газа, водяного пара – лишь бы к нему была применима модель идеального газа), выражение будет равно постоянной . Поэтому эта постоянная и названа универсальной. Но даже если мы возьмем произвольную, но – что важно – фиксированную массу газа, выражение для этой массы газа будет постоянным:
Поэтому эта постоянная и названа универсальной. Но даже если мы возьмем произвольную, но – что важно – фиксированную массу газа, выражение для этой массы газа будет постоянным:
Или, по-другому, если газ переходит из одного состояния с параметрами , , в состояние с параметрами , , , то можем записать:
В таком виде или в виде это уравнение называют уравнением Клапейрона, хотя это то же уравнение состояния, записанное немного иначе.
Газовые законы
Рассматривать изменение переменной от двух других не очень удобно. У нас есть подходящий математический инструмент для описания одной переменной от другой – функция. В рассмотренных в начале урока примерах мы фиксировали один из трех параметров газа (например, температуру) и рассматривали зависимость двух других. Подробно рассмотрим все три случая.
Начнем с фиксированной температуры и рассмотрим связь давления и объема в этом случае. Процессы, в которых мы считаем неизменным один из параметров состояния газа, назвали изопроцессами, от древнегреческого ἴσος, что означает «одинаковый, равный». А процесс, в котором сохраняется температура (const), называется изотермическим (несложно запомнить: термос – то, что сохраняет температуру).
А процесс, в котором сохраняется температура (const), называется изотермическим (несложно запомнить: термос – то, что сохраняет температуру).
Умножим обе части уравнения Клапейрона на температуру:
Если умножить постоянную температуру на константу, то получим тоже константу, только другую:
Нам даже не нужно знать ее значение, главное, что произведение p на V каким было в начале процесса, таким и осталось в конце:
Из уравнения видно: при уменьшении объема (сжатии) при постоянной температуре увеличивается давление, и наоборот (на математике мы говорили, что такая зависимость называется обратной пропорциональностью).
Мы получили это уравнение, воспользовавшись математической моделью, но еще в XVII веке эту закономерность экспериментально выявили англичанин Бойль и француз Мариотт, поэтому ее назвали в их честь законом Бойля – Мариотта:
Для газа данной массы при постоянной температуре произведение давления газа на его объем постоянно.
Как это выглядит на практике? Представьте шар с мягкой резиновой оболочкой или цилиндр со скользящим поршнем, в которых находится определенная масса газа. Как добиться того, чтобы при сжатии газа его температура оставалась постоянной? Газ должен обмениваться теплотой с большим телом с неизменной температурой – термостатом (см. рис. 2).
Рис. 2. Сжатие газа, отвод теплоты для постоянной температуры
Реально ли поддерживать таким способом постоянную температуру? Нет, для этого газ нужно сжимать очень медленно, чтобы он успевал остывать, едва начиная нагреваться. Но если не будет разности температур, то и теплообмена не будет: тепло передается от теплого холодному. Поэтому процесс сможет протекать так: небольшими шагами сжимаем газ, чтобы на каждом таком шаге он немного нагревался и это тепло тут же забирал термостат. Постоянная температура – это приближение, тем не менее достаточно точно описывающее реальный процесс и позволяющее решать задачи.
Зафиксируем второй параметр – давление, при этом меняться будут температура и объем.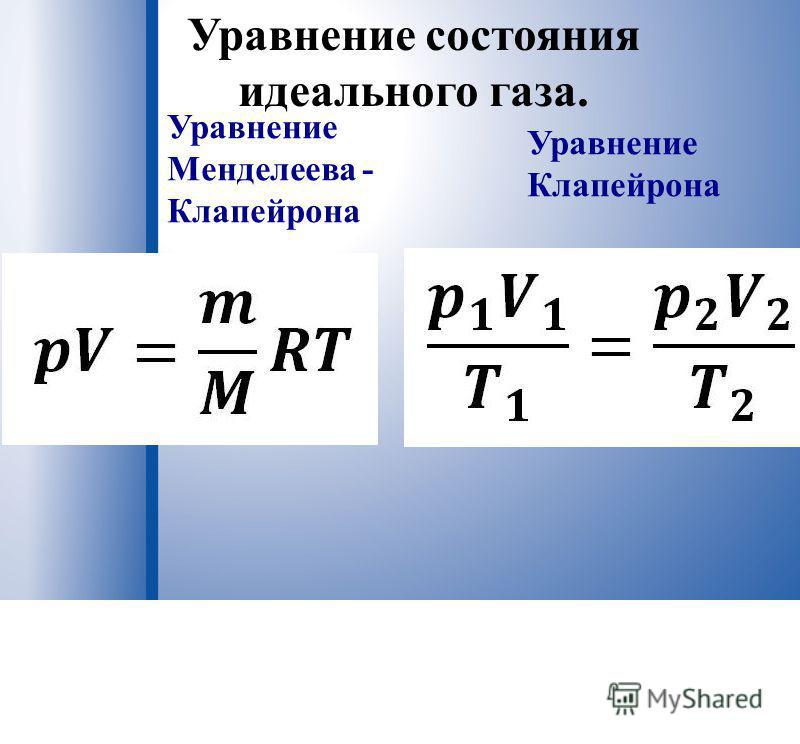 Давление мы ассоциируем с древнегреческим βαρύς – «тяжелый», вы знаете, что атмосферное давление измеряют барометром, поэтому процесс с постоянным давлением (onst) назвали изобарным.
Давление мы ассоциируем с древнегреческим βαρύς – «тяжелый», вы знаете, что атмосферное давление измеряют барометром, поэтому процесс с постоянным давлением (onst) назвали изобарным.
Разделим обе части уравнения Клапейрона на давление:
Если разделить константу на постоянное давление, то получим тоже константу:
А если рассмотреть объем и температуру в начале и в конце изобарного процесса, можно записать:
Из уравнения видно: при увеличении температуры (нагревании) при постоянном давлении увеличивается объем (газ расширяется), и наоборот, при охлаждении – сжимается. Это пример прямой пропорциональности. До того как вывели этот закон математически, его экспериментально получил Гей-Люссак (это двойная фамилия одного человека, французского ученого), поэтому его назвали законом Гей-Люссака:
Для данной массы газа при постоянном давлении отношение объема к температуре постоянно.
Пример реального процесса, который можно описывать как изобарный: газ, который находится в цилиндре под поршнем, который свободно перемещается и на который снаружи действует постоянное давление, например атмосферное. Тогда, если нагреть этот газ, он будет расширяться, но давление как было равным атмосферному (плюс давление самого поршня), так и останется.
Тогда, если нагреть этот газ, он будет расширяться, но давление как было равным атмосферному (плюс давление самого поршня), так и останется.
На самом деле, если давление газа совсем не будет увеличиваться, у поршня не будет причин двигаться, давления будут все время уравновешены. Так что давление немного увеличивается, но под его действием поршень сдвигается вверх, и оно тут же понижается до прежнего значения. Эти изменения небольшие, так что для решения многих задач давление можно действительно считать постоянным.
И остался третий параметр, который мы еще не фиксировали, – объем, при этом изменяются температура и давление. Называется такой процесс, при котором (onst), изохорным, от древнегреческого χῶρος – «место, пространство». Разделим обе части уравнения Клапейрона на объем:
Справа получилась константа:
Теперь можно связать давление и температуру в начале и в конце изохорного процесса:
Из уравнения видно: при увеличении температуры (нагревании) при постоянном объеме увеличивается давление газа, и наоборот. Это тоже прямая пропорциональность. И этот закон тоже сначала был получен экспериментально, французским ученым Шарлем, поэтому и назван его именем – закон Шарля:
Это тоже прямая пропорциональность. И этот закон тоже сначала был получен экспериментально, французским ученым Шарлем, поэтому и назван его именем – закон Шарля:
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
Для этого процесса модель точнее описывает реальный процесс: в закрытом жестком сосуде объем действительно можно считать постоянным с хорошей точностью. Пример – металлический баллон. Если газ в нем нагреть, давление увеличится, но при большой жесткости баллона он практически не деформируется (по крайне мере настолько, чтобы внести заметную погрешность в расчеты).
Решение задач. Графики для описания газовых законов. Границы применимости модели
Итак, какие инструменты мы получили? Основной инструмент один – уравнение состояния идеального газа. А все остальное – это запись этого же уравнения в более удобных формах для решения той или иной задачи. Если мы имеем дело с неизменной массой газа (то есть нет утечек), то три параметра состояния связаны уравнением Клапейрона.
Задача 2. При сжатии воздуха в цилиндре дизельного двигателя объем воздуха уменьшается в 15 раз, а температура повышается от 47 до 620 ˚С. Каково давление воздуха в конце сжатия, если в начале сжатия давление воздуха было равно атмосферному (100 кПа)?
Анализ условия. В задаче описано изменение состояния воздуха, будем его описывать с помощью модели идеального газа – температура сотни градусов по Цельсию это позволяет. Состояние газа описано тремя макропараметрами (давлением, температурой и объемом), причем изменяются все три макропараметра, это не изопроцесс. При этом ничего об утечках воздуха из цилиндра ничего не сказано, значит, количество воздуха не изменяется. Будем применять уравнение Клапейрона.
Физическая часть решения.
Температуры заданы (нужно только перевести их в кельвины), давление тоже. Что сказано об объеме – перепишем условие в математическом виде. Объем уменьшился в 15 раз, это значит, что в состоянии 2 объем в 15 раз меньше, чем в состоянии 1:
Получили простую систему уравнений, решим ее – это будет математическая часть решения. Подставим второе давление:
Выразим давление во втором состоянии:
Получили ответ: 4,2 МПа (или 42 атмосферы).
Задача 3. После повышения температуры на 15 К давление газа в закрытом баллоне увеличилось на 3 %. Какой была начальная температура?
Анализ условия. В задаче описано изменение состояния газа. За неимением другой информации будем применять модель идеального газа. Речь идет о закрытом баллоне. Это значит, во-первых, что масса газа постоянна, а, во-вторых, баллоны обычно жесткие, значит, и объем не изменяется. Поэтому можем описать процесс как изохорный.
Поэтому можем описать процесс как изохорный.
Физическая часть решения. Запишем уравнение для изохорного процесса:
Перепишем условие в математическом виде, чтобы можно было подставлять в уравнение. Температура увеличилась на 15 К, значит,.
А давление увеличилось на 3 %, это по-другому можно записать:
Физика здесь закончилась на выборе закона, которым описывать процесс, осталось подставить переписанные величины и решить уравнение:
Нашли начальную температуру, она равна 500 К. Или, в более привычных для нас градусах Цельсия, 227 ˚С.
Часто бывает удобно выразить зависимость одного параметра от другого в виде графиков. Это наглядно, помогает лучше представить себе процесс, а иногда по графикам можно оценить численные значения. Начертим графики зависимостей параметров газа и разберемся, какую информацию можно из них получить. Начнем с изотермического процесса, .
Чтобы начертить график зависимости давления от объема, нужно переписать уравнение в виде :
Это обратно пропорциональная зависимость типа , и ее график имеет вид гиперболы (см. рис. 3).
рис. 3).
Рис. 3. Изотермический процесс на графике зависимости давления от температуры
От константы зависит расположение кривой: чем больше константа, тем выше располагается график. А вы помните, что константа содержит температуру, в промежуточном варианте уравнение выглядело так:
Так что если у нас есть две изотермы для одной и той же массы газа, значит, каждая изотерма описывает процесс, при котором температура постоянна. Но в первом случае эта постоянная температура равна , которая меньше, чем постоянная температура во втором случае (см. рис. 3).
Графики двух остальных изопроцессов мы будем рассматривать в координатах и , поэтому сразу рассмотрим и изотермический процесс в этих координатах. Начертим график (см. рис. 4) изотермы в координатах .
Рис. 4. Изотермический процесс на графике зависимости
Температура не меняется, значит, графики будут перпендикулярны оси Т, а объем при этой температуре приобретает разные значения.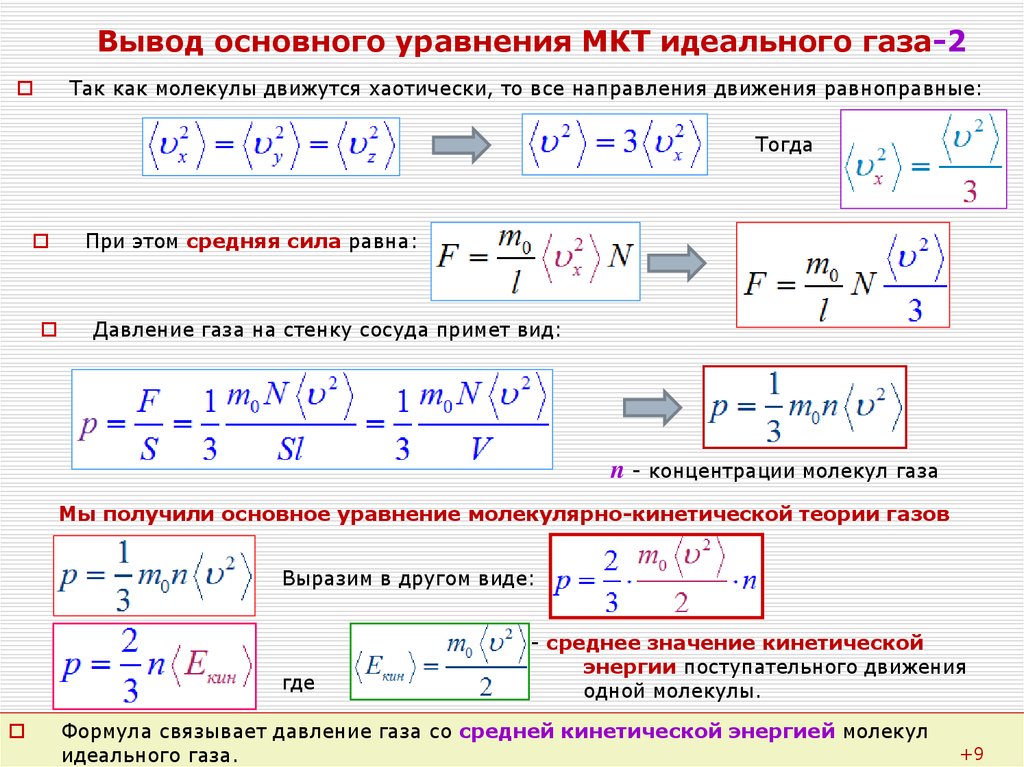 И легко определить по оси Т, какая изотерма соответствует большей температуре. На этом графике не видно, как изменяется давление, но мы понимаем, что давление увеличивается при уменьшении объема, что соответствует движению точки на графике вниз.
И легко определить по оси Т, какая изотерма соответствует большей температуре. На этом графике не видно, как изменяется давление, но мы понимаем, что давление увеличивается при уменьшении объема, что соответствует движению точки на графике вниз.
Аналогично выглядят графики изотермического процесса в координатах : температура постоянна, температура для второго процесса больше, чем для первого. А давление изменяется при изменении объема, которого на графике явно не видно, но можно понять по изменению давления (см. рис. 5).
Рис. 5. Изотермический процесс на графике зависимости
Теперь рассмотрим изобарный процесс.
Представим в виде зависимости :
Это прямо пропорциональная зависимость вида , ее график – прямая, которая начинается в точке начала координат (см. рис. 6).
Рис. 6. График зависимости для изобарного процесса
Коэффициентом перед определяется крутизна графика. Там у нас стоит константа, которая содержит давление, вспомните промежуточное уравнение, полученное из уравнения Клапейрона:
Там давление в числителе, поэтому чем больше давление, тем меньше коэффициент пропорциональности на графике и тем ниже располагается график. Поэтому у двух процессов, происходящих с одной и той же массой газа при разных давлениях: .
Поэтому у двух процессов, происходящих с одной и той же массой газа при разных давлениях: .
Рис. 7. График зависимости для двух изобарных процессов при разных давлениях
Начертим графики изобары в двух других системах координат. В координатах найдем на оси нужное нам давление и горизонтальной прямой покажем, что при любом изменении объема оно не изменяется. При другом давлении это будет такая же прямая, только выше или ниже (см. рис. 8).
Рис. 8. Графики зависимости и для изобарного процесса
Аналогично выглядят графики изобар в координатах : при любом значении температуры давление остается постоянным.
И последним рассмотрим изохорный процесс:
Представим в виде зависимости :
Это тоже прямо пропорциональная зависимость вида , с графиком – прямой, крутизна которой определяется коэффициентом перед переменной , а в нашем случае – .
Рис. 9. График зависимости для изохорного процесса
Этот коэффициент определяется объемом, при котором протекает изохорный процесс, и чем объем меньше, тем коэффициент больше и график круче:
Графики, описывающие изохорные процессы при разных объемах, в координатах и , начертите самостоятельно. И напоследок поговорим о границах применимости моделей.
И напоследок поговорим о границах применимости моделей.
Мы подробно обсудили, что в реальности нельзя абсолютно точно сохранять неизменными температуру, давление или объем при изопроцессах. Но даже в этом приближении модель работает с ограничениями. В уравнение, например , мы можем подставить любое значение температуры и получить соответствующее значение объема. Но вспомните: мы изначально всю эту модель строили на модели идеального газа. Это работает при привычных нам температурах, близких к комнатной, и более высоких, используемых в технике, и при давлениях, близких к атмосферному.
Но реальный газ нельзя, например, охлаждать до сколь угодно малых температур, чтобы он сжимался до сколь угодно малого объема. В какой-то момент размеры молекул не будут уже пренебрежимо малыми по сравнению с расстояниями между ними, а это уже не описывается моделью идеального газа. Усилится взаимодействие между молекулами, которым мы изначально пренебрегли, и газ перейдет в состояние жидкости (см. рис. 9).
рис. 9).
Рис. 9. Границы применимости модели идеального газа
Конечно, это не значит, что физика здесь больше не работает. Если нужно рассмотреть состояние жидкости, это тоже можно сделать: у нее тоже можно измерить температуру, рассмотреть изменение объеме при сжатии – оно будет небольшим. Только это будет другая модель с другими инструментами ее описания.
Список литературы
- Г.Я. Мякишев, Б.Б. Буховцев, Н.Н. Сотский. Физика 10. – М.: Просвещение, 2008.
- Касьянов В.А. Физика 10. – М.: Дрофа, 2000.
- М.М. Балашов, А.И. Гомонова, А.Б. Долицкий и др. Физика: Механика 10. – М.: Дрофа, 2004.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал Класс!ная физика
- Интернет-портал Класс!ная физика
Домашнее задание
- Начертите по памяти и объясните графики, описывающие изохорные процессы при разных объемах, в координатах и .

- До какой температуры нужно изобарически охладить некоторую массу газа с начальной температурой 40 ˚С, чтобы объем газа уменьшился при этом на одну четверть?
11.9: Закон идеального газа: давление, объем, температура и моли
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 182717
Цели обучения
- Объяснить закон идеального газа.
Для ряда химических реакций требуется аммиак. Чтобы эффективно провести реакцию, нам нужно знать, сколько аммиака у нас есть для стехиометрических целей. Используя газовые законы, мы можем определить количество молей, присутствующих в резервуаре, если мы знаем объем, температуру и давление в системе.
Закон идеального газа
Закон комбинированного газа показывает, что давление газа обратно пропорционально объему и прямо пропорционально температуре. Закон Авогадро показывает, что объем или давление прямо пропорциональны количеству молей газа. Объединив их, мы получим следующее уравнение:
\[\dfrac{P_1 \times V_1}{T_1 \times n_1} = \dfrac{P_2 \times V_2}{T_2 \times n_2} \nonumber \]
Как и в случае с другими газовыми законами, мы также можем сказать что \(\dfrac{\left( P \times V \right)}{\left( T \times n \right)}\) равно константе. Константу можно оценить, если описываемый газ считать идеальным.
Закон идеального газа представляет собой единое уравнение, связывающее давление, объем, температуру и количество молей идеального газа. Если мы заменим в переменной \(R\) константу, уравнение примет вид:
\[\dfrac{P \times V}{T \times n} = R \nonumber \]
Закон идеального газа удобно перестроить, чтобы он выглядел следующим образом, с опущенными знаками умножения:
\[PV = nRT \nonumber \]
Переменная \(R\) в уравнении называется постоянной идеального газа .
Оценка постоянной идеального газа
Значение \(R\), постоянной идеального газа, зависит от единиц измерения, выбранных для давления, температуры и объема в уравнении идеального газа. Для температуры необходимо использовать кельвины, а для объема принято использовать литры в системе СИ. Однако давление обычно измеряется в одной из трех единиц: \(\text{кПа}\), \(\text{атм}\) или \(\text{мм} \: \ce{Hg}\). Следовательно, \(R\) может иметь три различных значения.
Мы покажем, как рассчитывается \(R\), когда давление измеряется в \(\text{кПа}\). Объем \(1,00 \: \text{моль}\) любого газа при STP (стандартная температура, 273,15 К и давление, 1 атм) измерен как \(22,414 \: \text{L}\) . Мы можем заменить \(101,325 \: \text{kPa}\) для давления, \(22,414 \: \text{L}\) для объема и \(273,15 \: \text{K}\) для температуры в уравнение идеального газа и решить относительно \(R\).
\[\begin{align*} R &= \dfrac{PV}{nT} \\[4pt] &= \dfrac{101,325 \: \text{кПа} \times 22,414 \: \text{L}} {1. 000 \: \text{моль} \times 273,15 \: \text{K}} \\[4pt] &= 8,314 \: \text{кПа} \cdot \text{L/K} \cdot \text{моль } \end{align*} \nonumber \]
000 \: \text{моль} \times 273,15 \: \text{K}} \\[4pt] &= 8,314 \: \text{кПа} \cdot \text{L/K} \cdot \text{моль } \end{align*} \nonumber \]
Это значение \(R\), которое должно использоваться в уравнении идеального газа, когда давление указано в \(\text{кПа}\). В таблице ниже показана сводка этого и других возможных значений \(R\). Важно выбрать правильное значение \(R\) для использования в данной задаче.
| Единица \(P\) | Единица \(В\) | Единица \(n\) | Единица \(Т\) | Значение и единица \(R\) |
|---|---|---|---|---|
| \(\текст{кПа}\) | \(\текст{L}\) | \(\текст{моль}\) | \(\текст{К}\) | \(8,314 \: \text{J/K} \cdot \text{моль}\) |
| \(\текст{атм}\) | \(\текст{L}\) | \(\текст{моль}\) | \(\текст{К}\) | \(0,08206 \: \text{L} \cdot \text{атм/K} \cdot \text{моль}\) |
| \(\text{мм} \: \ce{Hg}\) | \(\текст{L}\) | \(\текст{моль}\) | \(\текст{К}\) | \(62,36 \: \text{L} \cdot \text{мм} \: \ce{Hg}/\text{K} \cdot \text{mol}\) |
Обратите внимание, что единица измерения \(R\) при давлении в \(\text{кПа}\) была изменена на \(\text{Дж/К} \cdot \text{моль}\) . Килопаскаль, умноженный на литр, равен единице энергии в СИ, джоулю \(\left( \text{J} \right)\). 9\text{o} \text{C} = 292 \: \text{K}\)
Килопаскаль, умноженный на литр, равен единице энергии в СИ, джоулю \(\left( \text{J} \right)\). 9\text{o} \text{C} = 292 \: \text{K}\)
Масса \(\ce{O_2} = 3,76 \: \text{g}\)
Найти: В = ? Л
\(\ce{O_2} = 32,00 \: \text{г/моль}\)
\(R = 8,314 \: \text{Дж/К} \cdot \text{моль}\)
- Сначала определите количество молей O 2 по данной массе и молярной массе.
- Затем перестройте уравнение алгебраически, чтобы решить для V
\[V = \dfrac{nRT}{P} \номер\]

1.
\[3,76 \: \cancel{\text{g}} \times \dfrac{1 \: \text{mol} \: \ce{O_2}}{32,00 \: \cancel{\text{g}} \ : \ce{O_2}} = 0,1175 \: \text{моль} \: \ce{O_2} \nonumber \]
2. Теперь подставьте известные величины в уравнение и решите.
\[V = \dfrac{nRT}{P} = \dfrac{0,1175 \: \cancel{\text{моль}} \times 8,314 \: \cancel{\text{J/K}} \cdot \cancel{ \text{моль}} \times 292 \: \cancel{\text{K}}}{88,4 \: \cancel{\text{кПа}}} = 3,23 \: \text{L} \: \ce{O_2 } \номер \]

Пример \(\PageIndex{2}\): газообразный аргон
Образец аргона массой 4,22 моль имеет давление 1,21 атм и температуру 34°C. Каков его объем?
Решение
| Действия по устранению неполадок | |
|---|---|
| Определите «данную» информацию и то, что проблема просит вас «найти». | Дано: n = 4,22 моль P = 1,21 атм Т = 34°С Найти: В = ? Л |
| Перечислите другие известные количества. | нет |
Спланируйте задачу. | 1. Первый шаг — перевести температуру в градусы Кельвина. 2. Затем перестройте уравнение алгебраически, чтобы решить для V \[V = \dfrac{nRT}{P} \номер\] |
| Рассчитать. | 1. 34 + 273 = 307 К 2. Теперь подставьте известные величины в уравнение и решите. \[ \begin{align*} V&=\dfrac{(4,22\, \cancel{mol})(0,08205\dfrac{L.\cancel{atm}}{\cancel{mol.K}})(307\ , \cancel{K)}}{1.21\cancel{atm}} \\[4pt] &= 87,9 \,L \end{align*} \] |
| Подумайте о своем результате. | Количество молей Ar велико, поэтому ожидаемый объем также должен быть большим. |
Упражнение \(\PageIndex{1}\)
Образец O 2 массой 0,0997 моль имеет давление 0,692 атм и температуру 333 К. Каков его объем?
Каков его объем?
- Ответить
3,94 л
Упражнение \(\PageIndex{2}\)
Для образца 0,00554 моль H 2 , P = 23,44 торр и T = 557 К. Каков его объем?
- Ответить
8,21 л
Резюме
- Закон идеального газа представляет собой единое уравнение, связывающее давление, объем, температуру и количество молей идеального газа.
11.9: Закон об идеальном газе: давление, объем, температура и моли распространяется по незаявленной лицензии и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Включено
- да
- Теги
- источник-хим-47539
Связь между давлением и температурой
24 апреля 2018 г.
от Lakna
Чтение через 4 мин.
Связь между давлением и температурой газа определяется законом Гей-Люссака о давлении и температуре. Этот закон гласит, что давление (P) фиксированной массы газа при постоянном объеме прямо пропорционально его температуре по Кельвину (T). Следовательно, когда давление в конкретной системе повышается, температура этой системы также повышается, и наоборот. Газовые законы описывают поведение газов в зависимости от давления, объема, температуры и количества. Газы — одно из состояний вещества, либо очень сильно сжатое, либо расширенное, чтобы заполнить большое пространство.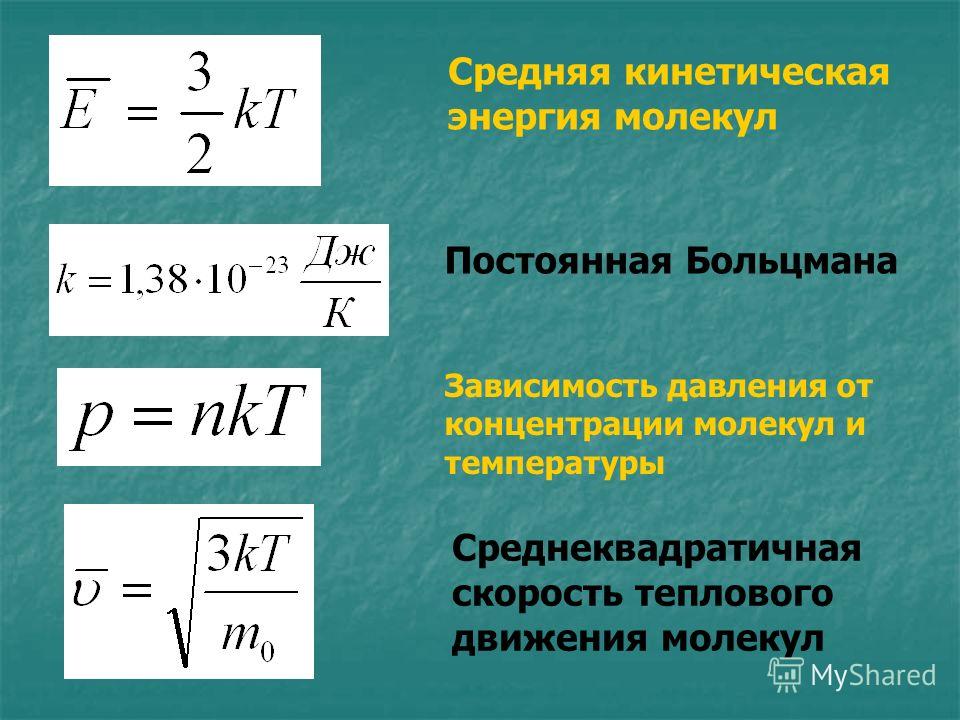
Ключевые области, покрытые
1. Каково давление
– Определение, давление газа
2. Что такое температура
– определение, измерение
3. Связаны с давлением и связями между отношениями и знакомыми и значениями. Температура
– Закон Гей-Люссака
Ключевые термины: Газ, Закон Гей-Люссака, Кельвин, Давление, Температура в контакте с ним. Он рассчитывается как сила, приходящаяся на единицу площади. Когда рассматривается закрытая газовая камера, окруженная вакуумом, давление, оказываемое газом на стенки камеры, зависит от трех факторов. Это количество газа в камере, объем камеры и температура газа. Когда другие параметры постоянны, давление внутри камеры прямо пропорционально количеству газа в камере; обратно пропорциональна объему камеры; она прямо пропорциональна температуре газа внутри камеры. Давление определяется в Рисунок 1.
Рисунок 1: Давление
Атмосферное давление создается весом воздуха над нами.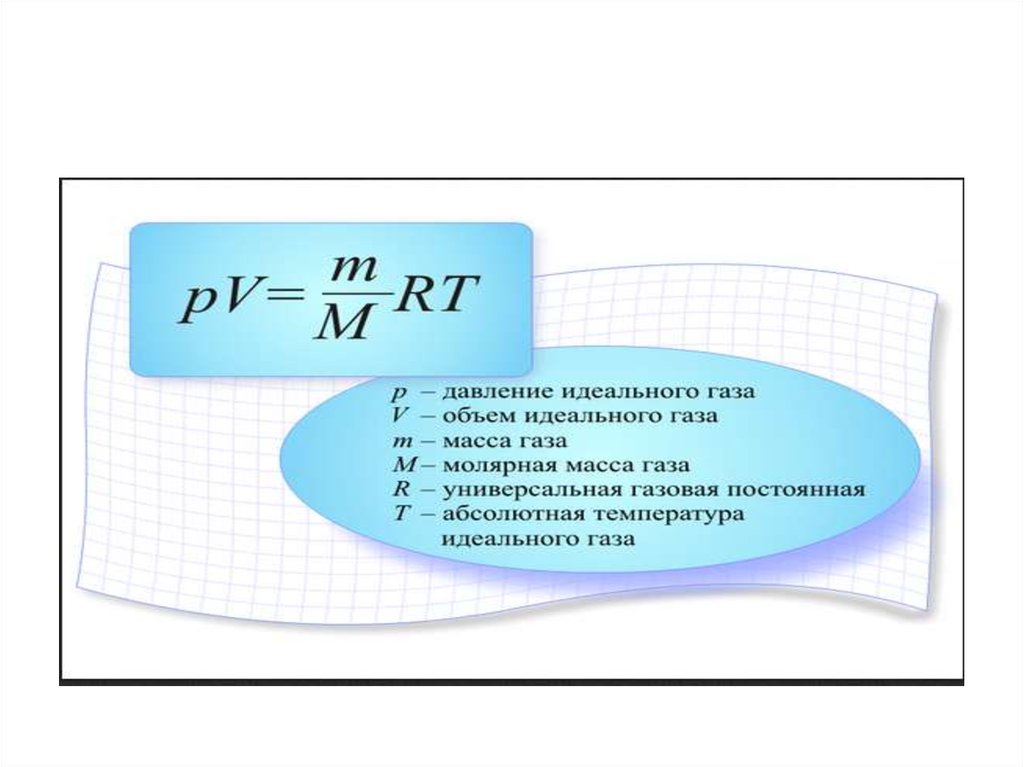 На уровне моря это 10 5 Па.
На уровне моря это 10 5 Па.
Что такое температура
Температура – это степень нагревания вещества или объекта. Он представляет собой внутреннюю энергию, содержащуюся в конкретной системе. Температуру можно измерить термометром, который откалиброван в различных единицах измерения. Шкала Цельсия является наиболее широко используемой шкалой для измерения температуры, которая обозначается в °C. Единицей измерения температуры в Международной системе единиц (СИ) является кельвин (К). Термометр изображен на рис. 2.
Рис. 2: Термометр
При самой низкой теоретической температуре, равной абсолютному нулю, тепловое движение частиц в веществе минимально. Абсолютный ноль равен 0 К, а это -273,14 °С.
Какая связь между давлением и температурой
Связь между давлением и температурой описывается применительно к газам. Закон Гей-Люссака — это газовый закон, описывающий зависимость давления от температуры. В нем говорится, что при постоянном объеме давление данного количества определенного газа прямо пропорционально его температуре по Кельвину. Можно записать так:
Можно записать так:
- П ∝ Т или
- P/T = k, где k — константа, или
- P 1 /T 1 = P 2 /T 2
Рисунок 3: Зависимость между давлением и температурой
При повышении температуры в конкретной системе молекулы газа движутся быстрее, оказывая большее давление на стенки газового баллона. Это в плане увеличивает давление в системе. Если температура системы снижается, давление падает. Следовательно, при постоянном объеме давление конкретного газа прямо пропорционально температуре.
Заключение
Давление данного количества газа прямо пропорционально температуре данного объема. При повышении температуры в системе повышается и давление, и наоборот. Связь между давлением и температурой газа определяется законом Гей-Люссака.
Ссылка:
1. «9.2 Соотношение давления, объема, количества и температуры: закон идеального газа». Химия , Доступно здесь.



 е в считающее устройство должна подаваться информация с дополнительного датчика температуры.
е в считающее устройство должна подаваться информация с дополнительного датчика температуры.