Давление идеального газа – формула, примеры, уравнение и определение кратко (10 класс)
4.5
Средняя оценка: 4.5
Всего получено оценок: 73.
Обновлено 6 Августа, 2021
4.5
Средняя оценка: 4.5
Всего получено оценок: 73.
Обновлено 6 Августа, 2021
Из курса физики 10 класса известно, что газ — это состояние вещества, в котором беспорядочно движущиеся молекулы слабо связаны друг с другом. В отсутствие внешних сил они стремятся равномерно распределиться по всей предоставленной ёмкости. При этом молекулы сталкиваются друг с другом и со стенками, сила их соударений складывается в постоянное давление. Кратко рассмотрим эту тему, выведем формулу давления газа.
Идеальный газ
Точное описание взаимодействия отдельных молекул в газе — достаточно сложная физическая задача. Однако давление газа создаётся ударами огромного их числа, поэтому появляется возможность создания некоторой «усреднённой» модели вещества в газообразном состоянии, которая, тем не менее, позволяет достаточно точно рассчитывать такие макроскопические параметры газа, как температура и давление.
Такой моделью является идеальный газ.
Определение идеального газа включает следующие условия:
- он состоит из молекул, представляющих собой материальные точки;
- молекулы никак не взаимодействуют между собой;
- движение молекул хаотично и подчиняется законам ньютоновской механики;
- соударения между молекулами абсолютно упругие, то есть сумма кинетических энергий молекул при столкновении не меняется.
В реальных газах, строго говоря, ни одно из этих условий не выполняется. Однако с достаточной степенью точности примером идеального газа можно считать воздух и отдельные газы, входящие в его состав при нормальных условиях (давление порядка атмосферного и температура порядка 300 К).
Давление идеального газа
Для вывода формулы давления идеального газа представим идеальный газ, молекулы которого имеют массу $m_0$ и среднюю скорость $v_{ср}$. В результате соударения эта скорость меняет направление на противоположное.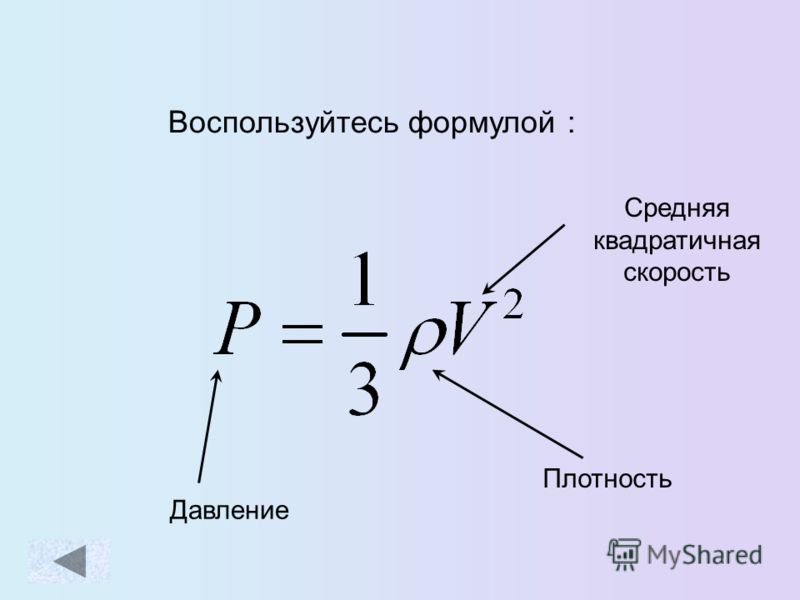 2\over 2}$$
2\over 2}$$
А значит, формула давления может быть преобразована к виду:
$$p={2\over 3}nE_{ср}$$
Отметим, что скорость и средняя кинетическая энергия молекулы прямо пропорциональны температуре. Поэтому в полученную формулу неявно входит и температура газа.
Что мы узнали?
Идеальный газ — это упрощённая модель вещества в газообразном состоянии. Реальные газы хорошо описываются этой моделью в нормальных условиях. Давление идеального газа создаётся в результате ударов отдельных молекул, оно пропорционально концентрации молекул газа и средней кинетической энергии молекулы.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 73.
А какая ваша оценка?
что это, единица измерения, от чего зависит, как вычислить, формулы МКТ
- Давление газа — что это за параметр
- Причина возникновения давления в газах
- Формула давления идеального газа из молекулярно-кинетической теории
- Второй способ записи основного уравнения МКТ
- Давление газа — что это за параметр
- Причина возникновения давления в газах
- Формула давления идеального газа из молекулярно-кинетической теории
- Второй способ записи основного уравнения МКТ
Давление газа — что это за параметр
Давление в физике представляет собой один из трех ключевых термодинамических макроскопических характеристик для измерения любой газовой системы.
Определение
Газ — это одно из четырех, включая плазму, агрегатных состояний материи, характеризующееся очень слабыми связями между составляющими его частицами, а также их большой подвижностью.
В газообразной среде частицы в определенной концентрации расположены не упорядоченно и перемещаются в хаотичном порядке в разных направлениях с одинаковой вероятностью. Подобное строение не позволяет газам сохранять стабильность объема и формы даже при малом внешнем силовом воздействии. Для любого газа, включая одноатомный, значение средней кинетической энергии его частиц в виде атомов и молекул будет превышать энергию межмолекулярного взаимодействия между ними.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Кроме того, расстояние, на которое удалены частицы, значительно превышает их собственные размеры. В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде
В том случае, когда молекулярными взаимодействиями и габаритами частиц допускается пренебрегать, газ считают идеальным. Для такой формы материи характерен только один тип внутреннего взаимодействия в виде
Примечание
По этой причине в идеальной газовой среде можно наблюдать лишь столкновения частиц со стенками сосуда. Какой-либо реальный газ с хорошей точностью можно отнести к идеальному, когда их температура выше, чем комнатная, а давление несущественно больше, чем атмосферное.
Причина возникновения давления в газах
Давление газа нельзя объяснить теми же причинами, что и давление твердого тела на опору. Расстояние, на которое удалены молекулы газообразной среды, существенно больше. В результате хаотичного движения они сталкиваются между собой и со стенками сосуда, который они занимают. Давление газа на стенки сосуда и вызвано ударами его молекул.
Давление газа на стенки сосуда и вызвано ударами его молекул.
Данный параметр увеличивается по мере того, как нарастает сила ударов молекул о стенки. Газ характеризуется одинаковым давлением во всех направлениях, которое является следствием хаотичного движения огромного числа молекул.
Примечание
Важно отметить, что газ оказывает давление на дно и стенки сосуда, объем которого он занимает, во всех направления равномерно. В связи с этим, воздушный шарик сохраняет форму, несмотря на то, что его оболочка достаточно эластична.
Перед тем как транспортировать или отправить на хранение газообразные вещества, их сильно сжимают. В этом случае давление газа увеличивается. Его помещают в специальные баллоны из стали высокой прочности. Такие емкости необходимы для хранения сжатого воздуха на подводных лодках и кислорода, предназначенного для сварки металлов.
Свойства давления газа:
- Если объем уменьшается, то давление газа возрастает, а во время увеличения объема, давление будет снижаться при постоянных величинах массы и температуры вещества.

- Газ, находящийся в закрытом сосуде, характеризуется давлением, которое возрастает по мере увеличения температуры вещества при условии постоянства его массы и объема.
- В том случае, когда масса газа увеличивается, его давление также будет возрастать и наоборот.
Запись формул для определения давления газа начинают с выяснения причин, по которым оно возникает в рассматриваемой системе. Исходя из физического смысла, давление представляет собой величину, равную отношению силы, перпендикулярно воздействующей на некоторое основание, к площади этого основания:
\(P=\frac{F}{S}\)
Как было отмечено ранее, для идеальной газовой системы характерен лишь один тип взаимодействия — это абсолютно упругие столкновения. В процессе частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. В данном случае применим второй закон Ньютона:
\(F*Δt = Δp\)
Таким образом, конкретно сила F является причиной формирования давления на стенки сосуда. Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Данная величина F, производимая одной частицей, незначительна. Однако, когда количество частиц огромно, они в совокупности создают ощутимый эффект, проявляемый в виде наличия давления в сосуде.
Формула давления идеального газа из молекулярно-кинетической теории
Объяснение концепции идеального газа построено на основных положениях молекулярно-кинетической теории, которая вытекает из принципов статистической механики. Наука получила активное развитие во второй половине XIX, благодаря таким ученым, как Джеймс Максвелл и Людвиг Больцман. Основы дисциплины были заложены еще Бернулли в первой половине XVIII века.
Исходя из статистики Максвелла-Больцмана, все частицы в системе обладают разными скоростями движения. При этом можно наблюдать небольшой процент частиц со скоростями, приближенными к нулю, и малую долю частиц, обладающих огромной скоростью. Средняя квадратичная скорость в этом случае будет соответствовать некоторой величине, не изменяющейся с течением времени.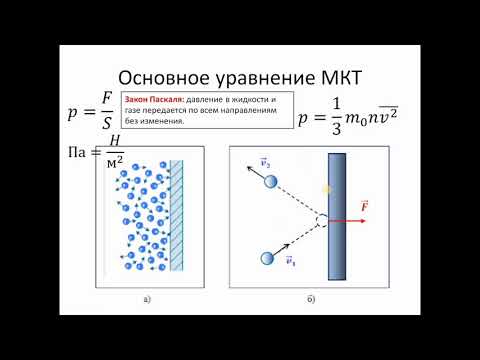 {2}}{3*V}\)
{2}}{3*V}\)
где N является количеством частиц в системе; V обозначает объем; v представляет собой среднюю квадратичную скорость; m является массой одной частицы.
При наличии указанных в формуле параметров, выраженных в единицах СИ, можно вычислить давление газа в сосуде.
Второй способ записи основного уравнения МКТ
Определение
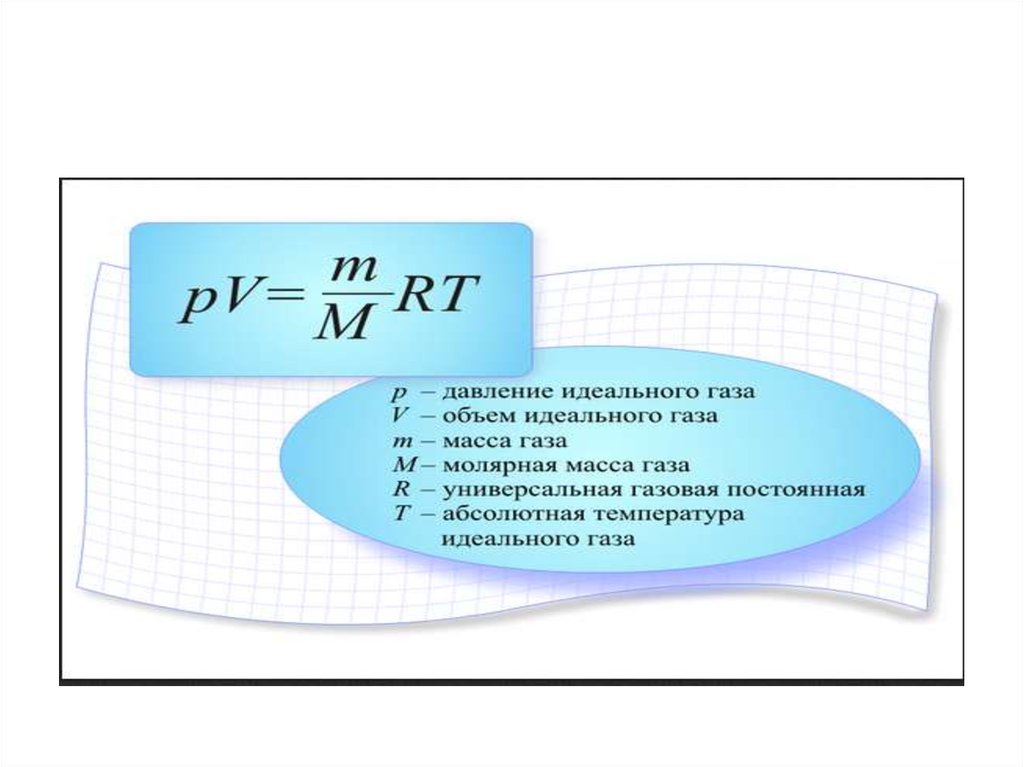
В середине 30-х годов XIX столетия французскому инженеру Эмилю Клапейрону удалось обобщить накопленный до этого времени экспериментальный опыт изучения поведения газов во время разнообразных изопроцессов и получить формулу, которую в будущем назвали универсальным уравнением состояния идеального газа:
\(P*V = n*R*T \)
n является количеством вещества в молях; T представляет собой температуру по абсолютной шкале и обозначается в кельвинах.
Величина R является универсальной газовой постоянной. Этот термин был введен в уравнение русским химиком Д.И. Менделеевым. Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
Исходя из этого, запись уравнения называют законом Клапейрона-Менделеева.
Определение
С помощью данного выражения можно определить формулу для расчета давления газа:
\(P=\frac{n*R*T}{V}\)
Полученное уравнение объясняет линейный рост давления при увеличении температуры в условиях стабильности объема. Если объем уменьшается с сохранением температуры, то давление увеличивается по гиперболе. Данные закономерности явления отражены в законах Гей-Люссака и Бойля-Мариотта.
Сравнивая представленное выражение с записью формулы, которая вытекает из положений молекулярно-кинетической теории, можно установить связь кинетической энергии одной частицы, либо системы в общем, и абсолютной температуры.
Важно отметить, что при расчетах с использованием формулы для Р, вытекающей из уравнения Клапейрона, связь с химическим составом газа отсутствует. Если давление определяют с помощью выражения, согласно понятию молекулярно-кинетической теории, то данную связь следует учитывать в виде параметра m. {2}}{3*V}\)
{2}}{3*V}\)
Таким образом, удельный объем сосуда в кубических метрах равен 0,01. Молярная масса молекулы кислорода М составляет 0,032 кг/моль. Данные параметры можно подставить в уравнение вместе со скоростью и количеством вещества. Тогда Р = 533333 Па, что представляет собой давление в 5,3 атмосферы.
Насколько полезной была для вас статья?
Рейтинг: 4.00 (Голосов: 4)
Поиск по содержимому
Калькулятор давления идеального газа
Создано Кришной Нелатуру
Отредактировано Аденой Бенн
Последнее обновление: 12 февраля 2023 г.
Содержание:- Что такое закон идеального газа?
- Как рассчитать давление, используя закон идеального газа?
- Как пользоваться калькулятором идеального давления газа?
- Другие соответствующие калькуляторы
- Часто задаваемые вопросы
Наш калькулятор давления идеального газа поможет вам рассчитать давление с помощью закон идеального газа . Если вам интересно узнать об идеальном газе или о том, где применяется этот закон, вы обратились по адресу. В этой статье мы кратко рассмотрим закон идеального газа и как рассчитать давление, используя закон идеального газа.
Если вам интересно узнать об идеальном газе или о том, где применяется этот закон, вы обратились по адресу. В этой статье мы кратко рассмотрим закон идеального газа и как рассчитать давление, используя закон идеального газа.
Что такое закон идеального газа?
идеальный газ – это теоретический газ , состоящий из точечных частиц с отсутствием межмолекулярных сил . Любые столкновения между частицами газа должны быть идеально эластичный . Это соображение дает значительное математическое преимущество, так как закон идеального газа описывает взаимосвязь между давлением, температурой и объемом газа:
pV=nRTpV = nRTpV=nRT
Где: идеальный газ;

Некоторые реальные газы можно считать идеальными при стандартной температуре и давлении (STP). Газы демонстрируют идеальное поведение при более высоких температурах и более низких давлениях, поскольку кинетическая энергия частиц будет достаточно высокой, чтобы можно было пренебречь межмолекулярными силами.
Как рассчитать давление, используя закон идеального газа?
Чтобы рассчитать давление газа по закону идеального газа, выполните следующие действия:
- Умножьте температуру газа в Кельвинах на количество молей частиц в газе.
- Умножьте этот результат на на постоянную идеального газа , которая равна 8,314 Дж∙К -1 ∙моль -1 .
- Разделите этого результата на объем газа в кубических метрах, чтобы получить давление газа.
Как пользоваться калькулятором идеального давления газа?
Наш калькулятор идеального давления газа универсален и прост в использовании:
Вы можете ввести объем V , число молей n и температуру T , и этот инструмент автоматически рассчитает давление, используя закон идеального газа.

Вы можете нажать на кнопку расширенного режима
Другие соответствующие калькуляторы
У нас есть другие калькуляторы закона идеального газа, которые вы можете изучить:
- Калькулятор закона идеального газа;
- Калькулятор объема идеального газа; и
- Калькулятор температуры идеального газа.
Часто задаваемые вопросы
Каково давление 1 моля идеального газа, занимающего 10 литров при 25°C?
247,89 кПа или 2,47 бар . Чтобы рассчитать это значение вручную, выполните следующие действия:
- Умножьте температуру газа в Кельвинах (298,15 К) на количество молей (1 моль) частиц в газе, чтобы получить
298,15.
- Умножьте на постоянную идеального газа (8,314 Дж∙К -1 ∙моль -1 ), чтобы получить
298,15 × 8,314 = 2 478,8191 9 0122 . - Разделите этот результат на объем газа в кубических метрах, чтобы получить давление газа как
2 478,8191 × 1000/10 = 247,89 кПа. - Проверьте этот результат с помощью нашего калькулятора давления идеального газа.
Кришна Нелатуру
Объем (V)
Количество вещества (n)
моль
Температура (T)
Результат
9000 2 Давление (p)Ознакомьтесь с 43 похожими термодинамическими и тепловыми калькуляторами 🌡️
Число БиоФактор БольцманаЗакон Бойля… Еще 40
Калькулятор закона идеального газа
Created by Bogna Szyk
Отзыв Стивена Вудинга
Последнее обновление: 27 марта 2023 г.
Содержание:- Что такое идеальный газ?
- Уравнение закона идеального газа
- Постоянная идеального газа
- Часто задаваемые вопросы
Этот калькулятор закона идеального газа поможет вам установить свойства идеального газа в зависимости от давления, температуры или изменения объема . Читайте дальше, чтобы узнать о характеристиках идеального газа, как использовать уравнение закона идеального газа и определение постоянной идеального газа.
Читайте дальше, чтобы узнать о характеристиках идеального газа, как использовать уравнение закона идеального газа и определение постоянной идеального газа.
Мы также рекомендуем воспользоваться нашим калькулятором комбинированного газового закона для лучшего понимания основных термодинамических процессов идеальных газов.
Что такое идеальный газ?
Идеальный газ — это частный случай любого газа, удовлетворяющего следующим условиям:
Газ состоит из большого количества беспорядочно движущихся молекул.
Все молекулы являются точечными частицами (не занимают места).
Молекулы не взаимодействуют, за исключением столкновения.
Все столкновения между частицами газа являются абсолютно упругими (посетите наш калькулятор сохранения импульса, чтобы узнать больше).
Частицы подчиняются законам движения Ньютона.
Уравнение закона идеального газа
Все свойства идеального газа сводятся к одной формуле вида: ⋅Р⋅Т
где:
- ppp – давление газа, измеренное в Па;
- ВВВ – Объем газа, м³;
- nnn – количество вещества, измеренное в молях;
- RRR – постоянная идеального газа; и
- ТТТ – температура газа, измеряемая в кельвинах.

Чтобы найти любое из этих значений, просто введите другие значения в калькулятор закона идеального газа.
Например, если вы хотите рассчитать объем 40 молей газа при давлении 1013 гПа и температуре 250 К, результат будет равен:
В = nRT/p = 40 × 8,31446261815324 × 250 / 101300 = 0,82 м³ .
Постоянная идеального газа
Газовая постоянная (символ R) также называется молярной или универсальной постоянной. Он используется во многих фундаментальных уравнениях, таких как закон идеального газа.
Значение этой константы равно 8,31446261815324 Дж/(моль·К) .
Газовая постоянная часто определяется как произведение постоянной Больцмана k (которая связывает кинетическую энергию и температуру газа) и числа Авогадро (количество атомов в моле вещества): 9{-23} \text{ J/K})\\
&= 8,3144626 \text{ Дж/(моль}\! \cdot\! \text{К)}
\end{align*}R=NAk=(6,02214076×1023/моль)⋅(1,38064852×10−23 Дж/К)=8,3144626 Дж/(моль⋅К)
Вы можете найти это давление воздуха при Калькулятор высоты тоже полезен.
Часто задаваемые вопросы
Когда можно использовать закон идеального газа?
Вы можете применить закон об идеальном газе для любого газа с плотностью, достаточно низкой для предотвращения возникновения сильных межмолекулярных сил. В этих условиях любой газ более или менее правильно моделируется простым уравнением PV = nRT , который относится к давлению, температуре и объему.
Какова формула закона идеального газа?
Формула закона идеального газа:
PV = nRT
где:
-
P— Давление , в паскалях; -
V— Объем в кубических метрах; -
n— Количество родинок ; -
T— Температура в кельвинах; и -
R— Постоянная идеального газа .
Не забывайте использовать согласованные единицы измерения! Значение, обычно используемое для R , 8,314., относится к давлению, измеренному исключительно в паскалях.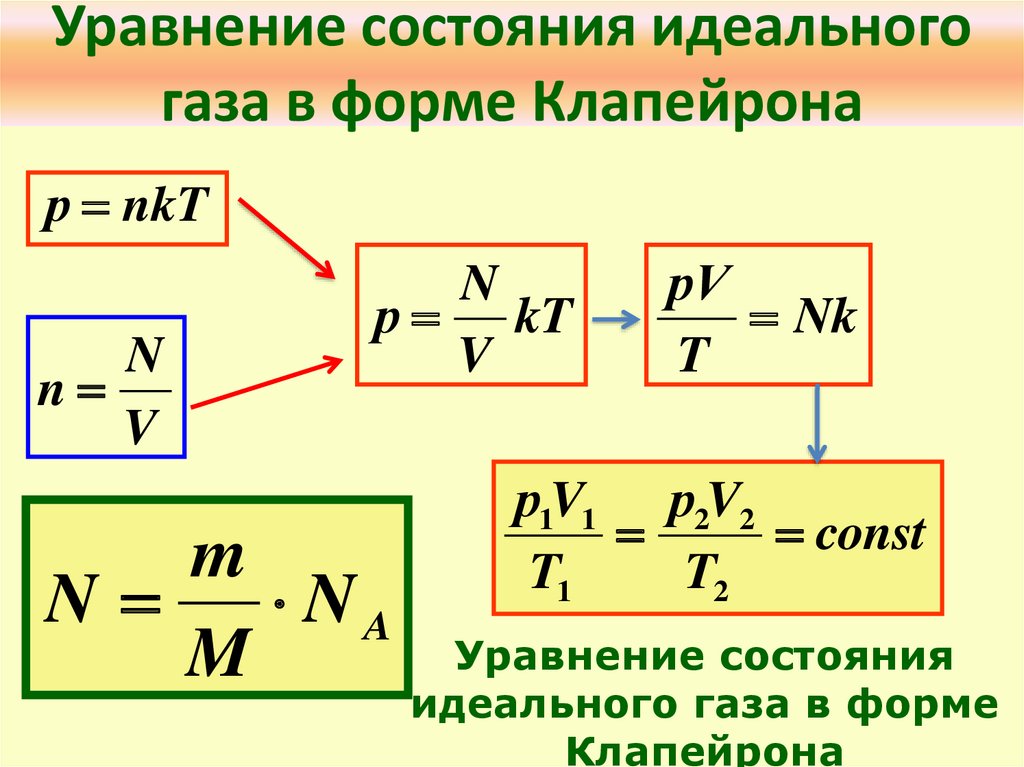 .. Дж·К/моль
.. Дж·К/моль
Каково давление 0,1 моля газа при 50 °C в кубическом метре?
268,7 Па или 0,00265 атм . Чтобы найти этот результат:
Преобразование температуры в кельвины:
Т [К] = 273,15 + 50 = 323,15 К.Вычислите произведение температуры, числа молей и газовой постоянной:
нРТ = 0,1 моль × 323,15 К × 8,3145 Дж·К/моль = 268,7 Дж(то есть энергия ).Разделите на объем. В этом случае объем равен
1, следовательно:P = 268,7 Па.
Какие три закона термодинамики можно выделить в законе идеального газа?
Закон идеального газа имеет четыре параметра . Одним из них является число молей, которое немного выходит за рамки термодинамики. Остальные три — это давление, температура и объем . Мы можем выделить три закона, зафиксировав по очереди каждый из трех:
Остальные три — это давление, температура и объем . Мы можем выделить три закона, зафиксировав по очереди каждый из трех:
- Зафиксировав температуру, мы найдем изотермическое превращение (или закон Бойля ):
PV = k. - Фиксируя объем, находим изохорное преобразование ( закон Шарля ):
P/T = k. - Зафиксировав давление, мы имеем изобарическое преобразование ( закон Гей-Люссака ):
V/T = k.
Как рассчитать температуру газа, зная количество молей, объем и давление?
Чтобы рассчитать температуру газа по давлению и объему, выполните следующие простые шаги:
Рассчитайте произведение давления на объем. Убедитесь, что вы используете одинаковые единицы измерения: хороший выбор — 9.0021 паскаль и кубический метр .
Рассчитайте произведение количества молей на газовую постоянную .