Как формировалась и менялась цена на газ в Европе
15 сентября 2021, 12:56
ТАСС-ДОСЬЕ. 15 сентября 2021 года цены на газ в Европе поставили очередной рекорд, они приблизились к $970 за 1 тыс. куб. м
ТАСС рассказывает об истории современных механизмов формирования газовых цен и об их динамике.
Механизмы ценообразования
Исторически с 1960-х годов, когда начались активное использование природного газа в качестве источника топлива и его экспортные поставки, в мире сложились две системы ценообразования на газ.
В Северной Америке наибольшее распространение получила конкурентная модель: газ продавался по цене, определяемой рынком.
В Европе же с 1960-х годов доминировала модель, основанная на долгосрочных экспортных газовых контрактах (ДСЭГК), которые предусматривали фиксированные договорные цены или их периодическую индексацию. Такие контракты заключались как при поставках сжиженного газа во Францию из Алжира (1964), так и при доставке этого топлива трубопроводами, например, из СССР в Австрию (1968) и Италию (1973) и из Норвегии в Центральную Европу (1977, 1985).
Фактически к 1990-м годам ДСЭГК были доминирующим способом определения цен на газ и сложилась их типичная формула: индексация в зависимости от биржевой цены на другие энергоносители – нефть, дизельное топливо или уголь. Также повсеместно внедрялся принцип “бери или плати”: покупатель должен был платить неустойку в случае недобора газа. Это было необходимо для обеспечения длительных и предсказуемых финансовых потоков от экспорта газа, необходимых для возврата средств, вложенных в строительство транспортной инфраструктуры.
Помимо ДСЭГК в Европе существовали также соглашения по поставкам газа в рамках бартерных схем. Однако они применялись, в основном, в 1970-1980-х годах при поставках из СССР в страны Восточной Европы и в 1990-2000-х годах при поставках в СНГ.
В 1986 году в Великобритании в рамках либеральных реформ, запущенных премьер-министром Маргарет Тэтчер, был ликвидирован газовый монополист, компания British Gas. После этого в стране были введены внутренние рыночные цены на газ. В 1998 году была построена газопроводная система “Интерконнектор”, которая позволила начать поставки природного газа из Великобритании в континентальную Европу. С самого начала они шли по рыночной модели. Тем не менее, до 2005 года доля конкурентного ценообразования на газ в Европе не превышала 15% от общих поставок и касалась, в основном, газа по “Интерконнектору, а также закупок сжиженного природного газа (СПГ).
В 1998 году была построена газопроводная система “Интерконнектор”, которая позволила начать поставки природного газа из Великобритании в континентальную Европу. С самого начала они шли по рыночной модели. Тем не менее, до 2005 года доля конкурентного ценообразования на газ в Европе не превышала 15% от общих поставок и касалась, в основном, газа по “Интерконнектору, а также закупок сжиженного природного газа (СПГ).
Ситуация изменилась после мирового финансового кризиса 2008-2009 годов, когда многие из импортеров газа оказались неспособны исполнять контрактные обязательства.
Рыночные цены на газ оказались значительно ниже зафиксированных по ДСЭГК. В этих условиях многие из европейских покупателей, а также страны СНГ потребовали пересмотреть ранее заключенные контракты или вовсе их расторгнуть, перейдя на конкурентные цены. В 2009 году российский “Газпром” договорился с рядом покупателей, в том числе компаниями из Италии, Германии, Австрии и Франции, о предоставлении скидок или снижении обязательных объемов по принципу “бери или плати”. Однако некоторые из импортеров при этом решили опротестовать контракты в арбитраже, добиваясь снижения закупочных цен. Как результат, в 2010-2011 годы “Газпром” отказался от дальнейших уступок и начал заключать или продлевать ДСЭГК на основе рыночных цен по желанию импортеров. Похожим образом поступили и другие крупные поставщики, в том числе Норвегия. Уже к середине 2010-х годов доля поставок на основе чисто рыночных цен или ориентированных на них контрактов достигла в Европе 70%. К маю 2021 года доля экспортных продаж “Газпрома”, привязанных к биржевым индексам и форвардным контрактам достигла 87%, лишь 13% импортеров продолжали привязывать цену к нефти.
Однако некоторые из импортеров при этом решили опротестовать контракты в арбитраже, добиваясь снижения закупочных цен. Как результат, в 2010-2011 годы “Газпром” отказался от дальнейших уступок и начал заключать или продлевать ДСЭГК на основе рыночных цен по желанию импортеров. Похожим образом поступили и другие крупные поставщики, в том числе Норвегия. Уже к середине 2010-х годов доля поставок на основе чисто рыночных цен или ориентированных на них контрактов достигла в Европе 70%. К маю 2021 года доля экспортных продаж “Газпрома”, привязанных к биржевым индексам и форвардным контрактам достигла 87%, лишь 13% импортеров продолжали привязывать цену к нефти.
Расчет газовых котировок, хабы
Единой рыночной цены на природный газ в мире и даже отдельно в Европе нет. Цены на биржах могут меняться разноправленно в зависимости от климатических условий, наполненности газохранилищ и других факторов. Также они далеко не всегда отражают реальные цены для импортеров.
В 1996-2016 годы рыночные цены на газ обычно определяли через электронную торговую площадку с точкой сдачи на виртуальном газовом хабе National Balancing Point (NBP, “Национальная балансовая точка”) в Великобритании. С 2016 года главным считается аналогичный хаб Title Transfer Facility (TTF, “Главный пункт перевода”) в Нидерландах. Торги на TTF производятся амстердамской биржей ICE-Endex Exchange, на NBP – Лондонской биржей ICE. Как на NBP, так и на TTF цена рассчитывается на основе фьючерсных контрактов, причем не в кубометрах за доллар, а в МВт·ч за фунт стерлинга или евро, то есть учитывается не физический объем газа, а электроэнергия, которую из него можно произвести. Помимо этого существуют и другие показатели цены, например, Федеральное управление экономики и экспортного контроля Германии фиксирует текущие цены природного газа, закупаемого в России.
С 2016 года главным считается аналогичный хаб Title Transfer Facility (TTF, “Главный пункт перевода”) в Нидерландах. Торги на TTF производятся амстердамской биржей ICE-Endex Exchange, на NBP – Лондонской биржей ICE. Как на NBP, так и на TTF цена рассчитывается на основе фьючерсных контрактов, причем не в кубометрах за доллар, а в МВт·ч за фунт стерлинга или евро, то есть учитывается не физический объем газа, а электроэнергия, которую из него можно произвести. Помимо этого существуют и другие показатели цены, например, Федеральное управление экономики и экспортного контроля Германии фиксирует текущие цены природного газа, закупаемого в России.
Динамика цен с 1996 года
Цены на газ для Европы на хабе NBP начали рассчитываться в конце 1996 года в преддверии начала поставок газа по “Интерконнектору”. Первоначально цена составляла $68 за 1 тыс. куб. м газа. В 2000 году цены выросли до $100 за 1 тыс. куб. м. Первый резкий скачок рыночных газовых цен в Европе произошел зимой 2005/2006 годов – с уровня около $200 до $480 за 1 тыс. куб. м газа. Вызван он был аномальными холодами в Западной Европе, снижением производства газа на британских шельфовых месторождениях и задержками с поставками СПГ. При этом цены российского газа на границе в Германии оставались стабильными – порядка $250 за 1 тыс. куб. м.
куб. м газа. Вызван он был аномальными холодами в Западной Европе, снижением производства газа на британских шельфовых месторождениях и задержками с поставками СПГ. При этом цены российского газа на границе в Германии оставались стабильными – порядка $250 за 1 тыс. куб. м.
Следующий скачок произошел летом 2008 года и совпал с ростом цен на нефть. На хабе NBP цены достигли $500 за 1 тыс. куб. м, а на немецкой границе российский газ стоил еще дороже – почти $600. Однако из-за начала экономического кризиса цены на газ перешли к падению, к осени 2009 года котировки на NBP опустились ниже уровня $100. При этом российский газ на немецкой границе стоил дороже – около $250 за 1 тыс. куб. м. Поскольку такой диспаритет цен наблюдался и у других импортеров, те потребовали пересмотра цен и в конце концов большинство из них сменили системы ценообразования в долгосрочных контрактах, привязав их к биржевым ценам, а не к нефти.
По мере преодоления последствий мирового финансового кризиса цены на хабе NBP восстановились к 2013-2014 годам до уровня $300-450 за 1 тыс. куб. м.
куб. м.
В 2015-2019 годы газовые котировки в Европе вели себя относительно предсказуемо, их динамика приблизительно соответствовала динамике цен на нефть. Зимой 2015/2016 годов на хабе TTF стоимость газа падала до уровня $140 1 тыс. куб. м, но затем снова колебалась в пределах $200-350.
Весной 2020 года из-за обвала цен на энергоресурсы, вызванного пандемией коронавируса, стоимость газа на TTF также упала, причем до рекордно малых величин – в мае 2020 года 1 тыс. куб. м стоила всего $34.
По мере восстановления мировой экономики из-за последствий локдаунов и стабилизации цен на нефть, достигнутой соглашениями ОПЕК+, цены на газ также начали расти. Уже в январе 2021 года цены на хабе TTF достигли $335 за 1 тыс. куб. м, вернувшись к уровню 2018 года. Уже тогда эксперты предупреждали о возможном продолжении этого роста, поскольку текущие биржевые цены на рынках Азии достигли $1000 за 1 тыс. куб. м, и экспортерам СПГ стало невыгодно отправлять продукцию в Европу. Весной европейские котировки снизились до уровня $250 за 1 тыс. куб. м.
куб. м.
Вновь рост начался в июле 2021 года. К концу месяца из-за низких запасов в европейских хранилищах, жаркой погоды, приведшей к росту потребления электроэнергии и снижению уровня воды в водохранилищах европейских ГЭС, а также конкуренции с Азией из-за СПГ цены на хабе TTF подскочили до $500. Следующий виток роста цен начался после пожара 5 августа на уренгойском заводе “Газпром переработка”, приведшему к снижению прокачки российского газа в Европу. К концу августа рыночные цены установили абсолютный рекорд – $600, 9 сентября преодолели отметку в $700, а 14 сентября – в $800 за 1 тыс. куб. м.
Веселящий газ
Закись азота всем известна как «веселящий газ». Закись азота (веселящий газ) – это первый в мире газ, который начали применять для наркоза. Сейчас его используют в медицине, в технических целях, в пищевой промышленности, а также для заполнения воздушных шаров. В медицине веселящий газ используется более 200 лет. Закись азота – это бесцветный газ, с приятным запахом и сладковатым привкусом, тяжелее воздуха, растворим в воде, при температуре ниже нуля и обычной комнатной температуре сжижается. Большой проблемой современного общества является то, что люди стали использовать веселящий газ для получения удовольствия.
Большой проблемой современного общества является то, что люди стали использовать веселящий газ для получения удовольствия.
Веселящий газ распространяется в клубах в шариках, реализуется в сети Интернет.
Продавцы веселящего газа убеждают нас в его безопасности, объясняя это тем, что он применяется даже в медицине. Соответственно, это «полезно». Люди начали употреблять его на вечеринках как средство, снимающее стресс, доставляющее удовольствие. Но никто не задумывается о вреде, который может причинить организму закись азота. В современной медицинской практике уже достаточно случаев отравления веселящим газом, удуший. К сожалению, в настоящее время законодательство не запрещает его приобретать и распространять, но каждый из нас обязан знать, что такое закись азота и как она влияет на здоровье человека.
Почему в медицинских целях применять закись азота можно, а использовать ее для получения удовольствия крайне опасно?
В медицинских целях закись азота используется как средство для ингаляционного наркоза в хирургии, как обезболивающее средство у тех, кому противопоказаны другие препараты, например, людям страдающим аллергией, а также в акушерской практике. Такая закись азота имеет высокую степень очистки от примесей. Во время операции веселящий газ вводят в организм человека дозированно, пропуская его через фильтры, обязательно закись азота разбавляется кислородом. 30% газа, 70% – кислород.
Такая закись азота имеет высокую степень очистки от примесей. Во время операции веселящий газ вводят в организм человека дозированно, пропуская его через фильтры, обязательно закись азота разбавляется кислородом. 30% газа, 70% – кислород.
Как веселящий газ действует на человека?
При вдыхании веселящего газа человек ощущает эйфорию, состояние радости, восторга, безудержный смех, убирает чувство тревоги, вызывает состояние похожее на опьянение. Так как быстро попадает в кровь, действует молниеносно. Длится этот эффект примерно 30 секунд.
Чем веселящий газ опасен для человека?
Один вдох этого газа может привести к серьезным психическим заболеваниям, сердечной недостаточности, бесплодию, а в случае повреждения головного мозга – смерть, может произойти в течение нескольких минут
· Попадая в организм человека, веселящий газ вызывает сильнейшую интоксикацию.
· Регулярное употребление закиси азота может вызвать дефицит витамина B12. Дефицит витамина В может привести к серьезному повреждению нервов.
Дефицит витамина В может привести к серьезному повреждению нервов.
· Воздействуя на клетки крови, вызывает анемию, которая проявляется слабостью и утомляемостью, снижает количество лейкоцитов, повышает восприимчивость организма к инфекционным заболеваниям.
· Закись азота угнетает дыхание. При накапливании вызывает асфиксию (удушье). Если закись азота вдыхается в ограниченном пространстве, это может вызвать внезапную смерть из-за недостатка кислорода.
· Вдыхание в чистом виде вызывает наркотическое опьянение, галлюцинации. В дальнейшем при систематическом употреблении веселящего газа развивается депрессия, бессонница, которые перерастают в агрессию.
· Даже при небольшой концентрации дезорганизует мыслительную деятельность, затрудняет работу мышц, угнетает зрение.
· Вызывает гипоксию (кислородное голодание), соответственно страдает сердечно-сосудистая система, почки, печень, центральная нервная система. Без кислорода клетки головного мозга необратимо отмирают через 2. 5 – 3 минуты.
5 – 3 минуты.
· Имеет накопительный эффект, образует некоторые соединения, которые накапливаются в костном мозге. Поражает спинной мозг. В будущем может обернуться параличом.
· При употреблении немедицинской закиси азота во время беременности, вызывает уродства у плода
· Так как газ холодный, возможно развитие ангины
· Как и любое вещество, вызывающее эйфорию, может вызвать зависимость. Веселящий газ формирует зависимость у каждого человека.
· При вдыхании большого количества газа может развиться эффект наркоза, который приведет к падению, которое может послужить причиной различных травм, ссадин, ушибов. Закись азота быстро приводит к полной потере двигательного контроля, после вдоха, у человека нарушается координация движения, он начинает качаться и падает.
Признаки употребления веселящего газа:
При краткосрочном применении:
Беспричинный смех, головокружение, частые головные боли, частые падения в обморок.
При долгосрочном применении:
Кратковременная потеря памяти, эмоциональная неустойчивость, нарушение мыслительных процессов, ухудшение слуха, осязания, шаткая походка, невнятная речь, постепенная атрофия языка.
Профилактика:
Для того чтобы сократить употребление веселящего газа среди молодежи, а также детей и подростков, необходимо разъяснить им вред и опасность этого увлечения. Родители должны проводить беседу с детьми, преподаватели должны уделить внимание этой теме на занятиях объяснить, что употребление веселящего газа по эффектам приравнивается к употреблению наркотиков, может привести к гибели. Самостоятельное употребление закиси азота без соответствующих показаний может вызвать серьезные проблемы со здоровьем. Каждый вдох веселящего газа может оказаться последним.
ЗАО ФОРМУЛА-ГАЗ, Москва (ИНН 7706207112), реквизиты, выписка из ЕГРЮЛ, адрес, почта, сайт, телефон, финансовые показатели
Обновить браузер
Обновить браузер
Возможности
Интеграция
О системе
Статистика
Контакты
CfDJ8No4r7_PxytLmCxRl2AprPpDnLU-OcX9q-qcbMtNvSp75dYpJh8v04AY4W56fdLALStCgSNwxBe2bNg9F7Z0xrZsuu-K1N5iAT-PlB2DCzKsfuTC1hz936_-wh0OnV48Glr3XeK0enMV3cAckKOmQSE
Описание поисковой системы
энциклопедия поиска
ИНН
ОГРН
Санкционные списки
Поиск компаний
Руководитель организации
Судебные дела
Проверка аффилированности
Исполнительные производства
Реквизиты организации
Сведения о бенефициарах
Расчетный счет организации
Оценка кредитных рисков
Проверка блокировки расчетного счета
Численность сотрудников
Уставной капитал организации
Проверка на банкротство
Дата регистрации
Проверка контрагента по ИНН
КПП
ОКПО
Тендеры и госзакупки
Юридический адрес
Анализ финансового состояния
Учредители организации
Бухгалтерская отчетность
ОКТМО
ОКВЭД
Сравнение компаний
Проверка лицензии
Выписка из ЕГРЮЛ
Анализ конкурентов
ОКОПФ
Сведения о регистрации
ОКФС
Филиалы и представительства
ОКОГУ
ОКАТО
Реестр недобросовестных поставщиков
Рейтинг компании
Проверь себя и контрагента
Должная осмотрительность
Банковские лицензии
Скоринг контрагентов
Лицензии на алкоголь
Мониторинг СМИ
Признаки хозяйственной деятельности
Репутационные риски
Комплаенс
Компания ЗАО ФОРМУЛА-ГАЗ, адрес: г. Москва, ул. Полянка Б., д. 24/2 к. 4 зарегистрирована 24.03.2003. Организации присвоены ИНН 7706207112, ОГРН 1037706018316, КПП 770601001. Всего зарегистрировано 17 видов деятельности по ОКВЭД. Связи с другими компаниями отсутствуют.
Москва, ул. Полянка Б., д. 24/2 к. 4 зарегистрирована 24.03.2003. Организации присвоены ИНН 7706207112, ОГРН 1037706018316, КПП 770601001. Всего зарегистрировано 17 видов деятельности по ОКВЭД. Связи с другими компаниями отсутствуют.
Компания ЗАО ФОРМУЛА-ГАЗ не принимала участие в тендерах. В отношении компании нет исполнительных производств. ЗАО ФОРМУЛА-ГАЗ не участвовало в арбитражных делах.
Реквизиты ЗАО ФОРМУЛА-ГАЗ, юридический адрес, официальный сайт и выписка ЕГРЮЛ, а также 1 существенное событие доступны в системе СПАРК (демо-доступ бесплатно).
Полная проверка контрагентов в СПАРКе
- Неоплаченные долги
- Арбитражные дела
- Связи
- Реорганизации и банкротства
Полная информация о компании ЗАО ФОРМУЛА-ГАЗ
299₽
- Регистрационные данные компании
- Руководитель и основные владельцы
- Контактная информация
- Факторы риска
- Признаки хозяйственной деятельности
- Ключевые финансовые показатели в динамике
- Проверка по реестрам ФНС
Купить Пример
999₽
Включен мониторинг изменений на год
- Регистрационные данные компании
- История изменения руководителей, наименования, адреса
- Полный список адресов, телефонов, сайтов
- Данные о совладельцах из различных источников
- Связанные компании
- Сведения о деятельности
- Финансовая отчетность за несколько лет
- Оценка финансового состояния
Купить Пример
Бесплатно
- Отчет с полной информацией — СПАРК-ПРОФИЛЬ
- Добавление контактных данных: телефон, сайт, почта
- Добавление описания деятельности компании
- Загрузка логотипа
- Загрузка документов
Редактировать данные
СПАРК-Риски для 1С
Оценка надежности и мониторинг контрагентов
Узнать подробности
Заявка на демо-доступ
Заявки с указанием корпоративных email рассматриваются быстрее.
Вход в систему будет возможен только с IP-адреса, с которого подали заявку.
Компания
Телефон
Вышлем код подтверждения
Эл. почта
Вышлем ссылку для входа
Нажимая кнопку, вы соглашаетесь с правилами использования и обработкой персональных данных
Закон идеального газа | Уравнение и константа
Учебные пособия
- Сообщение от Бо Брамер
29 Март
Основные понятия закона идеального газа
В этом уроке вы узнаете, как было получено уравнение закона идеального газа и как его использовать. Вы также узнаете, что определяет идеальный газ, что такое постоянная идеального газа, единицы закона идеального газа и какие допущения мы делаем, чтобы назвать газ идеальным — свойства идеального газа.
Темы, охватываемые в других статьях
- Что такое давление
- Закон Далтона о парциальном давлении
- Закон Чарльза
- Закон Авогадро
- Закон Бойла
- Ван -дер -ваал Уравнение
- Теория Kinetic Gas
- Loos Lauss Law.
- Комбинированный газовый закон
- Закон Генри
Введение
Закон идеального газа — это уравнение состояния, описывающее идеальные газы. Это уравнение состояния связывает давление, объем, температуру и массу газа и очень полезно для описания поведения газа в идеальных условиях. Это наиболее распространенное уравнение состояния газов.
Несколько других примечательных уравнений — это уравнение состояния Ван-дер-Ваала и уравнение состояния Вириала, которые описывают состояние газов в неидеальных состояниях. См. нашу статью об уравнении Ван-дер-Ваала, чтобы узнать больше об этом.
Уравнение идеального газа было впервые сформулировано Бенуа Полем Эмилем Клапейроном в 1834 году как комбинация законов Бойля, Шарля, Авогадро и Гей-Люссака. Клапейтон был французским инженером и одним из основоположников термодинамики.
Клапейтон был французским инженером и одним из основоположников термодинамики.
Каковы свойства идеального газа?
Газы состоят из большого количества частиц, постоянно случайно сталкивающихся друг с другом. Для моделирования и прогнозирования поведения газов была создана концепция идеального газа. Чтобы газ был идеальным, необходимо сделать несколько предположений. Их также можно рассматривать как свойств идеального газа .
- Во-первых, мы предполагаем, что объем частиц газа пренебрежимо мал. Это означает, что объем контейнера намного больше объема частиц газа.
- Второе предположение, которое мы делаем, заключается в том, что частицы газа имеют одинаковый размер и не имеют межмолекулярных сил с другими частицами газа.
- В-третьих, мы предполагаем, что частицы газа движутся хаотично в соответствии с законами движения Ньютона.
- Наконец, мы предполагаем, что все столкновения абсолютно упругие и не имеют потери энергии.
 Это означает, что при столкновениях частиц газа со стенками энергия не теряется, а давление постоянно.
Это означает, что при столкновениях частиц газа со стенками энергия не теряется, а давление постоянно.
Хотя ни один газ не является идеально идеальным, большинство газов достаточно близки при комнатной температуре и почти идеальны.
Объединение газовых законов в уравнение закона идеального газа
Если мы рассмотрим три основных газовых закона, закон Шарля, закон Авогадро и закон Бойля, мы можем установить взаимосвязь между давлением, объемом, температурой и количеством газа. родинки. Взяв каждое уравнение и объединив их, мы можем вывести уравнение закона идеального газа.
Поскольку эта пропорциональность учитывает все изменения состояния газов, она будет постоянной для идеального газа. Эта константа известна как Идеальная газовая постоянная или универсальная газовая постоянная, имеет значение . Мы можем подставить эту постоянную, обозначенную , в уравнение, чтобы вывести закон идеального газа, .
Единицы закона идеального газа
Следующие единицы используются в уравнении закона идеального газа, когда используются единицы SI (международная система единиц).
- P – давление, измеренное в Паскалях, Па.
- V – объем, измеренный в кубических метрах, м 3
- n – количество молей.
- R = 8,3145 — универсальная газовая постоянная, измеренная в Дж/(K · моль) , или, альтернативно, м 3 ·Па/(K · 8 моль) 90 температура измеряется в Кельвинах.
Если вместо паскалей и кубических метров вы используете литры и атмосферы, то у вас будет следующее:
- P – давление, измеренное в атмосферах
- V – объем, измеренный в литрах
- n — количество молей.
- R = 0,08206 – универсальная газовая постоянная, измеренная в л·атм/(K · моль)
- T – температура, измеренная в градусах Кельвина.
- Смесь этанола и метанола сгорает в кислороде с образованием 35 см 3 CO 2 и 55 см 3 H 1 H 1 происходит, и объемы обоих продуктов измеряются при 101 кПа и 120 градусах Цельсия.
 Каково молярное соотношение этанола к метанолу в смеси?
Каково молярное соотношение этанола к метанолу в смеси?
а) Пусть соотношение этанол:метанол составляет 1:3. Тогда реакция метанола будет происходить в 3 раза чаще, чем реакция этанола. Таким образом, продуктов метанола будет в 3 раза больше, чем продуктов этанола.
б) Пусть отношение будет 2:3.
c) Пусть отношение будет 3:2.
г) Пусть отношение будет 3:1
Из этих значений видно, что вариант (d) имеет такое же молярное соотношение, как мы рассчитали ранее, и поэтому вариант (d) является правильным ответом.
6.3: Сочетание газовых законов: уравнение идеального газа и общее уравнение газа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24195
Цели обучения
- Использовать закон идеального газа для описания поведения газа.

В этом модуле описывается взаимосвязь между давлением, температурой, объемом и количеством газа, а также способы объединения этих взаимосвязей для получения общего выражения, описывающего поведение газа.
Вывод закона идеального газа
Любой набор взаимосвязей между одной величиной (например, V) и несколькими другими переменными (\(P\), \(T\) и \(n\)) можно объединить в одно выражение, описывающее все отношения одновременно. Три отдельных выражения выглядят следующим образом:
- Закон Бойля
\[V \propto \dfrac{1}{P} \;\; \text{@ константы n и T}\]
- Закон Шарля
\[V \propto T \;\; \text{@ константа n и P}\]
- Закон Авогадро
\[V \propto n \;\; \text{@ константы T и P}\]
Объединение этих трех выражений дает
\[V \propto \dfrac{nT}{P} \tag{6.3.1}\]
, что показывает, что объем газ пропорционален числу молей и температуре и обратно пропорционален давлению.
\[V= {\rm Cons.} \left( \dfrac{nT}{P} \right) \tag{6.3.2}\]
По соглашению константа пропорциональности в уравнении 6.3.1 называется газовой постоянной, которая обозначается буквой \(R\). Подстановка R в уравнение 6.3.2 дает
\[ V = \dfrac{Rnt}{P} = \dfrac{nRT}{P} \tag{6.3.3}\]
Очистка дробей путем умножения обеих частей уравнения 6.3.4 на \(P \) дает
\[PV = nRT \tag{6.3.4}\]
Это уравнение известно как закон идеального газа .
Идеальный газ определяется как гипотетическое газообразное вещество, поведение которого не зависит от сил притяжения и отталкивания и может быть полностью описано законом идеального газа. На самом деле идеального газа не существует, но идеальный газ — это полезная концептуальная модель, которая позволяет нам понять, как газы реагируют на изменяющиеся условия. Как мы увидим, при многих условиях поведение большинства реальных газов очень близко к поведению идеального газа. Таким образом, закон идеального газа можно использовать для предсказания поведения реальных газов в большинстве условий. Закон идеального газа плохо работает при очень низких температурах или очень высоких давлениях, когда чаще всего наблюдаются отклонения от идеального поведения.
Таким образом, закон идеального газа можно использовать для предсказания поведения реальных газов в большинстве условий. Закон идеального газа плохо работает при очень низких температурах или очень высоких давлениях, когда чаще всего наблюдаются отклонения от идеального поведения.
Примечание
Значительные отклонения от поведения идеального газа обычно возникают при низких температурах и очень высоких давлениях.
Прежде чем мы сможем использовать закон идеального газа, нам нужно знать значение газовой постоянной R. Его форма зависит от единиц, используемых для других величин в выражении. Если V выражено в литрах (л), P в атмосферах (атм), T в кельвинах (К) и n в молях (моль), то
\[R = 0,08206 \dfrac{\rm L\cdot атм} {\rm K\cdot моль} \tag{6.3.5}\] 95\;Pa\]
Обратите внимание, что в этой части STP определяется иначе. Старое определение основывалось на стандартном давлении 1 атм.
Мы можем рассчитать объем 1000 моль идеального газа при стандартных условиях, используя вариант закона идеального газа, приведенный в уравнении 6. 3.4:
3.4:
\[V=\dfrac{nRT}{P}\tag{6.3 .7}\]
Таким образом, объем 1 моля идеального газа равен 22,71 л при СТП и 22,41 л при 0°C и 1 атм , что примерно эквивалентно объему трех баскетбольных мячей. Молярные объемы нескольких реальных газов при 0°C и 1 атм приведены в таблице 10.3, из которой видно, что отклонения от поведения идеального газа довольно малы. Таким образом, закон идеального газа хорошо аппроксимирует поведение реальных газов при 0°C и 1 атм. Соотношения, описанные в разделе 10.3 как законы Бойля, Шарля и Авогадро, являются просто частными случаями закона идеального газа, в котором два из четырех параметров (P, V, T и n) остаются фиксированными.
| Газ | Молярный объем (л) |
|---|---|
| Он | 22. 434 434 |
| Ар | 22.397 |
| В 2 | 22.433 |
| Н 2 | 22.402 |
| О 2 | 22.397 |
| СО 2 | 22.260 |
| НХ 3 | 22.079 |
Применение закона идеального газа
Закон идеального газа позволяет нам вычислить значение четвертой переменной для газовой пробы, если мы знаем значения любых трех из четырех переменных ( P , V , T и n ). Это также позволяет нам предсказать конечное состояние образца газа (т. е. его конечную температуру, давление, объем и количество) после любых изменений условий, если параметры ( P , V , T и n ) указаны для начального состояния . Некоторые приложения проиллюстрированы в следующих примерах. Подход, используемый повсюду, заключается в том, чтобы всегда начинать с одного и того же уравнения — закона идеального газа — и затем определять, какие величины даны, а какие необходимо рассчитать. Начнем с простых случаев, когда нам даны три из четырех параметров, необходимых для полного физического описания газообразного образца.
Это также позволяет нам предсказать конечное состояние образца газа (т. е. его конечную температуру, давление, объем и количество) после любых изменений условий, если параметры ( P , V , T и n ) указаны для начального состояния . Некоторые приложения проиллюстрированы в следующих примерах. Подход, используемый повсюду, заключается в том, чтобы всегда начинать с одного и того же уравнения — закона идеального газа — и затем определять, какие величины даны, а какие необходимо рассчитать. Начнем с простых случаев, когда нам даны три из четырех параметров, необходимых для полного физического описания газообразного образца.
Пример \(\PageIndex{1}\)
Воздушный шар, который Чарльз использовал для своего первого полета в 1783 году, был уничтожен, но мы можем оценить его объем в 31 150 л (1100 футов 3 ), учитывая записанные размеры в это время. Если температура на уровне земли была 86°F (30°C) и атмосферное давление 745 мм ртутного столба, сколько молей газообразного водорода потребовалось, чтобы заполнить воздушный шар?
Дано: объем, температура и давление
Запрошено: количество газа
Стратегия:
- Решите закон идеального газа для неизвестного количества, в данном случае n .

- Убедитесь, что все величины даны в единицах, совместимых с единицами газовой постоянной. При необходимости переведите их в соответствующие единицы, вставьте в полученное уравнение, а затем рассчитайте необходимое количество молей газообразного водорода.
Решение:
A Нам дают значения для P , T и V и просят вычислить n . Если мы решим закон идеального газа (уравнение 6.3.4) для n , получим \]
B P и T даны в единицах, несовместимых с единицами газовой постоянной [ R = 0,08206 (л•атм)/(К•моль)]. Поэтому мы должны перевести температуру в кельвины, а давление в атмосферы: 93\;mol\]
Упражнение \(\PageIndex{1}\)
Предположим, что «пустой» аэрозольный баллончик из-под краски имеет объем 0,406 л и содержит 0,025 моль газа-вытеснителя, такого как CO 2 . Каково давление газа при 25°С?
Ответ: 1,5 атм
В примере \(\PageIndex{1}\) нам были даны три из четырех параметров, необходимых для описания газа при определенном наборе условий, и нас попросили рассчитать четвертый . Мы также можем использовать закон идеального газа, чтобы вычислить эффект заменяет в любом из указанных условий на любой из других параметров, как показано в примере \(\PageIndex{5}\).
Мы также можем использовать закон идеального газа, чтобы вычислить эффект заменяет в любом из указанных условий на любой из других параметров, как показано в примере \(\PageIndex{5}\).
Закон идеального газа: https://youtu.be/rHGs23368mE
Общее уравнение газа
Когда газ описывается при двух различных условиях, уравнение идеального газа должно применяться дважды — к конечное условие. Это:
\[\begin{array}{cc}\text{Исходное состояние}(i) & \text{Окончательное условие} (f)\\P_iV_i=n_iRT_i & P_fV_f=n_fRT_f\end{массив}\]
Оба уравнения можно преобразовать, чтобы получить:
\[R=\dfrac{P_iV_i}{n_iT_i} \hspace{1cm} R=\dfrac{P_fV_f}{n_fT_f}\]
Два уравнения равны друг другу другой, поскольку каждый из них равен одной и той же константе \(R\). Таким образом, мы имеем:
\[\dfrac{P_iV_i}{n_iT_i}=\dfrac{P_fV_f}{n_fT_f}\tag{6. 3.8}\]
3.8}\]
Уравнение называется общим уравнением газа . Уравнение особенно полезно, когда одно или два свойства газа остаются постоянными между двумя условиями. В таких случаях уравнение можно упростить, исключив эти постоянные свойства газа.
Пример \(\PageIndex{2}\)
Предположим, что Чарльз изменил свои планы и совершил свой первый полет не в августе, а в холодный январский день, когда температура у земли была -10°C ( 14°F). Насколько большой воздушный шар ему понадобился бы, чтобы содержать то же количество газообразного водорода при том же давлении, что и в примере \(\PageIndex{1}\)?
Дано: температура, давление, количество и объем в августе; температура в январе
Просили: объем в январе
Стратегия:
- Используйте результаты примера \(\PageIndex{1}\) для августа в качестве начальных условий, а затем рассчитайте изменение объема из-за изменения температуры от 30 °С до -10°С.
 Начните с построения таблицы, показывающей начальные и конечные условия.
Начните с построения таблицы, показывающей начальные и конечные условия. - Упростите общее уравнение газа, исключив величины, которые остаются постоянными между начальным и конечным условиями, в данном случае \(P\) и \(n\).
- Найдите неизвестный параметр.
Решение:
A Чтобы точно увидеть, какие параметры изменились, а какие остались постоянными, подготовьте таблицу начальных и конечных условий:
Начальное (август)| Финал (январь) | |
| \(T_i=30\)°С = 303 К | \(T_f=\)−10°C = 263 K |
| \(P_i=\)0,980 атм | \(P_f=\)0,980 атм |
| \(n_i=\)1,23 × 103 моль | \(n_f=\)1,23 × 103 моль |
| \(V_i=31150\) Л | \(V_f=?\) |
B И \(n\), и \(P\) в обоих случаях одинаковы (\(n_i=n_f,P_i=P_f\)). Следовательно, уравнение можно упростить до:
Следовательно, уравнение можно упростить до:
\[\dfrac{V_i}{T_i}=\dfrac{V_f}{T_f}\]
Это соотношение впервые было отмечено Чарльзом. 94\;L\]
Важно проверить свой ответ, чтобы убедиться, что он имеет смысл, на тот случай, если вы случайно инвертировали величину или умножили, а не разделили. При этом температура газа снижается. Поскольку мы знаем, что объем газа уменьшается с понижением температуры, конечный объем должен быть меньше начального объема, поэтому ответ имеет смысл. Мы могли бы рассчитать новый объем, подставив все заданные числа в закон идеального газа, но, как правило, гораздо проще и быстрее сосредоточиться только на изменяющихся величинах.
Упражнение \(\PageIndex{2}\)
На вечеринке в лаборатории наполненный гелием воздушный шар объемом 2,00 л при температуре 22°C опускают в большой контейнер с жидким азотом (T = −196°C). ). Каков конечный объем газа в баллоне?
Ответ : 0,52 л
Пример \(\PageIndex{1}\) иллюстрирует взаимосвязь, первоначально обнаруженную Чарльзом. Мы могли бы проработать аналогичные примеры, иллюстрирующие обратную зависимость между давлением и объемом, отмеченную Бойлем (9).0369 PV = константа) и соотношение между объемом и количеством, наблюдаемое Авогадро ( V / n = константа). Мы, однако, не будем этого делать, потому что важнее отметить, что исторически важные газовые законы являются лишь частными случаями идеального газового закона, в котором две величины изменяются, а две другие остаются постоянными. Метод, используемый в примере \(\PageIndex{1}\), может быть применен в 90 369 любых 90 370 таких случаях, как мы демонстрируем в примере \(\PageIndex{2}\) (который также показывает, почему нагрев закрытого контейнера с газом (например, картридж с бутановой зажигалкой или аэрозольный баллончик) может привести к взрыву).
Мы могли бы проработать аналогичные примеры, иллюстрирующие обратную зависимость между давлением и объемом, отмеченную Бойлем (9).0369 PV = константа) и соотношение между объемом и количеством, наблюдаемое Авогадро ( V / n = константа). Мы, однако, не будем этого делать, потому что важнее отметить, что исторически важные газовые законы являются лишь частными случаями идеального газового закона, в котором две величины изменяются, а две другие остаются постоянными. Метод, используемый в примере \(\PageIndex{1}\), может быть применен в 90 369 любых 90 370 таких случаях, как мы демонстрируем в примере \(\PageIndex{2}\) (который также показывает, почему нагрев закрытого контейнера с газом (например, картридж с бутановой зажигалкой или аэрозольный баллончик) может привести к взрыву).
Пример \(\PageIndex{3}\)
На аэрозольных баллончиках имеется четкая маркировка с предупреждением, например: «Не сжигайте пустой контейнер». Предположим, что вы не заметили этого предупреждения и бросили «пустой» аэрозольный баллончик в упражнении 5 (0,025 моль в 0,406 л, первоначально при 25°C и внутреннем давлении 1,5 атм) в огонь при 750°C. Какое давление было бы внутри банки (если бы она не взорвалась)?
Какое давление было бы внутри банки (если бы она не взорвалась)?
Дано: начальный объем, количество, температура и давление; конечная температура
Запрос: конечное давление
Стратегия:
Следуйте стратегии, описанной в примере \(\PageIndex{5}\).
Решение:
Подготовьте таблицу, чтобы определить, какие параметры изменяются, а какие остаются постоянными:
| Исходный | Окончательный |
| \(V_i=0,406\;\rm L\) | \(V_f=0,406\;\rm L\) | 9\цирк С=1023\;К\)
| \(P_i=1.5\;\rm атм\) | \(P_f=?\) |
И \(V\), и \(n\) в обоих случаях одинаковы (\(V_i=V_f,n_i=n_f\)). Следовательно, уравнение можно упростить до:
\[P_iT_i=P_fT_f\]
Решив уравнение для \(P_f\), мы получим:
\[P_f=P_i\times\dfrac{T_i}{T_f} =\rm1. 5\;atm\times\dfrac{1023\;K}{298\;K}=5.1\;atm\]
5\;atm\times\dfrac{1023\;K}{298\;K}=5.1\;atm\]
Этого давления более чем достаточно, чтобы разорвать контейнер из тонкого листового металла и вызвать взрыв !
Упражнение \(\PageIndex{3}\)
Предположим, что огнетушитель, заполненный CO 2 до давления 20,0 атм при 21°C на заводе, случайно оставлен на солнце в закрытом автомобиле. в Тусоне, штат Аризона, в июле. Температура внутри автомобиля поднимается до 160°F (71,1°C). Какое внутреннее давление в огнетушителе?
Ответ : 23,4 атм
В примере \(\PageIndex{1}\) и примере \(\PageIndex{2}\) два из четырех параметров ( P , V , T и n ) были фиксированными, в то время как один из них можно было изменять, и нас интересовало влияние на значение четвертого. В самом деле, мы часто сталкиваемся со случаями, когда две переменные P , V и T могут изменяться для данной пробы газа (следовательно, n постоянно), и нас интересует изменение в значении третьего в новых условиях.
Пример \(\PageIndex{4}\)
В примере \(\PageIndex{1}\) мы видели, что Чарльз использовал воздушный шар объемом 31 150 л для своего начального подъема и что воздушный шар содержал 1,23 × 10 3 моль газа H 2 первоначально при 30°С и 745 мм рт.ст. Предположим, что Гей-Люссак также использовал этот воздушный шар для своего рекордного подъема на высоту 23 000 футов и что давление и температура на этой высоте составляли 312 мм ртутного столба и -30°C соответственно. До какого объема должен был бы расшириться воздушный шар, чтобы удержать такое же количество газообразного водорода на большей высоте?
Дано: начальное давление, температура, количество и объем; конечное давление и температура
Требуемый запрос: конечный объем
Стратегия:
Следуйте стратегии, описанной в примере \(\PageIndex{5}\).
Решение:
Начните с создания таблицы двух наборов условий:
| Исходный | Окончательный | 94\;L\]

 Это означает, что при столкновениях частиц газа со стенками энергия не теряется, а давление постоянно.
Это означает, что при столкновениях частиц газа со стенками энергия не теряется, а давление постоянно.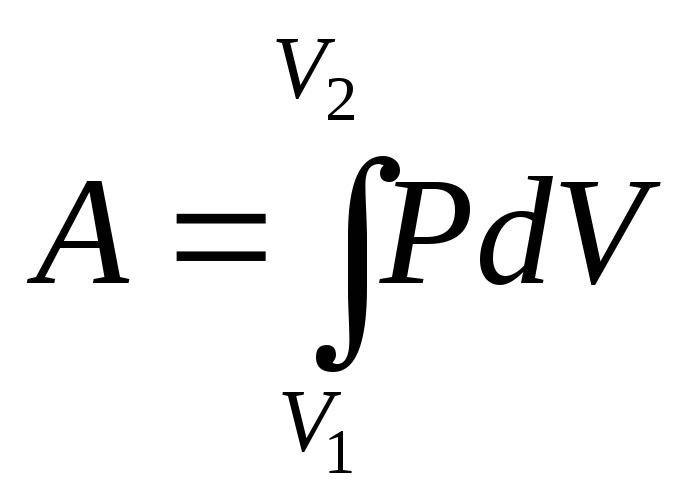 Каково молярное соотношение этанола к метанолу в смеси?
Каково молярное соотношение этанола к метанолу в смеси? 

 Начните с построения таблицы, показывающей начальные и конечные условия.
Начните с построения таблицы, показывающей начальные и конечные условия. Что мы ожидаем преобладать? Давление падает более чем в два раза, а абсолютная температура падает всего примерно на 20%. Поскольку объем пробы газа прямо пропорционален как T , так и 1/P , переменная , которая больше всего изменится , окажет наибольшее влияние на V . В этом случае преобладает эффект уменьшения давления, и мы ожидаем, что объем газа увеличится, как мы и обнаружили в нашем расчете.
Что мы ожидаем преобладать? Давление падает более чем в два раза, а абсолютная температура падает всего примерно на 20%. Поскольку объем пробы газа прямо пропорционален как T , так и 1/P , переменная , которая больше всего изменится , окажет наибольшее влияние на V . В этом случае преобладает эффект уменьшения давления, и мы ожидаем, что объем газа увеличится, как мы и обнаружили в нашем расчете. )
) 3.12}\]
3.12}\] ст.\times\dfrac{1\;атм}{760\;мм рт.ст.}=0,987\;атм\]
ст.\times\dfrac{1\;атм}{760\;мм рт.ст.}=0,987\;атм\] Этот метод особенно удобен для идентификации газа, образовавшегося в результате реакции, и его несложно осуществить. Колбу или стеклянную колбу известного объема тщательно высушивают, вакуумируют, запечатывают и взвешивают пустыми. Затем он заполняется образцом газа при известной температуре и давлении и повторно взвешивается. Разница в массе между двумя показаниями и есть масса газа. Объем колбы обычно определяют путем взвешивания пустой колбы и наполненной жидкостью известной плотности, например водой. Использование измерений плотности для расчета молярных масс показано в примере \(\PageIndex{6}\).
Этот метод особенно удобен для идентификации газа, образовавшегося в результате реакции, и его несложно осуществить. Колбу или стеклянную колбу известного объема тщательно высушивают, вакуумируют, запечатывают и взвешивают пустыми. Затем он заполняется образцом газа при известной температуре и давлении и повторно взвешивается. Разница в массе между двумя показаниями и есть масса газа. Объем колбы обычно определяют путем взвешивания пустой колбы и наполненной жидкостью известной плотности, например водой. Использование измерений плотности для расчета молярных масс показано в примере \(\PageIndex{6}\). 3.12 для определения молярной массы газа, а затем рассчитайте плотность газа на основе предоставленной информации.
3.12 для определения молярной массы газа, а затем рассчитайте плотность газа на основе предоставленной информации. Красно-коричневый цвет смога также является результатом присутствия газа NO 2 .
Красно-коричневый цвет смога также является результатом присутствия газа NO 2 . Константа пропорциональности, R , называется газовой постоянной и имеет значение 0,08206 (л•атм)/(К•моль), 8,3145 Дж/(К•моль) или 1,9872 кал/(К•моль) , в зависимости от используемых единиц измерения. Закон идеального газа описывает поведение идеального газа , гипотетического вещества, поведение которого можно количественно объяснить законом идеального газа и кинетической молекулярной теорией газов. Стандартная температура и давление (STP) : 0°C и 1 атм. Объем 1 моль идеального газа при СТП равен 22,41 л, стандартный молярный объем . Все эмпирические газовые соотношения являются частными случаями закона идеального газа, в котором два из четырех параметров остаются постоянными. Закон идеального газа позволяет вычислить значение четвертой величины ( P , V , T или n ), необходимой для описания газовой пробы, когда известны остальные, а также предсказать значение этих величин.
Константа пропорциональности, R , называется газовой постоянной и имеет значение 0,08206 (л•атм)/(К•моль), 8,3145 Дж/(К•моль) или 1,9872 кал/(К•моль) , в зависимости от используемых единиц измерения. Закон идеального газа описывает поведение идеального газа , гипотетического вещества, поведение которого можно количественно объяснить законом идеального газа и кинетической молекулярной теорией газов. Стандартная температура и давление (STP) : 0°C и 1 атм. Объем 1 моль идеального газа при СТП равен 22,41 л, стандартный молярный объем . Все эмпирические газовые соотношения являются частными случаями закона идеального газа, в котором два из четырех параметров остаются постоянными. Закон идеального газа позволяет вычислить значение четвертой величины ( P , V , T или n ), необходимой для описания газовой пробы, когда известны остальные, а также предсказать значение этих величин. количества после изменения условий, если исходные условия (значения P , V , T и n ). Закон идеального газа можно использовать и для вычисления плотности газа, если известна его молярная масса, или, наоборот, молярной массы неизвестной пробы газа, если измерена его плотность.
количества после изменения условий, если исходные условия (значения P , V , T и n ). Закон идеального газа можно использовать и для вычисления плотности газа, если известна его молярная масса, или, наоборот, молярной массы неизвестной пробы газа, если измерена его плотность. Закон Бойля, закон Шарля, закон Авогадро, закон Гей-Люссака, закон идеального газа и закон Грэма определяют соотношение между массой, давлением, объемом, температурой и плотностью молекул идеального газа.
Закон Бойля, закон Шарля, закон Авогадро, закон Гей-Люссака, закон идеального газа и закон Грэма определяют соотношение между массой, давлением, объемом, температурой и плотностью молекул идеального газа.

 Когда эти кривые строятся при различных фиксированных температурах, называемых изотермами.
Когда эти кривые строятся при различных фиксированных температурах, называемых изотермами. формула,
формула,