Откуда взялся природный газ. Две теории газа.
Многие ли в наше время могут сразу дать определение природному газу? Знают ли его историю и химический состав? Очевидно нет, ведь в Google найдется все.
Итак.
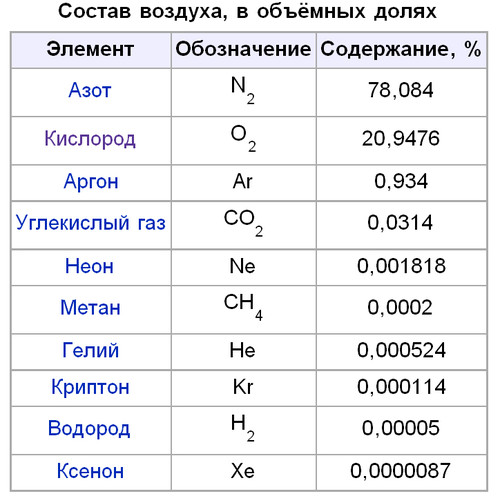
Природный газ — смесь углеводородов, представляющая собой нечто эфемерное, то, что нельзя потрогать, увидеть и без запаха. Основу природного газа составляет метан (Ch5) — простейший углеводород (органическое соединение, состоящее из атомов углерода и водорода). Обычно в его состав также входят более тяжелые углеводороды, гомологи метана: этан (C2H6), пропан (C3H8), бутан (C4h20) и некоторые неуглеводородные примеси.
В поисках истины.
Ученые до сих пор не могут прийти к единому мнению относительно происхождения природного газа, и своем споре разбились на два лагеря, пытаясь доказать возникновение газа, предложили две основные теории.
Минеральная теория
Согласно этой теории все химические элементы, из которых состоит природный газ и нефть изначально заложены в мантии Земли, представляя собой залежи полезных ископаемых. находясь глубоко в пластах горных пород являются частью процесса дегазации Земли. Из-за внутренних движений Земли углеводороды, находящиеся на больших глубинах поднимаются ближе к поверхности, туда, где образуется наименьшее давление, таким образом, в результате появляются нефтяные и газовые залежи.
находясь глубоко в пластах горных пород являются частью процесса дегазации Земли. Из-за внутренних движений Земли углеводороды, находящиеся на больших глубинах поднимаются ближе к поверхности, туда, где образуется наименьшее давление, таким образом, в результате появляются нефтяные и газовые залежи.
Биогенная теория.
Приверженцы этой теории считают, что природный газ образовался из остатков растительных и животных организмов, вымерших в конце палеозойской эры, которые под действием бактерий, высокого давления и температуры превратились в смесь газообразных углеродов. Именно биохимические процессы и обеспечили химический коктейль природного газа: 80-98% метана, 2-3% его ближайших гомологов – этана, пропана, бутана, пентана, а также небольшое количество примесей – сероводорода, углекислого газа, азота.
Газ видишь? Нет. А он есть.
Большинство людей, далеких от газовой отрасли, представляют, что газ, находящийся под землей подобен ценным ископаемым, занимает собой некие пустоты в недрах земли, и легко полностью извлекается. Но это не совсем верно. Природный газ действительно находится глубоко под землей, внутри горных пород, имеющих пористую структуру, но поры на столько микроскопические, что их невооружённым глазом разглядеть почти нереально. Поэтому, взяв в руки извлеченный из недр земли небольшой кусок песчаника, сложно осознать, что внутри заключен природный газ.
Но это не совсем верно. Природный газ действительно находится глубоко под землей, внутри горных пород, имеющих пористую структуру, но поры на столько микроскопические, что их невооружённым глазом разглядеть почти нереально. Поэтому, взяв в руки извлеченный из недр земли небольшой кусок песчаника, сложно осознать, что внутри заключен природный газ.
Священный огонь.
Древний зороастрийский храм Атешгях
У многих народов огонь вызывал благоговейный трепет. Люди поклонялись огню, огонь любили, огонь ненавидели.
Человечество знает о существовании природного газа давно. И, хотя уже в IV веке до н. э. в Китае его научились использовать для отопления и освещения, долгое время яркое пламя, не оставляющее пепла, являлось предметом мистического и религиозного культа для некоторых народов. Например, на Апшеронском полуострове (современная территория Азербайджана) в VII веке был воздвигнут храм огнепоклонников Атешгях, почитаемый в разное время зороастрийцами, индуистами и сикхами. Храм возник на месте «вечных» неугасимых огней — горящих выходов естественного газа, благодаря чему храм и носит название «Атешгях», что означает «Дом огня». Служения в нем проходили вплоть до XIX века. Однако, сами зороастрийцы говорят, что они не поклоняются огню как таковому, а почитают Творца (Q’rt’), символом которого является огонь.
Храм возник на месте «вечных» неугасимых огней — горящих выходов естественного газа, благодаря чему храм и носит название «Атешгях», что означает «Дом огня». Служения в нем проходили вплоть до XIX века. Однако, сами зороастрийцы говорят, что они не поклоняются огню как таковому, а почитают Творца (Q’rt’), символом которого является огонь.
Добыть и использовать.
«Человечеству всего около 200 тыс. лет. А добыча газа началась только в прошлом веке»
Человек всегда и везде ищет выгоду. Вот и персидский царь в I веке н.э., увидев огонь, горевший и день и ночь, не требующий дополнительного топлива приказал построить дворцовую кухню на месте где газ выходил на поверхность. Природный газ впервые применили в 1821 году в городе Фредония, штат Нью-Йорк.
На заметку: Общая протяженность газопроводов в России в два раза больше, чем расстояние от Земли до Луны или в 20 раз больше, чем протяженность экватора.
Газания Газу Формула Микс.
 Биотехника
БиотехникаОтправить запрос о поступлении:
- Главная
- Семена цветов
- Однолетники
- Газания
- Газания Газу Формула Микс. Биотехника
Описание
Важная особенность серии – цветки долго остаются открытыми в облачную погоду по сравнению с другими сериями газаний.
Растение долгоцветущее. Используется для оформления бордюров, вазонов, балконных ящиков, а также в качестве горшечной культуры.
Похожие товары
скидка
Газания Нью Дэй Роуз Страйп (Семена Профи). Поиск
102
82
Гацания гибридная Солнечная, смесь сортов (5шт). Аэлита
новинка
ГАЗАНИЯ (Гацания) НЬЮ ДЭЙ F1 чистый оранж. Аэлита
скидка
Газания Дайбрек Тайгер Микс (Семена Профи). Поиск
Поиск
102
82
Гацания Махагон. (Урожай удачи)
Гацания Балконная мега оранж (5шт). Аэлита
Газания Нью Дэй Ред Страйп (Семена Профи). Поиск
Газания Нью Дэй Стравберри Шорткейк микс (Семена Профи). Пои …
ГАЗАНИЯ (Гацания) МУЗА смесь. Гавриш
Гацания Яркая вспышка. (Урожай удачи)
Газания Гибридная смесь. Поиск
Гацания Рассвет F1 тигровая смесь сортов (5шт). Аэлита
новинка
Газания Арктик Флэйм. Биотехника
Биотехника
Газания (Гацания) Загадка (Семена Профи). Поиск
новинка
Газания Арктик Берри. Биотехника
ГАЗАНИЯ (Гацания) ТРИАДА смесь. Гавриш
новинка
Газания Африка Фламинго. Биотехника
ГАЗАНИЯ (Гацания) НЬЮ ДЭЙ F1 красный ковёр. Аэлита
Гацания Новый день F1 смесь окрасок (10шт). Аэлита
Гацания Рассвет F1 тигровая розовая (5шт). Аэлита
Газания Откровение (0.1г). Седек
Гацания Нью Дэй F1 белая (10шт). Аэлита
новинка
Газания Африка Килиманджаро.
Гацания Балконная мега ваниль (5шт). Аэлита
Газания Газу Формула Микс. Биотехника
Гацания Балконная мега вспышка (5шт). Аэлита
Общее уравнение газа
Каждый материал состоит из атомов или молекул. По определению, количество
вещество указывается в молях. В одном моле вещества содержится 6,022
· 10 23 составляющих частиц (постоянная Авогадро. Это не
число, а физическая величина с единицей моль -1 ). 1 моль
определяется как количество вещества системы, состоящей из одного и того же
количество частиц как количество атомов, содержащихся ровно в 12 г углерода
нуклида
При нормальных условиях, т.е. при давлении 101 325 Па и температуре 273,15 К (равно 0°С), один моль идеального газа заполняет объем 22,414 л.
Еще в 1664 году Роберт Бойль изучал влияние давления на
заданное количество воздуха. Результаты, подтвержденные Мариоттом в экспериментах, таковы.
резюмируется в законе Бойля-Мариотта:
Результаты, подтвержденные Мариоттом в экспериментах, таковы.
резюмируется в законе Бойля-Мариотта:
\[p\cdot V = \mbox{const.}\]
Формула 1-4: Закон Бойля-Мариотта [4]
Закон Бойля-Мариотта, выраженный словами, гласит, что объем заданное количество газа при постоянной температуре обратно пропорционально давление – произведение давления на объем постоянно.
Более ста лет спустя температурная зависимость объема также было определено количество газа: объем данного количества газа при постоянном давлении прямо пропорциональна абсолютной температуре или
\[V = \mbox{const.}\cdot T\]
Формула 1-5: Закон Гей-Люссака
Последовательное воздействие на данное количество газа изменением давления а изменение температуры приводит к
\[\frac{p\cdot V}T=\mbox{const.}\]
Это по-прежнему применимо для данного количества газа. Объем газа на
данная температура и данное давление пропорциональны количеству
материал $\nu$.
\[\frac{p\cdot V}T=\nu\cdot\mbox{const.}\]
Количество материала определяется взвешиванием. Мы можем выразить количество газа отношением массы к молярной массе. Константа const. относится здесь к 1 молю рассматриваемого газа, и его называют газом постоянная $R$. В результате состояние идеального газа можно описать как следует в зависимости от давления, температуры и объема:
Формула 1-6: Общее уравнение состояния идеальных газов [5]
| $р$ | Давление | [Па] |
| $В$ | Том | [м 3 ] |
| млн $ | Масса | [кг] |
| $M$ | Молярная масса | [кг кмоль -1 ] |
| реалов | Общая газовая постоянная | [кДж кмоль -1 К -1 ] |
| Т$ | Абсолютная температура | [К] |
Количество вещества $\nu$ также может быть указано как количество
молекул относительно постоянной Авогадро.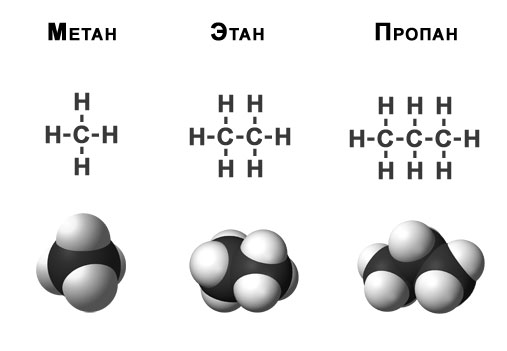
\[p\cdot V=\frac N {N_A} \cdot R \cdot T = N \cdot k \cdot T \quad\mbox{где} k=\frac R {N_A}\]
Формула 1-7: Уравнение состояния идеальных газов I
| $N$ | Количество частиц | ||
| $N_A$ | Постоянная Авогадро | = 6,022 · 10 23 | [моль -1 ] |
| $k$ | постоянная Больцмана | = 1,381 · 10 -23 | [JK -1 ] |
Если теперь обе части уравнения разделить на объем, то мы получить
\[p=n\cdot k\cdot T\]
Формула 1-8: Уравнение состояния идеальных газов II
| $n$ | Численная плотность частиц | [м -3 ] |
Формула плотности газа – определение, понятия, примеры и часто задаваемые вопросы
Плотность определяется как отношение массы вещества к единице объема при определенных условиях давления и температуры. Математически его можно определить как массу, деленную на объем. Обычно обозначается буквой «ρ» или «D». Плотность вещества изменяется в зависимости от его давления и температуры. Например, плотность идеального газа можно увеличить вдвое, если удвоить давление или уменьшить вдвое его абсолютную температуру. Это означает, что плотность газа всегда увеличивается с увеличением давления и уменьшается с ростом температуры. Мы можем определить молярную массу вещества, если знаем его плотность. Как правило, плотность вещества различна для разных материалов. При стандартных условиях температуры и давления осмий и иридий являются самыми плотными из известных элементов.
Математически его можно определить как массу, деленную на объем. Обычно обозначается буквой «ρ» или «D». Плотность вещества изменяется в зависимости от его давления и температуры. Например, плотность идеального газа можно увеличить вдвое, если удвоить давление или уменьшить вдвое его абсолютную температуру. Это означает, что плотность газа всегда увеличивается с увеличением давления и уменьшается с ростом температуры. Мы можем определить молярную массу вещества, если знаем его плотность. Как правило, плотность вещества различна для разных материалов. При стандартных условиях температуры и давления осмий и иридий являются самыми плотными из известных элементов.
Плотность (ρ) = m/V
Где «m» — масса, а «V» — объем.
Единицей плотности вещества в системе СИ является килограмм на кубический метр (кг/м 3 ). Некоторые другие единицы измерения плотности: килограмм на литр (кг/л), грамм на миллилитр (г/мл), тонна на кубический метр (т/м 3 ) и т. д.
д.
Формула плотности газа
формула для определения плотности газа дается следующим образом:
Плотность газа (ρ) = PM/RT
Где
«P» — давление газа,
«M» — молярная масса (г/моль),
«R» — универсальная газовая постоянная (R = 0,082 л⋅ атм⋅ K −1⋅ моль −1 ), а
«T» — температура газа (K)
Вывод для плотности газа формула
Плотность газа равна отношению общей массы газа к общему объему газа. Чтобы определить молярную массу газа, мы должны рассмотреть уравнение идеального газа.
Из уравнения идеального газа имеем
PV = nRT …………(1)
где,
«P» — давление газа,
«V» — объем газа
« n» — количество молей
«R» — универсальная газовая постоянная (R = 0,082 л⋅ атм⋅ K −1 ⋅ моль −1 ), а
«T» — температура газаМы знаем, что количество молей (n) = m/M
, где
«m» — масса газа,
«M» — молекулярная масса газа.Теперь подставьте n = m/M в уравнение (1).
Таким образом, PV = mRT/M
P = mRT/MV ……….(2)
мы знаем, что плотность (ρ) = m/V. Итак, подставьте значение ρ в уравнение (2).
Таким образом, мы получаем
P = ρ RT/M
ρ = PM/RT
Таким образом, формула плотности идеального газа ρ = PM/RT.
Решенные примеры плотности газа
Пример 1: Какой будет плотность газа при 37 °C, давлении 5 атм и молярной массе 84 г/моль?
Решение:
Данные:
Молярная масса (M) = 84 г/моль
Давление газа (P) =5 атм
Температура газа (T) = 37 °C = 310 K
Универсальная газовая постоянная (R) = 0,082 л⋅атм⋅K −1 ⋅моль −1
Из формулы плотности идеального газа имеем
ρ = MP/RT
ρ = (84 × 5)/ (0,082 × 310)
ρ = 420/25,42 г/л
ρ = 16,522 г/л
Следовательно, плотность газа равна 16,522 г/л.
Пример 2: Определите плотность газа при 27 °C, давлении 7 атм и молярной массе 54 г/моль. (R = 0,082 л⋅атм⋅K −1 ⋅моль −1 )
Раствор:
Данные:
2 Молярная масса 90 г/моль газа (P) =7 атм
Температура газа (T) = 27 °C = 300 K
Универсальная газовая постоянная (R) = 0,082 л⋅атм⋅K −1 ⋅моль −1
Из формулы плотности идеального газа имеем г/л
ρ= 15,37 г/л
Следовательно, плотность газа равна 15,37 г/л.
Пример 3: Определите плотность монооксида углерода при 40 °C и давлении 730 Торр. (R = 0,082 л⋅атм⋅K −1 ⋅моль −1 )
Решение:
Данные:
Молярная масса монооксида углерода (M) = 28 г/моль
Давление (P) = 730 Торр = 730/760 атм = 0,9605 атм
Температура (T) = 40 °C = 313 K
Универсальная газовая постоянная (R) = 0,082 л⋅атм⋅K −1 ⋅моль −1
Из формулы плотности идеального газа имеем
× 313)
ρ= 26,894/25,666 г/л
ρ= 1,0478 г/л
Отсюда плотность окиси углерода при 40 °C и давлении 730 Торр равна 1,0478 г/л.
Пример 4: Если плотность газа составляет 9,35 г/л при нормальных условиях, то определите его плотность при 30 °C и давлении 700 мм рт.ст.
Решение:
Данные:
Плотность газа (ρ 1 ) = 9,35 г/л
Мы знаем, что при СТП давление равно 2,73 при м и 0,987. K.
Итак, P 1 = 0,987 атм
T 1 = 273,15 K
Пусть плотность газа при 30 °С и давлении 700 мм рт.ст. равна ρ 2 .
P 2 = 700 мм рт. Ст. = 700 × 0,00131579 Атм = 0,9210 Атм
T 2 = 30 ° C = 303K
Из формы идеального газа, мы имеем
ρ = MP/RT
. вычисляют плотность одного и того же газа при разных условиях, масса газа остается неизменной.
ρ ∝ P/T
ρ 1 /ρ 2 = (P 1 /T 1 )/ (P 2 /T 2 )
9.
35/ρ 2 = (0.987/273.15)/ (0.9210/303)
9.35/ρ 2 = (0.987 × 303)/ (0.9210 × 273.15)
9.35/ρ 2 = (299.061/251.57)
ρ 2 = (9,35 × 251,57)/299,061
ρ 2 = 7,865 г/л
Следовательно, плотность газа при 30 °C и давлении 700 мм рт.ст. равна 7,865 г/л.
Пример 5: Какова плотность оксида азота (NO) при температуре 51 °C и давлении 6 бар? (R = 0,082 л⋅атм⋅К −1 ⋅MOL −1 )
Решение:
Данные данные:
Плотность (ρ) = 3,42 г
Температура (T) = 51 + 273 = 324 K
. Давление (P)= 6 бар = 6 × 0,9869 атм = 5,9215 атм
Молярная масса оксида азота = 30 г/моль
Универсальная газовая постоянная (R) = 0,082 л⋅атм⋅K −1 ⋅моль −1
Из формулы плотности идеального газа имеем
ρ= MP/RT
ρ= (30 × 5,9215)/ (0,082 × 324)
ρ= 177,645/26,568 г/л
ρ= 6,686 г/л
Отсюда плотность оксида азота при 51 °С и давлении 6 бар составляет 6,686 г/л.
.
Часто задаваемые вопросы о плотности газа
Вопрос 1: Определите плотность газа.
Ответ:
Плотностью называется отношение массы вещества к единице объема при определенных условиях давления и температуры. Математически его можно определить как массу, деленную на объем. Обычно обозначается буквой «ρ» или «D».
Плотность (ρ) = m/V
Где «m» — масса, а «V» — объем.
Вопрос 2: Как давление и температура влияют на плотность газа?
Ответ:
Плотность вещества изменяется в зависимости от его давления и температуры. Например, плотность идеального газа можно увеличить вдвое, если удвоить давление или уменьшить вдвое его абсолютную температуру. Это означает, что плотность газа всегда увеличивается с увеличением давления и уменьшается с ростом температуры.
Вопрос 3: Что понимают под идеальным газом? Запишите формулу плотности идеального газа.