НАЧАЛА ФИЗИКИ
Формула (22.3) (как и аналогичные соотношения термодинамики газа) имеет алгебраический смысл: количество теплоты, сообщенное телу, следует считать положительным, если тело получает внутреннюю энергию, и отрицательным, если отдает.
Еще одним существенным отличием термодинамики жидкости или твердого тела от термодинамики идеального газа является то, что жидкости и твердые тела слабо расширяются при нагревании и, как правило, имеют свободные границы. Поэтому они не совершают работу при нагревании, которую, следовательно, не нужно учитывать в уравнениях баланса энергии (если, конечно, не рассматривать процессы типа трения, в которых внутреннюю энергию тел можно значительно повысить за счет совершения работы). Поэтому задачи на термодинамику жидкостей или твердых тел часто называют задачами на тепловой баланс.
Эти задачи ставятся, как правило, следующим образом. Два или несколько тел приводят в тепловой контакт, нужно найти установившуюся температуру.
Пример 22.1. В калориметр с температурой , содержащий воды, добавляют воды при температуре . Определить температуру смеси. Теплоемкость калориметра C. Удельная теплоемкость воды c. Тепловые потери отсутствуют.
Решение. Пусть температура смеси . Тогда количества теплоты, полученные телами можно найти по формулам (22.1)-(22.2)
(22.4)
где , и – количества теплоты, полученные первой и второй порциями воды, и калориметром соответственно. В формуле (22.4) учтено, что начальные температуры первой порции воды и калориметра одинаковы. Все формулы (22.4) справедливы независимо от того, нагревалась первая или вторая порция воды и калориметр, или охлаждались.
Как найти температуру из формулы количества теплоты. Формула количества теплоты
«Физика – 10 класс»
В каких процессах происходят агрегатные превращения вещества?
Как можно изменить агрегатное состояние вещества?
Изменить внутреннюю энергию любого тела можно, совершая работу, нагревая или, наоборот, охлаждая его.
Также если закрепить поршень (рис. 13.5), то объём газа при нагревании не меняется и работа не совершается. Но температура газа, а следовательно, и его внутренняя энергия возрастают.
Внутренняя энергия может увеличиваться и уменьшаться, поэтому количество теплоты может быть положительным и отрицательным.
Процесс передачи энергии от одного тела другому без совершения работы называют теплообменом .
Количественную меру изменения внутренней энергии при теплообмене называют

Молекулярная картина теплообмена.
При теплообмене на границе между телами происходит взаимодействие медленно движущихся молекул холодного тела с быстро движущимися молекулами горячего тела. В результате кинетические энергии молекул выравниваются и скорости молекул холодного тела увеличиваются, а горячего уменьшаются.
При теплообмене не происходит превращения энергии из одной формы в другую, часть внутренней энергии более нагретого тела передаётся менее нагретому телу.
Количество теплоты и теплоёмкость.
Вам уже известно, что для нагревания тела массой т от температуры t 1 до температуры t 2 необходимо передать ему количество теплоты:
Q = cm(t 2 – t 1) = cm Δt. (13.5)
При остывании тела его конечная температура t 2 оказывается меньше начальной температуры t 1 и количество теплоты, отдаваемой телом, отрицательно.
Коэффициент с в формуле (13.5) называют удельной теплоёмкостью вещества.
Удельная теплоёмкость – это величина, численно равная количеству теплоты, которую получает или отдаёт вещество массой 1 кг при изменении его температуры на 1 К.
Удельная теплоёмкость газов зависит от того, при каком процессе осуществляется теплопередача. Если нагревать газ при постоянном давлении, то он будет расширяться и совершать работу. Для нагревания газа на 1 °С при постоянном давлении ему нужно передать большее количество теплоты, чем для нагревания его при постоянном объёме, когда газ будет только нагреваться.
Жидкие и твёрдые тела расширяются при нагревании незначительно. Их удельные теплоёмкости при постоянном объёме и постоянном давлении мало различаются.
Удельная теплота парообразования.
Для превращения жидкости в пар в процессе кипения необходима передача ей определённого количества теплоты. Температура жидкости при кипении не меняется. Превращение жидкости в пар при постоянной температуре не ведёт к увеличению кинетической энергии молекул, но сопровождается увеличением потенциальной энергии их взаимодействия. Ведь среднее расстояние между молекулами газа много больше, чем между молекулами жидкости.
Величину, численно равную количеству теплоты, необходимой для превращения при постоянной температуре жидкости массой 1 кг в пар, называют удельной теплотой парообразования .
Процесс испарения жидкости происходит при любой температуре, при этом жидкость покидают самые быстрые молекулы, и она при испарении охлаждается. Удельная теплота испарения равна удельной теплоте парообразования.
Эту величину обозначают буквой r и выражают в джоулях на килограмм (Дж/кг).
Очень велика удельная теплота парообразования воды: r Н20 = 2,256 10 6 Дж/кг при температуре 100 °С. У других жидкостей, например у спирта, эфира, ртути, керосина, удельная теплота парообразования меньше в 3-10 раз, чем у воды.
Для превращения жидкости массой m в пар требуется количество теплоты, равное:
Q п = rm. (13.6)
При конденсации пара происходит выделение такого же количества теплоты:
Q к = -rm. (13.7)
Удельная теплота плавления.
При плавлении кристаллического тела всё подводимое к нему тепло идёт на увеличение потенциальной энергии взаимодействия молекул.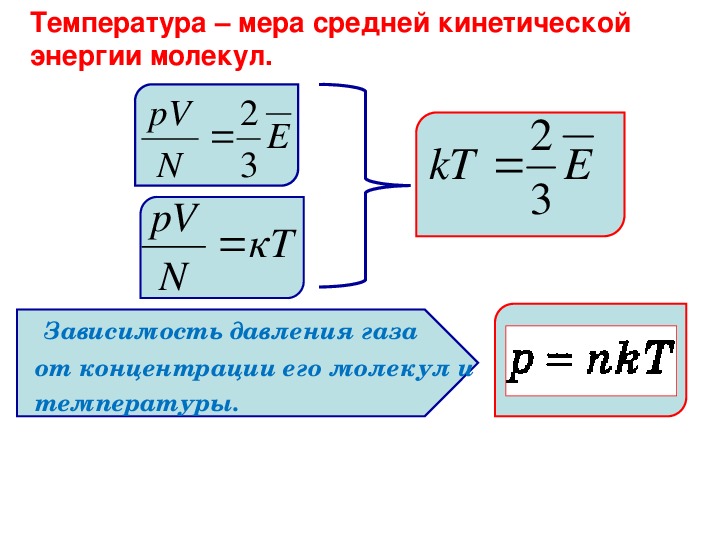
Величину, численно равную количеству теплоты, необходимой для превращения кристаллического вещества массой 1 кг при температуре плавления в жидкость, называют удельной теплотой плавления и обозначают буквой λ.
При кристаллизации вещества массой 1 кг выделяется точно такое же количество теплоты, какое поглощается при плавлении.
Удельная теплота плавления льда довольно велика: 3,34 10 5 Дж/кг.
«Если бы лёд не обладал большой теплотой плавления, то тогда весной вся масса льда должна была бы растаять в несколько минут или секунд, так как теплота непрерывно передаётся льду из воздуха. Последствия этого были бы ужасны; ведь и при существующем положении возникают большие наводнения и сильные потоки воды при таянии больших масс льда или снега». Р. Блек, XVIII в.
Для того чтобы расплавить кристаллическое тело массой m, необходимо количество теплоты, равное:
Q пл = λm. (13.8)
(13.8)
Количество теплоты, выделяемой при кристаллизации тела, равно:
Q кр = -λm (13.9)
Уравнение теплового баланса.
Рассмотрим теплообмен внутри системы, состоящей из нескольких тел, имеющих первоначально различные температуры, например теплообмен между водой в сосуде и опущенным в воду горячим железным шариком. Согласно закону сохранения энергии количество теплоты, отданной одним телом, численно равно количеству теплоты, полученной другим.
Отданное количество теплоты считается отрицательным, полученное количество теплоты – положительным. Поэтому суммарное количество теплоты Q1 + Q2 = 0.
Если в изолированной системе происходит теплообмен между несколькими телами, то
Q 1 + Q 2 + Q 3 + … = 0. (13.10)
Уравнение (13.10) называется уравнением теплового баланса .
Здесь Q 1 Q 2 , Q 3 – количества теплоты, полученной или отданной телами. Эти количества теплоты выражаются формулой (13.5) или формулами (13.6)-(13.9), если в процессе теплообмена происходят различные фазовые превращения вещества (плавление, кристаллизация, парообразование, конденсация).
План- конспект
открытого урока физики в 8 «Е» классе
МОУ гимназии №77 г. о. Тольятти
учителя физики
Ивановой Марии Константиновны
Тема урока:
Решение задач на расчёт количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении.
Дата проведения:
Цель урока:
отработать практические навыки расчета количества теплоты, необходимого для нагревания и выделяемого при охлаждении;
развивать навыки счёта, совершенствовать логические умения при анализе сюжета задач, решении качественных и расчётных задач;
воспитывать умение работать в парах, уважать мнение оппонента и отстаивать свою точку зрения, соблюдать аккуратность при оформлении задач по физике.
Оборудование урока:
компьютер, проектор, презентация по теме (Приложение №1), материалы единой коллекции цифровых образовательных ресурсов.
Тип урока:
«Суньте палец в пламя от спички, и вы испытаете ощущение, равного которому нет ни на небе, ни на земле; однако все, что произошло, есть просто следствие соударений молекул».
Дж. Уилер
Ход урока:
Организационный момент
Приветствие учащихся.
Проверка отсутствующих учащихся.
Сообщение темы и целей урока.
Проверка домашнего задания.
1.Фронтальный опрос
Что называется удельной теплоемкостью вещества? (Слайд №1)
Что является единицей удельной теплоемкости вещества?
Почему водоемы замерзают медленно? Почему с рек и особенно озер долго не сходит лед, хотя давно стоит теплая погода?
Почему на Черноморском побережье Кавказа даже зимой достаточно тепло?
Почему многие металлы остывают значительно быстрее воды? (Слайд №2)
2. Индивидуальный опрос (карточки с разноуровневыми заданиями для нескольких учащихся)
Индивидуальный опрос (карточки с разноуровневыми заданиями для нескольких учащихся)
Изучение новой темы.
1. Повторение понятия количества теплоты.
Количество теплоты – количественная мера изменения внутренней энергии при теплообмене.
Количество теплоты, поглощаемое телом, принято считать положительным, а выделяемое – отрицательным. Выражение «тело обладает некоторым количеством теплоты» или «в теле содержится (запасено) какое- то количество теплоты» не имеет смысла. Количество теплоты можно получить или отдать в каком- либо процессе, но обладать им нельзя.
При теплообмене на границе между телами происходит взаимодействие медленно движущихся молекул холодного тела с быстро движущимися молекулами горячего тела. В результате кинетические энергии молекул выравниваются и скорости молекул холодного тела увеличиваются, а горячего уменьшаются.
При теплообмене не происходит превращения энергии из одной формы в другую, часть внутренней энергии горячего тела передается холодному телу.
2. Формула количества теплоты .
Выведем рабочую формулу, чтобы решать задачи по расчету количества теплоты: Q = cm ( t 2 – t 1 ) – запись на доске и в тетрадях .
Выясняем, что количество теплоты, отданное или полученное телом зависит от начальной температуры тела, его массы и от его удельной теплоемкости.
На практике часто пользуются тепловыми расчетами. Например, при строительстве зданий необходимо учитывать, какое количество теплоты должна отдавать зданию вся система отопления. Следует также знать, какое количество теплоты будет уходить в окружающее пространство через окна, стены, двери.
3 . Зависимость количества теплоты от различных величин . (Слайды №3, №4, №5,№6)
4 . Удельная теплоёмкость (Слайд №7)
5. Единицы измерения количества теплоты (Слайд №8)
6. Пример решения задачи на расчёт количества теплоты (Слайд №10)
Пример решения задачи на расчёт количества теплоты (Слайд №10)
7. Решение задач на расчёт количества теплоты на доске и в тетрадях
Выясняем также, что если между телами происходит теплообмен, то внутренняя энергия всех нагревающихся тел увеличивается на столько, на сколько уменьшается внутренняя энергия остывающих тел. Для этого используем пример решенной задачи из § 9 учебника.
Динамическая пауза.
IV. Закрепление изученного материала.
1. Вопросы для самоконтроля (Слайд №9)
2. Решение качественных задач :
Почему в пустынях днем жарко, а ночью температура падает ниже 0°С? (Песок обладает малой удельной теплоемкостью, поэтому быстро нагревается и охлаждается.)
По куску свинца и куску стали, той же массы ударили молотком одинаковое число раз. Какой кусок нагрелся больше? Почему? (Кусок свинца нагрелся больше, т. к. удельная теплоемкость свинца меньше.)
к. удельная теплоемкость свинца меньше.)
Почему железные печи скорее нагревают комнату, чем кирпичные, но не так долго остаются теплыми? (Удельная теплоемкость меди меньше, чем у кирпича.)
Медной и стальной гирькам одинаковой массы передали равные количества теплоты. У какой гирьки температура изменится сильнее? (У медной, т.к. удельная теплоемкость меди меньше.)
На что расходуется больше энергии: на нагревание воды или на нагревание алюминиевой кастрюли, если их массы одинаковы? (На нагревание воды, т. к. удельная теплоемкость воды большая.)
Как известно, железо имеет большую удельную теплоемкость, чем медь. Следовательно, жало пальника, изготовленное из железа, обладало бы большим запасом внутренней энергии, чем такое же жало из меди, при равенстве их масс и температур. Почему, несмотря на это, жало паяльника делают из меди? (Медь обладает большой теплопроводностью.)
Известно, что теплопроводность металла значительно больше теплопроводности стекла. Почему же тогда калориметры делают из металла, а не из стекла? (Металл обладает большой теплопроводностью и малой удельной теплоемкостью, благодаря этому температура внутри калориметра быстро выравнивается, а на нагревание его затрачивается мало тепла. Кроме того, излучение металла значительно меньше излучения стекла, что уменьшает потери тепла.)
Почему же тогда калориметры делают из металла, а не из стекла? (Металл обладает большой теплопроводностью и малой удельной теплоемкостью, благодаря этому температура внутри калориметра быстро выравнивается, а на нагревание его затрачивается мало тепла. Кроме того, излучение металла значительно меньше излучения стекла, что уменьшает потери тепла.)
Известно, что рыхлый снег хорошо предохраняет почву от промерзания, потому что в нем заключено много воздуха, который является плохим проводником тепла. Но ведь и к почве, не покрытой снегом, прилегают слои воздуха. Отчего же в таком случае она сильно не промерзает? (Воздух, соприкасаясь с непокрытой снегом почвой, все время находится в движении, перемешивается. Этот движущийся воздух отнимает от земли тепло и усиливает испарение из нее влаги. Воздух же, находящийся между частицами снега, малоподвижен и, как плохой проводник тепла, предохраняет землю от промерзания.)
3. Решение расчетных задач
Первые две задачи решаются высокомотивированными учащимися у доски с коллективным обсуждением. Находим правильные подходы в рассуждениях и оформлении решения задач.
Находим правильные подходы в рассуждениях и оформлении решения задач.
Задача №1 .
При нагревании куска меди от 20°С до 170°С Было затрачено 140000 Дж тепла. Определить массу меди.
Задача №2
Чему равна удельная теплоемкость жидкости, если для нагревания 2 л её на 20°С потребовалось 150000 Дж. Плотность жидкости 1,5 г/см³
Ответы на следующие задачи учащиеся находят в парах:
Задача №3.
Два медных шара массами m o и 4m o нагревают так, что оба шара получают одинаковое количество теплоты. При этом большой шар нагрелся на 5°C Насколько нагрелся шар меньшей массы?
Задача №4.
Какое количество теплоты выделяется при охлаждении 4 м³ льда от 10°C до– 40°C ?
Задача №5.
В каком случае потребуется для нагревания двух веществ большее количество теплоты, если нагрев двух веществ одинаков ∆t 1 = ∆t 2 Первое вещество- кирпич массы 2 кг и с =880Дж/кг ∙ °C , и латунь – масса 2 кг и с = 400 Дж/кг ∙ °C
Задача №6.
Стальной брусок массы 4 кг нагрели. При этом было затрачено 200000 Дж тепла. Определите конечную температуру тела, если начальная температура равна t 0 = 10°C
При самостоятельном решении задач у учеников, это естественно, возникают вопросы. Наиболее часто задаваемые вопросы разбираем коллективно. На те вопросы, которые носят частный характер, даются индивидуальные ответы.
Рефлексия. Выставление отметок.
Учитель: Итак, ребята, чему вы сегодня научились на уроке и что узнали нового?
Примерные ответы учащихся :
Отработали навыки решения качественных и расчётных задач по теме «Расчет количества теплоты, необходимого для нагревания тела и выделяемого при охлаждении».
Убедились на практике в том, как перекликаются и связаны такие предметы как физика и математика.
Задание на дом:
Решить задачи№ 1024, 1025, из сборника задач В.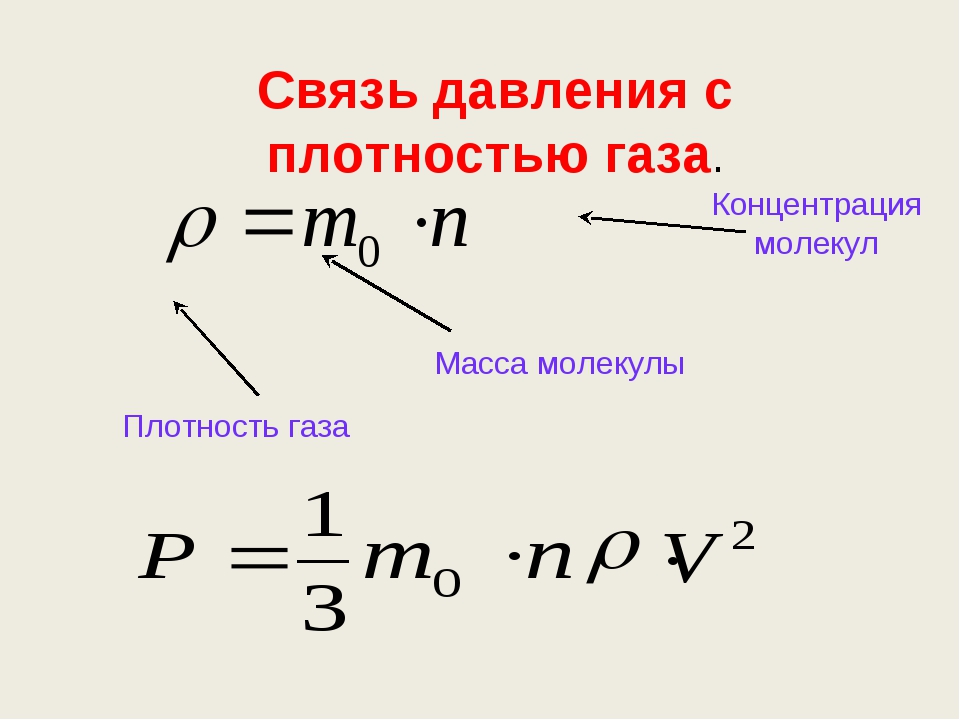 И. Лукашика, Е. В. Ивановой.
И. Лукашика, Е. В. Ивановой.
Самостоятельно придумать задачу на расчёт количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении.
721. Почему для охлаждения некоторых механизмов применяют воду?
Вода обладает большой удельной теплоемкостью, что способствует хорошему отводу тепла от механизма.
722. В каком случае нужно затратить больше энергии: для нагревания на 1 °С одного литра воды или для нагревания на 1 °С ста граммов воды?
Для нагрева литра воды, так как чем больше масса, тем больше нужно затратить энергии.
723. Мельхиоровую и серебряную вилки одинаковой массы опустили в горячую воду. Одинаковое ли количество теплоты они получат воды?
Мельхиоровая вилка получит больше теплоты, потому что удельная теплоемкость мельхиора больше, чем серебра.
724. По куску свинца и по куску чугуна одинаковой массы три раза ударили кувалдой. Какой кусок сильнее нагрелся?
Свинец нагреется сильнее, потому что его удельная теплоемкость меньше, чем чугуна, и для нагрева свинца нужно меньше энергии.
725. В одной колбе находится вода, в другой – керосин той же массы и температуры. В каждую колбу бросили по одинаково нагретому железному кубику. Что нагреется до более высокой температуры – вода или керосин?
Керосин.
726. Почему в городах на берегу моря колебания температуры зимой и летом менее резки, чем в городах, расположенных в глубине материка?
Вода нагревается и остывает медленнее, чем воздух. Зимой она остывает и двигает теплые массы воздуха на сушу, делая климат на берегу более теплым.
727. Удельная теплоемкость алюминия равна 920 Дж/кг °С. Что это означает?
Это означает, что для нагрева 1 кг алюминия на 1 °С необходимо затратить 920 Дж.
728. Алюминиевый и медный бруски одинаковой массы 1 кг охлаждают на 1 °С. На сколько изменится внутренняя энергия каждого бруска? У какого бруска она изменится больше и на сколько?
729. Какое количество теплоты необходимо для нагрева килограммовой железной заготовки на 45 °С?
730. Какое количество теплоты требуется, чтобы нагреть 0,25 кг воды с 30 °С до 50 °С?
Какое количество теплоты требуется, чтобы нагреть 0,25 кг воды с 30 °С до 50 °С?
731. Как изменится внутренняя энергия двух литров воды при нагревании на 5 °С?
732. Какое количество теплоты необходимо для нагрева 5 г воды от 20 °С до 30 °С?
733. Какое количество теплоты необходимо для нагревания алюминиевого шарика массой 0,03 кг на 72 °С?
734. Рассчитайте количество теплоты, необходимое для нагрева 15 кг меди на 80 °С.
735. Рассчитайте количество теплоты, необходимое для нагрева 5 кг меди от 10 °С до 200 °С.
736. Какое количество теплоты требуется для нагрева 0,2 кг воды от 15 °С до 20 °С?
737. Вода массой 0,3 кг остыла на 20 °С. На сколько уменьшилась внутренняя энергия воды?
738. Какое количество теплоты нужно, чтобы 0,4 кг воды при температуре 20 °С нагреть до температуры 30 °С?
739. Какое количество теплоты затрачено на нагрев 2,5 кг воды на 20 °С?
740. Какое количество теплоты выделилось при остывании 250 г воды от 90 °С до 40 °С?
Какое количество теплоты выделилось при остывании 250 г воды от 90 °С до 40 °С?
741. Какое количество теплоты потребуется для того, чтобы 0,015 л воды нагреть на 1 °С?
742. Рассчитайте количество теплоты, необходимое, чтобы нагреть пруд объемом 300 м3 на 10 °С?
743. Какое количество теплоты нужно сообщить 1 кг воды, чтобы повысить ее температуру от 30 °С до 40 °С?
744. Вода объемом 10 л остыла от температуры 100 °С до температуры 40 °С. Какое количество теплоты выделилось при этом?
745. Рассчитайте количество теплоты, необходимое для нагрева 1 м3 песка на 60 °С.
746. Объем воздуха 60 м3, удельная теплоемкость 1000 Дж/кг °С, плотность воздуха 1,29 кг/м3. Какое количество теплоты необходимо, чтобы нагреть его на 22 °С?
747. Воду нагрели на 10 °С, затратив 4,20 103 Дж теплоты. Определите количество воды.
748. Воде массой 0,5 кг сообщили 20,95 кДж теплоты. Какой стала температура воды, если первоначальная температура воды была 20 °С?
Какой стала температура воды, если первоначальная температура воды была 20 °С?
749. В медную кастрюлю массой 2,5 кг налито 8 кг воды при 10 °С. Какое количество теплоты необходимо, чтобы воду в кастрюле нагреть до кипения?
750. Литр воды при температуре 15 °С налит в медный ковшик массой 300 г. Какое количество теплоты необходимо, чтобы нагреть воду в ковшике на 85 °С?
751. Кусок нагретого гранита массой 3 кг помещают в воду. Гранит передает воде 12,6 кДж теплоты, охлаждаясь на 10 °С. Какова удельная теплоемкость камня?
752. К 5 кг воды при 12 °С долили горячую воду при 50 °С, получив смесь температурой 30 °С. Сколько воды долили?
753. В 3 л воды при 60 °С долили воду при 20 °С, получив воду при 40 °С. Сколько воды долили?
754. Какова будет температура смеси, если смешать 600 г воды при 80 °С с 200 г воды при 20 °С?
755. Литр воды при 90 °С влили в воду при 10 °С, причем температура воды стала 60 °С. Сколько было холодной воды?
Сколько было холодной воды?
756. Определите, сколько надо налить в сосуд горячей воды, нагретой до 60 °С, если в сосуде уже находится 20 л холодной воды при температуре 15 °С; температура смеси должна быть 40 °С.
757. Определите, какое количество теплоты требуется для нагревания 425 г воды на 20 °С.
758. На сколько градусов нагреются 5 кг воды, если вода получит 167,2 кДж?
759. Сколько потребуется тепла, чтобы m граммов воды при температуре t1, нагреть до температуры t2?
760. В калориметр налито 2 кг воды при температуре 15 °С. До какой температуры нагреется вода калориметра, если в нее опустить латунную гирю в 500 г, нагретую до 100 °С? Удельная теплоемкость латуни 0,37 кДж/(кг °С).
761. Имеются одинакового объема куски меди, олова и алюминия. Какой из этих кусков обладает наибольшей и какой наименьшей теплоемкостью?
762. В калориметр было налито 450 г воды, температура которой 20 °С. Когда в эту воду погрузили 200 г железных опилок, нагретых до 100 °С, температура воды стала 24 °С. Определите удельную теплоемкость опилок.
Когда в эту воду погрузили 200 г железных опилок, нагретых до 100 °С, температура воды стала 24 °С. Определите удельную теплоемкость опилок.
763. Медный калориметр весом 100 г вмещает 738 г воды, температура которой 15 °С. В этот калориметр опустили 200 г меди при температуре 100 °С, после чего температура калориметра поднялась до 17 °С. Какова удельная теплоемкость меди?
764. Стальной шарик массой 10 г вынут из печи и опущен в воду с температурой 10 °С. Температура воды поднялась до 25 °С. Какова была температура шарика в печи, если масса воды 50 г? Удельная теплоемкость стали 0,5 кДж/(кг °С).
770. Стальной резец массой 2 кг был нагрет до температуры 800 °С и затем опущен в сосуд, содержащий 15 л воды при температуре 10 °С. До какой температуры нагреется вода в сосуде?
(Указание. Для решения данной задачи необходимо составить уравнение, в котором за неизвестное принять искомую температуру воды в сосуде после опускания резца.)
771. Какой температуры получится вода, если смешать 0,02 кг воды при 15 °С, 0,03 кг воды при 25 °С и 0,01 кг воды при 60 °С?
Какой температуры получится вода, если смешать 0,02 кг воды при 15 °С, 0,03 кг воды при 25 °С и 0,01 кг воды при 60 °С?
772. Для отопления хорошо вентилируемого класса требуется количество теплоты 4,19 МДж в час. Вода поступает в радиаторы отопления при 80 °С, а выходит из них при 72 °С. Сколько воды нужно подавать каждый час в радиаторы?
773. Свинец массой 0,1 кг при температуре 100 °С погрузили в алюминиевый калориметр массой 0,04 кг, содержащий 0,24 кг воды при температуре 15 °С. После чего в калориметре установилась температура 16 °С. Какова удельная теплоемкость свинца?
В фокусе внимания нашей статьи – количество теплоты. Мы рассмотрим понятие внутренней энергии, которая трансформируется при изменении этой величины. А также покажем некоторые примеры применения расчетов в человеческой деятельности.
Теплота
С любым словом родного языка у каждого человека есть свои ассоциации. Они определяются личным опытом и иррациональными чувствами. Что обычно представляется при слове «теплота»? Мягкое одеяло, работающая батарея центрального отопления зимой, первый солнечный свет весной, кот. Или взгляд матери, утешительное слово друга, вовремя проявленное внимание.
Что обычно представляется при слове «теплота»? Мягкое одеяло, работающая батарея центрального отопления зимой, первый солнечный свет весной, кот. Или взгляд матери, утешительное слово друга, вовремя проявленное внимание.
Физики подразумевают под этим совершенно конкретный термин. И очень важный, особенно в некоторых разделах этой сложной, но увлекательной науки.
Термодинамика
Рассматривать количество теплоты в отрыве от простейших процессов, на которые опирается закон сохранения энергии, не стоит – ничего не будет понятно. Поэтому для начала напомним их читателям.
Термодинамика рассматривает любую вещь или объект как соединение очень большого количества элементарных частей – атомов, ионов, молекул. Ее уравнения описывают любое изменение коллективного состояния системы как целого и как части целого при изменении макропараметров. Под последними понимаются температура (обозначается как Т), давление (Р), концентрация компонентов (как правило, С).
Внутренняя энергия
Внутренняя энергия – довольно сложный термин, в смысле которого стоит разобраться прежде, чем говорить о количестве теплоты. Он обозначает ту энергию, которая изменяется при увеличении или уменьшении значения макропараметров объекта и не зависит от системы отсчета. Является частью общей энергии. Совпадает с ней в условиях, когда центр масс исследуемой вещи покоится (то есть отсутствует кинетическая составляющая).
Он обозначает ту энергию, которая изменяется при увеличении или уменьшении значения макропараметров объекта и не зависит от системы отсчета. Является частью общей энергии. Совпадает с ней в условиях, когда центр масс исследуемой вещи покоится (то есть отсутствует кинетическая составляющая).
Когда человек чувствует, что некоторый объект (скажем, велосипед) нагрелся или охладился, это показывает, что все молекулы и атомы, составляющие данную систему, испытали изменение внутренней энергии. Однако неизменность температуры не означает сохранение этого показателя.
Работа и теплота
Внутренняя энергия любой термодинамической системы может преобразоваться двумя способами:
- посредством совершения над ней работы;
- при теплообмене с окружающей средой.
Формула этого процесса выглядит так:
dU=Q-А, где U – внутренняя энергия, Q – теплота, А – работа.
Пусть читатель не обольщается простотой выражения. Перестановка показывает, что Q=dU+А, однако введение энтропии (S) приводит формулу к виду dQ=dSxT.
Так как в данном случае уравнение принимает вид дифференциального, то и первое выражение требует того же. Далее, в зависимости от сил, действующих в исследуемом объекте, и параметра, который вычисляется, выводится необходимое соотношение.
Возьмем в качестве примера термодинамической системы металлический шарик. Если на него надавить, подбросить вверх, уронить в глубокий колодец, то это значит совершить над ним работу. Чисто внешне все эти безобидные действия шарику никакого вреда не причинят, но внутренняя энергия его изменится, хоть и очень ненамного.
Второй способ – это теплообмен. Теперь подходим к главной цели данной статьи: описанию того, что такое количество теплоты. Это такое изменение внутренней энергии термодинамической системы, которое происходит при теплообмене (смотрите формулу выше). Оно измеряется в джоулях или калориях. Очевидно, что если шарик подержать над зажигалкой, на солнце, или просто в теплой руке, то он нагреется. А дальше можно по изменению температуры найти количество теплоты, которое ему было при этом сообщено.
Почему газ – лучший пример изменения внутренней энергии, и почему из-за этого школьники не любят физику
Выше мы описывали изменения термодинамических параметров металлического шарика. Они без специальных приборов не очень заметны, и читателю остается поверить на слово о происходящих с объектом процессах. Другое дело, если система – газ. Надавите на него – это будет видно, нагрейте – поднимется давление, опустите под землю – и это можно с легкостью зафиксировать. Поэтому в учебниках чаще всего в качестве наглядной термодинамической системы берут именно газ.
Но, увы, в современном образовании реальным опытам уделяется не так много внимания. Ученый, который пишет методическое пособие, отлично понимает, о чем идет речь. Ему кажется, что на примере молекул газа все термодинамические параметры будут нужным образом продемонстрированы. Но ученику, который только открывает для себя этот мир, скучно слушать про идеальную колбу с теоретическим поршнем. Если бы в школе существовали настоящие исследовательские лаборатории и на работу в них выделялись часы, все было бы по-другому. Пока, к сожалению, опыты только на бумаге. И, скорее всего, именно это становится причиной того, что люди считают данный раздел физики чем-то чисто теоретическим, далеким от жизни и ненужным.
Пока, к сожалению, опыты только на бумаге. И, скорее всего, именно это становится причиной того, что люди считают данный раздел физики чем-то чисто теоретическим, далеким от жизни и ненужным.
Поэтому мы решили в качестве примера привести уже упоминаемый выше велосипед. Человек давит на педали – совершает над ними работу. Помимо сообщения всему механизму крутящего момента (благодаря которому велосипед и перемещается в пространстве), изменяется внутренняя энергия материалов, из которых сделаны рычаги. Велосипедист нажимает на ручки, чтобы повернуть, – и опять совершает работу.
Внутренняя энергия внешнего покрытия (пластика или металла) увеличивается. Человек выезжает на полянку под яркое солнце – велосипед нагревается, изменяется его количество теплоты. Останавливается отдохнуть в тени старого дуба, и система охлаждается, теряя калории или джоули. Увеличивает скорость – растет обмен энергией. Однако расчет количества теплоты во всех этих случаях покажет очень маленькую, незаметную величину. Поэтому и кажется, что проявлений термодинамической физики в реальной жизни нет.
Поэтому и кажется, что проявлений термодинамической физики в реальной жизни нет.
Применение расчетов по изменению количества теплоты
Вероятно, читатель скажет, что все это весьма познавательно, но зачем же нас так мучают в школе этими формулами. А сейчас мы приведем примеры, в каких областях человеческой деятельности они нужны непосредственно и как это касается любого в его повседневности.
Для начала посмотрите вокруг себя и посчитайте: сколько предметов из металла вас окружают? Наверняка больше десяти. Но прежде чем стать скрепкой, вагоном, кольцом или флешкой, любой металл проходит выплавку. Каждый комбинат, на котором перерабатывают, допустим, железную руду, должен понимать, сколько требуется топлива, чтобы оптимизировать расходы. А рассчитывая это, необходимо знать теплоемкость металлосодержащего сырья и количество теплоты, которое ему необходимо сообщить, чтобы произошли все технологические процессы. Так как выделяемая единицей топлива энергия рассчитывается в джоулях или калориях, то формулы нужны непосредственно.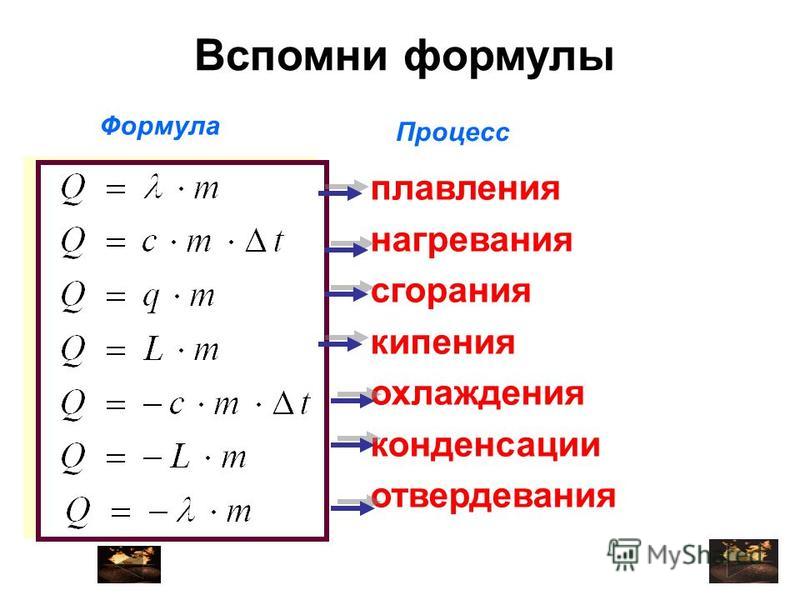
Или другой пример: в большинстве супермаркетов есть отдел с замороженными товарами – рыбой, мясом, фруктами. Там, где сырье из мяса животных или морепродуктов превращается в полуфабрикат, должны знать, сколько электричества употребят холодильные и морозильные установки на тонну или единицу готового продукта. Для этого следует рассчитать, какое количество теплоты теряет килограмм клубники или кальмаров при охлаждении на один градус Цельсия. А в итоге это покажет, сколько электричества потратит морозильник определенной мощности.
Самолеты, пароходы, поезда
Выше мы показали примеры относительно неподвижных, статичных предметов, которым сообщают или у которых, наоборот, отнимают определенное количество теплоты. Для объектов, в процессе работы движущихся в условиях постоянно меняющейся температуры, расчеты количества теплоты важны по другой причине.
Есть такое понятие, как “усталость металла”. Включает оно в себя также и предельно допустимые нагрузки при определенной скорости изменения температуры. Представьте, самолет взлетает из влажных тропиков в замороженные верхние слои атмосферы. Инженерам приходится много работать, чтобы он не развалился из-за трещин в металле, которые появляются при перепаде температуры. Они ищут такой состав сплава, который способен выдержать реальные нагрузки и будет иметь большой запас прочности. А чтобы не искать вслепую, надеясь случайно наткнуться на нужную композицию, приходится делать много расчетов, в том числе и включающих изменения количества теплоты.
Представьте, самолет взлетает из влажных тропиков в замороженные верхние слои атмосферы. Инженерам приходится много работать, чтобы он не развалился из-за трещин в металле, которые появляются при перепаде температуры. Они ищут такой состав сплава, который способен выдержать реальные нагрузки и будет иметь большой запас прочности. А чтобы не искать вслепую, надеясь случайно наткнуться на нужную композицию, приходится делать много расчетов, в том числе и включающих изменения количества теплоты.
Температура (в физике) – это… Что такое Температура (в физике)?
- Температура (в физике)
- Температура (от лат. temperatura — надлежащее смешение, соразмерность, нормальное состояние), физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Т. одинакова для всех частей изолированной системы, находящейся в равновесии термодинамическом.
 Если изолированная система не находится в равновесии, то с течением времени переход энергии (теплопередача) от более нагретых частей системы к менее нагретым приводит к выравниванию Т. во всей системе (первый постулат, или нулевое начало термодинамики). Т. определяет: распределение образующих систему частиц по уровням энергии (см. Больцмана статистика) и распределение частиц по скоростям (см. Максвелла распределение); степень ионизации вещества (см. Саха формула); свойства равновесного электромагнитного излучения тел — спектральную плотность излучения (см. Планка закон излучения), полную объёмную плотность излучения (см. Стефана — Больцмана закон излучения) и т. д. Т., входящую в качестве параметра в распределение Больцмана, часто называют Т. возбуждения, в распределение Максвелла — кинетической Т., в формулу Саха — ионизационной Т., в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы.
Если изолированная система не находится в равновесии, то с течением времени переход энергии (теплопередача) от более нагретых частей системы к менее нагретым приводит к выравниванию Т. во всей системе (первый постулат, или нулевое начало термодинамики). Т. определяет: распределение образующих систему частиц по уровням энергии (см. Больцмана статистика) и распределение частиц по скоростям (см. Максвелла распределение); степень ионизации вещества (см. Саха формула); свойства равновесного электромагнитного излучения тел — спектральную плотность излучения (см. Планка закон излучения), полную объёмную плотность излучения (см. Стефана — Больцмана закон излучения) и т. д. Т., входящую в качестве параметра в распределение Больцмана, часто называют Т. возбуждения, в распределение Максвелла — кинетической Т., в формулу Саха — ионизационной Т., в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы. В кинетической теории газов и др. разделах статистической механики Т. количественно определяется так, что средняя кинетическая энергия поступательного движения частицы (обладающей тремя степенями свободы) равнакТ, где k — Больцмана постоянная, Т — температура тела. В общем случае Т. определяется как производная от энергии тела в целом по его энтропии. Такая Т. всегда положительна (поскольку кинетическая энергия положительна), её называют абсолютной Т. или Т. по термодинамической температурной шкале. За единицу абсолютной Т. в Международной системе единиц (СИ) принят кельвин (К). Часто Т. измеряют по шкале Цельсия (t), значения t связаны с Т равенством t = Т √ 273,15 К (градус Цельсия равен Кельвину). Методы измерения Т. рассмотрены в статьях Термометрия, Термометр.
В кинетической теории газов и др. разделах статистической механики Т. количественно определяется так, что средняя кинетическая энергия поступательного движения частицы (обладающей тремя степенями свободы) равнакТ, где k — Больцмана постоянная, Т — температура тела. В общем случае Т. определяется как производная от энергии тела в целом по его энтропии. Такая Т. всегда положительна (поскольку кинетическая энергия положительна), её называют абсолютной Т. или Т. по термодинамической температурной шкале. За единицу абсолютной Т. в Международной системе единиц (СИ) принят кельвин (К). Часто Т. измеряют по шкале Цельсия (t), значения t связаны с Т равенством t = Т √ 273,15 К (градус Цельсия равен Кельвину). Методы измерения Т. рассмотрены в статьях Термометрия, Термометр.Строго определённой Т. характеризуется лишь равновесное состояние тел. Существуют, однако, системы, состояние которых можно приближённо охарактеризовать несколькими не равными друг другу температурами. Например, в плазме, состоящей из лёгких (электроны) и тяжёлых (ионы) заряженных частиц, при столкновении частиц энергия быстро передаётся от электронов к электронам и от ионов к ионам, но медленно от электронов к ионам и обратно.
 Существуют состояния плазмы, в которых системы электронов и ионов в отдельности близки к равновесию, и можно ввести Т. электронов Тэ и Т. ионов Ти, не совпадающие между собой.
Существуют состояния плазмы, в которых системы электронов и ионов в отдельности близки к равновесию, и можно ввести Т. электронов Тэ и Т. ионов Ти, не совпадающие между собой.В телах, частицы которых обладают магнитным моментом, энергия обычно медленно передаётся от поступательных к магнитным степеням свободы, связанным с возможностью изменения направления магнитного момента. Благодаря этому существуют состояния, в которых система магнитных моментов характеризуется Т., не совпадающей с кинетической Т., соответствующей поступательному движению частиц. Магнитная Т. определяет магнитную часть внутренней энергии и может быть как положительной, так и отрицательной (см. Отрицательная температура). В процессе выравнивания Т. энергия передаётся от частиц (степеней свободы) с большей Т. к частицам (степеням свободы) с меньшей Т., если они одновременно положительны или отрицательны, но в обратном направлении, если одна из них положительна, а другая отрицательна. В этом смысле отрицательная Т.
 «выше» любой положительной.
«выше» любой положительной.Понятие Т. применяют также для характеристики неравновесных систем (см. Термодинамика неравновесных процессов). Например, яркость небесных тел характеризуют яркостной температурой, спектральный состав излучения — цветовой температурой и т. д.
Л. Ф. Андреев.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Температура (в астрофизике)
- Температура замерзания растворов
Полезное
Смотреть что такое “Температура (в физике)” в других словарях:
Температура (в физике) — … Википедия
ТЕМПЕРАТУРА — • ТЕМПЕРАТУРА, в биологии интенсивность тепла. У теплокровных (ГОМОЙОТЕРМНЫХ) животных, таких, как птицы и млекопитающие, температура тела поддерживается в узких пределах независимо от температуры окружающей среды.
 Это обусловлено мышечной… … Научно-технический энциклопедический словарь
Это обусловлено мышечной… … Научно-технический энциклопедический словарьТемпература — Размерность Θ Единицы измерения СИ К … Википедия
Температура кипения — Температура кипения, точка кипения температура, при которой происходит кипение жидкости, находящейся под постоянным давлением. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как … Википедия
Температура воздуха* — Главнейшим элементом, характеризующим погоду, является Т. газовой среды, окружающей земную поверхность, правильнее Т. того слоя воздуха, который подлежит нашему наблюдению. При метеорологических наблюдениях этому элементу и отводится первое место … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Температура воздуха — Главнейшим элементом, характеризующим погоду, является Т. газовой среды, окружающей земную поверхность, правильнее Т.
 того слоя воздуха, который подлежит нашему наблюдению. При метеорологических наблюдениях этому элементу и отводится первое место … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
того слоя воздуха, который подлежит нашему наблюдению. При метеорологических наблюдениях этому элементу и отводится первое место … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефронатемпература — 1) Величина, характеризующая физ.тела в состоянии теплового равновесия, связана с интенсивностью теплового движения частей тела; 2) степень теплоты человеческого тела как показатель здоровья; разг. повышенная степень теплоты тела при… … Историко-этимологический словарь латинских заимствований
Список обозначений в физике — Необходимо проверить качество перевода и привести статью в соответствие со стилистическими правилами Википедии. Вы можете помочь … Википедия
Важнейшие открытия в физике — История технологий По периодам и регионам: Неолитическая революция Древние технологии Египта Наука и технологии древней Индии Наука и технологии древнего Китая Технологии Древней Греции Технологии Древнего Рима Технологии исламского мира… … Википедия
Отрицательная абсолютная температура — температура, характеризующая равновесные состояния термодинамической системы, в которых вероятность обнаружить систему в микросостоянии с более высокой энергией выше, чем в микросостоянии с более низкой.
 В квантовой статистике это значит, что… … Википедия
В квантовой статистике это значит, что… … Википедия
Книги
- Спектральная пирометрия, Магунов Александр Николаевич. Рассматривается новый экспериментальный метод измерения температуры нагретых объектов по непрерывному спектру теплового излучения, регистрируемому в широком интервале длин волн (например, от… Подробнее Купить за 1896 грн (только Украина)
- Механика и молекулярная физика. Учебное пособие, Ландау Лев Давидович, Ахиезер Александр Ильич, Лифшиц Евгений Михайлович. Трудно писать о книге Л. Д. Ландау, А. И. Ахиезера, Е. М. Лифшица, потому что это как раз тот случай, когда ни книга, ни, тем более, её авторы, как принято говорить,`в рекламене нуждаются`.… Подробнее Купить за 1849 грн (только Украина)
- Статистическая физика сложных систем. От фракталов до скейлинг-поведения. Выпуск 57, Абаимов С.Г.. Многообразие происходящих в природе явлений, на первый взгляд, не подчиняется каким-то унифицированным принципам, и каждое явление требует введения своих законовописания поведения.
 Однако… Подробнее Купить за 1225 грн (только Украина)
Однако… Подробнее Купить за 1225 грн (только Украина)
Разработка урока по физике «Расчет количества теплоты, необходимо го для нагревания те ла или выделяемого им при охлаждении. Уравнение теплового баланса». 8-й класс
Урок разработан по учебнику: А.В.Перышкин «Физика. 8 класс».
Цель урока: Знать формулу расчета количества теплоты, необходимого для нагревания тела или выделяемого им при охлаждении. Уметь решать задачи на количество теплоты.
Задачи урока: Детально разобрать важнейшую ключевую ситуацию в тепловых явлениях – теплопередачу между двумя телами, в результате которой тела приходят в тепловое равновесие друг с другом и решение задач демонстрационным опытом, развитие физической интуиции школьников.
Тип урока: Урок изучения нового материала.
Форма проведения: Исследовательская работа.
Оборудование: Калориметр, сосуд с горячей водой, стакан с водой комнатной температуры, металлический цилиндр привязанный к нити, термометр, карточки с задачами, мультимедийный проектор.
1. Начало урока: Объявление темы. Организационный момент2. Получение новых знанийНачинаем с демонстрационного опыта, сходного с лабораторной работой по измерению удельной теплоемкости вещества. Но не спешим с расчетами: сначала нужно, чтобы ребята хорошо поняли смысл происходящего. Погружаем вынутый из кипящей воды металлический цилиндр в калориметр с водой комнатной температуры и проводим беседу. При этом неторопливо и отчетливо повторяем новые для учеников термины, характеризующие тепловые процессы.
Если ученики не смогут дать ответ, не упрекаем их и даем ответ сами. Проявляем терпение, и оно наверняка будет вознаграждено: ребята начнут проявлять всю большую самостоятельность в ответах.
Учитель: Какое не видимое невооруженным глазом явление сейчас происходит в калориметре.
Учащиеся: Теплопередача, внутренняя энергия переходит от нагретого цилиндра к воде.
Учитель: Можно ли это явление сделать видимым?
Учащиеся: Да, для этого надо опустить в воду термометр: его показание будет увеличиваться. (Прокомментируем заодно двумя-тремя словами значение измерительных приборов: они расширяют возможности наших органов чувств)
Учитель: Какое тело вследствие теплопередачи отдает некоторое количество теплоты?
Учащиеся: Металлический цилиндр; его начальная температура выше, чем температура воды, поэтому он охлаждается.
Учитель: А какое тело получает некоторое количество теплоты?
Учащиеся: Вода; вследствие теплопередачи она нагревается.
Учитель: Как связаны количество теплоты Qм, отдаваемое цилиндром, и количество теплоты Qв, получаемое водой? (Напишем рядом на доске обозначения для указанных количеств теплоты, оставив между ними место для знака равенства. ) Будем считать,что теплопередачей с окружающей средой можно пренебречь.
) Будем считать,что теплопередачей с окружающей средой можно пренебречь.
Учащиеся: Эти количества теплоты равны.
Учитель: Правильно. (Пишем знак равенства между выражениями для количеств теплоты: Qм= Qв.) А откуда следует это равенство?
Учащиеся: Это уравнение теплового баланса,которое является следствием закона сохранения энергии в тепловых явлениях.
Учитель: Точно. Каким же будет результат теплопередачи?
Учащиеся: Цилиндр и вода в калориметре придут в состояние теплового равновесия.
Учитель: Что это означает?
Учащиеся: Температуры цилиндра и воды станут равными.
Учитель: Посмотрим теперь, что мы сможем измерить в нашем опыте. Введем для этого некоторые обозначения. Начнем с металлического цилиндра. Обозначим его массу mм, начальную температуру tм, а конечную общую температуру цилиндра и воды tk. Достаточно ли этих величин, чтобы записать выражение для количества теплоты, отданной цилиндром?
Достаточно ли этих величин, чтобы записать выражение для количества теплоты, отданной цилиндром?
Учащиеся: Нет, потому что оно зависит еще от удельной теплоемкости вещества, из которого сделан цилиндр.
Учитель: Правильно. Обозначим эту удельную теплоемкость cм. Как тогда записать выражение для количества теплоты Qм, отданной цилиндром?
Учащиеся: Qм= cм mм(tм– tk). (Записываем эту формулу на доске)
Учитель: Хорошо. А как записать выражение для количества теплоты Qв, полученного водой? Обозначим массу воды mв, ее начальную температуру tв, а удельную теплоемкость св.
Учащиеся: Qв = свmв (tk – tв) (Записываем эту формулу на доске справа от предыдущей, чтобы потом можно было с помощью небольших изменений «преобразовать» эти две формулы в следующую. )
)
Учитель: Какой же вид примет теперь уравнение теплового баланса?
Учащиеся: cм mм (tм – tk)= свmв (tk – tв) (Получаем эту формулу на доске из двух предыдущих)
Учитель: Посмотрим теперь на это равенство как на источник задач. Сколько физических величин входит в написанное равенство?
Учащиеся: Семь: удельные теплоемкости cм и св, массы mм и mв, начальные температуры tм и tв, а также конечная температура tk.
Учитель: Значит, можно составить семь различных задач: в каждой из них одна физическая величина неизвестна, а все остальные известны. Например в лабораторной работе, которую вы скоро будете делать, неизвестной величиной будет удельная теплоемкость металла из которого сделан цилиндр. Как преобразовать наше уравнение теплового баланса, чтобы найти удельную теплоемкость металла?
Учащиеся: cм = (свmв (tk – tв)) / mм (tм – tk) (Записываем эту формулу на доске)
Перед лабораторной работой не забудьте попросить учеников повторить вывод этой формулы. Напомните им, что в этом опыте и в лабораторной работе мы пренебрегаем количеством теплоты, которое получил внутренний стакан калориметра.)
Напомните им, что в этом опыте и в лабораторной работе мы пренебрегаем количеством теплоты, которое получил внутренний стакан калориметра.)
Поможем ребятам сформулировать другие задачи. Нужно постараться, чтобы в них были достаточно простые числовые данные. Приведем примеры (с общей оговоркой, что можно пренебречь теплообменом с окружающей средой).
3. Обобщение и закрепление нового материала(Используем мультимедийный проектор и экран для проверки хода решения и ответов задач)
Решим несколько таких задач:
Задача №1. Смешали 6 кг холодной воды, имеющей температуру 8oС, с 2 кг горячей воды при температуре 80oС. Определите конечную температуру смеси.
Решение: Обозначим температуру и массу холодной воды через t1 и m1. Горячей воды через t2 и m2
Q1 = с1m1 (t2 -tk) – количество теплоты полученное холодной водой.
Q2 = с2m2 (tk -t1) – количество теплоты, отданное горячей водой. Количество теплоты, отданное горячей водой, равно количеству теплоты, полученному холодной водой.
Q1=Q2 или с1m1 (t2 – tk) = с2m2 (tk -t1), т.к. с1 = с2.
Обе части уравнения сокращаем на с1, получаем m1 (t2 – tk) = m2 (tk – t1) Решая уравнение и подставив численные значения получаем ответ: конечная температура смеси 26oС.
Задача №2. Для ванны необходимо приготовить воду с температурой 36oС. Из горячего крана смесителя идет вода при температуре 80oС, а из холодного – при температуре 8oС. Сколько надо взять горячей воды, чтобы приготовить ванну, если для этого требуется 196 кг холодной воды?
Решение: Обозначим массу холодной воды mx, общую массу воды m, массу горячей вод mr = m – mx Qx = с mx (tk – tx) – количество теплоты полученное холодной водой. Qr = с mr (tr – tk) – количество теплоты отданное горячей водой. Количество теплоты, полученное холодной водой равно количеству теплоты, отданному горячей водой. Qx = Qr. Тогда уравнение теплового равновесия примет вид с mr (tr– tk) = с mx (tk – tx). Сокращаем обе части уравнение на с. Получаем уравнение с одним неизвестным mr (tr– tk) = mx(tk – tx). mr = (mx (tk – tx))/ (tr – tk), mr = 125кг
Qr = с mr (tr – tk) – количество теплоты отданное горячей водой. Количество теплоты, полученное холодной водой равно количеству теплоты, отданному горячей водой. Qx = Qr. Тогда уравнение теплового равновесия примет вид с mr (tr– tk) = с mx (tk – tx). Сокращаем обе части уравнение на с. Получаем уравнение с одним неизвестным mr (tr– tk) = mx(tk – tx). mr = (mx (tk – tx))/ (tr – tk), mr = 125кг
Ответ: надо взять 125 кг горячей воды.
Задача №3. В 1 л воды при температуре 18oС вылили 300 г расплавленного олова, имеющего температуру 232oС. На сколько градусов при этом нагрелась вода?
Решение: Обозначим Q1 = с1m1 (tk – t1) количество теплоты полученное водой. Q2 = с2m (t2 – t1) – количество теплоты выделившееся при охлаждении олова. Q3 = Lm2 – количество теплоты выделившееся при кристаллизации расплавленного олова. L – удельная теплота плавления олова. Количество теплоты отданное оловом равно количеству теплоты полученному водой. Пишем уравнение теплового баланса.
Q2 = с2m (t2 – t1) – количество теплоты выделившееся при охлаждении олова. Q3 = Lm2 – количество теплоты выделившееся при кристаллизации расплавленного олова. L – удельная теплота плавления олова. Количество теплоты отданное оловом равно количеству теплоты полученному водой. Пишем уравнение теплового баланса.
Q1= Q2 + Q3,
с1m1 (tk – t1) = с2m2 (t2 – t1) + Lm2. (tk -t1) = (с2m2 (t2 – t1) + Lm2 ) / с1m1, (tk– t1) =(с2m2 (t2 – t1) + Lm2)// с1rV,
где r – плотность воды, V – объем воды.
m1 = rV. Решая уравнение и подставив численные значения получаем ответ. Вода нагрелась на 8oC.
Вода нагрелась на 8oC.
Остановимся на использовании уравнения теплового баланса в случае трех тел с различными температурами. (Заметим, что эти задачи следует предлагать только на повышенном уровне). Сложность состоит в том, что в начале неизвестно, будет ли тело с «промежуточной» температурой нагреваться или охлаждаться. Поэтому просто приравнять количество теплоты, отданное одним телом (телами), количеству теплоты, полученному другим телом (телами), невозможно.
Иногда для решения подобных задач применяют вторую из упомянутых в начале этого раздела форм записи уравнения теплового баланса:
Q1 + Q2 + Q3 = 0,
где Q1 = с1m1 (tk– t1),
Q2 = с2m2 (tk– t2),
Q3 = с3m3 (tk – t3) (обозначения очевидны).
Решая уравнение теплового баланса, в котором неизвестной величиной является конечная температура, по ответу определяют, нагревалось или охлаждалось тело «промежуточной» температуры.
Такое решение дает правильный ответ, но оно не раскрывает существа дела, т.к. все внимание учеников уходит на написание громоздких формул и алгебраические преобразования, а не на понимание происходящих физических явлений. Поэтому лучше применять первую форму записи уравнения теплового баланса. Но для этого надо выяснить с помощью предварительного анализа условия задачи, будет нагреваться тело «промежуточной температуры или охлаждаться. Рассмотрим это на конкретном примере.
Задача № 4. В калориметр, содержащий воду массой 200 г при температуре 50oС, поместили стальной цилиндр массой 100г, вынутый из сосуда с тающим льдом, и медный брусок массой 250 г, вынутый из кипятка. Какой станет температура содержимого калориметра после установления теплового равновесия? Удельные теплоемкости меди и стали равны соответственно 400Дж/кгoС и 500Дж/кгoС.
Указание. Чтобы выяснить, будет вода нагреваться или охлаждаться в процессе установления теплового равновесия, рассмотрим, при каком условии температура воды в калориметре не изменится. Это произойдет, если медный брусок при охлаждении до начальной температуры воды (500) отдаст такое же количество теплоты, какое необходимо для нагревания стального цилиндра тоже до начальной температуры воды. Однако расчет с использованием приведенных в условии числовых данных показывает, что при этом медный брусок отдает большее количество теплоты, чем получает стальной цилиндр. Значит, в процессе установления теплового равновесия вода нагреется. Это позволяет написать уравнение теплового баланса в виде:
Это произойдет, если медный брусок при охлаждении до начальной температуры воды (500) отдаст такое же количество теплоты, какое необходимо для нагревания стального цилиндра тоже до начальной температуры воды. Однако расчет с использованием приведенных в условии числовых данных показывает, что при этом медный брусок отдает большее количество теплоты, чем получает стальной цилиндр. Значит, в процессе установления теплового равновесия вода нагреется. Это позволяет написать уравнение теплового баланса в виде:
Qм =Qc + Qв,
где Qм – количество теплоты, отданное медным бруском.
Qc – количество теплоты, полученное стальным цилиндром,
Qв– количество теплоты, полученное водой. Все количества теплоты при этом положительны.
4. Заключительный этапМне очень понравилось с вами работать. А теперь подведем итоги вашей работы на сегодняшнем уроке.
Задание на дом: Решить задачи.
Задача №1. Стакан емкостью 200 см3 наполовину заполнен водой при температуре 20oС. Его доливают доверху кипятком. Какова будет температура воды в стакане?
Задача №2. Какую массу кипятка надо долить в детскую ванночку, содержащую 20 л воды при температуре 20oС, чтобы конечная температура воды стала равной 30oС?
Задача №3. Кипяток массой 200г налили в фарфоровую чашку массой 100г. Тепловое равновесие установилось при температуре 80oС. Какой была начальная температура чашки? Удельная теплоемкость фарфора 1100 Дж/кг.
Подготовиться к лабораторной работе №2
Использованная литература1. Л.Э.Генденштейн, В.А.Орлов, Г.Г.Никифоров. Учебно-методическое пособие. «Как научить решать задачи по физике (основная школа). Подготовка к ГИА. Москва. Педагогический университет « Первое сентября» 2011.
2. А.В.Перышкин. Физика. 8класс: учеб. для общеобразоват. учреждений. Москва. Дрофа, 2010.
для общеобразоват. учреждений. Москва. Дрофа, 2010.
Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Подробности
- Просмотров: 733
Температура – это просто!
Температура
Температура – это мера средней кинетической энергии молекул.
Температура характеризует степень нагретости тел.
Прибор для измерения температуры – термометр.
Принцип действия термометра:
При измерении температуры используется зависимость изменения какого-либо макроскопического параметра (объема, давления, электрического сопротивления и т.д.) вещества от температуры.
В жидкостных термометрах – это изменение объема жидкости.
При контакте двух сред происходит передача энергии от более нагретой среды менее нагретой.
В процессе измерения температура тела и термометра приходят в состояние теплового равновесия.
Жидкостные термометры
На практике часто используются жидкостные термометры: ртутные (в диапазоне от -35oС до +750oС) и спиртовые (от -80oС до +70oС).
В них используется свойство жидкости изменять свой объем при изменении температуры.
Однако, у каждой жидкости существуют свои особенности изменения объема (расширения) при различных температурах.
В результате сравнения, например, показаний ртутного и спиртового термометров, точное совпадение будет только лишь в двух точках (при температурах 0oС и 100oС).
Этих недостатков лишены газовые термометры.
Газовые термометры
Первый газовый термометр был создан французским физиком Ж. Шарлем.
Преимущества газового термометра:
– используется линейная зависимость изменения объема или давления газа от температуры, которая справедлива для всех газов
– точность измерения от 0,003oС до 0,02oС
– интервал температур от -271oС до +1027oС.
Тепловое равновесие
При соприкосновении двух тел различной температуры происходит передача внутренней энергии от более нагретого тела менее нагретому, и температуры обоих тел выравниваются.
Наступает состояние теплового равновесия, при котором все макропараметры (объем, давление, температура) обоих тел остаются в дальнейшем неизменными при неизменных внешних условиях.
Тепловым равновесием называется такое состояние, при котором все макроскопические параметры остаются неизменными сколь угодно долго.
Состояние теплового равновесия системы тел характеризуется температурой: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е.
Для разреженных (идеальных) газов величина
и зависит только от температуры, тогда
где k – постоянная Больцмана
Эта зависимость дает возможность ввести новую температурную шкалу абсолютную шкалу температур, не зависящую от вещества, используемого для измерения температуры.
Абсолютная шкала температур
– введена английским физиком У. Кельвином
– нет отрицательных температур
Единица абсолютной температуры в СИ: [T] = 1K (Кельвин)
Нулевая температура абсолютной шкалы – это абсолютный ноль ( 0К = -273oС ), самая низкая температура в природе. В настоящее время достигнута самая низкая температура – 0,0001К.
По величине 1К равен 1oC.
Связь абсолютной шкалы со шкалой Цельсия
Запомни! В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
После введения абсолютной температуры получаем новые выражения для формул:
Средняя кинетическая энергия поступательного движения молекул
Давление газа – основное уравнение МКТ
Средняя квадратичная скорость молекул
И как следствие, закон Авогадро:
В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Заметьте, здесь концентрация молекул также одинакова!
Молекулярная физика. Термодинамика – Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. – Взаимодействие молекул. Строение твердых тел, жидкостей и газов. – Идеальный газ. Основное уравнение МКТ. — Температура. Тепловое равновесие. Абсолютная шкала температур. — Уравнение состояния идеального газа. — Изопроцессы. Газовые законы. — Взаимные превращения жидкостей и газов. Влажность воздуха. — Твердые тела. Кристаллические тела. Аморфные тела.
8 класс – Физика
Как вы думаете, от чего зависит скорость растворения сахара в воде? Можете провести простой эксперимент. Возьмите два куска сахара и киньте один в стакан с кипятком, другой – в стакан с холодной водой.
Вы увидите, как сахар в кипятке растворится в несколько раз быстрее, чем в холодной воде. Причиной растворения является диффузия. Значит, диффузия происходит быстрее при более высокой температуре. А причина диффузии – это движение молекул. Следовательно, мы делаем вывод, что молекулы при более высокой температуре движутся быстрее. То есть, скорость их движения зависит от температуры. Именно поэтому беспорядочное хаотическое движение молекул, из которых состоят тела, называют тепловым движением.
Значит, диффузия происходит быстрее при более высокой температуре. А причина диффузии – это движение молекул. Следовательно, мы делаем вывод, что молекулы при более высокой температуре движутся быстрее. То есть, скорость их движения зависит от температуры. Именно поэтому беспорядочное хаотическое движение молекул, из которых состоят тела, называют тепловым движением.
При повышении температуры усиливается тепловое движение молекул, меняются свойства вещества. Твердое тело тает, превращаясь в жидкость, жидкость испаряется, переходя в газообразное состояние. Соответственно, если температуру понижать, то будет уменьшаться и средняя энергия теплового движения молекул, а соответственно, процессы изменения агрегатного состояния тел будут происходить в обратном направлении: вода будет конденсироваться в жидкость, жидкость будет замерзать, переходя в твердое состояние. При этом, мы всегда говорим о средних значениях температуры и скорости молекул, так как всегда присутствуют частицы с большими и меньшими значениями этих величин.
Молекулы в веществах движутся, проходя определенное расстояние, следовательно, совершают некую работу. То есть, мы можем говорить о кинетической энергии частиц. Вследствие их взаимного расположения существует также и потенциальная энергия молекул. Когда идет речь о кинетической и потенциальной энергии тел, то мы говорим о существовании полной механической энергии тел. Если кинетической и потенциальной энергией обладают частицы тела, следовательно, можно говорить о сумме этих энергии, как о самостоятельной величине.
Рассмотрим пример. Если мы кидаем упругий мячик об пол, то кинетическая энергия его движения полностью переходит в потенциальную в момент касания пола, а потом вновь переходит в кинетическую, когда он отскакивает. Если же мы бросим тяжелый железный мячик на твердую неупругую поверхность, то мячик приземлится, не отскакивая. Его кинетическая и потенциальная энергии после приземления будут равны нулю. Куда же подевалась энергия? Она просто исчезла? Если мы изучим шарик и поверхность после столкновения, то увидим, что шарик немного сплющился, на поверхности осталась вмятина, и оба они слегка нагрелись. То есть произошло изменение в расположении молекул тел, а также увеличилась температура. Это означает, что изменились кинетическая и потенциальная энергия частиц тела. Энергия тела никуда не пропала, она перешла во внутреннюю энергию тела. Внутренней энергией называют кинетическую и потенциальную энергию всех частиц тела. Столкновение тел вызвало изменение внутренней энергии, она увеличилась, а механическая энергия уменьшилась. В этом и состоит закон сохранения энергии. Энергия не возникает из ниоткуда и не исчезает в никуда. Она только переходит из одного состояния в другое.
То есть произошло изменение в расположении молекул тел, а также увеличилась температура. Это означает, что изменились кинетическая и потенциальная энергия частиц тела. Энергия тела никуда не пропала, она перешла во внутреннюю энергию тела. Внутренней энергией называют кинетическую и потенциальную энергию всех частиц тела. Столкновение тел вызвало изменение внутренней энергии, она увеличилась, а механическая энергия уменьшилась. В этом и состоит закон сохранения энергии. Энергия не возникает из ниоткуда и не исчезает в никуда. Она только переходит из одного состояния в другое.
Как изменить механическую энергию тела? Да очень просто. Поменять его местоположение или придать ему ускорение. Например, пнуть мячик или поднять его над землей повыше.
В первом случае мы изменим его кинетическую энергию, во втором потенциальную. А как обстоит дело с внутренней энергией? Каким способом изменить внутреннюю энергию тела? Для начала разберемся, что же это такое. Внутренняя энергия – это кинетическая и потенциальная энергия всех частиц, из которых состоит тело. В частности, кинетическая энергия частиц – это энергия их движения. А скорость их движения, как известно, зависит от температуры. То есть, логичный вывод – повышая температуру тела, мы повысим его внутреннюю энергию. Самый простой способ повысить температуру тела – это теплообмен. При контакте тел с разной температурой более холодное тело нагревается за счет более теплого. Более теплое тело в этом случае охлаждается.
В частности, кинетическая энергия частиц – это энергия их движения. А скорость их движения, как известно, зависит от температуры. То есть, логичный вывод – повышая температуру тела, мы повысим его внутреннюю энергию. Самый простой способ повысить температуру тела – это теплообмен. При контакте тел с разной температурой более холодное тело нагревается за счет более теплого. Более теплое тело в этом случае охлаждается.
Простой ежедневный пример: холодная ложка в чашке с горячим чаем очень быстро нагревается, а чай при этом чуть-чуть остывает. Повышение температуры тела возможно и другими способами. Как мы все поступаем, когда у нас на улице замерзают лицо или руки? Мы трем их. При трении предметы нагреваются. Также предметы нагреваются при ударах, давлении, то есть, иными словами, при взаимодействии. Всем известно, как добывали огонь в древности – либо терли деревяшки друг о друга, либо стукали кремнием по другому камню. Также и в наше время в кремниевых зажигалках используется трение металлического стержня о кремень.
До сих пор речь шла о изменении внутренней энергии путем изменения кинетической энергии составляющих его частиц. А как насчет потенциальной энергии этих же самых частиц? Как известно, потенциальная энергия частиц – это энергия их взаиморасположения. Таким образом, для изменения потенциальной энергии частиц тела, нам надо тело деформировать: сжать, скрутить и так далее, то есть, изменить расположение частиц друг относительно друга. Это достигается путем воздействия на тело. Мы меняем скорость отдельных частей тела, то есть совершаем над ним работу.
Таким образом, все случаи воздействия на тело с целью изменения его внутренней энергии достигаются двумя способами. Либо путем передачи ему тепла, то есть теплопередачей, либо путем изменения скорости его частиц, то есть совершением над телом работы.
Примеры изменения внутренней энергии – это практически все происходящие в мире процессы. Не меняется внутренняя энергия частиц в случае, когда с телом абсолютно ничего не происходит, что согласитесь, крайняя редкость – закон сохранения энергии действует. Вокруг нас все время что-то происходит. Даже с предметами, с которыми на первый взгляд ничего не происходит, на самом деле происходят различные незаметные нам изменения: незначительные изменения температуры, небольшие деформации и так далее. Стул прогибается под нашей тяжестью, у книги на полке чуть-чуть изменяется температуру от каждого движения воздуха, не говоря уже про сквозняки. Ну а что касается живых тел – тут понятно без слов, что в них внутри все время что-то происходит, и внутренняя энергия меняется практически в каждый момент времени.
Вокруг нас все время что-то происходит. Даже с предметами, с которыми на первый взгляд ничего не происходит, на самом деле происходят различные незаметные нам изменения: незначительные изменения температуры, небольшие деформации и так далее. Стул прогибается под нашей тяжестью, у книги на полке чуть-чуть изменяется температуру от каждого движения воздуха, не говоря уже про сквозняки. Ну а что касается живых тел – тут понятно без слов, что в них внутри все время что-то происходит, и внутренняя энергия меняется практически в каждый момент времени.
Что быстрее нагреется на плите – чайник или ведро воды? Ответ очевиден – чайник. Тогда второй вопрос – почему?
Ответ не менее очевиден – потому что масса воды в чайнике меньше. Отлично. А теперь вы можете проделать самостоятельно самый настоящий физический опыт в домашних условиях. Для этого вам понадобится две одинаковые небольшие кастрюльки, равное количество воды и растительного масла, например, по пол-литра и плита. На одинаковый огонь ставите кастрюльки с маслом и водой. А теперь просто наблюдайте, что быстрее будет нагреваться. Если есть градусник для жидкостей, можно применить его, если нет, можно просто пробовать температуру время от времени пальцем, только осторожно, чтобы не обжечься. В любом случае вы вскоре убедитесь, что масло нагревается значительно быстрее воды. И еще один вопросик, который тоже можно реализовать в виде опыта. Что быстрее закипит – теплая вода или холодная? Все снова очевидно – теплая будет на финише первой. К чему все эти странные вопросы и опыты? К тому, чтобы определить физическую величину, называемую «количеством теплоты».
А теперь просто наблюдайте, что быстрее будет нагреваться. Если есть градусник для жидкостей, можно применить его, если нет, можно просто пробовать температуру время от времени пальцем, только осторожно, чтобы не обжечься. В любом случае вы вскоре убедитесь, что масло нагревается значительно быстрее воды. И еще один вопросик, который тоже можно реализовать в виде опыта. Что быстрее закипит – теплая вода или холодная? Все снова очевидно – теплая будет на финише первой. К чему все эти странные вопросы и опыты? К тому, чтобы определить физическую величину, называемую «количеством теплоты».
Количество теплоты
Количество теплоты – это энергия, которую тело теряет или приобретает при теплопередаче. Это понятно и из названия. При остывании тело будет терять некое количество теплоты, а при нагревании – поглощать. А ответы на наши вопросы показали нам, от чего зависит количество теплоты?Во-первых, чем больше масса тела, тем большее количество теплоты надо затратить на изменение его температуры на один градус. Во-вторых, количество теплоты, необходимое для нагревания тела, зависит от того вещества, из которого оно состоит, то есть от рода вещества. И в-третьих, разность температур тела до и после теплопередачи также важна для наших расчетов. Исходя из всего вышесказанного, мы можем определить количество теплоты формулой:
Во-вторых, количество теплоты, необходимое для нагревания тела, зависит от того вещества, из которого оно состоит, то есть от рода вещества. И в-третьих, разность температур тела до и после теплопередачи также важна для наших расчетов. Исходя из всего вышесказанного, мы можем определить количество теплоты формулой:
Q=cm(t_2-t_1 ) ,
где Q – количество теплоты,
m – масса тела,
(t_2-t_1 ) – разность между начальной и конечной температурами тела,
c – удельная теплоемкость вещества, находится из соответствующих таблиц.
По этой формуле можно произвести расчет количества теплоты, которое необходимо, чтобы нагреть любое тело или которое это тело выделит при остывании.
Измеряется количество теплоты в джоулях (1 Дж), как и всякий вид энергии. Однако, величину эту ввели не так давно, а измерять количество теплоты люди начали намного раньше. И пользовались они единицей, которая широко используется и в наше время – калория (1 кал). 1 калория – это такое количество теплоты, которое потребуется для нагреванияь 1 грамма воды на 1 градус Цельсия. Руководствуясь этими данными, любители подсчитывать калории в съедаемой пище, могут ради интереса подсчитать, сколько литров воды можно вскипятить той энергией, которую они потребляют с едой в течение дня.
Руководствуясь этими данными, любители подсчитывать калории в съедаемой пище, могут ради интереса подсчитать, сколько литров воды можно вскипятить той энергией, которую они потребляют с едой в течение дня.
Как вы думаете, что быстрее нагревается на плите: литр воды в кастрюльке или же сама кастрюлька массой 1 килограмм? Масса тел одинакова, можно предположить, что нагревание будет происходить с одинаковой скоростью.
А не тут-то было! Можете проделать эксперимент – поставьте пустую кастрюльку на огонь на несколько секунд, только не спалите, и запомните, до какой температуры она нагрелась. А потом налейте в кастрюлю воды ровно такого же веса, как и вес кастрюли. По идее, вода должна нагреться до такой же температуры, что и пустая кастрюля за вдвое большее время, так как в данном случае нагреваются они обе – и вода, и кастрюля.
Однако, даже если вы выждете втрое большее время, то убедитесь, что вода нагрелась все равно меньше. Воде потребуется почти в десять раз большее время, чтобы нагреться до такой же температуры, что и кастрюля того же веса. Почему это происходит? Что мешает воде нагреваться? Почему мы должны тратить лишний газ на подогрев воды при приготовлении пищи? Потому что существует физическая величина, называемая удельной теплоемкостью вещества.
Почему это происходит? Что мешает воде нагреваться? Почему мы должны тратить лишний газ на подогрев воды при приготовлении пищи? Потому что существует физическая величина, называемая удельной теплоемкостью вещества.
Удельная теплоемкость вещества
Эта величина показывает, какое количество теплоты надо передать телу массой один килограмм, чтобы его температура увеличилась на один градус Цельсия. Измеряется в Дж/(кг * ˚С). Существует эта величина не по собственной прихоти, а по причине разности свойств различных веществ.
Удельная теплоемкость воды примерно в десять раз выше удельной теплоемкости железа, поэтому кастрюля нагреется в десять раз быстрее воды в ней. Любопытно, что удельная теплоемкость льда в два раза меньше теплоемкости воды. Поэтому лед будет нагреваться в два раза быстрее воды. Растопить лед проще, чем нагреть воду. Как ни странно звучит, но это факт.
Расчет количества теплоты
Обозначается удельная теплоемкость буквой c и применяется в формуле для расчета количества теплоты:
Q = c*m*(t2 – t1),
где Q – это количество теплоты,
c – удельная теплоемкость,
m – масса тела,
t2 и t1 – соответственно, конечная и начальная температуры тела.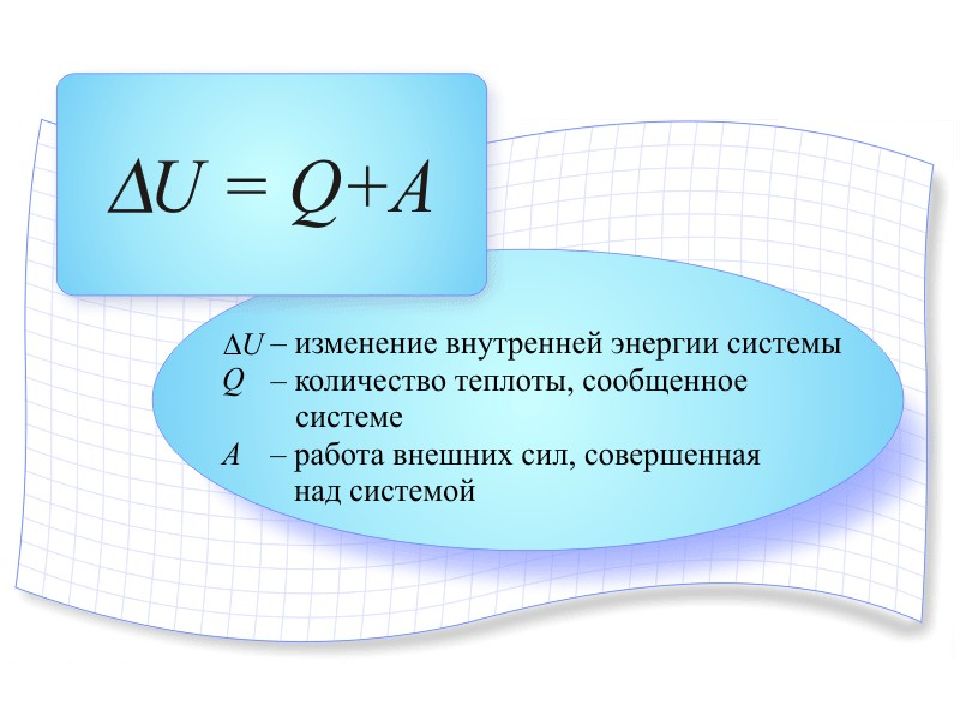
Формула удельной теплоемкости: c = Q / m*(t2 – t1)
По этой формуле можно рассчитать количество тепла, которое нам необходимо, чтобы нагреть конкретное тело до определенной температуры. Удельную теплоемкость различных веществ можно найти из соответствующих таблиц.
Также из этой формулы можно выразить:
- m = Q / c*(t2-t1) – массу тела
- t1 = t2 – (Q / c*m) – начальную температуру тела
- t2 = t1 + (Q / c*m) – конечную температуру тела
- Δt = t2 – t1 = (Q / c*m) – разницу температур (дельта t)
А что насчет удельной теплоемкости газов? Тут все запутанней. С твердыми веществами и жидкостями дело обстоит намного проще. Их удельная теплоемкость – величина постоянная, известная, легко рассчитываемая. А что касается удельной теплоемкости газов, то величина эта очень различна в разных ситуациях. Возьмем для примера воздух. Удельная теплоемкость воздуха зависит от состава, влажности, атмосферного давления.
Возьмем для примера воздух. Удельная теплоемкость воздуха зависит от состава, влажности, атмосферного давления.
При этом, при увеличении температуры, газ увеличивается в объеме, и нам надо ввести еще одно значение – постоянного или переменного объема, что тоже повлияет на теплоемкость. Поэтому при расчетах количества теплоты для воздуха и других газов пользуются специальными графиками величин удельной теплоемкости газов в зависимости от различных факторов и условий.
Всем известно, что в нашей жизни огромную роль играет использование топлива. Топливо применяют практически в любой отрасли современной промышленности. Особенно часто применяется топливо, полученное из нефти: бензин, керосин, соляр и другие. Также применяют горючие газы (метан и другие).
Откуда берется энергия у топлива
Известно, что молекулы состоят из атомов. Для того, чтобы разделить какую либо молекулу (например, молекулу воды) на составляющие её атомы, требуется затратить энергию (на преодоление сил притяжения атомов). Опыты показывают, что при соединении атомов в молекулу (это и происходит при сжигании топлива) энергия, напротив, выделяется.
Опыты показывают, что при соединении атомов в молекулу (это и происходит при сжигании топлива) энергия, напротив, выделяется.
Как известно, существует ещё и ядерное топливо, но мы не будем здесь говорить о нём.
При сгорании топлива выделяется энергия. Чаще всего это тепловая энергия. Опыты показывают, что количество выделившейся энергии прямо пропорционально количеству сгоревшего топлива.
Удельная теплота сгорания
Для расчёта этой энергии используют физическую величину, называемую удельная теплота сгорания топлива. Удельная теплота сгорания топлива показывает, какая энергия выделяется при сгорании единичной массы топлива.
Её обозначают латинской буквой q. В системе СИ единица измерения этой величины Дж/кг. Отметим, что каждое топливо имеет собственную удельную теплоту сгорания. Эта величина измерена практически для всех видов топлива и при решении задач определяется по таблицам.
Например, удельная теплота сгорания бензина 46 000 000 Дж/кг, керосина такая же, этилового спирта 27 000 000 Дж/кг. Нетрудно понять, что энергия, выделившаяся при сгорании топлива, равна произведению массы этого топлива и удельной теплоты сгорания топлива:
Нетрудно понять, что энергия, выделившаяся при сгорании топлива, равна произведению массы этого топлива и удельной теплоты сгорания топлива:
Q = q*m
Рассмотрим пример
Рассмотрим пример. 10 граммов этилового спирта сгорело в спиртовке за 10 минут. Найдите мощность спиртовки.
Решение. Найдём количество теплоты, выделившееся при сгорании спирта:
Q = q*m; Q = 27 000 000 Дж/кг * 10 г = 27 000 000 Дж/кг * 0,01 кг = 270 000 Дж.
Найдём мощность спиртовки:
N = Q / t = 270 000 Дж / 10 мин = 270 000 Дж / 600 с = 450 Вт.
Для того чтобы понять, что такое агрегатное состояние вещества, вспомните или представьте себя летом возле речки с мороженным в руках. Замечательная картинка, правда?
Так вот, в этой идиллии кроме получения удовольствия можно еще осуществить физическое наблюдение. Обратите внимание на воду. В реке она жидкая, в составе мороженного в виде льда – твердая, а в небе в виде облаков – газообразная. То есть она находится одновременно в трех различных состояниях. В физике это называется агрегатным состоянием вещества. Различают три агрегатных состояния – твердое, жидкое и газообразное.
То есть она находится одновременно в трех различных состояниях. В физике это называется агрегатным состоянием вещества. Различают три агрегатных состояния – твердое, жидкое и газообразное.
Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества мы можем наблюдать воочию в природе. Вода с поверхности водоемов испаряется, и образуются облака. Так жидкость переходит в газ. Зимой вода в водоемах замерзает, переходя в твердое состояние, а весной вновь тает, переходя в обратно в жидкость. Что происходит с молекулами вещества при переходе его из одного состояния в другое? Меняются ли они? Отличаются ли, например, молекулы льда от молекул пара? Ответ однозначный: нет. Молекулы остаются абсолютно теми же. Меняется их кинетическая энергия, а соответственно и свойства вещества. Энергия молекул пара достаточно велика, чтобы разлетаться в разные стороны, а при охлаждении пар конденсируется в жидкость, и энергии у молекул все еще достаточно для почти свободного перемещения, но уже недостаточно, чтобы оторваться от притяжения других молекул и улететь. При дальнейшем охлаждении вода замерзает, становясь твердым телом, и энергии молекул уже недостаточно даже для свободного перемещения внутри тела. Они колеблются около одного места, удерживаемые силами притяжения других молекул.
При дальнейшем охлаждении вода замерзает, становясь твердым телом, и энергии молекул уже недостаточно даже для свободного перемещения внутри тела. Они колеблются около одного места, удерживаемые силами притяжения других молекул.
Характер движения и состояния молекул в различных агрегатных состояниях вещества можно отразить на следующей таблице:
Агрегатное состояние вещества | Свойства вещества | Расстояние между частицами | Взаимодействие частиц | Характер движения | Порядок расположения |
Газ | Не сохраняет форму и объем | Гораздо больше размеров самих частиц | Слабое | Хаотическое (беспорядочное) непрерывное. | Беспорядочное |
| Жидкость | Не сохраняет форму, сохраняет объем
| Сравнимо с размерами самих частиц | Сильное | Колеблются около положения равновесия, постоянно перескакивая с одного места на другое. | <p >Беспорядочное |
Твердое тело | <p >Сохраняет форму и объем | Мало по сравнению с размерами самих частиц | Очень сильное | Непрерывно колеблются около положения равновесия | В определенном порядке |
Процессов, в которых происходит изменение агрегатных состояний веществ, всего шесть.
Переход вещества из твердого состояния в жидкое называется плавлением, обратный процесс – кристаллизацией. Когда вещество переходит из жидкости в газ, это называется парообразованием, из газа в жидкость – конденсацией. Переход из твердого состояния сразу в газ, минуя жидкое, называют сублимацией, обратный процесс – десублимацией.
Когда вещество переходит из жидкости в газ, это называется парообразованием, из газа в жидкость – конденсацией. Переход из твердого состояния сразу в газ, минуя жидкое, называют сублимацией, обратный процесс – десублимацией.
- 1. Плавление
- 2. Кристаллизация
- 3. Парообразование
- 4. Конденсация
- 5. Сублимация
- 6. Десублимация
Примеры всех этих переходов мы с вами не раз наблюдали в жизни. Лед плавится, образуя воду, вода испаряется, образуя пар. В обратную сторону пар, конденсируясь, переходит снова в воду, а вода, замерзая, становится льдом. А если вы думаете, что вы не знаете процессов сублимации и десублимации, то не спешите с выводами. Запах любого твердого тела – это и есть не что иное, как сублимация. Часть молекул вырывается из тела, образуя газ, который мы и можем унюхать. А пример обратного процесса – это узоры на стеклах зимой, когда пар в воздухе, замерзая, оседает на стекле и образует причудливые узоры.
Одно и тоже вещество в реальном мире в зависимости от окружающих условий может находиться в различных состояниях. Например, вода может быть в виде жидкости, в идее твердого тела – лед, в виде газа – водяной пар.
- Эти состояния называются агрегатными состояниями вещества.
Молекулы вещества в различных агрегатных состояниях ничем не отличаются друг от друга. Конкретное агрегатное состояние определяется расположением молекул, а так же характером их движения и взаимодействия между собой.
Газ – расстояние между молекулами значительно больше размеров самих молекул. Молекулы в жидкости и в твердом теле расположены достаточно близко друг к другу. В твердых телах еще ближе.
Чтобы изменить агрегатное состояние тела, ему необходимо сообщить некоторую энергию. Например, чтобы перевести воду в пар её надо нагреть.Чтобы пар снова стал водой, он должен отдать энергию.
Переход из твердого состояния в жидкое
Переход вещества из твердого состояние в жидкое называется плавлением. Для того чтобы тело начало плавиться, его необходимо нагреть до определенной температуры. Температура, при которой вещество плавится, называют температурой плавления вещества.
Для того чтобы тело начало плавиться, его необходимо нагреть до определенной температуры. Температура, при которой вещество плавится, называют температурой плавления вещества.
Каждое вещество имеет свою температуру плавления. У каких-то тел она очень низкая, например, у льда. А у каких-то тел температура плавления очень высокая, например, железо. Вообще, плавление кристаллического тела это сложный процесс.
График плавления льда
Ниже на рисунке представлен график плавления кристаллического тела, в данном случае льда.
- График показывает зависимость температуры льда от времени, которое его нагревают. На вертикально оси отложена температура, по горизонтальной – время.
Из графика, что изначально температура льда была -20 градусов. Потом его начали нагревать. Температура начала расти. Участок АВ это участок нагревания льда. С течением времени, температура увеличилась до 0 градусов. Эта температура считается температурой плавления льда. При этой температуре лед начал плавиться, но при этом перестала возрастать его температура, хотя при этом лед также продолжали нагревать. Участку плавления соответствует участок ВС на графике.
При этой температуре лед начал плавиться, но при этом перестала возрастать его температура, хотя при этом лед также продолжали нагревать. Участку плавления соответствует участок ВС на графике.
Затем, когда весь лед расплавился и превратился в жидкость, температура воды снова стала увеличиваться. Это показано на графике лучом C. То есть делаем вывод, что во время плавления температура тела не изменяется, вся поступающая энергия идет на плвление.
Для того, чтобы расплавить какое-либо вещество в твердом состоянии, необходимо его нагреть. И при нагревании любого тела отмечается одна любопытная особенность
Особенность такая: температура тела растет вплоть до температуры плавления, а потом останавливается до того момента, пока все тело целиком не перейдет в жидкое состояние. После расплавления температура вновь начинает расти, если, конечно, продолжать нагревание. То есть, существует промежуток времени, во время которого мы нагреваем тело, а оно не нагревается. Куда же девается энергия тепла, которую мы расходуем? Чтобы ответить на этот вопрос, надо заглянуть внутрь тела.
Куда же девается энергия тепла, которую мы расходуем? Чтобы ответить на этот вопрос, надо заглянуть внутрь тела.
В твердом теле молекулы расположены в определенном порядке в виде кристаллов. Они практически не двигаются, лишь слегка колеблясь на месте. Для того, чтобы вещество перешло в жидкое состояние, молекулам необходимо придать дополнительную энергию, чтобы они смогли вырваться от притяжения соседних молекул в кристалликах. Нагревая тело, мы придаем молекулам эту необходимую энергию. И вот пока все молекулы не получат достаточно энергии и не разрушатся все кристаллики, температура тела не повышается. Опыты показывают, что для разных веществ одной массы требуется разное количество теплоты для полного его расплавления.
То есть существует определенная величина, от которой зависит, сколько тепла необходимо поглотить веществу для расплавления. И величина эта различна для разных веществ. Эта величина в физике называется удельная теплота плавления вещества. Опять же, вследствие опытов установлены значения удельной теплота плавления для различных веществ и собраны в специальные таблицы, из которых можно почерпнуть эти сведения. Обозначают удельную теплоту плавления греческой буквой λ (лямбда), а единицей измерения является 1 Дж/кг.
Обозначают удельную теплоту плавления греческой буквой λ (лямбда), а единицей измерения является 1 Дж/кг.
Формула удельной теплоты плавления
Удельная теплота плавления находится по формуле:
λ=Q/m,
где Q – это количество теплоты, необходимое для того, чтобы расплавить тело массой m.
Опять-таки из опытов известно, что при отвердевании вещества выделяют такое же количество тепла, которое требовалось затратить на их расплавление. Молекулы, теряя энергию, образуют кристаллы, будучи не в силах сопротивляться притяжению других молекул. И опять-таки, температура тела не будет понижаться вплоть до того момента, пока не отвердеет все тело, и пока не выделится вся энергия, которая была затрачена на его плавление. То есть удельная теплота плавления показывает, как сколько надо затратить энергии, чтобы расплавить тело массой m, так и сколько энергии выделится при отвердевании данного тела.
Для примера, удельная теплота плавления воды в твердом состоянии, то есть, удельная теплота плавления льда равна 3,4*105 Дж/кг. Эти данные позволяют рассчитать, сколько потребуется энергии, чтобы расплавить лед любой массы. Зная также удельную теплоемкость льда и воды, можно рассчитать, сколько точно потребуется энергии для конкретного процесса, например, расплавить лед массой 2 кг и температурой – 30˚С и довести получившуюся воду до кипения. Такие сведения для различных веществ очень нужны в промышленности для расчета реальных затрат энергии при производстве каких-либо товаров.
Эти данные позволяют рассчитать, сколько потребуется энергии, чтобы расплавить лед любой массы. Зная также удельную теплоемкость льда и воды, можно рассчитать, сколько точно потребуется энергии для конкретного процесса, например, расплавить лед массой 2 кг и температурой – 30˚С и довести получившуюся воду до кипения. Такие сведения для различных веществ очень нужны в промышленности для расчета реальных затрат энергии при производстве каких-либо товаров.
Если оставить незакрытым сосуд с водой, то через некоторое время вода испарится. Если проделать тот же опыт с этиловым спиртом или бензином, то процесс происходит несколько быстрее. Если кастрюлю с водой нагревать на достаточно мощной горелке, то вода закипит.
Все эти явления являются частным случаем парообразования превращения жидкости в пар. Существует два вида парообразования испарение и кипение.
Что такое испарение
Испарением называют парообразование с поверхности жидкости. Объяснить испарение можно следующим образом.
При соударениях скорости молекул меняются. Часто находятся молекулы, скорость которых настолько велика, что они преодолевают притяжение соседних молекул и отрываются от поверхности жидкости. (Молекулярное строение вещества). Так как даже в небольшом объёме жидкости очень много молекул, такие случаи получаются довольно часто, и идёт постоянный процесс испарения.
Отделившиеся от поверхности жидкости молекулы образуют над ней пар. Некоторые из них вследствие хаотического движения возвращаются обратно в жидкость. Поэтому испарение происходит быстрее, если есть ветер, так как он уносит пар в сторону от жидкости (здесь также имеет место явление «захвата» и отрыва молекул с поверхности жидкости ветром).
Поэтому же в закрытом сосуде испарение быстро прекращается: количество «оторвавшихся» за единицу времени молекул становится равно количеству «вернувшихся» в жидкость.
Интенсивность испарения зависит от рода жидкости: чем меньше притяжение между молекулами жидкости, тем интенсивнее испарение.
Чем больше площадь поверхности жидкости, тем больше молекул имеют возможность покинуть её. Значит, интенсивность испарения зависит от площади поверхности жидкости.
При повышении температуры скорости молекул возрастают. Поэтому чем выше температура, тем интенсивнее испарение.
Что такое кипение
Кипение это интенсивное парообразование, которое происходит в результате нагревания жидкости, образования в ней пузырьков пара, всплывающих на поверхность и разрывающихся там.
Во время кипения температура жидкости остаётся постоянной.
Температура кипения это температура, при которой жидкость кипит. Обычно, говоря о температуре кипения данной жидкости, подразумевают температуру, при которой эта жидкость кипит при нормальном атмосферном давлении.
При парообразовании молекулы, которые отделились от жидкости, уносят из неё часть внутренней энергии. Поэтому при испарении жидкость охлаждается.
Удельная теплота парообразования
Физическую величину, характеризующую количество теплоты, которое требуется для испарения единичной массы вещества, называют удельной теплотой парообразования. (по ссылке более подробный разбор этой темы)
(по ссылке более подробный разбор этой темы)
В системе СИ единица измерения этой величины Дж/кг. Её обозначают буквой L.
Чтобы рассчитать количество теплоты, которое потребляется при превращении в пар некоторой жидкости с удельной теплотой плавления L и массой m, применяют формулу:
Q = m*L
(где Q искомое количество теплоты).
Знаете ли вы, какова температура варящегося супа? 100 ˚С. Ни больше, ни меньше. При той же температуре закипает чайник, и варятся макароны. Что это значит?
Почему при постоянном подогреве кастрюльки или чайника горящим газом температура воды внутри не подымается выше ста градусов? Дело в том, что когда вода достигает температуры в сто градусов, вся поступающая тепловая энергия расходуется на переход воды в газообразное состояние, то есть испарение. До ста градусов испарение происходит в основном с поверхности, а достигнув этой температуры, вода закипает. Кипение – это тоже испарение, но только по всему объему жидкости. Пузырьки с горячим паром образуются внутри воды и, будучи легче воды, эти пузырьки вырываются на поверхность, а пар из них улетучивается в воздух.
До ста градусов температура воды при нагревании растет. После ста градусов при дальнейшем нагревании будет расти температура водяного пара. А вот пока вся вода не выкипит при ста градусах, ее температура не повысится, сколько энергии не прикладывай. Куда девается эта энергия, мы уже разобрались – на переход воды в газообразное состояние. Но раз существует такое явление, значит должна быть описывающая это явление физическая величина. И такая величина существует. Называется она удельной теплотой парообразования.
Удельная теплота парообразования воды
Удельная теплота парообразования – это физическая величина, которая показывает количество теплоты, нужное, чтобы превратить жидкость массой 1 кг в пар при температуре кипения. Обозначается удельная теплота парообразования буквой L. А единицей измерения является джоуль на килограмм (1 Дж/кг).
Удельную теплоту парообразования можно найти из формулы:
L=Q/m,
где Q – это количество теплоты,
m – масса тела.
Кстати, формула такая же, как и для расчета удельной теплоты плавления, разница лишь в обозначении. λ и L
Опытным путем найдены значения удельной теплоты парообразования различных веществ и составлены таблицы, откуда можно найти данные для каждого вещества. Так, удельная теплота парообразования воды равна 2,3*106 Дж/кг. Это означает, что на каждый килограмм воды необходимо потратить количество энергии, равное 2,3*106 Дж, чтобы превратить ее в пар. Но при этом вода должна уже обладать температурой кипения. Если вода изначально была более низкой температуры, то необходимо рассчитать еще то количество теплоты, которое потребуется для подогрева воды до ста градусов.
В реальных условиях часто требуется определить количество теплоты, необходимое для превращения в пар определенной массы какой-либо жидкости, поэтому чаще приходится иметь дело с формулой вида: Q=Lm, а значения удельной теплоты парообразования для конкретного вещества берут из готовых таблиц.
Согласитесь, что сегодня невозможно представить себе современный мир без автомобилей, поездов, теплоходов и так далее. А ведь так было не всегда.
Еще совсем недавно каких-то двести лет назад единственным средством передвижения по земле кроме собственных ног были лошади. Лошади возили телеги, повозки, кареты, даже вагоны по рельсам.
И мысль о том, что все это можно передвигать без помощи этих несчастных животных была из области фантастики. Тогда-то, в начале 19 века, и начались первые изобретения самоходных машин на основе парового двигателя.
В таком двигателе нагревался огнем наполненный водой котел, и пар от кипящей воды совершал механическую работу по приведению двигателя в ход. Двигатели были чудовищными, малоэффективными, огромными и небезопасными. Однако, на основе этих двигателей были созданы первые автомобили, паровозы и пароходы.
Изобретение двигателя внутреннего сгорания
Людям понравилась эта затея, несмотря на все минусы. Тогда это было чудом техники. И лишь в 1860 году, когда паровые двигатели применялись уже повсеместно и перестали считаться чем-то необыкновенным, был изобретен первый двигатель внутреннего сгорания.
Еще 18 лет понадобилось, чтобы изобретение доработали до нормально работающего варианта, который и по сей день является основой любого двигателя внутреннего сгорания четырехтактного двигателя.
Еще через семь лет двигатели начали работать на бензине. До этого их топливом был светильный газ. В наше время практически везде применяются двигатели внутреннего сгорания с кратным четырем количеством цилиндров. Давайте рассмотрим устройство и принцип работы двигателя внутреннего сгорания.
Устройство и принцип работы двигателя внутреннего сгорания
Он состоит из цилиндра с поршнем, клапанов для впуска топлива и выпуска отработанных паров и коленчатого вала, соединенного с поршнем. Разберем, как работает двигатель внутреннего сгорания на основе простейшего одноцилиндрового движка.
Во время первого такта сквозь топливный клапан впускается горючая смесь бензина и воздуха. Поршень двигается вниз.
На втором такте поршень двигается вверх, сжимая эту смесь, отчего она нагревается.
Третий такт: сжатая смесь поджигается электрической свечой, и энергия от этого небольшого взрыва толкает поршень вниз, приводя в движение коленчатый вал. Энергии толчка достаточно, чтобы коленвал, вращаясь по инерции, приводил в движение поршень при последующих тактах.
И наконец, на четвертом такте, сквозь второй клапан отработанные газы выталкиваются поршнем из цилиндра. Как видно, только один из четырех тактов рабочий.
Для равномерного вращения вала и увеличения мощности совмещают на одном валу четыре цилиндра таким образом, чтобы во время каждого такта один из цилиндров был в стадии рабочего хода. В таком случае они равномерно и последовательно вращают коленвал. Восемь, двенадцать и более цилиндров применяются уже исключительно для увеличения мощности движка.
Развлекались ли вы в детстве таким нехитрым фокусом: если потереть о сухие волосы надутый воздушный шарик, а потом приложить его к потолку, то он как бы «прилипает»?
Нет? Попробуйте, это забавно. Не менее забавно потом торчат во все стороны волосы. Такой же эффект получается иногда при расчесывании длинных волос. Они торчат и липнут к расческе. Ну и всем знакомы ситуации, когда походив в шерстяных или синтетических вещах, прикасаешься к чему-то или к кому-то и чувствуешь резкий укол. В таких случаях говорят – бьешься током. Все это примеры электризации тел. Но откуда возникает электризация, если мы все прекрасно знаем, что электрический ток живет в розетках и батарейках, а не в волосах и одежде?
Явление электризации тел: способы электризации
Явление электризации тел начинают изучать в восьмом классе. И начинают изучение с рассмотрения электризации тел при соприкосновении. Для этого на уроках проводят опыты с применением простейших способов электризации тел трением эбонитовой или стеклянной палочки о мех или шелк. Вы можете проделать такие опыты самостоятельно, вместо палочки можно взять пластмассовую ручку или линейку. Потрите ручку о шерсть или мех, а затем поднесите к мелко нарезанным кусочкам бумаги, соломинкам или шерстинкам. Вы увидите, как эти кусочки притягиваются к ручке. То же произойдет с тонкой струей воды, если поднести к ней наэлектризованную ручку.
Два рода электрических зарядов
Впервые подобные эффекты были обнаружены с янтарем, потому и были названы электрическими от греческого слова «электрон» – янтарь. И способности тел притягивать другие предметы после соприкосновения, а натирание – это лишь способ увеличить площадь соприкосновения, назвали электризацией или приданием телу электрического заряда. Опытным путем установили, что существует два рода электрических зарядов. Если натереть стеклянную и эбонитовую палочки, то они будут притягиваться между собой. А две одинаковые – отталкиваться. И это происходит не потому, что они не нравятся друг другу, а потому, что у них разные электрические заряды. Электрический заряд стеклянной палочки условились называть положительным, а эбонитовой – отрицательным. Обозначаются они, соответственно, знаками «+» и «-». Опять-таки, эти названия взяты не в смысле того, то один вид заряда хороший, а второй плохой. Имеется в виду, что они противоположны друг другу.
В наше время широко используют легко электризующиеся предметы – пластмассы, синтетические волокна, нефтепродукты. При трении таких веществ возникает электрический заряд, который иногда бывает как минимум неприятен, как максимум он может быть вреден. В промышленности с ними борются специальными средствами. В быту же самый простой способ избавиться от электризации – это смочить наэлектризованную поверхность. Если воды под рукой нет, то поможет прикосновение к металлу или земле. Эти тела снимут электризацию. А чтобы вообще не ощущать на себе эти неприятные эффекты рекомендуется пользоваться антистатиками.
Если вы походили в одежде из синтетической ткани, то очень вероятно, что вскоре вы ощутите не очень приятные последствия от такого занятия. Ваше тело наэлектризуется и, здороваясь с другом или дотрагиваясь до дверной ручки, вы ощутите острый укол тока.
Это не смертельно и не опасно, но не очень-то приятно. Каждый хотя бы раз в жизни сталкивался с подобным явлением. Но частенько мы узнаем, что наэлектризовались, уже по последствиям. Можно ли узнать, что тело наэлектризовано каким-нибудь более приятным способом, чем укол тока? Можно.
Для чего нужны электроскоп и электрометр?
Самый простой прибор для определения наэлектризованности – электроскоп. Принцип действия его очень прост. Если дотронуться до электроскопа телом, обладающим каким-либо зарядом, то этот заряд передастся металлическому стержню с лепестками внутри электроскопа. Лепестки приобретут заряд одного знака и разойдутся, отталкиваемые одноименным зарядом друг от друга. По шкале можно будет увидеть размер заряда в кулонах. Есть еще разновидность электроскопа – электрометр. Вместо лепестков на металлическом стержне в нем укреплена стрелка. Но принцип действия тот же – стержень и стрелка заряжаются и отталкиваются друг от друга. Величина отклонения стрелки показывает на шкале уровень заряда.(-19) Кл (Кулона). Эта величина в миллиарды раз меньше величины заряда, который мы получаем, наэлектризовав волосы расческой.
Сущность электрического поля
Еще один вопрос, который возникает при изучении явления электризации, заключается в следующем. Чтобы передать заряд, нам надо прикоснуться непосредственно наэлектризованным телом к другому телу, но чтобы заряд подействовал на другое тело, непосредственный контакт не нужен. Так, наэлектризованная стеклянная палочка притягивает к себе кусочки бумаги на расстоянии, не дотрагиваясь до них. Может, это притяжение передается по воздуху? Но опыты показывают, что в безвоздушном пространстве эффект притяжения остается. Что же это тогда?
Это явление объясняют существованием вокруг заряженных тел определенного вида материи – электрического поля. Электрическому полю в курсе физики 8 класса дают следующее определение: электрическое поле – это особый вид материи, отличающейся от вещества, существующий вокруг каждого электрического заряда и способный действовать на другие заряды. Честно говоря, до сих пор нет однозначного ответа, что это такое, и каковы его причины. Все, что мы знаем об электрическом поле и его воздействии, установлено опытным путем. Но наука движется вперед, и хочется верить, что и данный вопрос когда-нибудь разрешится до полной ясности. Тем более, что хотя мы и не до конца понимаем природу существования электрического поля, тем не менее, мы уже довольно неплохо научились использовать это явление на благо человечества.
Мы знаем, что частица, которая является носителем элементарного электрического заряда – это электрон. Передача электронов телами и обусловливает существование и передачу электрического заряда.
При этом электрон заряжен отрицательно. Откуда же тогда берется положительный заряд? Еще мы знаем, что электроны входят в состав атомов. Однако, далеко не все атомы имеют отрицательный заряд. Что компенсирует отрицательный заряд электронов в атоме? И если электрон, входящий в состав атома так легко перемещается, как тогда может оставаться в устойчивости атом, а соответственно и вещество? На эти и другие вопросы дается ответ на уроках по строению атома в восьмом классе в курсе физики. Сейчас мы их разберем.
Электронная модель строения атома
Итак, модель электронного строения атома такова: в центре атома расположено положительно заряженное ядро, вокруг которого движутся отрицательно заряженные электроны. Количество электронов в атомах различных веществ различается. В атоме водорода один электрон, в атоме кислорода – восемь, в атоме железа – двадцать шесть.
Но главное в атоме – это совсем не количество электронов. В атоме главное – это состав ядра. Электроны могут покидать атом, и тогда он приобретает положительный заряд за счет положительного заряда ядра. Но свойства вещества при этом не изменяются. А вот если изменить состав ядра, то это будет уже другое вещество с другими свойствами. Сделать это очень сложно, однако возможно.
Ядро атома состоит из положительно заряженных частиц. Частицы называются протонами. В состоянии покоя количество протонов и электронов равно, таким образом атом имеет нулевой заряд. Масса каждого протона в 1840 раз больше массы любого электрона. Масса ядра – это около 99% массы всего атома.
А вот заряд протона равен по модулю заряду одного электрона. Опыты показали, что ядро состоит не только из протонов. В его состав входят еще частицы, не имеющие заряда и практически равные по массе протонам. Эти частицы назвали нейтронами. Различие в составе атома на один протон или нейтрон придает атому совсем другие свойства. Это уже разные вещества.
Атом может без всякого ущерба терять электроны, и тогда его заряд становится положительным. Такой атом называют положительно заряженным ионом. Атом может также и приобретать дополнительные электроны. В таком случае атом получает отрицательный заряд, и его называют отрицательным ионом. Надо еще сказать, что изменяться может только заряд атома в ту или иную сторону. Заряд каждого отдельного электрона или протона – величина постоянная, и изменяться не может ни при каких условиях.
Ни для кого не секрет, что радиация вредна. Это знают все. Все слышали про ужасные жертвы и опасность радиоактивного воздействия. Что же такое радиация? Как она возникает? Существуют ли разные виды радиации? И как от нее защититься?
Слово «радиация» происходит от латинского radius и обозначает луч. В принципе радиация – это все виды существующих в природе излучений – радиоволны, видимый свет, ультрафиолет и так далее. Но излучения бывают различными, некоторые из них полезны, некоторые вредны. Мы в обычной жизни привыкли словом радиация называть вредное излучение, возникающее вследствие радиоактивности некоторых видов вещества. Разберем, как на уроках физики объясняют явление радиоактивности.
Радиоактивность в физике
Мы знаем, что атомы вещества состоят из ядра и вращающихся вокруг него электронов. Так вот ядро – это в принципе очень устойчивое образование, которое сложно разрушить. Однако, ядра атомов некоторых веществ обладают нестабильностью и могут излучать в пространство различную энергию и частицы.
Это излучение называют радиоактивным, и оно включает в себя несколько составляющих, которые назвали соответственно первым трем буквам греческого алфавита: α-, β- и γ- излучение. (альфа-, бета- и гамма-излучение). Эти излучения различны, различно и их действие на человека и меры защиты от него. Разберем все по порядку.
Альфа-излучение
Альфа-излучение — это поток тяжелых положительно заряженных частиц. Возникает в результате распада атомов тяжелых элементов, таких как уран, радий и торий. В воздухе альфа-излучение проходит не более пяти сантиметров и, как правило, полностью задерживается листом бумаги или внешним омертвевшим слоем кожи. Однако если вещество, испускающее альфа-частицы, попадает внутрь организма с пищей или воздухом, оно облучает внутренние органы и становится опасным.
Бета-излучение
Бета-излучение — это электроны, которые значительно меньше альфа-частиц и могут проникать вглубь тела на несколько сантиметров. От него можно защититься тонким листом металла, оконным стеклом и даже обычной одеждой. Попадая на незащищенные участки тела, бета-излучение оказывает воздействие, как правило, на верхние слои кожи. Во время аварии на Чернобыльской АЭС в 1986 году пожарные получили ожоги кожи в результате очень сильного облучения бета-частицами. Если вещество, испускающее бета-частицы, попадет в организм, оно будет облучать внутренние ткани.
Гамма-излучение
Гамма-излучение — это фотоны, т.е. электромагнитная волна, несущая энергию. В воздухе оно может проходить большие расстояния, постепенно теряя энергию в результате столкновений с атомами среды. Интенсивное гамма-излучение, если от него не защититься, может повредить не только кожу, но и внутренние ткани. Плотные и тяжелые материалы, такие как железо и свинец, являются отличными барьерами на пути гамма-излучения.
Как видно, альфа-излучение по его характеристикам практически не опасно, если не вдохнуть его частички или не съесть с пищей. Бета-излучение может причинить ожоги кожи в результате облучения. Самые опасные свойства у гамма-излучения. Оно проникает глубоко внутрь тела, и вывести его оттуда очень сложно, а воздействие очень разрушительно.
В любом случае без специальных приборов знать, что за вид радиации присутствует в данном конкретном случае нельзя, тем более, что всегда можно случайно вдохнуть частички радиации с воздухом. Поэтому общее правило одно – избегать подобных мест, а если уж попали, то укутаться как можно большим количеством одежды и вещей, дышать через ткань, не есть и не пить, и постараться поскорее покинуть место заражения. А потом при первой же возможности избавиться от всех этих вещей и хорошенько вымыться.
Радиоактивность также можно рассматривать как свидетельство сложного строения атомов. Изначально еще философы древности представляли себе мельчайщую частицу вещества – атом – неделимой частицей. Как радиактивность позволила разрушить данное представление? Подробности по ссылке.
11.1 Температура и тепловая энергия – Физика
Цели обучения разделу
К концу этого раздела вы сможете делать следующее:
- Объясните, что температура является мерой внутренней кинетической энергии
- Взаимное преобразование температур между шкалами Цельсия, Кельвина и Фаренгейта
Поддержка учителей
Поддержка учителей
Цели обучения в этом разделе помогут вашим ученикам овладеть следующими стандартами:
- (6) Научные концепции.Учащийся знает, что в физической системе происходят изменения, и применяет законы сохранения энергии и количества движения. Ожидается, что студент:
- (E) описывают, как макроскопические свойства термодинамической системы, такие как температура, удельная теплоемкость и давление, связаны с молекулярным уровнем вещества, включая кинетическую или потенциальную энергию атомов.
Кроме того, лабораторное руководство по физике средней школы рассматривает содержание этого раздела лаборатории под названием «Термодинамика», а также следующие стандарты:
- (6) Научные концепции.Учащийся знает, что в физической системе происходят изменения, и применяет законы сохранения энергии и количества движения. Ожидается, что студент:
- (E) описать, как макроскопические свойства термодинамической системы, такие как температура, удельная теплоемкость и давление, связаны с молекулярным уровнем вещества, включая кинетическую или потенциальную энергию атомов;
- (ГРАММ) анализировать и объяснять повседневные примеры, иллюстрирующие законы термодинамики, включая закон сохранения энергии и закон энтропии.
Раздел Ключевые термины
| абсолютный ноль | Шкала Цельсия | градус Цельсия (° C) (° C) | тепловая энергия |
| градус Фаренгейта (° F) (° F) | Шкала Фаренгейта | тепло | |
| кельвин (К) | Шкала Кельвина | температура |
Поддержка учителей
Поддержка учителей
[BL] [OL] [AL] Проверьте предварительное знание таких терминов, как тепло, температура и температурные шкалы.
[OL] Спросите студентов, что содержит больше тепла: ведро теплой воды или ложка кипятка. Исходя из этого, попросите их определить тепло. Спросите их, у кого температура выше.
Предупреждение о заблуждении
Избавьтесь от любых представлений о том, что теплосодержание зависит исключительно от температуры.
Температура
Что такое температура? Это одна из тех концепций, которые настолько укоренились в нашей повседневной жизни, что, хотя мы интуитивно знаем, что она означает, ее бывает трудно определить.Заманчиво сказать, что температура измеряет тепло, но это не совсем так. Тепло – это передача энергии из-за разницы температур. Температура определяется с точки зрения инструмента, который мы используем, чтобы сказать нам, насколько горячий или холодный объект, на основе механизма и шкалы, изобретенных людьми. Температура буквально определяется как то, что мы измеряем термометром.
Тепло часто путают с температурой. Например, мы можем сказать, что жара была невыносимой, когда на самом деле имели в виду, что температура была высокой.Это потому, что мы более чувствительны к потоку энергии за счет тепла, чем к температуре. Поскольку тепло, как и работа, передает энергию, в системе СИ единица измерения – джоуль (Дж).
Атомы и молекулы постоянно находятся в движении, отражаясь друг от друга в случайных направлениях. Напомним, что кинетическая энергия – это энергия движения, и она увеличивается пропорционально квадрату скорости. Не вдаваясь в математические подробности, мы можем сказать, что тепловая энергия – энергия, связанная с теплом, – это средняя кинетическая энергия частиц (молекул или атомов) в веществе.Молекулы, движущиеся быстрее, обладают большей кинетической энергией, поэтому вещество имеет большую тепловую энергию и, следовательно, более высокую температуру. Полная внутренняя энергия системы – это сумма кинетической и потенциальной энергий ее атомов и молекул. Тепловая энергия – это одна из подкатегорий внутренней энергии, как и химическая энергия.
Поддержка учителей
Поддержка учителей
Демонстрация учителей
Вы можете показать, что температура связана с кинетической энергией молекул, с помощью простой демонстрации.Возьмите ластик и энергично потрите им любую поверхность. Затем почувствуйте это на своей коже. Горячо?
Для измерения температуры необходимо использовать шкалу в качестве эталона. Три наиболее часто используемых температурных шкалы – это шкала Фаренгейта, Цельсия и Кельвина. И шкала Фаренгейта, и шкала Цельсия являются относительными температурными шкалами, что означает, что они построены вокруг контрольной точки. Например, шкала Цельсия использует точку замерзания воды в качестве точки отсчета; все измерения либо ниже точки замерзания воды на заданное число градусов (и имеют знак минус), либо выше точки замерзания воды на заданное число градусов (и имеют положительный знак).Температура кипения воды составляет 100 ° C ° C по шкале Цельсия, а ее единицей является градус Цельсия (° C (° C).
По шкале Фаренгейта точка замерзания воды составляет 32 ° F ° F, а точка кипения – 212 ° F ° F. Единицей измерения температуры на этой шкале является градус Фаренгейта (° F (° F). Обратите внимание, что разница в градусах между точками замерзания и кипения больше для шкалы Фаренгейта, чем для шкалы Цельсия. Следовательно, разница температур составляет единицу градус Цельсия больше, чем разница температур в один градус Фаренгейта.Поскольку 100 градусов Цельсия охватывают тот же диапазон, что и 180 градусов по Фаренгейту, один градус по шкале Цельсия в 1,8 раза больше, чем один градус по шкале Фаренгейта (потому что 180100 = 95 = 1,8180100 = 95 = 1,8). Это соотношение можно использовать для преобразования температуры в градусы Фаренгейта и Цельсия (см. Рисунок 11.2).
Рис. 11.2 Взаимосвязь температурных шкал по Фаренгейту, Цельсию и Кельвину, округленная до ближайшего градуса. Также показаны относительные размеры чешуек.
Шкала Кельвина – это шкала температур, которая обычно используется в науке, потому что это шкала абсолютных температур.Это означает, что теоретически минимально возможной температуре присваивается нулевое значение. Ноль градусов по шкале Кельвина называется абсолютным нулем; Теоретически это точка, в которой нет движения молекул для производства тепловой энергии. В оригинальной шкале Кельвина, впервые созданной лордом Кельвином, все температуры имеют положительные значения, что делает ее полезной для научной работы. Официальная единица измерения температуры на этой шкале – кельвин, сокращенно К. Точка замерзания воды – 273.15 К, а температура кипения воды 373,15 К.
Поддержка учителей
Поддержка учителей
[BL] [OL] [AL] Спросите учащихся, в каком случае каждая шкала будет наиболее удобной для использования.
Хотя абсолютный ноль теоретически возможен, на практике он не может быть достигнут. Самая низкая температура, когда-либо созданная и измеренная во время лабораторного эксперимента, составляла 1,0 × 10–101,0 × 10–10 К в Хельсинкском технологическом университете в Финляндии. Для сравнения, самая низкая зарегистрированная температура для места на поверхности Земли составляла 183 K ( – 89 ° C). ), Восток, Антарктида, а самым холодным известным местом (за пределами лаборатории) во Вселенной является туманность Бумеранг с температурой 1 К.К счастью, большинству из нас, людей, никогда не придется сталкиваться с такими крайностями.
Поддержка учителей
Поддержка учителей
[AL] Спросите, почему никогда не записывался абсолютный ноль. Обсудите, могут ли атомы и молекулы когда-либо быть полностью неподвижными.
Средняя нормальная температура тела составляет 98,6 ° F ° F (37,0 ° C ° C), но люди, как известно, выживают при температуре тела от 75 ° F до 111 ° F ° F (от 24 ° C до 111 ° F). 44 ° С ° С).
Watch Physics
Сравнение температурных шкал по Цельсию и Фаренгейту
В этом видео показано, как сравниваются температурные шкалы по Фаренгейту и Цельсию.
Проверка захвата
Смотреть Physics: сравнение температурных шкал Цельсия и Фаренгейта. В этом видео сравниваются температурные шкалы Цельсия и Фаренгейта.Даже без числовых меток на термометре вы можете определить, на какой стороне нанесен градус Фаренгейта, а на какой – по Цельсию. Почему?
- Разделение между двумя последовательными делениями по шкале Фаренгейта больше, чем аналогичное разделение по шкале Цельсия, потому что каждый градус Фаренгейта равен 1.8 градусов по Цельсию.
- Разделение между двумя последовательными делениями по шкале Фаренгейта меньше, чем аналогичное разделение по шкале Цельсия, потому что каждый градус Цельсия равен 1,8 градусу Фаренгейта.
- Разделение между двумя последовательными делениями по шкале Фаренгейта больше, чем аналогичное разделение по шкале Цельсия, потому что каждый градус Фаренгейта равен 3,6 градуса Цельсия.
- Разделение между двумя последовательными делениями по шкале Фаренгейта меньше, чем аналогичное разделение по шкале Цельсия, потому что каждый градус Цельсия равен 3.6 градусов по Фаренгейту.
Поддержка учителя
Поддержка учителя
Учащиеся могут использовать процесс, описанный в этом видео, как средство сравнения различных температурных шкал. Укажите им, что все, что им нужно знать, – это температуры по каждой шкале одного свойства, например, точки кипения и замерзания жидкости, будь то вода, этанол или тетрахлорметан.
Преобразование шкал Цельсия, Кельвина и Фаренгейта
Хотя шкала Фаренгейта по-прежнему является наиболее часто используемой шкалой в Соединенных Штатах, в большинстве стран мира используется градус Цельсия, а ученые предпочитают Кельвин.Часто бывает необходимо выполнить преобразование между этими шкалами. Например, если бы телевизионный метеоролог предоставил местную сводку погоды в градусах Кельвина, вероятно, некоторые зрители были бы сбиты с толку! В таблице 11.1 приведены уравнения для преобразования трех температурных шкал.
| Преобразовать из… | Используйте это уравнение |
|---|---|
| Цельсия до Фаренгейта | T ° F = 95T ° C + 32T ° F = 95T ° C + 32 |
| Фаренгейта до Цельсия | T ° C = 59 (T ° F − 32) T ° C = 59 (T ° F − 32) |
| Цельсия к Кельвину | TK = T ° C + 273.15ТК = Т ° С + 273,15 |
| От Кельвина до Цельсия | T ° C = TK − 273,15T ° C = TK − 273,15 |
| Фаренгейта до Кельвина | TK = 59 (T ° F − 32) + 273,15 TK = 59 (T ° F − 32) +273,15 |
| от Кельвина до Фаренгейта | T ° F = 95 (TK-273,15) + 32T ° F = 95 (TK-273,15) +32 |
Таблица 11.1 Преобразование температуры
Поддержка учителя
Поддержка учителя
[BL] [OL] [AL] Спросите студентов, что больше – разница в 5 ° F5 ° F или разница в 5 ° C5 ° C.Теперь спросите их то же самое для 5 ° C5 ° C и 5 ° F5 ° F. Разница в температуре по Кельвину и по Цельсию одинакова. То же самое нельзя сказать о градусах Цельсия и Фаренгейта.
Рабочий пример
Комнатная температура обычно определяется как 25 ° C ° C. (а) Что такое комнатная температура в ° F? ° F? (б) Что это в К?
Поддержка учителя
Поддержка учителя
Преобразование температурных шкал: комнатная температура
Поддержка учителя
В стеклянном термометре со спиртом молекулы спирта поглощают энергию за счет тепла, и по мере увеличения межмолекулярных расстояний объем спирта расширяется.Спросите учащихся, в каком диапазоне температур этот термометр показывает точные показания. Почему это так? Спросите их, можно ли создать термометр с каким-либо другим веществом. Почему или почему нет?
Стратегия
Чтобы ответить на эти вопросы, все, что нам нужно сделать, это выбрать правильные уравнения преобразования и подставить известные значения.
Решение для (а)
- Выберите правильное уравнение. Чтобы преобразовать из ° C ° C в ° F ° F, используйте уравнение
T ° F = 95T ° C + 32.T ° F = 95T ° C + 32.
11,1
- Подставьте известное значение в уравнение и решите.
T ° F = 9525 ° C + 32 = 77 ° FT ° F = 9525 ° C + 32 = 77 ° F
11,2
Решение для (b)
- Выберите правильное уравнение. Чтобы преобразовать из ° C ° C в K, используйте уравнение
ТК = Т ° С + 273,15. ТК = Т ° С + 273,15.
11,3
- Подставьте известное значение в уравнение и решите.
TK = 25 ° C + 273,15 = 298 KTK = 25 ° C + 273,15 = 298K
11,4
Обсуждение
Живя в Соединенных Штатах, вы, вероятно, лучше почувствуете, на что похожа температура, если ее описывают как 77 ° F ° F, чем как 25 ° C ° C (или 298 K, если на то пошло).
Рабочий пример
Преобразование температурных шкал: шкала Реомюра
Шкала Реомюра – это шкала температур, которая широко использовалась в Европе в 18 -х и 19 -х веках. По температурной шкале Реомюра точка замерзания воды составляет 0 ° R ° R, а температура кипения – 80 ° R ° R. Если «комнатная температура» составляет 25 ° C ° C по шкале Цельсия, что это такое по шкале Реомюра?
Стратегия
Чтобы ответить на этот вопрос, мы должны сравнить шкалу Реомюра со шкалой Цельсия.Разница между температурой замерзания и температурой кипения воды по шкале Реомюра составляет 80 ° R ° R. По шкале Цельсия это 100 ° C ° C. Следовательно, 100 ° C = 80 ° R ° C = 80 ° R. Обе шкалы начинаются с 0 ° ° для замораживания, поэтому мы можем создать простую формулу для преобразования между температурами на двух шкалах.
Решение
- Выведите формулу для преобразования одного масштаба в другой.
T ° R = 0,80 ° R ° C × T ° CT ° R = 0,80 ° R ° C × T ° C
11,5
- Подставьте известное значение в уравнение и решите.T ° R = 0,80 ° R ° C × 25 ° C = 20 ° RT ° R = 0,80 ° R ° C × 25 ° C = 20 ° R
11,6
Обсуждение
Как показывает этот пример, относительные температурные шкалы несколько произвольны. При желании можно создать свою собственную шкалу температур!
Практические задачи
1.Что такое 12,0 ° C в кельвинах?
- 112.0 К
- 273,2 К
- 12,0 К
- 285,2 К
Что такое 32,0 ° C в градусах Фаренгейта?
- 57.6 ° F
- 25,6 ° F
- 305,2 ° F
- 89,6 ° F
Советы для успеха
Иногда точно угадать температуру воздуха не так-то просто. Почему это? Такие факторы, как влажность и скорость ветра, влияют на то, насколько нам жарко или холодно. Ветер отводит тепловую энергию от нашего тела быстрее, чем обычно, заставляя нас чувствовать себя холоднее, чем мы могли бы в противном случае; в холодный день вы, возможно, слышали, что телеведущий обозначает модель wind chill .
Во влажные летние дни людям становится жарче, потому что пот не испаряется с кожи так эффективно, как в засушливые дни, когда испарение пота охлаждает нас.
Поддержка учителя
Поддержка учителя
Спросите учащихся, как работает охлаждение ветром. Будет ли он работать на любой поверхности или только на теле человека? Скорость потери тепла для любого объекта зависит от разницы температур между объектом и его окружением. Когда тепло передает энергию от объекта, оно нагревает слой воздуха вокруг него.Ветер разрушает этот слой, заменяя его более прохладным воздухом. Это, в свою очередь, увеличивает скорость потери тепла.
Предупреждение о заблуждении
Охлаждение ветром может только увеличить скорость охлаждения. Он никогда не может охладить объект до температуры ниже температуры окружающей среды.
Проверьте свое понимание
Поддержка учителей
Поддержка учителей
Используйте эти вопросы, чтобы оценить достижения учащимися учебных целей раздела. Если учащиеся борются с какой-то конкретной целью, эти вопросы помогут определить, какие учащиеся, и направить их к соответствующему содержанию.
3.Что такое тепловая энергия?
- Тепловая энергия – это средняя потенциальная энергия частиц в системе.
- Тепловая энергия – это полная сумма потенциальных энергий частиц в системе.
- Тепловая энергия – это средняя кинетическая энергия частиц из-за взаимодействия между частицами в системе.
- Тепловая энергия – это средняя кинетическая энергия частиц в системе.
Что используется для измерения температуры?
- гальванометр
- манометр
- термометр
- вольтметр
Пример задачи
Свинцовый шар массой 300 г при температуре 80 ° C помещается в 300 г вода температурой 20С. Когда система достигает равновесия, что равновесная температура? Предположим, что нет обмена энергией с окружение.
- чуть менее 80C
- около 50C
- чуть больше 20С
- недостаточно информации дано
Давайте посчитаем, чтобы убедиться.Позволять
T w = начальная температура воды
T Pb = начальная температура свинца
T f = конечная температура при равновесии
Поскольку тепло не обменивается с окружающей средой:
тепла, полученного водой = тепло, потерянное свинцом
mc w (T f – T w ) = mc Pb (T Pb – T f ) (1)
Мы можем провести эксперимент двумя способами:
- От конечной температуры и удельной тепло воды, определите удельную теплоемкость свинца.
- Вычислите конечную температуру с учетом удельной теплоты воды и свинца.
1. Решение относительно c Pb в уравнении теплового баланса (1) дает:
| c Pb | = c w | ( |
| ) |
Теперь используйте c w = 4186 Дж / (кг C) для удельной теплоемкости воды и измеренное значение T f для вычисления c Pb .
Значение c Pb составляет 130 Дж / (кг C).
2. В качестве альтернативы мы используем c w = 4186 Дж / (кг C) и c Pb = 130 Дж / (кг C) и решите для T f в уравнении теплового баланса (1). Это дает:
| T f = | ( |
| ) |
Конечная температура является средневзвешенной. двух начальных температур, с взвешиванием, смещенным к материал с большей теплоемкостью.
Расчеты теплопередачи
Расчеты теплопередачи
Теорема сохранения энергии также применяется к теплопередаче. В изолированной системе заданное тепло всегда равно отведенному теплу или изменение тепла в системе равно нулю. Если два объекта с разной температурой соприкасаются, между ними начинается теплопередача. Подаваемое количество тепла равно количеству отведенного тепла. Первый объект имеет массу м 1 , температуру t 1 и удельную теплоемкость c 1 , второй объект имеет массу m 2 , температуру t 2 и удельная теплоемкость c 2 .
Пример: Найдите конечную температуру смеси, если две чашки воды массой m1 = 150 г и m2 = 250 г и температурами T1 = 30 ºC и T2 = 75 ºC смешаны в изолированной системе, в которой нет тепла. потерянный. (вода = 1 ккал / гºC)
Пример: Температура железного блока снижается с 85 ºC до 25 ºC.Если масса блока составляет 1,2 кг, рассчитайте потери тепла блоком. (ciron = 0,115 ккал / г ºC)
Пример: График, приведенный ниже, показывает взаимосвязь между заданным теплом и изменением температуры трех веществ, имеющих одинаковые массы. Сравните удельную теплоемкость этих веществ.
Поскольку массы этих веществ равны, B имеет наибольшую удельную теплоемкость, потому что при одинаковом количестве тепла изменение температуры B ниже, чем у двух других веществ.Более того, A имеет минимальную удельную теплоемкость, потому что изменение его температуры при том же количестве тепла больше, чем у других. Наконец, удельная теплоемкость C находится между A и B. Таким образом;
c B > c C > c A
Исследования температуры нагрева и теплового расширения и растворы
| Теплопередача <Предыдущая | Далее> Изменение фазы / состояния (фазовый переход) |
|---|
Начинающий Путеводитель по ракетамТемпературная и кинетическая энергия активности Если по указанию вашего учителя распечатайте страницу рабочего листа для этих проблемы. Прежде чем начать:
Для этого вида деятельности вам нужно будет выполнить аналогичные вычисления, а затем использовать свои ответы в формуле кинетической энергии. ОТВЕТЬТЕ НА СЛЕДУЮЩИЕ ВОПРОСЫ:
Сайты по теме: |
Уравнения для пределов температуры Рона Куртуса
SfC Home> Физика> Тепловая энергия>
от Рона Куртуса
Нижний и верхний температурные пределы могут быть достигнуты, но физически недостижимы.Существует связь между кинетической энергией, скоростью частиц и температурой. Абсолютный ноль – это самая низкая из возможных температур. Предел максимальной температуры – это когда частицы достигают скорости света.
Вопросы, которые могут у вас возникнуть:
- Какая связь между кинетической энергией, скоростью и температурой?
- Что происходит при нагревании материала?
- Каков верхний предел температуры?
Этот урок ответит на эти вопросы.Полезный инструмент: Конвертация единиц
Отношения
Существуют уравнения, которые определяют взаимосвязь между кинетической энергией идеального газа, температурой и скоростью атомов или молекул в газе.
Примечание : Идеальный газ – это теоретический газ, состоящий из беспорядочно движущихся точечных частиц, которые взаимодействуют только посредством упругих столкновений. Это полезно при определении простых уравнений в отличие от очень сложных в реальном мире.
Кинетическая энергия и температура
Соотношение между кинетической энергией молекул или атомов в идеальном газе и температурой составляет:
KE = 2kT / 3
где
- KE = кинетическая энергия частиц в идеальном газе в джоулях (Дж)
- k = постоянная Больцмана (число, которое связывает энергию и температуру)
k = 1.38 * 10 −23 джоуль / кельвин - T = температура в градусах Кельвина (K)
Уравнения взаимосвязи кинетической энергии и температуры для реальных газов, жидкостей и твердых тел слишком сложны, чтобы работать с ними на этом уровне изучения.
Кинетическая энергия и скорость
Кинетическая энергия движущейся массы частиц составляет:
KE = ½ мв²
где
- KE = кинетическая энергия в джоулях или кг-м² / с²
- м = масса в килограммах (кг)
- v = скорость в метрах в секунду (м / с)
- v² = квадрат скорости или v * v в м² / с²
- ½ мв² равно ½ раз м раз в²
Температура и скорость
Вы можете найти взаимосвязь между температурой и скоростью частиц в идеальном газе.
Поскольку KE = 2kT / 3 и KE = ½ мв² , вы можете заменить KE , чтобы получить 2kT / 3 = ½ мв² . Затем вы можете умножить на 3 и разделить на 2k , чтобы получить:
T = 3 м² / 4k
где
- T измеряется в градусах кельвина (K)
- м – масса в килограммах
- v в метрах в секунду
- k в джоуль / кельвин или кг-м² / с²-кельвин
Абсолютный ноль
Из T = 3mv² / 4k легко увидеть, что при T = 0 кельвинов скорость частиц v = 0 .Таким образом, кинетическая энергия за счет линейного движения равна нулю. Но атомы все еще обладают спином, а это значит, что они все еще имеют некоторую энергию.
Еще один факт в том, что уравнение действительно является приближением, поскольку мы имеем дело с идеальным газом. Реальный газ не сможет достичь T = 0 .
Предел температуры и скорости света
Максимально возможная температура ограничена скоростью движения его атомов. Верхний предел того, что все может перемещаться – скорость света.
Хотя кинетическая энергия равна KE = ½ мв² , предельная энергия определяется уравнением теории относительности Эйнштейна
E = mc²
где;
- м = масса покоя
- c² = скорость света ( c ) в квадрате
Таким образом, теоретически максимально возможная температура определяется как:
T = 3 м² / 2 кОм
Вы можете рассчитать эту температуру, подставив соответствующие значения.Это уравнение может не вписываться в теорию относительности, поскольку масса частицы резко возрастает по мере приближения частицы к скорости света. Но, по крайней мере, это интересное упражнение.
Сводка
Нижний и верхний пределы температуры могут быть достигнуты, но не достигнуты физически. Соотношение между кинетической энергией, скоростью частиц и температурой определяет это значение абсолютного нуля и предел максимально возможной температуры.
Превзойдите свои ограничения
Ресурсы и ссылки
Полномочия Рона Куртуса
Сайтов
Кинетическая температура – HyperPhysics
Физические ресурсы
Книги
(Примечание: Школа чемпионов может получать комиссионные от покупки книг)
Книги по физике температуры с самым высоким рейтингом
Книги с самым высоким рейтингом по Absolute Zero
Поделиться страницей
Нажмите кнопку, чтобы добавить эту страницу в закладки или поделиться ею через Twitter, Facebook, электронную почту или другие службы:
Студенты и исследователи
Веб-адрес этой страницы:
www.school-for-champions.com/science/
temperature_limits_equations.htm
Пожалуйста, включите его в качестве ссылки в свой отчет, документ или диссертацию.
Где ты сейчас?
Школа чемпионов
По физике
Уравнения для температурных пределов
Температура
В твердых телах частицы, составляющие твердое тело, плотно удерживаются вместе, поэтому их движение ограничивается колебаниями назад и вперед в своих заданных положениях.В жидкостях частицы могут двигаться вперед и назад друг относительно друга, но сам объект не имеет определенной формы. В газах частицы движутся по доступному объему, взаимодействуя друг с другом и со стенками любого контейнера, в котором они находятся. Во всех случаях полная тепловая энергия объекта – это сумма кинетических энергий составляющих его частиц.
Вместо того, чтобы просто смотреть на сумму кинетических энергий всех отдельных частиц, вы могли бы изучить среднюю кинетическую энергию частиц, составляющих объект, понимая, что фактические кинетические энергии отдельных частиц могут значительно различаться.Средняя кинетическая энергия частиц напрямую связана с температурой объекта следующим уравнением:
Рассматривая это уравнение, средняя кинетическая энергия дается в Джоулях, k B – постоянная Больцмана (1,38 × 10 -23 Дж / К), а температура дается в Кельвинах, единицах измерения температуры в системе СИ. Обратите внимание, что даже если два объекта могут иметь одинаковую температуру (и, следовательно, одинаковую среднюю кинетическую энергию), они могут иметь разные внутренние энергии.
Шкала Кельвина тесно связана с температурной шкалой Цельсия, но там, где шкала Цельсия нацелена на точку замерзания воды как 0 ° C, шкала Кельвина использует ее ноль на так называемом абсолютном нуле (точка на шкале объема против График температуры газа, где расширенная кривая гипотетически достигнет нулевого объема), считается теоретической минимальной температурой. Следовательно, абсолютный ноль равен 0 Кельвина, что эквивалентно -273,15 ° Цельсия. Чтобы преобразовать градусы Кельвина в градусы Цельсия, просто добавьте 273.15 к вашему показанию температуры в градусах Цельсия. Таким образом, точка замерзания воды составляет 0 ° C или 273,15 K, а точка кипения воды составляет 100 ° C или 373,15 K. Сравните это со шкалой Фаренгейта, где вода замерзает при 32 ° F и закипает при 212 °. F!
Вопрос: Какова средняя кинетическая энергия молекул в стейке при температуре 345 Кельвинов?
Ответ:
Вопрос: Нормальная температура тела собаки – 101.5 ° F. Какова нормальная температура тела собаки в градусах Цельсия? В Кельвинах?
Ответ:
Вопрос: Учитывая, что средняя кинетическая энергия частиц, составляющих наше Солнце, составляет 1,2 × 10 -19 Дж, найдите температуру Солнца.
Ответ:
Вопрос: Какой график лучше всего отображает соотношение между средней кинетической энергией (K avg ) случайного движения молекул идеального газа и его абсолютной температурой (T)?
Ответ: (2), поскольку K avg является линейной функцией абсолютной температуры T.
Вопрос: На орбите Земли космический челнок зафиксировал температуру в диапазоне от 398K до 118K. Эти температуры соответствуют температурам Цельсия в диапазоне от
- от 125 ° C до -391 ° C
- от 125 ° C до -155 ° C
- от 671 ° C до 391 ° C
- от 671 ° C до 155 ° C
Ответ: (2) от 125 ° C до -155 ° C
Вопрос: Температура, при которой тепловая энергия не может передаваться от одного объекта к другому, равна
- -273 тыс.
- 0 К
- 0 ° С
- 273 ° C
Ответ: (2) 0 K является абсолютным нулем.
Как рассчитать тепловое расширение – x-engineer.org
Тепловое расширение – это физическое свойство вещества (газа, жидкости или твердого тела) изменять свою форму (длину, площадь или объем) в зависимости от температуры. Тепловое расширение связано с расширением и сжатием частиц в зависимости от температуры вещества.
Термическое расширение также можно рассматривать как частичное изменение размера материала / вещества, вызванное изменением температуры.
Изображение: Расширение и сжатие частиц
Тепловое расширение влияет на газы, жидкости и твердые тела. С математической точки зрения тепловое расширение можно описать как:
- линейное (одно направление, 1-D)
- площадное (два направления, 2-D)
- объемное (три направления, 3-D)
Линейное и площадное (также называемое поверхностным) тепловое расширение применимо только к твердым телам. Объемное (также называемое кубическим) тепловое расширение относится как к твердым телам, так и к жидкостям.Для газов тепловое расширение описывается законом идеального газа и трактуется иначе.
Линейное тепловое расширение
Изображение: Линейное тепловое расширение
Линейное тепловое расширение применяется в основном к твердым телам. Зная начальную длину L 0 [м] данного твердого тела (например, металлического стержня), разность температур ΔT [ºC] и коэффициент линейного расширения твердого тела α [1 / ºC], изменение длины ΔT [м] твердого тела можно рассчитать как:
\ [\ Delta L = \ alpha \ cdot L_0 \ cdot \ Delta T \ tag {1} \]Изменение длины прямо пропорционально изменение температуры.Чем выше разница температур, тем больше увеличивается длина материала (например, металлического стержня).
Разница в длине ΔL равна вычитанию начальной длины L 0 из конечной длины L:
\ [\ Delta L = L – L_0 \ tag {2} \]Путем замены (2) в (1) мы можем вычислить конечную длину (после теплового расширения) как функцию начальной длины, разности температур и коэффициента линейного теплового расширения.
\ [\ bbox [# FFFF9D] {L = L_0 \ cdot (1+ \ alpha \ cdot \ Delta T)} \ tag {3} \]Коэффициент линейного теплового расширения не постоянный, но незначительно изменяется в зависимости от температуры.Следовательно, математическое выражение применимо только к небольшим колебаниям температуры.
Поверхностное тепловое расширение
Изображение: Поверхностное тепловое расширение
Термическое расширение также относится к поверхностям. Представьте себе металлический лист с определенной площадью. При нагревании тот же лист металла будет иметь немного большую площадь.
Зная начальную площадь A 0 [м 2 ] данного твердого тела (например, металлического листа), разность температур ΔT [ºC] и коэффициент линейного расширения твердого тела α [ 1 / ºC], изменение площади ΔA [м 2 ] твердого тела можно рассчитать как:
\ [\ Delta A = 2 \ cdot \ alpha \ cdot A_0 \ cdot \ Delta T \ tag {4} \ ]Изменение площади прямо пропорционально изменению температуры. 2 \ right) \ tag {8} \]
Так как коэффициент теплового расширения очень мал (например.2 \ tag {9} \]
уравнение (8) превращается в (6).
Тот же принцип применяется к поверхностному тепловому расширению. Коэффициент линейного теплового расширения непостоянен, но незначительно изменяется в зависимости от температуры. Следовательно, математическое выражение применимо только к небольшим колебаниям температуры.
Объемное тепловое расширение
Изображение: Тепловое расширение (объемное)
Тепловое расширение вызывает изменения объема твердых и жидких тел в зависимости от температуры.
Зная начальный объем V 0 [м 3 ] данного твердого тела, разность температур ΔT [ºC] и коэффициент линейного расширения твердого тела α [1 / ºC], изменение объема ΔV [м 3 ] твердого тела можно рассчитать как:
\ [\ Delta V = 3 \ cdot \ alpha \ cdot V_0 \ cdot \ Delta T \ tag {10} \]Изменение объем прямо пропорционален изменению температуры. 3 \ right) \ tag {14} \ ]
Поскольку коэффициент теплового расширения очень мал, кубическими и квадратичными членами уравнения (14) можно пренебречь.3 \ tag {15} \]
уравнение (14) превращается в (12).
Для расчетов объемного теплового расширения мы можем использовать коэффициент объемного теплового расширения β вместо коэффициента линейного теплового расширения α.
\ [\ beta \ приблизительно 3 \ cdot \ alpha \ tag {16} \], который дает уравнение для изменения объема:
\ [\ bbox [# FFFF9D] {\ Delta V = \ beta \ cdot V_0 \ cdot \ Delta T} \ tag {17} \]Тот же принцип применяется к объемному тепловому расширению.Коэффициент объемного теплового расширения непостоянен, но незначительно изменяется в зависимости от температуры. Следовательно, математическое выражение применимо только к небольшим колебаниям температуры.
Коэффициент теплового расширения получен из экспериментальных данных . В таблице ниже вы можете найти значения коэффициента теплового расширения для обычных веществ.
| Материал | Коэффициент линейного расширения | Коэффициент объемного расширения |
| Твердые вещества | ||
| Алюминий | 25 · 10 -6 | -6 |
| Латунь | 19 · 10 -6 | 56 · 10 -6 |
| Медь | 17 · 10 -6 | 51 · 10 -6 |
| Золото | 14 · 10 -6 | 42 · 10 -6 |
| Железо | 12 · 10 -6 | 35 · 10 -6 |
| Инвар | 0.9 · 10 -6 | 2,7 · 10 -6 |
| Свинец | 29 · 10 -6 | 87 · 10 -6 |
| Серебро | 18 · 10 -6 | 54 · 10 -6 |
| Стекло | 9 · 10 -6 | 27 · 10 -6 |
| Стекло | 3 · 10 -6 | 9 · 10 -6 |
| Кварц | 0.4 · 10 -6 | 1 · 10 -6 |
| Бетон | 12 · 10 -6 | 36 · 10 -6 |
| Мрамор | 7 · 10 -6 | 21 · 10 -6 |
| Жидкости | ||
| Эфир | 1650 · 10 -6 | |
| Этил | 1100 · 10 -6 900 | |
| Бензин | 950 · 10 -6 | |
| Глицерин | 500 · 10 -6 | |
| Ртуть | 180 · 10 -6 | |
| Вода | 210 · 10 -6 | |
| Газы | ||
| Воздух и большинство других газов при атмосферном давлении | 3400 · 10 -6 | |

 Если изолированная система не находится в равновесии, то с течением времени переход энергии (теплопередача) от более нагретых частей системы к менее нагретым приводит к выравниванию Т. во всей системе (первый постулат, или нулевое начало термодинамики). Т. определяет: распределение образующих систему частиц по уровням энергии (см. Больцмана статистика) и распределение частиц по скоростям (см. Максвелла распределение); степень ионизации вещества (см. Саха формула); свойства равновесного электромагнитного излучения тел — спектральную плотность излучения (см. Планка закон излучения), полную объёмную плотность излучения (см. Стефана — Больцмана закон излучения) и т. д. Т., входящую в качестве параметра в распределение Больцмана, часто называют Т. возбуждения, в распределение Максвелла — кинетической Т., в формулу Саха — ионизационной Т., в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы.
Если изолированная система не находится в равновесии, то с течением времени переход энергии (теплопередача) от более нагретых частей системы к менее нагретым приводит к выравниванию Т. во всей системе (первый постулат, или нулевое начало термодинамики). Т. определяет: распределение образующих систему частиц по уровням энергии (см. Больцмана статистика) и распределение частиц по скоростям (см. Максвелла распределение); степень ионизации вещества (см. Саха формула); свойства равновесного электромагнитного излучения тел — спектральную плотность излучения (см. Планка закон излучения), полную объёмную плотность излучения (см. Стефана — Больцмана закон излучения) и т. д. Т., входящую в качестве параметра в распределение Больцмана, часто называют Т. возбуждения, в распределение Максвелла — кинетической Т., в формулу Саха — ионизационной Т., в закон Стефана — Больцмана — радиационной температурой. Поскольку для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, их называют просто температурой системы. В кинетической теории газов и др. разделах статистической механики Т. количественно определяется так, что средняя кинетическая энергия поступательного движения частицы (обладающей тремя степенями свободы) равнакТ, где k — Больцмана постоянная, Т — температура тела. В общем случае Т. определяется как производная от энергии тела в целом по его энтропии. Такая Т. всегда положительна (поскольку кинетическая энергия положительна), её называют абсолютной Т. или Т. по термодинамической температурной шкале. За единицу абсолютной Т. в Международной системе единиц (СИ) принят кельвин (К). Часто Т. измеряют по шкале Цельсия (t), значения t связаны с Т равенством t = Т √ 273,15 К (градус Цельсия равен Кельвину). Методы измерения Т. рассмотрены в статьях Термометрия, Термометр.
В кинетической теории газов и др. разделах статистической механики Т. количественно определяется так, что средняя кинетическая энергия поступательного движения частицы (обладающей тремя степенями свободы) равнакТ, где k — Больцмана постоянная, Т — температура тела. В общем случае Т. определяется как производная от энергии тела в целом по его энтропии. Такая Т. всегда положительна (поскольку кинетическая энергия положительна), её называют абсолютной Т. или Т. по термодинамической температурной шкале. За единицу абсолютной Т. в Международной системе единиц (СИ) принят кельвин (К). Часто Т. измеряют по шкале Цельсия (t), значения t связаны с Т равенством t = Т √ 273,15 К (градус Цельсия равен Кельвину). Методы измерения Т. рассмотрены в статьях Термометрия, Термометр. Существуют состояния плазмы, в которых системы электронов и ионов в отдельности близки к равновесию, и можно ввести Т. электронов Тэ и Т. ионов Ти, не совпадающие между собой.
Существуют состояния плазмы, в которых системы электронов и ионов в отдельности близки к равновесию, и можно ввести Т. электронов Тэ и Т. ионов Ти, не совпадающие между собой. «выше» любой положительной.
«выше» любой положительной. Это обусловлено мышечной… … Научно-технический энциклопедический словарь
Это обусловлено мышечной… … Научно-технический энциклопедический словарь того слоя воздуха, который подлежит нашему наблюдению. При метеорологических наблюдениях этому элементу и отводится первое место … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
того слоя воздуха, который подлежит нашему наблюдению. При метеорологических наблюдениях этому элементу и отводится первое место … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона В квантовой статистике это значит, что… … Википедия
В квантовой статистике это значит, что… … Википедия Однако… Подробнее Купить за 1225 грн (только Украина)
Однако… Подробнее Купить за 1225 грн (только Украина) Свободно летают, иногда сталкиваясь.
Свободно летают, иногда сталкиваясь.