Количество теплоты
Внутренняя энергия тела может изменяться за счет работы внешних сил. Для характеристики изменения внутренней энергии при теплообмене вводится величина, называемая количеством теплоты и обозначаемая Q.
|
В международной системе единицей количества теплоты, также как работы и энергии, является джоуль: [Q] = [A] = [E] = 1 Дж.
На практике еще иногда применяется внесистемная единица количества теплоты – калория. 1 кал. = 4,2 Дж.
Следует отметить, что термин «количество теплоты» неудачен. Он был введен в то время, когда считалось, что в телах содержится некая невесомая, неуловимая жидкость – теплород.
|
Рассмотрим более подробно процессы, которые могут протекать в результате теплообмена.
Нальем в пробирку немного воды и закроем ее пробкой. Подвесим пробирку к стержню, закрепленному в штативе, и подведем под нее открытое пламя. От пламени пробирка получает некоторое количество теплоты и температура жидкости, находящейся в ней, повышается. При повышении температуры внутренняя энергия жидкости увеличивается. Происходит интенсивный процесс ее парообразования. Расширяющиеся пары жидкости совершают механическую работу по выталкиванию пробки из пробирки.
Проведем еще один опыт с моделью пушки, изготовленной из отрезка латунной трубки, которая укреплена на тележке. С одной стороны трубка плотно закрыта эбонитовой пробкой, сквозь которую пропущена шпилька. К шпильке и трубке припаяны провода, оканчивающиеся клеммами, на которые может подаваться напряжение от осветительной сети. Модель пушки, таким образом, представляет собой разновидность электрического кипятильника.
К шпильке и трубке припаяны провода, оканчивающиеся клеммами, на которые может подаваться напряжение от осветительной сети. Модель пушки, таким образом, представляет собой разновидность электрического кипятильника.
Нальем в ствол пушки немного воды и закроем трубку резиновой пробкой. Подключим пушку к источнику тока. Электрический ток, проходя через воду, нагревает ее. Вода закипает, что приводит к ее интенсивному парообразованию. Давление водяных паров растет и, наконец, они совершают работу по выталкиванию пробки из ствола пушки.
Пушка, вследствие отдачи, откатывается в сторону, противоположную вылету пробки.
Оба опыта объединяют следующие обстоятельства. В процессе нагревания жидкости различными способами, температура жидкости и, соответственно, ее внутренняя энергия увеличивались. Для того, чтобы жидкость кипела и интенсивно испарялась, необходимо было продолжать ее нагревание.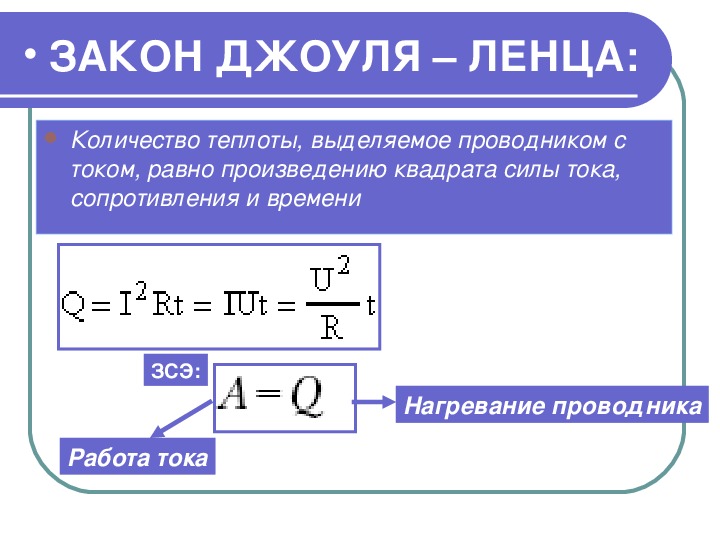
Пары жидкости за счет своей внутренней энергии совершили механическую работу.
Исследуем зависимость количества теплоты, необходимой для нагревания тела, от его массы, изменения температуры и рода вещества. Для исследования данных зависимостей будем использовать воду и масло. (Для измерения температуры в опыте применяется электрический термометр, изготовленный из термопары, подключенной к зеркальному гальванометру. Один спай термопары опущен в сосуд с холодной водой для обеспечения постоянства его температуры. Другой спай термопары измеряет температуру исследуемой жидкости).
Опыт состоит из трех серий. В первой серии исследуется для постоянной массы конкретной жидкости (в нашем случае – воды) зависимость количества теплоты, необходимого для ее нагревания, от изменения температуры. О количестве теплоты, полученной жидкостью от нагревателя (электрической плитки), будем судить по времени нагревания, предполагая, что между ними существует прямо пропорциональная зависимость.
Сделаем вывод: между количеством теплоты, необходимым для нагревания тела и изменением его температуры, существует прямая пропорциональная зависимость.
Во второй серии опытов будем сравнивать количества теплоты, необходимые для нагревания одинаковых жидкостей разной массы при изменении их температуры на одну и ту же величину.
Для удобства сравнения получаемых величин массу воды для второго опыта возьмем в два раза меньше, чем в первом опыте.
Вновь будем фиксировать показания термометра через равные промежутки времени.
Сравнивая результаты первого и второго опытов можно сделать следующие выводы.
|
В третьей серии опытов будем сравнивать количества теплоты, необходимые для нагревания равных масс различных жидкостей, при изменении их температуры на одну и ту же величину.
Будем нагревать на электроплитке масло, масса которого равна массе воды в первом опыте. Будем фиксировать показания термометра через равные промежутки времени.
Результат опыта подтверждает вывод о том, что количество теплоты, необходимое для нагревания тела, прямо пропорционально изменению его температуры и, кроме того, свидетельствует о зависимости этого количества теплоты от рода вещества.
Поскольку в опыте использовалось масло, плотность которого меньше плотности воды и для нагревания масла до некоторой температуры потребовалось меньшее количество теплоты, чем для нагревания воды, можно предположить, что количество теплоты, необходимое для нагревания тела, зависит от его плотности.
Чтобы проверить это предположение, будем одновременно нагревать на нагревателе постоянной мощности одинаковые массы воды, парафина и меди.
Через одно и то же время температура меди оказывается примерно в 10 раз, а парафина примерно в 2 раза выше температуры воды.
Но медь имеет большую, а парафин меньшую плотность, чем вода.
Опыт показывает, что величиной, характеризующей скорость изменения температуры веществ, из которых изготовлены тела, участвующие в теплообмене, является не плотность. Эта величина называется удельной теплоемкостью вещества и обозначается буквой c.
Для сравнения удельных теплоемкостей различных веществ служит специальный прибор. Прибор состоит из стоек, в которых крепится тонкая парафиновая пластинка и планка с пропущенными сквозь нее стержнями. На концах стержней укреплены алюминиевый, стальной и латунный цилиндры равной массы.
Прибор состоит из стоек, в которых крепится тонкая парафиновая пластинка и планка с пропущенными сквозь нее стержнями. На концах стержней укреплены алюминиевый, стальной и латунный цилиндры равной массы.
Нагреем цилиндры до одинаковой температуры, погрузив их в сосуд с водой, стоящий на горячей электроплитке. Закрепим горячие цилиндры на стойках и освободим их от крепления. Цилиндры одновременно прикасаются к парафиновой пластине и, плавя парафин, начинают погружаться в нее. Глубина погружения цилиндров одинаковой массы в парафиновую пластину, при изменении их температуры на одну и ту же величину, оказывается разной.
Опыт свидетельствует о том, что удельные теплоемкости алюминия, стали и латуни различны.
Проделав соответствующие опыты с плавлением твердых тел, парообразованием жидкостей, сгоранием топлива получаем следующие количественные зависимости.
|
|
|
|
Во всех формулах, позволяющих рассчитывать количество теплоты для различных тепловых процессов, стоят коэффициенты пропорциональности, называемые удельными величинами, то есть приходящимися на единицу других величин. Удельные величины являются характеристиками веществ, а не тел.
|
|
Чтобы получить единицы удельных величин, их надо выразить из соответствующих формул и в полученные выражения подставить единицы теплоты – 1 Дж, массы – 1 кг, а для удельной теплоемкости – и 1 К.
Получаем единицы: удельной теплоемкости – 1 Дж/кг·К, остальных удельных теплот: 1 Дж/кг.
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Физический справочник / / Физика для самых маленьких. Шпаргалки. Школа. / / Термодинамика. Внутренняя энергия. Работа. Количество теплоты. Тепловые явления. Первый закон термодинамики. Применение первого закона термодинамики к различным процессам. Уравнение теплового балланса. Второй закон термодинамики. Тепловые двигатели Шпаргалки. Школа. / / Термодинамика. Внутренняя энергия. Работа. Количество теплоты. Тепловые явления. Первый закон термодинамики. Применение первого закона термодинамики к различным процессам. Уравнение теплового балланса. Второй закон термодинамики. Тепловые двигателиПоделиться:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста. Вложите в письмо ссылку на страницу с ошибкой, пожалуйста. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коды баннеров проекта DPVA.ru Начинка: KJR Publisiers Консультации и техническая | Проект является некоммерческим. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Владельцы сайта www.dpva.ru не несут никакой ответственности за риски, связанные с использованием информации, полученной с этого интернет-ресурса. Free xml sitemap generator | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Расчёт количества теплоты при нагревании или охлаждении тела
На прошлых уроках мы с вами познакомились с понятием «внутренняя энергия тела» и узнали, что изменить её можно двумя способами: либо путём совершения механической работы, либо теплопередачей.
Также
мы с вами выяснили, что мерой изменения внутренней энергии тела при
теплопередаче является количество теплоты. Давайте вспомним, что количество
теплоты — это скалярная физическая величина, равная изменению внутренней
энергии тела в процессе теплопередачи без совершения механической работы.
Давайте вспомним, что количество
теплоты — это скалярная физическая величина, равная изменению внутренней
энергии тела в процессе теплопередачи без совершения механической работы.
А ещё мы получили уравнение, по которому можно рассчитать количество теплоты, которое необходимо подвести к телу для его нагревания, или выделяемое телом, при его охлаждении:
Q = cm(t – t0).
Из формулы видно, что количество теплоты зависит от массы тела, разности температур в конечном и начальном состояниях, а также от удельной теплоёмкости вещества, из которого это тело изготовлено.
Чтобы вспомнить, же что же такое теплоёмкость, рассмотрим решение следующей задачи.
Задача 1. В сосуд с горячей водой опустили алюминиевую и латунную болванки одинаковой массы и температуры. Одинаковым ли будет изменение их температур?
В
жизненных ситуациях довольно часто возникает необходимость в тепловых расчётах. Например, при строительстве жилых домов необходимо знать, какое количество
теплоты должна отдавать зданию система отопления. Или нужно определить
температуру после смешивания горячей и холодной воды. И на этом уроке мы
разберёмся, как проводятся такие расчёты.
Например, при строительстве жилых домов необходимо знать, какое количество
теплоты должна отдавать зданию система отопления. Или нужно определить
температуру после смешивания горячей и холодной воды. И на этом уроке мы
разберёмся, как проводятся такие расчёты.
Последовательность действий при решении задач на расчёт теплообменных процессов:
Задача 2. Для купания ребёнка температура воды в ванночке не должна превышать 38 оС. Для этого родители смешали 40 кг холодной воды при температуре 12 оС и 20 кг горячей воды при температуре 90 оС. Если потерями тепла можно пренебречь, то какое количество теплоты получили холодная вода при нагревании и отдала горячая вода при охлаждении?
Мы
получили, что количество теплоты, отданное горячей водой, равно количеству
теплоты, полученному водой холодной. И это не случайно. Вспомните: если
между телами происходит теплообмен, то внутренняя энергия всех нагревающихся
тел увеличивается ровно на столько, на сколько уменьшается внутренняя энергия
остывающих тел.
Конечно в реальных условиях количество теплоты, отданное горячей водой, всегда будет больше чем-то количество теплоты, которое получит холодная вода. Это объясняется тем, что часть энергии идёт на нагревание сосуда, в котором находилась вода, а ещё часть теряется на нагревание окружающего воздуха.
Теперь мы можем внести дополнительный пункт в нашу последовательность действий при решении задач — пункт о необходимости составления уравнения теплового баланса.
Количество теплоты, отданное или полученное телом, можно измерить с помощью прибора, который называется калориметр.
Школьный калориметр
Школьный калориметр состоит из двух стаканов, вставленных один в другой. Воздушная прослойка и подставка между ними уменьшают теплопередачу между содержимым внутреннего стакана и окружающим воздухом.
Задача
3.
Калориметр содержит 3 л воды при температуре 80 оС. В воду опускают
нагретый на плитке кирпич массой 1,5 кг. Определите начальную температуру
кирпича, если в результате теплообмена температура воды повысилась до 9 оС.
Теплопередачей калориметру и окружающему воздуху можно пренебречь.
В воду опускают
нагретый на плитке кирпич массой 1,5 кг. Определите начальную температуру
кирпича, если в результате теплообмена температура воды повысилась до 9 оС.
Теплопередачей калориметру и окружающему воздуху можно пренебречь.
Обратите внимание на то, что в некоторых задачах теплоёмкостью калориметра пренебрегать нельзя. В этом случае необходимо учитывать, что и вода, и калориметр будут нагреваться или охлаждаться вместе. А их температуры можно считать одинаковыми.
Первый закон термодинамики., калькулятор онлайн, конвертер
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Манером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
ΔU = A + Q,
где ΔU — изменение внутренней энергии, A — работа внешних сил, Q — количество теплоты, переданной системе.
Из (ΔU = A + Q) следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, то A = 0 и Q = 0, а следовательно, и ΔU = 0.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение (ΔU = A + Q) записывается в виде:
,
где A’ — работа, совершаемая системой (A’ = -A).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника (т. е. только за счет внутренней энергии).
Действительно, если к телу не поступает теплота (Q – 0), то работа A’, согласно уравнению , совершается только за счет убыли внутренней энергии А’ = -ΔU. После того, как запас энергии окажется исчерпанным, двигатель перестает работать.
Следует помнить, что как работа, так и количество теплоты, являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Система в любом состоянии обладает лишь определенной внутренней энергией.
Применение первого закона термодинамики к различным процессам .
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
Изохорный процесс.
Зависимость р(Т) на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинамический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется (ΔV= 0), и, согласно первому началу термодинамики ,
ΔU = Q,
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа (А = рΔV=0) газом не совершается.
Если газ нагревается, то Q > 0 и ΔU > 0, его внутренняя энергия увеличивается. При охлаждении газа Q < 0 и ΔU < 0, внутренняя энергия уменьшается.
Изотермический процесс.
Изотермический процесс графически изображается изотермой.
Изотермический процесс — это термодинамический процесс, происходящий в системе при постоянной температуре.
Поскольку при изотермическом процессе внутренняя энергия газа не меняется, см. формулу , (Т = const), то все переданное газу количество теплоты идет на совершение работы:
Q = A’,
При получении газом теплоты (Q > 0) он совершает положительную работу (A’ > 0). Если газ отдает тепло окружающей среде Q < 0 и A’ < 0. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой p(V).
Геометрически работа при изотермическом процессе определяется площадью под кривой p(V).
Изобарный процесс.
Изобарный процесс на термодинамической диаграмме изображается изобарой.
Изобарный (изобарический) процесс — термодинамический процесс, происходящий в системе с постоянным давлением р.
Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
При изобарном процессе, согласно формуле , передаваемое газу количество теплоты идет на изменение его внутренней энергии ΔU и на совершение им работы A’ при постоянном давлении:
Q = ΔU + A’.
Работа идеального газа определяется по графику зависимости p(V) для изобарного процесса (A’ = pΔV).
Для идеального газа при изобарном процессе объем пропорционален температуре, в реальных газах часть теплоты расходуется на изменение средней энергии взаимодействия частиц.
Адиабатический процесс .
Адиабатический процесс (адиабатный процесс) — это термодинамический процесс, происходящий в системе без теплообмена с окружающей средой (Q = 0).
Адиабатическая изоляция системы приближенно достигается в сосудах Дьюара, в так называемых адиабатных оболочках. На адиабатически изолированную систему не оказывает влияния изменение температуры окружающих тел. Ее внутренняя энергия U может меняться только за счет работы, совершаемой внешними телами над системой, или самой системой.
Согласно первому началу термодинамики (ΔU = А + Q), в адиабатной системе
ΔU = A,
где A — работа внешних сил.
При адиабатном расширении газа А < 0. Следовательно,
,
что означает уменьшение температуры при адиабатном расширении. Оно приводит к тому, что давление газа уменьшается более резко, чем при изотермическом процессе. На рисунке ниже адиабата 1-2, проходящая между двумя изотермами, наглядно иллюстрирует сказанное. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объема V1, до V2.
На рисунке ниже адиабата 1-2, проходящая между двумя изотермами, наглядно иллюстрирует сказанное. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объема V1, до V2.
Адиабатное сжатие приводит к повышению температуры газа, т. к. в результате упругих соударений молекул газа с поршнем их средняя кинетическая энергия возрастает, в отличие от расширения, когда она уменьшается (в первом случае скорости молекул газа увеличиваются, во втором — уменьшаются).
Резкое нагревание воздуха при адиабатическом сжатии используется в двигателях Дизеля.
Уравнение теплового баланса .
В замкнутой (изолированной от внешних тел) термодинамической системе изменение внутренней энергии какого-либо тела системы ΔU1 не может приводить к изменению внутренней энергии всей системы. Следовательно,
Если внутри системы не совершается работа никакими телами, то, согласно первому закону термодинамики, изменение внутренней энергии любого тела происходит только за счет обмена теплом с другими телами этой системы: ΔUi = Qi. Учитывая , получим:
Учитывая , получим:
,
Это уравнение называется уравнением теплового баланса. Здесь Qi – количество теплоты, полученное или отданное i-ым телом. Любое из количеств теплоты Qi может означать теплоту, выделяемую или поглощаемому при плавлении какого-либо тела, сгорании топлива, испарении или конденсации пара, если такие процессы происходят с различными телами системы, и будут определятся соответствующими соотношениями.
Уравнение теплового баланса является математическим выражением закона сохранения энергии при теплообмене.
Внутренняя энергия идеального газа. Термодинамика. Лекция 3.2
1. Тема:«Основы термодинамики. Внутренняя энергия. Работа газа. Количество теплоты».
2. Содержание
• Внутренняя энергия• Работа в термодинамике
• Количество теплоты
_________
Определение: Термодинамика – теория тепловых
процессов, в которой не учитывается
молекулярное строение тел.

3. Внутренняя энергия
• Определение:Внутренняя энергия тела – это сумма
кинетической энергии хаотического теплового
движения частиц (атомов и молекул) тела и
потенциальной энергии их взаимодействия
• Обозначение:
U
• Единицы измерения:
[Дж]
U= Ек +Еp
4. Внутренняя энергия идеального одноатомного газа.
U NE ,k
m
N NА
M
3
E kT
k 2
3
U NАkT
2
число молекул
кинетическая энергия
одной молекулы
(NAk = R)
5. Внутренняя энергия идеального одноатомного газа
3 mU
RT
2M
Так как
m
pV RT
M
– уравнение Клапейрона –
Менделеева,
то внутренняя энергия:
3
U pV
2
5
U pV
2
– для одноатомного газа
– для двухатомного газа.
7. В общем виде:
i mi
U
RT pV
2M
2
где i – число степеней свободы молекул газа (i = 3
для одноатомного газа и i = 5 для двухатомного
газа)
Изменение внутренней энергии:
10.
 Изменение внутренней энергии тела ΔU Совершение
Изменение внутренней энергии тела ΔU Совершениеработы А
Теплообмен Q
теплопроводность
над
телом
самим
телом
ΔU
ΔU
излучение
конвекция
11. Работа в термодинамике
Работа в термодинамике – работа сил, приложенных квнешним телам со стороны системы при её деформации.
Работа газа численно равна площади фигуры под графиком
зависимости давления от объёма в координатах p, V
Расширение газа
p
p
2
2
1
Сжатие газа
p
A>0
V1
1
A
V2
V
V1
V2
V
AГ p (V2 V1 ) p V – работа газа
Aвн AГ p V – работа внешних сил
13. Работа в термодинамике
• Работа газа:A p (V2 V1 ) p V
• Работа внешних сил:
A A
• Работа А, совершаемая
внешними телами над газом,
отличается от работы А’
самого газа только знаком:
14. Работа газа при изопроцессах
• При изохорном процессе (V=const):ΔV = 0 работа газом не совершается:
A 0
P
V
Изохорное нагревание
15.
 При изобарном процессе (Р=const): A p V
При изобарном процессе (Р=const): A p VP
1
2
P
A 0
Изобарное расширение
V1
V2
V
16. При изотермическом процессе (Т=const):
Изотермическое расширениеP
1
A 0
2
Р2
V1
V2
V
19. Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче
ПроцессНагревание или
охлаждение
Кипение или
конденсация
формула
Q cm T
Q rm
С – удельная теплоёмкость
вещества [ Дж/кг 0К], m –
масса [кг], ΔT – изменение
температуры [ 0K].
r – удельная теплота
парообразования [ Дж/кг ]
Плавление или
кристаллизация
Q m
Сгорание
топлива
– удельная теплота сгорания
Q qm qтоплива
[ Дж/кг ]
λ- удельная теплота плавления
вещества [ Дж/кг ]
22. Уравнение теплового баланса:
23. Первое начало термодинамики.
25. Тема: Коэффициент полезного действия (КПД) тепловых двигателей
Развитие техники зависит от уменияиспользовать громадные запасы внутренней
энергии.
 Использовать эту энергию – это
Использовать эту энергию – этозначит совершать за ее счет полезную работу.
Рассмотрим источники, которые совершают
работу за счет внутренней энергии.
Вся
ли тепловая энергия превращается в
тепловых двигателях в механическую энергию?
Любой тепловой двигатель превращает в
механическую энергию только часть той
энергии, которая выделяется топливом.
Для характеристики экономичности различных
двигателей введено понятие КПД
(коэффициент полезного действия) двигателя.
Нагреватель
Передает количество
теплоты Q1 рабочему телу
Q1
Совершает работу:
рабочее
тело
Q2
холодильник
A=Q1 −|Q 2|
Потребляет часть полученного
количества теплоты Q2
КПД замкнутого цикла
|Q 2|
A Q 1 −|Q 2|
η=
=
=1−
|Q 1|
Q1
Q1
Q1 – количество теплоты полученное от нагревания
Q1>Q2
Q2 – количество теплоты отданное холодильнику
Q 2
A’ = Q 1- |Q 2| – работа совершаемая двигателем за цикл
η
Цикл C.
 Карно
КарноT 1 −T 2
T2
η max =
=1−
T1
T1
¿
T1 – температура нагревания
Т2 – температура холодильника
Виды тепловых двигателей
Паровой
двигатель
Двигатель
внутреннего
сгорания
Паровая
турбина
Дизельный
двигатель
Газовая
турбина
Реактивный
двигатель
Характеристики тепловых двигателей
Двигатели
Мощность, кВт
КПД, %
ДВС:
карбюраторный
дизельный
1 – 200
15 – 2200
25
35
Турбины:
паровые
газовые
3 105
12 105
30
27
Реактивный
3 107
80
КПД теплового двигателя
= (А / Q1 ) 100%
= А п / Аз
= ( Q1-Q2 / Q1 ) 100%
= А п/ Аз
ВСЕГДА!
Почему?
= А п/ Аз
00%
Качественные задачи:
1. Один из учеников при решении
получил ответ, что КПД теплового
двигателя равен 200%. Правильно ли
решил ученик задачу?
2. КПД теплового двигателя 45%.
 Что
Чтоозначает это число?
Ответы:
1. Нет. КПД теплового двигателя не
может быть равен 200%, т. к. он всегда
00%.
2. КПД теплового двигателя 45%
означает, что только 45% от теплоты,
переданной рабочему телу (газу), идет
на совершение полезной работы.
Первый закон термодинамики
Первый закон термодинамики (закон сохранения энергии для тепловых процессов) определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему.
Первый закон термодинамики – Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме
количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
Первый закон термодинамики – количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на
совершение системой работы над внешними телами:
Частные случаи первого закона термодинамики для изопроцессов
При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии
газа происходит благодаря теплообмену с окружающими телами:
Изменение внутренней энергии
газа происходит благодаря теплообмену с окружающими телами:
При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
При изобарном расширении газа подведенное к нему количество теплоты расходуется как на увеличение его внутренней
энергии и на совершение работы газом:
Адиабатный процесс – термодинамический процесс в теплоизолированной системе.
Теплоизолированная система – система, не обменивающаяся энергией с окружающими телами.
Формула КПД теплового двигателя:Здесь Q1 – количество теплоты, полученное рабочим телом,
Q2 – количество теплоты, отданное холодильнику.
A – полезная работа.
Формула Карно для оценки максимального КПД теплового двигателя:
T1 – температура нагревателя, T2 – температура холодильника.
Цикл Карно для тепловой машины
Энергетическая схема тепловой машины: 1 – нагреватель; 2 – холодильник; 3 – рабочее
тело, совершающее круговой процесс.
 Q1 > 0, A > 0, Q2 T2
Q1 > 0, A > 0, Q2 T2Энергетическая схема холодильной машины. Q1 0, T1 > T2
Работа и тепло – Вводная химия – 1-е канадское издание
- Определите вид работы по давлению и объему.
- Определите тепло .
- Соотнесите количество тепла с изменением температуры.
Мы уже определили работу как силу, действующую на расстоянии. Оказывается, есть и другие эквивалентные определения работы, которые также важны в химии.
Когда определенный объем газа расширяется, он работает против внешнего давления и расширяется (см.Рисунок 7.5 «Объем в зависимости от давления»). То есть газ должен выполнять работу. Предполагая, что внешнее давление P ext является постоянным, объем работы, выполняемой газом, определяется следующим уравнением:
В, где Δ V – изменение объема газа. Этот член всегда представляет собой конечный объем минус начальный объем, как показано здесь:
Δ V может быть положительным или отрицательным, в зависимости от того, V final больше (расширяется) или меньше (сокращается), чем V начальный . Отрицательный знак в уравнении для работы важен и означает, что по мере увеличения объема (Δ V положительно), газ в системе составляет , теряя энергии в качестве работы. С другой стороны, если газ сжимается, Δ V отрицательно, и два отрицательных знака делают работу положительной, поэтому в систему добавляется энергия.
Отрицательный знак в уравнении для работы важен и означает, что по мере увеличения объема (Δ V положительно), газ в системе составляет , теряя энергии в качестве работы. С другой стороны, если газ сжимается, Δ V отрицательно, и два отрицательных знака делают работу положительной, поэтому в систему добавляется энергия.
Наконец, рассмотрим единицы.Изменения объема обычно выражаются в таких единицах, как литры, тогда как давление обычно выражается в атмосферах. Когда мы используем уравнение для определения работы, единица измерения работы получается как литр · атмосфера, или L⋅atm. Это не очень распространенная единица для работы. Однако существует переводной коэффициент между L⋅atm и обычной единицей работы, джоулями:
Используя этот коэффициент преобразования и предыдущее уравнение для работы, мы можем рассчитать работу, выполняемую при расширении или сжатии газа.
Какую работу совершает газ, если он расширяется с 3,44 л до 6,19 л при постоянном внешнем давлении 1,26 атм? Выразите окончательный ответ в джоулях.
Решение
Сначала нам нужно определить изменение объема, Δ В . Изменением всегда является конечное значение минус начальное значение:
Теперь мы можем использовать определение работы для определения проделанной работы:
Теперь мы построим коэффициент преобразования из отношения между литром · атмосферой и джоулями:
Мы ограничиваем окончательный ответ тремя значащими цифрами, если это необходимо.
Какая работа выполняется, когда газ расширяется с 0,66 л до 1,33 л при внешнем давлении 0,775 атм?
Ответ
−53 Дж
Тепло – еще один аспект энергии. Тепло – это передача энергии от одного тела к другому из-за разницы температур. Например, когда мы касаемся чего-то руками, мы интерпретируем этот объект как горячий или холодный в зависимости от того, как передается энергия: если энергия передается в ваши руки, объект ощущается горячим. Если энергия передается от ваших рук к объекту, они становятся холодными. Поскольку тепло является мерой передачи энергии, оно также измеряется в джоулях.
Если энергия передается от ваших рук к объекту, они становятся холодными. Поскольку тепло является мерой передачи энергии, оно также измеряется в джоулях.
Для данного объекта количество тепла ( q ) пропорционально двум вещам: массе объекта ( m ) и изменению температуры (Δ T ), вызванному передачей энергии. Мы можем записать это математически как:
, где ∝ означает «пропорционально». Чтобы сделать пропорциональность равенством, мы включаем константу пропорциональности.В этом случае константа пропорциональности обозначена как c и называется удельной теплоемкостью, или, более кратко, удельной теплоемкостью:
, где масса, удельная теплоемкость и изменение температуры умножаются. Удельная теплоемкость – это мера того, сколько энергии необходимо для изменения температуры вещества; чем больше удельная теплоемкость, тем больше энергии требуется для изменения температуры. Единицами измерения удельной теплоемкости являются или, в зависимости от единицы измерения Δ T . Вы можете заметить отклонение от требования выражать температуру в Кельвинах. Это потому, что изменение температуры имеет одно и то же значение, независимо от того, выражена ли температура в градусах Цельсия или в кельвинах.
Вы можете заметить отклонение от требования выражать температуру в Кельвинах. Это потому, что изменение температуры имеет одно и то же значение, независимо от того, выражена ли температура в градусах Цельсия или в кельвинах.
Рассчитайте количество тепла, возникающее при повышении температуры 25,0 г Fe с 22 ° C до 76 ° C. Удельная теплоемкость Fe составляет 0,449.
Решение
Сначала нам нужно определить Δ T . Изменением всегда является конечное значение минус начальное значение:
Теперь мы можем использовать выражение для q , подставить все переменные и найти тепло:
Обратите внимание, как единицы измерения g и ° C отменяются, оставляя J – единицу тепла.Также обратите внимание, что это значение q является положительным по своей природе, что означает, что в систему поступает энергия.
Рассчитайте количество тепла, возникающее при повышении температуры 76,5 г Ag с 17,8 ° C до 144,5 ° C. Удельная теплоемкость Ag составляет 0,233.
Удельная теплоемкость Ag составляет 0,233.
Ответ
2260 Дж
Как и в случае с любым уравнением, когда вы знаете все переменные, кроме одной, в выражении для q , вы можете определить оставшуюся переменную с помощью алгебры.
Для повышения температуры 373 г Hg на 104 ° C требуется 5 408 Дж тепла.Какова удельная теплоемкость Hg?
Решение
Мы можем начать с уравнения для q , но теперь даны другие значения, и нам нужно решить для удельной теплоемкости. Обратите внимание, что Δ T дается непосредственно как 104 ° C. Подставляем:
Разделим обе части уравнения на 373 г и 104 ° C:
Объединяя числа и объединяя все единицы, получаем:
Золото имеет удельную теплоемкость 0.129. Если для повышения температуры образца золота на 99,9 ° C требуется 1377 Дж, какова масса золота?
Ответ
107 г
Таблица 7.3 «Удельная теплоемкость различных веществ» перечисляет удельную теплоемкость некоторых веществ. Удельная теплоемкость – это физическое свойство веществ, поэтому это характеристика вещества. Общая идея состоит в том, что чем ниже удельная теплоемкость, тем меньше энергии требуется для изменения температуры вещества на определенную величину.
Удельная теплоемкость – это физическое свойство веществ, поэтому это характеристика вещества. Общая идея состоит в том, что чем ниже удельная теплоемкость, тем меньше энергии требуется для изменения температуры вещества на определенную величину.
| Вещество | Удельная теплоемкость |
|---|---|
| вода | 4,184 |
| утюг | 0,449 |
| золото | 0,129 |
| ртуть | 0,139 |
| алюминий | 0,900 |
| спирт этиловый | 2,419 |
| магний | 1.03 |
| гелий | 5,171 |
| кислород | 0,918 |
- Работа может быть определена как изменение объема газа при постоянном внешнем давлении.
- Тепло – это передача энергии из-за разницы температур.
- Теплота может быть рассчитана через массу, изменение температуры и удельную теплоемкость.
- Дайте два определения работы .
- Какой знак работы при увеличении объема пробы газа? Объясните, почему у работы есть этот знак.
- Что происходит, когда газ расширяется с 3,00 л до 12,60 л при внешнем давлении 0,888 атм?
- Что происходит, когда газ расширяется с 0,666 л до 2,334 л при внешнем давлении 2,07 атм?
- Какова работа, когда газ сжимается с 3,45 л до 0,97 л при внешнем давлении 0,985 атм?
- Какова работа, когда газ сжимается с 4,66 л до 1,22 л при внешнем давлении 3,97 атм?
- Как и работа, знак тепла может быть положительным или отрицательным.Что происходит с общей энергией системы, если тепло положительно?
- Как и работа, знак тепла может быть положительным или отрицательным. Что происходит с полной энергией системы, если тепло отрицательно?
- Что такое тепло, когда 55,6 г Fe повышают температуру с 25,6 ° C до 177,9 ° C? Теплоемкость Fe приведена в таблице 7.3.
- Что такое тепло, когда 0,444 г золота повышают температуру с 17,8 ° C до 222,5 ° C? Теплоемкость Au представлена в таблице 7.3.
- Что такое тепло, когда 245 г H 2 O охлаждают с 355 K до 298 K? Теплоемкость H 2 O приведена в таблице 7.3.
- Что такое тепло, когда 100,0 г Mg охлаждают с 725 K до 552 K? Теплоемкость Mg приведена в таблице 7.3.
- Для повышения температуры образца металла весом 36,8 г с 22,9 ° C до 98,2 ° C требуется 452 Дж тепла. Какова теплоемкость металла?
- Требуется 2267 Дж тепла, чтобы поднять температуру образца металла массой 44,5 г с 33,9 ° C до 288,3 ° C. Какова теплоемкость металла?
- Экспериментатор добавляет 336 Дж тепла к 56,2 г образца Hg.Каково его изменение температуры? Теплоемкость Hg приведена в таблице 7.3.
- К образцу 0,444 г H 2 O добавляют 23,4 Дж тепла. Каково его изменение температуры? Теплоемкость H 2 O приведена в таблице 7.3.
- Неизвестная масса алюминия поглощает 187,9 Дж тепла и увеличивает его температуру с 23,5 ° C до 35,6 ° C. Какая масса у алюминия? Сколько это молей алюминия?
- Образец He переходит с 19,4 ° C до 55,9 ° C при добавлении 448 Дж энергии.Какая масса у гелия? Сколько это молей гелия?
- Работа – это сила, действующая через расстояние или объем, изменяющийся против некоторого давления.
- −864 Дж
- 248 Дж
- При положительном нагреве общая энергия системы увеличивается.
- 3.80 × 10 3 Дж
- −58 400 Дж
- 43.0 ° С
- 17,3 г; 0,640 моль
Атрибуция в СМИ
Работа
РаботаРабота
Определение работы
Работа может быть определена как произведение силы, используемой для перемещения объект, умноженный на расстояние, на которое объект перемещен.
w = F x d
Представьте себе систему, состоящую из образца аммиака, захваченного поршнем и цилиндром, как показано на рисунке ниже.Предположим, что давление газа на поршень просто уравновешивает вес поршня, так что объем газа остается постоянным. Теперь Предположим, что газ разлагается с образованием азота и водорода, увеличивая количество газа частицы в контейнере. Если температура и давление газа поддерживаются постоянными, это означает, что объем газа должен увеличиваться.
2 NH 3 ( г ) N 2 ( г ) + 3 H 2 ( г )
Объем газа может увеличиваться за счет частичного выталкивания поршня из цилиндра.Объем проделанной работы равен произведению силы, действующей на поршень, на время. расстояние, на которое перемещается поршень.
w = F x d
Давление ( P ), которое газ оказывает на поршень, равно силе (F) с которым он толкает поршень, разделенный на площадь поверхности ( A, ) поршень.
Таким образом, сила, оказываемая газом, равна произведению его давления на площадь поверхности поршня.
F = P x A
Подстановка этого выражения в уравнение, определяющее работу, дает следующее результат.
w = ( P x A ) x d
Произведение площади поршня на расстояние, на которое перемещается поршень, равно изменение, которое происходит в объеме системы при расширении газа. Условно, изменение громкости обозначается символом V .
В = A x d
Следовательно, величина работы, совершаемой при расширении газа, равна произведению давление газа умножается на изменение объема газа.
| w | = пол В
Джоуль – Измерение тепла и работы
По определению, один джоуль – это работа, выполненная, когда сила в один ньютон используется для перемещения объект один метр.
1 Дж = 1 Н · м
Поскольку работа может быть преобразована в тепло и наоборот, система СИ использует джоуль для измерять энергию в виде тепла и работы.
Первый закон термодинамики: сохранение Энергия
Первый закон термодинамики гласит, что энергия не может быть создана или уничтожен.Система может набирать или терять энергию. Но любое изменение энергии системы должно сопровождаться эквивалентным изменением энергии его окружения, потому что полная энергия Вселенной постоянна. Первый закон термодинамики можно описать по следующему уравнению.
E унив. = E системный + E по адресу = 0
(индексы univ , sys и surr обозначают вселенную, система и ее окружение.)
Внутренняя энергия
Энергию системы часто называют ее внутренней энергией , потому что она представляет собой сумму кинетической и потенциальной энергий частиц, образующих систему. Потому что отсутствие взаимодействия между частицами, единственный вклад во внутреннюю энергию идеального газ – кинетическая энергия частиц. Внутренняя энергия идеального газа равна поэтому прямо пропорциональна температуре газа.
(В этом уравнении R – постоянная идеального газа, а T – температура газа в единицах Кельвина.)
Хотя трудно, если не невозможно, написать уравнение для более сложных систем, внутренняя энергия системы по-прежнему прямо пропорциональна ее температура. Таким образом, мы можем использовать изменения температуры системы для отслеживания изменения его внутренней энергии.
Величина изменения внутренней энергии системы определяется как разница между начальным и конечным значениями этой величины.
E sys = E конечный – E начальный
Поскольку внутренняя энергия системы пропорциональна ее температуре, E положительный, когда температура системы увеличивается.
Первый закон термодинамики: взаимопревращение тепла и труда
Энергия может передаваться между системой и ее окружением, пока энергия полученная одним из этих компонентов Вселенной равна энергии, потерянной Другие.
E sys = – E поверх
Энергия может передаваться между системой и ее окружением в виде тепло ( q ) или работать ( w ).
E sys = q + w
Когда тепло проникает в систему, оно может повышать температуру системы или может Работа.
q = E sys – Вт
Знаковое соглашение для отношения между внутренней энергией системы и тепло , которое пересекает границу между системой и ее окружением, дается на рисунке ниже.
- Когда тепло, поступающее в систему, увеличивает температуру системы, внутренний энергия системы увеличивается, а E положительный.
- Когда температура системы снижается из-за выхода тепла из системы, E отрицательный.
Знаковое соглашение между работой и внутренней энергией система показана в левой части рисунка ниже.
- Когда система работает с окружающей средой, энергия теряется, и E отрицательный.
- Когда окружение работает с системой, внутренняя энергия системы становится больше, поэтому E положительный.
Взаимосвязь между объемом работы, выполняемой системой при ее расширении, и изменение объема системы ранее описывалось следующим уравнением.
| w | = пол В
На рисунке выше показано, что условное обозначение для работы расширения может быть включено записав это уравнение следующим образом.
w = – P V
Функции состояния
Когда уравнения соединяют два или более свойств, которые описывают состояние системы, они называются уравнениями состояния .Например, закон идеального газа – это уравнение состояния.
PV = nRT
Функция состояния с зависит только от состояния системы, а не от путь, используемый для перехода в это состояние.
Температура – это функция состояния. Сколько бы раз мы ни нагревали, ни охлаждали, ни расширяли, сжать или иным образом изменить систему, чистое изменение температуры зависит только от от начального и конечного состояний системы.
т = T конечный – T начальный
То же самое можно сказать об объеме, давлении и количестве молей газа в образец. Все эти величины являются государственными функциями.
Тепло и работа – это , а не государственные функции. Работа не может быть государственной функцией, потому что пропорционально расстоянию, на которое перемещается объект, которое зависит от используемого пути от начального до конечного состояния.Если работа не является государственной функцией, то тепло не может быть государственная функция тоже. Согласно первому закону термодинамики изменение внутренняя энергия системы равна сумме тепла и переданной работы между системой и ее окружением.
E sys = q + w
Если E не зависит от пути перехода от начального к конечному состоянию, а от количества работы зависит от используемого пути, количество отдаваемого или поглощенного тепла должно зависеть на пути.
Термодинамические свойства системы, являющиеся функциями состояния обычно обозначаются заглавными буквами ( T , V , P , E и т. д. на). Термодинамические свойства, которые не являются функциями состояния, часто описываются строчные буквы ( q и w ).
Измерение тепла калориметром
Количество тепла, выделяемого или поглощаемого в химической реакции, можно измерить с помощью калориметр, как показано на рисунке ниже.
Поскольку реакция происходит в герметичном контейнере при постоянном объеме, работа расширение происходит во время реакции. Тепло, выделяемое или поглощаемое реакцией, равно следовательно, равняется изменению внутренней энергии системы в течение реакция:
E sys = q В .
Количество тепла, выделяемого или поглощаемого водой в калориметре, может быть рассчитывается исходя из теплоемкости воды.
Heat – это экстенсивное количество . Самый распространенный подход к преобразованию измерение тепла в интенсивное количество – это расчет теплоты реакции в единиц килоджоулей на моль. Результатом этого расчета является величина, известная как молярных долей. теплота реакции . По определению, молярная теплота реакции – это тепло, выделяемое или поглощается реакцией, выражается в килоджоулей на моль одного из реагентов в реакции.
Тепло, работа и энергия
Тепло (энергия)
Единица измерения тепла (или энергии) в системе СИ составляет джоуль (Дж) .
С разницей температур
Другими единицами измерения тепла являются британская тепловая единица – Btu (количество тепла для подъема 1 фунта воды на 1 o F ) и Калорийность (количество тепла для поднятия 1 грамма воды на 1 o C ( или 1 K )).
A калорий определяется как количество тепла, необходимое для изменения температуры одного грамма жидкой воды на один градус Цельсия (или один градус Кельвина).
1 кал = 4,184 Дж
1 Дж = 1 Вт · с
= (1 Вт · с) (1/3600 ч / с)
= 2,78 10 -4 Вт · ч
= 2,78 10 -7 кВтч
Тепловой поток (мощность)
Теплопередача только в результате разницы температур называется тепловым потоком . Единицы СИ для теплового потока: Дж / с или ватт (Вт) – то же, что и мощность. Один ватт определяется как 1 Дж / с .
Удельная энтальпия
Удельная энтальпия – это мера полной энергии в единицах массы. Обычно используются единицы СИ: Дж / кг или кДж / кг .
Термин относится к общей энергии, обусловленной давлением и температурой текучей среды (например, воды или пара) в любой момент времени и при любых условиях.В частности, энтальпия – это сумма внутренней энергии и работы, совершаемой под действием приложенного давления.
Теплоемкость
Теплоемкость системы составляет
- количество тепла, необходимое для изменения температуры всей системы на на один градус .
Удельная теплоемкость
Удельная теплоемкость (= удельная теплоемкость) – это количество тепла, необходимое для изменения температуры на одну единица массы вещества на на один градус .
Удельная теплоемкость может быть измерена в Дж / г K, Дж / кг K , кДж / кг K, кал / гK или БТЕ / фунт o F и более .
Никогда не используйте табличные значения теплоемкости без проверки единиц фактических значений!
Удельную теплоемкость для обычных продуктов и материалов можно найти в разделе «Свойства материала».
Удельная теплоемкость – постоянное давление
Энтальпия – или внутренняя энергия – вещества зависит от его температуры и давления.
Изменение внутренней энергии относительно изменения температуры при фиксированном давлении составляет Удельная теплоемкость при постоянном давлении – c p .
Удельная теплоемкость – постоянный объем
Изменение внутренней энергии относительно изменения температуры при фиксированном объеме – это удельная теплоемкость при постоянном объеме – c v .
Если давление не является чрезвычайно высоким, работой, выполняемой приложением давления к твердым телам и жидкостям, можно пренебречь, а энтальпия может быть представлена только компонентом внутренней энергии.Можно сказать, что теплота постоянного объема и теплоты постоянного давления равны.
Для твердых и жидких веществ
c p = c v (1)
Удельная теплоемкость представляет собой количество энергии, необходимое для подъема 1 кг вещества на 1 o C (или 1 K) , и ее можно рассматривать как способность поглощать тепло. Единицы измерения удельной теплоемкости в системе СИ: Дж / кг · К (кДж / кг o C) .Вода имеет большую удельную теплоемкость 4,19 кДж / кг o C по сравнению со многими другими жидкостями и материалами.
- Вода – хороший теплоноситель!
Количество тепла, необходимое для повышения температуры
Количество тепла, необходимое для нагрева объекта от одного температурного уровня до другого, может быть выражено как:
Q = c p m dT ( 2)
где
Q = количество тепла (кДж)
c p = удельная теплоемкость (кДж / кг · K)
м = масса (кг )
dT = разница температур между горячей и холодной стороной (K)
Пример отопительной воды
Рассмотрим энергию, необходимую для нагрева 1.0 кг воды от 0 o C до 100 o C при удельной теплоемкости воды 4,19 кДж / кг o C :
Q = (4,19 кДж / кг o C ) (1,0 кг) ((100 o C) – (0 o C))
= 419 (кДж)
Рабочий
С технической точки зрения работа и энергия – одно и то же, но работа – это результат, когда направленная сила (вектор) перемещает объект в одном направлении.
Объем выполненной механической работы можно определить с помощью уравнения, полученного из механики Ньютона
Работа = Приложенная сила x Расстояние, перемещенное в направлении силы
или
W = F l (3)
, где
W = работа (Нм, Дж)
F = приложенная сила (Н)
l = длина или пройденное расстояние (м)
Рабочая емкость также можно описать как произведение приложенного давления и вытесненного объема:
Работа = Приложенное давление x Вытесненный объем
или
W = p A l (3b)
где
p = приложенное давление (Н / м 2 , Па)
A = под давлением площадь (м 2 )
l = длина или расстояние, на которое зона давления перемещается под действием приложенной силы (м)
Пример – Работа, выполняемая силой
Работа, выполняемая силой 100 Н перемещение тела 50 м можно рассчитать как
W = (100 Н) (50 м)
= 5000 (Нм, Дж)
Единица измерения работы – джоуль, J, который определяется как количество работы, выполненной, когда сила 1 ньютон действует на расстоянии 1 м в направлении силы.
1 Дж = 1 Нм
Пример – Работа под действием силы тяжести
Работа, выполненная при подъеме массы 100 кг на высоте 10 м может быть рассчитана как
W = F г ч
= mgh
= (100 кг) (9,81 м / с 2 ) (10 м)
= 9810 (Нм, Дж)
где
F г = сила тяжести – или вес (Н)
г = ускорение свободного падения 9.81 (м / с 2 )
h = высота (м)
В британских единицах измерения единичная работа выполняется при весе 1 фунт f (фунт-сила) поднял вертикально против силы тяжести на расстояние 1 фут . Единица называется фунт-фут .
Поднят объект массой 10 снарядов 10 футов . Выполненную работу можно рассчитать как
W = F г ч
= m g h
= (10 пробок) (32.17405 фут / с 2 ) (10 футов)
= 3217 фунтов f футов
Пример – Работа, связанная с изменением скорости
Работа, выполненная при массе 100 кг ускоряется от от скорости 10 м / с до скорости 20 м / с можно рассчитать как
W = (v 2 2 – v 1 2 ) м / 2
= ((20 м / с) 2 – (10 м / с) 2 ) (100 кг) / 2
= 15000 (Нм, Дж)
где
v 2 = конечная скорость (м / с)
v 1 = начальная скорость (м / с)
Энергия
Энергия – это способность делать работа (перевод с греческого – «работа внутри»).Единицей измерения работы и энергии в системе СИ является джоуль, определяемый как 1 Нм .
Движущиеся объекты могут выполнять работу, потому что обладают кинетической энергией. («кинетический» означает «движение» по-гречески).
Количество кинетической энергии, которой обладает объект, можно рассчитать как
E k = 1/2 мв 2 (4)
где
м = масса объекта (кг)
v = скорость (м / с)
Энергия положения уровня (запасенная энергия) называется потенциальной энергией.Это энергия, связанная с силами притяжения и отталкивания между объектами (гравитация).
Полная энергия системы складывается из внутренней, потенциальной и кинетической энергии. Температура вещества напрямую связана с его внутренней энергией. Внутренняя энергия связана с движением, взаимодействием и связыванием молекул внутри вещества. Внешняя энергия вещества связана с его скоростью и местоположением и является суммой его потенциальной и кинетической энергии.
Тепловая энергия Термодинамические свойства | Инженеры Edge
Термодинамические свойства тепловой энергии
Справочник по термодинамике | Справочник по теплопередаче
Тепловая энергия
Тепло , как и работа, – это энергия в пути. Однако передача энергии в виде тепла происходит на молекулярном уровне в результате разницы температур.Символ Q используется для обозначения тепла. В инженерных приложениях единицей тепла является британская тепловая единица (БТЕ). В частности, это называется 60 градусов британской тепловой единицы, потому что она измеряется изменением температуры на один градус с 59,5 до 60,5 ° F.
Как и при работе, количество передаваемого тепла зависит от пути, а не просто от начального и конечного состояния системы. Также, как и в случае с работой, важно различать тепло, добавляемое к системе из окружающей среды, и тепло, отводимое от системы к ее окружению.Положительное значение тепла указывает на то, что тепло добавляется в систему окружающей средой. Это отличается от работы, которая является положительной, когда энергия передается от системы, и отрицательной, когда она передается в систему. Символ q иногда используется для обозначения тепла, добавляемого в систему или удаляемого из системы на единицу массы. Он равен общему количеству добавленного или удаленного тепла (Q), разделенному на массу (m). Термин «удельная теплоемкость» не используется для q, поскольку удельная теплоемкость используется для другого параметра. Величина, представленная q, называется просто теплотой, передаваемой на единицу массы.
Пример:
Определите тепло, передаваемое на единицу массы, если 1500 британских тепловых единиц передаются 40 фунтам на метр воды.
Решение:
Использование уравнения 1-16
Наилучший способ дать количественную оценку определению тепла – это рассмотреть взаимосвязь между количеством тепла, добавляемого или отводимого из системы, и изменением температуры системы. Всем известны физические явления: когда вещество нагревается, его температура повышается, а при охлаждении – понижается.Тепло, добавляемое к веществу или отводимое от него для изменения его температуры, называется явным теплом . Единицы тепла часто определяют с точки зрения изменений температуры, которые оно производит.
Другой вид тепла называется скрытой теплотой . Скрытая теплота – это количество тепла, добавляемого к веществу или отводимого от него для изменения фазы. При добавлении скрытого тепла изменение температуры не происходит. Есть два типа скрытого тепла. Первый – это скрытая теплота плавления .Это количество тепла, добавляемого или удаляемого для изменения фазы между твердым и жидким. Второй тип скрытой теплоты – это скрытая теплота парообразования . Это количество тепла, добавляемого или удаляемого для изменения фазы между жидкостью и паром. Скрытую теплоту парообразования иногда называют скрытой теплотой конденсации.
Различные вещества в разной степени подвержены воздействию тепла. Когда к разным веществам добавляется определенное количество тепла, их температура увеличивается на разную величину.Отношение тепла (Q), добавляемого к веществу или отводимого от него, к произведенному изменению температуры (ΔT) называется теплоемкостью (C p ) вещества. Теплоемкость вещества на единицу массы называется удельной теплоемкостью (c p ) вещества. Индекс p указывает, что теплоемкость и удельная теплоемкость применяются, когда тепло добавляется или удаляется при постоянном давлении.
Один фунт воды поднимается на 1 ° F и добавляется одна британская тепловая единица.Это означает, что удельная теплоемкость (c p ) воды составляет одну британскую тепловую единицу / фунт-метр-° F. C p воды равняется одной британской тепловых единиц на фунт-фут-° F только при 39,1 ° F.
Путем преобразования уравнения 1-17 получаем Q = mc p ΔT, которое используется для расчета скрытой теплоты. К подставляя массовый расход в фунт-м3 / ч, м вместо m, получаем Q p mc p ΔT. Это уравнение используется для расчета теплопередачи в британских тепловых единицах в час и будет полезно в следующих главах.
Пример:
Сколько тепла требуется, чтобы поднять температуру 5 фунтов воды с 50 ° F до 150 ° F? (Предположим, что удельная теплоемкость (c p ) для воды постоянна и равна 1.0 британских тепловых единиц на фунт-метр)
Решение:
Из предыдущих обсуждений тепла и работы очевидно, что между ними есть много общего. Тепло и работа – это временные явления. Системы никогда не обладают теплом или работой, но одно или оба могут возникнуть, когда система претерпевает изменение энергетического состояния. И тепло, и работа являются граничными явлениями, поскольку оба наблюдаются на границе системы. Оба представляют энергию, пересекающую границу системы.
ДОМ Главы курса Основы калькулятора Обзор математики Основные понятия Advanced Concepts Раздел Тесты Предварительное испытание Пост-тест Полезные материалы Глоссарий Онлайн-калькуляторы Калькулятор окислительно-восстановительного потенциала Калькулятор кинетики Аррениуса Калькулятор термодинамики Калькулятор ядерного распада Регрессия методом наименьших квадратов Решатель уравнений метода Ньютона Калькулятор сжимаемости Калькулятор перевода единиц Калькулятор номенклатуры Ссылки по теме Калькуляторы Texas Instruments Калькуляторы Casio Калькуляторы Sharp Калькуляторы Hewlett Packard Кредиты Связаться с веб-мастером | Научная дисциплина, которая пересекает области химии и Физика широко известна как физическая химия, и именно в этой области проводится тщательное изучение термодинамики.Физика в значительной степени занимается механикой явлений в природе. Безусловно, изменения энергии – как бы они ни измерялись, будь то тепло, свет, работа и т. Д. – явно являются физическими явлениями, которые также имеют химическую природу. Термодинамика – это изучение изменений энергии, сопровождающих физические и химические изменения. Сам термин ясно указывает на то, что происходит – «термо», от температуры, что означает энергия, и «динамика», что означает изменение во времени. Термодинамика может быть грубо заключены в следующие темы: Тепло и работаТепло и работа – это формы энергии.Они также являются родственными формами в том смысле, что одна может трансформироваться в другую. Тепловую энергию (например, паровые двигатели) можно использовать для выполнения работы (например, толкания поезда по рельсам). Работа может превратиться в тепло, как, например, если потирать руки, чтобы согреть их.И работу, и тепло можно описать с помощью одной и той же единицы измерения. Иногда калорийность является единицей измерения и относится к количеству тепла, необходимому для поднятия одного (1) грамма воды на один (1) градус Цельсия.Тепловая энергия измеряется в килокалориях или 1000 калориях. Обычно в системе СИ используются джоули (Дж) и килоджоули (кДж). Одна калория тепла эквивалентна 4,187 Дж. Вы также столкнетесь с термином удельная теплоемкость, теплота, необходимая для повышения одного (1) грамма материала на один (1) градус Цельсия. Удельная теплоемкость, обозначенная символом «C», обычно определяется как:
Где: C = удельная теплоемкость в кал / г- ° C Значение C для воды составляет 1,00 кал / г- ° C. Значения удельной теплоемкости, указанные в литературе, обычно указаны для определенного давления и / или объема, и вам нужно обращать внимание на эти настройки при использовании значений из учебников в задачах или компьютерных моделях. Пример задачи: если 2,34 г вещества при 22 ° C с удельной теплоемкостью 3,88 кал / г- ° C нагревается с помощью 124 кал энергии, какова новая температура вещества?
Две другие общие тепловые переменные – это теплота плавления и теплота испарения. Теплота плавления – это тепло, необходимое для плавления вещества при его температуре плавления, а теплота испарения – это тепло, необходимое для испарения вещества при его температуре кипения. Химическая работа в первую очередь связана с расширением. В физике работа определяется как: w = d × fГде: w = работа в джоулях (Н × м) (или калориях, но мы используем в основном единицы СИ) В химических реакциях работа обычно определяется как: w = расстояние × (площадь × давление)Значение расстояния, умноженного на площадь, на самом деле является объемом.Если мы представим реакцию, происходящую в контейнере некоторого объема, мы измеряем работу давлением, умноженным на изменение объема. w = ΔV × PГде: ΔV – изменение объема, литры Если ΔV = 0, то работа не выполняется. Пример задачи: Рассчитайте работу, которую необходимо проделать при стандартной температуре и давлении (STP – 0 ° C и 1 атм), чтобы освободить место для продуктов сгорания с октановым числом: 2 C 8 H 18 + 25 O 2 -> 16 CO 2 + 18 H 2 O
ЭнергияВозможно, вы помните первый закон термодинамики: энергия не может быть создана или уничтожена.Энергия может изменять только форму. С химической точки зрения это обычно означает, что энергия преобразуется в работу, энергия в виде тепла перемещается из одного места в другое или энергия накапливается в составляющих химических веществах. Вы видели, как рассчитать работу. Тепло определяется как энергия, которая передается в результате разницы температур между системой и ее окружением. Математически мы можем рассматривать изменение энергии системы как функцию тепла и работы: ΔE = q + wГде: ΔE – изменение внутренней энергии системы. Если q положительно, мы говорим, что реакция эндотермическая, то есть тепло поступает в реакцию из внешней среды.Если q отрицательно, то реакция экзотермическая, то есть тепло отдается во внешнюю среду. Вы также можете вспомнить термины кинетическая энергия и потенциальная энергия. Кинетическая энергия – это энергия движения – количество энергии в движущемся объекте. Потенциальная энергия – это стационарная накопленная энергия. Если вы представите мяч, сидящий на краю стола, он обладает потенциальной энергией в той энергии, которая возможна, если он упадет со стола. Потенциальная энергия может быть преобразована в кинетическую, если мяч действительно скатывается со стола и находится в движении.Полная энергия системы определяется как сумма кинетической и потенциальной энергий. В описании энергии системы вы также увидите фразу «свойства состояния». Государственная собственность – это величина, стоимость которой не зависит от прошлой истории вещества. Типичные свойства состояния – высота, давление, объем, температура и внутренняя энергия. ЭнтальпияЭнтальпия – интересное понятие: она определяется ее изменением, а не единичным объектом.Государственная собственность, слово энтальпия происходит от греческого «тепло внутри». Если у вас есть химическая система, которая претерпевает какие-то изменения, но имеет фиксированный объем, тепловая мощность равна изменению внутренней энергии (q = ΔE). Мы определим изменение энтальпии, ΔH, системы как равное ее тепловой мощности при постоянном давлении: dH = q при постоянном давленииГде: ΔH = изменение энтальпии Саму энтальпию мы определяем как: H = E + PVГде: H = энтальпия Вам не потребуется напрямую рассчитывать энтальпию; в химии нас интересует только изменение энтальпии, или ΔH. ΔH = H конечный – H начальный или ΔH = H (продукты) – H (реагенты) Таблицы энтальпий обычно представлены как значения ΔH. Пример задачи: Рассчитайте значение ΔH реакции:
Мы также можем представить изменение энтальпии с помощью уравнения: ΔH = ΔE + P ΔVГде: ΔV – изменение объема, в литрах Если вы помните, работа определяется как P ΔV, поэтому изменения энтальпии – это просто отражение количества изменения энергии (входящая или исходящая энергия, эндотермическая или экзотермическая) и объем работы, выполняемой реакцией.Например, если ΔE = -100 кДж в определенной реакции сгорания, но необходимо выполнить 10 кДж работы, чтобы освободить место для продуктов, изменение энтальпии составит: ΔH = -100 кДж + 10 кДж = -90 кДж.Это экзотермическая реакция (которая ожидается при горении), и в окружающую среду выделяется 90 кДж энергии. В основном становится теплее. Обратите внимание на используемое здесь соглашение – отрицательное значение представляет энергию, исходящую из системы. Вы также можете определить ΔH для реакции на основе энергии диссоциации связи.Разрыв связей требует энергии, а образование связей высвобождает энергию. В данном уравнении вы должны определить, какие виды связей разорваны и какие связи образуются. Используйте эту информацию для расчета количества энергии, используемой для разрыва связей, и количества, используемого для образования связей. Если вы вычтете количество разрыва связей из количества образования связей, у вас будет ΔH для реакции. Пример задачи: вычислить ΔH для реакции:
ЭнтропияЭнтропия – это мера беспорядка системы. Возьмем, к примеру, вашу комнату.Предоставленная самой себе, ваша комната будет увеличивать энтропию (то есть станет более грязной), если не будет проводиться работа (уборка), чтобы сдержать беспорядок. Должна быть проделана работа, чтобы поддерживать низкую энтропию системы. Энтропия исходит из второго закона термодинамики, который гласит, что все системы стремятся достичь состояния равновесия. Значение энтропии состоит в том, что когда в системе происходит спонтанное изменение, всегда будет обнаружено, что если рассчитать общее изменение энтропии для всего, что вовлечено, будет получено положительное значение.Просто все самопроизвольные изменения в изолированной химической системе происходят с увеличением энтропии. Энтропия, как температура, давление и энтальпия, также является государственным свойством и обозначается в литературе символом « S ». Как и энтальпия, вы можете рассчитать изменение S (ΔS). Δ S = S конечный – S начальный или Δ S = S (продукты) – S (реагенты)Где: ΔS – изменение энтропии В следующей таблице показана взаимосвязь между состоянием вещества и его энтропией:
Свободная энергия ГиббсаСвободная энергия системы, обозначаемая буквой « G », определяется как энергия системы, которая может выполнять работу при постоянной температуре и давлении.Математически это определяется как: G = H – TSГде: G – энергия (иногда называемая свободной энергией) Вы также можете рассчитать изменение G таким же образом, как и изменение энтальпии или энтропии: ΔG = G (продукты) – G (реагенты)Где: Δ G – изменение свободной энергии Доступен всплывающий калькулятор для расчета изменений энтальпии и свободной энергии Гиббса в реакциях. При постоянных температуре и давлении любое спонтанное изменение направлено в сторону более низкой свободной энергии Гиббса. График ниже показывает, что во время реакции количество свободной энергии уменьшается до тех пор, пока реакция не достигнет равновесия. Если реакция идет к завершению, минимум свободной энергии происходит очень близко к части кривой, содержащей чистые продукты. Другими словами, кривая движется в зависимости от условий реакции. Таблица, относящаяся ко всем свойствам состояния, приведенным выше – изменение энтальпии, изменение энтропии и изменение свободной энергии – показана ниже.Спонтанная реакция – это реакция, которая возникает без какого-либо постороннего вмешательства. Процессы, спонтанные в одном направлении, не являются спонтанными в обратном направлении.
Практическая задача по энтальпии: Учитывая следующие энергии диссоциации связи (HC составляет 413 кДж / моль; HH составляет 436 кДж / моль; C = C составляет 614 кДж / моль; CC составляет 348 кДж / моль), определите ΔH для реакции: H 2 C = CH 2 (г) + H 2 (г) -> H 3 C-CH 3 (г) Энтальпийный раствор. Практическая задача по энтропии: При следующих значениях энтропии Al 2 O 3 (s) составляет 51,00 кДж / моль; Al (s) составляет 28,32 кДж / моль; H 2 O (г) составляет 188,7 кДж / моль; H 2 (г) составляет 130,6 кДж / моль, определите ΔS для реакции: Al 2 O 3 (с) + 3H 2 (г) -> 2Al (с) + 3H 2 O (г) Энтропийное решение. [Расширенный указатель]
[Газовые законы]
[Термодинамика]
[Кинетика]
[Equilibria] | ||||||||
17.ТЕПЛО И ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
17,1. Тепло
Два тела, находящиеся в тепловом контакте, будут изменять свою температуру до тех пор, пока находятся при одинаковой температуре. В процессе достижения тепловых равновесие , тепло передается от одного тела к другому.
Предположим
у нас есть интересующая система при температуре TS в окружении среды с температурой TE.Если TS> TE тепло идет от
система в окружающую среду. Если TS Рисунок 17.1. Тепловой поток. Тепло
это не единственный способ передачи энергии между системами.
и его окружение. Энергия также может передаваться между системами
и его окружение с помощью работы (W). Единица работы – Джоуль. Другой
обычно используемая единица – калория. Калорийность определяется как количество тепла.
это повысит температуру 1 г воды с 14.От 5 C до 15,5 C. Джоуль и калорийность соотносятся следующим образом: 1
cal = 4,1860 Дж Когда
к объекту добавляется тепло, увеличивается его температура. Перемена
температура пропорциональна количеству добавленного тепла г.
Константа C называется теплоемкостью объекта. Теплоемкость
объект зависит от его массы и типа материала, из которого он изготовлен.В
теплоемкость объекта пропорциональна его массе, а теплоемкость емкость на единицу массы , c. В этом случае где
m – масса объекта. Молярная теплоемкость – это теплоемкость на моль материала. Для
Для большинства материалов молярная теплоемкость составляет 25 Дж / моль К. В
для определения теплоемкости вещества нам не только нужно
знать, сколько тепла добавлено, а также условия, при которых
перевод состоялся.Для газов, добавление тепла при постоянном давлении
и при постоянной температуре приведет к очень разным значениям
удельная теплоемкость. Когда
тепло добавляется к твердому телу или жидкости, температура образца делает
не обязательно вставать. Во время фазового перехода (плавление, кипение) нагревают
добавляется к образцу без повышения температуры. Количество
тепла, передаваемого на единицу массы во время фазового перехода, называется теплотой преобразования (символ L) для процесса.Количество
необходимого / отпущенного тепла составляет где
m – масса образца. Проблема
28П Что
массу пара 100C необходимо смешать со 150 г льда при 0C, в термически
изолированный контейнер для производства жидкой воды при температуре 50C? ср
начните с расчета количества тепла, необходимого для преобразования 150 г льда при 0 ° C в 150 г.
жидкости при 0С.Теплота превращения воды 333
кДж / кг (см. Таблица 20-2, стр. 555). Превращение льда в
вода, следовательно, требует общего тепла, отдаваемого г.
дается тепло, необходимое для изменения температуры 150 г воды с 0C до 50C
по г.
Таким образом, общее количество тепла, которое необходимо добавить в систему, равно 81,5.
кДж. Это тепло должно передаваться паром. Будет выпущено тепло
когда пар превращается в жидкость, теплота превращения
для этого процесса составляет 2260 кДж / кг.Предположим, что масса пара равна
м. Общее количество тепла, выделяемого при преобразовании пара в воду
дается г.
тепло, выделяемое при охлаждении пара с 100 ° C до 50 ° C, определяется параметром г.
Таким образом, общее количество тепла, выделяемого при охлаждении пара, равно 2470
м кДж. Общее необходимое количество тепла составляет 81,5 кДж, поэтому мы заключаем
что масса пара должна быть равна 33 г. Предположим
система запускается из начального состояния, описываемого давлением pi, объемом Vi и температурой
Ti. Конечное состояние системы
описывается давлением pf, объемом Vf и температурой Tf. Переход из начального состояния в конечное состояние может
можно достичь разными способами (см., например, рисунок 17.2). В
На рис. 17.2a давление и объем изменяются одновременно.На рисунке
17.2b сначала понижают давление в системе при сохранении объема
постоянным (это может быть достигнуто, например, путем охлаждения образца), а затем,
объем увеличивается при постоянном давлении (это может быть
достигается за счет нагрева газа при увеличении объема). Если
давление газа увеличивается, он может перемещать поршень (это происходит в
двигатель). В этом случае работа выполняется системой по мере подъема расширяющихся газовых лифтов.
поршень.С другой стороны, если мы увеличим вес поршня,
работа над системой будет производиться по мере того, как поршень опускается. Сила проявляется
газом на поршне равна p A, где A – площадь
поршневой, p – давление газа. Если поршень смещается
расстояние ds, объем проделанной работы можно рассчитать следующим образом: Рисунок 17.2. Два возможных способа добраться от
начальное состояние в конечное состояние. The
общая работа, выполняемая во время конечного перемещения поршня, теперь легко
для расчета Если
W положительный, работа была выполнена системой (например, расширяющаяся
газ поднимает поршневой). Отрицательное значение W говорит о том, что работают
было сделано по системе (поршень прижимается, чтобы сжать
газ). г.
объем проделанной работы равен площади под кривой на диаграммах pV
показано на рисунке 17.2. Очевидно, что объем проделанной работы зависит от
выбранный путь. Работа W для пути, показанного на рисунке 17.2a, равна
значительно больше, чем работа W для пути, показанного на рисунке 17.2b. Любой
изменение в системе, в которой объем не изменяется, не будет производить / стоить
любая работа. Работа, проделанная для путей, показанных на рисунке 17.2, может быть
легко вычисляется Нет
работа выполняется для пути, показанного на рисунке 17.2b между (pi, Vi) и (pf, Vi), поскольку нет изменения громкости.Работа
сделано для перехода от (pf, Vi) к (pf, Vf) вычисляется легко Ясно,
W2b всегда меньше W2a, и мы можем сделать объем проделанной работы настолько малым или большим, насколько захотим. Для
пример, никакая работа не будет выполнена, если переход будет происходить по следующему пути: (пи, Vi) (0, Vi) (0,
Vf) (pf, Vi) А
система может быть переведена из заданного начального состояния в заданное конечное состояние с помощью
бесконечное количество процессов.В общем, работа W, а также
тепло Q будет иметь разные значения для каждого из этих процессов. Мы
говорят, что тепло и работа – это величин, зависящих от пути. От
предыдущее обсуждение ни Q, ни W не представляет собой изменение некоторых внутренних
свойства системы. Однако экспериментально наблюдается
что величина Q – W одинакова для всех процессов. Это зависит
только на начальном и конечном состояниях и неважно на каком пути
следует, чтобы перейти от одного к другому.Величина Q – W называется
изменение внутренней энергии U системы: U = Uf – Ui = Q – W Это
Уравнение называется первым законом термодинамики . Для небольших изменений первый закон термодинамики
можно переписать как dU = dQ
– dW Если
система хорошо изолирована, теплопередачи между ней и
его окружение.Это означает, что Q = 0, и первое начало термодинамики
показывает, что U = –
W Если
работа совершается системой (положительная W), ее внутренняя энергия уменьшается. Наоборот,
если над системой выполняется работа (отрицательная W), ее внутренняя энергия увеличивается. Для
газов, внутренняя энергия связана с температурой: более высокая внутренняя энергия
энергия означает более высокую температуру. Адиабатическое расширение газа понизит его температуру; адиабатический
сжатие газа повысит его температуру . Если
объем системы остается постоянным, система не может работать (W =
0 Дж). Первый закон термодинамики показывает, что U = Q Если
в систему добавляется тепло, увеличивается ее внутренняя энергия; если тепло
удаляется из системы, его внутренняя энергия уменьшится на . Процессы
которые после определенных обменов тепла и работы возвращаются к своему
начальное состояние называют циклическими процессами.В этом случае нет собственных
свойства системы изменяются, поэтому U = 0. Первый
закон термодинамики немедленно дает Q = W Бесплатно
расширение – это адиабатический процесс, в котором никакая работа не выполняется
система. Это означает, что Q = W = 0 J и
первый закон термодинамики теперь требует, чтобы U = 0
J г.
передача тепла между системой и окружающей средой может происходить
разными способами. Три разных механизма теплопередачи
Теперь мы обсудим: проводимость, конвекцию и излучение. Рассмотрим плиту материала, показанную на рисунке 17.3. В
левый конец балки поддерживается при температуре TH; правый конец балки
выдерживается при температуре ТС.В результате разницы температур тепло
будет течь через плиту от горячего конца к холодному концу. Экспериментально
показано, что скорость теплопередачи (Q / t) пропорциональна
площадь поперечного сечения плиты, пропорциональная разнице температур,
и обратно пропорциональна длине плиты Здесь,
k – коэффициент теплопроводности , , постоянная величина, зависящая от типа материала.Большой
значения k определяют хорошие проводники тепла. Тепловое сопротивление R связано с теплопроводностью k следующим образом:
манера Рисунок 17.3. Проведение. Таким образом,
чем ниже теплопроводность материала, тем выше тепловая
сопротивление R. Из определения R сразу следует, что Рассмотреть
композитная плита состоит из двух разных материалов с длиной
L1 и L2, а с теплопроводностью
k1 и k2, помещается между двумя термостатами (см. рисунок 17.4). Предполагать
что температура поверхности раздела между двумя плитами равна
Tx. Количество тепла, протекающего от TH к Tx, определяется как г.
количество тепла, протекающего от Tx до
TC задан Оф
Конечно, тепло, протекающее через плиту 1, должно равняться теплу, протекающему через
плита 2. Таким образом, Рисунок 17.4. Передача тепла через композитную плиту. Это
уравнение можно использовать для получения температуры на границе раздела между
плита 1 и плита 2: г.
теплоту, протекающую через плиту, теперь можно легко вычислить А
композитная плита поэтому имеет тепловое сопротивление, равное сумме
тепловое сопротивление каждой отдельной плиты. Тепло
перенос конвекцией происходит, когда жидкость, такая как воздух или вода,
при контакте с объектом, температура которого выше, чем температура
своего окружения. Температура жидкости увеличивается и (в
в большинстве случаев) жидкость расширяется. Быть менее плотным, чем окружающий
более прохладная жидкость, она поднимается из-за выталкивающей силы. Окружающая
более холодная жидкость опускается, чтобы занять место поднимающейся более теплой жидкости и конвективного
тираж налажен. Каждый
объект излучает электромагнитное излучение. Энергетический спектр испускаемого излучения
зависит от температуры объекта; средняя энергия увеличивается
при повышении температуры. Проблема
57P А
емкость с водой находилась на открытом воздухе в холодную погоду до толщины 5,0 см.
на его поверхности образовалась глыба льда.Воздух над льдом
-10С. Рассчитайте скорость образования льда (в
сантиметров в час) на нижней поверхности ледяной плиты. Брать
теплопроводность льда – 0,0040 кал / с. см . C
и плотность должна быть 0,92 г / см3. г.
вода на границе между водой и льдом будет иметь температуру
0С. В
тепло, передаваемое через 5 см льда, равно Это
тепло выделяется, когда вода превращается в лед.Жара
трансформация этого процесса составляет 79,5 кал / г. Предположим, что масса m равна
вода каждую секунду превращается в лед. Это дает всего
тепло равно H = 79,5
м кал / с Это
должно быть равно тепловому потоку через лед: 79,5
m = 0,0080 А А
масса льда m (покрывающая площадь A) будет иметь толщину d, где d –
предоставлено Комбинирование
последние два выражения получаем для скорости образования льда: Тепло и работа – это два разных способа передачи энергии от одной системы к другой. Различие между Heat и Work важно в области термодинамики. Тепло – это передача тепловой энергии между системами, а работа – это передача механической энергии между двумя системами. Это различие между микроскопическим движением (теплом) и макроскопическим движением (работой) имеет решающее значение для того, как работают термодинамические процессы.Тепло можно преобразовать в работу и наоборот (см. Механический эквивалент тепла), но это не одно и то же. Первый закон термодинамики гласит, что тепло и работа вносят вклад в общую внутреннюю энергию системы, но второй закон термодинамики ограничивает количество тепла, которое может быть превращено в работу. Тепло и работа имеют свои собственные отличительные свойства, и они различаются по тому, как они влияют на систему. Они перечислены и сопоставлены ниже: [1] 17,2. Теплоемкость
17,3. Тепло трансформации
17,4. Работа
17.4.1. Адиабатические процессы
17.4.2. Процессы постоянного объема
17.4.3. Циклические процессы;
17.4.4. Бесплатное расширение
17.5. Передача тепла
17.5.1. Проводимость
17.5.2. Конвекция
17.5.3. Радиация
Комментарии, вопросы и / или предложения отправляйте по электронной почте на адрес wolfs @ pas.rochester.edu и / или
посетите домашнюю страницу Фрэнка
Волков. Тепло против работы – Энергетическое образование
Основные отличия
Работа (Вт) Heat (клавиша Q) Взаимодействие Механический Тепловой Требуется Сила и смещение Разница температур Процесс Макроскопические толкания и тяги Микроскопические столкновения Положительное значение W> 0, когда газ сжат.Энергия передается в систему. Q> 0, когда температура окружающей среды выше, чем температура системы. Энергия передается в систему. Отрицательное значение W <0 при расширении газа. Энергия передается из системы. Q <0, когда система находится при более высокой температуре, чем окружающая среда. Энергия передается из системы. Равновесие Система находится в механическом равновесии, когда на нее нет действующей силы или крутящего момента. Система находится в тепловом равновесии, если ее температура равна температуре окружающей среды. Для дальнейшего чтения
Список литературы
.





 Если система (тело) получает энергию, то ΔQ системы > 0, если отдает энергию, то ΔQ системы < 0
Если система (тело) получает энергию, то ΔQ системы > 0, если отдает энергию, то ΔQ системы < 0 При охлаждении – внутренняя энергия уменьшается за счет передачи тепла окружающей среде.
При охлаждении – внутренняя энергия уменьшается за счет передачи тепла окружающей среде.
