Внутренняя энергия и работа идеального газа
теория по физике 🧲 термодинамика
ОпределениеЧислом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM.·ikT2..=i2..·mM..RT=i2..νRT=i2..pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула | ΔU=32..·mM..RT=32..νRT=32..νR(T2−T1) |
| Изотермический процесс | ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение | ΔU=32..νR(T2−T1)=32..(pV2−pV1)=32..pΔV |
| Изохорное увеличение давления | ΔU=32..νR(T2−T1)=32..(p2V−p1V)=32..VΔp |
| Произвольный процесс | ΔU=32..νR(T2−T1)=32..(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?
Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.
Механическая работа вычисляется по формуле:
A=Fscos.α
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h3−h2
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mM..νRΔT
Внимание!  Если изменения нет, работы тоже нет.
Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение: A‘=p(V2−V1) A‘>0 | |
| Изобарное сжатие: A‘=p(V2−V1) A‘<0 | |
| Изохорное охлаждение: V=const A‘=0 | |
Изохорное охлаждение и изобарное сжатие: 1–2: .A‘=0 2–3:A‘=pΔV<0 | |
| Замкнутый цикл:
1–2: A‘>0 2–3:A‘=0 3–4:A‘<0 4–1:A‘=0 A‘=(p1−p3)(V2−V1) | |
| Произвольный процесс: A‘=p1+p22..(V2−V1) |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505Идеальный одноатомный газ переходит из состояния 1 в состояние 2 (см. диаграмму). Масса газа не меняется. Как изменяются при этом следующие три величины: давление газа, его объём и внутренняя энергия?
Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
- Определить по графику, как меняется давление.

- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17758Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
1. Записать исходные данные.
Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105Па.
• Конечное давление: p2
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32..νRT
Внутренняя энергия аргона до расширения и после него:
U1=32..νRT1
U2=32..νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
Следовательно:
T=constV..
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2..
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1..=p2V2T2..
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2..=p2T1p1T2..
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2..=p2T12p1T2..
Отсюда:
T2=T1√p2p1..
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32..νRT1√p2p1..
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32..νRT1−32..νRT1√p2p1..=32..νRT1(1−√p2p1..)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32..νRT1(1−√p2p1..)−A
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17966Идеальный газ переводят из состояния 1 в состояние 3 так, как показано на графике зависимости давления газа от объёма. Работа, совершённая при этом газом, равна
Работа, совершённая при этом газом, равна
Ответ:
а) р0V0
б) 2р0V0
в) 4р0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: бpазбирался: Алиса Никитина | обсудить разбор | оценить
Алиса Никитина | Просмотров: 11. 1k | Оценить:
1k | Оценить:
|
Навигация: Главная Случайная страница Обратная связь ТОП Интересно знать Избранные Топ: Динамика и детерминанты показателей газоанализа юных спортсменов в восстановительном периоде после лабораторных нагрузок до отказа… Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности… Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь… Интересное: Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются… Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей. Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным… Дисциплины: Автоматизация Антропология Археология Архитектура Аудит Биология Бухгалтерия Военная наука Генетика География Геология Демография Журналистика Зоология Иностранные языки Информатика Искусство История Кинематография Компьютеризация Кораблестроение Кулинария Культура Лексикология Лингвистика Литература Логика Маркетинг Математика Машиностроение Медицина Менеджмент Металлургия Метрология Механика Музыкология Науковедение Образование Охрана Труда Педагогика Политология Правоотношение Предпринимательство Приборостроение Программирование Производство Промышленность Психология Радиосвязь Религия Риторика Социология Спорт Стандартизация Статистика Строительство Теология Технологии Торговля Транспорт Фармакология Физика Физиология Философия Финансы Химия Хозяйство Черчение Экология Экономика Электроника Энергетика Юриспруденция |
⇐ ПредыдущаяСтр 11 из 30Следующая ⇒ Работа совершается, неважно, газом или еще кем (или чем), если что-то куда-то перемещено. Для сложения тучи чего-то маленького в то, что можно пощупать или увидеть, существует интеграл: . Геометрический смысл определенного интеграла – это площадь криволинейной трапеции (площадь под кривой). Если объем газа в цикле сначала растет (работа положительна), а потом уменьшается (работа отрицательна), то в итоге газ совершает работу, которая пропорциональна площади фигуры, ограниченной линиями цикла (см. рисунок) Здесь газ переходит сначала из состояния 1 в состояние 2, не совершая работы (изохорно), затем он переходит в сосотояние 3 изобарно, работа, которую он при этом совершает, равна площади голубого прямоугольника. Работа положительна, так как объем газа растет. Затем следует переход в точку 4, и снова работа газом не совершается. Из точки 4 газ возвращается в первоначальное состояние, работа, совершаемая им отрицательна (объем становится меньше, то есть газ сжимают внешние силы, работа которых как раз положительна). Немного обобщим и подведем итог: При изохорном процессе, так как объем не меняется, то работа равна нулю. При изобарном процессе давление постоянно, вытащим его за знак интеграла: . А при изотермическом процессе происходит как изменение давления, так и объема. Выразим давление через объем с помощью уравнения Клапейрона -Менделеева: : Подставим в наш интеграл; . ⇐ Предыдущая6789101112131415Следующая ⇒ Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ – конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой… Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства… Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим. Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого… |
11.2. Элементарная работа. Работа идеального газа при изопроцессах
Принято считать, что если система совершает работу против действия внешних сил, то эта работа положительная.
Если внешние силы совершают работу над системой, то работа отрицательная.
Рассмотрим идеальный газ, находящийся под поршнем в цилиндре (рис. 11.6). Газ расширяется, и поршень поднимается на бесконечно малую высоту . Силу, действующую со стороны газа на поршень, находим по формуле
,
где – давление газа на поршень;– площадь поршня. Бесконечно малую работу, совершаемую газом, можно найти по формуле
,
где – бесконечно малое изменение объёма газа. Окончательно
(11.6)
Рис. |
Элементарной работой газа называется величина
. (11.7)
Это выражение остается справедливым для элементарной работы произвольной физически однородной и изотропной термодинамической системы в равновесном процессе.
Работа A12 термодинамической системы в равновесном процессе перехода из начального состояния с объёмом V1 в конечное состояние с объёмом V2 (работа в конечном процессе) вычисляется интегрированием.
При конечном изменении объёма газа от доработа
. (11.8)
Изобразим процесс
перехода системы из начального состояния 1 в конечное состояние 2,
построив график зависимости P(V).
Элементарная работа
численно равна площади прямоугольника
с длинами сторон P и dV. Работа в конечном процессе, когда объём
изменяется от
до,
работа равна площади фигуры, ограниченной
отрезкомоси абсцисс, соответствующим этому
отрезку участком графика функцииP(V)
и проходящими через концы отрезка
параллельными оси ординат прямыми.
Работа в конечном процессе, когда объём
изменяется от
до,
работа равна площади фигуры, ограниченной
отрезкомоси абсцисс, соответствующим этому
отрезку участком графика функцииP(V)
и проходящими через концы отрезка
параллельными оси ординат прямыми.
Рис. 11.7 | Работа – это мера изменения внутренней энергии системы в процессе совершения работы. Работа является функцией процесса, но не является функцией состояния. |
Работа идеального газа при изопроцессах
Вычислим работу идеального газа при изопроцессах.
I. Рассмотрим изобарический процесс (рис. 11.8).
П
Рис. 11.8
ри изобарическом процессе. Если в результате этого процесса объём газа изменился отдо, то работа газа
; (11. 9)
9)
Построим график процесса в координатах . Работаграфически выражается площадью заштрихованного прямоугольника.
II. Рассмотрим изохорический процесс (рис. 11.9). При изохорическом процессе и изменение объёма газаdV = 0 равно нулю. Следовательно, согласно формулам (11.6) и (11.9) работа газа при изохорическом процессе равна нулю.
III. Рассмотрим изотермический процесс. При изотермическом процессе и внутренняя энергия газа
. (11.10)
Изменение внутренней энергии , т.к..
Если в результате этого процесса объём газа изменился от до, то работа газа равна:.
Но здесь . Найдём давлениеиз уравнения Менделеева – Клапейрона:
.
Тогда
, и
.
Итак, при изотермическом процессе:
. (11.11)
Строим график
процесса в координатах
.
Работа графически выражается заштрихованной площадью под изотермой.
11.3. Первое начало термодинамики
Рассмотрим газ в теплоизолированном цилиндре (теплоизолированную термодинамическую систему), рис. 11.11. Цилиндр разделен жесткой теплопроводящей перегородкой на два отсека C и D. Объём отсека С поддерживается постоянным, над этой частью газа не может быть совершена работа. Объём отсека D может меняться при помощи подвижного поршня. За счет теплопроводящей перегородки отсеки могут обмениваться внутренней энергией.
Если в результате совершения над системой C+D внешними силами работы , система перешла из произвольного состояния1 в произвольное состояние 2, то при этом изменилась внутренняя энергия системы. Тогда .
Тогда,
изменение внутренней энергии газа в
отсекеС произошло за счет теплообмена без
совершения работы и равно количеству
теплоты Q,
полученному газом через жёсткую
перегородку. Обозначим
изменение внутренней энергии газа в
отсекеD.
Тогда получим:
.
Это равенство является математическим
выражениемпервого
начала термодинамики. Оно подразумевает, что полученное
термодинамической системой количество
теплоты Q равно приращению её внутренней энергии
за вычетом работы над системой внешних
сил.
Обозначим
изменение внутренней энергии газа в
отсекеD.
Тогда получим:
.
Это равенство является математическим
выражениемпервого
начала термодинамики. Оно подразумевает, что полученное
термодинамической системой количество
теплоты Q равно приращению её внутренней энергии
за вычетом работы над системой внешних
сил.
Если переход системы из состояние 1 в состояние 2 является равновесным, то = –A, где А – работа системы против внешних сил. В таком случае
. (11.12)
Это выражение представляет собой интегральную форму записи первого начала термодинамики.
Равенство подразумевает, что полученное термодинамической системой в равновесном процессе количество теплоты Q идет на приращение его внутренней энергии и совершение работы над внешними телами.
Для бесконечно малого (элементарного) равновесного процесса уравнение принимает вид:
. (11.13)
(11.13)
Это выражение представляет собой дифференциальную форму записи первого начала термодинамики.
Первое начало термодинамики – это закон сохранения и превращения энергии. I начало термодинамики – частный случай всеобщего закона сохранения энергии: полная энергия замкнутой системы может изменяться только качественно, количественно оставаясь неизменной.
Таким образом, первое начало термодинамики является фундаментальным постулатом, утверждающим собой закон сохранения энергии. Оно устанавливает закон взаимопревращения теплоты, энергии и работы. За всю историю развития науки не обнаружено опытных фактов, которые противоречили бы этому постулату.
Дифференциальная форма записи закона подчеркивает важные свойства теплоты, энергии и работы. Обратим на это внимание.
Внутренняя энергия
термодинамической системы (или тела) –
это сумма всех видов энергии (энергии
теплового движения атомов или молекул,
потенциальная энергия их взаимодействия
и т. п.), заключающихся в данной системе,
за исключением энергии, которой система
обладает в результате взаимодействия
с другими телами. Внутреннюю энергию
можно изменить двумя способами.
п.), заключающихся в данной системе,
за исключением энергии, которой система
обладает в результате взаимодействия
с другими телами. Внутреннюю энергию
можно изменить двумя способами.
1. Газ находится под поршнем. Вдвигая поршень, совершаем работу. Газ сжимается и нагревается, его внутренняя энергия изменяется. Совершение работы – первый способ изменения внутренней энергии тела.
2. Но можно изменить внутреннюю энергию тела и другим способом, не совершая работы А, а только подводя к телу тепло. Газ находится под поршнем. Пусть поршень закреплён. При подведении тепла к газу, его внутренняя энергия меняется.
Подведение некоторого количества теплоты – второй способ изменения внутренней энергии тела. Но тогда теплота и работа должны быть эквивалентными формами передачи энергии.
Работа – способ
передачи энергии. В процессе работы
происходит переход энергии из одного
вида энергии в другой.
Теплота – тоже способ передачи энергии.
Внутренняя энергия является функцией состояния системы (или тела, если система состоит из одного тела). Это означает, чтооднозначно определяется термодинамическим состоянием тела, т.е. каждому состоянию тела соответствует одно значение.
Если тело в состоянии 1 имеет энергию , а в состоянии2 – энергию , то изменение энергиине зависит от того, каким путём совершается переход из одного состояния в другое. Следовательно, бесконечно малое изменениевнутренней энергии является полным дифференциалом (11.13).
Количества теплоты и работы зависят от пути перехода системы из начального в конечное состояние, они не являются функциями состояния системы, их бесконечно малые изменения ине являются полными дифференциалами, что подчёркивается в записи этих величин в формуле (11.13).
В
СИ количество теплоты, энергия и работа
измеряются в джоулях (Дж).
19.2: Работа давление-объем — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 13700
Работа в целом определяется как произведение силы F и элемента пути дс . Оба являются векторами, и работа вычисляется путем интегрирования их внутреннего продукта:
\[w = \int \textbf{F} \cdot \textbf{ds} \номер\]
Перемещение объекта против силы трения, как это сделано в приведенном выше эксперименте по диссипации, является лишь одним из примеров работы:
\[w_{трение} = \int \textbf{F}_{трение} \cdot \textbf{ds} \nonumber \]
Мы могли бы также подумать о электрических работах. В этом случае мы бы двигали заряд e (например, отрицательный заряд электрона) против электрического (векторного) поля \(\textbf{E}\). Работа будет:
В этом случае мы бы двигали заряд e (например, отрицательный заряд электрона) против электрического (векторного) поля \(\textbf{E}\). Работа будет:
\[w_{electical} = \int e \textbf{E} \cdot \textbf{ds} \nonumber \]
Другими примерами являются растяжение резиновой ленты против силы упругости или перемещение магнита в магнитном поле и т. д. и т. д.
В случае цилиндра с поршнем давление молекул газа внутри цилиндра, \(P\), и молекулы газа снаружи поршня, \(P_{ext}\) оба оказывают силу друг против друга. Давление (\P\) – это сила, \(F\), действующая на частицы на единицу площади, \(A\):
\[P=\frac{F}{A} \номер\]
Рисунок 19.2.1 : Поршень с внутренним давлением \(P\) и внешним давлением \(P_{ext}\). Можно предположить, что все силы, создаваемые давлением частиц, действуют параллельно направлению движения поршня. То есть сила перемещает поршень вверх или вниз, поскольку движение поршня ограничивается одним направлением. Поршень движется по мере того, как молекулы газа быстро уравновешиваются приложенным давлением, так что внутреннее и внешнее давления становятся одинаковыми. Результатом этого движения является работа:
Результатом этого движения является работа:
\[w_{volume} = \int \left( \dfrac{F}{A} \right) (A\,ds) = \int P\,dV \nonumber \]
Эта конкретная форма работы называется давление- объем (\(PV\)) работа и будет играть важную роль в развитии нашей теории. Однако обратите внимание, что объем работы составляет всего одной формы работы.
Условные обозначения знаков
На этом этапе важно создать условное обозначение: положительное тепло, положительная работа — это всегда энергия, которую вы вкладываете в систему. Если система решает удалить энергию, выделяя тепло или работу, это получает знак минус.
Другими словами: вы оплачиваете счет .
Чтобы соответствовать этому соглашению, нам нужно переписать объемную работу (уравнение \(\ref{Объемная работа}\)) как
\[w_{PV} = – \int \left( \dfrac{F}{A} \right) (A\,ds) = – \int P\,dV \nonumber \]
Следовательно, чтобы уменьшить объем газа (\(\Delta V\) отрицательно), мы должны совершить (положительную) работу.
Термодинамика не продвинулась бы очень далеко без цилиндров для хранения газов, в частности пара. На следующем рисунке показано, когда внешнее давление \(P_{ext}\) больше и меньше внутреннего давления \(P\) поршня. 9{V_{final}}dV = -P\Delta V \label{необратимая работа PV} \]
Для системы, которая совершает работу при постоянном внешнем давлении, мы можем показать количество работы, совершаемой с помощью \(PV\ ) схема.
Рисунок 19.2.3 : Система сжимается под постоянным внешним давлением, \(P_{ext}\), из состояния 1 в состояние 2. Заштрихованная область показывает объем работы, выполняемой для сжатия. Сплошная линия — изотерма, путь постоянной температуры.Уравнение \(\ref{необратимая работа PV}\) выполняется только в изобарических условиях. Если внешнее давление изменяется во время сжатия, мы должны 9{V_{final}}P_{ext}dV \номер\]
19.2: Работа «Давление-объем» распространяется по недекларированной лицензии и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- № на стр.
- Теги
Работа и тепло | Введение в химию
Цели обучения
- Определить тип работы с точки зрения давления и объема.
- Определить тепло .
- Свяжите количество тепла с изменением температуры.
Мы уже определили работу как силу, действующую на расстоянии.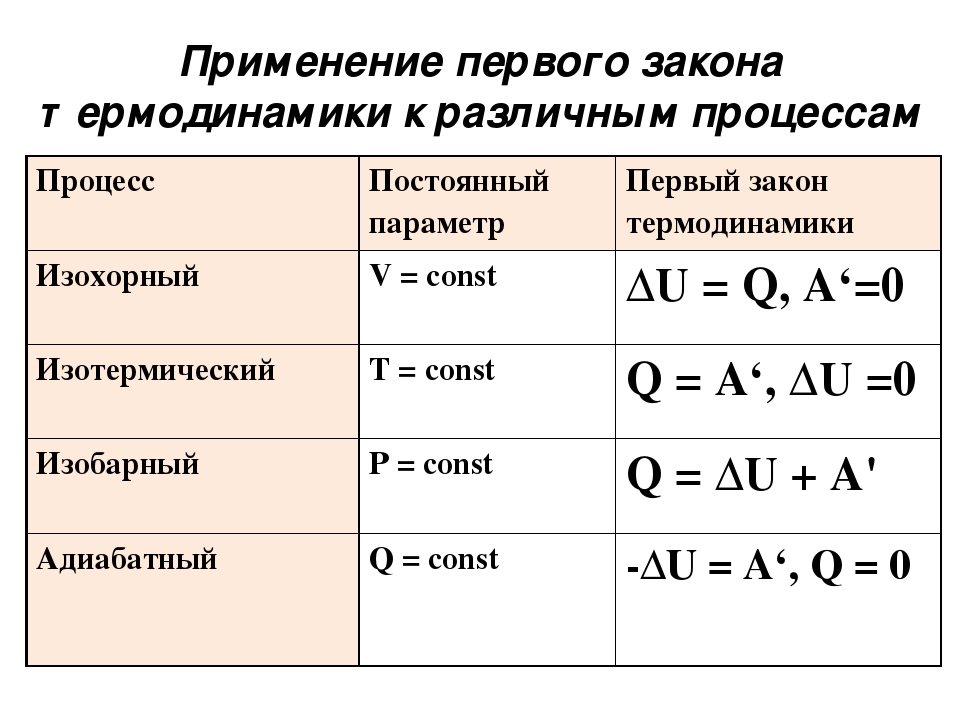 Оказывается, есть и другие эквивалентные определения работы, которые также важны в химии.
Оказывается, есть и другие эквивалентные определения работы, которые также важны в химии.
Когда определенный объем газа расширяется, он расширяется против внешнего давления (рис. 7.2 «Объем против давления»). То есть газ должен совершить работу. Предполагая, что внешнее давление P ext постоянно, количество работы, совершаемой газом, определяется уравнением
w = − P ext × Δ V
, где Δ V — изменение объема газа. Этот член всегда представляет собой конечный объем минус начальный объем,
Δ V = V конечный − V начальный
и может быть положительным или отрицательным, в зависимости от того, является ли больше (расширяется) или меньше (сжимается), чем V начальный . Отрицательный знак в уравнении для работы важен и означает, что по мере увеличения объема (Δ V положительное значение) газ в системе теряет энергии в виде работы. С другой стороны, если газ сжимается, Δ V отрицательно, а два отрицательных знака делают работу положительной, поэтому в систему добавляется энергия.
С другой стороны, если газ сжимается, Δ V отрицательно, а два отрицательных знака делают работу положительной, поэтому в систему добавляется энергия.
Рисунок 7.2 Объем в зависимости от давления
Когда газ расширяется против внешнего давления, он работает.
Наконец, давайте рассмотрим единицы измерения. Изменения объема обычно выражаются в таких единицах, как литры, а давление обычно выражается в атмосферах. Когда мы используем уравнение для определения работы, единицей измерения работы выступает литр·атмосфер, или л·атм. Это не очень распространенный агрегат для работы. Однако существует коэффициент преобразования между л·атм и общепринятой единицей работы, джоулями:
1 л·атм = 101,32 Дж
Используя этот коэффициент преобразования и предыдущее уравнение для работы, мы можем рассчитать работу, выполненную, когда газ расширяется или сжимается.
Пример 2
Какую работу совершает газ, если он расширяется с 3,44 л до 6,19 л при постоянном внешнем давлении 1,26 атм? Выразите окончательный ответ в джоулях.
Решение
Сначала нам нужно определить изменение объема, Δ V . Изменение всегда представляет собой конечное значение минус начальное значение:
Δ В = В окончательное − В начальное = 6,19 л − 3,44 л = 2,75 л
8 Теперь мы можем использовать определение
8
8 . работу, чтобы определить проделанную работу:
w = − P ext · Δ V = −(1,26 атм)(2,75 л) = −3,47 л·атм
Теперь построим коэффициент пересчета из соотношений между литр·атмосфера джоулей:
Мы ограничиваем окончательный ответ тремя значащими цифрами, если это необходимо.
Проверь себя
Какую работу совершает газ при расширении от 0,66 л до 1,33 л при внешнем давлении 0,775 атм?
Ответ
−53 Дж
Тепло — еще один аспект энергии. Тепло – это передача энергии от одного тела к другому из-за разницы температур. Например, когда мы прикасаемся к чему-то руками, мы интерпретируем этот объект как горячий или холодный в зависимости от того, как передается энергия: если энергия передается в ваши руки, объект кажется горячим. Если энергия передается от ваших рук к объекту, ваши руки кажутся холодными. Поскольку теплота является мерой передачи энергии, теплота также измеряется в джоулях.
Например, когда мы прикасаемся к чему-то руками, мы интерпретируем этот объект как горячий или холодный в зависимости от того, как передается энергия: если энергия передается в ваши руки, объект кажется горячим. Если энергия передается от ваших рук к объекту, ваши руки кажутся холодными. Поскольку теплота является мерой передачи энергии, теплота также измеряется в джоулях.
Для данного объекта количество тепла ( q ) пропорционально двум вещам: массе объекта ( m ) и изменению температуры (Δ T ), вызванному передачей энергии. Мы можем записать это математически как
q∝m × ΔT
, где ∝ означает «пропорционально». Чтобы сделать пропорциональность равенством, мы включаем константу пропорциональности. В этом случае константа пропорциональности обозначается как c и называется удельной теплоемкостью, или, более кратко, удельная теплоемкость :
q = mc Δ T
где масса, удельная теплоемкость и изменение температуры перемножаются. Удельная теплоемкость — это мера того, сколько энергии необходимо для изменения температуры вещества; чем больше удельная теплоемкость, тем больше энергии необходимо для изменения температуры. Единицами удельной теплоемкости являются Джг⋅°C или Джг⋅K, в зависимости от того, какова единица измерения Δ T . Вы можете заметить отход от требования выражать температуру в градусах Кельвина. Это потому что изменение температуры имеет одинаковое значение независимо от того, выражена ли температура в градусах Цельсия или кельвинах.
Удельная теплоемкость — это мера того, сколько энергии необходимо для изменения температуры вещества; чем больше удельная теплоемкость, тем больше энергии необходимо для изменения температуры. Единицами удельной теплоемкости являются Джг⋅°C или Джг⋅K, в зависимости от того, какова единица измерения Δ T . Вы можете заметить отход от требования выражать температуру в градусах Кельвина. Это потому что изменение температуры имеет одинаковое значение независимо от того, выражена ли температура в градусах Цельсия или кельвинах.
Пример 3
Рассчитайте теплоту, выделяемую при повышении температуры с 22°C до 76°C при добавлении 25,0 г Fe. Удельная теплоемкость Fe составляет 0,449 Дж/г·°С.
Решение
Сначала нам нужно определить Δ T . Изменение всегда представляет собой конечное значение минус начальное значение:
Δ T = 76°C − 22°C = 54°C
Теперь мы можем использовать выражение для q , подставьте все переменные и решите для теплоты:
Обратите внимание, что единицы g и °C сокращаются, оставляя J, единицу теплоты. Также обратите внимание, что это значение q по своей природе положительно, что означает, что энергия поступает в систему.
Также обратите внимание, что это значение q по своей природе положительно, что означает, что энергия поступает в систему.
Проверь себя
Рассчитайте теплоту, выделяемую при повышении температуры 76,5 г Ag с 17,8°C до 144,5°C. Удельная теплоемкость Ag составляет 0,233 Дж/г·°С.
Ответ
2 260 Дж
Как и в любом уравнении, когда вы знаете все переменные, кроме одной, в выражении для q , вы можете определить оставшуюся переменную с помощью алгебры.
Пример 4
Для повышения температуры 373 г Hg на 104°C требуется 5408 Дж тепла. Какова удельная теплоемкость ртути?
Решение
Мы можем начать с уравнения для q , но теперь даны другие значения, и нам нужно решить для удельной теплоемкости. Обратите внимание, что Δ T дается непосредственно как 104°C. Замена,
5,408 Дж = (373 г) с (104°С)
Разделим обе части уравнения на 373 г и 104°С:
Сложив числа и собрав все единицы, получим
Проверь себя
Золото имеет удельную теплоемкость 0,129 Дж/г·°C. Если для повышения температуры образца золота на 99,9 °С требуется 1377 Дж, то какова масса золота?
Если для повышения температуры образца золота на 99,9 °С требуется 1377 Дж, то какова масса золота?
Ответ
107 г
В таблице 7.1 «Удельная теплоемкость различных веществ» указана удельная теплоемкость некоторых веществ. Удельная теплоемкость является физическим свойством веществ, поэтому она является характеристикой вещества. Общая идея заключается в том, что чем ниже удельная теплоемкость, тем меньше энергии требуется для изменения температуры вещества на определенную величину.
Таблица 7.1 Удельная теплоемкость различных веществ
| Вещество | Удельная теплоемкость (Дж/г·°C) |
|---|---|
| вода | 4,184 |
| железо | 0,449 |
| золото | 0,129 |
| ртуть | 0,139 |
| алюминий | 0,900 |
| этиловый спирт | 2,419 |
| магний | 1,03 |
| гелий | 5. 171 171 |
| кислород | 0,918 |
Ключевые выводы
- Работу можно определить как изменение объема газа при постоянном внешнем давлении.
- Тепло – это передача энергии за счет разницы температур.
- Теплота может быть рассчитана по массе, изменению температуры и удельной теплоемкости.
Boyle’s Law Calculator
, созданный Wojciech SAS, кандидат доктора философии
, рассмотренные Bogna Szyk and Jack Bowater
Последний обновление: 20 февраля 2022
Законодательство- 113.
- Примеры закона Бойля
- Где применяется закон Бойля?
- Прочие термодинамические процессы
Калькулятор закона Бойля является отличным инструментом, когда вам нужно оценить параметры газа в изотермическом процессе. Вы найдете ответ на вопрос “Что такое закон Бойля?” в тексте, поэтому читайте дальше, чтобы узнать о формуле закона Бойля, увидеть несколько полезных примеров упражнений по закону Бойля и узнать, как распознать, когда процесс удовлетворяет закону Бойля на графике.
Определение закона Бойля
Закон Бойля (также известный как закон Бойля-Мариотта) говорит нам о соотношении между давлением газа и его объемом при постоянной температуре и массе газа . В нем говорится, что абсолютное давление обратно пропорционально объему .
Определение закона Бойля можно также сформулировать следующим образом: произведение давления и объема газа в замкнутой системе постоянно, пока не изменяется температура.
Закон Бойля описывает поведение идеального газа (газов, которые могут быть описаны уравнением идеального газа) во время изотермического процесса , что означает, что температура газа остается постоянной во время перехода, как и внутренняя энергия газ.
Формула закона Бойля
Уравнение закона Бойля можно записать следующим образом:
p₁ * V₁ = p₂ * V₂ ,
где p₁ и V соответственно начальное давление. Точно так же p₂ и V₂ — окончательные значения этих параметров газа.
В зависимости от того, какой параметр мы хотим оценить, формулу закона Бойля можно записать по-разному. Допустим, мы изменили объем газа в изотермических условиях и хотим найти результирующее давление. Тогда уравнение закона Бойля утверждает, что:
p₂ = p₁ * V₁ / V₂ или p₂ / p₁ = V₁ / V₂ .
Как мы видим, соотношение конечного и начального давления является обратным соотношением для объемов . Этот калькулятор закона Бойля работает в любом направлении, которое вам нравится. Просто введите любые три параметра, и четвертый будет рассчитан сразу! И если вы не знаете, как рассчитать это вручную, вы можете воспользоваться нашим калькулятором коэффициентов для получения более подробной информации.
Весь процесс можно визуализировать на графике закона Бойля. Чаще всего используется тип, в котором давление зависит от объема. Для этого процесса кривая представляет собой гиперболу. Переход может происходить в обоих направлениях, поэтому и сжатие, и расширение газа удовлетворяют закону Бойля.
Примеры закона Бойля
Закон Бойля можно использовать несколькими способами, поэтому давайте рассмотрим несколько примеров:
Представьте, что у нас есть эластичный контейнер с газом. Начальное давление равно 90 506 100 кПа 90 507 (или 90 506 10⁵ Па 90 507, если мы используем экспоненциальную запись), а объем сосуда равен 90 506 2 м³ 90 507 . Решаем сжать ящик до
1 м³, но общую температуру не меняем. Вопрос: «Как меняется давление газа?». Мы можем использовать формулу закона Бойля:p₂ = p₁ * V₁ / V₂ = 100 кПа * 2 м³ / 1 м³ = 200 кПа.После уменьшения объема вдвое внутреннее давление удваивается. Это является следствием того, что произведение давления на объем должно быть постоянным в течение этого процесса.
Следующий пример закона Бойля относится к газу под давлением
2,5 атм, занимая6 литровпространства. Затем его изотермически декомпрессируют до давления0,2 атм. Узнаем его окончательный объем. Мы должны переписать уравнение закона Бойля:
Узнаем его окончательный объем. Мы должны переписать уравнение закона Бойля:V₂ = p₁ * V₁ / p₂ = 2,5 атм * 6 л / 0,2 атм = 75 л.Вы всегда можете воспользоваться нашим калькулятором закона Бойля, чтобы проверить правильность своих оценок!
Где применяется закон Бойля?
Закон Бойля описывает все процессы, при которых температура остается постоянной. В термодинамике температура является мерой средней кинетической энергии, которой обладают атомы или молекулы. Другими словами, можно сказать, что средняя скорость частиц газа при этом переходе не меняется. Формула закона Бойля справедлива для широкого диапазона температур.
В расширенном режиме вы можете выбрать любую температуру, а мы рассчитаем количество молекул, содержащихся в газе. Вам нужно только убедиться, что вещество остается в газовой форме (например, не конденсируется и не кристаллизуется) при этой температуре.
Есть несколько областей, где применим закон Бойля:
Тепловая машина Карно - состоит из четырех термодинамических процессов, два из которых изотермические, удовлетворяющие закону Бойля.
 Эта модель может сказать нам, каков максимальный КПД тепловой машины.
Эта модель может сказать нам, каков максимальный КПД тепловой машины.Дыхание тоже можно описать законом Бойля. Всякий раз, когда вы делаете вдох, ваша диафрагма и межреберные мышцы увеличивают объем легких, что приводит к снижению давления газа. Когда воздух течет из области более высокого давления в область более низкого давления, воздух поступает в легкие и позволяет нам получать кислород из окружающей среды. При выдохе объем легких уменьшается, поэтому давление внутри выше, чем снаружи, поэтому воздух течет в обратном направлении.
Шприц - всякий раз, когда вам нужно сделать инъекцию, врач или медсестра сначала набирают жидкость из маленького флакона. Для этого они используют шприц. При вытягивании поршня доступный объем увеличивается, что приводит к снижению давления и, согласно формуле закона Бойля, вызывает всасывание жидкости.
Другие термодинамические процессы
Закон Бойля вместе с законом Шарля и законом Гей-Люссака относятся к числу фундаментальных законов, описывающих подавляющее большинство термодинамических процессов.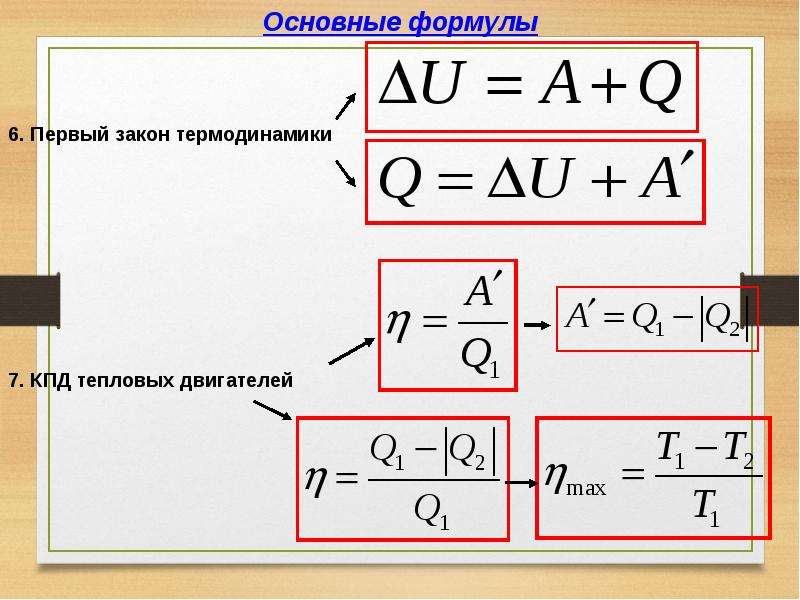



 ..
.. Газ может переместить что-либо, только если изменит объем. Без изменения объема работа совершена быть не может. То есть, если в каком-то процессе объем не менялся, то и работы никакой нет. Определим элементарную работу газа , то есть о-очень маленькую. Пусть газ давит на некоторую пластину и перемещает ее на маленькое-маленькое расстояние , тогда работа газа . То есть газ должен давить на пластину с силой . Эту силу определим как произведение давления газа на площадь пластины S: . Как известно, газ одинаково давит во все стороны. То есть давление газа направлено нормально к нашей пластинке (перпендикулярно), направление действия силы совпадает с перемещением, угол, соответственно, равен , а его косинус равен 1. Так как перемещение у нас совсем маленькое, то считаем, что давление газа не изменилось. Запишем тогда, что у нас получается для работы: . Если подумать, то произведение площади пластинки на малое перемещение ее – это ни что иное, как изменение объема сосуда. Тогда окончательно .
Газ может переместить что-либо, только если изменит объем. Без изменения объема работа совершена быть не может. То есть, если в каком-то процессе объем не менялся, то и работы никакой нет. Определим элементарную работу газа , то есть о-очень маленькую. Пусть газ давит на некоторую пластину и перемещает ее на маленькое-маленькое расстояние , тогда работа газа . То есть газ должен давить на пластину с силой . Эту силу определим как произведение давления газа на площадь пластины S: . Как известно, газ одинаково давит во все стороны. То есть давление газа направлено нормально к нашей пластинке (перпендикулярно), направление действия силы совпадает с перемещением, угол, соответственно, равен , а его косинус равен 1. Так как перемещение у нас совсем маленькое, то считаем, что давление газа не изменилось. Запишем тогда, что у нас получается для работы: . Если подумать, то произведение площади пластинки на малое перемещение ее – это ни что иное, как изменение объема сосуда. Тогда окончательно . Не забываем, что мы нашли только очень маленькую часть работы (элементарную работу), чтобы найти полную работу, надо сложить маленькие-маленькие работки в одну макроработу (такую ощутимую уже работу :).
Не забываем, что мы нашли только очень маленькую часть работы (элементарную работу), чтобы найти полную работу, надо сложить маленькие-маленькие работки в одну макроработу (такую ощутимую уже работу :). Отрицательная работа газа показана фиолетовым прямоугольником Таким образом, вся работа, совершенная в этом цикле – это площадь прямоугольника 1-2-3-4.
Отрицательная работа газа показана фиолетовым прямоугольником Таким образом, вся работа, совершенная в этом цикле – это площадь прямоугольника 1-2-3-4. ..
.. 11.6
11.6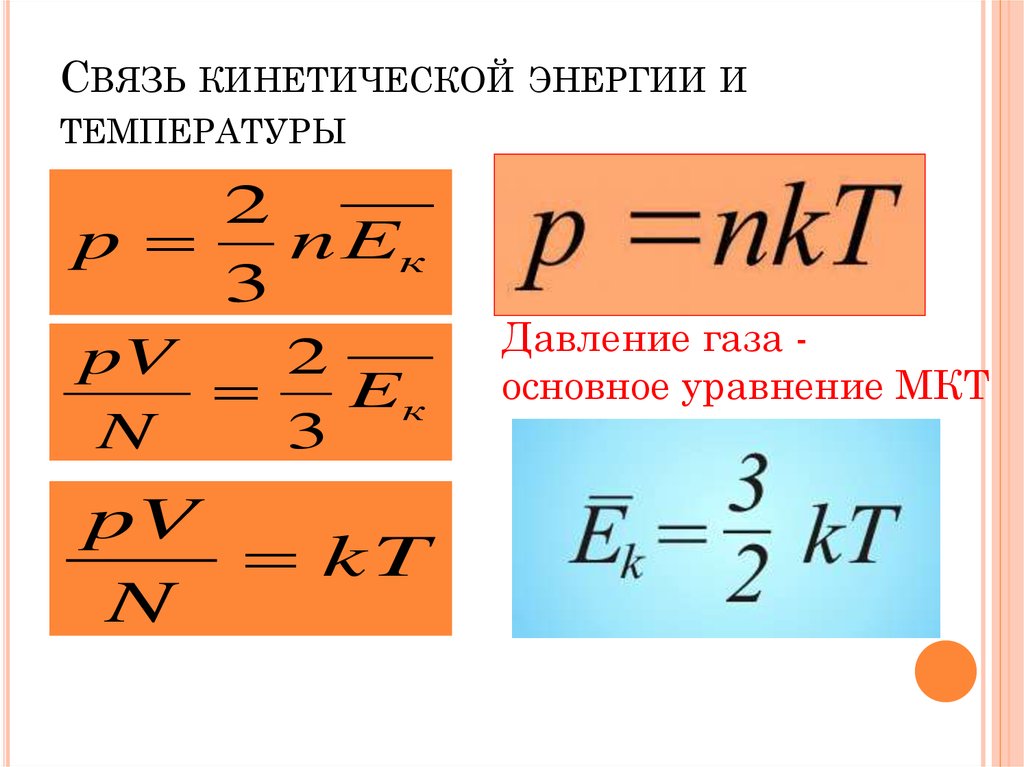 Узнаем его окончательный объем. Мы должны переписать уравнение закона Бойля:
Узнаем его окончательный объем. Мы должны переписать уравнение закона Бойля: Эта модель может сказать нам, каков максимальный КПД тепловой машины.
Эта модель может сказать нам, каков максимальный КПД тепловой машины.