Работа в термодинамике. | Объединение учителей Санкт-Петербурга
Основные ссылки
CSS adjustments for Marinelli theme
Объединение учителей Санкт-Петербурга
Форма поиска
Поиск
Вы здесь
Главная » Работа в термодинамике.
Работа в термодинамике. | |
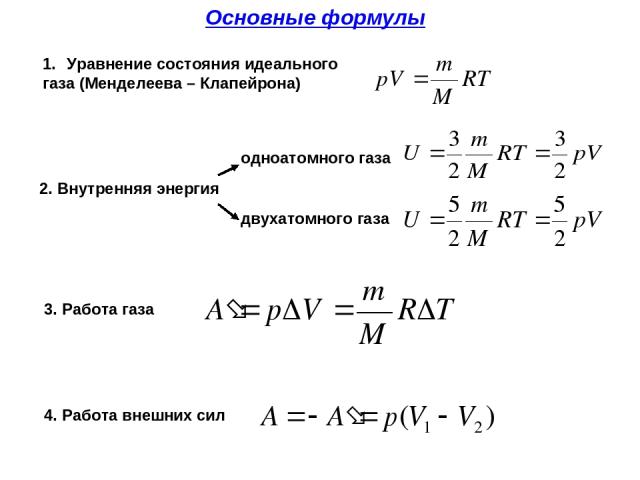
В термодинамике движение тела как целого не рассматривается и речь идет о перемещении частей макроскопического тела относительно друг друга. При совершении работы меняется объем тела, а его скорость остается раной нулю. Носкорости молекул тела меняются! Поэтому меняется температура тела. Причина в том, что при столкновении с движущимся поршнем (сжатие газа) кинетическая энергия молекул изменяется – поршень отдает часть своей механической энергии. При столкновении с удаляющимся поршнем (расширение) скорости молекул уменьшаются, газ охлаждается. | |
– сила, действующая на газ со стороны поршня. А – работа внешних сил по сжатию газа. – сила, действующая на поршень со стороны газа. А’ – работа газа по расширению. = – – по 3-ему з-ну Ньютона. Следовательно: А= – А’ = pS, где p– давление, S – площадь поршня. Если газ расширяется: Δh=h2 – h1 – перемещение поршня. V1=Sh1; V2=Sh2. | |
Тогда: A’=F’Δh=pS(h |
|
При расширении работа газа положительна. A= – pΔV – работа внешних сил. |
|
Используя уравнение Менделеева-Клапейрона, получим: |
|
Эти выражения справедливы при очень малых (!) изменениях объема или |
|
Физический смысл универсальной газовой постоянной. – универсальная газовая постоянная численно равна работе 1 моля идеального газа при изобарном нагревании на 1 К. |
|
Геометрическое истолкование работы. | |
В изобарном процессе площадь под графиком в координатах p,V численно равна работе (вспомните – перемещение на графике скорости!). | |
В общем случае надо процесс разбить на малые части и сосчитать элементарные работы, а затем их сложить (процесс интегрирования): Например, в изотермическом процессе . | |
В изохорном процессе объем не меняется, следовательно, в изохорном процессе работа не совершается! В адиабатном процессе . |
|
Теги:
конспект
Газовые циклы — что это, определение и ответ
При изменении объёма газ совершает работу.
При изобарическом процессе работа определяется как \(A = p\mathrm{\Delta}V\)
\(A\) — работа газа [Дж]
\(p\) — давление газа [Па]
\(\mathrm{\Delta}V\) — изменение объёма [м3]
Если газ расширяется, то работа газа положительна, A > 0.
Если газ сжимается, то работа газа отрицательна, A < 0.
Если не происходит изменения объема газа, то работа равна нулю, A = 0.
Работа, совершаемая над газом равна работе, совершаемой газом, но взятой с обратным знаком: \(A_{над\ газом} = – A_{газа}\)
Работа газа — площадь под кривой на pV-диаграмме.
Работа газа за цикл — площадь внутри замкнутой фигуры
Если цикл совершается по часовой стрелке, то работа газа за цикл положительна.
Если цикл совершается против часовой стрелки, то работа газа за цикл отрицательна.
Внутренняяэнергияодноатомногоидеальногогаза определяется формулой: \(\mathrm{\Delta}U = \frac{3}{2}\text{vR}(T_{2} – T_{1})\)
\(U\) — внутренняя энергия [Дж]
\(\nu\) — количество вещества газа [моль]
\(R\) — универсальная газовая постоянная, равная 8,31 [Дж/моль∙К]
\(T\) — температура газа в Кельвинах [К]
Если температура газа увеличивается, то изменение внутренней энергии газа положительно, ΔU > 0.
Если температура газа уменьшается, то изменение внутренней энергии газа отрицательно, ΔU < 0.
Если температура газа не изменяется, то изменение внутренней энергии газа равно нулю, ΔU = 0.
Первоеначалотермодинамики представляет собой закон сохранения энергии, в применении к тепловым явлениям. Оно гласит, что тепло, полученное газом, идет на изменение внутренней энергии и совершение работы:
\(Q = \mathrm{\Delta}U + A\)
\(Q\) — тепло, полученное газом [Дж]
\(\mathrm{\Delta}U\) — изменение внутренней энергии [Дж]
\(A\) — работа газа [Дж]
Адиабатический процесс — термодинамический процесс, при котором система не обменивается теплотой с окружающим пространством.
Адиабатическими могут считаться либо очень быстрые процессы, либо процессы в теплоизолированной среде.
В первом начале термодинамики при адиабатическом процессе необходимо положить Q = 0.
Коэффициент полезного действия (КПД) — отношение полезно использованной энергии газа, ко всей полученной энергии: \(\eta = \frac{A_{п}}{Q_{н}} \cdot 100\% = \frac{Q_{н} – Q_{х}}{Q_{н}} \cdot 100\%\)
\(\eta\) — коэффициент полезного действия, КПД [%]
\(Q_{н}\) — количество теплоты, полученное от нагревателя [Дж]
\(Q_{х}\ \)— количество теплоты, отданное холодильнику [Дж]
\(A_{п}\) — полезная работа газа, равная \(A_{п} = Q_{н} – Q_{х}\) [Дж]
Цикл Карно — максимально возможный КПД любой тепловой машины.
КПД цикла Карно определяется температурами нагревателя и холодильника:
\(\eta = \left( 1 – \frac{Т_{х}}{Т_{н}} \right) \cdot 100\%\)
\(\eta\) — коэффициент полезного действия, КПД [%]
\(Т_{н}\) — температура нагревателя [К]
\(Т_{х}\) — температура холодильника [К]
Калькулятор комбинированного газового закона
Автор Wojciech Sas, PhD
Рассмотрение Богной Шик и Стивеном Вудингом
Последнее обновление: 27 марта 2023 г.
- Что такое термодинамические процессы? Формула комбинированного газового закона
- Первый закон термодинамики
- Изохорный процесс
- Изобарический процесс
- Изотермический процесс
- Адиабатический процесс
- Пример расчета
- Цикл Карно 0009 FAQ
Этот калькулятор комбинированного газового закона является отличным инструментом для решения проблем, связанных с наиболее распространенными преобразованиями газов . Прочтите об изобарических, изохорных, изотермических и адиабатических процессах идеальных газов (газов, которые можно описать уравнением идеального газа) и о том, как идеальные газы могут совершать работу или выделять/поглощать тепло.
Проверьте точные значения для реальных газов, используя наш калькулятор уравнения Ван-дер-Ваальса, и забудьте о термодинамических упражнениях!
Что такое термодинамические процессы? Формула комбинированного газового закона
Мы можем описать идеальный газовый баллон несколькими параметрами: давлением p , объемом  Их можно соотнести уравнением: p·V = n·R·T , где R – постоянная идеального газа, равная 8,3144598 Дж/(моль·К) .
Их можно соотнести уравнением: p·V = n·R·T , где R – постоянная идеального газа, равная 8,3144598 Дж/(моль·К) .
Во время любого процесса по крайней мере два из этих свойств изменяются , которое мы можем скомпилировать в формулу комбинированного газового закона: p·V/T = k , где k — константа.
Из всех трансформаций можно выделить несколько, которые охватывают подавляющее большинство примеров из повседневной жизни, или мы можем рассматривать их как хорошие приближения.
В этом калькуляторе комбинированного газового закона мы рассматриваем процессы, в которых число частиц является постоянным . Таким образом, мы можем представить себе газ в закрытом контейнере. Это:
- Изохорический процесс;
- Изобарический процесс;
- Изотермический процесс; и
- Адиабатический процесс.
Первый закон термодинамики
Внутренняя энергия U представляет собой сумму всех видов энергии, присутствующих в системе. Довольно сложно оценить точное значение внутренней энергии. Тем не менее, можно найти
Довольно сложно оценить точное значение внутренней энергии. Тем не менее, можно найти
Изменение внутренней энергии пропорционально изменению температуры ΔT и типу газа по следующему уравнению: ΔU = Cv·n·ΔT , где Cv – молярная теплоемкость при постоянном объеме. Для идеального газа принимает значения:
- 3/2·R для одноатомного газа;
- 5/2·R для двухатомного газа; и
- 3·R для газов с более сложными молекулами.
Эти параметры в реальных газах отличаются от теоретических, но они уже есть в нашем калькуляторе термодинамических процессов.
Общая формула для работы, совершаемой газом, выражается как ∫p(V)dV , если мы рассматриваем давление как функцию объема . Хотя в целом это нетривиально, вы можете проверить, как формула упрощается для процессов, упомянутых ниже.
Изохорный процесс
При этом переходе объем является постоянным параметром , так что начальные свойства p₁ , T₁ изменяются на p₂ , T₂ , T₂ = p⁂ : ₂ .
Неизменность объема означает, что газ не совершает никакой работы и теплота, поглощаемая газом, в точности равна изменению внутренней энергии: ΔU = Q = Cv·n·ΔT . Мы можем визуализировать этот процесс для газа, хранящегося в жестком контейнере, который может обмениваться теплом с окружающей средой. Вы можете попробовать наш калькулятор закона Гей-Люссака, так как закон Гей-Люссака соответствует этому термодинамическому процессу.
Изобарический процесс
Мы предполагаем, что давление является постоянным параметром газа во время этого перехода. Следовательно, начальные параметры В₁ , Т₁ преобразуются в В₂ , Т₂ с помощью следующей формулы комбинированного газового закона: В₁ / T₁ = V₂ / T₂ .
Поскольку давление неизменно, формула работы, совершаемой газом, будет следующей: Вт = p·ΔV . Теплота, однако, может быть рассчитана как: Q = ΔU + W = Cv·n·ΔT + p·ΔV = Cp·n·ΔT .
Cp известна как молярная теплоемкость при постоянном давлении, а для идеального газа она связана с Cv , так что Cp = Cv + R . Проверьте калькулятор закона Чарльза Омни, так как закон Чарльза связан с изобарическим переходом.
Изотермический процесс
Постоянный параметр в этом переходе равен температуре , так что начальные свойства p₁ , V₁ изменяются на p₂ , V₂ , и соотношение: p₁·V₁ = p₂·V₂ . В представленном примере видно, что согласно уравнению идеального газа давление является следующей функцией объема: p(V) = n·R·T / V = A / V , где A постоянным на протяжении всего процесса.
В представленном примере видно, что согласно уравнению идеального газа давление является следующей функцией объема: p(V) = n·R·T / V = A / V , где A постоянным на протяжении всего процесса.
Общее выражение для работы, совершаемой газом, можно оценить как W = n·R·T·ln(V₂ / V₁) , где ln обозначает натуральный логарифм заданного числа. Из-за постоянства температуры начальная энергия не меняется , откуда следует равенство: Q = W . Можно сказать, что мы превращаем всю теплоту, поглощаемую газом, в совершаемую им работу, но, с другой стороны, этот переход, как известно, на практике очень медленный. Для более подробного объяснения обратитесь к нашему калькулятору закона Бойля, который описывает термодинамические процессы такого рода.
Адиабатический процесс
При этом переходе изменяются все три параметра, но одновременно газ не обменивается теплом с окружающей средой . Справедлива следующая формула: p₁V₁ γ = p₂·V₂ γ , где γ = Cp / Cv известно как отношение теплоемкости . Работа, совершаемая газом, противоположна его начальному изменению внутренней энергии Вт = -ΔU . Этот процесс описывает переходы, которые происходят быстро , и газ не успевает поглотить или отдать какое-либо тепло.
Справедлива следующая формула: p₁V₁ γ = p₂·V₂ γ , где γ = Cp / Cv известно как отношение теплоемкости . Работа, совершаемая газом, противоположна его начальному изменению внутренней энергии Вт = -ΔU . Этот процесс описывает переходы, которые происходят быстро , и газ не успевает поглотить или отдать какое-либо тепло.
Расчетный пример
Предположим, что вы хотите найти изменение внутренней энергии
Рассчитать конечный объем:
V₂ = V₁·T₂ / T₁
= 0,5 м³ · 300 K / 250 K
= 0,6 м³Определите количество молекул:
n = p·V₁ / (R·T₁)
= 101,325 кПа · 0,5 м³ / (8,314 Дж/(моль·K) · 250 K)
= 24,375 мольНайти теплоемкость Cv азота, которая равна 20,814 Дж/(моль·К) (для идеального двухатомного газа она должна быть равна

Оценка изменения внутренней энергии:
ΔU = 20,814 Дж/(моль·К) · 24,375 моль · 50 К
= 25,367 кДжОпределить работу, совершаемую газом:
Вт = 101,325 кПа · 0,1 м³
= 10,133 кДжОцените тепло, поглощенное азотом:
Q = 25,367 кДж + 10,133 кДж
= 35,500 кДж .
Вы всегда можете сэкономить свое время и воспользоваться нашим комбинированным газовым калькулятором!
Цикл Карно
Это один из циклов, представляющих модель идеального двигателя с максимально возможным КПД в соответствии с законами термодинамики.
Наш калькулятор эффективности Карно отлично подходит для этой темы! Он состоит из двух адиабатических и двух изотермических процессов. Этот двигатель поглощает тепло от горячего резервуара, преобразует его в работу, а остальное тепло отдает холодному.
С помощью этого калькулятора комбинированного газового закона вы можете разработать термодинамический цикл любого типа и узнать, как это изменение влияет на выходную эффективность!
Часто задаваемые вопросы
Как найти T₂ в комбинированном газовом законе?
Чтобы найти T
- Выясните, какой термодинамический процесс протекает, и используйте правильную формулу:
- Если это изохорный процесс (объем постоянный):
T 2 = (T 2 × p 2 ) / p 1 - Если это изобарический процесс (давление постоянно):
T 2 = (T 1 × V 2 ) / V 1
- Не забудьте использовать единицы СИ: кельвины для температуры, паскали для давления и кубические метры для объема.
Давление и температура прямо пропорциональны?
В комбинированном газовом законе давление и температура прямо пропорциональны, но только если объем постоянен (изохорический процесс). Понятно почему, если посмотреть на формулу:
Понятно почему, если посмотреть на формулу:
p×V=n×R×T
Когда объем постоянен, давление и температура являются единственными изменяющимися параметрами. А с повышением температуры будет повышаться и давление.
Каковы четыре термодинамических процесса?
Четыре термодинамических процесса:
- Изохорный процесс;
- Изобарический процесс;
- Изотермический процесс; и
- Адиабатический процесс.
Узнайте больше о них в нашем комбинированном газовом калькуляторе.
Что такое изобарический процесс?
В изобарическом процессе давление остается постоянным, а температура и объем изменяются. Тогда связь между начальным и конечным значениями температуры и объема описывается формулой:
V 1 / T 1 = V 2 / T 2
В изобарных процессах совершается работа. Его значение можно рассчитать, умножив постоянное давление на изменение объема.
Какова T₂ изохорного процесса, где T₁ = 300 K, p₁ = 100 кПа и p₂ = 125 кПа?
Конечная температура такого процесса составляет 375 K . В изохорных процессах объем постоянен, а давление и температура изменяются следующим образом: р 1 / Т 1 = р 2 / Т 2 .
Чтобы найти конечную температуру в вашем примере: T 2 = (T 1 × p 2 ) / p 1 = (300 × 125) / 100 = 375 K .
Wojciech Sas, PhD
Выберите процесс и тип газа
Процесс
Рабочий газ
Введите начальные параметры
Начальное давление (p₁)
Начальный объем (V₁) Начальная температура
3
30003
Полученные параметры
Окончательное давление (P₂)
Окончательный объем (V₂)
Окончательная температура (T₂)
Внутреннее изменение энергии (ΔU)
подобные калькуляторы термодинамики и теплоты 🌡️
Число БиоФактор БольцманаЗакон Бойля… Еще 39
Работа
РаботаРабота
| Определение работы | Тепло и работа | Сохранение энергии | Внутренняя энергия |
| Взаимное превращение тепла и работы | Функции состояния | Калориметр | |
Определение работы
Работа может быть определена как произведение силы, используемой для перемещения
объект, умноженный на расстояние, на которое перемещается объект.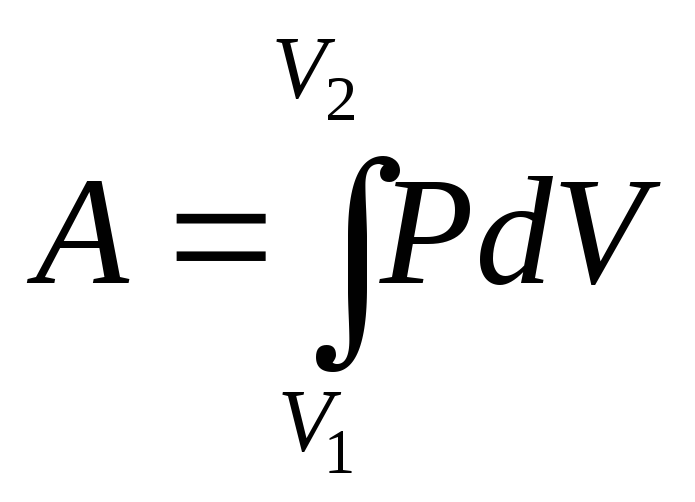
ш = F x г
Представьте себе систему, состоящую из образца аммиака, запертого в поршне и цилиндре, как показано на рисунке ниже. Предположим, что давление газа, давит на поршень просто уравновешивает вес поршня, так что объем газа остается постоянным. Сейчас считать, что газ разлагается с образованием азота и водорода, увеличивая количество газа частицы в контейнере. Если температура и давление газа остаются постоянными, это означает, что объем газа должен увеличиться.
2 NH 3 ( г ) N 2 ( г ) + 3 Н 2 ( г )
Объем газа можно увеличить, частично вытолкнув поршень из цилиндра.
Совершаемая работа равна произведению силы, действующей на поршень, на
расстояние, на которое перемещается поршень.
ш = F x г
Давление ( P ), которое газ оказывает на поршень, равно силе (F) с которой он давит на поршень, деленную на площадь поверхности ( A ) поршня. поршень.
Таким образом, сила, действующая на газ, равна произведению его давления на площадь поверхности поршня.
F = P x A
Подстановка этого выражения в уравнение, определяющее работу, дает следующее результат.
w = ( P x A ) x d
Произведение площади поршня на расстояние, на которое перемещается поршень, равно изменение объема системы при расширении газа. Условно, изменение объема представлено символом В .
В = А х д
Таким образом, величина работы, совершаемой при расширении газа, равна произведению
давление газа, умноженное на изменение объема газа.
| с | = П В
Джоуль — измерение теплоты и работы
По определению, один джоуль — это работа, совершаемая, когда сила в один ньютон используется для перемещения объект один метр.
1 Дж = 1 Н·м
Поскольку работа может быть преобразована в теплоту и наоборот, система СИ использует джоуль для измерять энергию в виде теплоты и работы.
Первый закон термодинамики: сохранение Энергия
первый закон термодинамики утверждает, что энергия не может быть создана или
уничтожен. Система может получать или терять энергию. Но любое изменение энергии системы
должно сопровождаться эквивалентным изменением энергии его окружения, потому что
полная энергия Вселенной постоянна. Первый закон термодинамики можно описать
следующим уравнением.
E унив = Е сис + E вкл = 0
(Индексы univ , sys и surr обозначают вселенную, системы и ее окружения.)
Внутренняя энергия
Энергию системы часто называют ее внутренней энергией , потому что она представляет собой сумму кинетической и потенциальной энергий частиц, образующих систему. Потому что отсутствие взаимодействия между частицами, единственный вклад во внутреннюю энергию идеального газа есть кинетическая энергия частиц. Внутренняя энергия идеального газа равна следовательно, прямо пропорциональна температуре газа.
(В этом уравнении R — постоянная идеального газа, а T — температура газа в единицах Кельвина.)
Хотя трудно, если вообще возможно, написать уравнение для более сложных
системы, внутренняя энергия системы по-прежнему прямо пропорциональна ее
температура. Поэтому мы можем использовать изменения температуры системы для мониторинга.
изменение его внутренней энергии.
Поэтому мы можем использовать изменения температуры системы для мониторинга.
изменение его внутренней энергии.
Величина изменения внутренней энергии системы определяется как разница между начальным и конечным значениями этой величины.
Е сис = E окончательный – E начальный
Поскольку внутренняя энергия системы пропорциональна ее температуре, E положительна при повышении температуры системы.
Первый закон термодинамики: взаимопревращение тепла и работы
Энергия может передаваться между системой и ее окружением до тех пор, пока энергия энергия, полученная одним из этих компонентов Вселенной, равна энергии, потерянной другой.
Е сис = – E сурр
Энергия может передаваться между системой и ее окружением в виде либо
тепло ( q ) или рабочий ( w ).
Е сис = ч + ш
Когда тепло поступает в систему, это может привести к повышению температуры системы или работа.
q = E сис – ш
Правила знаков для связи между внутренней энергией системы и задано теплоты , пересекающей границу между системой и ее окружением. на рисунке ниже.
- Когда тепло, поступающее в систему, увеличивает температуру системы, внутренний энергия системы возрастает, и E положительный.
- Когда температура системы снижается из-за выхода тепла из системы, E отрицательно.
Соглашение о знаках для отношения между работой и внутренней энергией система показана в левой части рисунка ниже.
- Когда система воздействует на окружающую среду, энергия теряется, и E отрицательно.

- Когда окружающая среда воздействует на систему, внутренняя энергия системы становится больше, поэтому E положительный.
Соотношение между величиной работы, совершаемой системой при ее расширении, и изменение объема системы ранее описывалось следующим уравнением.
| с | = П В
На приведенном выше рисунке показано, что можно включить соглашение о знаках для работы расширения. записав это уравнение следующим образом.
w = – P В
Функции состояния
Когда уравнения связывают два или более свойств, описывающих гос. системы, они называются уравнениями состояния . Например, закон идеального газа уравнение состояния.
PV = нРТ
Функция состояния s зависит только от состояния системы, а не от
путь, используемый для достижения этого состояния.
Температура является функцией состояния. Сколько бы раз мы ни нагревали, ни охлаждали, ни расширяли, сжать или иным образом изменить систему, чистое изменение температуры зависит только от на начальное и конечное состояния системы.
Т = T окончательный – T начальный
То же самое можно сказать об объеме, давлении и числе молей газа в образец. Все эти величины являются функциями состояния.
Теплота и работа являются , а не функциями состояния. Работа не может быть функцией государства, потому что она
пропорциональна расстоянию, на которое перемещается объект, которое зависит от пути, по которому он двигался
от начального до конечного состояния. Если работа не является функцией состояния, то теплота не может быть
государственная функция либо. Согласно первому закону термодинамики изменение
внутренняя энергия системы равна сумме переданной теплоты и работы
между системой и ее окружением.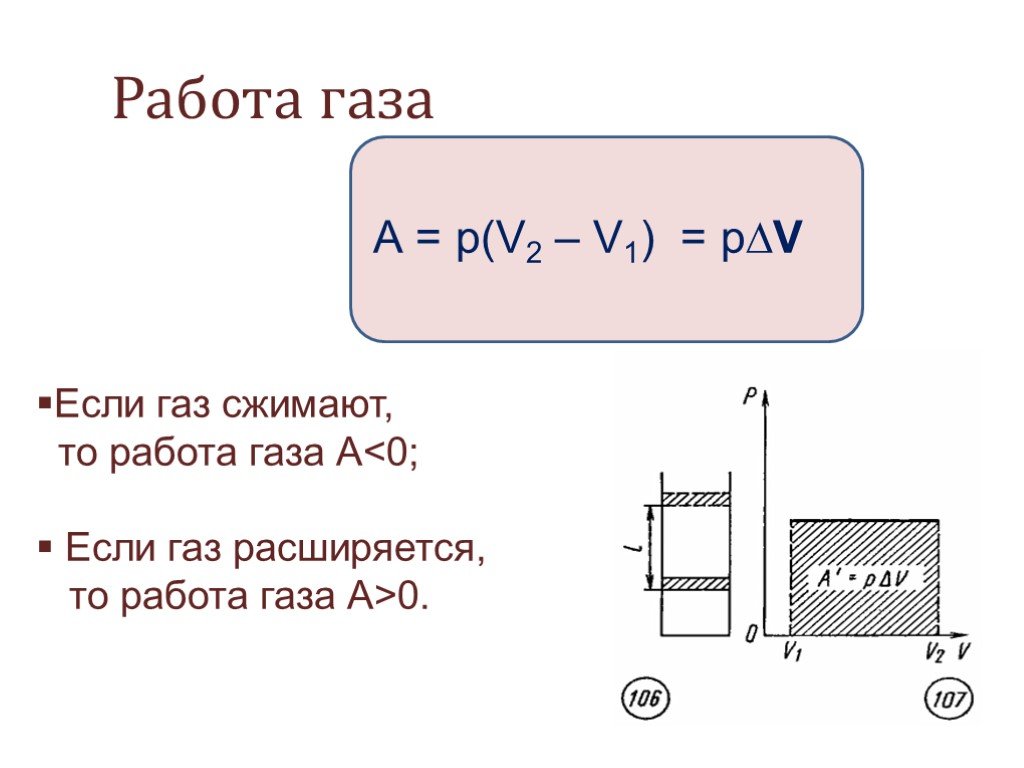
Е сис = ч + ш
Если Е зависит не от пути перехода от начального состояния к конечному, а от количества работы зависит от используемого пути, количество отдаваемой или поглощаемой теплоты должно зависеть на пути.
Термодинамические свойства системы, являющиеся функциями состояния обычно обозначаются заглавными буквами ( T , V , P , E и так далее на). Термодинамические свойства, не являющиеся функциями состояния, часто описываются формулой строчные буквы ( q и w ).
| Практическая задача 3: Что из следующего свойства газа являются функциями состояния? (а) Температура, T (б) Объем, В (с) Давление, P (d) Количество молей газа, n (e) Внутренняя энергия, E Нажмите здесь, чтобы проверить свой ответ на практическое задание 3 |
Измерение тепла с помощью калориметра
Количество теплоты, выделяемой или поглощаемой в ходе химической реакции, можно измерить с помощью
калориметр, как показано на рисунке ниже.
Поскольку реакция происходит в закрытом сосуде при постоянном объеме, никакая работа расширение происходит во время реакции. Теплота, выделяемая или поглощаемая в результате реакции, равна равно изменению внутренней энергии системы за время реакция:
Е сис = q V .
Количество теплоты, отдаваемое или поглощаемое водой в калориметре, может быть рассчитывается исходя из теплоемкости воды.
| Практическая задача 4: Природный газ в метан реагирует с кислородом с образованием углекислого газа и воды. CH 4 ( г ) + 2 O 2 ( г ) CO 2 ( г ) + 2 H 2 5 г Рассчитайте теплоту, выделяющуюся при взаимодействии 0,160 г метана с избытком кислорода в
бомбовый калориметр, если температура 1000 кг воды в ванне, окружающей
бомба увеличивается на 1,918 или С. |

 При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура.
При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура. При сжатии – отрицательна. Таким образом: A’ = pΔV – работа газа
При сжатии – отрицательна. Таким образом: A’ = pΔV – работа газа