Работа в термодинамике. | Объединение учителей Санкт-Петербурга
Основные ссылки
CSS adjustments for Marinelli theme
Объединение учителей Санкт-Петербурга
Форма поиска
Поиск
Вы здесь
Главная » Работа в термодинамике.
Работа в термодинамике. | |
В термодинамике движение тела как целого не рассматривается и речь идет о перемещении частей макроскопического тела относительно друг друга. При совершении работы меняется объем тела, а его скорость остается раной нулю. Носкорости молекул тела меняются! Поэтому меняется температура тела. Причина в том, что при столкновении с движущимся поршнем (сжатие газа) кинетическая энергия молекул изменяется – поршень отдает часть своей механической энергии. При столкновении с удаляющимся поршнем (расширение) скорости молекул уменьшаются, газ охлаждается. | |
– сила, действующая на газ со стороны поршня. А – работа внешних сил по сжатию газа. – сила, действующая на поршень со стороны газа. А’ – работа газа по расширению. = – – по 3-ему з-ну Ньютона. Следовательно: А= – А’ = pS, где p– давление, S – площадь поршня. Если газ расширяется: Δh=h2 – h1 – перемещение поршня. V1=Sh1; V2=Sh2. | |
Тогда: A’=F’Δh=pS(h |
|
При расширении работа газа положительна. A= – pΔV – работа внешних сил. |
|
Используя уравнение Менделеева-Клапейрона, получим: |
|
Эти выражения справедливы при очень малых (!) |
|
Физический смысл универсальной газовой постоянной. – универсальная газовая постоянная численно равна работе 1 моля идеального газа при изобарном нагревании на 1 К. |
|
Геометрическое истолкование работы. | |
В изобарном процессе площадь под графиком в координатах p,V численно равна работе (вспомните – перемещение на графике скорости!). | |
В общем случае надо процесс разбить на малые части и сосчитать элементарные работы, а затем их сложить (процесс интегрирования): Например, в изотермическом процессе . | |
В изохорном процессе объем не меняется, следовательно, в изохорном процессе работа не совершается! В адиабатном процессе . |
|
Теги:
конспект
2.13.Максимальная работа и свободная энергия
55 | Молекулярная физика |
Пример: Сразу можно отметить пользу, которую можно извлечь из этих уравнений. Часто, бывает легко найти свободную энергию F с точностью до слагаемого, зависящего только от температуры. Это можно сделать, вычислив изотермическую работу, совершаемую системой.
Действительно при изотермическом процессе dT = 0, а потому dF= -PdV =- A
F =−∫PdV +const (T )
Тогда формула (8) позволяет с той же неопределенностью найти и внутреннюю энергию системы.
U =F −T (∂∂TF )V
Максимальная работа
Рассмотрим какую-либо термодинамическую систему в произвольном, равновесном, либо неравновесном состоянии. Пусть она граничит со средой, температура Т0 которой поддерживается постоянной.
ТД система Т0 Q
Система может обмениваться теплом только с этой средой. С остальными телами теплообмена нет. Что касается работы, производимой системой, то в общем случае она слагается из двух частей: из работы над рассматриваемой средой и над всеми остальными телами. Эту общую работу, как обычно, будем обозначать буквой А.
Пусть система переходит из состояния 1 в состояние 2. В соответствии с первым началом термодинамики
А=U1—U2+Q. | (1) |
Работа А и количество сообщенного тепла Q зависят от вида процесса, переводящего систему из состояния 1 в состояние 2. Второе начало термодинамики позволяет указать верхний предел для работы. Согласно неравенству Клаузиуса
|
| 2 | δ Q | ||
S 2−S1 ≥∫1 |
| T 0 | |||
или ввиду предполагаемого постоянства температуры Т0 | |||||
S | −S | ≥ | Q |
| (2) |
|
| ||||
2 | 1 |
| T 0 | ||
Подставим сюда Q= А-(U1—U2) из (1) |
|
|
|
|
|
T 0 S 2−T 0 S1≥ A−(U1−U 2)
(U 1−T 0 S 1)−(U 2−T 0 S 2)≥ A
Обозначим Y =U −T 0 S и тогда
56 | Молекулярная физика |
A≤Y 1−Y 2 | (3) |
Знак равенства относится к обратимым процессам.
В частности, когда температура системы Т все время равна температуре окружающей
среды Т0,
Y=F=U-TS
функция Y переходит в свободную энергию системы.
|
|
| Amax≤F 1−F 2 | (4) | |||||||
Знак равенства относится к обратимым процессам. Таким образом, | |||||||||||
для обратимого процесса Т = Т0, |
|
|
|
|
|
|
|
|
| ||
Amax =F 1−F 2 (5) |
|
|
|
|
|
|
|
|
|
|
|
Если воспользоваться уравнением Гиббса — Гельмгольца | |||||||||||
U =F −T ( | ∂ F | )V | или |
| F =U +T ( | ∂ F | )V | ||||
|
| ||||||||||
∂T |
| ∂T | |||||||||
то выражение (5) легко преобразовать к виду |
|
|
|
|
| ||||||
А_ | ( | ∂T |
| )V |
|
|
|
|
|
| |
Amax=F 1−F 2=U 1−U 2 +T |
| ∂(F 1−F 2 ) |
|
|
|
|
|
|
|
| |
|
|
|
|
|
| ( | ∂T | )V | |||
|
|
|
|
|
|
| |||||
|
| Amax=U 1−U 2+T |
| ∂ Amax | (6) | ||||||
|
|
|
| ||||||||
Эта формула называется уравнением Гиббса — Гельмгольца для максимальной работы.
Из формулы (5) следует, что если система находится в тепловом контакте со средой, температура которой Т поддерживается постоянной, то только часть внутренней энергии, а именно U — TS, может быть использована для получения работы. В этом смысле она и является свободной.
Оставшаяся часть в работу превращена быть не может. Она называется связанной энергией.
Максимальная полезная работа
Наряду с полной работой A часто рассматривают так называемую полезную работу.
Понятие полезной работы вводится в тех случаях, когда рассматриваемая термодинамическая система помещена в среду, находящуюся в равновесии и поддерживаемую при постоянной температуре Т0 и постоянном давлении Р0.
Система производит работу не только против давления среды Р0, но и над другими телами. Работа над другими телами и называется
57 | Молекулярная физика |
полезной работой. |
|
Работа, производимая против давления | среды Р0, представляется выражением |
Р0 (V2-V1).
Эту часть нужно вычесть из полной работы А, чтобы получить полезную работу.
Апол=А-P0(V2-V1)
А=Апол+P0(V2-V1)
Воспользуемся формулой (3)
A≤Y 1−Y 2
Aпол +P0 (V 2−V 1)≤Y 1−Y 2
Aпол ≤(Y 1+ P0 V 1 )−(Y 2 +P0 V 2 )
Введем обозначение:
Z =Y +P0 V =U−T 0 S+P0 V
Если температура и давление среды равны температуре и давлению самой системы
T=T0 , P=P0 функция Z переходит в термодинамический потенциал
Z = Ф = U – TS+ PV.
Вэтом случае
Aпол≤Ф1−Ф2 (7)
Максимальная полезная работа получается при обратимом процессе и равна
Amaxпол =Ф1−Ф2 | (8) |
Для этой работы по аналогии с. формулой (6) получаем вторую формулу Гиббса — Гельмгольца
|
| ( | ∂ T | )V |
Amaxпол | =I 1−I 2+T |
| ∂ Amaxпол | (9) |
|
|
Когда термодинамическая система состоит только из твердых и жидких тел, изменением ее объема при всех процессах можно пренебречь.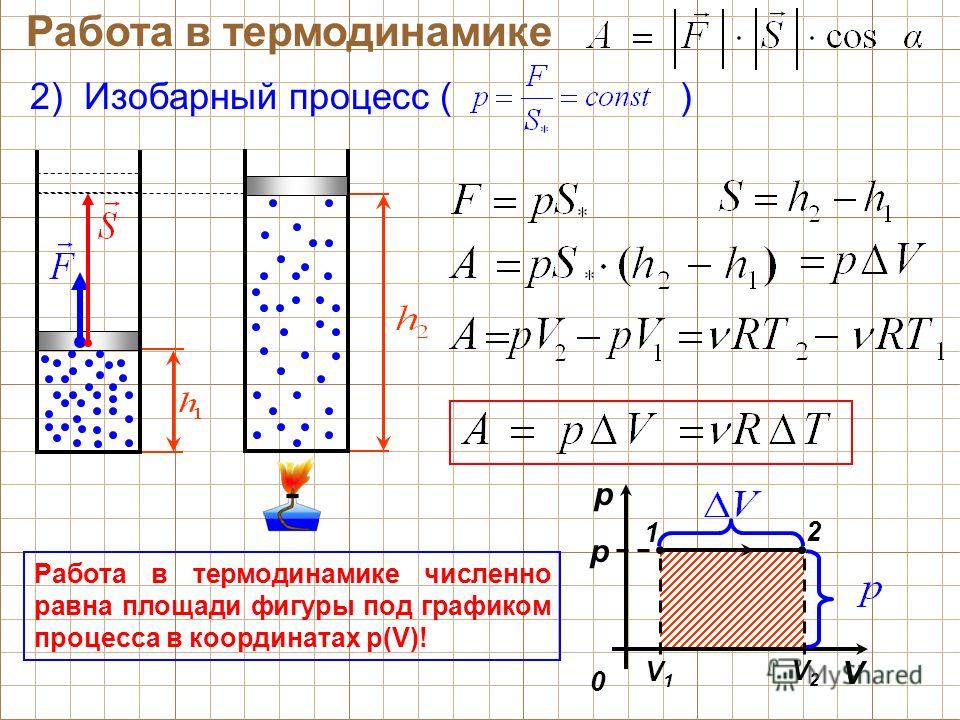 В этих случаях различие между полной и полезной работой пропадает. Для газообразных систем это различие может быть существенным.
В этих случаях различие между полной и полезной работой пропадает. Для газообразных систем это различие может быть существенным.
Работа, выполненная в термодинамике – W3schools
by
Химическая термодинамика: Работа
Энергия $(\Delta U)$ может пересекать границу системы в двух формах -> Работа (Вт) и Теплота (к). И работа, и тепло относятся к процессам, посредством которых энергия передается веществу или от него.
$\Delta U=W+q$
Работа, совершаемая системой, определяется как количество энергии, обмениваемой между системой и ее окружением. Он определяется внешними факторами, такими как внешняя сила, давление или объем, изменение температуры и т. д.
Работа (W) в механике – это перемещение (d) против силы сопротивления (F).
Работа выражена в единицах энергии (Джоуль, Дж)
Рис. 1: Основная формула работы
В термодинамике работа определяется соотношением давления и объема газообразного вещества. Энергия, затрачиваемая на преодоление внешней силы, называется работой. когда система работает против внешнего давления или расширения, ее внутренняя энергия уменьшается, и система сжимается. Когда на систему действует внешнее давление, система расширяется, и ее внутренняя энергия увеличивается.
Энергия, затрачиваемая на преодоление внешней силы, называется работой. когда система работает против внешнего давления или расширения, ее внутренняя энергия уменьшается, и система сжимается. Когда на систему действует внешнее давление, система расширяется, и ее внутренняя энергия увеличивается.
Работа, совершаемая системой, рассчитывается с учетом передачи энергии молекулами газа при движении поршня, когда положительное направление оси x соответствует расширению.
Чтобы вычислить, какую работу газ совершил при постоянном внешнем давлении, мы используем вариант предыдущего уравнения:
$W=-P_{ext}\times \Delta V$
внешнее давление (в отличие от давления газа в системе), а ∆V — изменение объема газа, которое можно вычислить по начальному и полному объему газа: 9{V2}{p(V)dV}$
Работа, выполненная системой, обозначается положительным знаком (+ve), а работа, выполняемая системой, обозначается отрицательным знаком (-ve). Точно так же работа совершается над системой, когда объем системы увеличивается, и работа совершается системой, когда ее объем уменьшается. Когда газ расширяется против внешнего давления, газ должен передать некоторую энергию окружающей среде. Отрицательная работа останавливает увеличение общей энергии газа. Когда газ сжимается, энергия передается газу, поэтому энергия газа увеличивается за счет положительной работы.
Когда газ расширяется против внешнего давления, газ должен передать некоторую энергию окружающей среде. Отрицательная работа останавливает увеличение общей энергии газа. Когда газ сжимается, энергия передается газу, поэтому энергия газа увеличивается за счет положительной работы.
Поскольку работа представляет собой энергию, она измеряется в джоулях. Вы также можете увидеть другие используемые единицы измерения, такие как атмосферы для давления и литры для объема, что приводит к $L\cdot atm$. Мы можем преобразовать $L\cdot atm$ в джоули, используя коэффициент преобразования $\frac{101,325 J}{1 L\cdot atm}$
Работа, совершаемая системой, равна площади, заключенной между кривой P-V и объемная ось. Это зависит от начальной и конечной стадий системы, а также от выбранного пути процесса.
Рисунок 3a: Диаграмма PV для системы, подвергающейся расширению при переменном давлении
3b: Диаграмма PV для системы, подвергающейся сжатию при переменном давлении
3c: Изобарический процесс: Диаграмма PV для системы, подвергающейся расширению при постоянном давлении. {s_{2}} {\bf F} \cdot d{\bf s}.$$
{s_{2}} {\bf F} \cdot d{\bf s}.$$
Это выражение позволяет величине силы изменяться на пути ее действия s по мере перехода процесса из состояния (1) в конечное состояние (2). Определение работы в средней школе физики «сила, умноженная на расстояние» должно быть расширено, чтобы включить формы работы, имеющие отношение к термодинамике. Термодинамическое определение работы : Работа совершается системой над окружающей средой, если результатом могло бы быть поднятие веса. Подумайте об этом с его точки зрения, если работать над сжатием пружины, я проделал работу с моим окружением. Энергия, запасенная теперь в пружине, может быть использована для поднятия веса, когда пружина разворачивается.
В этом курсе мы рассматриваем три режима передачи работы через границу системы, как показано на следующей диаграмме:
Рассмотрены три вида работ:
a) Граничные работы [латекс]W_b \подразумевается[/латекс] Поршень-цилиндр
b) Работа с валом [латекс]W_s \подразумевается[/латекс] Лопастное колесо
c) Электрические работы [латекс] W_e =[/latex]Вольт [латекс]\cdot I[/латекс] (Ампер) [латекс]\cdot[/латекс] время
В первую очередь нас интересует Граничные работы из-за сжатия или расширения системы в устройстве поршень-цилиндр, как показано выше.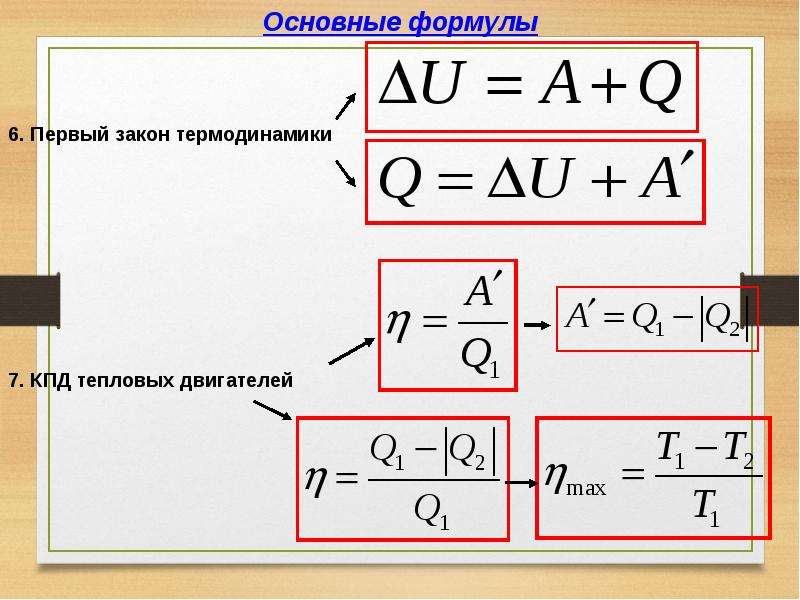 Во всех случаях предполагается идеальное уплотнение (отсутствие потока массы в систему и из системы), отсутствие потерь на трение и квазиравновесные процессы в том смысле, что при каждом пошаговом движении поршня сохраняются условия равновесия. По соглашению:
Во всех случаях предполагается идеальное уплотнение (отсутствие потока массы в систему и из системы), отсутствие потерь на трение и квазиравновесные процессы в том смысле, что при каждом пошаговом движении поршня сохраняются условия равновесия. По соглашению:
$$W>0: \quad \text{работа, выполненная системой}$$
$$W<0: \quad \text{работа над системой}$$ Это соглашение о знаках будет использоваться на протяжении всего курса.
Граничная работа оценивается путем интегрирования силы F , умноженной на инкрементальное расстояние, пройденное [латекс]dx[/латекс] между начальным состоянием (1) и конечным состоянием (2). Теперь, когда мы заставили нашу границу двигаться линейно, мы можем заменить [latex]d{\bf s}[/latex] на [latex]dx[/latex]. Обычно мы имеем дело с поршневым цилиндром, поэтому сила может быть заменена площадью поршня A, умноженной на давление P, что позволяет нам заменить [латекс]Adx[/латекс] изменением объема 92 P\:dV =[/latex] (площадь под кривой)
Обратите внимание, что выполненная работа является функцией пути , а не свойством, поэтому она зависит от пути процесса между начальным и конечным состояниями. Иногда эти пути упрощаются, когда одно свойство остается постоянным. Условия для этих специальных типов путей следующие:
Иногда эти пути упрощаются, когда одно свойство остается постоянным. Условия для этих специальных типов путей следующие:
- Изотермический (процесс с постоянной температурой)
- Изохорный или Изометрический (процесс постоянного объема) 93}{кг}\справа][/латекс].
W — выполненная работа [кДж], w — удельная выполненная работа [латекс]\влево[\фрак{кДж}{кг}\вправо][/латекс].
Для изобарического процесса или при постоянном давлении приведенный выше интеграл для граничной работы упрощается до
.$$W_{1-2}=p\влево (V_{2}-V_{1} \вправо).$$
Опять же, согласно установленному выше соглашению, работа, совершаемая системой над окружением (процесс расширения), положительна, а работа, совершаемая над системой окружением (процесс сжатия), отрицательна. Работа на валу (из-за гребного колеса) также соответствует этому соглашению, но нет такого выражения, как для граничной работы, которое можно было бы использовать для количественной оценки работы на валу.

Инженерный анализ часто требует использования временных показателей подачи энергии. Мощность ([латекс]\точка{Вт}[/латекс]) — это термин, используемый для описания скорости передачи энергии во время работы. Мощность может быть выражена как скалярное произведение векторов силы и скорости,
$$\dot{W}={\bf F}\cdot {\bf V}.$$
Это уравнение хорошо работает для поршня с линейным перемещением или автомобиля, преодолевающего сопротивление воздуха с постоянной скоростью. Однако во многих случаях в этом курсе мощность, передаваемая валом, будет количеством, поступающим в насос, или мощностью турбины. Если мы знаем крутящий момент на валу [латекс]\тау[/латекс] и скорость его вращения [латекс]\омега[/латекс],
$$\dot{W}=\тау \омега.$$
Но это редко случается в высокоуровневом термодинамическом анализе. Таким образом, мы не будем определять его напрямую, а будем использовать энергетический баланс (приходящий в более позднем узле) для расчета мощности.


 При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура.
При совершении работы в термодинамике меняется состояние макроскопических тел: их объем и температура. При сжатии – отрицательна. Таким образом: A’ = pΔV – работа газа
При сжатии – отрицательна. Таким образом: A’ = pΔV – работа газа

