Тепловой эффект химической реакции — что это?
Определение теплового эффекта химической реакции
В процессе химической реакции связи в исходных веществах разрываются и образуются новые связи, благодаря чему образуются новые вещества — продукты реакции. Разрыв связи протекает с поглощением энергии, а образование — с выделением, то есть химические реакции сопровождаются энергетическими эффектами.
Как правило, энергия выделяется или поглощается в виде теплоты, поэтому мы говорим, что протекание химической реакции сопровождается тепловым эффектом.
Тепловой эффект химической реакции — это количество теплоты, которое поглощается или выделяется в результате протекания химической реакции.
Если исходные вещества были менее устойчивыми (поглощается небольшое количество энергии), а образуются устойчивые (выделяется большое количество энергии), то в результате химической реакции выделяется тепловой эффект.
И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты.
Рассмотрим эти процессы на рисунке:
В зависимости от того, выделяется или поглощается теплота, различают два типа химических реакций: экзотермические и эндотермические.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Экзотермические реакции
Экзотермические реакции протекают с выделением теплоты.
Запоминаем
Q — обозначение теплового эффекта химической реакции.
Единица измерения — килоджоули (кДж) или джоули (Дж).
1 кДж = 1 000 Дж.
В экзотермических реакциях количество выделившейся теплоты указывают со знаком «+».
Например, при сгорании угля:
C(тв) + O2 (г) = CO2 (г) + Q.
Чтобы запустить эту и некоторые другие реакции, нужна инициация, или, проще говоря, пинок. В случае с реакцией горения угля это нагрев (поджигание).
К экзотермическим реакциям относятся реакции горения и реакции соединения.
Реакции горения
Пример — реакция горения метана в атмосфере кислорода:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
Реакции соединения
Пример — образование воды из двух простых веществ, при этом выделяется 484 кДж:
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж.
Исключение
При образовании оксида азота (II) и йодоводорода реакции протекают с поглощением теплоты:
N2 (г) + O2 (г) = 2NO (г) − 180 кДж.
Эндотермические реакции
Эндотермические реакции протекают с поглощением теплоты. Количество поглощенной теплоты указывают со знаком «−».
К эндотермическим реакциям чаще всего относят реакции разложения.
Например, реакции разложения нитрата калия и карбоната кальция:
2KNO3(тв) → 2KNO2(тв) + O2 (г) – Q;
CaCO3(тв) = CaO(тв) + CO2 (г) − 170 кДж.
Термохимические уравнения
Уравнения реакций, в которых указано количество выделившейся теплоты, называют термохимическими.
Важно
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
Рассмотрим термохимическое уравнение сгорания газа метана:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
Глядя на уравнение, можно сделать вывод, что при сгорании 1 моля газообразного метана в 2 молях газообразного кислорода выделяется 802 кДж теплоты сгорания.
Теплота сгорания — это количество теплоты, выделяющееся при горении 1 моля вещества.
Если в реакцию вступит в 5 раз больше метана, чем в представленном термохимическом уравнении, то есть не 1 моль метана, а 5, то тепловой эффект будет пропорционально больше, то есть не 802 кДж, а 802 ⨯ 5 = 4 010 кДж.
Практика
Рассмотрим несколько термохимических расчетов для типовых заданий.
Задача 1
Рассчитайте количество теплоты, выделившейся в результате реакции образования метана, термохимическое уравнение которой —
C(тв) + 2H2 (г) = CH4 (г) + 76 кДж,
из: а) 0,3 моля углерода; б) 2,4 г углерода; в) 2,24 л водорода.
Решение.
Важно помнить, что количество теплоты, которая выделяется в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
а) Из термохимического уравнения видно, что при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,3 моля С выделяется
Составим уравнение и решим его:
1 моль × х = 76 кДж × 0,3 моля;
.
б) Для начала найдем количество вещества прореагировавшего углерода. Для этого разделим его массу m на молярную массу M:
.
Молярная масса углерода равна 12 г/моль (значение из таблицы Менделеева).
Тогда .
В соответствии с термохимическим уравнением при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,2 моля выделяется х кДж.
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,2 моля;
.
в) Для начала найдем количество вещества вступившего в реакцию водорода. Для этого разделим его объем V на молярный объем Vm:
.
Молярный объем любого вещества равен 22,4 л/моль.
Тогда .
В соответствии с термохимическим уравнением при взаимодействии 2 молей H выделяется 76 кДж, тогда при взаимодействии 0,1 моля выделяется
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,1 моля;
.
Задача 2
В результате реакции, термохимическое уравнение которой —
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж,
выделилось 1 360 кДж.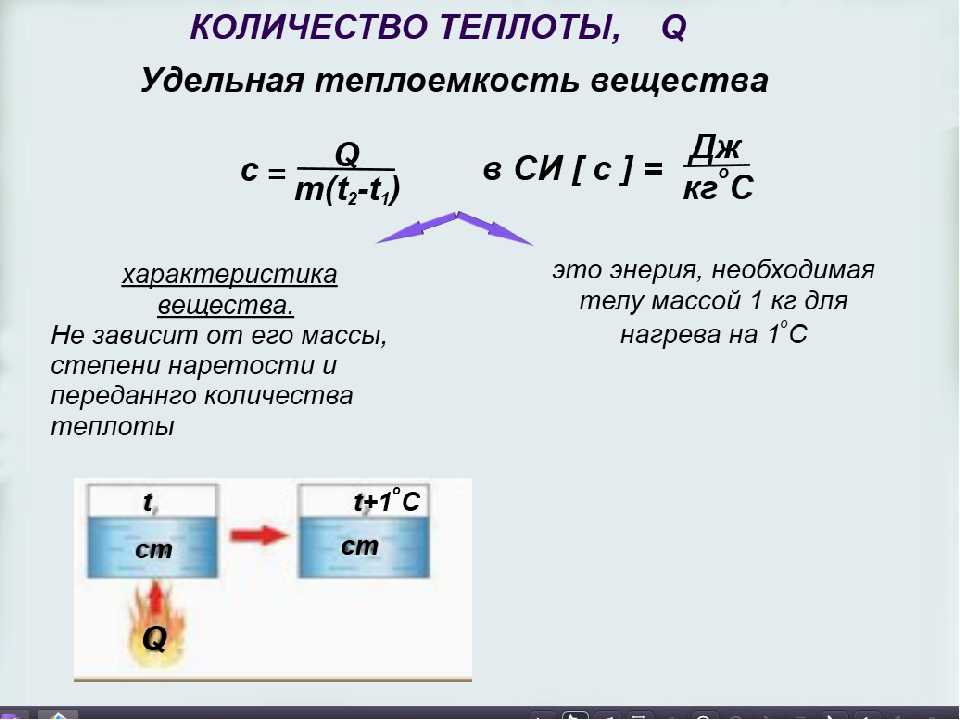 Вычислите: а) объем (н. у.) вступившего в реакцию кислорода; б) массу образовавшейся воды.
Вычислите: а) объем (н. у.) вступившего в реакцию кислорода; б) массу образовавшейся воды.
а) В соответствии с термохимическим уравнением при взаимодействии 1 моля кислорода выделяется 484 кДж, тогда при взаимодействии х молей кислорода выделяется 1 360 кДж.
Этой пропорции соответствует уравнение:
1 моль × 1 360 кДж = 484 кДж × х молей;
.
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
V = n(H) × Vm, где Vm — молярный объем;
V(H) = 2,81 моля × 22,4 л/моль = 62,95 л.
б) В соответствии с термохимическим уравнением при взаимодействии
2 молей воды выделяется 484 кДж, тогда при взаимодействии
Этой пропорции соответствует уравнение:
2 моля × 1 360 кДж = 484 кДж × х молей;
.
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
m(H2O) = n(H2O) × M(H2O), где M — молярная масса;
M(H2O) = 1 × 2 + 16 × 1 = 18 г/моль;
m(H2O) = 5,62 моля × 18 г/моль = 101,16 г.
Еще больше задач, да еще и в интерактивном формате — на онлайн-курсах по химии в школе Skysmart.
Вопросы для самопроверки
Что такое тепловой эффект?
На какие типы делятся реакции по тепловому эффекту?
Приведите примеры реакций, которые протекают с выделением теплоты.
Какие уравнения называют термохимическими?
Рассчитайте количество теплоты, которая выделится при сгорании 0,7 моля метана.

CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
2.7. Теплота реакции. Закон Гесса
2.7. Теплота реакции. Закон Гесса2.7. Теплота реакции. Закон Гесса
Разрыв и образование химических связей в ходе реакции сопровождается изменением энергии системы. Разница в энергиях связей в продуктах реакции и исходных веществах составляет энергию химической реакции, в том числе ее теплоту.

Тепловой эффект обозначается символами Q или ΔH (Q = -ΔH). Реакции, идущие с выделением теплоты (Q > 0; ΔH относятся к экзотермическим, а с ее поглощением (Q 0) – к эндотермическим. Уравнение реакции с указанием ее теплового эффекта называется термохимическим. Например:
Если теплоту реакции отнести к 1 моль определенного вещества, то в термохимическом уравнении некоторые стехиометрические коэффициенты могут быть дробными. Например:
В основе термохимических расчетов лежит закон постоянства количества теплоты, открытый русским химиком Г. И. Гессом в 1840 г.
И. Гессом в 1840 г.
Этот закон является следствием всеобщего закона сохранения энергии. Согласно закону Гесса, теплота химической реакции равна разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ:
Величину Qобр. = -ΔHoобр. называют стандартной молярной теплотой (энтальпией) образования вещества.
Стандартные теплоты образования простых веществ в наиболее устойчивой модификации (О2, Н2, Сграфит и т.п.) приняты равными нулю.
Закон Гесса позволяет рассчитать тепловые эффекты любых промежуточных (в том числе, гипотетических) стадий на пути превращения реагента в продукт реакции.
Формула теплоты реакции – GeeksforGeeks
Теплота реакции , также известная как Энтальпия реакции , представляет собой разницу в значении энтальпии химической реакции при постоянном давлении. Это термодинамическая единица измерения, используемая для определения общего количества энергии, произведенной или высвобожденной на моль в реакции. В результате теплота химической реакции может быть определена как теплота, выделяемая в окружающую среду или поглощаемая при протекании реакции при постоянном давлении и температуре. Джоуль (Дж) — это единица, используемая для измерения общего количества полученного или выделенного тепла.
В химических реакциях тепло в основном передается между реагирующей системой как одной средой и окружающей средой как другой. До и после химического превращения количество тепловой энергии одинаково. Другими словами, теплота, полученная или потерянная в реагирующей системе, эквивалентна теплоте, полученной или потерянной в окружающей среде.
Проще говоря, теплота реакции – это количество энергии, необходимое для проведения указанной реакции; он отрицателен для экзотермических реакций и положителен для эндотермических реакций. Здесь для эндотермической реакции ∆H положителен, тогда как ∆H отрицателен для тех реакций, которые выделяют тепло.
Когда данная реакция проводится при постоянном объеме, тепло, необходимое для воздействия на реакцию, представляет собой не что иное, как увеличение внутренней энергии (∆U) за счет ∆H/∆U, которое будет отрицательным для эндотермической реакции и положительным для экзотермической реакции .
Формула для теплоты реакцииQ = m × c × ΔT
Где,
- Q = теплота реакции,
- m9 = 0029,
- m9 = 00 масса среды реакционная среда,
- ∆T = разница температур среды.
Кроме того, у нас есть еще одно уравнение: Формула реакции
Пример 1: Рассчитайте теплоотдачу, которая происходит при сгорании этанола при сжигании определенного количества вещества в воздухе для повышения температуры с 28 до 42 градусов Цельсия 200 г воды, при условии, что вода имеет удельную теплоемкость 4,2 Дж/г.
К.
Решение:
Указано, что
C = 4,2 JG -1 K -1 ,
M = 2007
ΔT = 42 -28,
I.E. = 14 °C или 14 K
Здесь в вопросе упоминается, что определенное количество этанола сжигается для повышения температуры воды, подразумевая, что тепло, поглощаемое водой, выделяется в процессе сгорания этанола. Количество теплоты, потерянное в процессе горения, равно количеству теплоты, полученному водой.
Количество теплоты, которое было изменено, можно определить по формуле 2: Когда хлорид натрия растворяют в 100 г воды при 25°C, полученный раствор имеет температуру 21°C после надлежащего перемешивания. Если принять удельную теплоемкость раствора равной 4,18 Дж/г°С, рассчитайте изменение теплоты в процессе растворения.
Решение:
Здесь дано, что
C = 4,18 J / G ° C,
M = 100 г,
ΔT = 25 – 21,
, то есть ΔT = 4 K
Процесс приводит к падению температуры, что указывает на то, что растворение соли имеет тенденцию к поглощению тепла из системы.
Так как тепло, потерянное водой, такое же, как тепло, поглощенное солью,
Мы имеем,
Q = m × c × ΔT
Q = 100 × 4,18 × 4
Следовательно, Q = 1672 Дж
Пример 3: Когда 240 граммов железа охлаждаются с 90 °C до 25 °C, какое количество тепла выделяется? (Дано: с = 0,452 Дж/г °С).
Решение:
Имеем,
m = 240 г,
Удельная теплоемкость железа (c) = 0,452 Дж/г°C,
ΔT = 2 Начальная температура – 5 90 = -65 °C
У нас есть формула,
Q = m × c × ΔT
Подставляя данные значения в приведенное выше уравнение, мы получаем,
Q = 240 × 0,452 × (-65)
отсюда Q = -7051,2 Дж
т.е. Q = -7,05 кДж
Следовательно, 7,05 кДж при протекании процесса выделяется тепло.
Пример 4. При наличии 650 кДж энергии, сколько углерода можно нагреть с 20 градусов C до 100 °C? (Дано: c = 4,184 Дж/г °C)
Решение:
Здесь мы получаем,
c = 4,184 Дж/г °C,
q = 650 KJ0 J0 = 6500007
ΔT = 100 – 20 = 80 градусов Цельсия
Нас попросили найти массу (m), поэтому у нас есть формула,
Q = m × c × ΔT
приведенное выше уравнение даст нам,
m = Q / (c × ΔT)
, подставив данные значения в приведенное выше уравнение, мы получим фактическую массу необходимого углерода,
m = 650000 / (4,184 × 80)
m = 1941,9 г
т.
е. m = 194 кг
Пример 5: Какова удельная теплоемкость 60 граммов вещества, которое нагревается от 30°C до 40°C при 968 Дж энергии добавилось?
Решение:
. В вопросе дается, что
M = 60 г
ΔT = 40 – 30 = 10 градусов Цельсия
Q = 968 Joules
Мы должны найти специфическое тепло. емкость ( c ), поэтому у нас есть формула
Q = m × c × ΔT
, приведенное выше уравнение даст нам
c = Q / (m × ΔT)
, подставив заданные значения в приведенное выше уравнение, мы получится,
с = 968 / (50 × 10)
c = 1,936 Дж/г°C
Что такое удельная теплоемкость? | Термодинамика
Учебные пособия
- Сообщение от Мелисса Валки
12
июляОсновные понятия
В этом руководстве вы познакомитесь с темой удельная теплоемкость .
Кроме того, вы изучите формулу, которая соответствует этой концепции, и рассмотрите пример, чтобы решить математику. Также вы узнаете список удельной теплоемкости нескольких веществ .
Темы, освещенные в других статьях
- Химические реакции, упрощаемые
- Состояние вещества
- Физические и химические свойства
- Свойства твердых тел, жидкостей и газов
- Теплота плавления
Определение удельной теплоемкости
Насколько легко нагреть вещество? Все ли вещества требуют одинакового количества тепла для повышения своей температуры?
Наблюдение ученого Джозефа Блэка показало, что для нагревания равных масс различных веществ в одном и том же интервале температур требуется разное количество энергии. Кстати, Джозеф Блэк наиболее известен своими экспериментами с углекислым газом, назвав этот газ «неподвижным воздухом».
Это химическое свойство, известное как удельная теплоемкость , определяется как количество теплоты, необходимое для повышения температуры 1 грамма вещества на 1 градус Цельсия.
Удельная теплоемкость обычно измеряется в джоулях на грамм на градус Цельсия (Дж/г o C), но также может иметь единицу измерения «калория».
Каждое вещество имеет свою собственную удельную теплоемкость , которая представляет собой числовое значение, описывающее это химическое свойство! Например, удельная теплоемкость меди составляет 0,385, что довольно мало. Это означает, что кусок меди достаточно легко нагреть.
Формула удельной теплоемкости
Вы можете дополнительно изучить взаимосвязь между теплом и изменением температуры с помощью следующего уравнения:
Q= mcΔT
Q= добавленное тепло (Джоули)
m= масса (граммы)
c= удельная тепла (Дж/г o C)
ΔT= изменение температуры (T конечное – T начальное )другая единица измерения температуры. Это связано с тем, что разница между двумя температурами будет одинаковой независимо от единицы измерения!
Это соотношение справедливо только при отсутствии фазового перехода, т.
е. вещество остается в одном и том же состоянии от начала до конца. Приток или потеря тепла, которые приводят к фазовому переходу, такому как плавление или замерзание, имеют другие уравнения; Нажмите сюда, чтобы узнать больше!
Пример уравнения удельной теплоемкости
В: Какая энергия в джоулях необходима для нагрева свинцовой трубы весом 100 г с 25 o C до 37 o C? Удельная теплоемкость свинца 0,128 Дж/г o C.
A: Используйте уравнение и подставьте числа, чтобы найти ответ.
Q=mcΔT
Q= (100 г)(0,128 Дж/г o C)(37 o C -25 o C)= (100)(0,128)(12)
Q= 153,6 ДжУдельная теплоемкость – примеры
Единицы измерения – джоули на грамм на градус Цельсия.
- Вода = 4,186 Дж/г o C (или 1 калория)
- Сухой воздух = 1,01 Дж/г o C
- Лед = 2,05 Дж/г O C
- Алюминий = 0,900 J/G O C
- Алкоголь = 0,508 J/G O C
- Медная = 0,385 J/G O C
- HED = 0,128 J/G O C
- HED = 0,128 J/G O C
- HED = 0,128 J/G O C
- = 0,128 J/G O C
- .
C
Может ли удельная теплоемкость быть отрицательной? Насколько нам известно, не на этой планете, но, возможно, в некоторых звездах или газовых облаках.
Теплоемкость воды
Теплоемкость воды связана с единицей измерения, называемой калорией. Фактически, одна калория определяется как количество тепла, необходимое для нагревания 1 грамма жидкой воды на один градус Цельсия. Калория была впервые использована Николя Клементом в начале 19 века.век. Оно происходит от латинского слова «calor», означающего тепло.
Почему вода имеет высокую удельную теплоемкость?
Это из-за водородных связей. На самом деле, это высший S.H. всех жидкостей. Поскольку вода является полярной молекулой, с большой разницей электроотрицательностей между водородом и кислородом, водородные связи образуются между положительными атомами водорода в одной молекуле и отрицательными атомами кислорода в соседних молекулах. Требуется много энергии, чтобы ослабить и разорвать водородные связи между молекулами воды.




 К.
К.  Так как тепло, потерянное водой, такое же, как тепло, поглощенное солью,
Так как тепло, потерянное водой, такое же, как тепло, поглощенное солью, е. m = 194 кг
е. m = 194 кг  Кроме того, вы изучите формулу, которая соответствует этой концепции, и рассмотрите пример, чтобы решить математику. Также вы узнаете список удельной теплоемкости нескольких веществ .
Кроме того, вы изучите формулу, которая соответствует этой концепции, и рассмотрите пример, чтобы решить математику. Также вы узнаете список удельной теплоемкости нескольких веществ . Удельная теплоемкость обычно измеряется в джоулях на грамм на градус Цельсия (Дж/г o C), но также может иметь единицу измерения «калория».
Удельная теплоемкость обычно измеряется в джоулях на грамм на градус Цельсия (Дж/г o C), но также может иметь единицу измерения «калория». е. вещество остается в одном и том же состоянии от начала до конца. Приток или потеря тепла, которые приводят к фазовому переходу, такому как плавление или замерзание, имеют другие уравнения; Нажмите сюда, чтобы узнать больше!
е. вещество остается в одном и том же состоянии от начала до конца. Приток или потеря тепла, которые приводят к фазовому переходу, такому как плавление или замерзание, имеют другие уравнения; Нажмите сюда, чтобы узнать больше! C
C