Открытая Физика. Теплоёмкость идеального газа
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. c = Q / (mΔT).
Во многих случаях удобно использовать молярную теплоемкость C: C = M ċ c, где M – молярная масса вещества.
Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры.
Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует QV = CV ΔT = ΔU.
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.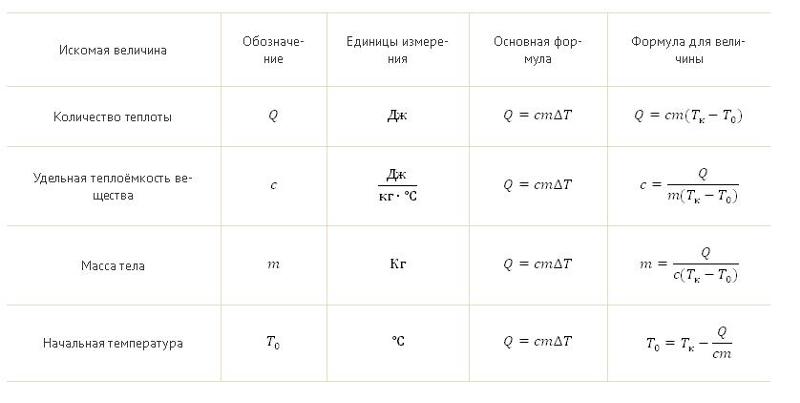
Для процесса при постоянном давлении первый закон термодинамики дает: Qp = ΔU + p (V2 – V1) = CV ΔT + pΔV, где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля: pV = RT, где R – универсальная газовая постоянная. При p = const
pΔ V=R ΔT или ΔVΔT=Rp.
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера): Cp = CV + R.
Молярная теплоемкость Cp газа в процессе с постоянным давлением всегда больше молярной теплоемкости
 3.10.1).
3.10.1).Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ. γ=Cp/CV.
В частности, это отношение входит в формулу для адиабатического процесса (см. §3.9).
Между двумя изотермами с температурами T1 и T2 на диаграмме (p, V) возможны различные пути перехода. Поскольку для всех таких переходов изменение температуры ΔT = T2 – T1 одинаково, следовательно, одинаково изменение ΔU внутренней энергии. Однако, совершенные при этом работы
 Отсюда следует, что у газа имеется бесчисленное количество теплоемкостей. Cp и CV – это лишь частные (и очень важные для теории газов) значения теплоемкостей.
Отсюда следует, что у газа имеется бесчисленное количество теплоемкостей. Cp и CV – это лишь частные (и очень важные для теории газов) значения теплоемкостей.Термодинамические процессы, в которых теплоемкость газа остается неизменной, называются политропическими. Все изопроцессы являются политропическими. В случае изотермического процесса ΔT = 0, поэтому C
Следует отметить, что «теплоемкость», как и «количество теплоты» – крайне неудачные термины. Они достались современной науке в наследство от теории теплорода, господствовавшей в XVIII веке. Эта теория рассматривала теплоту как особое невесомое вещество, содержащееся в телах. Считалось, что оно не может быть ни создано, ни уничтожено. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Теория теплорода несостоятельна. Она не может объяснить, почему одно и то же изменение внутренней энергии тела можно получить, передавая ему разное количество теплоты в зависимости от работы, которую совершает тело. Поэтому лишено физического смысла утверждение, что «в данном теле содержится такой-то запас теплоты».
Теория теплорода несостоятельна. Она не может объяснить, почему одно и то же изменение внутренней энергии тела можно получить, передавая ему разное количество теплоты в зависимости от работы, которую совершает тело. Поэтому лишено физического смысла утверждение, что «в данном теле содержится такой-то запас теплоты».
В молекулярно-кинетической теории устанавливается следующее соотношение между средней кинетической энергией E→ поступательного движения молекул и абсолютной температурой T: E→=32kT.
Внутренняя энергия 1 моля идеального газа равна произведению E→ на число Авогадро NА: U=32kNAT=32RT.
При изменении температуры на ΔT внутренняя энергия изменяется на величину ΔU=32RΔT=CVΔT.
Коэффициент пропорциональности между ΔU и ΔT равен теплоемкости CV при постоянном давлении: CV=32R=12,47 Дж/мольċК.
Это соотношение хорошо подтверждается в экспериментах с газами, состоящими из одноатомных молекул (гелий, неон, аргон). Однако, для двухатомных (водород, азот) и многоатомных (углекислый газ) газов это соотношение не согласуется с экспериментальными данными. Причина такого расхождения состоит в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию не только поступательного, но и вращательного движения молекул.
Однако, для двухатомных (водород, азот) и многоатомных (углекислый газ) газов это соотношение не согласуется с экспериментальными данными. Причина такого расхождения состоит в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию не только поступательного, но и вращательного движения молекул.
На рис. 3.10.2 изображена модель двухатомной молекулы. Молекула может совершать пять независимых движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y. Опыт показывает, что вращение относительно оси Z, на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких температурах. При обычных температурах вращение около оси Z не происходит, так же как не вращается одноатомная молекула. Каждое независимое движение называется  Таким образом, одноатомная молекула имеет 3 поступательные степени свободы, «жесткая» двухатомная молекула имеет 5 степеней (3 поступательные и 2 вращательные), а многоатомная молекула – 6 степеней свободы (3 поступательные и 3 вращательные).
Таким образом, одноатомная молекула имеет 3 поступательные степени свободы, «жесткая» двухатомная молекула имеет 5 степеней (3 поступательные и 2 вращательные), а многоатомная молекула – 6 степеней свободы (3 поступательные и 3 вращательные).
В классической статистической физике доказывается так называемая теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 12kT.
Из этой теоремы следует, что молярные теплоемкости газа Cp и CV и их отношение γ могут быть записаны в виде CV=i2R, Cp=CV+R=i+22R, γ=CpCV=i+2i, где i – число степеней свободы газа.
Для газа, состоящего из одноатомных молекул (i = 3) CV=32R, Cp=CV+R=52R, γ=53=1,66.
Для газа, состоящего из двухатомных молекул (i = 5)
CV=52R, Cp=CV+R=72R, γ=75=1,4.
Для газа, состоящего из многоатомных молекул (i = 6) CV=3R, Cp=CV+R=4R, γ=43=1,33.
Теорему о равномерном распределении энергии по степеням свободы можно применить и к тепловому движению частиц в твердом теле. Атомы, входящие в состав кристаллической решетки, совершают колебания около положений равновесия. Энергия этих колебаний и представляет собой внутреннюю энергию твердого тела. Каждый атом в кристаллической решетке может колебаться в трех взаимно перпендикулярных направлениях. Следовательно, каждый атом имеет 3 колебательные степени свободы. При гармонических колебаниях средняя кинетическая энергия равна средней потенциальной энергии. Поэтому в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия kT, а на один атом – 3kT. Внутренняя энергия 1 моля твердого вещества равна:
U = 3NАkT = 3RT.
При гармонических колебаниях средняя кинетическая энергия равна средней потенциальной энергии. Поэтому в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия kT, а на один атом – 3kT. Внутренняя энергия 1 моля твердого вещества равна:
U = 3NАkT = 3RT.
Поэтому молярная теплоемкость вещества в твердом состоянии равна: C = 3R = 25,12 Дж/моль·К.
Это соотношение называется законом Дюлонга–Пти. Для твердых тел практически не существует различия между Cp и CV из-за ничтожно малой работы при расширении или сжатии.
Опыт показывает, что у многих твердых тел (химических элементов) молярная теплоемкость при обычных температурах действительно близка к 3R. Однако, при низких температурах наблюдаются значительные расхождения между теорией и экспериментом. Это показывает, что гипотеза о равномерном распределении энергии по степеням свободы является приближением. Наблюдаемая на опыте зависимость теплоемкости от температуры может быть объяснена только на основе квантовых представлений.
Наблюдаемая на опыте зависимость теплоемкости от температуры может быть объяснена только на основе квантовых представлений.
Смотрите также:
Математика,
Английский язык,
Химия,
Биология,
Физика,
География,
Астрономия.
А также: библиотека ЭОРов и образовательный онлайн-сервис с тысячами интерактивных работ “Облако знаний”.
Расчет количества теплоты.
Урок проверки знаний и умений по физике в 8 классе по теме «Количество теплоты. Расчет количества теплоты »
Цель урока Закрепление основных понятий, таких как «температура,
внутренняя энергия, количество теплоты», используемых
при изучении тепловых явлений
1. Фронтальный устный опрос
Приведите примеры тепловых явлений
а) Вызвать к доске для построения схемы изменения внутренней энергии
2) Что такое внутренняя энергия тела?
3) Что такое изменение внутренней энергии?
4) От чего зависит внутренняя энергия тела? Как она зависит?
5) Что такое температура?
6) Какими способами можно изменить внутреннюю энергию тела?
7) Что такое теплообмен или теплопередача?
8) Закончите фразу «В процессе теплообмена тело получает или отдает …»
9) Что такое количество теплоты?
10) Какие виды теплообмена вы знаете?
11) Что такое теплопроводность?
12) Что такое конвекция?
11) Что такое излучение?
Раздать листки, 2 человека у доски работают
2. Физический диктант
Физический диктант
Вариант 1 Вариант 2
1. 1б 1. 1а
2. 2д 2. 2в
3. 3в 3. 3в
4. 4д 4. 4а
5. 5б 5. 5а
Взаимоконтроль. Обменялись заданиями. Работающие у доски проговаривают правильные ответы.
Собрать листки.
3. Закрепление формулы для расчета количества теплоты.
Дать карточку для написания формулы.
Карточка. Записать формулу для расчета количества теплоты, получаемого телом при нагревании
или выделяемого им при охлаждении.
Q = cm (t2 _—- t1)
Выразить из этой формулы следующие величины
c = Все пишут в тетради, на доску не сморят!
m = Проверить!
(t2 __—- t1) =
t2 _= t1 =
4. Самостоятельная письменная работа.
Самостоятельная письменная работа.
На доске
1 | 2 |
1. Какое количество теплоты требуется для нагревания стальной детали массой 400 г от 20 ˚С до 50 ˚С. | 1. Какое количество теплоты выделятся при охлаждении латунной детали массой 200 г от 80 ˚С до 30 ˚С. |
2. Чему равна масса медного паяльника, если при нагревании от 20 ˚С до 420 ˚С потребовалось 30,4 кДж энергии. | 2. При нагревании куска олова от 32 ˚С до 232 ˚С выделилось 5 кДж энергии. Чему равна масса олова. |
3. Определите удельную теплоемкость металла, если для изменения температуры от 20 ˚С до 24 ˚С бруску массой 100 г, сделанного из этого металла, передано количество теплоты равное 152 кДж. | 3. При изменении температуры куска металла массой 100 г от 20 ˚С до 40 ˚С внутренняя энергия его увеличилась на 280 Дж. |
Какая таблица будет нужна?
Откройте учебник на странице___
4*. До какой температуры остынут 5 л кипятка, взятого при температуре 100 ˚С, отдав в
окружающую среду 1680 кДж энергии.
ОРГАНИЗАЦИЯ УРОКА
На каждый стол два чистых листка. Проследить, чтобы дети их подписали.
Приготовить карточку с формулой.
Записать на доске 1 и 2 варианты. справочные данные.
Подвести итоги, отметить лучших учащихся.
МБОУ СОШ №13
Урок проверки знаний и умений по физике в 8 классе по теме:
«Количество теплоты. Расчет количества теплоты»
Учитель физики
Литвиненко Наталия Ивановна
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/71441-raschet-kolichestva-teploty
3.
 12: Расчеты энергии и теплоемкости
12: Расчеты энергии и теплоемкости- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47467
Цели обучения
- Связать теплопередачу с изменением температуры.
Тепло — знакомое нам проявление передачи энергии. Когда мы прикасаемся к горячему предмету, энергия течет от горячего предмета к нашим пальцам, и мы воспринимаем эту поступающую энергию как «горячий» предмет. И наоборот, когда мы держим кубик льда в ладонях, энергия течет из нашей руки в кубик льда, и мы воспринимаем эту потерю энергии как «холод». В обоих случаях температура объекта отличается от температуры нашей руки, поэтому можно сделать вывод, что разность температур является конечной причиной теплопередачи.
Удельная теплоемкость вещества может быть использована для расчета изменения температуры данного вещества при нагревании или охлаждении. Уравнение, связывающее теплоту \(\left( q \right)\) с удельной теплоемкостью \(\left( c_p \right)\), массой \(\left( m \right)\) и изменением температуры \(\ слева( \Delta T \right)\) показано ниже.
\[q = c_p \times m \times \Delta T \nonumber \]
Тепло, которое либо поглощается, либо выделяется, измеряется в джоулях. Масса измеряется в граммах. Изменение температуры определяется выражением \(\Delta T = T_f – T_i\), где \(T_f\) – конечная температура, а \(T_i\) – начальная температура.
Каждое вещество имеет характеристическую удельную теплоемкость, которая выражается в единицах кал/г•°C или кал/г•K, в зависимости от единиц, используемых для выражения Δ T . Удельной теплоемкостью вещества называется количество энергии, которое необходимо передать 1 г этого вещества или от него, чтобы изменить его температуру на 1°. \text{o} \text{C} \right)\)”> 0,233
\text{o} \text{C} \right)\)”> 0,233
направление теплового потока не показано в тепле = mc Δ T . Если энергия уходит в объект, то полная энергия объекта увеличивается, а значения теплоты Δ T положительны. Если энергия исходит от объекта, полная энергия объекта уменьшается, а значения теплоты и Δ T отрицательны.
Пример \(\PageIndex{1}\) 9\text{o} \text{C} \nonumber \]
Пример \(\PageIndex{2}\)
Какое количество теплоты передается при нагревании бруска металлического железа массой 150,0 г с 25,0°C до 73,3°C? Каково направление теплового потока?
Решение
Мы можем использовать теплоту = mc Δ T для определения количества теплоты, но сначала нам нужно определить Δ T . Поскольку конечная температура железа составляет 73,3°С, а начальная температура составляет 25,0°С, Δ T будет следующим: 9\circ C) = 782\: кал} \nonumber \]
Обратите внимание, что грамм и °C сокращаются алгебраически, остается только единица калорий, которая является единицей тепла. Поскольку температура железа увеличивается, энергия (в виде тепла) должна течь в металл.
Поскольку температура железа увеличивается, энергия (в виде тепла) должна течь в металл.
Упражнение \(\PageIndex{1}\)
Какое количество теплоты передается при охлаждении бруска металлического алюминия массой 295,5 г со 128,0°C до 22,5°C? Каково направление теплового потока?
- Ответ
- Тепло покидает алюминиевый блок.
Пример \(\PageIndex{2}\)
Образец красновато-коричневого металла массой 10,3 г выделил 71,7 кал тепла при снижении его температуры с 97,5°C до 22,0°C. Чему равна удельная теплоемкость металла? Можете ли вы определить металл по данным в таблице \(\PageIndex{1}\)?
Решение
Вопрос дает нам теплоту, конечную и начальную температуры и массу образца. Значение Δ T выглядит следующим образом:
Δ T = T конечная − T начальная = 22,0°C − 97,5°C = −75,5°C
(как тепло), поэтому значение тепла записывается в виде отрицательного числа, -71,7 кал. \circ C)}}\)
\circ C)}}\)c = 0,0923 кал/г•°C
Это значение удельной теплоемкости очень близко к значению, указанному для меди в таблице 7.3.
Упражнение \(\PageIndex{2}\)
Кристалл хлорида натрия (NaCl) массой 10,7 г имеет начальную температуру 37,0°C. Какова конечная температура кристалла, если к нему подведено 147 кал теплоты?
- Ответить
Проиллюстрированы расчеты удельной теплоемкости.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- автор@Генри Эгнью
- автор@Мариса Альвиар-Агнью
- Расчет теплоемкости
- источник@https://www.ck12.org/c/chemistry/
Изменение температуры и теплоемкость | Физика |
Цели обучения
К концу этого раздела вы сможете:
- Наблюдать за теплопередачей и изменением температуры и массы.
- Рассчитать конечную температуру после теплопередачи между двумя объектами.
Одним из основных эффектов теплопередачи является изменение температуры: нагревание повышает температуру, а охлаждение снижает ее. Мы предполагаем, что фазового перехода нет и что над системой или системой не совершается никакой работы. Опыты показывают, что передаваемое тепло зависит от трех факторов — изменения температуры, массы системы, вещества и фазы вещества.
Опыты показывают, что передаваемое тепло зависит от трех факторов — изменения температуры, массы системы, вещества и фазы вещества.
Рис. 1. Теплота Q , переданная для изменения температуры, зависит от величины изменения температуры, массы системы, а также вовлеченного вещества и фазы. а) Количество переданного тепла прямо пропорционально изменению температуры. Чтобы удвоить изменение температуры массы m, нужно добавить удвоенное количество теплоты. б) Количество переданного тепла также прямо пропорционально массе. Чтобы вызвать эквивалентное изменение температуры в удвоенной массе, нужно добавить в два раза больше тепла. в) Количество переданного тепла зависит от вещества и его фазы. Если требуется сумма Q тепла, чтобы вызвать изменение температуры Δ T в данной массе меди, потребуется в 10,8 раз больше тепла, чтобы вызвать эквивалентное изменение температуры в той же массе воды, при условии отсутствия фазового перехода ни в одном из веществ.
Зависимость от изменения температуры и массы легко понять. Благодаря тому, что (средняя) кинетическая энергия атома или молекулы пропорциональна абсолютной температуре, внутренняя энергия системы пропорциональна абсолютной температуре и числу атомов или молекул. Благодаря тому, что переданное тепло равно изменению внутренней энергии, теплота пропорциональна массе вещества и изменению температуры. Переносимое тепло также зависит от вещества, так что, например, теплота, необходимая для повышения температуры, для спирта меньше, чем для воды. Для одного и того же вещества передаваемая теплота также зависит от фазы (газовая, жидкая или твердая).
Теплопередача и изменение температуры
Количественная связь между теплопередачей и изменением температуры содержит все три фактора: Q = mc Δ T , где Q — символ теплопередачи, m — масса вещества, а Δ T — изменение температуры. Символ c означает удельную теплоемкость и зависит от материала и фазы. Удельная теплоемкость – это количество теплоты, необходимое для изменения температуры 1,00 кг массы на 1,00°С. Удельная теплоемкость c — свойство вещества; его единица СИ – Дж / (кг ⋅ K) или Дж / (кг ⋅ ºC). Напомним, что изменение температуры (Δ T ) одинаково в единицах кельвина и градусах Цельсия. Если теплопередача измеряется в килокалориях, то единицей удельной теплоемкости является ккал/(кг ⋅ ºC).
Удельная теплоемкость – это количество теплоты, необходимое для изменения температуры 1,00 кг массы на 1,00°С. Удельная теплоемкость c — свойство вещества; его единица СИ – Дж / (кг ⋅ K) или Дж / (кг ⋅ ºC). Напомним, что изменение температуры (Δ T ) одинаково в единицах кельвина и градусах Цельсия. Если теплопередача измеряется в килокалориях, то единицей удельной теплоемкости является ккал/(кг ⋅ ºC).
Значения удельной теплоемкости обычно нужно искать в таблицах, потому что нет простого способа их вычислить. В общем случае удельная теплоемкость также зависит от температуры. В таблице 1 перечислены репрезентативные значения удельной теплоемкости для различных веществ. За исключением газов, зависимость теплоемкости большинства веществ от температуры и объема слабая. Из этой таблицы мы видим, что удельная теплоемкость воды в пять раз больше, чем у стекла, и в десять раз больше, чем у железа, а это значит, что требуется в пять раз больше теплоты, чтобы поднять температуру воды на ту же величину, что и для стекла, и в десять раз больше, чем для стекла. много тепла, чтобы поднять температуру воды, как для железа. На самом деле вода имеет одну из самых больших удельных теплоемкостей среди всех материалов, что важно для поддержания жизни на Земле.
много тепла, чтобы поднять температуру воды, как для железа. На самом деле вода имеет одну из самых больших удельных теплоемкостей среди всех материалов, что важно для поддержания жизни на Земле.
Пример 1. Расчет необходимого количества тепла: нагрев воды в алюминиевой кастрюле
Алюминиевая кастрюля массой 0,500 кг на плите используется для нагрева 0,250 л воды с 20,0°С до 80,0°С. а) Какое количество тепла потребуется? Какой процент тепла используется для повышения температуры (b) кастрюли и (c) воды?
Стратегия
Кастрюля и вода всегда одной температуры. Когда вы ставите кастрюлю на плиту, температура воды и сковороды увеличивается на одинаковую величину. Воспользуемся уравнением теплообмена при заданном изменении температуры и массы воды и алюминия. Удельные теплоемкости воды и алюминия приведены в табл. 1.
Решение
Поскольку вода находится в тепловом контакте с алюминием, сковорода и вода имеют одинаковую температуру.
Рассчитайте разницу температур:
Δ T = T f − T i = 60,0ºC.
Вычислите массу воды. Поскольку плотность воды 1000 кг/м 3 , один литр воды имеет массу 1 кг, а масса 0,250 л воды равна м w = 0,250 кг.
Рассчитайте тепло, переданное воде. Используйте удельное тепло воды в Таблице 1:
Q W = M W C W Δ T = (0,250 KG) (4186 J/KGº) (0,250 KG) (4186 J/KGº) (0,250 KG) (4186 J/KGº) (0,250 KG) (4186 J/KGº) (0,250 KG) (4186 J/KGº) (0,250 KG) (4186 J/KGº) (0,250 KG) (4186 J/KGº) (0,250 KG) (4186 J/KGº). = 62,8 кДж.
Вычислите теплоту, переданную алюминию. Используйте удельную теплоемкость алюминия из таблицы 1:
Q Al = m Al c Al Δ T = (0,500 кг)(900 Дж/кгºC)(60,0ºC) = 27,0 × 10 4 Дж = 27,0 кДж. Сравните процент тепла, поступающего в кастрюлю, и процент тепла, поступающего в воду. Сначала найдем общее переданное тепло:
Сравните процент тепла, поступающего в кастрюлю, и процент тепла, поступающего в воду. Сначала найдем общее переданное тепло:
Q Всего = Q w + Q Al = 62,8 кДж + 27,8 кДж + 27,8 кДж + 27,8 кДж + 27,8 кДж + 27,8 кДж
Таким образом, количество тепла, идущего на нагрев сковороды, равно
27,0 кДж 89,8 кДж × 100 % = 30,1 %\frac{27,0\text{ кДж}}{89..8\text{ кДж}}\times100\%=30,1\%\\89,8 кДж27,0 кДж×100%=30,1%
а количество, идущее на нагрев воды, равно
62,8 кДж89,8 кДж×100%=69,9%\frac{62,8\text{кДж}}{89,8\text{кДж}}\times100\%=69,9\%\\ 89,8 кДж62,8 кДж×100%=69,9%
.
Обсуждение
В этом примере тепло, переданное контейнеру, составляет значительную долю от общего количества переданного тепла. Хотя масса кастрюли в два раза больше массы воды, удельная теплоемкость воды более чем в четыре раза больше, чем у алюминия. Следовательно, для достижения заданного изменения температуры воды требуется чуть более чем в два раза больше тепла по сравнению с алюминиевой кастрюлей.
Следовательно, для достижения заданного изменения температуры воды требуется чуть более чем в два раза больше тепла по сравнению с алюминиевой кастрюлей.
Пример 2. Расчет повышения температуры по работе, совершаемой над веществом: перегрев тормозов грузовика при движении вниз по склону
Рис. 2. Дымящиеся тормоза на этом грузовике являются видимым свидетельством механического эквивалента тепла.
Тормоза грузовиков, используемые для контроля скорости на спуске, работают, преобразуя потенциальную энергию гравитации в повышенную внутреннюю энергию (более высокую температуру) тормозного материала. Это преобразование предотвращает преобразование потенциальной энергии гравитации в кинетическую энергию грузовика. Проблема заключается в том, что масса грузовика велика по сравнению с массой тормозного материала, поглощающего энергию, и повышение температуры может происходить слишком быстро, чтобы достаточное количество тепла передавалось от тормозов в окружающую среду.
Рассчитайте повышение температуры 100 кг тормозного материала со средней удельной теплоемкостью 800 Дж/кг ⋅ ºC, если материал сохраняет 10 % энергии от 10 000-килограммового грузовика, спускающегося с высоты 75,0 м (при вертикальном перемещении) при постоянном скорость.
Стратегия
Если тормоза не задействованы, гравитационная потенциальная энергия преобразуется в кинетическую энергию. При торможении потенциальная энергия гравитации преобразуется во внутреннюю энергию тормозного материала. Сначала вычислим гравитационную потенциальную энергию ( Mgh ), что весь грузовик теряет при спуске, а затем найти повышение температуры только в тормозном материале.
Решение
- Рассчитайте изменение потенциальной энергии гравитации при движении грузовика под уклон
- Рассчитайте температуру по переданному теплу, используя Q = Mgh и
ΔT=Qmc\Delta{T}=\frac{Q}{mc}\\ΔT=mcQ 9{\ circ} C \\ ΔT = (100 кг) (800 Дж / кг ∘ C) (7,35 × 106 Дж) = 92 ∘ C
.
Обсуждение
Эта температура близка к температуре кипения воды. Если бы грузовик какое-то время ехал, то непосредственно перед спуском температура тормозов, вероятно, была бы выше температуры окружающей среды. Повышение температуры при спуске, вероятно, повысит температуру тормозного материала выше точки кипения воды, поэтому этот метод нецелесообразен. Однако та же идея лежит в основе новейшей гибридной технологии автомобилей, где механическая энергия (потенциальная энергия гравитации) преобразуется тормозами в электрическую энергию (аккумулятор).
| Таблица 1. Удельная теплоемкость [4] различных веществ | ||
|---|---|---|
| Вещества | Удельная теплоемкость ( c ) | |
| Твердые вещества | Дж/кг ⋅ ºC | ккал/кг ⋅ ºC [5] |
| Алюминий | 900 | 0,215 |
| Асбест | 800 | 0,19 |
| Бетон, гранит (средний) | 840 | 0,20 |
| Медь | 387 | 0,0924 |
| Стекло | 840 | 0,20 |
| Золото | 129 | 0,0308 |
| Тело человека (в среднем при 37 °C) | 3500 | 0,83 |
| Лед (средний, от −50°C до 0°C) | 2090 | 0,50 |
| Железо, сталь | 452 | 0,108 |
| Свинец | 128 | 0,0305 |
| Серебро | 235 | 0,0562 |
| Дерево | 1700 | 0,4 |
| Жидкости | ||
| Бензол | 1740 | 0,415 |
| Этанол | 2450 | 0,586 |
| Глицерин | 2410 | 0,576 |
| Меркурий | 139 | 0,0333 |
| Вода (15,0 °C) | 4186 | 1. 000 000 |
| Газы [6] | ||
| Воздух (сухой) | 721 (1015) | 0,172 (0,242) |
| Аммиак | 1670 (2190) | 0,399 (0,523) |
| Углекислый газ | 638 (833) | 0,152 (0,199) |
| Азот | 739 (1040) | 0,177 (0,248) |
| Кислород | 651 (913) | 0,156 (0,218) |
| Пар (100°C) | 1520 (2020) | 0,363 (0,482) |
Обратите внимание, что пример 2 – это иллюстрация механического эквивалента тепла. В качестве альтернативы, повышение температуры может быть произведено с помощью паяльной лампы вместо механического.
Пример 3. Расчет конечной температуры при передаче тепла между двумя телами: наливание холодной воды на горячую сковороду
Предположим, вы налили 0,250 кг воды температурой 20,0°C (около чашки) в 0,500-килограммовую алюминиевую кастрюлю с температурой 150°C, снятую с плиты. Предположим, что кастрюля находится на изолированной подушке и что незначительное количество воды выкипает. При какой температуре вода и кастрюля через короткое время достигают теплового равновесия?
Предположим, что кастрюля находится на изолированной подушке и что незначительное количество воды выкипает. При какой температуре вода и кастрюля через короткое время достигают теплового равновесия?
Стратегия
Кастрюля размещена на изолирующей подушке, так что происходит небольшая теплопередача с окружающей средой. Первоначально кастрюля и вода не находятся в тепловом равновесии: кастрюля имеет более высокую температуру, чем вода. Затем теплопередача восстанавливает тепловое равновесие, когда вода и кастрюля соприкасаются. Поскольку теплопередача между кастрюлей и водой происходит быстро, масса испаряемой воды пренебрежимо мала, а величина тепла, теряемого кастрюлей, равна теплу, приобретаемому водой. Обмен теплом прекращается, как только достигается тепловое равновесие между чашей и водой. Теплообмен можно записать как | Q горячий |= Q холодный .
Раствор
Используйте уравнение теплопередачи Q = mc Δ T , чтобы выразить потери тепла алюминиевой кастрюлей через массу кастрюли, удельную теплоемкость алюминия, начальную температуру кастрюли и конечная температура: Q горячий = m Al c Al ( T f − 150ºC). {\ circ} \ text {C} \ right)} {m _ {\ text {Al}} c _ {\ text {Al }}+m_{\text{W}}c_{\text{W}}}\\Tf=mAlcal+mWcWmAlcal(Tf−150∘C)+mWcW (Tf−20.0∘C) 9{\circ}\text{C}\end{array}\\Tf ===(0,500 кг)(900 Дж/кг∘C)+(0,250 кг)(4186 Дж/кг∘C)(0,500 кг)(900 Дж/кг∘C)(150°C)+(0,250 кг)(4186 Дж/кг∘C)(20,0°C)1496,5 Дж/∘C88430 Дж59,1°C
{\ circ} \ text {C} \ right)} {m _ {\ text {Al}} c _ {\ text {Al }}+m_{\text{W}}c_{\text{W}}}\\Tf=mAlcal+mWcWmAlcal(Tf−150∘C)+mWcW (Tf−20.0∘C) 9{\circ}\text{C}\end{array}\\Tf ===(0,500 кг)(900 Дж/кг∘C)+(0,250 кг)(4186 Дж/кг∘C)(0,500 кг)(900 Дж/кг∘C)(150°C)+(0,250 кг)(4186 Дж/кг∘C)(20,0°C)1496,5 Дж/∘C88430 Дж59,1°C
Обсуждение
Это типичная калориметрическая задача: два тела с разными температурами соприкасаются друг с другом и обмениваются теплом до тех пор, пока не будет достигнута общая температура. Почему конечная температура намного ближе к 20,0ºC, чем к 150ºC? Причина в том, что вода имеет большую удельную теплоемкость, чем большинство обычных веществ, и, таким образом, претерпевает небольшое изменение температуры при заданной теплопередаче. Большому водоему, такому как озеро, требуется большое количество тепла, чтобы заметно повысить его температуру. Это объясняет, почему температура озера остается относительно постоянной в течение дня даже при больших изменениях температуры воздуха. Однако температура воды меняется в течение более длительного времени (например, с лета на зиму).
Однако температура воды меняется в течение более длительного времени (например, с лета на зиму).
Самостоятельный эксперимент: изменение температуры земли и воды
Что нагревается быстрее, земля или вода?
Для изучения различий в теплоемкости:
- Поместите равные массы сухого песка (или почвы) и воды одинаковой температуры в два небольших сосуда. (Средняя плотность почвы или песка примерно в 1,6 раза выше, чем у воды, поэтому вы можете получить примерно равные массы, используя на 50% больше воды по объему.)
- Нагревайте оба (используя духовку или греющую лампу) в течение одинакового времени.
- Запишите конечную температуру двух масс.
- Теперь доведите обе банки до одинаковой температуры, нагревая их в течение более длительного периода времени.
- Снимите банки с источника тепла и измеряйте их температуру каждые 5 минут в течение примерно 30 минут.
Какой образец остывает быстрее? Эта деятельность воспроизводит явления, ответственные за наземные и морские бризы.
Проверьте свое понимание
Если для повышения температуры блока с 25°С до 30°С необходимо 25 кДж, то какое количество теплоты необходимо, чтобы нагреть блок с 45°С до 50°С?
Решение
Теплопередача зависит только от разницы температур. Так как разность температур одинакова в обоих случаях, то и во втором случае необходимы одни и те же 25 кДж.
Section Summary
- The transfer of heat Q that leads to a change Δ T in the temperature of a body with mass m is Q = mc Δ T , where c – удельная теплоемкость материала. Это соотношение также можно рассматривать как определение удельной теплоемкости.
Концептуальные вопросы
- Какие три фактора влияют на теплопередачу, необходимую для изменения температуры объекта?
- Повышение температуры тормозов в автомобиле на Δ T при остановке автомобиля со скорости v .
 Насколько больше было бы Δ T , если бы скорость автомобиля изначально была вдвое больше? Вы можете предположить, что автомобиль останавливается достаточно быстро, чтобы тепло от тормозов не отводилось.
Насколько больше было бы Δ T , если бы скорость автомобиля изначально была вдвое больше? Вы можете предположить, что автомобиль останавливается достаточно быстро, чтобы тепло от тормозов не отводилось.
Задачи и упражнения
- В жаркий день температура в бассейне объемом 80 000 литров повышается на 1,50ºC. Какова чистая теплопередача при этом нагреве? Игнорируйте любые осложнения, такие как потеря воды в результате испарения.
- Показать, что 1 кал/г · ºC = 1 ккал/кг · ºC.
- Чтобы стерилизовать стеклянную детскую бутылочку весом 50,0 г, мы должны поднять ее температуру с 22,0ºC до 95,0ºC. Какая теплопередача требуется?
- Одинаковая передача тепла одинаковым массам различных веществ вызывает различные изменения температуры. Рассчитайте конечную температуру, когда 1,00 ккал теплоты переходит в 1,00 кг следующих веществ при исходной температуре 20,0ºC: (a) вода; (б) бетон; (в) сталь; и d) ртуть.
- Потирание рук согревает их, превращая работу в тепловую энергию.
 Если женщина потирает руки взад-вперед, совершая в общей сложности 20 движений, на расстоянии 7,50 см за одно движение и со средней силой трения 40,0 Н, на сколько повысится температура? Масса согреваемых тканей составляет всего 0,100 кг, преимущественно в ладонях и пальцах.
Если женщина потирает руки взад-вперед, совершая в общей сложности 20 движений, на расстоянии 7,50 см за одно движение и со средней силой трения 40,0 Н, на сколько повысится температура? Масса согреваемых тканей составляет всего 0,100 кг, преимущественно в ладонях и пальцах. - Блок чистого материала массой 0,250 кг нагревается с 20,0°С до 65,0°С за счет добавления 4,35 кДж энергии. Рассчитайте его удельную теплоемкость и определите вещество, из которого он, скорее всего, состоит.
- Предположим, что одинаковые количества тепла передаются разным массам меди и воды, вызывая одинаковые изменения температуры. Каково отношение массы меди к воде?
- (a) Количество килокалорий в пище определяется методами калориметрии, при которых пища сжигается и измеряется количество теплопередачи. Сколько килокалорий на грамм содержится в 5,00 г арахиса, если энергия его сжигания передается 0,500 кг воды, находящейся в алюминиевом стакане весом 0,100 кг, вызывая 54,9ºC повышение температуры? (б) Сравните свой ответ с информацией на этикетке на упаковке арахиса и прокомментируйте, совпадают ли значения.

- После интенсивной физической нагрузки температура тела человека массой 80,0 кг составляет 40,0ºC. С какой скоростью в ваттах человек должен передать тепловую энергию, чтобы снизить температуру тела до 37,0ºC за 30,0 мин, если предположить, что тело продолжает производить энергию мощностью 150 Вт? 1 Вт = 1 Дж/сек или 1 Вт = 1 Дж/сек.
- Даже при остановке после периода нормальной эксплуатации большой коммерческий ядерный реактор передает тепловую энергию со скоростью 150 МВт за счет радиоактивного распада продуктов деления. Этот теплообмен вызывает быстрое повышение температуры в случае отказа системы охлаждения (1 Вт = 1 Дж/сек или 1 Вт = 1 Дж/сек и 1 МВт = 1 мегаватт). (a) Рассчитайте скорость повышения температуры в градусах Цельсия в секунду (ºC/с), если масса активной зоны реактора составляет 1,60 × 10 5 кг и имеет среднюю удельную теплоемкость 0,3349 кДж/кг ⋅ ºC. (б) Сколько времени потребуется, чтобы получить повышение температуры на 2000ºC, что может привести к плавлению некоторых металлов, содержащих радиоактивные материалы? (Начальная скорость повышения температуры будет больше рассчитанной здесь, потому что теплопередача сосредоточена в меньшей массе.
 Однако позже рост температуры замедлится, поскольку стальная защитная оболочка весом 5 × 10 5 кг также начинают нагреваться.)
Однако позже рост температуры замедлится, поскольку стальная защитная оболочка весом 5 × 10 5 кг также начинают нагреваться.)
Рис. 3. Бассейн с радиоактивным отработавшим топливом на атомной электростанции. Отработавшее топливо долго остается горячим. (кредит: Министерство энергетики США)
Глоссарий
удельная теплоемкость: количество теплоты, необходимое для изменения температуры 1,00 кг вещества на 1,00 ºC
Избранные решения задач и упражнений
1. 5,02 × 10 8 J
3. 3,07 × 10 3 J
5. 0,171ºC
7. 10,8
9. 617 Вт
- «значения для твердых и жидких веществ даны при постоянном объеме и температуре 25ºC, если не указано иное». ↵
- Эти
«значения идентичны в единицах кал/г ⋅ ºC».


