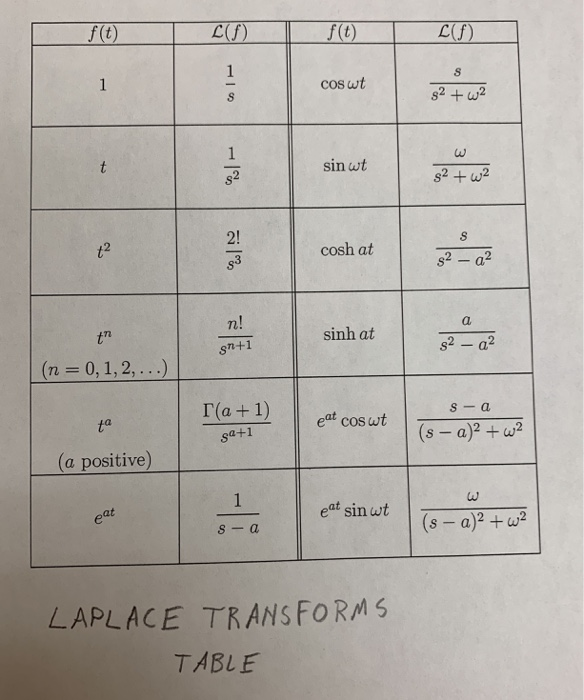
Расчет корригированного QT – Формула Базетта (Bazett’s formula) – QTc он-лайн
Кафедра внутрішньої медицини № 3 та ендокринології > Для лікарів > Калькулятори > Формула Базетта (Bazett’s formula) – Розрахунок QTc
Расчет корригированного QT – Формула Базетта (Bazett’s formula) – QTc
- Формула Базетта (Bazett’s formula) может быть использована у пациентов с ЧСС от 60 до 100 ударов в минуту. При тахикардии или брадикардии значения могут быть искажены.
- Для ЧСС ниже 60 или выше 100 ударов в минуту определение корригированного значения интервала QT должно быть подсчитано по формуле Framingham.
Нормальные значения корригированного QT: 320-430 для мужчин и 320-450 для женщин.
Корригированный интервал Q-T
| Интервал R-R | |
|---|---|
| |
| Пульс | уд/мин |
| Q-T измеренный | |
| |
| Корригированный интервал Q-T |
Интервал QT — расстояние от начала комплекса QRS до завершения зубца T. С точки зрения электрофизиологии отражает сумму процессов деполяризации (электрическое возбуждение со сменой заряда клеток) и последующей реполяризации (восстановление электрического заряда) миокарда желудочков. Часто этот параметр называют электрическая систола сердца.
С точки зрения электрофизиологии отражает сумму процессов деполяризации (электрическое возбуждение со сменой заряда клеток) и последующей реполяризации (восстановление электрического заряда) миокарда желудочков. Часто этот параметр называют электрическая систола сердца.
Продолжительность
Продолжительность интервала QT непостоянна как у индивида, так и в популяциях. Факторами изменяющими его длительность являются (только основные):
- частота сердечных сокращений (ЧСС)
- состояние автономной нервной системы
- действие т.н. симпатомиметиков (адреналин, например)
- электролитный баланс (особенно Ca2+)
- некоторые лекарственные препараты
- возраст
- пол
- время суток
Наиболее важным фактором, определяющим продолжительность интервала QT является ЧСС. Зависимость носит нелинейный и обратно пропорциональный характер.
Bazett (1920), Fridericia (1920), Hegglin и Holzmann (1937) были первыми исследователями этого феномена.
Расчет длительности.
Так как длительность интервала QT зависит от частоты сердечного ритма (удлиняясь при его замедлении), для оценки она должна быть корригирована относительно ЧСС.
Чаще всего используются формулы Базетта и Фредерика.
А также формула Саги для подсчёта корригированного QT у пациентов с фибрилляцией предсердий:
QTс(S) = QT + 0,154×(1000 − RR)
где:
QTc — корригированная (относительно частоты сердечных сокращений) величина интервала QT, относительная величина.
RR — расстояние между данным комплексом QRS и предшествующим ему, выражается в секундах для формул Базетта и Фредерика, и в миллисекундах для формулы Саги.
Формула Базетта не вполне корректна. Отмечена тенденция к излишней корректировке при высокой частоте сердечных сокращений (при тахикардии), и недостаточная корректировка при низкой (при брадикардии).
Должные величины лежат в диапазоне 320-430 для мужчин и 320-450 для женщин.
Удлинение интервала.
При удлинении интервала QT повышается риск развития фатальных нарушений ритма, в том числе полиморфной (веретенообразной) желудочковой тахикардии, которая несёт непосредственную угрозу жизни пациента. Удлинение интервала QT может быть как врождённым (вследствие мутаций определённых генов), так и приобретённым — электролитные нарушения, ишемия миокарда, влияние лекарственных препаратов.
Значимость.
Удлинение (в некоторой мере, – и укорочение) интервала QT, отражает негомогенность (неоднородность) процессов реполяризации миокарда желудочков, и расценивается как независимый предиктор фатальных нарушений ритма.
Генетика.
Наследуемость интервала составляет, по одной оценке, около 30%. Теми же авторами была отмечена ассоциация длины интервала с вариациями гена NOS1AP на хромосомном участке 1q23.
CELLFOOD® Natural Weight Loss Formula (Формула похудения)
66.00 лв.
CELLFOOD® Natural Weight Loss Formula — Селфуд Формула для успешного сброса веса
118 ml
Биологически активная добавка.
Цена с учетом НДС. Не включает в себя
доставкуКоличество CELLFOOD® Natural Weight Loss Formula (Селфуд Формула похудения)
Категория: СЕЛФУД (CELLFOOD)
- Описание
Описание
CELLFOOD® Natural Weight Loss Formula (Селфуд Формула похудения) — незаменимая часть любой программы для коррекции и контроля телесного веса. Эта сбаллансированная, но мощная трехкомпонентная натуральная формула, комбинирует запатентованную формулу  Формула способствует удалению основной причины ожирения — нарушения метаболизма, способствуя регуляции обмена веществ и повышению еффективности сжигания жиров — даже во сне (жиры разщепляются неожиданно мощно во время ночных циклях).
Формула способствует удалению основной причины ожирения — нарушения метаболизма, способствуя регуляции обмена веществ и повышению еффективности сжигания жиров — даже во сне (жиры разщепляются неожиданно мощно во время ночных циклях).
- L-carnitin. Левокарнитин синтезируется в печени и играет важную роль в обмене жиров на клеточном уровне, превращая жирные кислоты в источники энергии („сжигание” жиров). Это витаминоподобное питательное вещество, синтезируемое в организме, которое переносит длинноцепочечные жирные кислоты в митохондрии (наши центры выработки энергии). Кроме того L-карнитин помогает сердечно-сосудистой системе и сердечной мышце, так как 2/3 энергии сердца приходит от расщепления жиров.

- Citrin K. Это экстракт плодов южноамериканской Garcinia cambogia. Он усиливает метаболизм жиров, уменьшает отложение жиров в жировых депо и помогает уменьшить еду, воздействуя на центральные структуры в гипоталамусе как центр аппетита и т.д. Citrin K ингибирует синтез жирных кислот в печени и уменьшает серьезные уровни синтезированных жиров.
- CELLFOOD® запатентованная формула. Именно этот компонент завоевал престижный Приз Клуба изобретателей в Атланте, США. Он ограничивает нарушения метаболизма на клеточном уровне, что в принципе и есть основная проблема, приводящая к ожирению, устранение которой имеет решающее значение не только в процессе самого похудения, но и для его последующей длительности.

- CELLFOOD® запатентованая формула– 250 mg
- Экстракт Garcinia cambogia — 110
- L-carnitin — 90
Количество в одной упаковке – 118 ml.
Срок хранения – 2 года с даты изготовления.
Способ хранения – при температуре до 25 ° С.
Биологически активная добавка (БАД).
Весовая/объемная концентрация в процентах Учебное пособие по химии
Ключевые понятия
⚛ Концентрация в процентах по массе/объему – это измерение концентрации раствора.
· Концентрация в процентах по массе/объему также известна как концентрация в процентах по массе/объему.
⚛ массовая/объемная концентрация в процентах обычно обозначается аббревиатурой w/v (%) или w/v% или (w/v)% или %(w/v) или %w/v
· Массовая/объемная процентная концентрация обычно обозначается аббревиатурой m/v (%) или m/v% или (m/v)% или %(m/v) или %m/v
⚛ вес./об.% (масс./об.%) — полезная мера концентрации при дозировании реагентов.
⚛ Для расчета концентрации масс./об.% (масс./об.% концентрации):
| масса/объем (%) = %(масса/объем) = | масса растворенного вещества (г) объем раствора (мл) | × 100 |
⚛ Общепринятыми единицами измерения (1) для концентрации вес/объем являются г/100 мл (граммы растворенного вещества на 100 мл раствора)
· пример: 5% (масса/объем) = 5 г/100 мл
· пример: 12%(масс. /об.) = 12 г/100 мл
/об.) = 12 г/100 мл
⚛ Измените уравнение для концентрации w/v% (m/v%), чтобы найти:
(i) масса растворенного вещества
масса (растворенное вещество) = [объем (раствор) × (вес/объем)%]/100
(ii) объем раствора
объем (раствор) = [масса (растворенное вещество)/(вес/объем)%] × 100
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Расчет концентрации в процентах по массе/объему
Концентрация в процентах по массе/объему (w/v%) или концентрация в процентах по массе/объему (m/v%) является мерой концентрации раствора.
мас./об.% или масс./об.% рассчитывается путем деления массы растворенного вещества в граммах на объем раствора в миллилитрах с последующим умножением на 100, как показано ниже.
| вес/объем (%) = | масса растворенного вещества (г) объем раствора (мл) | × 100 |
Процентная концентрация говорит нам, сколько частей растворенного вещества присутствует на 100 частей раствора. В терминах веса на объем (масса на объем) это означает, что процентная концентрация говорит нам о частях растворенного вещества по массе на 100 частей по объему раствора.
В терминах веса на объем (масса на объем) это означает, что процентная концентрация говорит нам о частях растворенного вещества по массе на 100 частей по объему раствора.
В единицах СИ концентрация w/v% (m/v%) должна быть указана в кг/100 л, но эти единицы слишком велики, чтобы быть полезными для химиков в лаборатории, граммы и миллилитры являются более удобными единицами измерения для нас. .
Напомним, что 1 кг = 1 000 г
Напомним, что 1 л = 1 000 мл
т.о. кг/100 л = 1000 г/100 000 мл = г/100 мл
, так что единицы измерения % массы/объема чаще всего указываются как г/100 мл
Таким образом, единицами концентрации w/v% (m/v%) являются граммы растворенного вещества на 100 мл раствора (г/100 мл).
Это означает, что массовая/объемная процентная концентрация (массовая/объемная процентная концентрация) может быть указана разными, но эквивалентными способами. Некоторые примеры приведены в таблице ниже:
масс. /об.% /об.% (масс./об.%) | = | г/100 мл |
|---|---|---|
| 0,5 % (вес/объем) | = | 0,5 г/100 мл |
| 1,0 %(масс./об.) | = | 1,0 г/100 мл |
| 5,25 % (вес/объем) | = | 5,25 г/100 мл |
| 12,78 %(масс./об.) | = | 12,78 г/100 мл |
| 22,75 % (вес/объем) | = | 22,75 г/100 мл |
Чтобы приготовить раствор определенной концентрации, вы взвесите твердое вещество, а затем растворите его в достаточном количестве растворителя, чтобы получился известный объем раствора. Следовательно, вы будете знать значение двух величин:
- масса растворенного вещества
- объем раствора
, который можно использовать для расчета процентной концентрации веса/объема (концентрация в процентах масса/объем).
Для расчета процентной концентрации масса/объем (массовая/объемная концентрация в процентах):
- Шаг 1: Напишите уравнение: либо масса/объем % = масса/объем × 100, либо масса/объем % = масса/объем × 100
- Шаг 2: Определите растворенное вещество и растворитель (по названию или химической формуле)
- Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
- Шаг 4: Проверьте единицы измерения на соответствие и при необходимости переведите (масса в граммах, объем в миллилитрах)
- Шаг 5: Подставьте эти значения в уравнение и решите.

- Шаг 6: Напишите ответ
Примеры обработки: масс./об.% (масс./об.%) Расчеты
Вопрос 1. Какова массовая/объемная концентрация 250 мл водного раствора хлорида натрия, содержащего 5 г NaCl?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
вес/объем (%) = (масса растворенного вещества ÷ объем раствора) × 100
Шаг 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид натрия = NaCl
Растворитель— вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (NaCl) = 5 г
объем раствора = 250 мл
Шаг 4: Проверьте единицы измерения на соответствие и при необходимости переведите (масса в граммах, объем в миллилитрах)
масса растворенного вещества (NaCl) = 5 г (преобразование единиц не требуется)
объем раствора = 250 мл (пересчет единиц измерения не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = (5 г ÷ 250 мл) × 100 = 2 г/100 мл
(Примечание: допустима только 1 значащая цифра)
Шаг 6: Напишите ответ
% масс./об. = 2 г/100 мл = 2%(масс./об.) = 2%(масс./об.)
Вопрос 2. 10,00 г BaCl 2 растворяют в 90,00 г воды.
Плотность раствора 1,090 г/мл (1,090 г/мл -1 ).
Рассчитайте массовую/объемную процентную концентрацию раствора.
Решение:
Шаг 1: Напишите уравнение: либо m/v% = m/v × 100, либо w/v% = w/v × 100
масса/объем (%) = (масса растворенного вещества ÷ объем раствора) × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид бария = BaCl 2
растворитель = вода = H 2 O (l) (это водный раствор)
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества = масса (BaCl 2 ) = 10,00 г
масса растворителя = масса (H 2 O) = 90,00 г
плотность раствора = 1,090 г/мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса растворенного вещества = масса (BaCl 2 ) = 10,00 г (преобразование единиц не требуется)
объем раствора неизвестен и должен быть рассчитан с использованием плотности раствора и масс растворенного вещества и растворителя:
плотность = масса(раствор) ÷ объем(раствор)
масса(раствор) = масса(раствор) + масса(растворитель)
масса(раствор) = 10,00 г BaCl 2 + 90,00 г воды = 100,0 г
объем(раствор) = масса(раствор) ÷ плотность(раствор)
объем (раствор) = 100,0 г ÷ 1,090 г /мл = 91,74 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
m/v (%) = (масса растворенного вещества ÷ объем раствора) × 100
м/об (%) = (10,00 г ÷ 91,74 мл) × 100
м/об (%) = 10,90 г/100 мл
(Примечание: оправданы только 4 значащие цифры)
Шаг 6: Напишите ответ
масс./об. % = 10,90 г/100 мл = 10,90 % (масс./об.) = 10,90 % (масс./об.)
↪ Наверх
Преобразование других единиц измерения в мас./об. % или масс./об. %
Наиболее распространенными единицами измерения концентрации вес./об.% (м/об.%) являются г/100 мл (граммы растворенного вещества на 100 мл раствора).
Если масса растворенного вещества не указана в граммах, вам необходимо перевести единицы измерения в граммы.
Если объем раствора не указан в миллилитрах, вам необходимо перевести единицы измерения в миллилитры.
Примеры работы: w/v% (m/v%) Расчеты, требующие преобразования единиц измерения
Вопрос 1. 2,00 л водного раствора хлорида калия содержат 45,0 г KCl.
Какова массовая/объемная концентрация этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид калия = KCl
растворитель – вода, H 2 O, так как это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса KCl = 45,0 г
объем раствора = 2,00 л
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
масса KCl = 45,0 г (масса в г, преобразование единиц измерения не требуется)
объем раствора = 2,00 л (необходимо перевести в мл)
В (раствор) = 2,00 л × 10 3 мл/ л = 2000 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
вес/объем (%) = [45,0 г ÷ 2000 мл] × 100 = 2,25 г/100 мл
(Примечание: оправданы только 3 значащие цифры)
Шаг 6: Напишите ответ
% масс./об. = 2,25 г/100 мл = 2,25 % (масс./об.) = 2,25 % (масс./об.)
Вопрос 2. 15 мл водного раствора сахарозы содержат 750 мг сахарозы.
Какова массовая/объемная концентрация этого раствора в процентах в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо m/v% = m/v × 100, либо w/v% = w/v × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = сахароза
Растворитель— вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (сахароза) = 750 мг
объем раствора = 15 мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
Масса растворенного вещества (сахароза) = 750 мг (необходимо перевести в граммы)
масса растворенного вещества = 750 мг ÷ 1000 мг /г = 0,750 г
объем раствора = 15 мл (преобразование не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
вес/объем (%) = (0,750 г ÷ 15 мл) × 100 = 5,0 г/100 мл
(Примечание: оправданы только 2 значащие цифры)
Шаг 6: Напишите ответ
масс./об.% = 5,0 г/100 мл = 5,0 % (масс./об.) = 5,0 % (масс./об.)
Вопрос 3. 186,4 л водного раствора гидроксида натрия содержит 1,15 кг NaOH.
Какова массовая/объемная концентрация этого раствора в г/100 мл?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = гидроксид натрия = NaOH
Растворитель— вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества (NaOH) = 1,15 кг
объем раствора = 186,4 л
Шаг 4: Проверить единицы измерения на соответствие и при необходимости преобразовать (масса в граммах, объем в миллилитрах) (2)
масса растворенного вещества (NaOH) = 1,15 кг (перевести единицы в г)
масса растворенного вещества (NaOH) = 1,15 кг = 1,15 кг × 1000 г/ кг = 1 150 г
= 186,4 л (перевести единицы в мл)
объем раствора = 186,4 л = 186,4 л × 1000 мл/ л = 186 400 мл
Шаг 5: Подставьте эти значения в уравнение и решите.
вес/объем (%) = [масса растворенного вещества (г) ÷ объем раствора (мл)] × 100
вес/объем (%) = (1 150 г ÷ 186 400 мл) × 100
вес/объем (%) = 0,617 г/100 мл
(Примечание: допустимы только 3 значащие цифры)
Шаг 6: Напишите ответ
% масс./об. = 0,617 г/100 мл = 0,617 % (масс./об.) = 0,617 % (масс./об.)
↪ Наверх
Расчет объема и массы реагента
В предыдущих разделах мы рассчитали концентрацию растворов в процентах по весу и объему, используя известные массу растворенного вещества и объем раствора.
Когда мы начинаем использовать этот раствор в лаборатории, мы, скорее всего, будем использовать пипетку или бюретку для подачи объема раствора.
Если мы знаем объем используемого раствора, мы можем рассчитать массу присутствующего растворенного вещества.
| масса растворенного вещества (г) = | объем раствора (мл) × масса/объем (%) 100 |
Если мы знаем массу растворенного вещества, которое хотим использовать, мы можем рассчитать объем раствора, который нам потребуется.
| объем раствора (мл) = | масса растворенного вещества (г) масса/объем (%) | × 100 |
Вопрос 1. Учащийся должен добавить в реакционный сосуд 1,22 г хлорида натрия.
Учащийся получает 11,78 г/100 мл водного раствора хлорида натрия (11,78 % масс./об.).
Какой объем этого раствора нужно добавить в реакционный сосуд?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Измените уравнение, чтобы найти объем раствора:
мас./об.% = масса растворенного вещества (г) ÷ объем раствора (мл) × 100
Умножить обе части уравнения на объем
мас./об.% × объем (мл) = (масса растворенного вещества (г) ÷ объем раствора (мл) ) × объем (мл) × 100
мас./об.% × объем (мл) = масса растворенного вещества (г) × 100
Разделите обе части уравнения на мас. /об.%
/об.%
[ мас./об.% × объем (мл)]/ мас./об.% = (масса растворенного вещества (г) × 100)/масс./об.%
| объем раствора (мл) = | масса растворенного вещества (г) масса/объем (%) | × 100 |
Этап 2: Определите растворенное вещество и растворитель (по названию или химической формуле)
растворенное вещество = хлорид натрия = NaCl
Растворитель— вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
необходимая масса растворенного вещества = масса (NaCl) = 1,22 г
концентрация NaCl (водн.) при условии = масса/объем (%) = 11,78 г/100 мл
Требуетсяобъема раствора = ? мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
необходимая масса растворенного вещества = масса (NaCl) = 1,22 г (преобразование единиц не требуется)
концентрация NaCl (водн. ) при условии = масса/объем (%) = 11,78 г/100 мл (пересчет единиц не требуется)
) при условии = масса/объем (%) = 11,78 г/100 мл (пересчет единиц не требуется)
объема раствора = ? мл
Шаг 5: Подставьте эти значения в уравнение и решите.
| объем раствора (мл) | = | масса растворенного вещества (г) масса/объем (%) | × 100 |
| = | 1,22 г 11,78 г/100 мл | × 100 | |
| = | 10,36 мл | ||
| = | 10,4 мл |
(Примечание: допустимы только 3 значащие цифры)
Шаг 6: Напишите ответ
объем раствора = 10,4 мл
Вопрос 2. Какова масса йодида калия в граммах в 14,86 мл 32,44 г/100 мл водного раствора йодида калия (32,44% масс./об.)?
Решение:
Шаг 1: Напишите уравнение: либо масса/объем% = масса/объем × 100, либо масса/объем% = масса/объем × 100
Измените уравнение, чтобы найти массу растворенного вещества:
вес/объем (%) = масса растворенного вещества (г) ÷ объем раствора (мл) × 100
Разделите обе части уравнения на 100
вес/объем (%) ÷ 100 = масса растворенного вещества (г) ÷ объем раствора (мл)
Умножить обе части уравнения на объем раствора (мл)
масса растворенного вещества (г) = (вес/объем (%) ÷ 100) × объем раствора (мл)
Этап 2: Определите растворяемое вещество и растворитель (по названию или химической формуле)
растворенное вещество = йодид калия = KCl
Растворитель — вода, H 2 O, потому что это водный раствор.
Шаг 3: Извлечение данных из вопроса (масса растворенного вещества, объем раствора)
масса растворенного вещества = масса (KI) = ? г
объем (KI (водн.) ) = 14,86 мл
концентрация раствора = мас./об.% (KI (водн.) ) = 32,44 г/100 мл
Шаг 4: Проверить единицы измерения на согласованность и при необходимости преобразовать (масса в граммах, объем в миллилитрах)
объем (KI (водн.) ) = 14,86 мл (не требуется преобразование единиц измерения)
мас./об.% (KI (водн.) ) = 32,44 г/100 мл (преобразование единиц не требуется)
Шаг 5: Подставьте эти значения в уравнение и решите.
масса растворенного вещества (г) = (масс./об.% ÷ 100) × объем раствора (мл)
масса (KI) = (32,44 ÷ 100) × 14,86 = 4,821 г
(Примечание: оправданы 4 значащие цифры)
Шаг 6: Напишите ответ
масса растворенного вещества (KI) = 4,821 г
↪ Наверх
Пример вопроса: расчеты масс.
 /об.% (масс./об.%)
/об.% (масс./об.%)Определите массу в граммах нитрата калия (KNO 3 ) в 22,65 мл 2,15% (масс./об.) водного раствора нитрата калия.
м (КНО 3 (водн.) ) = г
↪ Наверх
Сноски:
(1) Общепринятыми единицами измерения масс./об.% (масс./об.%) являются г/100 мл, но возможны и другие единицы, например, кг/100 л, мг/100 мкл.
Мы ограничим последующее обсуждение г/100 мл, но вы можете применить ту же логику и уравнения, используя другие подходящие единицы измерения.
Обратите внимание, что растворимость чаще всего указывается в виде весового отношения процентной концентрации.
(2) Вам не нужно преобразовывать эти единицы, потому что и масса, и объем даны в единицах СИ, то есть
мас./об.% = (1,15 кг/186,4 л) × 100 = 0,617 кг/100 л = 617 г/100 000 мл = 0,617 г/100 мл
, но, вероятно, лучше попрактиковаться в преобразовании единиц измерения, по крайней мере, до тех пор, пока вы полностью не поймете, что означает концентрация w/v%.
↪ Наверх
Калькулятор растворов в процентах (%) – PhysiologyWeb
Калькулятор растворов в процентах (%)
Предназначенный для использования как в учебной, так и в исследовательской лаборатории, этот калькулятор (см. процентов (%) растворов при исходном твердом или жидком материале. Очень часто концентрацию растворов выражают в процентах. Процент означает на 100 частей, где для растворов часть относится к единице измерения массы (мкг, мг, г, кг и т. д.) или объема (мкл, мл, л и т. д.). В процентных растворах количество (масса или объем) растворенного вещества выражается в процентах от общей массы или объема раствора. Процентные решения могут принимать форму вес/объем % (вес/объем % или вес/объем %), вес/вес % (вес/вес % или вес/вес %), или объем/объем % (объем/объем % или объем /v %). В каждом случае процентная концентрация рассчитывается как доля веса или объема растворенного вещества по отношению к общему весу или объему раствора.
Поскольку процентные растворы могут быть выражены тремя различными способами, необходимо явно указать тип процентного раствора. Если эта информация не предоставлена, конечному пользователю остается «угадать», использовалось ли % вес/об, % вес/вес или % объем/объем. Каждый процентный раствор подходит для ряда различных приложений. Например, коммерческие водные реагенты, такие как концентрированные кислоты и основания, обычно выражают в виде растворов в процентах по массе. Например, коммерчески доступная концентрированная соляная кислота (HCl) составляет 37% по весу (мас./мас.%). С другой стороны, многие разбавленные растворы, используемые для биологических исследований, выражаются в % массы/объема (например, 1% додецилсульфат натрия, SDS). Объемные/объемные % растворенных веществ также распространены и используются, когда используются чистые растворенные вещества в жидкой форме. Например, 70 % (об./об.) раствор этанола можно приготовить путем растворения 70 мл 100 % (т. е. пробы 200) этанола в общем объеме раствора 100 мл.
При выборе типа процентного раствора для приготовления могут иметь значение и другие факторы. Например, если рассматриваемый процентный раствор должен использоваться при самых разных температурах, то лучше приготовить раствор в виде раствора в процентах по массе, поскольку его концентрация не зависит от изменений температуры окружающей среды.
Важное примечание. Здесь мы использовали «вес» вместо «масса» просто для того, чтобы соответствовать традиции и популярному использованию. Таким образом, 9Растворы 0157 вес/объем % должны правильно называться вес/объем % . Аналогично, растворы масс./масс.% следует обозначать как масс./масс.% или просто масс.% .
Если вы хотите выполнить расчеты разведения для растворов с молярностью или процентной концентрацией, используйте наш Калькулятор разбавления – молярность, проценты.
Если вы хотите выполнить фактор разбавления или кратное разведение для расчетов растворов с молярностью или процентной концентрацией, используйте наш Калькулятор коэффициента разбавления – молярность, проценты.
Уравнения с процентным решением
| (уравнение 1) | |
| (уравнение 2) | |
| (уравнение 3) |
Как отмечалось выше, вес относится к массе (т. е. измеренной на весах). При изучении уравнения для каждого из приведенных выше процентных растворов очень важно отметить, что во всех случаях знаменатель относится к массе или объему раствора , а не только к массе или объему растворителя. Таким образом, масса раствора представляет собой объединенную массу растворенного вещества и растворителя, а объем раствора представляет собой объединенный объем растворенного вещества и растворителя.
Последнее примечание необходимо при рассмотрении объемных/объемных % растворов. Когда разные объемы идентичного раствора добавляются вместе, конечный объем всегда будет в точности равен сумме добавленных отдельных порций. Например, добавление 50 мл воды к 50 мл воды даст общий объем 100 мл, а добавление 75 мл 100% этанола к 75 мл 100% этанола даст общий объем 150 мл. Однако при смешивании смешивающихся жидкостей (например, воды и этанола) конечный объем раствора не совсем равен сумме отдельных объемов. Например, при добавлении 50 мл этанола к 50 мл воды общий объем будет меньше 100 мл. на самом деле ближе к 96 мл. Поэтому при приготовлении растворов объем/объем в процентах всегда лучше растворить растворенное вещество в растворителе, а затем добавить дополнительное количество растворителя, чтобы довести общий объем раствора до желаемого конечного значения.
Когда разные объемы идентичного раствора добавляются вместе, конечный объем всегда будет в точности равен сумме добавленных отдельных порций. Например, добавление 50 мл воды к 50 мл воды даст общий объем 100 мл, а добавление 75 мл 100% этанола к 75 мл 100% этанола даст общий объем 150 мл. Однако при смешивании смешивающихся жидкостей (например, воды и этанола) конечный объем раствора не совсем равен сумме отдельных объемов. Например, при добавлении 50 мл этанола к 50 мл воды общий объем будет меньше 100 мл. на самом деле ближе к 96 мл. Поэтому при приготовлении растворов объем/объем в процентах всегда лучше растворить растворенное вещество в растворителе, а затем добавить дополнительное количество растворителя, чтобы довести общий объем раствора до желаемого конечного значения.
Калькулятор процентного решения
Каждая показанная ниже ячейка калькулятора соответствует члену в приведенной выше формуле. Введите соответствующие значения во все ячейки, кроме той, которую вы хотите рассчитать.