Основания (химия, 8 класс) – формулы и свойства реакций
4.5
Средняя оценка: 4.5
Всего получено оценок: 2129.
4.5
Средняя оценка: 4.5
Всего получено оценок: 2129.
Один из классов сложных неорганических веществ – основания. Это соединения, включающие атомы металла и гидроксильную группу, которая может отщепляться при взаимодействии с другими веществами.
Строение
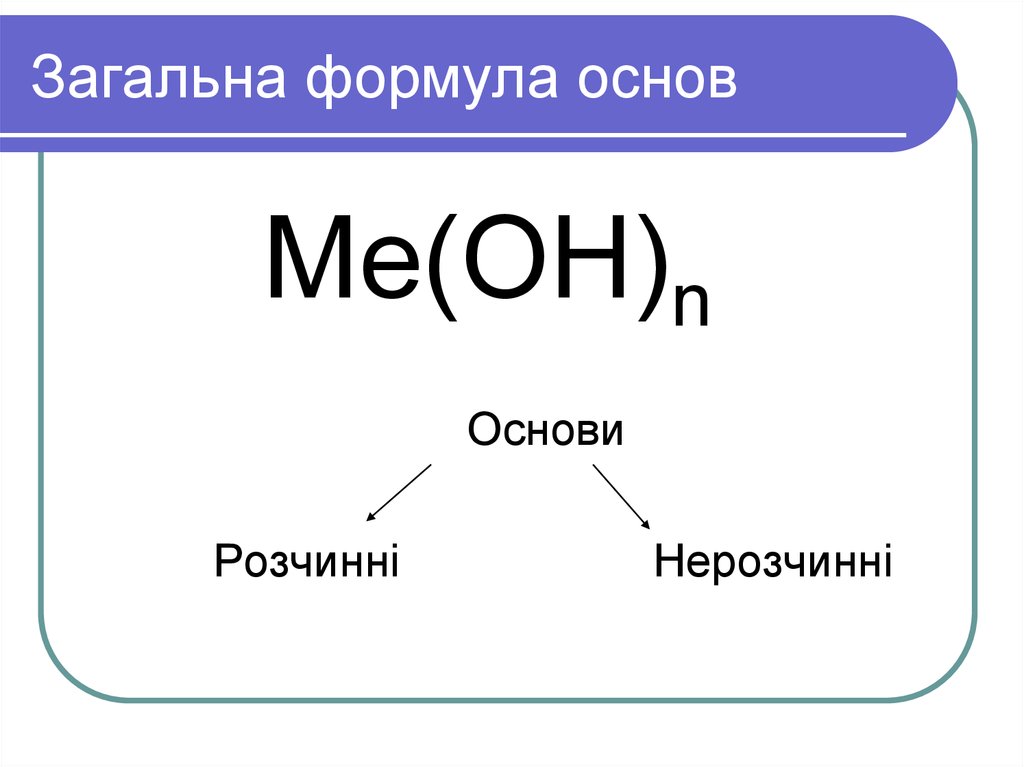
Основания могут содержать одну или несколько гидроксо-групп. Общая формула оснований – Ме(ОН)х. Атом металла всегда один, а количество гидроксильных групп зависит от валентности металла. При этом валентность группы ОН всегда I. Например, в соединении NaOH валентность натрия равна I, следовательно, присутствует одна гидроксильная группа. В основании Mg(OH)2 валентность магния – II, Al(OH)3 валентность алюминия – III.
Количество гидроксильных групп может меняться в соединениях с металлами с переменной валентностью. Например, Fe(OH)2 и Fe(OH)3.
Физические свойства
Характеристика и активность основания зависит от металла. Большинство оснований – твёрдые вещества белого цвета без запаха. Однако некоторые металлы придают веществу характерную окраску. Например, CuOH имеет жёлтый цвет, Ni(OH)2 – светло-зелёный, Fe(OH)3 – красно-коричневый.
Рис. 1. Щёлочи в твёрдом состоянии.Виды
Основания классифицируются по двум признакам:
- по количеству групп ОН – однокислотные и многокислотные;
- по растворимости в воде – щёлочи (растворимые) и нерастворимые.
Щёлочи образуются щелочными металлами – литием (Li), натрием (Na), калием (K), рубидием (Rb) и цезием (Cs).
- LiOH;
- NaOH;
- KOH;
- RbOH;
- CsOH;
- Ca(OH)2;
- Sr(OH)2;
- Ba(OH)2.

Все остальные основания, например, Mg(OH)2, Cu(OH)2, Al(OH)3, относятся к нерастворимым.
По-другому щёлочи называются сильными основаниями, а нерастворимые – слабыми основаниями. При электролитической диссоциации щёлочи быстро отдают гидроксильную группу и быстрее вступают в реакцию с другими веществами. Нерастворимые или слабые основания менее активные, т.к. не отдают гидроксильную группу.
Особое место в систематизации неорганических веществ занимают амфотерные гидроксиды. Они взаимодействуют и с кислотами, и с основаниями, т.е. в зависимости от условий ведут себя как щёлочь или как кислота. К ним относятся Zn(OH)2, Al(OH)3, Pb(OH)2, Cr(OH)3, Be(OH)2 и другие основания.
Получение
Основания получают различными способами. Самый простой – взаимодействие металла с водой:
Ba + 2H2O → Ba(OH)2 + H2.
Щёлочи получают в результате взаимодействия оксида с водой:
Na2O + H2O → 2NaOH.
Нерастворимые основания получаются в результате взаимодействия щелочей с солями:
CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4.
Химические свойства
Основные химические свойства оснований описаны в таблице.
Реакции | Что образуется | Примеры |
С кислотами | Соль и вода. Нерастворимые основания взаимодействуют только с растворимыми кислотами | Cu(OH)2↓ + H2SO4 → CuSO4 +2H2O |
Разложение при высокой температуре | Оксид металла и вода | 2Fe(OH)3 → Fe2O3 + 3H2O |
С кислотными оксидами (реагируют щёлочи) | Соль | NaOH + CO2 → NaHCO3 |
Соль и водород | 2NaOH + Si + H2O → Na2SiO3 +H2↑ | |
Обмена с солями | Гидроксид и соль | Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4↓ |
Щелочей с некоторыми металлами | Сложная соль и водород | 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ |
С помощью индикатора проводится тест на определение класса основания.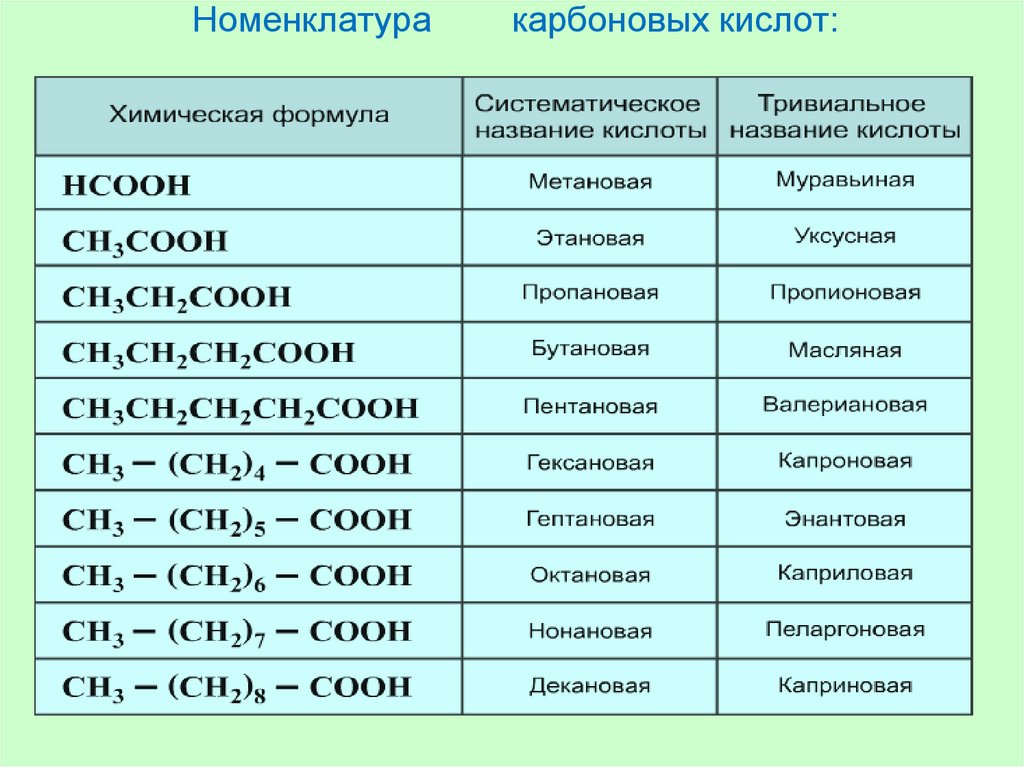
Что мы узнали?
Из урока 8 класса химии узнали об особенностях, классификации и взаимодействии оснований с другими веществами. Основания – сложные вещества, состоящие из металла и гидроксильной группы ОН. Они делятся на растворимые или щёлочи и нерастворимые. Щёлочи – более агрессивные основания, быстро реагирующие с другими веществами. Основания получают при взаимодействии металла или оксида металла с водой, а также в результате реакции соли и щёлочи. Основания реагируют с кислотами, оксидами, солями, металлами и неметаллами, а также разлагаются при высокой температуре.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Еркежан Рысова
10/10
Александр Котков
10/10
Мишлен Громов
10/10
Вика Мартынова
10/10
Ольга Хромцова
10/10
Лилия Швец
10/10
Наталья Чернова
10/10
Максим Макеев
10/10
Сергей Ефремов
8/10
Оля Вернер
9/10
Оценка доклада
4.
Средняя оценка: 4.5
Всего получено оценок: 2129.
А какая ваша оценка?
Трапеция. Формулы, признаки и свойства трапеции
Навигация по странице: Определение трапеции Элементы трапеции Виды трапеций Основные свойства трапеции Стороны трапеции Средняя линия трапеции Высота трапеции Диагонали трапеции Площадь трапеции Периметр трапеции Окружность описанная вокруг трапеции Окружность вписанная в трапецию Другие отрезки трапеции
Определение.
Трапеция — это четырехугольник, у которого две стороны параллельны, а две другие стороны не параллельны.
Параллельные стороны называются основами трапеции, а две другие боковыми сторонами
Так же, трапецией называется четырехугольник, у которого одна пара противоположных сторон параллельна, и стороны не равны между собой.
Элементы трапеции:
- Основы трапеции – параллельные стороны
- Боковые стороны – две другие стороны
- Средняя линия – отрезок, соединяющий середины боковых сторон.

Виды трапеций:
- Равнобедренная трапеция – трапеция, у которой боковые стороны равны
- Прямоугольная трапеция – трапеция, у которой одна из боковых сторон перпендикулярна основам
| Рис.1 | Рис.2 |
Основные свойства трапеции
1. В трапецию можно вписать окружность, если сумма длин оснований равна сумме длин боковых сторон:
AB + CD = BC + AD
2. Средняя линия трапеции разделяет пополам любой отрезок, который соединяет основы, так же делит диагонали пополам:
AK = KB, AM = MC, BN = ND, CL = LD
3. Средняя линия трапеции параллельна основаниям и равна их полусумме:
| m = | a + b |
| 2 |
4. Точка пересечения диагоналей трапеции и середины оснований лежат на одной прямой.
Точка пересечения диагоналей трапеции и середины оснований лежат на одной прямой.
5. В трапеции её боковая сторона видна из центра вписанной окружности под углом 90°.
6. Каждая диагональ в точке пересечения делится на две части с таким соотношением длины, как соотношение между основаниями:
BC : AD = OC : AO = OB : DO
7. Диагонали трапеции d1
d12 + d22 = 2ab + c2 + d2
Сторона трапеции
Формулы определения длин сторон трапеции:
1. Формула длины оснований трапеции через среднюю линию и другую основу:
a = 2m – b
b = 2m – a
2. Формулы длины основ через высоту и углы при нижнем основании:
a = b + h · (ctg α + ctg β)
b = a – h · (ctg α + ctg β)
3. Формулы длины основ через боковые стороны и углы при нижнем основании:
Формулы длины основ через боковые стороны и углы при нижнем основании:
a = b + c·cos α + d·cos β
b = a – c·cos α – d·cos β
4. Формулы боковых сторон через высоту и углы при нижнем основании:
| с = | h | d = | h |
| sin α | sin β |
Средняя линия трапеции
Определение.
Средняя линия – отрезок, соединяющий середины боковых сторон трапеции.
Формулы определения длины средней линии трапеции:
1. Формула определения длины средней линии через длины оснований:
| m = | a + b | |
| 2 |
2. Формула определения длины средней линии через площадь и высоту:
| m = | S |
| h |
Высота трапеции
Формулы определения длины высоты трапеции:
1. Формула высоты через сторону и прилегающий угол при основании:
Формула высоты через сторону и прилегающий угол при основании:
h = c·sin α = d·sin β
2. Формула высоты через диагонали и углы между ними:
| h = | sin γ · | d1 d2 | = | sin δ · | d1 d2 |
| a + b | a + b |
3. Формула высоты через диагонали, углы между ними и среднюю линию:
| h = | sin γ · | d1 d2 | = | sin δ · | d1 d2 |
| 2m | 2m |
4. Формула высоты трапеции через площадь и длины оснований:
| h = | 2S |
| a + b |
5. Формула высоты трапеции через площадь и длину средней линии:
| h = | S |
| m |
Диагонали трапеции
Формулы определения длины диагоналей трапеции:
1. Формулы диагоналей по теореме косинусов:
Формулы диагоналей по теореме косинусов:
d1 = √a2 + d2 – 2ad·cos β
d2 = √a2 + c2 – 2ac·cos α
2. Формулы диагоналей через четыре стороны:
| d1 = | √ | d 2 + ab – | a(d 2 – c2) |
| a – b |
| d2 = | √ | c2 + ab – | a(c2 – d 2) | a – b |
3. Формула длины диагоналей через высоту:
d1 = √h2 + (a – h · ctg β)2 = √h2 + (b + h · ctg α)2
d2 = √h2 + (a – h · ctg α)2 = √h2 + (b + h · ctg β)2
4. Формулы длины диагонали через сумму квадратов диагоналей:
d1 = √c2 + d 2 + 2ab – d22
d2 = √c2 + d 2 + 2ab – d12
Площадь трапеции
Формулы определения площади трапеции:
1. Формула площади через основания и высоту:
Формула площади через основания и высоту:
| S = | (a + b) | · h |
| 2 |
2. Формула площади через среднюю линию и высоту:
S = m · h
3. Формула площади через диагонали и угол между ними:
| S = | d1d2 | · sin γ | = | d1d2 | · sin δ |
| 2 | 2 |
4. Формула площади через четыре стороны:
| S = | a + b | √ | c2 – | ( | (a – b)2 + c2 – d 2 | ) | 2 |
| 2 | 2(a – b) |
5. Формула Герона для трапеции
| S = | a + b | √(p – a)(p – b)(p – a – c)(p – a – d) |
| |a – b| |
| p = | a + b + c + d | – полупериметр трапеции. |
| 2 |
Периметр трапеции
Формула определения периметра трапеции:
1. Формула периметра через основания:
P = a + b + c + d
Окружность описанная вокруг трапеции
Окружность можно описать только вокруг равнобедренной трапеции!!!
Формула определения радиуса описанной вокруг трапеции окружности:
1. Формула радиуса через стороны и диагональ:
| R = | a·c·d1 |
| 4√p(p – a)(p – c)(p – d1) |
где
| p = | a + c + d1 |
| 2 |
a – большее основание
Окружность вписанная в трапецию
В трапецию можно вписать окружность, если сумма длин оснований равна сумме длин боковых сторон:
a + b = c + d
Формула определения радиуса вписанной в трапецию окружности
1. Формула радиуса вписанной окружности через высоту:
Формула радиуса вписанной окружности через высоту:
| r = | h |
| 2 |
Другие отрезки разносторонней трапеции
Формулы определения длин отрезков проходящих через трапецию:
1. Формула определения длин отрезков проходящих через трапецию:
| KM = NL = | b | KN = ML = | a | TO = OQ = | a · b |
| 2 | 2 | a + b |
Все таблицы и формулы
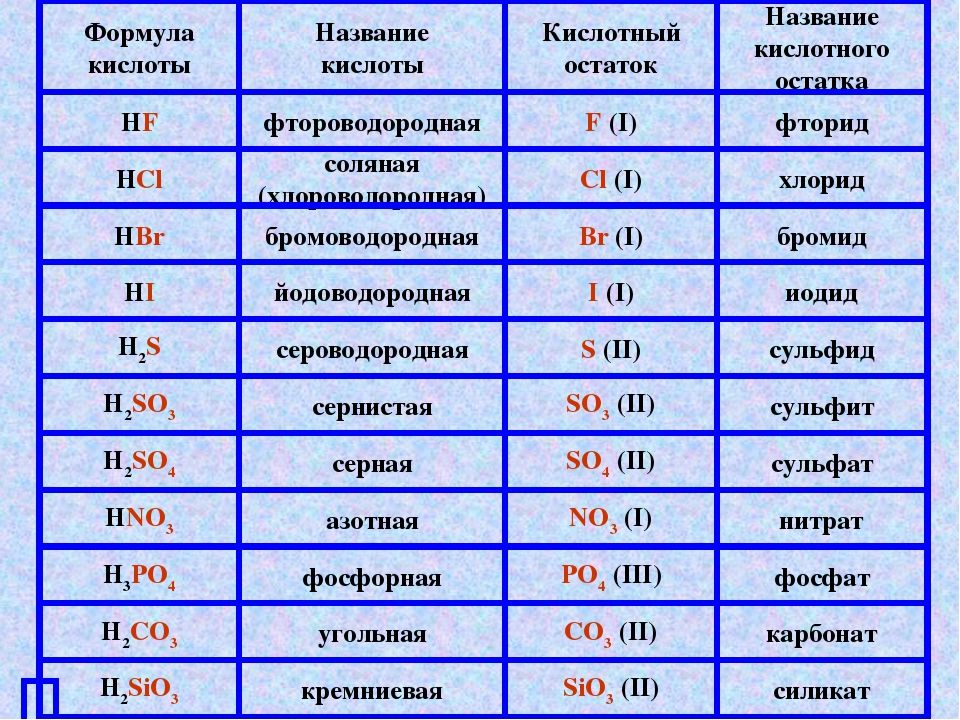
7.4: Названия и формулы оснований
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 310241
Основания
Основание можно просто определить как ионное соединение, производящее 9-}\) анион, названия оснований оканчиваются на гидроксид .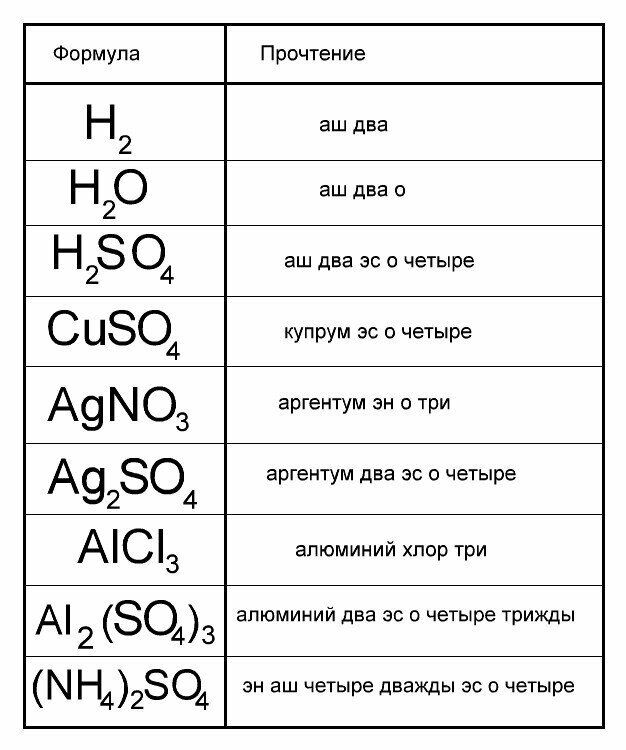 Катион просто назван первым. Некоторые примеры названий и формул для оснований показаны в таблице ниже.
Катион просто назван первым. Некоторые примеры названий и формул для оснований показаны в таблице ниже.
| Таблица \(\PageIndex{1}\) | |
| Формула | Имя |
| \(\ce{NaOH}\) | гидроксид натрия |
| \(\ce{Ca(OH)_2}\) | гидроксид кальция |
| \(\ce{NH_4OH}\) | гидроксид аммония |
| НХ 3 | аммиак |
| Fe(OH) 2 | Гидроксид железа(II) или гидроксид железа |
| Fe(OH) 3 | Гидроксид железа(III) или гидроксид железа |
Обратите внимание: поскольку гидроксиды являются ионными соединениями, количество гидроксидов в формуле не влияет на название. -}\) для балансировки заряда, поэтому формула \(\ce{Ca (ОН)_2}\). Ион гидроксида является многоатомным ионом и должен быть заключен в круглые скобки, если в формуле их несколько.
-}\) для балансировки заряда, поэтому формула \(\ce{Ca (ОН)_2}\). Ион гидроксида является многоатомным ионом и должен быть заключен в круглые скобки, если в формуле их несколько.
Концентрированные водные растворы аммиака (NH 3 ) содержат значительное количество гидроксид-иона, хотя растворенное вещество не является в основном гидроксидом аммония (NH 4 OH), как часто указывается на этикетке. Таким образом, водный раствор аммиака также является обычным основанием.
Для переходных металлов возможно наличие более одного катиона. В этом случае название гидроксида включает заряд катиона римскими цифрами и скобками. Например, железо может образовывать два возможных катиона: Fe 2 + или Fe 3 +, и, следовательно, возможны два гидроксида: гидроксид железа(II) с формулой Fe(OH) 2, или гидроксид железа(III) с формулой Fe(OH) 3 . В качестве альтернативы, классическая система номенклатуры использует коренное название металла на латыни плюс окончание -ous для обозначения минимально возможного заряда и окончание -ic для обозначения максимально возможного заряда. В этой системе Fe(OH) 2 и Fe(OH) 3 называются гидроксидом железа и гидроксидом железа соответственно.
В этой системе Fe(OH) 2 и Fe(OH) 3 называются гидроксидом железа и гидроксидом железа соответственно.
Резюме
- Основания представляют собой ионные соединения, образующие гидроксид-ионы при растворении в воде.
- Катион назван первым, за ним следует гидроксид . Если возможно более одного катиона, заряд иона должен быть указан римскими цифрами.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- источник@https://flexbooks.ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник[1]-chem-53727
- источник[2]-chem-53727
Bases — Учебное пособие по именованию и формулам
Инструменты Creator скоро будут вдохновлять!
Присоединяйтесь к списку рассылки, чтобы узнать, когда мы запустимся.
Химия.
Общая химия.
ВВЕДЕНИЕ:
Что такое основание в химии? Основные соединения принимают протоны, отдают электроны или выделяют ионы гидроксида в водной фазе. Они нейтрализуют кислоты, образуя соли и воду, когда реагируют с ионами водорода. «Щелочь» — это термин, обозначающий основание, которое растворяется в воде. Основания играют важную роль в нашей повседневной жизни. Пищевая сода — это слабое основание, распространенное в нашем домашнем хозяйстве, тогда как чистящие средства для канализации являются примерами сильных оснований.
Основания играют важную роль в нашей повседневной жизни. Пищевая сода — это слабое основание, распространенное в нашем домашнем хозяйстве, тогда как чистящие средства для канализации являются примерами сильных оснований.
Источник
ЧТО ТАКОЕ БАЗА?
- Основание представляет собой ионное соединение, которое при растворении в воде образует гидроксид-ионы.
- Базы горькие и скользкие.
- Они имеют рН выше 7.
НОМЕНКЛАТУРА ОСНОВАНИЙ:
- Гидроксид, многоатомный ион (ковалентно связанный набор из двух или более атомов), содержится в самых сильных основаниях. В результате сильные основания называются в соответствии с правилами наименования ионных соединений.
- Например, гидроксид натрия — это NaOH, гидроксид калия — это KOH, а гидроксид кальция — это Ca(OH)₂.
- Схема ионной номенклатуры также используется для обозначения слабых оснований, состоящих из ионных соединений.
- Гидроксид аммония, например, представляет собой NH₄OH.

- Из-за ковалентных связей слабые основания часто называют молекулярными или органическими соединениями. В результате им даются имена, соответствующие рекомендациям по именованию молекулярных или химических соединений.
ПРИМЕРЫ ПОВСЕДНЕВНЫХ ОСНОВ
ОСНОВЫ АРРЕНИУСА
Они производят ионы гидроксида, которые повышают содержание гидроксида в воде. Основания Аррениуса можно найти в различных изделиях, в том числе:
- Очиститель стоков
- Моющее средство для стирки
- Консистентная смазка
- Щелочные батареи
- Мыло и банные принадлежности
- Пищевая сода
ОСНОВАНИЯ БРЕНСТЕД-ЛОУРИ
Основания Бренстеда-Лоури — это основания, принимающие протоны от других молекул. Основания Бренстеда-Лоури можно найти в следующих товарах:
- Щелочные батареи с аммиаком
- Жидкость для полоскания рта
- Обезболивающие, наносимые на кожу
- Жевательная резинка
- Обивка для мебели
ОСНОВАНИЯ ЛЬЮИСА
Основания Льюиса отдают электронные пары, тогда как кислоты Льюиса являются соединениями, принимающими электроны. Вот несколько примеров баз.
Вот несколько примеров баз.
- Алкоголь
- Краска для волос
- Табачный дым
- Пестициды
- Гипс
- Английская соль
Источник
ВЫВОД:
- Основание представляет собой ионное соединение, которое при растворении в воде образует гидроксид-ионы.
- Все основания имеют в качестве анионов ионы гидроксида (ОН-), поэтому их названия оканчиваются на гидроксид. Катионы — это просто название другого вовлеченного соединения.
- Базы горькие и скользкие. Они имеют pH больше 7,9.0010
- Вот несколько основ вашей повседневной жизни. Стиральные порошки, средство для слива, мыло для купания, пищевая сода, зубная паста, жидкость для полоскания рта, чистящее средство для духовки.
Часто задаваемые вопросы:
1. Как вы называете и пишете химические формулы оснований?
Особой системы наименования базы не существует. Все они содержат ионы гидроксида (ОН-) в качестве анионов, поэтому их названия заканчиваются на гидроксид.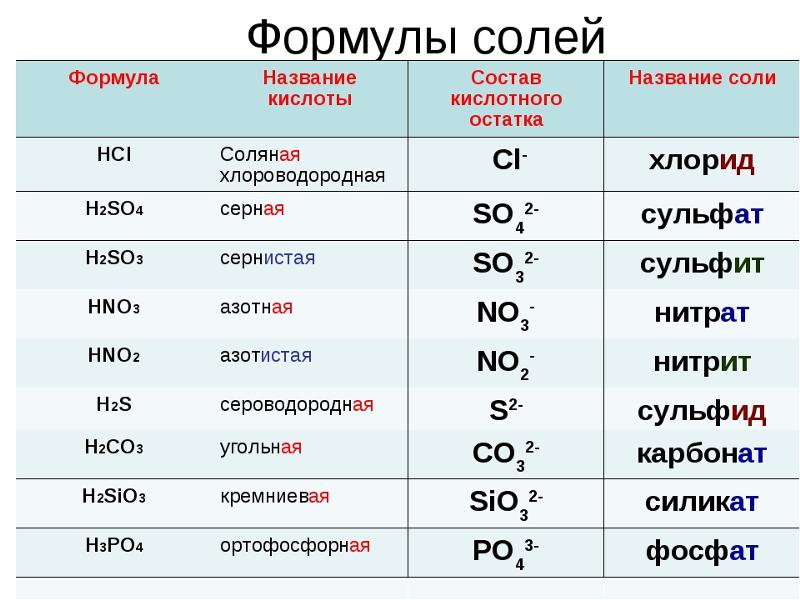 Катионы — это просто название другого вовлеченного соединения.
Катионы — это просто название другого вовлеченного соединения.
Например, гидроксид натрия – NaOH гидроксид аммония – NH₄OH Гидроксид магния – Mg(OH)₂
2. Что такое 10 общих домохозяйств?
Так много домашних баз. Вот некоторые из них:
- Пищевая сода
- Моющее средство
- Жидкость для полоскания рта
- Мыло для купания
- Жевательная резинка
- Зубная паста
- Средство для чистки духовки
- Очиститель канализации
- Отбеливатель
- Цемент
Мы надеемся, что вам понравился этот урок, и вы узнали что-то интересное о Базовое наименование и формулы ! Присоединяйтесь к нашему сообществу Discord, чтобы получить ответы на любые вопросы и пообщаться с другими студентами, такими же, как и вы! Не забудьте загрузить наше приложение, чтобы испытать наши веселые классы виртуальной реальности – мы обещаем, это делает учебу намного веселее! 😎
ИСТОЧНИКИ:
- 10 общедомовых баз https://www.