Agrafima.ru | Химия — жизнь!
Как молодой специалист подала заявку на конкурс «Профессиональный дебют». Участникам предлагалось написать эссе «Проблемы современного школьного образования и пути их решения». Меня, как учителя, очень волнует эта тема, поэтому я была рада высказать своё личное мнение по этому поводу. И вот что из этого получилось.
Дневник учителя химии.
«Проблемы современного школьного образования и пути их решения»
В нашей стране нет такого человека, которого в той или иной степени не волновали бы проблемы современного школьного образования. Ведь каждый из нас в прошлом, настоящем или будущем ученик, выпускник, родитель, учитель. А от того, насколько удачно будут решаться задачи, стоящие сегодня перед школой, зависит будущее государства.
Главное в школе – учитель. Столкнулась с проблемами в школьном образовании еще в университете. На химическом факультете были и юные Менделеевы, и те, кто пришел получить хоть какое-то высшее образование.
Металлы состоят из железа? Университет закончила с твердой уверенностью учить детей. В первой же школе мне отказали в предоставлении работы. Недолго думая, устроилась в юридический техникум. Преподавала студентам из разных городов, сел, деревень края естественнонаучные дисциплины. В первом же семестре дети ввергли меня в шок. Оказывается, все металлы состоят из железа, атомы из молекул, а в Солнечной системе всего три планеты – Земля, Луна и Солнце. Попыталась решить эту проблему в масштабах 60 человек.
Электронная школа. Наконец я добралась до школы. Чистые кабинеты, красивые плакаты, доброжелательный директор, умные дети. Думала, попала в рай. Сразу же начала осваивать интерактивную доску. Сколько всего она умеет, просто чудо! Другие же учителя используют доску в качестве монитора, или еще хуже: стенда для приклеивания плакатов. Кроме этого, многие работники образовательной сферы не знают, как запустить ту или иную программу на компьютере, а учителей информатики на всех не хватает. Поэтому бурю негодований вызвал перевод компьютеров школ на свободное программное обеспечение Linux. Это всё говорит об отсутствии в школах специалистов в области информационных технологий, в обязанности которых входило бы и обучение учителей.
Родитель – первый воспитатель, а учитель – второй.
 Возникает вопрос: а кому тогда нужна школа, если не детям? Учителям? Иногда приходят папы и обещают выпороть ребенка за плохое поведение или плохую оценку, что тоже неправильно. Родители не понимают своей роли в воспитании и обучении детей. Как учителя повышают свою квалификацию, так и родители должны проходить определенные курсы по правильному мотивированию школьников к изучению мира. Конечно, радуют адекватные папы и мамы, которые беспокоятся за будущее своих детей.
Возникает вопрос: а кому тогда нужна школа, если не детям? Учителям? Иногда приходят папы и обещают выпороть ребенка за плохое поведение или плохую оценку, что тоже неправильно. Родители не понимают своей роли в воспитании и обучении детей. Как учителя повышают свою квалификацию, так и родители должны проходить определенные курсы по правильному мотивированию школьников к изучению мира. Конечно, радуют адекватные папы и мамы, которые беспокоятся за будущее своих детей.Все дороги ведут к финансам. Сколько бы проблем школьного образования я не вспомнила — и попустительское отношение учителей к обучению, и нехватка опыта работы сотрудников школы с компьютером, и недостаточно развитая материальная база образовательного учреждения, и нежелание молодых специалистов работать в школе – всё ведет к главной проблеме: недостаточное финансирование. Здесь, увы, ни директор, ни учителя сделать ничего не в силах…
И всё же, за время, проведенное в школе, я и мои ученики стали настоящей семьей, а вместе мы преодолеем любые проблемы!
Вывод химических формул | Задачи 99
Задача 99.
Найти простейшую формулу вещества, содержащего (по массе) 43,4% натрия, 11,3% углерода и 45,3% кислорода.
Решение:
Обозначим числа атомов натрия, углерода и кислорода в простейшей формуле вещества соответственно через x, y и z. Атомные массы этих элементов равны соответственно 23, 12 и 16. Поэтому массы натрия, углерода и кислорода в составе вещества относятся как 23х : 12у : 16z. По условию задачи это отношение имеет вид: 43,4 : 11,3 : 45,3. Следовательно: 23х : 12у : 16z = 43,4 : 11,3 : 45,3.
Откуда
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
Таким образом, простейшая формула вещества NaxCyOz будет иметь вид: Na2CO3.
Ответ: Na2CO3.
Задача 100.
Найти простейшую формулу вещества, в состав которого входят водород, углерод, кислород и азот в соотношении масс 1 : З : 4 : 7.
Решение:
Обозначим числа атомов водорода, углерода, кислорода и азота в простейшей формуле вещества соответственно через x, y, z. Атомные массы этих элементов равны соответственно 1, 12, 16 14. Поэтому массы водорода, углерода, кислорода и азота в составе вещества относятся как 1
Тогда
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
Таким образом, простейшая формула вещества HxCyOzNa будет иметь вид: H4CON4 или COH4N4.
Ответ: COH4N4
Задачи 101.
Найти простейшую формулу оксида ванадия, зная, что 2,73г оксида содержат 1,53г металла.
Решение:
Вариант I.
Находим процентное содержание ванадия в его оксиде из пропорции:
Тогда процентное содержание кислорода составляет; 100 – 56,04 = 43,96%.
Обозначим числа атомов ванадия и кислорода в простейшей формуле оксида соответственно через x и y. Атомные массы этих элементов равны соответственно 50,94 и 16. По-этому массы ванадия и кислорода в составе оксида относятся как 50,94
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
Таким образом, простейшая формула оксида ванадия имеет вид; V2O5.
Ответ: V2O5.
Вариант II.
Решение:
Находим массу кислорода в оксиде ванадия: m(O) 2,73 – 1,53 = 1,2г.
Обозначим числа атомов ванадия и кислорода в простейшей формуле оксида соответственно через
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
Таким образом, простейшая формула оксида ванадия имеет вид; V2O5.
Ответ :V2O5.
Задача 102.
Вещество содержит (по массе) 26,53% калия, 35,37% хрома и 38,10% кислорода. Найти его простейшую формулу.
Обозначим числа атомов калия, хрома и кислорода в простейшей формуле вещества через x, y и z.
 Атомные массы этих элементов равны соответственно 39, 52 и 16. Поэтому массы калия, хрома и кислорода в составе вещества относятся как 39x : 52y : 16z. По условию задачи это отношение равно 26,53 : 35,37 : 38,10. Следовательно:
Атомные массы этих элементов равны соответственно 39, 52 и 16. Поэтому массы калия, хрома и кислорода в составе вещества относятся как 39x : 52y : 16z. По условию задачи это отношение равно 26,53 : 35,37 : 38,10. Следовательно:Чтобы выразить полученное отношение целыми числами, разделим три его члена на наименьший из них:
а затем умножим три члена последнего отношения на 2, получим:
x : y = (1 .
Таким образом, простейшая формула вещества имеет вид: K2Cr2O7.
Ответ: K2Cr2O7.
Задача 103.
Найти формулу кристаллогидрата хлорида бария, зная, что 36,6г соли при прокаливании теряют в массе 5,4г.
Решение:
Молекулярные массы хлорида бария и воды соответственно равны 208, 236 и 18г/моль.
Находим массу хлорида бария в кристалле:
Обозначим числа молекул хлорида бария и воды в кристаллогидрате хлорида бария соответственно через z и y, получим формулу xBaCl2. yH2O. Массы молекул хлорида бария и воды в составе кристаллогидрата относятся как 208,236x : 18y. По условию задачи это отношение равно 31,2 : 5,4. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим два его члена на наименьший из них:
Таким образом, простейшая формула кристаллогидрата (xBaCl2 . yH2O) будет иметь вид: BaCl2. 2H2O.
Ответ: BaCl2 . 2H2O.
Задача 104.
Найти молекулярную формулу масляной кислоты, содержащей (по массе) 54,5% углерода, 36,4% кислорода и 9,1% водорода, зная, что плотность ее паров по водороду равна 44.
Решение:
Обозначим числа атомов углерода, кислорода и водорода в простейшей формуле масляной кислоты через x, y и z. Атомные массы этих элементов равны соответственно 12, 16 и 1. Поэтому массы калия, кислорода и водорода в составе вещества относятся как 12x : 16y : 1z. По условию задачи это отношение равно 54,5 : 36,4 : 9,1. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим три его члена на наименьший из них:
Обозначим формулу масляной кислоты как CxOyHz, тогда простейшая формула будет иметь вид: C2OH4. Этой формуле отвечает молекулярная масса 44. Истинную молекулярную массу кислоты находим исходя из её плотности по водороду:
Таким образом, истинная молекулярная масса кислоты отличается от вычисленной молекулярной массы по её простейшей формуле. Вычислим множитель (n), на который следует умножить значения всех трёх членов коэффициентов в простейшей формуле кислоты, разделив значение MCxOyHz на значение MC2OH4:
Тогда
x : y : z = (2 . 2) : (2 .1) : (2 . 4) = 4 : 2 : 8. .
2) : (2 .1) : (2 . 4) = 4 : 2 : 8. .
Следовательно, истинная молекулярная формула масляной кислоты будет иметь вид: C4O2H8.
Ответ: C4O2H8.
Задача 105.
Найти молекулярную формулу вещества, содержащего (по массе) 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
Решение:
Молекулярная масса воздуха равна 29 г/моль.
Обозначим числа атомов углерода и водорода в простейшей формуле вещества через x, y. Атомные массы этих элементов равны соответственно 12 и 1. Поэтому массы углерода и водорода в составе вещества относятся как 12x : 1y. По условию задачи это отношение равно 93,75 : 6,25. Следовательно:
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
а затем умножим оба члена последнего отношения на 4, получим:
x : y = (1,25 . 4) : (1 . 4) = 5 : 4.
4) : (1 . 4) = 5 : 4.
Простейшая формула вещества имеет вид: C5H4. Этой формуле отвечает молекулярная масса, равная 64 [M(С5H4) = (5 .12) .(4 . 1) = 64)]. Истинную молекулярную массу вещества находим исходя из его плотности по воздуху:
M(CxHy) = D . M(Возд.) = 4,41 .29 = 128
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
Теперь найденные значения x и y умножаем на 2, получаем: nCxHy = C10H8.
Истинная формула вещества будет иметь вид: C10H8.
Ответ: : C10H8.
Секретная шпаргалка по химии. 5.1. Вывод формулы вещества по общей формуле класса | Репетитор Богунова В.Г.
Уже который день моя статья “Тайны задач по химии? 1. Препарируем задачу ЕГЭ” вызывает нервные тики у вполне спокойных и уверенных в себе учителей. Не так они представляют себе решение задач. Им нужно, чтобы все было запутано и мало понятно, а на вопрос ученика: “Как решить задачу?” учитель, сделав умные глаза, отвечал бы: “Думай”. А чем думать? Как думать? Куда думать? В какую сторону? Сие есть тайна великая! Однако, все тайное становится явным на вскрытии задач ЕГЭ. Вот и моя статья показала, какие приколы (фишки) для ЕГЭ по химии могут приготовить нашим детям сотрудники ФИПИ.
35-е задание ЕГЭ по химии (Задачи на нахождение формулы вещества) – одно из самых интересных заданий ЕГЭ. От этих задач веет немножко Копперфильдом: делаешь расчеты – проводишь анализ химических свойств – составляешь структурную формулу вещества. Но не все так однозначно и просто. Как показал анализ “вскрытия” одной из 35-х задач, ученик может столкнуться с очень накрученным (т.е. комбинированным) заданием, в которое авторы на основе нахождения формулы вещества умудрились втиснуть множество элементов из разных разделов алгоритмики и теоретической химии. Чтобы достойно справиться с решением 35-й задачи, а также других заданий ЕГЭ, нужно в процессе подготовки тщательно отрабатывать (шлифовать) каждый отдельно взятый алгоритмический элемент (алгоритмическую фишку): вначале – на простых заданиях, а затем – на комбинированных. Чем я и занимаюсь с учениками и планирую рассказывать об этом в своих статьях.
Но не все так однозначно и просто. Как показал анализ “вскрытия” одной из 35-х задач, ученик может столкнуться с очень накрученным (т.е. комбинированным) заданием, в которое авторы на основе нахождения формулы вещества умудрились втиснуть множество элементов из разных разделов алгоритмики и теоретической химии. Чтобы достойно справиться с решением 35-й задачи, а также других заданий ЕГЭ, нужно в процессе подготовки тщательно отрабатывать (шлифовать) каждый отдельно взятый алгоритмический элемент (алгоритмическую фишку): вначале – на простых заданиях, а затем – на комбинированных. Чем я и занимаюсь с учениками и планирую рассказывать об этом в своих статьях.
Авторская Система Задач по Химии насчитывает несколько типов алгоритмов на вывод формулы вещества: по массовой доле, по продуктам сгорания, по стехиометрическим коэффициентам, по формуле в общем виде. Постепенно я буду рассказывать очень подробно о каждом алгоритме. Сегодня я хочу проработать специфику алгоритма Вывод формулы вещества по общей формуле класса. Итак, поехали!
Итак, поехали!
Вывод формулы вещества по общей формуле класса
Алгоритм решения строится на логической схеме М(реал) = М(общ)
М(реал) – реальная молярная масса, которая рассчитывается по многим формулам. На фото я представляют основные формулы расчета реальной молярной массы
М(общ) – молярная масса вещества в общем виде, рассчитывается по общей формуле класса веществ. На фото можно увидеть примеры расчета молярной массы вещества в общем виде
В основе алгоритма задачи лежит составление уравнение с одним неизвестным, решение которого приводит к ответу. Потренируемся решать несложные задачи по этому алгоритму
Задача 1
Углеводород имеет формулу Cnh3n-2. Определите n, если известно, что 0,8 моль углеводорода имеют массу 43,2 г.
Задача 2
Органическое вещество имеет формулу Cnh3n+2О.Определите n, если известно, что 0,7 моль углеводорода имеют массу 32,2 г.
Задача 3
Масса одной молекулы ромбической серы равна 4,252•10-22 г. Рассчитайте число атомов в одной молекуле ромбической серы
Задача 4
Алкен массой 28 г содержит 3,01∙1023 молекул. Определите структурную формулу алкена, если известно, что при его окислении подкисленным раствором перманганата калия образуется ацетон.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
“Решение задач на вывод формул органических веществ»
Интегрированный урок
(математика + химия),
11-й класс
Тема:
“Решение задач на вывод формул органических веществ»
Тип урока: комбинированный.
Вид урока: интегрированный.
Задачи:
- Способствовать развитию умений выводить формулы веществ через массовую долю химических элементов, с использованием относительной плотности газов, применяя основное свойство пропорции.
- Способствовать развитию умений работать по алгоритму, развитию навыков самообразования, логического мышления, устной и письменной речи учащихся.
- Формировать целостную систему знаний, воспитывать ответственность при работе в коллективе, исполнительность.

Формы учебной деятельности: коллективная и групповая.
Технические средства и оборудование: мультимедийная презентация, компьютер, мультимедийный экран, периодическая система Д. И. Менделеева, раздаточные листы на печатной основе (задачи, алгоритмы)
План урока:
- Организационный момент;
- Подготовка к усвоению нового учебного материала;
- Усвоение новых знаний;
- Закрепление новых знаний;
- Подведение итогов урока;
- Информация о домашнем задании, инструкция его выполнении.
- Презентация урока
ХОД УРОКА
I. Организационный момент
II. Подготовка к усвоению нового учебного материала
Сообщение о связи химии с математикою:
Учитель математики: Природа – единое целое, характеризующееся общими процессами и управляемая общими законами. Математические методы (решение систем линейных однородных уравнений, исследование функций и построение графиков) находят широкое применение в таких понятиях химии как протекание химических реакций; при решении химических задач.
Математические методы (решение систем линейных однородных уравнений, исследование функций и построение графиков) находят широкое применение в таких понятиях химии как протекание химических реакций; при решении химических задач.
Учитель химии сообщает учащимся план урока, цель и задачи:
Учитель химии: Химические процессы – это сложнейшие реакции, которые требуют огромных вычислений. И сегодня на уроке мы предлагаем вам решение химических задач с помощью математики, оформление результатов решения в виде программного продукта: презентации,.
Учитель математики: Для решения задач вспомним, что такое отношение двух чисел? (Частное двух чисел)
– Что показывает отношение? (Во сколько раз одно число больше или меньше другого или какую часть одно число составляет от другого)
– Что такое пропорция (Это равенство двух отношений)
Учащийся записывает пропорцию в общем виде на доске:– Как называются члены пропорции? (а и d – крайние, b и c – средние)
– Сформулируйте основное свойство пропорции (Произведение крайних членов равно произведению средних членов a • d = b • c)
– Как найти неизвестный член пропорции?
a : x = b : c
xb = ac
Учитель химии: Для решения задач необходимо вспомнить:
– Что такое массовая доля элемента? (Это отношение относительной атомной массы элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества.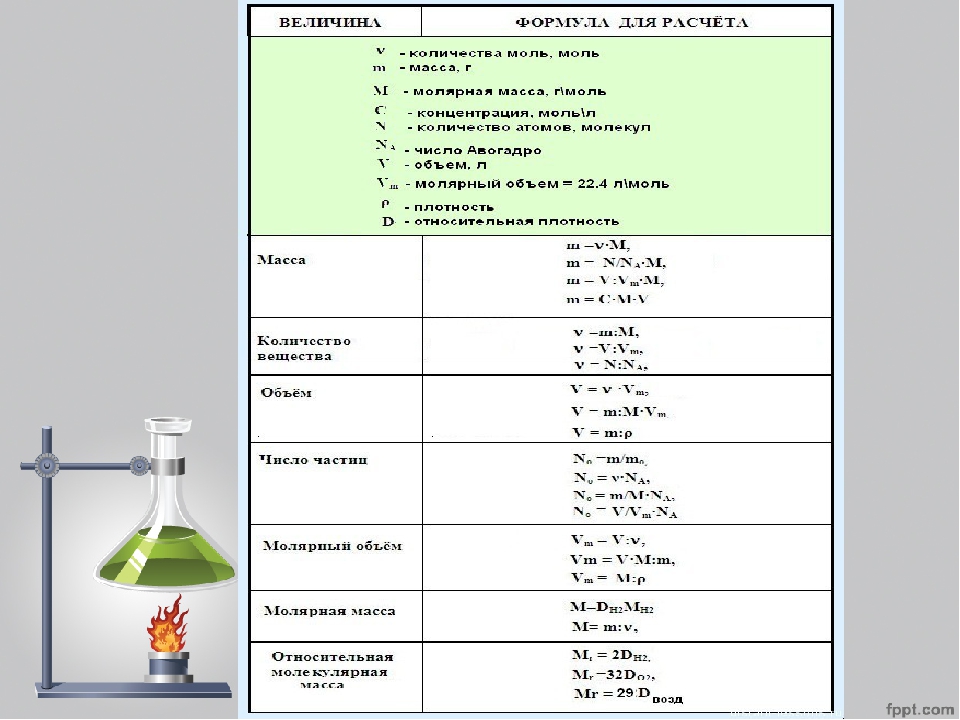 )
)
– Как определить массовую долю элемента?
(– Как определить количество вещества? или)
– Что такое относительная молекулярная масса? (Относительная молекулярная масса Mr – число, показывающее во сколько раз реальная масса молекулы, выраженная в граммах, больше массы 1/12 части атома элемента углерода, выраженной тоже в граммах.)
– Как определить относительную молекулярную массу углеводорода, зная относительную плотность по водороду или воздуху? (Mr (вещества) = D(H2) • Mr (H2) или Mr (вещества) = D(возд) • Mr (возд)).
Учитель математики: Решим устные упражнения:
- Найти отношение: 0,25 к 0,55; 9,1 к 0,07; 12,3 к 3; 1 кг к 250 г; 0,1 кг к 0,1 г.
- Найти неизвестный член пропорции: 5 : х = 4: 12;
- Определите Мr углеводорода, если D(возд) = 2, D(H2) = 15.
- Определите Mr: СН3, С2Н6, С2Н2.
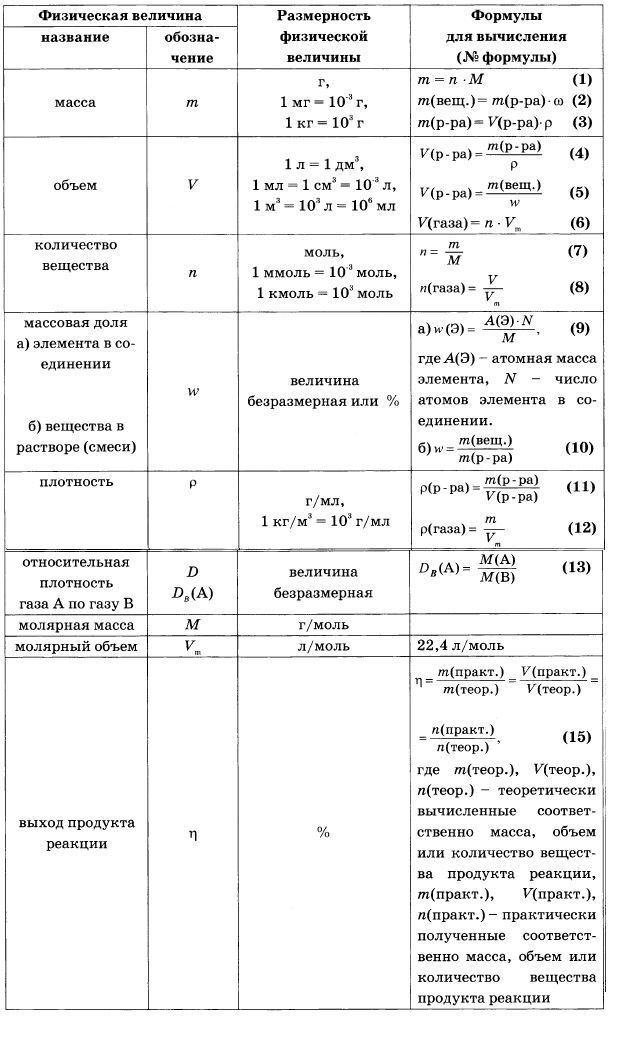
- Определите количество вещества, если известна массовая доля углерода 80%, водорода 20% .
III. Усвоение новых знаний
Учитель химии: Решим задачу на определение молекулярной формулы вещества на основании результатов количественного анализа (массовой доли элементов) и относительной плотности.
Задача 1.
Найдите молекулярную формулу углеводорода, содержание углерода в котором 80%, а водорода – 20%, относительная плотность по водороду равна 15.
1-й способ решения (соотношение атомов).
На каждой парте алгоритм решения задачи.
Алгоритм решения задачи
Задача 1.
Найдите молекулярную формулу углеводорода, содержание углерода в котором 80%, а водорода – 20%, относительная плотность по водороду равна 15.
1 – й способ решения (соотношение атомов).
Алгоритм решения задачи
- 1.
 Внимательно прочитайте условие задачи и кратко запишите его простейшую формулу
Внимательно прочитайте условие задачи и кратко запишите его простейшую формулу
2. Определите соотношение атомов в молекуле, разделив массовые доли каждого из элементов на их относительные атомные массы.
3. Установите соотношение атомов
4. Определите относительную молекулярную массу углеводорода
5. Установите, во сколько раз истинная относительная молекулярная масса углеводорода больше относительной молекулярной массы простейшей его молекулы
6. Напишите истинную формулу углеводорода, увеличив число атомов каждого элемента
7. Запишите ответ
Решение:
1. Внимательно прочитайте условие задачи и кратко запишите его
Дано:
D (H2) = 15
_____________
Mr (СхНy) – ?
2. Определите соотношение атомов в молекуле, разделив массовые доли каждого из элементов на их относительные атомные массы (учитель математики)
3.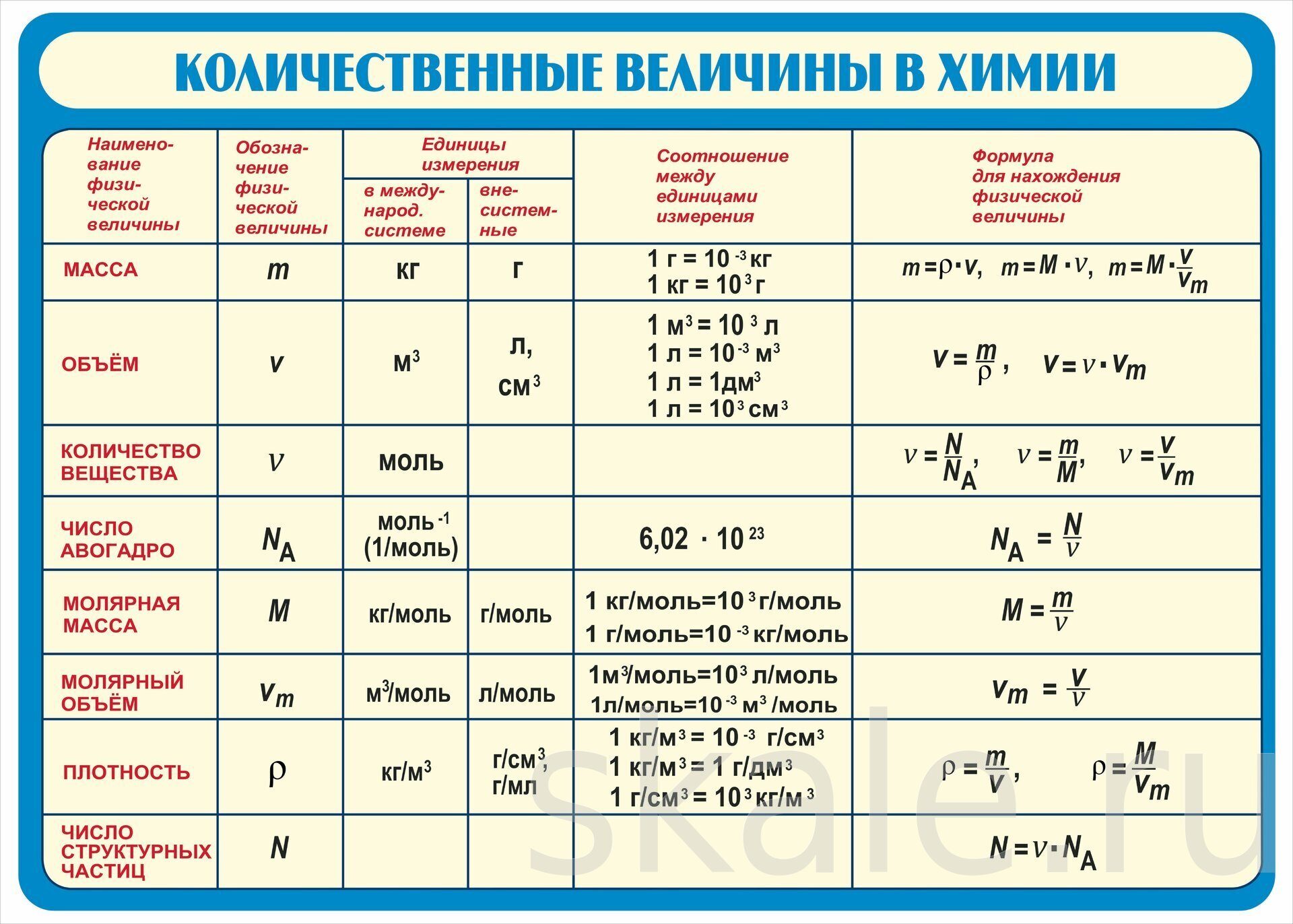 Установите соотношение атомов
Установите соотношение атомов
4. Напишите простейшую формулу (учитель химии)
Учитывая соотношение можно записать – СН3
5. Определите относительную молекулярную массу углеводорода
Mr (CH3) = 15
Mr (СхНy) = D H2 • Mr H2 = 15 • 2 = 30
6. Установите, во сколько раз истинная относительная молекулярная масса углеводорода больше относительной молекулярной массы простейшей его молекулы
7. Напишите истинную формулу углеводорода, увеличив число атомов каждого элемента в 2 раза СН3 – С2Н6
8. Запишите ответ
Ответ: молекулярная формула углеводорода – С2Н6 (этан).
Учитель математики:
Мы можем решить эту задачу вторым способом способом пропорции.
На каждой парте алгоритм решения задачи).
Алгоритм решения задачи
Задача 1.
Найдите молекулярную формулу углеводорода, содержание углерода в котором 80%, а водорода – 20%, относительная плотность по водороду равна 15.
2 – й способ решения (способ пропорции).
1. Внимательно прочитайте условие задачи и кратко запишите его
D (H2) = 15
______________
Mr (СхНy) – ?
2. Определите массу водорода, содержащегося в веществе (составьте на основании логического рассуждения пропорцию и решите ее)
Процентное содержание элементов в веществе есть не что иное, как отношение массы атомов данного элемента к массе атомов второго элемента и т.д., т.е.
На 80 мас.ч. углерода приходится 20 мас.ч. водорода.
А на 1 моль атомов углерода, масса которого m(C) = 12 г (М(С) = 12 г/моль), приходится х г водорода.
Составьте пропорцию:
80 : 12 = 20 : х,
Это составляет 3 моль атомов водорода (М (Н) = 1 г/моль).
3. Установите соотношение атомов элементов в молекуле данного вещества, приведя их значения к целым числам n (C) : n (H) = 1 : 3
4. Напишите простейшую формулу вещества и рассчитайте по ней относительную молекулярную массу СН3
Mr (Ch4) = 15
5. Определите истинную относительную молекулярную массу Mr (СхНy) = D H2 • Mr H2 = 15 • 2 = 30
6. Установите, во сколько раз истинная относительная молекулярная масса углеводорода больше относительной молекулярной массы простейшей его молекулы
7. Напишите истинную формулу углеводорода, увеличив число атомов каждого элемента в 2 раза СН3 – С2Н6
8. Напишите ответ
Ответ: молекулярная формула вещества С2Н6 – этан.
Учитель химии: Существует и третий способ решения подобных задач.
3-й способ решения (по формуле расчета массовой доли элемента в веществе)
На каждой парте алгоритм решения задачи
Задача 1.
Найдите молекулярную формулу углеводорода, содержание углерода в котором 80%, а водорода – 20%, относительная плотность по водороду равна 15.
1. Внимательно прочитайте условие задачи и кратко запишите его
Дано:
D (H2) = 15
____________
Mr (СхНy) – ?
2. Запишите формулы расчета массовой доли элемента вещества.;
Mr = 2 . D h3;
3. Все данные внесите в формулу
4. Установите соотношение атомов
n(C) : n(H) = 2 : 6
5. Напишите формулу вещества С2Н6
6. Запишите ответ
Ответ: молекулярная формула вещества С2Н6 – этан.
Учитель химии: Эту задачу можно решить используя ещё один способ – нахождению доли части от целого.
1. Mr = 2 • D h3
Mr = 2 • 15 = 30
2. По относительной молекулярной массе (целое) и массовой доле элемента в веществе (доля части от целого) найдите массу элемента в веществе (часть от целого):
b = C • массовая доля части.
На долю углерода приходится: 30 • 0,8 = 24
На долю водорода приходится: 30 • 0,2 = 6
3. Число атомов элементов в молекуле газообразного вещества определяют как частное от деления полученных чисел на относительные атомные массы соответствующих элементов:
n (C) = 24 : 12 = 2
n (Н) = 6 : 1 = 1
4. Установите соотношение атомов n(C) : n(H) = 2 : 6
5. Запишите формулу вещества С2Н6
6. Запишите ответ
Ответ: молекулярная формула вещества С2Н6 – этан.
Учитель математики: Я хочу предложить вам ещё один математический способ решения подобных задач
1. По относительной плотности вычисляем относительную молекулярную массу вещества:
Mr (CH3) = 15
Mr (СхНy) = D H2 • Mr H2 = 15 • 2 = 30
2. Предположим, что углеводород имеет формулу СхНу, тогда, подставим относительные атомные массы элементов, получим:
12х + у = 30.
3. Общая формула углеводорода – СхH2х+2.
Для углеводородов значение у будет равно или меньше (в случае непредельных углеводородов) значения 2х + 2:
4. Из уравнения находим значение у = 30 – 12х, подставляем его в неравенство и получаем:
Если х = 2, то у = 2 ? 2 + 2 = 6.
Если х >2.
Например, если х = 3, то 12х + у = 36 + у > 30, что не соответствует уравнению 12х + у = 30.
у = 30 – 12х
12х + 2х + 2 = 30
14х = 30 – 2
14х = 28
х = 28 : 14
х = 2, тогда
если х = 2, то 2х + 2 = 2 . 2 + 2 = 6.
5. Формула углеводорода: С2Н6
IV. Закрепление новых знаний
(работа по группам)
На каждой парте листы с задачами.
Задачи для самостоятельного решения дома.
- В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода по воздуху равна 3,45.
 Определите эмпирическую формулу углеводорода.
Определите эмпирическую формулу углеводорода. - Массовая доля углерода в углеводороде равна 85,71%, водорода – 14,29%. Относительная плотность углеводорода по азоту равна 1. Выведите молекулярную формулу углеводорода, напишите его структурную формулу.
- Массовая доля водорода в углеводороде 7,7%. Молярная масса углеводорода 78 г/моль. Выведите формулу вещества.
- В углеводороде массовые доли углерода и водорода соответственно равны 82,76 и 17,24%. Относительная плотность углеводорода по воздуху равна 2,0. выведите его молекулярную формулу.
- Относительная плотность алкана по воздуху равна 1,52. Выведите его молекулярную формулу.
1 группа – решение задачи 1 способом (соотношение атомов).
2 группа – решение задачи 2 способом (способ пропорции).
3 группа – решение задачи 3 способом (по формуле расчета массовой доли элемента в веществе).
4 группа – решение задачи 4 способом (по нахождению доли части от целого).
5 группа – решение задачи 5 способом (математический).
V. Подведение итогов
Учитель химии:
Химия тесно связана с математикой. Сегодня на уроке мы познакомились, как знания некоторых разделов математики необходимы для умения решать задачи по химии.
VI. Домашнее задние Каждой группе оформить решение задач в виде презентаций, статьи.
химических реакций
химических реакцийХимическая промышленность Реакция
Поскольку атомы не создаются и не разрушаются в химическом реакции, общая масса продуктов в реакции должна быть такая же, как и общая масса реагентов.
Химические уравнения
Химические реакции описываются химическими уравнениями.
Пример: реакция между водородом и кислородом с образованием вода представлена следующим уравнением.
2 ч 2 + O 2 2 H 2 O
Часто бывает полезно указать, реагенты или
продукты являются твердыми телами, жидкостями или газами, написав s , l ,
или г в скобках после символа реагентов или
продукты, как показано в следующих уравнениях.
2 H 2 ( г ) + O 2 ( г ) 2 H 2 O ( г )
2 Al ( с ) + Fe 2 O 3 ( с ) Al 2 O 3 ( с ) + 2 Fe ( л )
Потому что так много реакций происходит, когда решения двух растворенные в воде вещества смешиваются, специальный символ aq , используется для описания этих водных растворов .
Процесс растворения образца в воде будет обозначается следующими уравнениями.
| H 2 O | ||
| C 12 H 22 O 11 ( с ) | C 12 H 22 O 11 ( водн. ) |
Химическое уравнение – это утверждение того, что может случиться ,
не обязательно что будет . Следующее уравнение,
например, не гарантирует, что водород будет реагировать с
кислород с образованием воды.
Следующее уравнение,
например, не гарантирует, что водород будет реагировать с
кислород с образованием воды.
2 H 2 ( г ) + O 2 ( г ) 2 H 2 O ( г )
Можно наполнять баллон смесью водорода. и кислород, и вы обнаружите, что никакой реакции не происходит, пока вы не коснетесь воздушный шар с пламенем.Сбалансированное уравнение этой реакции описывает соотношение между количествами водорода и потребляется кислорода и образуется вода, если или когда эта реакция инициирован.
Уравнения на атомной и макроскопическая шкала
Химические уравнения могут использоваться для представления того, что происходит на либо в атомном, либо в макроскопическом масштабе.
2 H 2 ( г ) + O 2 ( г ) 2 H 2 O ( г )
Это уравнение можно прочитать одним из следующих способов.
- Если или когда водород вступает в реакцию с кислородом, две молекулы водорода и одна молекула кислорода расходуются на каждые две молекулы воды.
- Если или когда водород вступает в реакцию с кислородом, два моля водород и один моль кислорода расходуются на каждый произведено два моля воды.
Химические уравнения должны быть сбалансированы – они должны совпадать количество атомов каждого элемента в обеих частях уравнения.В виде в результате масса реагентов должна быть равна массе продукты реакции. В атомном масштабе следующие уравнение сбалансировано, поскольку общая масса реагентов равна равняется массе изделий.
| 2 H 2 ( г ) | + | O 2 ( г ) | 2 H 2 O ( г ) | |
2 x 2 а. е.м. е.м. | + | 32 а.е.м. | 2 x 18 а.е.м. | |
| 36 а.е.м. | 36 а.е.м. | |||
В макроскопическом масштабе он уравновешен, потому что масса два моля водорода и один моль кислорода равны массе двух молей воды.
| 2 H 2 ( г ) | + | O 2 ( г ) | 2 H 2 O ( г ) | |
| 2 x 2 г | + | 32 г | 2 x 18 г | |
| 36 г | 36 г | |||
Балансировочный химикат Уравнения
Не существует последовательности правил, которым можно было бы слепо следовать, чтобы
получите сбалансированное химическое уравнение. Управляйте коэффициентами
написано перед формулами реагентов и продуктов
до тех пор, пока количество атомов каждого элемента по обе стороны от
уравнения такие же.
Управляйте коэффициентами
написано перед формулами реагентов и продуктов
до тех пор, пока количество атомов каждого элемента по обе стороны от
уравнения такие же.
Обычно неплохо взяться за самую легкую часть проблема первая.
Пример: рассмотрим, что происходит, когда пропан (C 3 H 8 ) горит на воздухе с образованием CO 2 и H 2 О. Первый то, что нужно искать, когда балансирующие уравнения являются отношениями между двумя сторонами уравнения.
_____ C 3 H 8 + _____ O 2 _____ CO 2 + _____ H 2 O
Легче сбалансировать атомы углерода и водорода в
уравнения, чем атомы кислорода в этой реакции, потому что все
атомы углерода в пропане попадают в CO 2 и все
атомы водорода попадают в H 2 O, но некоторые из
атомы кислорода попадают в каждое соединение. Это означает, что нет
способ предсказать количество молекул O 2 , которые
расходуется в этой реакции, пока вы не узнаете, сколько CO 2 и H 2 O образуются молекулы.
Для начала отметим, что в каждая молекула C 3 H 8 . Таким образом, три CO 2 молекулы образуются для каждого C 3 H 8 молекула израсходована.
1 C 3 H 8 + _____ O 2 3 CO 2 + _____ H 2 O
Если в каждом восемь атомов водорода C 3 H 8 молекулы должно быть восемь атомов водорода, или четыре H 2 O молекулы в правой части уравнения.
1 C 3 H 8 + _____ O 2 3 CO 2 + 4 H 2 O
Теперь, когда атомы углерода и водорода уравновешены, мы можем
попробуйте уравновесить атомы кислорода. В нем шесть атомов кислорода.
три молекулы CO 2 и четыре атома кислорода в четырех H 2 O
молекулы. Чтобы сбалансировать 10 атомов кислорода в продуктах этого
реакции нам понадобится пять молекул O 2 среди
реагенты.
1 C 3 H 8 + 5 O 2 3 CO 2 + 4 H 2 O
Теперь есть три атома углерода, восемь атомы водорода и 10 атомов кислорода с каждой стороны уравнения. Таким образом, сбалансированное уравнение этой реакции записывается как следует.
C 3 H 8 ( г ) + 5 O 2 ( г ) 3 CO 2 ( г ) + 4 H 2 O ( г )
Молярные отношения
Сбалансированное химическое уравнение позволяет предсказать, что произойдет. когда происходит реакция.Мольное соотношение преобразует моли одного соединения в сбалансированное химическое уравнение в моли другого соединения.
Пример: фейерверк, освещающий небо каждую четверть
Июль основан на реакции магния и кислорода на
образуют оксид магния.
2 мг ( с ) + O 2 ( г ) 2 MgO ( с )
Вычисленное уравнение реакции можно использовать для построить два единичных факторов , которые описывают соотношение между количеством потребляемого магния и кислорода в этой реакции.
Сосредоточив внимание на элементах этой проблемы, мы можем выбрать правильное мольное соотношение для преобразования молей магния в эквивалентное количество молей кислорода. Предположим, например, что мы хотим рассчитать количество молей кислорода, необходимое для сжигания 0,40 моль металлического магния.
| 0.40 моль Mg | x | 1 моль O 2 | = | 0,20 моль O 2 |
| 2 моль магния |
Прогноз массы Потребляемые реагенты или продукты, выделяемые в химической реакции
Сбалансированные химические уравнения могут использоваться для прогнозирования
соотношение между количествами израсходованных реагентов и
количества продуктов, образующихся в химической реакции.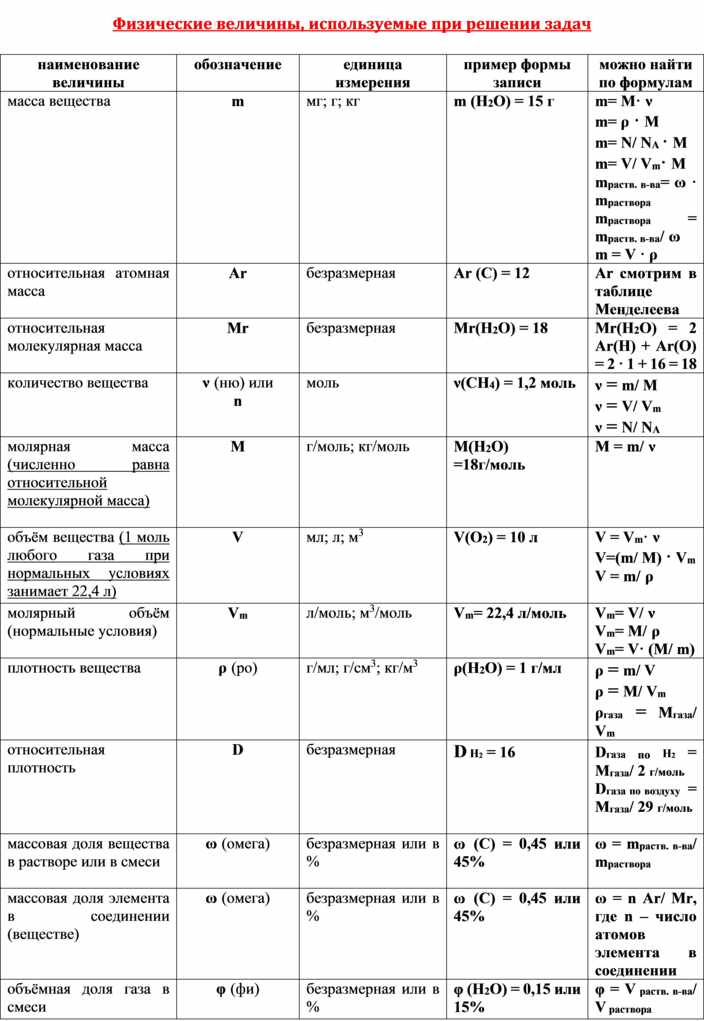
Пример: чтобы спрогнозировать количество кислорода, которое необходимо вдохнуть. чтобы переварить 10,0 грамма сахара, мы можем предположить, что сахар в нашем диета приходит к нам как C 12 H 22 O 11 молекулы и что наши тела сжигают этот сахар в соответствии с следующее уравнение.
C 12 H 22 O 11 ( с ) + 12 O 2 ( г ) 12 CO 2 ( г ) + 11 H 2 O ( л )
Возможно, лучший способ начать – это спросить: «Что мы такое пытаетесь найти? “, а затем резюмируйте важные части информация в проблеме.
Цель : Узнать, сколько граммов O 2 расходуется при сжигании 10,0 граммов сахара.
Факт : Начнем с 10 граммов сахара.
Факт : Сахар имеет формулу C 12 H 22 O 11 .
Fact : Рассчитанное уравнение этой реакции может быть
написано следующим образом.
С 12 В 22 О 11 + 12 О 2 12 CO 2 + 11 H 2 O
Поскольку мы знаем молекулярную массу сахара, мы можем преобразовать известную массу сахара на количество молей сахара.
Теперь у нас есть сбалансированное химическое уравнение, и мы знаем количество молей сахара в пробе. Как шаг к цель задачи мы можем вычислить количество молей кислорода израсходовано в реакции. Уравнение для этого реакция предполагает, что 12 моль O 2 расходуются на каждый моль сахара в этой реакции. Таким образом, мы можем вычислить количество молей кислорода, необходимое для сжигания 0.02921 моль сахар следующим образом.
Теперь у нас есть необходимая информация, чтобы добраться до цели
наш расчет. Нам известно количество O 2 , израсходованное в
эта реакция выражается в молях, и мы можем вычислить массу
0,3505 моль O 2 от молекулярной массы
кислород.
Согласно этому расчету требуется 11,2 грамма O 2 для сжигания 10.0 грамм сахара.
Ограничивающие реагенты
Требуется 1,70 г аммиака и 4,00 г кислорода, чтобы получают 3,00 грамма оксида азота по следующей реакции.
4 NH 3 ( г ) + 5 O 2 ( г ) 4 НО ( г ) + 6 H 2 O ( г )
Что произойдет с количеством NO, произведенного в этом
реакция, если оставить количество O 2 прежним (4.00 г)
но увеличивает количество присутствующего NH 3 изначально? Выход реакции останется прежним. Нет
сколько бы NH 3 мы ни добавили в систему, не более НЕТ
образуется, потому что в реакции заканчивается O 2 перед
расходуется весь NH 3 . Когда это происходит,
реакция должна прекратиться. Независимо от того, сколько NH 3 добавлено в
система, мы не можем получить более 3,00 граммов NO из 4,00
граммы кислорода.
Когда O 2 не хватает для потребления всего NH 3 в реакции количество O 2 ограничивает количество НЕТ, что может быть произведено. Таким образом, кислород – это предел . реагент в этой реакции. Потому что там больше NH 3 чем нам нужно, это избыток реагента .
Концепция ограничивающего реагента важна, потому что химики часто запускаются реакции, в которых только ограниченное количество одного из реагенты присутствует.
Ключом к ограничению проблем с реагентами является следующая последовательность шагов.
|
|
|
|
|
|
Химические формулы и уравнения | CPD
Вы когда-нибудь добавляли соль Эпсома в ванну, принимали магнезийное молоко от несварения желудка или клали цветы серы на свои розы? Вы, наверное, знаете химический состав этих продуктов, но как насчет спирта из рогового рога или купоросного масла? и не могли бы вы приготовить глауберову соль?
Эти алхимические имена могут вызывать воспоминания и загадочные, но они плохо передают химические знания. Хотя мы по-прежнему придерживаемся некоторых из этих названий, большинство химикатов теперь получают систематические названия на основе их состава. Несмотря на это, для начинающего химика аммиак и серная кислота могут быть столь же неоднозначными, как спирт из оленьего рога или купоросное масло. Даже систематические названия, такие как хлорид меди, дают лишь частичную информацию – количественное соотношение между элементами отсутствует.
Хотя мы по-прежнему придерживаемся некоторых из этих названий, большинство химикатов теперь получают систематические названия на основе их состава. Несмотря на это, для начинающего химика аммиак и серная кислота могут быть столь же неоднозначными, как спирт из оленьего рога или купоросное масло. Даже систематические названия, такие как хлорид меди, дают лишь частичную информацию – количественное соотношение между элементами отсутствует.
Подобные проблемы существуют при описании реакций. Естественный язык очень хорош для именования вещей, но ему трудно выразить точные суммы, поэтому мы используем числа.Представьте, что вы пытаетесь ответить на вопрос: «Сколько вам лет?» Без использования цифр.
В вашем классе
Загрузите упражнение по написанию формул для соединений неметаллов [MS PowerPoint или pdf] и рабочий лист для учащихся [MS Word].
Двести лет назад шведский химик Йенс Якоб Берцелиус ввел символическую систему для описания химического состава веществ. Символы, обычно это первые или первые два символа названия элемента, в сочетании с числами, чтобы показать относительные количества.Элементы в этих формулах соединены знаком +. Итак, оксид меди превратился в Cu + O, а вода в 2H + O. Эти формулы устранили как тайну состава, вызванную алхимическим названием, так и недостаток количественной информации. Система Берцелиуса с годами превратилась в химические формулы, которые мы знаем сегодня: CuO и H 2 O.
Символы, обычно это первые или первые два символа названия элемента, в сочетании с числами, чтобы показать относительные количества.Элементы в этих формулах соединены знаком +. Итак, оксид меди превратился в Cu + O, а вода в 2H + O. Эти формулы устранили как тайну состава, вызванную алхимическим названием, так и недостаток количественной информации. Система Берцелиуса с годами превратилась в химические формулы, которые мы знаем сегодня: CuO и H 2 O.
Что нужно знать студентам
Химические уравнения и формулы – важная часть изучения химии с 11-19.Умение правильно их использовать – это часть того, что значит быть химиком. Формулы и уравнения позволяют химикам эффективно передавать химические знания.
Студенты должны понимать, что химические формулы:
- дает название веществу – например, K 2 SO 4 – сульфат калия;
- предоставляет список элементов, входящих в состав вещества, например калий, серу и кислород;
- обеспечивает соотношение элементов в веществе – например, две части калия, 1 часть серы, 4 части кислорода;
и химические уравнения:
- описывают, как изменяются вещества – например, углерод + кислород → диоксид углерода становится C + O 2 → CO 2 ;
- сообщает нам соотношение реагентов и продуктов в реакции – например, 2Mg + O 2 → 2MgO означает, что две партии магния вступают в реакцию с одной партией кислорода, давая две партии оксида магния;
- может включать государственные символы – (g), (l), (s) и (aq) – которые могут помочь учащимся визуализировать реакцию и объяснить наблюдения.

Студенты должны уметь:
- напишите формулы элементов и простых соединений, используя химические символы и числа.
- называет простые соединения из химической формулы, используя такие префиксы, как моно-, ди-, три- и такие слова, как оксид, хлорид, гидроксид, сульфат, нитрат и карбонат.
- построить словесные уравнения для реакций.
- представляют собой реагенты и продукты химической реакции в сбалансированном уравнении.
Идеи для вашего класса
Общая последовательность обучения формулам и уравнениям может быть:
- проводить простые реакции в пробирках или на микроуровне;
- выучить общие словесные уравнения для химических реакций;
- научиться писать конкретные словесные уравнения;
- научитесь составлять химические формулы;
- и используйте химические формулы и слово уравнение для построения сбалансированных химических уравнений.
На сайте Learn Chemistry можно найти два отличных ресурса для обучения написанию словесных уравнений.
Когда учащиеся научатся пользоваться словесными уравнениями, вы можете переходить к написанию химических формул. К сожалению, названия некоторых веществ не всегда переводятся непосредственно в химические формулы. Например, формулы воды, метана, аммиака, азотной кислоты и т. Д. Придется выучить наизусть. Покажите имена и формулы и дайте учащимся стратегии их запоминания.
Наименование неметаллических соединений начинается с понимания приставок моно-, ди-, три- и т. Д. Свяжите их со словами из повседневной жизни и посмотрите, сколько учеников могут придумать. Затем разбейте формулы некоторых соединений, о которых они, возможно, уже слышали. Например, углекислый газ в виде углерода с двумя атомами кислорода. Потребуется множество примеров, чтобы помочь студентам развить мастерство этих обращений. Затем вы можете попросить студентов придумать свои собственные примеры и предложить своим сверстникам преобразовать их.
Наконец, вы можете перейти к именованию солей и ионных соединений. Опять же, потребуется некоторое механическое заучивание, чтобы убедиться, что они знают названия многоатомных ионов, таких как аммоний, гидроксид и карбонат.
Опять же, потребуется некоторое механическое заучивание, чтобы убедиться, что они знают названия многоатомных ионов, таких как аммоний, гидроксид и карбонат.
Распространенные заблуждения
- Все формулы представляют молекулы, например, «NaCl означает молекулы хлорида натрия».
- Не распознает многоатомные ионы как отдельные химические соединения, например, MgSO 4 , названный тетраоксидом серы магния, а не сульфатом магния.
- Многоатомные ионы путают с элементами, например, «Я не могу найти гидроксид в периодической таблице».
- Перемешивание символа элемента, например Cl, и его формулы как вещества, например Cl 2 . Это может быть осложнено использованием символа элемента для гигантских структур – например, алмаза в виде C и железа Fe – и некоторых, казалось бы, нелогичных исключений, например, S 8 и P 4 .
- Смешение формулы вещества с химическим уравнением его образования.
 Например, ответьте «водород + кислород → вода» на вопрос о формуле воды. Это заблуждение происходит из математики, где эти два слова часто используются как синонимы, и из повседневной жизни, где словесная формула часто ассоциируется с тем, как что-то делается.
Например, ответьте «водород + кислород → вода» на вопрос о формуле воды. Это заблуждение происходит из математики, где эти два слова часто используются как синонимы, и из повседневной жизни, где словесная формула часто ассоциируется с тем, как что-то делается. - Студенты часто испытывают трудности с числовыми соотношениями в уравнениях и формулах, это может затруднить балансирование уравнений и химических расчетов.
Формирующее оценивание
Написание формул и уравнений – это не тот навык, который можно развить после одного или двух уроков.Это навык, который должен быть постоянной частью уроков химии. Используйте регулярное тестирование с низкими ставками словесных уравнений и простых химических уравнений наряду с отзывом формул. Сосредоточьтесь на двухатомных элементах, а также на обычных кислотах, основаниях и солях, чтобы помочь учащимся получить общие химические знания и повысить уверенность в себе. Популярны игры в бинго по формулам или уравнениям, а мини-доски полезны для быстрой формирующей оценки.
Очков на вынос
- Формулы – это не просто сокращение химического названия, но и информация об относительных количествах элементов в веществе.
- Формулы некоторых соединений не могут быть производными от названия вещества, и их необходимо выучить.
- Написание химических формул и уравнений требует частого подкрепления.
- Не торопитесь писать сбалансированные уравнения. Помогите студентам сначала научиться писать формулы и словесные уравнения.
Переход к 14‒16
Когда учащиеся научатся писать формулы и сбалансированные химические уравнения, их можно расширить, включив в них написание ионных уравнений для реакций осаждения и полууравнений для электрохимических и окислительно-восстановительных процессов.
На этом уровне формулы и уравнения используются для выполнения многих химических расчетов, включая относительную формульную массу, количество молей вещества, реакционную массу и расчеты титрования. Овладение этими формулами и уравнениями помогает сгладить выполнение этих расчетов.
Овладение этими формулами и уравнениями помогает сгладить выполнение этих расчетов.
Олли Хантер – руководитель отдела химии и координатор EPQ в школе Бененден, Кент, и студент-неполный рабочий день на педагогическом факультете Кембриджского университета
Что скрыто в формулах и уравнениях?
Для балансировки уравнений и выполнения химических расчетов требуется четкое понимание роли чисел в формулах.Разница между числами перед и числами в формуле может вызвать путаницу.
Число в формуле означает число, кратное элементу (или группам элементов) слева от числа.
Таким образом, формула гидроксида меди Cu (OH) 2 читается как:
1 x Cu + 2 x (O + H) или Cu + 2 x O + 2 x H
Более сложная формула, такая как сульфат аммония (NH 4 ) 2 SO 4 , читается как:
2 x (N + (4 x H)) + 1 x S + 4 x O или 2 x N + 8 x H + S + 4 x O
Число перед формулой в уравнении говорит нам, сколько молекул (или молей) вещества вступают в реакцию. Например, в уравнении 2H 2 + O 2 → 2H 2 O читается как
Например, в уравнении 2H 2 + O 2 → 2H 2 O читается как
2 x H 2 + 1 x O 2 → 2 x (H 2 O)
или
две молекулы водорода реагируют с одной молекулой кислорода с образованием двух молекул воды.
Имейте в виду, что некоторые ученики предполагают, что число перед химической формулой является частью формулы или относится только к первому элементу. Например, интерпретация 2NaOH как:
’2NaOH – это формула гидроксида натрия’ или 2 x Na + O + H
8348_Student_Pocket_cover.indd
% PDF-1.6
%
1 0 объект
>
эндобдж
4 0 объект
> поток
2014-06-05T19: 24: 22-04: 002014-06-05T19: 21: 16-04: 002014-06-05T19: 24: 22-04: 00uuid: 761e3423-31d9-40c2-92d5-e70965b1e7a4uuid: a8700b09- 7ea5-2a4f-a6ab-55d99ff7a6edapplication / pdfCreo Normalizer JTP конечный поток
эндобдж
2 0 obj
>
эндобдж
3332 0 объект
>
эндобдж
3331 0 объект
>
эндобдж
1868 0 объект
>
эндобдж
2209 0 объект
>
эндобдж
2578 0 объект
>
эндобдж
2953 0 объект
>
эндобдж
3273 0 объект
>
эндобдж
3609 0 объект
>
эндобдж
3955 0 объект
>
эндобдж
4301 0 объект
>
эндобдж
3954 0 объект
>
эндобдж
4009 0 объект
>
эндобдж
4078 0 объект
>
эндобдж
4143 0 объект
>
эндобдж
4213 0 объект
>
эндобдж
4304 0 объект
>
эндобдж
4253 0 объект
>
эндобдж
4281 0 объект
>
эндобдж
4297 0 объект
>
эндобдж
4254 0 объект
> / Font> / ProcSet [/ PDF / Text / ImageC / ImageI] / Свойства >>> / ExtGState >>>
эндобдж
4273 0 объект
>
эндобдж
4258 0 объект
>
эндобдж
4257 0 объект
>
эндобдж
4256 0 объект
>
эндобдж
4255 0 объект
>
эндобдж
4259 0 объект
> поток
2014-04-17T14: 15: 02-04: 002014-04-17T14: 15: 05-04: 002014-04-17T14: 15: 05-04: 00Adobe InDesign CS6 (Macintosh) uuid: fbbe269b-fcc3-044f- a0d5-8bfad7b7366exmp. сделал: EBF97B1AED2168118083ABEE7E30EF1Cxmp.id: E6C4B363422368118083ABEE7E30EF1Cproof: pdf1
сделал: EBF97B1AED2168118083ABEE7E30EF1Cxmp.id: E6C4B363422368118083ABEE7E30EF1Cproof: pdf1
Wolfram | Alpha Примеры: Химия
Другие примеры
Химические элементы Используйте Wolfram | Alpha, чтобы исследовать элементы таблицы Менделеева.
Найдите количество элементов:
Получите информацию о химическом элементе:
Найдите элементы, соответствующие заданным критериям:
Постройте свойство для класса элементов:
Другие примеры
Другие примеры
Химические соединения Ищите химические вещества по названию, химической формуле или другому идентификатору.
Получите информацию о химическом составе:
Укажите соединение по химическому идентификатору:
Сравните разные органические химические вещества:
См. Примеры липидов, включая глицерофосфолипиды, жирные кислоты и многое другое:
Примеры липидов, включая глицерофосфолипиды, жирные кислоты и многое другое:
Другие примеры
Другие примеры
ИоныУзнайте о положительно и отрицательно заряженных ионах и их свойствах.
Получить информацию об ионе:
Сравните ионы данного элемента:
Найдите конкретное значение свойства для класса ионов:
Другие примеры
Другие примеры
Химические количества Вычисляет обширные свойства химикатов, которые зависят от количества присутствующего вещества, и преобразует количества в разные единицы.
Введите количества по массе:
Найдите количество молей данной массы:
Преобразование количества в объемы:
Другие примеры
Другие примеры
Химические Растворы Изучите свойства различных растворов, которые зависят от растворителя, растворенного вещества и концентрации.
Вычислить свойства химического раствора:
Вычислить свойства некоторого количества решения:
Проведите титровальные вычисления:
Выполните расчеты разбавления:
Другие примеры
Другие примеры
Химические реакции Используйте Wolfram | Alpha, чтобы сбалансировать химические уравнения, определить стехиометрию реакции и предсказать продукты.
Сбалансируйте химическое уравнение:
Рассчитайте стехиометрию реакции:
Найдите химические реакции, используя реагенты или продукты:
Другие примеры
Другие примеры
Химическая термодинамика Вычислить термодинамические свойства, такие как энтропия, теплоемкость или давление пара, для широкого спектра химических веществ.
Найдите свойства вещества в данной фазе:
Вычислить свойства при указанной температуре:
Выполните вычисления с помощью уравнения Аррениуса:
Оцените термодинамические свойства с помощью метода Джобака:
Другие примеры
Другие примеры
Функциональные группы Изучите функциональные группы, такие как цианаты, пероксиды, алканы и галогениды.
Получите информацию о функциональной группе:
Получите информацию о группе защиты:
Найдите поведение защитной группы при определенных условиях:
Другие примеры
Другие примеры
Хеминформатика Используйте Wolfram | Alpha для изучения свойств хеминформатики от инвариантов графа, таких как индекс J Балабана или индекс Хосоя, до дескрипторов QSAR, таких как количество доноров водорода или самая длинная цепочка.
Найдите самую большую общую субструктуру между двумя молекулами:
Найдите доноров и акцепторов водородных связей:
Вычислить набор топологических индексов для молекулы:
Другие примеры
Другие примеры
Квантовая химия Свяжите химические свойства с лежащей в основе квантово-механической природой атомов и молекул.
Соберите электронную конфигурацию:
Соберите орбитальную диаграмму в основном состоянии:
Посмотрите атомный радиус:
Подсчитайте количество валентных электронов:
Другие примеры
Другие примеры
Облигации и орбитали Изучите свойства электронных орбиталей и связи, которые они образуют. Найдите связи по составляющим их атомам, по их типу связи или по исходному химическому веществу.
Найдите связи по составляющим их атомам, по их типу связи или по исходному химическому веществу.
Получите сводную информацию о связях для химического вещества:
Вычислить гибридизацию в соединении:
Сравните гибридизацию в двух соединениях:
Другие примеры
Другие примеры
Ядерная химия Исследуйте ядерную химию с помощью Wolfram | Alpha.
Напишите символ нуклида:
Рассчитайте энергии связи:
Исследуйте источник элементов:
Другие примеры
Как правильно писать химические формулы
Химическая формула – это что-то вроде рецепта, который содержит различные ингредиенты и делает предмет. Например, из какао-масла, шоколадного ликера, сахара, лецитина и ароматизатора получается восхитительный продукт под названием «Шоколад». Точно так же соединение состоит из нескольких элементов, а элемент – из атомов.
Например, из какао-масла, шоколадного ликера, сахара, лецитина и ароматизатора получается восхитительный продукт под названием «Шоколад». Точно так же соединение состоит из нескольких элементов, а элемент – из атомов.
Итак, если вы хотите написать состав, который показывает его элементы и их пропорции, вы должны записать это в формулу. Это похоже на символическое представление соединения с помощью букв и цифр.
Каждый символ представляет элемент, а элемент состоит из атомов, связанных химической связью.Буквы представляют элемент, а число представляет количество атомов элемента.
Формулы также содержат стрелки, где односторонняя стрелка обозначает реакцию одного элемента на другой. Если есть стрелка, показывающая две стороны, это означает, что реакция может произойти в любом направлении – вперед или назад. Линии и символы взяты из диаграмм.
Что такое атом?
Это наименьшая или отдельная единица, образующая элемент в совокупности.Чтобы понять атом, возьмем стену. Стена из кирпича. Итак, если рассматривать стену как составную часть, кирпич можно рассматривать как атом. Кирпичи, скрепленные смесью цемента и песка, составляют стену.
Стена из кирпича. Итак, если рассматривать стену как составную часть, кирпич можно рассматривать как атом. Кирпичи, скрепленные смесью цемента и песка, составляют стену.
По сути, все во Вселенной состоит из атомов. Как не может быть стены без кирпичей, так и без атомов не может быть ничего. Итак, атом – это мельчайший компонент химического соединения, это важная его часть.
Как атом представлен в формуле
У элемента обычно есть три вещи: его имя, валентность и символ.И символ используется при написании уравнения химического соединения, поскольку он относится к этому конкретному элементу. В уравнении или формуле отдельный атом обозначается символом, то есть A1, который представляет собой атом алюминия.
Каждый элемент состоит из атомной массы, и это было теоретически обосновано Дальтоном. Он был первым ученым, который начал использовать символы для химического элемента.
Что такое химическая формула?
Химическое уравнение или формула, описанные в начале статьи, представляют собой символический способ отображения элементов и количества атомов в элементе. Символ определяет тип атома или элемента.
Символ определяет тип атома или элемента.
Чтобы показать, сколько атомов имеет элемент в формуле, мы должны использовать число в нижнем индексе. Например, сульфатная формула SO42-. Чтобы упростить задачу, если вам нужно показать водород, вы можете использовать H. Если вам нужно написать формулу воды, состоящую из двух атомов водорода и одного атома кислорода, вы должны написать ее как H 2 О. Здесь H 2 представляет два атома водорода, а O представляет один атом кислорода в формуле.
Как написать формулу
Есть несколько важных шагов и правил, которые вы должны учитывать при написании формулы. Это:
Префиксы для записи числа атомов
Число атомов для каждого элемента в формулах записывается с использованием греческих префиксов в именах соединений. Есть от 1 до 10 префиксов, т.е .;
- Mono-
- Di-
- Tri-
- Tetra-
- Penta-
- Hexa-
- Hepta-
- Octa-
- Nona-
- Deca- к водороду, поэтому для обозначения кислот необходимо использовать префикс «гидро-».

Ковалентные соединения записываются в виде молекулярных формул. Это потому, что каждое соединение представляет собой отдельную молекулу. Первый элемент ковалентного соединения записывается полностью, а второй элемент записывается с суффиксом «ide» в конце. Например, диоксид азота.
Напишите первый элемент символическим образом
Вы должны знать символы для элементов, когда пишете составное. Вы можете обратиться к таблице Менделеева, чтобы узнать символ элемента, например, элемент Br является символом для брома.Когда вы пишете первый элемент, он похож на первое имя соединения.
Например, если вы пишете название нитрида лития (Li 3 N), первым элементом будет литий. Химический символ этого элемента – Ли.
Теперь, чтобы показать количество атомов в уравнении нитрида лития, вы должны использовать число в нижнем индексе, то есть Li 3 . Вы можете определить количество атомов в соединении, вы должны запомнить греческие префиксы.
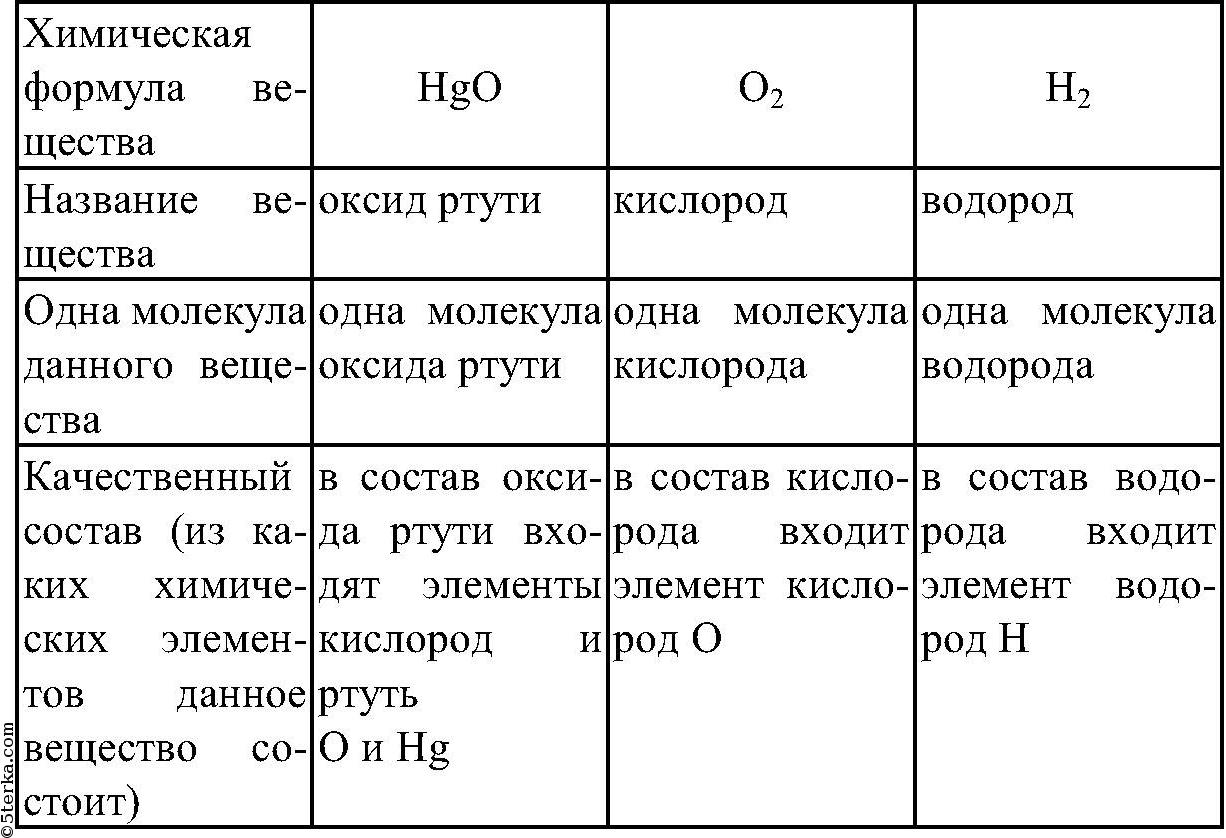 Если вы запомните префиксы, вы можете узнать количество атомов, т.е.е. Диоксид означает 2 атома кислорода.
Если вы запомните префиксы, вы можете узнать количество атомов, т.е.е. Диоксид означает 2 атома кислорода.Запишите второй элемент
Подобно первому элементу, который может называться первым именем соединения, второй элемент может называться фамилией. Название элемента будет заканчиваться суффиксом для ковалентных соединений. Например, гексафторид диазота. В этом соединении вторым элементом является фтор, а химический символ этого элемента – F.
Как и первый элемент, вы можете определить номер атома по имени второго элемента, если запомните греческие префиксы.Например, если вы пишете формулу для гексафторида динитрогена, вы можете указать количество атомов фтора, проверив его греческий префикс.
Второй элемент в этом соединении – гексафторид, с префиксом гекса. По-гречески гекса означает 6, поэтому это соединение содержит 6 атомов фтора. Чтобы записать этот элемент символическим образом, вы можете написать его как F 6.
Таким образом, записав первый и второй элементы, используя их символы и количество их атомов, полная химическая формула гексафторида динитрогена будет N 2 Ф 6 .

Сначала это может показаться сложным и трудным. У вас также могут возникнуть проблемы с запоминанием греческих префиксов. Но по мере того, как вы будете больше практиковаться в написании формул, вы познакомитесь с символами и префиксами элементов, а также с тем, как их писать. Вот еще несколько примеров химических уравнений. Проверьте их, чтобы улучшить свое понимание химического языка.
Соединение: CaO – оксид кальция
Обратите внимание, что и кальций, и кислород имеют по одному атому.Вы можете видеть, что в именах элементов нет префикса. Также обратите внимание, что нет нижнего индекса, так как оба элемента имеют одиночные атомы в этом соединении.
Соединение: SO 2 – Диоксид серы
Это соединение состоит из двух элементов: серы и кислорода. Обратите внимание, что первый элемент, то есть сера, имеет один атом, а второй элемент, то есть кислород, имеет два атома.
 Вы можете увидеть Di, что по-гречески означает два.Обратите внимание, как написано количество атомов.
Вы можете увидеть Di, что по-гречески означает два.Обратите внимание, как написано количество атомов.Соединение: P 2 O 5 – Пентоксид дифосфора
Это соединение состоит из фосфора. Вы можете видеть, что оба элемента имеют греческие префиксы, то есть Di в Diphosphorus и Pent в Pentoxide. По-гречески Di означает два, а Penta – 5. Итак, этот компонент состоит из двух атомов фосфора и пяти атомов кислорода.Число атомов обоих элементов записано в нижнем индексе.
Как писать формулы для ионных соединений
Некоторые соединения имеют ионы. Ионы бывают двух типов: положительные ионы, которые называются катионами, и отрицательные ионы, которые называются анионами.
Химические символы для катионов и анионов
Как вы знаете из предыдущих разделов этой статьи, химические соединения содержат элементы, которые можно назвать именем и фамилией.
 Таким же образом в ионных соединениях есть два типа ионов, т.е.е. катионы и анионы. В ионных формулах катионы записываются именем элемента, а анионы пишутся с суффиксом «ide» в конце имени элемента.
Таким же образом в ионных соединениях есть два типа ионов, т.е.е. катионы и анионы. В ионных формулах катионы записываются именем элемента, а анионы пишутся с суффиксом «ide» в конце имени элемента.Если говорить об ионах, то первые названия – это катионы. Это положительные ионы, и они записываются первыми. Анионы называются фамилиями. Это отрицательные ионы, которые записываются как второй элемент в соединении.
В ионных соединениях греческие префиксы не используются как ковалентные соединения. Таким образом, вы не можете сказать, сколько атомов содержит элемент в ионном соединении.В соединениях этого типа, чтобы узнать, сколько в них атомов, необходимо сбалансировать заряды элементов.
Например, сульфид калия, обозначаемый как K 2 S.
Это соединение состоит из калия и серы. Символ калия в таблице элементов – K. Он находится в первом столбце таблицы, поэтому его степень окисления +1. Сера обозначается словом «ид», так как это второй элемент в составе.
 Его символ в таблице элементов – S, а степень окисления – -2.
Его символ в таблице элементов – S, а степень окисления – -2.В ионном соединении общий положительный заряд должен быть равен общему отрицательному заряду. Итак, для этого примера нам нужно 2 атома калия (K). Это уравновесит отрицательный заряд серы, равный -2. Мы можем записать все это вместе как K 2 S.
Что такое многоатомные ионы
Иногда формулы для молекул содержат два или более атомов с ионными группами. Такие катионы или анионы называются многоатомными ионами. Ионы этого типа не имеют какой-либо систематической структуры, поэтому их невозможно запомнить никакими уловками.Вам просто нужно их запомнить.
Если говорить о катионных многоатомных ионах, то их всего три. Они такие, как показано ниже.
- Аммоний (Nh5 +)
- Гидроний (h4 +)
- Ртуть (I) (Hg22 +)
Все эти три иона содержат заряд +1. Но у ртути 2 атома связаны вместе, и они создают заряд 2+, а каждый катион ртути содержит заряд 1+.
Все остальные многоатомные ионы содержат отрицательные заряды.
 Они варьируются от -1 до -4, например, нитрат (NO3-) или NO 3 Заряд, содержащий заряд -1.Еще один хороший пример отрицательных зарядов – сульфатный заряд -2, то есть (SO42-).
Они варьируются от -1 до -4, например, нитрат (NO3-) или NO 3 Заряд, содержащий заряд -1.Еще один хороший пример отрицательных зарядов – сульфатный заряд -2, то есть (SO42-).Определение валентного заряда
Вы можете определить валентный заряд элемента, посмотрев на его положение в таблице элементов. Есть также некоторые правила, которые помогут вам определить валентный заряд, если вы помните. Они есть;
- Все элементы группы 1 имеют заряд +1
- Все элементы группы 2 имеют заряд +2
- Заряд переходных элементов обозначается римскими цифрами в скобках.
- Серебро заряжено 1+, цинк – 2+, а алюминий – 3+.
- Все элементы группы 17 имеют заряд 1-
- Все элементы группы 16 имеют заряд 2-
- Все элементы группы 15 имеют заряд 3-
Имейте в виду, что вы следует использовать заряд полного многоатомного иона вместо отдельных ионов, когда вы работаете с составом с многоатомными ионами.
Читайте также: Как попросить экспертов сделать мою исследовательскую работу за меня и получить идеальные результаты?
Уравновешивание положительных и отрицательных зарядов ионов
Как вы теперь знаете, количество атомов каждого элемента, присутствующего в соединении, определяется зарядом каждого элемента или многоатомного иона.
 Чтобы сбалансировать заряды, вы должны уравнять их для обоих элементов соединения, добавив атомы.
Чтобы сбалансировать заряды, вы должны уравнять их для обоих элементов соединения, добавив атомы.Возьмем, к примеру, оксид лития. Это соединение содержит литий и кислород. Но литий из группы 1 и, следовательно, имеет заряд +1, а кислород из группы 16 и имеет заряд 2. Это должно быть сбалансировано, поэтому вам понадобится 2 атома лития. Это уравновесит 2 заряда кислорода, а формула этого соединения – Li2O.
Как написать формулы для продукта с учетом реагентов
В уравнении двойной замены будет 2 катиона и аниона.Например AB + CD → AD + CB. Здесь катионы – это A и C, а анионы – это B и D. Рассмотрим для примера реальную формулу, то есть AgNO 3 + NaCl, здесь Ag и Na – катионы, а NO 3 и CI – анионы.
Теперь переключение ионов в приведенной выше формуле, так что это будет выглядеть как AgCI + NaNO 3 . В этом переключателе первый катион и второй анион составляют пару, а второй катион и первый анион составляют пару.
Поместив в уравнение реагенты слева и продукты справа, получается полное уравнение.

Например: AgNO 3 + NaCl → AgCI + NaNO 3 .
Вы также должны указать в скобках состояние вещества как для реагентов, так и для продуктов. В формуле (s) обозначает твердое вещество, (l) обозначает жидкость, а (g) обозначает газ. Вы должны указать состояние после каждого элемента, как показано в примере ниже.
SnO2 (s) + 2 h3 (g) → Sn (s) + 2 h3O (g)
Теперь вы должны быть достаточно знакомы, чтобы писать химические формулы. Однако вы можете найти больше примеров в Интернете и попрактиковаться, написав больше формул самостоятельно.
Обзор эмпирических исследований
Развитие интереса учащихся к школьной научной деятельности, их понимание основных химических концепций и взаимодействие между обоими конструкциями в 5–11 классах были проанализированы с помощью карандаша и бумаги. исследование (N = 2,510, средний возраст 11-17 лет). Предыдущие эмпирические данные показывают, что знания учащихся увеличиваются во время учебы в средней школе, в то время как интерес учащихся, особенно к естественным наукам, имеет тенденцию к снижению.
 В то же время есть свидетельства увеличения положительной связи между интересом и знаниями во времени. Однако предыдущие исследования в основном полагались на довольно глобальные показатели, например, школьные оценки или общий предметный интерес, и сосредотачивались на науке как интегрированном предмете, а не на конкретных дисциплинах, например, химии. В этой статье представлены более близкие и дифференцированные меры для понимания учащимися трех химических концепций (химическая реакция, энергия, материя) и интереса к семи измерениям школьной научной деятельности в соответствии с моделью RIASEC + N (реалистичный, исследовательский, художественный, социальный, Предприимчивый, обычный и сетевой; ср.Dierks, Höffler, & Parchmann, 2014). Результаты согласуются с предыдущими исследованиями, указывающими на общий рост концептуального понимания и снижение интереса учащихся ко всей школьной научной деятельности. Однако взаимодействие между концептуальным пониманием и интересом различается по семи измерениям.
В то же время есть свидетельства увеличения положительной связи между интересом и знаниями во времени. Однако предыдущие исследования в основном полагались на довольно глобальные показатели, например, школьные оценки или общий предметный интерес, и сосредотачивались на науке как интегрированном предмете, а не на конкретных дисциплинах, например, химии. В этой статье представлены более близкие и дифференцированные меры для понимания учащимися трех химических концепций (химическая реакция, энергия, материя) и интереса к семи измерениям школьной научной деятельности в соответствии с моделью RIASEC + N (реалистичный, исследовательский, художественный, социальный, Предприимчивый, обычный и сетевой; ср.Dierks, Höffler, & Parchmann, 2014). Результаты согласуются с предыдущими исследованиями, указывающими на общий рост концептуального понимания и снижение интереса учащихся ко всей школьной научной деятельности. Однако взаимодействие между концептуальным пониманием и интересом различается по семи измерениям. Интерес к деятельности, которая может способствовать когнитивной активации (исследования, нетворкинг) или связанной с передачей знаний (социальная, предприимчивая и нетворкинг), все больше связана с концептуальным пониманием, особенно в старших классах средней школы.Однако интерес к управляемым практическим занятиям (реалистичным), которые типичны для преподавания в средней школе, показывает лишь небольшие положительные корреляции с концептуальным пониманием учащимися во всех классах. Следовательно, в старших классах средней школы исследовательская, социальная, предпринимательская и нетворческая деятельность, кажется, дает возможность извлечь наибольшую пользу из взаимосвязи между интересами учащихся и их пониманием.
Интерес к деятельности, которая может способствовать когнитивной активации (исследования, нетворкинг) или связанной с передачей знаний (социальная, предприимчивая и нетворкинг), все больше связана с концептуальным пониманием, особенно в старших классах средней школы.Однако интерес к управляемым практическим занятиям (реалистичным), которые типичны для преподавания в средней школе, показывает лишь небольшие положительные корреляции с концептуальным пониманием учащимися во всех классах. Следовательно, в старших классах средней школы исследовательская, социальная, предпринимательская и нетворческая деятельность, кажется, дает возможность извлечь наибольшую пользу из взаимосвязи между интересами учащихся и их пониманием.5.4 Определение эмпирических и молекулярных формул – CHEM 1114 – Введение в химию
Цели обучения
К концу этого раздела вы сможете:
- Определите эмпирическую формулу соединения
- Определите молекулярную формулу соединения
В предыдущем разделе мы обсудили, как рассчитать процентный состав на основе экспериментальных измерений массы.
 Теперь мы увидим, как применить это к определению химической формулы соединения.
Теперь мы увидим, как применить это к определению химической формулы соединения.Эмпирические формулы
Эмпирическая формула – простейшая формула соединения. Это наименьшее целочисленное отношение атомов, но оно не обязательно отражает расположение атомов в реальной молекуле.
Например: молекула перекиси водорода состоит из двух атомов O и двух атомов H, связанных вместе – молекулярная формула, таким образом, H 2 O 2 .Поскольку простейшее соотношение атомов H и O составляет 1: 1, эмпирическая формула (но не фактическое расположение атомов в молекуле) – это HO.
Пример 1
Определите эмпирическую формулу диоксина (C 12 H 4 Cl 4 O 2 ), очень сильного яда.
Решение
Нижние индексы – 12, 4, 4 и 2. Все они делятся на 2.
Таким образом, эмпирическая формула = C 12/2 H 4/2 Cl 4/2 O 2/2 = C 6 H 2 Класс 2 OПроверьте себя
Определите эмпирическую формулу для следующих соединений:
a) C 6 H 16 N 2 b) CCl 4 c) C 4 H 10
Ответы
a) C 3 H 8 N b) CCl 4 c) C 2 H 5
Определение эмпирических формул
Как упоминалось ранее, наиболее распространенный подход к определению химической формулы соединения – сначала измерить массы составляющих его элементов.
 Однако мы должны помнить, что химические формулы представляют собой относительные числа и , а не массы атомов в веществе. Следовательно, любые экспериментально полученные данные, включающие массу, должны использоваться для определения соответствующего числа атомов в соединении. Для этого мы можем использовать молярные массы, чтобы преобразовать массу каждого элемента в число молей. Затем мы рассматриваем моли каждого элемента относительно друг друга, преобразовывая эти числа в целочисленное соотношение, которое можно использовать для вывода эмпирической формулы вещества.Рассмотрим образец соединения, содержащий 1,71 г C и 0,287 г H. Соответствующее количество атомов (в молях) составляет:
Однако мы должны помнить, что химические формулы представляют собой относительные числа и , а не массы атомов в веществе. Следовательно, любые экспериментально полученные данные, включающие массу, должны использоваться для определения соответствующего числа атомов в соединении. Для этого мы можем использовать молярные массы, чтобы преобразовать массу каждого элемента в число молей. Затем мы рассматриваем моли каждого элемента относительно друг друга, преобразовывая эти числа в целочисленное соотношение, которое можно использовать для вывода эмпирической формулы вещества.Рассмотрим образец соединения, содержащий 1,71 г C и 0,287 г H. Соответствующее количество атомов (в молях) составляет:[латекс] 1.17 \; \ text {g C} \ times \ frac {1 \; \ text {mol C}} {12.011 \; \ text {g C}} = 0.0 \ underline {974} 11 \; \ текст {mol C with 3 sig figs} [/ латекс]
[латекс] 0,287 \; \ text {g H} \ times \ frac {1 \; \ text {mol H}} {1.00794 \; \ text {g H}} = 0. \ underline {284} 74 \; \ text {mol H с 3 фигами сиг} [/ латекс]
Таким образом, мы можем точно представить это соединение формулой C 0.
 974 H 0,284 . Конечно, согласно принятому соглашению, формулы содержат индексы целых чисел, что может быть достигнуто путем деления каждого индекса на меньший индекс:
974 H 0,284 . Конечно, согласно принятому соглашению, формулы содержат индексы целых чисел, что может быть достигнуто путем деления каждого индекса на меньший индекс:[латекс] \ text {C} _ {\ frac {0.0 \ underline {974} 11} {0.0 \ underline {974} 11}} \; \ text {H} _ {\ frac {0. \ underline {284} 74} {0.0 \ underline {974} 11}} \; \ text {или CH} _3 [/ latex]
(Напомним, что нижние индексы «1» не записываются, а предполагаются, если нет другого числа.)
Таким образом, эмпирическая формула этого соединения: CH 3 .Это может быть или не быть молекулярной формулой соединения ; однако нам потребуется дополнительная информация, чтобы сделать это определение (как обсуждается далее в этом разделе).
Рассмотрим другой пример, образец соединения, содержащий 5,31 г Cl и 8,40 г O. Следуя тому же подходу, получаем предварительную эмпирическую формулу:
[латекс] \ text {Cl} _ {0.150} \ text {O} _ {0.525} \; знак равно \ text {Cl} _ {\ frac {0.
 150} {0.150}} \; \ text {O} _ {\ frac {0.525} {0.150}} = \ text {ClO} _ {3.5} [/ латекс]
150} {0.150}} \; \ text {O} _ {\ frac {0.525} {0.150}} = \ text {ClO} _ {3.5} [/ латекс]В этом случае деление на наименьший нижний индекс по-прежнему оставляет нам десятичный нижний индекс в эмпирической формуле. Чтобы преобразовать это в целое число, мы должны умножить каждый из нижних индексов на два, сохраняя то же соотношение атомов и получая Cl 2 O 7 в качестве окончательной эмпирической формулы.
Таким образом, эмпирические формулы получены из экспериментально измеренных масс элементов:
- Определение количества молей каждого элемента из его массы
- Разделив молярное количество каждого элемента на наименьшее молярное количество, чтобы получить индексы для предварительной эмпирической формулы
- Умножение всех коэффициентов на целое число, если необходимо, чтобы обеспечить наименьшее целочисленное отношение индексов
Обратите внимание, что важно следовать обычному правилу не округлять значения в середине вычисления.
 (Следите за значащими цифрами после каждого шага, но затем используйте цифры в вашем калькуляторе после последней значащей цифры, когда вы переносите значение в последующие вычисления.) В конце концов, вы округлите до целых чисел.
(Следите за значащими цифрами после каждого шага, но затем используйте цифры в вашем калькуляторе после последней значащей цифры, когда вы переносите значение в последующие вычисления.) В конце концов, вы округлите до целых чисел.На рисунке 1 показана эта процедура в виде блок-схемы для вещества, содержащего элементы A и X.
Рис. 1. Эмпирическая формула соединения может быть получена из масс всех элементов в образце.Пример 2
Образец черного минерала гематита (рис. 2), оксида железа, обнаруженного во многих железных рудах, содержит 34.97 г железа и 15,03 г кислорода. Какая эмпирическая формула гематита?
Рисунок 2. Гематит – это оксид железа, который используется в ювелирных изделиях. (кредит: Мауро Катеб)Решение
Для этой задачи нам дана масса в граммах каждого элемента. Начните с поиска родинок каждого:[латекс] 34,97 \; \ text {g Fe} \ times \ frac {\ text {mol Fe}} {55.
 847 \; \ text {g}} = 0. \ underline {6261} 8 \; \ text {моль Fe с 4 фигами сиг} [/ латекс]
847 \; \ text {g}} = 0. \ underline {6261} 8 \; \ text {моль Fe с 4 фигами сиг} [/ латекс][латекс] 15.03 \; \ text {g O} \ times \ frac {\ text {mol O}} {15.9994 \; \ text {g}} = 0. \ underline {9394} 1 \; \ text {mol O with 4 sig figs} [/ latex]
Затем выведите молярное отношение железа к кислороду путем деления на меньшее число молей:
[латекс] \ begin {array} {r @ {{} = {}} l} \ frac {0. \ underline {6261} 8} {0. \ underline {6261} 8} & \ underline {1.000} 0 \; \ text {mol Fe с 4-мя фигами} \\ [1em] \ frac {0. \ underline {9394} 1} {0. \ underline {6261} 8} & \ underline {1.500} 2 \; \ text {мол О с 4 сиг фигами} \ end {array} [/ latex]
Коэффициент равен 1.000 моль железа на 1.500 моль кислорода (Fe 1 O 1,5 ). Наконец, умножьте соотношение на два, чтобы получить наименьшие возможные индексы целых чисел, сохраняя при этом правильное соотношение железа и кислорода:
[латекс] 2 (\ text {Fe} _1 \ text {O} _ {1.5}) = \ text {Fe} _2 \ text {O} _3 [/ латекс]
Эмпирическая формула: Fe 2 O 3 .

Проверьте себя
Какова эмпирическая формула соединения, если образец содержит 0.130 г азота и 0,370 г кислорода?Ответ
N 2 O 5
Полезно запомнить некоторые общие дроби в десятичной форме, чтобы вы могли определить, когда вам следует умножить на:
1/2 = 0,500, поэтому умножьте на 2
1/3 = 0,333…, (x3) 1/4 = 0,25, (x4)
2/3 = 0,666…, (x3) 3/4 = 0,75, (x4)Примечание: если у вас есть формула, в которой более одного десятичного знака, вы можете пошагово умножать:
Например: C 1.50 H 1,33 O 1 x 2 = C 3 H 2,66 O 2 x 3 = C 9 H 8 O 6
Пример 3
Обнаружено, что образец соединения массой 2,500 г, содержащий только углерод и водород, содержит 2,002 г углерода. Определите эмпирическую формулу.

Решение
Шаг 1: Нам говорят, что соединение содержит 2,002 г C. Чтобы найти H, вычтите C из общего количества 2.500 г – 2,002 г = 0,498 г H
Шаг 2: Преобразовать в моль:
[латекс] 2.002 \; \ text {g C} \ times \ frac {1 \; \ text {mol C}} {12.011 \; \ text {g C}} = 0. \ underline {1666} 8 \; \ text {mol C с 4 фигами сиг} [/ латекс]
[латекс] 0,498 \; \ text {g H} \ times \ frac {1 \; \ text {mol H}} {1.00794 \; \ text {g H}} = 0. \ underline {494} 1 \; \ text {mol H с 3 фигами сиг} [/ латекс]
Шаг 3: C 0,16668 / 0,16668 H 0,4941 / 0,16668 = C 1.000 H 2.96 Поскольку 2,96 находится в пределах нескольких сотых от целого числа 3, мы можем округлить до C 1 H 3 . [Примечание. Если значение коэффициента составляет <± 0,2 целого числа, оно может быть округлено.]
Имеем эмпирическую формулу: CH 3
Проверьте себя
Образец пара-дихлорбензола содержит 11,314 г углерода, 0,6330 г водорода и 11,132 г хлора.
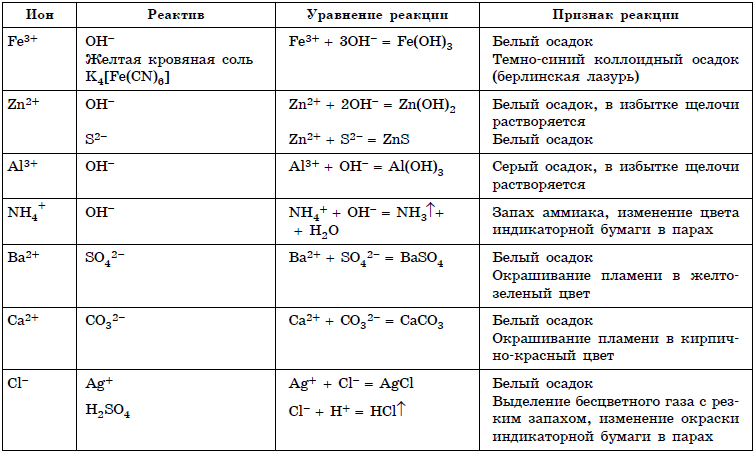 Какова эмпирическая формула этого соединения?
Какова эмпирическая формула этого соединения?Ответ
C 3 H 2 Класс
Дополнительные проработанные примеры, иллюстрирующие вывод эмпирических формул, можно найти в коротком видеоролике.
Получение эмпирических формул из процентного состава
Наконец, что касается вывода эмпирических формул, рассмотрим случаи, в которых доступен процентный состав соединения, а не абсолютные массы составляющих его элементов. В таких случаях процентный состав можно использовать для расчета масс элементов, присутствующих в любой удобной массе соединения; затем эти массы можно использовать для получения эмпирической формулы обычным способом.
Пример 4
Бактериальная ферментация зерна для производства этанола дает газ с процентным составом 27,29% C и 72,71% O (Рисунок 3). Какова эмпирическая формула этого газа?
Рис. 3. Окись углерода удаляется из этих бродильных чанов через большие медные трубы наверху. (кредит: «Dual Freq» / Wikimedia Commons)
(кредит: «Dual Freq» / Wikimedia Commons)Раствор
Поскольку шкала процентов равна 100, удобнее всего рассчитать массу элементов, присутствующих в образце весом 100 г.Расчет является «наиболее удобным», потому что, согласно определению процентного состава, масса данного элемента в граммах численно эквивалентна массовому процентному содержанию элемента. Эта числовая эквивалентность вытекает из определения «процентной» единицы, название которой происходит от латинской фразы « процентов », означающей «сотнями». Принимая во внимание это определение, представленные массовые проценты можно было бы более удобно выразить в виде дробей:[латекс] \ begin {array} {r @ {{} = {}} l} 27.29 \% \; \ text {C} & \ frac {27.29 \; \ text {g C}} {100 \; \ text {g соединение}} \\ [1em] 72.71 \% \; \ text {O} & \ frac {72.71 \; \ text {g O}} {100 \; \ text {g соединение}} \ end {array} [/ latex]
Молярные количества углерода и водорода в 100-граммовой пробе рассчитываются путем деления массы каждого элемента на его молярную массу:
[латекс] \ begin {array} {r @ {{} = {}} l} 27.
 29 \; \ text {g of C} (\ frac {\ text {mol C}} {12.011 \; \ text {g }}) & \ underline {2.272} 08 \; \ text {mol C with 4 sig figs} \\ [1em] 72.71 \; \ text {g of O} (\ frac {\ text {mol O}} {15 .9994 \; \ text {g}}) & \ underline {4.544} 54 \; \ text {mol O with 4 sig figs} \ end {array} [/ latex]
29 \; \ text {g of C} (\ frac {\ text {mol C}} {12.011 \; \ text {g }}) & \ underline {2.272} 08 \; \ text {mol C with 4 sig figs} \\ [1em] 72.71 \; \ text {g of O} (\ frac {\ text {mol O}} {15 .9994 \; \ text {g}}) & \ underline {4.544} 54 \; \ text {mol O with 4 sig figs} \ end {array} [/ latex]Коэффициенты для предварительной эмпирической формулы выводятся путем деления каждого молярного количества на меньшее из двух:
[латекс] \ begin {array} {r @ {{} = {}} l} \ frac {\ underline {2.272} 08 \; \ text {mol C}} {\ underline {2.272} 08} & 1.000 \ \ [1em] \ frac {\ underline {4.544} 54 \; \ text {mol O}} {\ underline {2.272} 08} & 2.000 \ end {array} [/ latex]
Поскольку результирующее соотношение составляет один атом углерода к двум атомам кислорода, эмпирическая формула CO 2 .
Проверьте себя
Какова эмпирическая формула соединения, содержащего 40,0% C, 6,71% H и 53,28% O?Ответ
CH 2 O
Пример 5
Оксид железа содержит 69,9% Fe по массе.
 Найдите его эмпирическую формулу. Примечание: «оксид» означает, что он содержит кислород, а также железо.
Найдите его эмпирическую формулу. Примечание: «оксид» означает, что он содержит кислород, а также железо.Решение
Шаг 1: Если принять образец 100 г, он должен содержать 69.9 г Fe и, следовательно, 100-69,9 = 30,1 г О.
Шаг 2: Преобразовать в моль:
[латекс] 69,9 \; \ text {g Fe} \ times \ frac {1 \; \ text {mol Fe}} {55.847 \; \ text {g Fe}} = \ underline {1.25} 16 \; \ text {моль Fe с 3 фигами сиг} [/ латекс]
[латекс] 30,1 \; \ text {g O} \ times \ frac {1 \; \ text {mol O}} {15.9994 \; \ text {g O}} = \ underline {1.88} 13 \; \ text {mol O with 3 sig figs} [/ latex]
Шаг 3: 1,2516… это наименьшее число, поэтому мы разделим каждый нижний индекс на это значение:
Fe 1.2516 O 1,8813 = Fe 1,2516 / 1,2516 O 1,8813 / 1,2516 = Fe 1,0000 O 1,503
Шаг 4: Поскольку отношение кислорода составляет 1,503 и не попадает в допустимый предел, в котором мы можем округлить [Примечание: пока значение отношения составляет <± 0,2 от целого числа, оно может быть округлено.
 ], Мы не может интерпретировать 1,503 как целое число (т.е. НЕ 1 или 2!). Мы понимаем, что 1,503 составляет приблизительно 1,50, поэтому мы можем умножить каждый нижний индекс на 2, чтобы получить целые числа: Fe 1 × 2 O 1.5 × 2 = Fe 2 O 3 .
], Мы не может интерпретировать 1,503 как целое число (т.е. НЕ 1 или 2!). Мы понимаем, что 1,503 составляет приблизительно 1,50, поэтому мы можем умножить каждый нижний индекс на 2, чтобы получить целые числа: Fe 1 × 2 O 1.5 × 2 = Fe 2 O 3 .Эмпирическая формула: Fe 2 O 3
Проверьте себя
Нейлон-6 содержит 63,68% C, 12,38% N, 9,80% H и 14,14% O по массе. Какова эмпирическая формула нейлона-6?
Ответ
C 6 H 11 НЕТ
Получение молекулярных формул
Напомним, что эмпирические формулы – это символы, представляющие относительных номеров элементов соединения.Определение абсолютного числа атомов, составляющих одну молекулу ковалентного соединения, требует знания как его эмпирической формулы, так и его молекулярной массы или молярной массы.
 Эти величины могут быть определены экспериментально с помощью различных методов измерения. Молекулярная масса, например, часто определяется из масс-спектра соединения (см. Обсуждение этого метода в предыдущей главе об атомах и молекулах). Молярную массу можно измерить с помощью ряда экспериментальных методов, многие из которых будут представлены в следующих главах этого текста.
Эти величины могут быть определены экспериментально с помощью различных методов измерения. Молекулярная масса, например, часто определяется из масс-спектра соединения (см. Обсуждение этого метода в предыдущей главе об атомах и молекулах). Молярную массу можно измерить с помощью ряда экспериментальных методов, многие из которых будут представлены в следующих главах этого текста.Молекулярные формулы получены путем сравнения молекулярной или молярной массы соединения с его массой по эмпирической формуле . Как следует из названия, эмпирическая формула массы – это сумма средних атомных масс всех атомов, представленных в эмпирической формуле. Если нам известна молекулярная (или молярная) масса вещества, мы можем разделить ее на массу эмпирической формулы, чтобы определить количество эмпирических формульных единиц на молекулу, которое мы обозначаем как n :
[латекс] \ frac {\ text {молекулярная или молярная масса (а.е.м. или} \; \ frac {\ text {g}} {\ text {mol}})} {\ text {эмпирическая формула массы (а.
 е.м. или} \ ; \ frac {\ text {g}} {\ text {mol}})} = n \; \ text {формульные единицы / молекула} [/ latex]
е.м. или} \ ; \ frac {\ text {g}} {\ text {mol}})} = n \; \ text {формульные единицы / молекула} [/ latex]Молекулярная формула затем получается путем умножения каждого нижнего индекса в эмпирической формуле на n , как показано общей эмпирической формулой A x B y :
[латекс] (\ text {A} _ {\ text {x}} \ text {B} _ {\ text {y}}) _ {\ text {n}} = \ text {A} _ {\ text {nx}} \ text {B} _ {\ text {nx}} [/ latex]
Например, рассмотрим ковалентное соединение, эмпирическая формула которого определена как CH 2 O.Масса по эмпирической формуле для этого соединения составляет приблизительно 30 а.е.м. (сумма 12 а.е.м. для одного атома C, 2 а.е.м. для двух атомов H и 16 а.е.м. для одного атома O). Если молекулярная масса соединения определена равной 180 а.е.м., это означает, что молекулы этого соединения содержат в шесть раз больше атомов, представленных в эмпирической формуле:
[латекс] \ frac {180 \; \ text {аму / молекула}} {30 \; \ frac {\ text {amu}} {\ text {формульная единица}}} = 6 \; \ text {формульная единица / молекула} [/ латекс]
Молекулы этого соединения затем представлены молекулярными формулами, индексы которых в шесть раз превышают индексы в эмпирической формуле:
[латекс] \ text {(CH} _2 \ text {O}) _ 6 = \ text {C} _6 \ text {H} _ {12} \ text {O} _6 [/ latex]
Обратите внимание, что этот же подход можно использовать с молярной массой (г / моль) вместо молекулярной массы (а.
 е.м.).
е.м.).Пример 6
Никотин, алкалоид из семейства пасленовых растений, который в основном отвечает за вызывающую привыкание природу сигарет, содержит 74,02% C, 8,710% H и 17,27% N. Если 40,57 г никотина содержит 0,2500 моль никотина, какова молекулярная формула?
Раствор
Определение молекулярной формулы на основе предоставленных данных потребует сравнения массы эмпирической формулы соединения с его молярной массой. В качестве первого шага используйте процентный состав, чтобы получить эмпирическую формулу соединения.Допустим, 100-граммовый образец никотина дает следующие молярные количества его элементов:[латекс] \ begin {array} {r @ {{} = {}} l} (74.02 \; \ text {g C}) (\ frac {1 \; \ text {mol C}} {12.011 \; \ text {g C}}) & \ underline {6.162} 68 \; \ text {mol C with 4 sig figs} \\ [1em] (8.710 \; \ text {g H}) (\ frac {1 \; \ text {mol H}} {1.00794 \; \ text {g H}}) & \ underline {8.641} 39 \; \ text {mol H с 4 сигн.
 фиг} \\ [1em] (17.27 \; \ text { g N}) (\ frac {1 \; \ text {mol N}} {14.0067 \; \ text {g N}}) & \ underline {1.232} 98 \; \ text {mol N с 4 сигн. Фиг} \ end {array} [/ latex]
фиг} \\ [1em] (17.27 \; \ text { g N}) (\ frac {1 \; \ text {mol N}} {14.0067 \; \ text {g N}}) & \ underline {1.232} 98 \; \ text {mol N с 4 сигн. Фиг} \ end {array} [/ latex]Затем мы вычисляем молярные отношения этих элементов относительно наименее распространенного элемента, N.
[латекс] \ frac {\ underline {1.232} 98} {\ underline {1.232} 98} = 1.000 \; \ text {mol N} = 1 \; \ text {mol N} [/ latex]
[латекс] \ frac {\ underline {6.162} 68} {\ underline {1.232} 98} = 4.999 \; \ text {mol C} = 5 \; \ text {mol C} [/ latex]
[латекс] \ frac {\ underline {8.641} 39} {\ underline {1.232} 98} = 7.008 \; \ text {mol H} = 7 \; \ text {mol H} [/ latex]
Молярные отношения C к N и H к N достаточно близки к целым числам, поэтому эмпирическая формула C 5 H 7 N.Таким образом, эмпирическая формула массы для этого соединения составляет 81,117 а.е.м. на формульную единицу или 81,117 г / моль на формульную единицу.
Рассчитываем молярную массу никотина исходя из заданной массы и молярного количества соединения:
[латекс] \ frac {40.
 57 \; \ text {g nicotine}} {0.2500 \; \ text {mol nicotine}} = \ frac {162.3 \; \ text {g}} {\ text {mol}} [/ латекс]
57 \; \ text {g nicotine}} {0.2500 \; \ text {mol nicotine}} = \ frac {162.3 \; \ text {g}} {\ text {mol}} [/ латекс]Сравнение молярной массы и эмпирической формулы массы показывает, что каждая молекула никотина содержит две формульные единицы:
[латекс] \ frac {162.3 \; \ text {г / моль}} {81.117 \; \ frac {\ text {g}} {\ text {формульная единица}}} = 2 \; \ text {формульная единица / молекула} [/ латекс]
Таким образом, мы можем вывести молекулярную формулу никотина из эмпирической формулы, умножив каждый нижний индекс на два:
[латекс] (\ text {C} _5 \ text {H} _7 \ text {N}) _ 2 = \ text {C} _ {10} \ text {H} _ {14} \ text {N} _2 [ / латекс]
Проверьте себя
Какова молекулярная формула соединения с процентным составом 49,47% C, 5.201% H, 28,84% N и 16,48% O и молекулярная масса 194,2 а.е.м.Ответ
C 8 H 10 N 4 O 2
Пример 7
Образец 13,8 г соединения, содержащего только азот и кислород, при разложении дает 4,2 г азота.
 Какова его эмпирическая формула и молекулярная формула, если молярная масса составляет 90,3 г / моль?
Какова его эмпирическая формула и молекулярная формула, если молярная масса составляет 90,3 г / моль?Решение
Для начала нам нужно определить эмпирическую формулу:
Шаг 1: Нам говорят, что он содержит 4.2 г N. Таким образом, он должен содержать 13,8 г – 4,2 г = 9,6 г О.
Шаг 2: Преобразовать в моль:
[латекс] 4,3 \; \ text {g N} \ times \ frac {1 \; \ text {mol N}} {14.0067 \; \ text {g N}} = 0. \ underline {30} 7 \; \ text {mol N с двумя фигами сиг} [/ латекс]
[латекс] 9,5 \; \ text {g O} \ times \ frac {1 \; \ text {mol O}} {15.9994 \; \ text {g O}} = 0. \ underline {59} 4 \; \ text {mol O with 2 sig figs} [/ latex]
Шаг 3: N 0,307 / 0,307 O 0,594 / 0,307 = N 1,00 O 1.93
Шаг 4: Значение 1,93 (вычислено до 2 сигн. Фиг.) Достаточно близко для округления до целого числа, или NO 2
Затем нам нужно использовать значения молярной массы для определения молекулярной формулы:
Шаг 1:
Эмпирическая формула Молярная масса = 14,0067 г / моль + 2 (15,9994 г / моль) = 46,0055 г / моль
Шаг 2:
Молярная масса молекулярной формулы / Молярная масса эмпирической формулы = 90,3 г / моль / 46,0055 г / моль = 1,963 (до 3 SF) = 2
Шаг 3: N 1 × 2 O 2 × 2 = N 2 O 4
Проверьте себя
Кофеин содержит водород, углерод, азот и кислород.
 Массовый% состав следующий: C = 49,47%; H = 5,191%; N = 28,86%; О = 16,48%. Молярная масса составляет примерно 194 г / моль. Определите молекулярную формулу.
Массовый% состав следующий: C = 49,47%; H = 5,191%; N = 28,86%; О = 16,48%. Молярная масса составляет примерно 194 г / моль. Определите молекулярную формулу.Ответ
C 8 H 10 N 4 O 2
Ключевые концепции и резюме
Химическая идентичность вещества определяется типами и относительным числом атомов, составляющих его основные сущности (молекулы в случае ковалентных соединений, ионы в случае ионных соединений).Процентный состав соединения обеспечивает массовый процент каждого элемента в соединении, и он часто определяется экспериментально и используется для вывода эмпирической формулы соединения. Эмпирическую формулу массы ковалентного соединения можно сравнить с молекулярной или молярной массой соединения для получения молекулярной формулы.
Определение эмпирической формулы
ШАГ 1: Определите массу каждого элемента в конкретном образце. Если вам даны данные в виде процентного состава, проще всего принять общий размер выборки 100 г.
 (Если процент одного элемента составляет 64%, 100 г соединения будет содержать 64 г этого конкретного элемента.)
(Если процент одного элемента составляет 64%, 100 г соединения будет содержать 64 г этого конкретного элемента.)ШАГ 2: Для каждого элемента замените g [латекс] \ longrightarrow [/ латекс] мол. Эти мольные значения становятся индексами первой попытки для формулы, например, C 0,1 H 0,4 O 0,1
ШАГ 3: Теперь разделите индекс каждого элемента на наименьшее значение индекса.
Например: C 0,1 H 0,4 O 0,1 , разделите каждый нижний индекс на 0.1 и получаем CH 4 OШАГ 4: Если какой-либо нижний индекс НЕ является целым числом (или легко округляется до единицы), умножьте ВСЕ нижние индексы на наименьшее целое число, которое превратит все нижние индексы в целые числа. Теперь это эмпирическая формула. Например: C 1,5 N 0,5 H 4 умножьте каждое на 2 и получите C 3 NH 8
Определение молекулярной формулы по эмпирической формуле
ШАГ 1: Рассчитайте молярную массу по эмпирической формуле.

ШАГ 2: Разделите полученную молекулярную молярную массу на молярную массу, рассчитанную по эмпирической формуле.
ШАГ 3: Умножьте каждый индекс на целое число, полученное на шаге 2. Теперь это молекулярная формула.
Ключевые уравнения
- [латекс] \% \ text {X} = \ frac {\ text {mass X}} {\ text {mass commpound}} \ times 100 \% [/ latex]
- [латекс] \ frac {\ text {молекулярная или молярная масса (а.е.м. или} \; \ frac {\ text {g}} {\ text {mol}})} {\ text {эмпирическая формула массы (а.е.м. или} \ ; \ frac {\ text {g}} {\ text {mol}})} = n \; \ text {формульные единицы / молекула} [/ latex]
- (A x B y ) n = A nx B ny
Упражнения
1.Определите эмпирические формулы для соединений со следующим процентным составом:
a) 15,8% углерода и 84,2% серы
б) 40,0% углерода, 6,7% водорода и 53,3% кислорода
2. Соединение углерода и водорода содержит 92,3% углерода и имеет молярную массу 78,1 г / моль.
 Какова его молекулярная формула?
Какова его молекулярная формула?3. Определите эмпирическую и молекулярную формулу хризотилового асбеста. Хризотил имеет следующий процентный состав: 28,03% Mg, 21,60% Si, 1,16% H и 49.21% О. Молярная масса хризотила составляет 520,8 г / моль.
4. Крупный производитель красителей для текстиля разработал новый желтый краситель. Краситель имеет процентный состав 75,95% C, 17,72% N и 6,33% H по массе с молярной массой около 240 г / моль. Определите молекулярную формулу красителя.
ответы
1. а) CS 2 б) CH 2 O
2. C 6 H 6
3. Mg 3 Si 2 H 3 O 8 (эмпирическая формула), Mg 6 Si 4 H 6 O 16 (молекулярная формула)
4.С 15 Н 15 Н 3
Глоссарий
эмпирическая формула: – простейшая формула соединения.

