Основные Химические формулы для решения задач.
5urokov.ru|write-online.ucoz.com|5urokov.ru
| № | Количественные характеристики вещества | Обозначение | Единицы измерения | Формула для расчета |
|---|---|---|---|---|
| 1 | Плотность вещества | ρ | кг/м³ | ρ = m / V(Массу делим на объем вещества) |
| 2 | Относительная атомная масса элемента | Аr | – | Ar = ma / u см. в периодической система химических элементов |
| 3 | Атомная единица массы | u а.е.м. | кг | u = 1/12 * ma (12C) const = 1.66*10-27 |
| 4 | Масса атома (абсолютная) | ma | кг | ma = Ar * u |
| 5 | Относительная молекулярная (формульная) масса вещества | Mr | – | Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
| 6 | Масса молекулы (формульной единицы) | m M | кг | mM = Mr*u |
| 7 | Количество вещества | n | моль | n=m/M n=N/NA n=V/VM |
| 8 | Молярная масса (масса 1 моль вещества) | M | г/моль | M=m/n M=Mr M=Ar (для простых веществ) |
| 9 | Масса вещества | m | г (кг) | m=M*n m=ρ*V |
| 10 | Число структурных единиц | N | атомов, молекул, ионов, частиц, формульных единиц (Ф.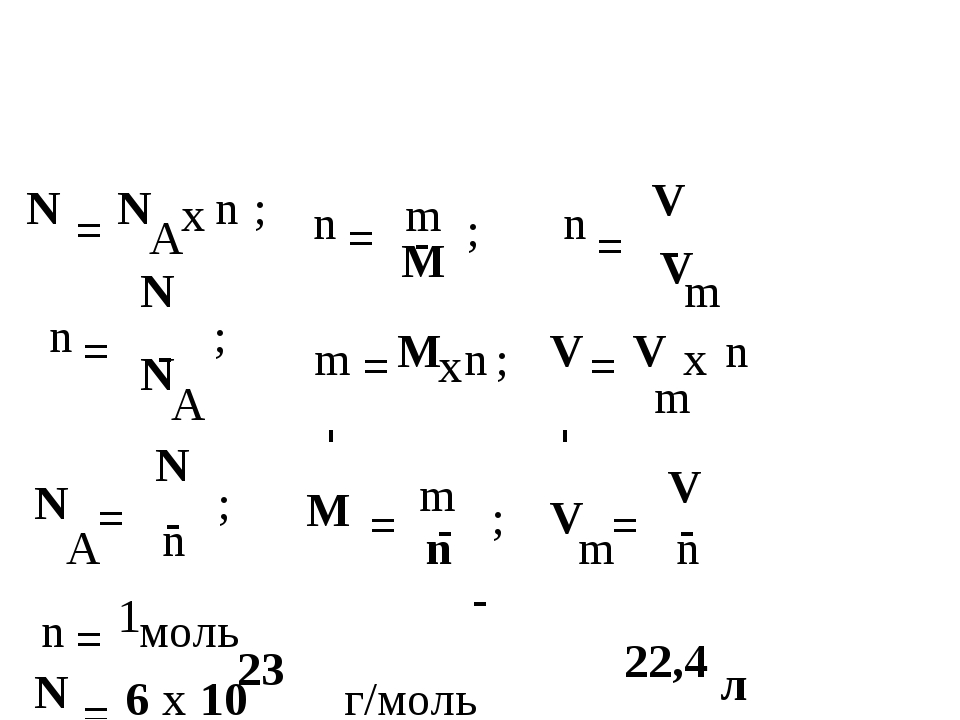 Е.) Е.) | N=NA*n |
| 11 | Молярный объем – число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) | VM | л/моль | const=22,4 |
| 12 | Объем газа при н.у. | V | л | V=VM*n V=m/ρ |
| 13 | Постоянная Авогадро | NA | частиц/моль | const=6,02*1023 |
| 14 | Массовая доля вещества (омега) | ωЭ/В | % | ωЭ/В = (Ar(э) * k) / Mr(В) |
| Формула | Название кислоты | Формула кислотного остатка | Название кислотного остатка |
|---|---|---|---|
| HF | Фтороводород, плавиковая | F– | Фторид |
| HCl | Хлороводород, соляная | Cl– | Хлорид |
| HBr | Бромоводород | Br– | Бромид |
| HI | Йодоводород | I– | Йодид |
| h3S | Сероводород | S2- | Сульфид |
| HCN | Циановодородная | CN– | Цианид |
| HNO2 | Азотистая | NO2– | Нитрит |
| HNO3 | Азотная | NO3– | Нитрат |
| h4PO4 | Ортофосфорная | PO43- | Фосфат |
| h4AsO4 | Мышьяковая | AsO43- | Арсенат |
| h3SO3 | Сернистая | SO32- | Сульфит |
| h3SO4 | Серная | SO42- | Сульфат |
| h3CO3 | Угольная | CO32- | Карбонат |
| h3SiO3 | Кремниевая | SiO32- | Силикат |
| h3CrO4 | Хромовая | CrO42- | Хромат |
| h3Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| HMnO4 | Марганцовая | MnO4 | Перманганат |
| HClO | Хлорноватистая | ClO– | Гипохлорит |
| HClO2 | Хлористая | ClO2– | Хлорит |
| HClO3 | Хлорноватая | ClO3– | Хлорат |
| HClO4 | Хлорная | ClO4– | Перхлорат |
| HCOOH | Метановая, муравьиная | HCOO– | Формиат |
| Ch4COOH | Этановая, уксусная | Ch4COO– | Ацетат |
| h4C2O4 | Этандиовая, щавелевая | C2O42- | Оксалат |
Нажмите на картинку для увеличения
Методы решения задач по химии.
 Задачи на вывод химической формулы вещества
Задачи на вывод химической формулы веществаС задачами на вывод химической формулы вещества учащиеся встречаются при прохождении программы химии с 8 по 11 классы. К тому же, данный тип задач довольно часто встречается в олимпиадных заданиях, контрольно – измерительных материалах ЕГЭ (части В и С). Диапазон сложности данных задач достаточно широк. Как показывает опыт, у школьников часто возникают затруднения уже на первых этапах решения при выводе молярной массы вещества.
В данной разработке предлагаются задачи на нахождение формулы вещества, исходя из разных параметров в условиях. В представленных задачах приведены различные способы нахождения молярной массы вещества. Задачи составлены таким образом, чтобы учащиеся могли освоить оптимальные методы и различные варианты решения. Наглядно демонстрируются наиболее общие приёмы решений. Для учащихся предлагаются решённые задачи по принципу нарастания сложности и задачи для самостоятельного решения.
Таблица 1
Вывод химической формулы вещества: |
Номер задачи |
Вычисление молярной массы вещества | Задачи для самостоятельного решения |
– на основании массовых долей (%) атомов элементов |
1 |
M, где n – число атомов |
Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47 %; кислород – 57,47%. Ответ: NaNO3 |
– на основании массовых долей (%) атомов элементов и плотности соединения |
2 | М (CхНу) = D(Н2) ·М (Н2) |
Относительная плотность паров органического кислородсодержащего соединения по кислороду равна 3, 125. |
– по плотности вещества в газообразном состоянии |
3 |
М (в-ва) = ρ · М (газообр. в-ва) |
Относительная плотность паров предельного альдегида по кислороду равна 1,8125. Выведите молекулярную формулу альдегида. Ответ: C3Н6О |
– на основании массовых долей (%) атомов элементов и массе соединения |
4 |
М находится по соотношению, |
Углеводород содержит 81,82 % углерода. Ответ: C3Н8 |
– по массе или объёму исходного вещества и продуктам горения |
5 |
М (в-ва)=Vm·ρ |
Относительная плотность паров кислородсодержащего органического соединения по гелию равна 25,5. При сжигании 15,3 г. этого вещества образовалось 20,16 л. СО2 и 18,9 г. Н2О. Выведите молекулярную формулу этого вещества. |
Приводится пример решения задачи № 6 на применение уравнения Менделеева – Клайперона
Задача № 1
Массовая доля кислорода в одноосновной аминокислоте равна 42,67%. Установите молекулярную формулу кислоты.
Установите молекулярную формулу кислоты.
Дано: |
Решение: M кислоты = 75 (г/моль) |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 2
Относительная плотность углеводорода по водороду, имеющего состав: w(С) = 85,7 %; w (Н) = 14,3 %, равна 21. Выведите молекулярную формулу углеводорода.
Выведите молекулярную формулу углеводорода.
Дано: |
Решение:
М (CхНу)= 21 · 2 = 42
m (Н) = 42г. /100% · 14,3 %= 6 г. Ответ: истинная формула вещества C3Н6. |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 3
Определите молекулярную формулу алкана, если известно, что его пары в 2,5 раза тяжелее аргона.
Дано: |
Решение: |
Вывести формулу алкана |
Вернуться к табл.1
Задача № 4
Массовая доля углерода в соединении равна 39,97 %, водорода 6, 73 %, кислорода 53,30 %. Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
Масса 300 мл. (н.у.) этого соединения равна 2,41 г. Выведите молекулярную формулу этого вещества.
Дано: |
Решение: |
Вывести формулу соединения |
Вернуться к табл.1
Задача № 5
Какова молекулярная формула углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г. его в кислороде образовалось 6,72 л. СО2 и 7,2 г. Н2О.
Дано: |
Решение: Составляем пропорции: |
Вывести формулу |
Вернуться к табл. 1
1
Задача № 6
Соединение содержит 62,8% S и 37,2% F. Масса 118 мл данного соединения при 70 и 98,64 КПа равна 0,51 г. Вывести формулу соединения.
Дано: |
Решение:
n(S) : n(F) = 62,80/32 : 37,2/19 = 1,96 : 1,96 = 1 : 1
M= (0, 51 · 8,31 · 280)/(98,64 ·103·118 ·10-6) = =101,95 г/моль.
Следовательно, формула соединения S2 F2 Ответ: S2F2 |
Вывести формулу соединения |
Вернуться к табл.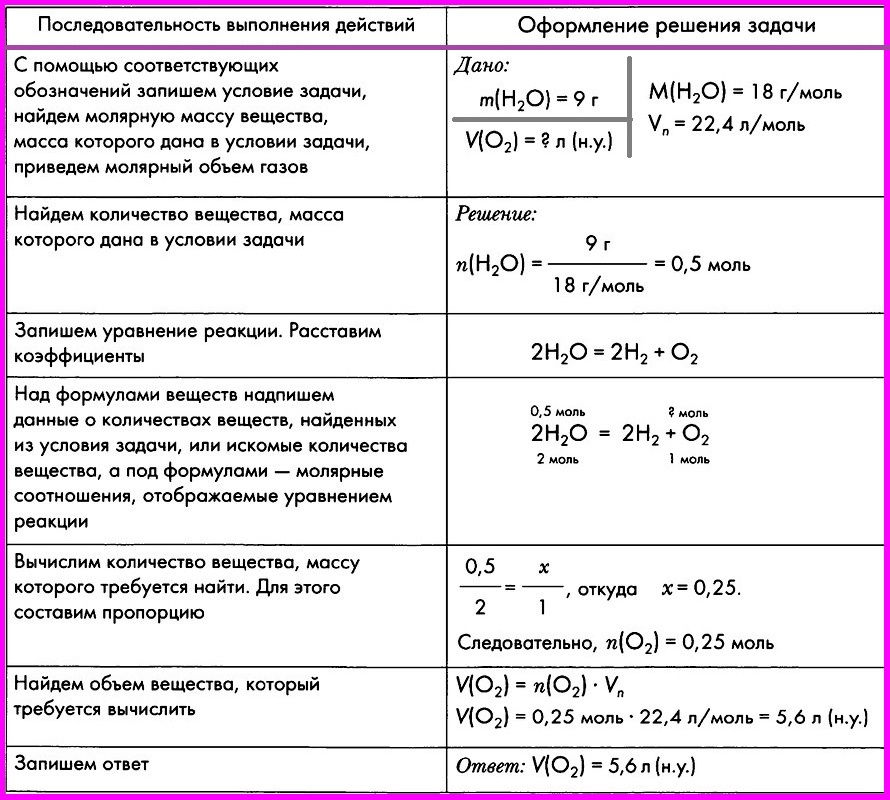 1
1
App Store: Химия
Решайте химические уравнения, Таблица Менделеева 2021, Таблица Растворимости и другие – и всё в одном приложении! Незаменимый помощник по химии! Химия – это просто!
Приложение находит Химические Реакции и химические уравнения с одним и несколькими неизвестными. У вас всегда будет под рукой Таблица Менделеева и Таблица Растворимости. И даже калькулятор молярных масс!
Добавляйте виджеты с химическими элементами на рабочий стол – запоминайте полезную информацию подсознательно.
Находит уравнения химических реакций, даже если неизвестна правая или левая часть, поможет с органической и неорганической химией. Вам будут отображен список найденных реакций в обычном и ионном виде и нарисованы формулы органической химии.
Удобная интерактивная Таблица Менделеева с поиском и информацией о всех химических элементах доступной оффлайн. Нажмите на химический элемент в таблице, чтобы посмотреть справочную информацию.
Запоминайте химические элементы подсознательно с использованием виджетов для рабочего стола. Разместите один или несколько виджетов и время от времени смотрите информацию о химических элементах: порядковый номер и расположение в Таблице Менделеева, фотографии химических веществ, даты открытия элементов.
Калькулятор молярных масс. Введите правильно химическое соединение и калькулятор покажет молярные массы и процентные содержания элементов в заданном химическом веществе.
Таблица растворимости будет всегда под рукой, и вы сможете понять какая реакция идет, а какая нет. Теперь не придется открывать учебник, чтобы узнать нужную информацию.
Самый лучший решатель химических уравнений для iPhone и iPad.
* Таблица Менделеева
* Таблица растворимости
* Поиск химических реакций
* Оффлайн доступ к информации о химических элементах
* Калькулятор молярных масс химических веществ
* Ряд электроотрицательности элементов
* Молекулярные массы органических веществ
* Электрохимический ряд активности металлов
* Ряд активности кислот
* Названия кислот и кислотных остатков
* Виджеты для легкого изучения Химии
И все эти таблицы и калькуляторы в бесплатном приложении Химия.
Подробнее про условия использовани приложения можно прочитать по следующим ссылкам:
Terms of Use: http://getchemistry.io/terms-and-conditions/ios/
Privacy policy: http://getchemistry.io/privacy-policy/ios/
Алгоритм решения задач по химическим уравнениям 8 класс
Алгоритм решения задач по химическим уравнениям
Запомни величины и формулы для расчета:
n- количество вещества (моль)
m- масса (г)
M-молярная масса (численно равна молекулярной массе) (г/моль)
V-объем (л)
Vm- молярный объем Vm=22,4 л/моль
n= ; m= n·M
n = ; V= n·Vm
1. Прочитай задачу. Определите массу оксида магния необходимого для сжигания 4,8 грамм магния.
2. Запиши дано задачи, найти.
Дано:
m (Мg)=4,8 г 3.Составь уравнение реакции и расставь коэффициенты:
Найти: 8г х г
m (МgО)=? 2Мg + О2 = 2 МgО
M (Мg)=24г/моль 2 моль 2 моль
M (МgО)=24+16=40 г/моль
4. Подчеркни в уравнении реакции формулы веществ данные в условии задачи и подпиши под формулами их количество вещества, а над формулами данные из условия задачи.
5. Рассчитай молярные массы веществ, используя соответствующие обозначения и запиши их в условие.
6. Найди количество известного вещества по формуле (Помни! Все расчетные задачи по уравнению реакции решаются через число моль)
n= (используем формулу для расчета количества вещества через массу)
n (Mg) == 0,2 моль
7. Сравнить число моль веществ по уравнению реакции и по расчету, в данном случаем по условию оно одинаковое 2n(Мg) = 2n(МgО), значит и по расчету число моль тоже одинаковое n(МgО)=n(Мg)=0,2 моль
8. Найди массу неизвестного вещества по формуле
Найди массу неизвестного вещества по формуле
m= n ·М
m (MgO)= 0,2 моль ·40 г/моль=8г
9. Запиши ответ: m (MgO)=8г.
Онлайн-решение задач химии | Домашнее задание по химии
Если эти странные уравнения, записанные учителем химии на классной доске, сводят вас с ума, не нужно мучить себя. Благодаря цифровому и технологическому прогрессу вы можете найти решение химических проблем для любого случая. Вот некоторые из них, которые вы можете использовать.
- Chem Wiz
- Калькулятор pH
- Балансировка химических уравнений
- Калькулятор кротов
- Калькулятор периодов полураспада (реакция второго порядка)
- Номенклатура
- Калькулятор химических реакций
- Калькулятор молярности Philip Harris
- Калькулятор химических реакций
- Балансировщик реакций
- Калькулятор частотного коэффициента
- Поиск элементов
- Generador de Estructuras de Lewis ITPA
- Калькулятор периодов полураспада (реакция нулевого порядка)
- Калькулятор pH
- Виджет VSEPR
- Калькулятор электронной конфигурации
- Оксид
- Фазовая диаграмма
- Химическая формула
- Элементы периодической таблицы
- Калькулятор валентной оболочки
- Химическая структура
- Калькулятор температуры воспламенения
- Найти и преобразовать массу по формуле грамма
- Этикетки NFPA для химических веществ
- Структура Льюиса
- Калькулятор периодов полураспада (реакция первого порядка)
- Идентификатор соединения
- Генератор трехмерной химической структуры
- Закон об идеальном газе
- Создатель молекулярной структуры
- Ящик для химикатов
- Калькулятор решений
- ДЖОЛЕЙ в эВ
- Онлайн-решение проблем
- Градус
- Калькулятор молярной массы
- Таблица реактивов Свойства II
- Калькулятор плотности воды
- Конвертер молей
- Калькулятор массового дефекта
- Определение постоянной скорости
- Поиск структуры Льюиса
- Калькулятор таблицы реактивов – настольный гаджет
- Поиск элемента
- Калькулятор pH для слабых кислот
10 лучших справочных приложений по химии
Химия – молярная массаЭто приложение предназначено как для iPhone, так и для iPad 0.  99 долларов США 99 долларов США |
Химическая формула Практика бесплатноЭто приложение предназначено как для iPhone, так и для iPad бесплатно |
Химия и таблица МенделееваЭто приложение предназначено как для iPhone, так и для iPad бесплатно |
Основы органической химииЭто приложение предназначено как для iPhone, так и для iPad бесплатно |
Набор тестов для органической химии LiteЭто приложение предназначено как для iPhone, так и для iPad бесплатно |
Название Лучшее по цене StudyBlue Это приложение, которое можно использовать на устройствах iOS и Android. Это учебное приложение, которое очень полезно для студентов, потому что оно создано студентами и запускается студентами. Это помогает студентам учиться с использованием 100% оригинального содержания, написанного студентами. Это очень интерактивное приложение, которым легко пользоваться.
Это учебное приложение, которое очень полезно для студентов, потому что оно создано студентами и запускается студентами. Это помогает студентам учиться с использованием 100% оригинального содержания, написанного студентами. Это очень интерактивное приложение, которым легко пользоваться.
Title Викторина по лучшей цене Это очень интерактивное приложение, которое помогает студентам готовиться к экзаменам. Он не только помогает студентам готовиться к тестам, но также помогает им готовиться к викторинам, тестам и экзаменам, потому что он настолько интерактивен. Это очень разностороннее приложение, потому что оно помогает студентам изучать очень много предметов.
Title Лучшее по цене Khan Academy Это приложение очень полезно для студентов, которые работают над своей математикой. Это помогает учащимся понять математику и математические задачи, с которыми у них могут возникнуть проблемы. В нем есть более 3000 видеороликов, которые студенты могут посмотреть и помочь им понять математику. В нем более 1000 практических задач и упражнений для студентов. Он очень интерактивен и прост в использовании.
В нем более 1000 практических задач и упражнений для студентов. Он очень интерактивен и прост в использовании.
Title Best For Price FlashCards + Это приложение очень полезно для студентов, потому что оно помогает им готовиться к экзаменам в интерактивной и увлекательной форме.Это помогает студентам готовиться к тестам, викторинам и экзаменам в увлекательной и интерактивной форме. Он имеет более 1000 наборов флеш-карт, которые можно использовать бесплатно. В нем более 100 000 флеш-карт, которые студенты могут использовать для подготовки к экзаменам.
Title Лучшее по цене eNotes Это приложение, которое можно использовать на устройствах iOS и Android. Это учебный инструмент, который помогает студентам с домашним заданием, и он очень полезен. У него есть учебное пособие, основанное на учебнике, и оно очень полезно для студентов.В нем есть словарь, который очень прост в использовании и навигации. В нем также есть глоссарий, который очень полезен для студентов.
Решение задач по химии для всех студентов-химиков
Когда вам нужно рассчитать молярную массу или уравновесить химическое уравнение, вы можете рассчитывать на решение химических задач, которое поможет вам. Этот инструмент достаточно всеобъемлющий. Это полезно для любого студента, независимо от типа и уровня курса химии, который он или она изучает. Если вам сложно что-то понять, решатель проблем поможет вам в процессе обучения.Если у вас есть опыт и навыки, это позволит вам сэкономить массу времени при выполнении домашней работы. Инструмент интуитивно понятен и очень прост в использовании.
Этот инструмент достаточно всеобъемлющий. Это полезно для любого студента, независимо от типа и уровня курса химии, который он или она изучает. Если вам сложно что-то понять, решатель проблем поможет вам в процессе обучения.Если у вас есть опыт и навыки, это позволит вам сэкономить массу времени при выполнении домашней работы. Инструмент интуитивно понятен и очень прост в использовании.
Домашнее задание по химии, чтобы получить хорошие оценки
Химия – это раздел науки, который учит студентов, как вещества ведут себя и взаимодействуют друг с другом. Это очень интересный предмет, который расширяет знания учащихся об элементах и принципах, регулирующих эти элементы. Но одна и та же химия оказывается сложной задачей для многих студентов, которые не могут запомнить формулы и уравнения, необходимые для понимания предмета.Это факт, что студенты должны запоминать множество формул и свойств веществ и газов, помимо запоминания того, как они реагируют с другими веществами и газами. Именно эти знания пригодятся при поиске ответов на домашние задания по химии, которые ставят учителя в школе. Для таких студентов, которые боятся химии, особенно формул этого предмета, становится важным организовать домашнее задание по химии, чтобы иметь возможность выполнять свои задания.
Именно эти знания пригодятся при поиске ответов на домашние задания по химии, которые ставят учителя в школе. Для таких студентов, которые боятся химии, особенно формул этого предмета, становится важным организовать домашнее задание по химии, чтобы иметь возможность выполнять свои задания.
Вам действительно нужна помощь, если вы не запомнили символы и значения
Если вы оказались одним из тысяч студентов, которые боятся химии из-за имен, символов и формул, которые вам нужно запомнить, чтобы решать задачи, вы повезло.Теперь вы можете получать домашние задания по химии, сидя дома, и то же самое с помощью всего лишь нескольких щелчков мышью на компьютере. Да, существует множество порталов, на которых можно найти ответы на домашние задания по химии учащимся, которые не могут выполнять задания, данные им учителями в школе. Конечно, вы платите небольшую сумму за такую услугу, но представьте себе комфорт и удобство, связанные с такой услугой.
Держитесь подальше от бесплатных онлайн-ресурсов
Если вас интересует программа для решения проблем химии , но вам трудно запомнить символы, валентности, свойства и характеристики различных веществ, лучший способ действий для вас – зарегистрироваться на веб-сайте или у онлайн-преподавателя, который может решить ваши проблемы в кратчайшие сроки. Хотя есть также репетиторы и веб-сайты, которые бесплатно предоставляют домашние задания по химии, вам лучше работать с веб-сайтами, которые взимают небольшую плату за свои услуги. Это связано с тем, что вы можете застрять в критический момент и не получить ответ на опубликованную вами проблему в случае бесплатного обслуживания. Это может нарушить ваши расчеты и снизить ваши оценки на выпускном экзамене. Чтобы избежать всего этого и получить быструю и эффективную помощь с домашним заданием по химии, выбирайте онлайн-справку с умом.
Хотя есть также репетиторы и веб-сайты, которые бесплатно предоставляют домашние задания по химии, вам лучше работать с веб-сайтами, которые взимают небольшую плату за свои услуги. Это связано с тем, что вы можете застрять в критический момент и не получить ответ на опубликованную вами проблему в случае бесплатного обслуживания. Это может нарушить ваши расчеты и снизить ваши оценки на выпускном экзамене. Чтобы избежать всего этого и получить быструю и эффективную помощь с домашним заданием по химии, выбирайте онлайн-справку с умом.
Есть несколько веб-сайтов, на которых работают лучшие из имеющихся специалистов в области химии.Эти эксперты остаются в распоряжении веб-сайта и в короткие сроки отвечают на вопросы зарегистрированных студентов. Из обзоров этих сайтов нужно убедиться в эффективности решателя домашних заданий по химии. Многие веб-сайты утверждают, что взломали вопросы из сотен учебников по химии. Вам нужно выбрать компанию с лучшими отзывами студентов. Если вы проведете небольшое исследование, прежде чем закончить онлайн-справку, вам никогда не придется беспокоиться о том, «как делать домашнее задание по химии» дома, не получив помощи от родителей, братьев и сестер.
10,6. Проблема химического уравнения – создание и запуск документации курса edX
Примечание
EdX не поддерживает этот тип проблем.
Тип задачи химического уравнения позволяет учащемуся ввести текст, который представляет химическое уравнение в текстовом поле. Система преобразует этот текст в химическое уравнение под текстовым полем. Оценщик оценивает ответ учащегося с помощью сценария Python, который вы создаете и встраиваете в проблема.
Примечание
Вы можете сделать калькулятор доступным для учащихся каждый страница блока. Для получения дополнительной информации см. Инструмент калькулятора.
В задачах с химическими уравнениями для создания формул используется MathJax. Для большего Информацию об использовании MathJax в Studio см. в разделе Использование MathJax для математики.
Чтобы создать указанное выше химическое уравнение, выполните следующие действия.
В блоке, где вы хотите создать проблему, выберите Проблема в Добавьте новый компонент , а затем выберите вкладку Advanced .
Выберите Пустая расширенная проблема .
В появившемся компоненте выберите Изменить .
В редакторе компонентов вставьте приведенный ниже код.
Выбрать Сохранить .
10.6.1.1. Пример кода задачи химического уравнения
<проблема>В некоторых задачах может потребоваться конкретное химическое уравнение. Попрактикуйтесь, записав следующую реакцию в поле ниже.-

 Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О
Массовая доля углерода равна 72%, водорода – 12 %. Выведите молекулярную формулу этого соединения. Ответ:C6H12О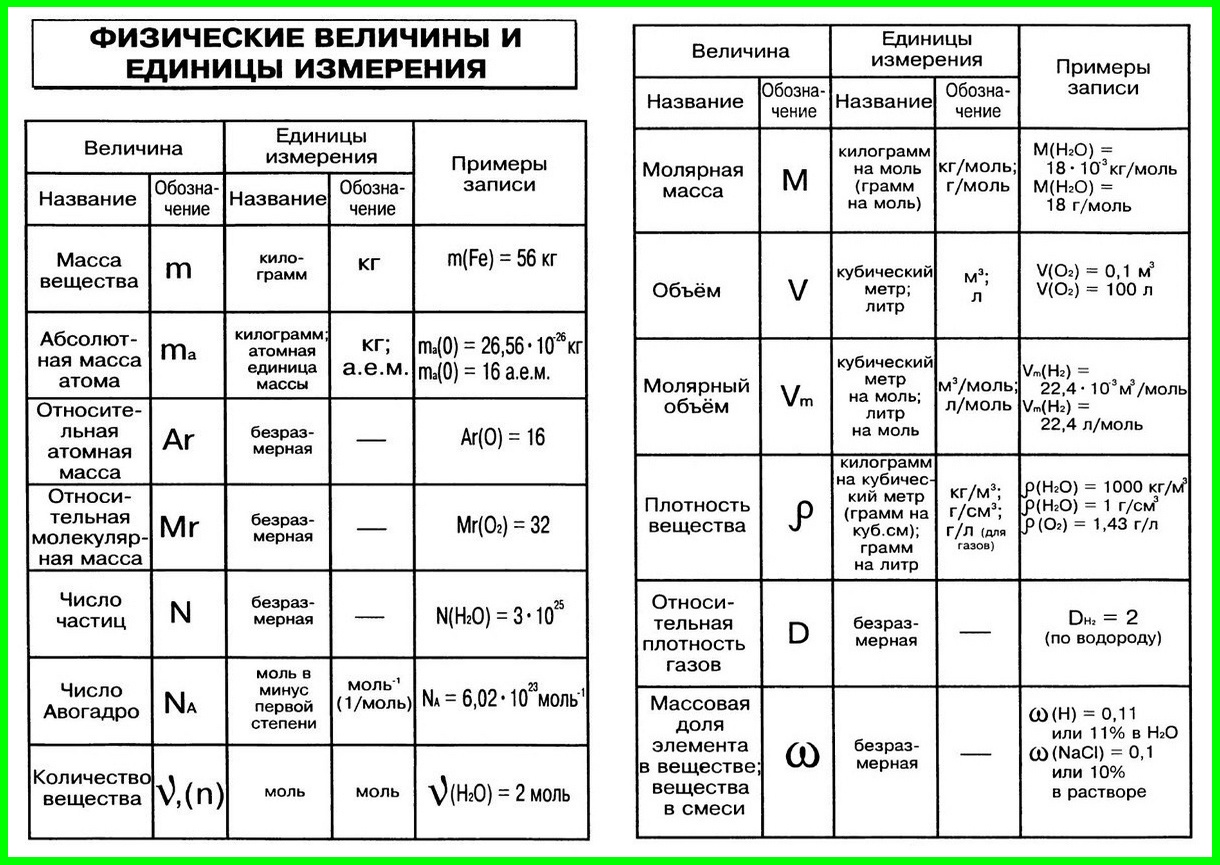
 – 2,41 г.
– 2,41 г.



 Вы всегда будете иметь под рукой Периодическую таблицу Менделеева и таблицу растворимости. И даже калькулятор молярных масс!
Вы всегда будете иметь под рукой Периодическую таблицу Менделеева и таблицу растворимости. И даже калькулятор молярных масс! Это интересный способ узнать и запомнить данные о химических элементах.
Это интересный способ узнать и запомнить данные о химических элементах. Они предоставляют студентам задания, видео-уроки, моделируемые эксперименты, периодические таблицы и ряд других материалов для повышения их усвоения химии.Проверьте их и поделитесь с нами своими отзывами. Ссылки на приложения находятся под визуалом.
Они предоставляют студентам задания, видео-уроки, моделируемые эксперименты, периодические таблицы и ряд других материалов для повышения их усвоения химии.Проверьте их и поделитесь с нами своими отзывами. Ссылки на приложения находятся под визуалом. EleMints может похвастаться феноменальной графикой сетчатки глаза и такими функциями, как свойства элементов, калькулятор молярной массы, график и многое другое.
EleMints может похвастаться феноменальной графикой сетчатки глаза и такими функциями, как свойства элементов, калькулятор молярной массы, график и многое другое.  Используйте приложение Formula MAX на своих устройствах iOS с эксклюзивным пользовательским интерфейсом на основе устройства всего за одну покупку. ’
Используйте приложение Formula MAX на своих устройствах iOS с эксклюзивным пользовательским интерфейсом на основе устройства всего за одну покупку. ’ ”’
”’ Хотя его открыли несколько исследователей, его формулировку чаще всего приписывают французскому ученому Антуану Лавуазье и иногда называют в его честь. Закон прост: атомы в закрытой системе нельзя ни создать, ни уничтожить. В реакции или серии реакций общая масса реагентов должна равняться общей массе продуктов. Что касается массы, стрелка в уравнении реакции становится знаком равенства, что очень помогает, когда дело доходит до отслеживания количества соединений в сложной реакции.
Хотя его открыли несколько исследователей, его формулировку чаще всего приписывают французскому ученому Антуану Лавуазье и иногда называют в его честь. Закон прост: атомы в закрытой системе нельзя ни создать, ни уничтожить. В реакции или серии реакций общая масса реагентов должна равняться общей массе продуктов. Что касается массы, стрелка в уравнении реакции становится знаком равенства, что очень помогает, когда дело доходит до отслеживания количества соединений в сложной реакции. Температура внутри закрытой системы может изменяться, и закрытая система может облучаться рентгеновскими лучами или микроволнами.Вам не нужно учитывать энергию, выделяемую во время экзотермической реакции или поглощаемую во время эндотермической реакции, при измерении массы до и после реакции. Некоторые соединения могут изменять состояние, а некоторые газы могут образовываться из твердых тел и жидкостей, но единственный важный параметр – это общая масса всех задействованных соединений. Он должен оставаться прежним.
Температура внутри закрытой системы может изменяться, и закрытая система может облучаться рентгеновскими лучами или микроволнами.Вам не нужно учитывать энергию, выделяемую во время экзотермической реакции или поглощаемую во время эндотермической реакции, при измерении массы до и после реакции. Некоторые соединения могут изменять состояние, а некоторые газы могут образовываться из твердых тел и жидкостей, но единственный важный параметр – это общая масса всех задействованных соединений. Он должен оставаться прежним. Разница в этих весах должна равняться общему весу газов, поднимающихся по дымоходу. Это основная идея решения всех проблем сохранения массы.
Разница в этих весах должна равняться общему весу газов, поднимающихся по дымоходу. Это основная идея решения всех проблем сохранения массы. Вы можете сбалансировать уравнение только путем изменения коэффициентов.
Вы можете сбалансировать уравнение только путем изменения коэффициентов. Например, четыреххлористый углерод и бром объединяются с образованием дибромдихлорметана и газообразного хлора. Сбалансированное уравнение этой реакции:
Например, четыреххлористый углерод и бром объединяются с образованием дибромдихлорметана и газообразного хлора. Сбалансированное уравнение этой реакции: 7
%
3008 0 объект
>
эндобдж
xref
3008 82
0000000016 00000 н.
0000004624 00000 н.
0000004859 00000 н.
0000004896 00000 н.
0000008046 00000 н.
0000008161 00000 п.
0000008280 00000 н.
0000008437 00000 н.
0000008486 00000 н.
0000008515 00000 н.
0000008554 00000 н.
0000009454 00000 п.
0000009987 00000 н.
0000010346 00000 п.
0000010795 00000 п.
0000010908 00000 п.
0000011515 00000 п.
0000011772 00000 п.
0000012217 00000 п.
0000012890 00000 н.
0000013451 00000 п.
0000013702 00000 п.
0000014147 00000 п.
0000014513 00000 п.
0000014617 00000 п.
0000014703 00000 п.
0000015383 00000 п.
0000016267 00000 п.
0000016973 00000 п.
0000017770 00000 п.
0000017904 00000 п.
0000017933 00000 п.
0000018264 00000 п.
0000018968 00000 п.
0000019631 00000 п.
0000020269 00000 н.
0000022636 00000 п.
0000023375 00000 п.
0000028397 00000 п.
0000059658 00000 п.
0000059852 00000 п.
0000060116 00000 п.
0000060504 00000 п.
0000060892 00000 п.
0000072016 00000 п.
0000072105 00000 п.
7
%
3008 0 объект
>
эндобдж
xref
3008 82
0000000016 00000 н.
0000004624 00000 н.
0000004859 00000 н.
0000004896 00000 н.
0000008046 00000 н.
0000008161 00000 п.
0000008280 00000 н.
0000008437 00000 н.
0000008486 00000 н.
0000008515 00000 н.
0000008554 00000 н.
0000009454 00000 п.
0000009987 00000 н.
0000010346 00000 п.
0000010795 00000 п.
0000010908 00000 п.
0000011515 00000 п.
0000011772 00000 п.
0000012217 00000 п.
0000012890 00000 н.
0000013451 00000 п.
0000013702 00000 п.
0000014147 00000 п.
0000014513 00000 п.
0000014617 00000 п.
0000014703 00000 п.
0000015383 00000 п.
0000016267 00000 п.
0000016973 00000 п.
0000017770 00000 п.
0000017904 00000 п.
0000017933 00000 п.
0000018264 00000 п.
0000018968 00000 п.
0000019631 00000 п.
0000020269 00000 н.
0000022636 00000 п.
0000023375 00000 п.
0000028397 00000 п.
0000059658 00000 п.
0000059852 00000 п.
0000060116 00000 п.
0000060504 00000 п.
0000060892 00000 п.
0000072016 00000 п.
0000072105 00000 п. 0000072161 00000 п.
0000095211 00000 п.
0000095282 00000 п.
0000097932 00000 н.
0000100185 00000 н.
0000102438 00000 н.
0000116362 00000 н.
0000119624 00000 н.
0000120012 00000 н.
0000120111 00000 п.
0000120268 00000 н.
0000120376 00000 н.
0000120486 00000 н.
0000120874 00000 н.
0000121266 00000 н.
0000121388 00000 н.
0000121545 00000 н.
0000121662 00000 н.
0000142545 00000 н.
0000142586 00000 н.
0000143775 00000 н.
0000143816 00000 н.
0000144197 00000 н.
0000144296 00000 н.
0000144445 00000 н.
0000144602 00000 н.
0000144694 00000 н.
0000144793 00000 н.
0000144950 00000 н.
0000145042 00000 н.
0000145141 00000 н.
0000145298 00000 н.
0000147091 00000 н.
0000209582 00000 н.
0000004397 00000 н.
0000001974 00000 н.
трейлер
] / Назад 4699344 / XRefStm 4397 >>
startxref
0
%% EOF
3089 0 объект
> поток
h Wkp {% {ҮJfjC4I
+% ٲ e) 5 /! 0 ㆔ $ yhm (4N 3̴ә6tѳ + ۲WF |; | JQAM: P = j @ Fpw; Y4owVcbjZiMYaWn ‘{V | tC3 {m #> 6n = + îsgv @ ˷ @ ^ – Kĉ / l7Pbʭ > Rx [͏ | 4 {̊kyOM? SONLG4Earcgm & fԐ% 7vԘIvw9hl * OWlta7) df; lNpmF
~ Wj) B_VEru4X4lDY];
0000072161 00000 п.
0000095211 00000 п.
0000095282 00000 п.
0000097932 00000 н.
0000100185 00000 н.
0000102438 00000 н.
0000116362 00000 н.
0000119624 00000 н.
0000120012 00000 н.
0000120111 00000 п.
0000120268 00000 н.
0000120376 00000 н.
0000120486 00000 н.
0000120874 00000 н.
0000121266 00000 н.
0000121388 00000 н.
0000121545 00000 н.
0000121662 00000 н.
0000142545 00000 н.
0000142586 00000 н.
0000143775 00000 н.
0000143816 00000 н.
0000144197 00000 н.
0000144296 00000 н.
0000144445 00000 н.
0000144602 00000 н.
0000144694 00000 н.
0000144793 00000 н.
0000144950 00000 н.
0000145042 00000 н.
0000145141 00000 н.
0000145298 00000 н.
0000147091 00000 н.
0000209582 00000 н.
0000004397 00000 н.
0000001974 00000 н.
трейлер
] / Назад 4699344 / XRefStm 4397 >>
startxref
0
%% EOF
3089 0 объект
> поток
h Wkp {% {ҮJfjC4I
+% ٲ e) 5 /! 0 ㆔ $ yhm (4N 3̴ә6tѳ + ۲WF |; | JQAM: P = j @ Fpw; Y4owVcbjZiMYaWn ‘{V | tC3 {m #> 6n = + îsgv @ ˷ @ ^ – Kĉ / l7Pbʭ > Rx [͏ | 4 {̊kyOM? SONLG4Earcgm & fԐ% 7vԘIvw9hl * OWlta7) df; lNpmF
~ Wj) B_VEru4X4lDY];