Примеры решения типовых задач на расчёт по формулам и вывод формул
Важно знать! Как научиться решать задачи по химии.
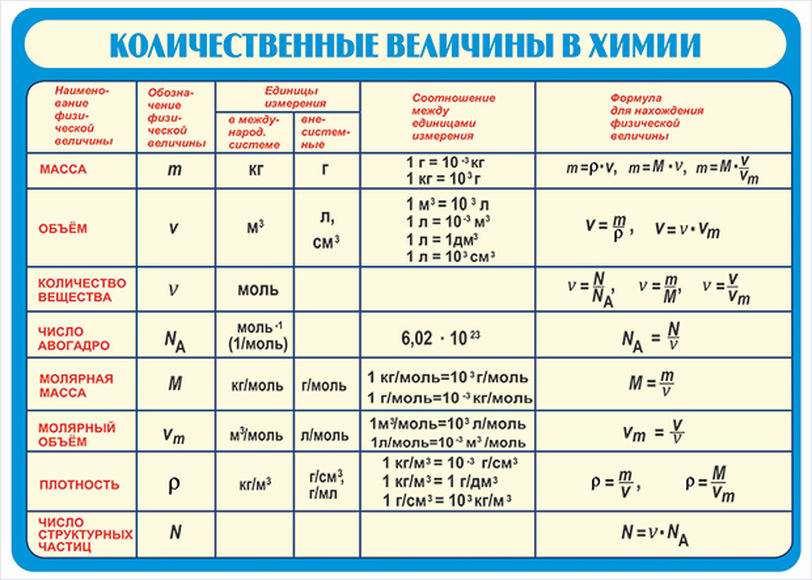
Задача 4.1. Определите массовые доли элементов в сульфате меди CuSO4.
Решение. Записываем формулу сульфата меди и определяем массы элементов в одном моле вещества:
М(С2Н5ОН) = 1 • 64 + 1 • 32 + 4 • 16 = 64 + 32 + 64 = 160 г/моль
Видно, что в 1 моле сульфата меди массой 160 г содержится 64 г меди, 32 г серы и 64 г кислорода.
Отсюда имеем:
w(Cu) = 64 г / 160 г = 0,40, w(S) = 32 г / 160 г = 0,20,
w(О) = 64 г / 160 г = 0,40.
Имея массовые доли элементов в соединении, можно вывести его молекулярную формулу, то есть определить числа атомов в молекулах. Так, для молекулы АxВyСz имеем массовые доли атомов: w(А) = х • М(А) / М,
w(В) = у • М(В) / М,
w(С) = z • М(С) / М,
где М — молярная масса молекулы,
М(А)

Имеем числа атомов элементов в молекуле:
х = w(А) • М / М(А),
у = w(В) • М / М(В),
z = w(С) • М / М(С).
Отсюда соотношение между числами атомов в молекуле равно частному от деления массовых долей элементов на молярные массы их атомов. Так, для молекулы АxВyСz имеем:
х : у : z = w(А) / М(А) : w(В) / М(В) : w(С) / М(С).
При этом массовые доли удобнее выражать в процентах. Вместо массовых долей можно брать пропорциональные им массы элементов для одного и того же количества вещества АxВy
Задача 4.2. Соль содержит по массе 6,25% водорода, 43,75% азота и 50,0% кислорода. Определите простейшую формулу соли.
Решение. Для HxNyOz имеем:
х : у : z = 6,25 / 1 : 43,75 / 14 : 50 / 16 = 6,25 : 3,125 : 3,125 = 2 : 1 : 1 = 4 : 2 : 2.
В соли отсутствует металл, но есть азот и водород, значит это соль аммония, и в молекуле должно быть не менее четырех атомов водорода. Поэтому формула соли — Н4N2O2 или NH4NO2.
Задача 4.3. Определите предельный двухатомный спирт, массовая доля углерода в котором равна 0,4737.
Решение. Общая формула членов гомологического ряда предельных двухатомных спиртов — СnН2n+2O2.
Молярная масса равна:
М(СnН2n+2O2) = n • М(С) + (2n + 2) • М(Н) + 2 • М(O) = 12n + 2n + 2 + 32 = (14n + 34) г/моль
Видно, что в 1 моле спирта массой (14n + 34) г содержится 12n г углерода, (2n + 2) г водорода и 32 г кислорода.

Массовая доля углерода в спирте равна:
w = m(С) / m(СnН2n+2O2) = 12n / (14n + 34) = 0,4737.
Находим (14n + 34) = 12n / 0,4737 = 25,33n; 11,33n = 34; n = 3.
Общая формула спирта С3Н8O2. Этой формуле отвечают два предельных двухатомных спирта: пропандиол-1,2 СН3—СНОН—СН2ОН и пропандиол-1,3 СН2ОН—СН2
Задача 4.4. Определите формулу кристаллогидрата карбоната натрия, массовая доля кислорода в котором равна 0,7273.
Решение. Общая формула кристаллогидрата Na2CO3 • nН2O. Молярная масса равна М(Na2CO3 • nН2O) = 2 • M(Na) + 1 • М(С) + З • М(О) + 2nМ(Н) + n • М(О) = 2 • 23 + 1 • 12 + 3 • 16 + 2n • 1 + n • 16 = (18n + 106) г/моль.
Видно, что в 1 моле массой (18n + 106) г содержится (16n + 48) г кислорода.
Массовая доля кислорода в кристаллогидрате равна:
w = m(O) / m(Na2C02 • nН2O) = (16n + 48) / (18n + 106) = 0,7273;
(16n + 48) = (18n + 106) • 0,7273 = 13,09n + 77,09
2,91n = 29,09;
n = 10.

Формула кристаллогидрата Na2C02 • 10Н2O.
Задача 4.5. При сжигании органического соединения массой 24,0 г образовалось 17,92 л (н.у.) оксида углерода (IV) и 14,4 г воды. Установите формулу этого соединения и назовите его, если относительная плотность его паров по неону равна 3,0.
Решение. Определим массу углерода в углекислом газе. Для этого найдем количество вещества оксида углерода
Поскольку в одной молекуле СO2 имеется один атом С, то:
v(C) = v(CO2) = 0,80 моль и m(C) = M • v = 12 г/моль • 0,8 моль = 9,6 г.
Аналогично находим массу водорода в образовавшейся воде: v(H2O) = m / M = 14,4 г / (18 г/моль) = 0,80 моль.
v(H) = 2 • v(H2O) = 2 • 0,8 моль = 1,6 моль и m(Н) = M • v = 1 г/моль • 1,6 моль = 1,6 г.
Сумма масс углерода и водорода в соединении, равная 9,6 + 1,6 = 11,2 г, меньше, чем масса соединения, равная 24,0 г.
Запишем формулу исходного соединения в виде CxНyОz.
х : у : z = 9,6 / 12 : 1,6 / 1 : 12,8 / 16 = 0,8 : 1,6 : 0,8 = 1 : 2 : 1. Простейшая формула СН2O.
Молярная масса простейшей формулы равна: М(СН2O) = 30 г/моль.
По условию D = М(CxНyО
Откуда
М(CxНyОz) = 3 • М(Аr) = 3 • 20 г/моль = 60 г/моль.
Видно, что молярная масса истинной формулы вдвое больше, чем молярная масса простейшей формулы. Значит, истинная формула — С2Н4O2. Этой формуле отвечают уксусная кислота СН3СООН и метилформиат НСООСН3. [Сборник задач, упражнений и тестов по химии: 11 класс: к учебнику Г.

Поделитесь с друзьями:
Алгоритмы решения задач № 22 в ОГЭ по химии | Химия
Автор: Верзакова Ксения Михайловна
Организация: МКОУ «Саргаинская СОШ»
Населенный пункт: Красноуфимск, п. Саргая
- Внимательно читаем условия задачи.
После пропускания через раствор гидроксида натрия 6,72 л оксида углерода (IV) (н.у.) получили 159 г раствора карбоната натрия. Вычислите массовую долю соли в полученном растворе.
|
Молярный объём 1 моля любого газа при н.у. = 22,4 л/моль |
- Записываем дано.
Дано:
V (CO2) = 6,72 л
m
w( Na2CO3) – ?
- Составляем молекулярное уравнение.
NaOH + CO2 = Na2CO3 + H2O
- Расставляем коэффициенты в уравнении.
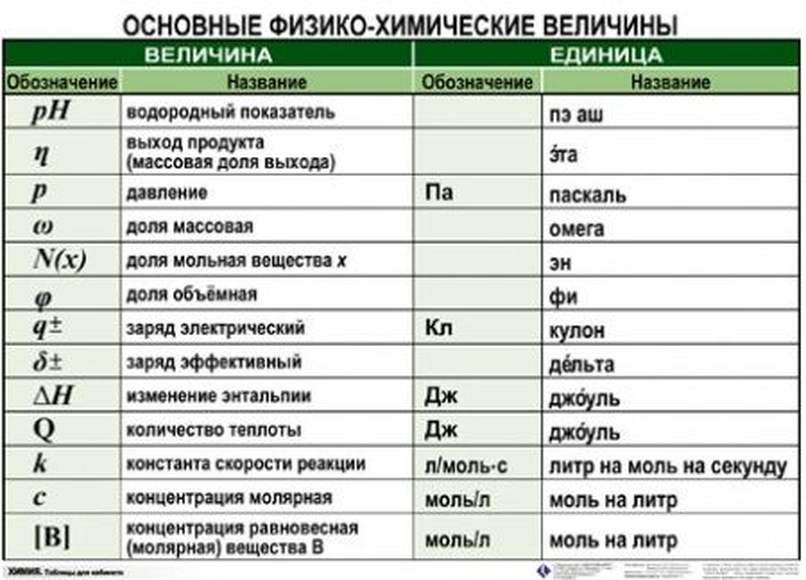
2 NaOH + CO2 = Na2CO3 + H2O
- Подчёркиваем вещества, о которых идёт речь.
2 NaOH + CO2 = Na2CO3 + H2O
- Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.
Vm (CO2) = 22,4 л/моль
M (Na2CO3) = 23*2 + 12*1 + 16*3= 106 г/моль
|
Молярная масса численно равна относительной молекулярной массе, поэтому её можно найти путём складывания относительных атомных масс элементов с учёт индексов |
Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
- Подписываем молярные массы или молярные
объёмы под формулами веществ
2 NaOH + CO2 = Na2CO3 + H2O
Vm=22,4 л/моль M=106 г/моль
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти.
 Если по условию задачи нужно найти массовую долю, то над веществом пишем массу и находим её.
Если по условию задачи нужно найти массовую долю, то над веществом пишем массу и находим её.
V=6,72 л m-?
2 NaOH + CO2 = Na2CO3 + H2O
Vm=22,4 л/моль M=106 г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Выводим формулу
- Подставляем данные и находим массу
m (Na2CO3) = 31,8 г.
- Находим массовую долю вещества по формуле w=m в-ваm р-ра*100
Записываем ответ: w (Na2CO3) = 20%
- Внимательно читаем условия задачи.
|
Массовую долю из процентов переводим в целое число, разделив на 100. |
К раствору с массовой долей гидроксида калия 3% добавили избыток раствора сульфата меди(II). При этом образовался осадок массой 5,3 г. Определите массу исходного раствора щёлочи.
- Записываем дано.
Дано:
w (KOH) = 3%=0,03
m(Cu(OH)2 = 5,3 г.
m(KOH) – ?
- Составляем молекулярное уравнение.
KOH + CuSO4 = K2SO4 + Cu(OH)2↓
- Расставляем коэффициенты в уравнении.
2 KOH + CuSO4 = K2SO4 + Cu(OH)2↓
- Подчёркиваем вещества, о которых идёт речь.
2 KOH + CuSO4 = K2SO4 + Cu(OH)2↓
-
Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.Молярную массу или молярный объём находим с учётом коэффициента перед формулой
 Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
Если в уравнении перед формулой вещества стоит коэффициент, то найденный молярный объём и молярную массу нужно умножить на этот коэффициент.
M (КOH) = 39*1+ 16*1+ 1*1= 56 г/моль*2= 112 г/моль
M (Cu(OH)2) = 64*1+ 16*1*2+ 1*1*2= 98 г/моль
- Подписываем молярные массы или
молярные объёмы под формулами веществ
2 КOH + CuSO4 = К2SO4 + Cu(OH)2↓
M=112 г/моль M=98 г/моль
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти. Если по условию задачи нужно найти массу раствора, то над веществом пишем массу и находим её.
m- ? m=5,3 г.
2 КOH + CuSO4 = К2SO4 + Cu(OH)2↓
M=112 г/моль M=98 г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.

- Выводим формулу
- Подставляем данные и находим массу
m (KOH) = 6 г.
- Находим массу раствора по формуле
Записываем ответ: m(KOH) = 200 г.
- Внимательно читаем условия задачи.
Вычислите массу осадка, который образуется при действии раствора нитрата серебра на 117 г 30 %-ного раствора хлорида меди (II).
- Записываем дано.
Дано:
mр-рa(CuCl2) = 117 г
w( CuCl2)=30% = 0,3
m(AgCl)-?
- Составляем молекулярное уравнение.
AgNO3 + CuCl2 = Cu(NO3)2 + AgCl↓
- Расставляем коэффициенты в уравнении.
2AgNO3 + CuCl2 = Cu(NO3)2 + 2AgCl↓
- Подчёркиваем вещества, о которых идёт речь.
2AgNO3 + CuCl2 = Cu(NO3)2 + 2AgCl↓
-
Находим молекулярную массу веществ, если подчёркнутое вещество газ, то находим молярный объём.Относительную атомную массу хлора принято считать равной 35,5, у остальных элементов она округляется до целого числа.
M (CuCl2) = 64*1+ 35,5*2= 135 г/моль*1= 135 г/моль
M (AgCl) = 108*1+ 35,5*1= 143,5 г/моль*2= 287 г/моль
- Подписываем молярные массы или
молярные объёмы под формулами веществ
2AgNO3 + CuCl2 = Cu(NO3)2 + 2AgCl↓
M=135г/моль М=287г/моль
- Если по условию задачи дан раствор и массовая доля, то находим массу вещества
mв-ва = ω * mр-ра
m(CuCl2) = 0,3*117 = 35,1 г.
- Над формулами записываем массы веществ или объемы веществ, которые даны и которые нужно найти.
- =35,1 г. m-?
2AgNO3 + CuCl2 = Cu(NO3)2 + 2AgCl↓
M=135г/моль М=287г/моль
- Записываем формулу соотношений, затем из этой формулы выводим нужную формулу нахождения массы или объема вещества.
- Выводим формулу
- Подставляем данные и находим ответ
- Записываем ответ
m (AgCl)=75 г.
Приложения:
- file0.docx.. 44,9 КБ
Химические расчеты | Общая химия 2
Глава 2
В этой главе изучаются типичные химические расчеты: взаимосвязь между массой, молями и числом частиц, процентный состав по массе, стехиометрия, предельный реагент и расчет выхода
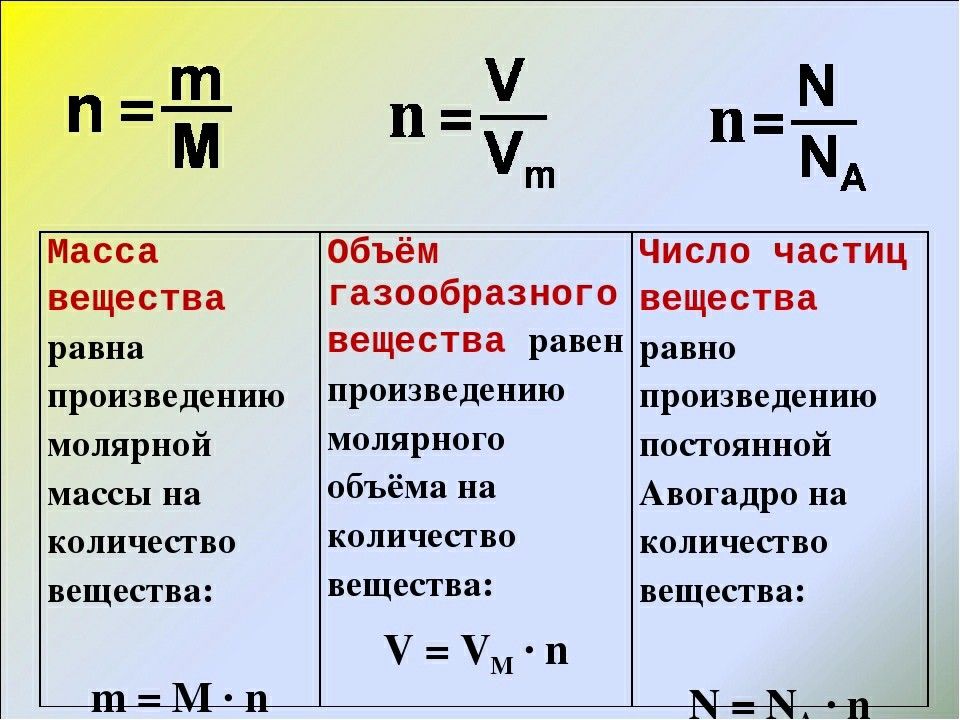
Соотношение масса-моль-число Число молей n (в молях):
Количество молей в образце
n = мМ
m = масса вещества (в г)
M = молярная масса вещества (в г. моль -1 )
моль -1 )
=
n = NNA
N количество частиц в веществе
N A = число Авогадро = 6,022 x 10 23 моль -1
Количество молей n в 2,0 г N 2 :
n = mN2MN2
m N2 = 2,0 г
M N2 = 2 x M N = 2 x 14,0 = 28,0 г.моль -1⇒ n = 2,028,0 = 7,1 x 10 -2 моль
Число атомов азота N N в 2,0 г N 2 :n = Mn2mn2 = Nn2na
M N2 = 2,0 г
M N2 = 28,0 г. Мол -1
N N2 = 2 x N N
N A = = = = = = = = = = = = = = = = = = = = = = = = = = = = .-23 моль -1
⇒ N N2 = N A x mN2MN2 = 4,3 x 10 22 атома
N N = 2 x N N2 = 8,6 x 10 22 атома
Процент состава по массе
Процент состава по массе – это процент от общей массы, вносимый каждым элементом соединения. Он рассчитывается следующим образом:
%X = n x MXMсоединение x 100 %
%X = процентный состав X
n = количество атомов X в молекуле соединения
M x = атомная масса X (в а.е.м. или г.моль -1 )
M соединение = молекулярная масса соединения (в а.е.м. или г.моль -1 )
5Определение % Al в Al 2 (SO 4 ) 3 :
%Al = n x MAlMAl2(SO4)3 x 100%
n = 2 [2 атома Al в одной молекуле Al 2 (SO 4 ) 3 ]
M Al3 г 900,393 моль -1
М Al2(SO4)3 = 2 M Al + 3 M S + 12 M O = 342,14 г.моль -1
%Al = 2 х 26,98342,14 х 100 = 15,77 %
Стехиометрия
Стехиометрические коэффициенты:
Числовые значения, записанные слева от каждого соединения в химическом уравнении для балансировки уравнения. Стехиометрические коэффициенты можно интерпретировать как количество молекул или количество молей вещества, образующегося или потребляемого в ходе реакции 9.0017
3 H 2 + N 2 → 2 NH 3
Молекулярная интерпретация: 3 молекулы H 2 реагируют с 1 молекулой N 2 с образованием 2 молекул NH 3
Молярная интерпретация: 3 моля H 2 реагируют с 1 моль N 2 с образованием образуют 2 моля NH 3
Стехиометрия:
Расчеты масс, молей или объемов реагентов и продуктов, участвующих в химической реакции.
Говорят, что реагенты находятся в стехиометрических количествах, когда они объединены в тех же относительных количествах, которые представлены в сбалансированном химическом уравнении 9.0005
Проблемы со стехиометрией:
- Какое количество продукта может быть получено из определенного количества реагентов
- Сколько одного реагента необходимо для реакции с данным количеством другого
- Сколько реагента требуется для получения желаемого количества продукта
Как решать стехиометрические задачи:
- Уравновешивание химического уравнения
- Расчет молярных масс реагентов и представляющих интерес продуктов
- Преобразовать все заданные массы в моли
- Используйте сбалансированное уравнение для определения стехиометрических соотношений
- Рассчитать количество молей желаемых материалов
- Расчет массы желаемых материалов
Ограничивающий реагент
Ограничивающий реагент:
Реагент, который полностью расходуется в химической реакции.
Лимитирующий реагент определяет максимальное количество продукта, которое может образоваться в ходе реакции
Как определить лимитирующий реагент:
a A + b B → c C
- Рассмотрим один из исходных реагентов в качестве лимитирующего реагента (например, A)
- Рассчитайте количество молей другого реагента, B, необходимого для полной реакции A
Обязательно используйте стехиометрические отношения сбалансированного уравнения: nAa = nBb- Сравните количество B, необходимое для полной реакции, с фактическим количеством B:
Если необходимое количество B > фактического количества B, B является ограничивающим реагентом
Если фактическое количество B > необходимого количества B, A является ограничивающим реагентомВыход в процентах
Теоретический и фактический выход:
Теоретический выход: количество продукта, которое образуется при потреблении всего ограничивающего реагента
Фактический выход: количество продукта, фактически полученного
Выход в процентах:
Мера эффективности химической реакции.
Процент выхода рассчитывается следующим образом:
Выход % = фактический выходтеоретический выход x 100
Химическое уравнение — стехиометрия и основные химические расчеты
Химическое уравнение. Стехиометрия и основные химические расчеты
Видеоурок
Решите любую задачу на стехиометрию, выполнив 5 простых шагов.
Лучший способ изучить эту тему — решить практические задачи. В этом посте мы рассмотрим решение одного практического вопроса.
Посмотрите видео с подробным пошаговым объяснением этого и другого вопроса.
Вопрос
Рассчитайте массу NaCl , полученную при взаимодействии 2 г натрия с избытком хлора .
ШАГ 1: Напишите сбалансированное химическое уравнение
Первым шагом является определение сбалансированного химического уравнения реакции.
Определите реагенты и продукты из вопроса.Из вопроса 1:
Реагенты – натрий и хлор
Продукты – хлорид натрияТаким образом, химическое уравнение будет таким: s)
Теперь нам нужно сбалансировать количество атомов каждого элемента в левой и правой частях химических уравнений.
Слева:
Na – 1
Cl – 2Справа:
Na – 1
Cl – 1Чтобы сбалансировать количество атомов хлора, нам нужно добавить « 2 »перед NaCl .
Na (т) + Cl 2 (г) → 2 NaCl (т)
Теперь имеем:
Слева:
Na – 1
Cl – 2Справа: 7 Cl 90 Na – 102017 Na – 7 – 2
Чтобы сбалансировать количество атомов натрия, нам нужно добавить « 2 » перед Na .
2 Na (т) + Cl 2 (г) → 2NaCl (т)
Теперь имеем:
Осталось:
Na – 2
Cl – 2Справа:
Na – 2
Cl – 2Теперь химическое уравнение окончательно сбалансировано.
У нас одинаковое количество атомов натрия и хлора в обеих частях химического уравнения.
Темы
Вопрос
Рассчитайте массу NaCl , полученную при взаимодействии 2 г натрия с избытком хлора.
ЭТАП 2: Найдите молярное соотношение участвующих видов
2Na (т) + Cl 2 (г) → 2NaCl (т)
Теперь, когда у нас есть сбалансированное химическое уравнение, мы можем проанализировать его количественно.
- Число перед каждым видом известно как коэффициент вида.
- Эти коэффициенты сообщают нам соотношение молей веществ, участвующих в химической реакции.
- Из уравнения мы знаем, что:
2 моль натрия реагирует с 1 моль хлора для получения 2 моль хлорида натрия
Решая, какое отношение молей найти, нам нужно внимательно изучить вопрос и обратить внимание на две вещи: )
Количество приведенных видов ( 2 г натрия ) Теперь мы знаем, что нам нужно найти отношение молей хлорида натрия NaCl к натрию Na .
Из проведенного ранее количественного анализа мы знаем, что:
моль NaCl : моль Na
= 2 : 2
Оба « 2 » являются коэффициентами каждого вида в сбалансированном химическом уравнении.
2 Na (т) + Cl 2 (г) → 2 NaCl (т)
Мы можем упростить это, разделив оба числа на 2, чтобы получить:
моль NaCl : моль Na
= 2 : 2
= 1 : 1
Темы
Вопрос
Рассчитайте массу NaCl , полученную при взаимодействии 2 г натрия с избытком хлора.
ЭТАП 3: Рассчитайте фактическое количество молей вещества с заданным количеством
- Вопрос говорит нам, что 2 г натрия вступили в реакцию.
- Это заданное количество ( масса натрия ).
- Мы можем использовать это количество, чтобы найти количество молей натрия , прореагировавших.
Есть четыре уравнения для количества молей, которые необходимо запомнить:
m. м. = молярная масса
м.кв. v. = молярный объем
# частиц = количество частиц
N A = постоянная Авогардро = 6,02 x 10 23
M = молярность
V = объемПоскольку нам известна масса натрия, мы выберем формула моля, в которую входит масса:
Темы
Вопрос
Рассчитайте массу NaCl , полученную при взаимодействии 2 г натрия с избытком хлора.
ШАГ 4: Рассчитайте фактическое количество молей видов с неизвестным количеством.
Теперь, когда у нас есть фактическое количество молей натрия , мы можем использовать молярное отношение , которое мы определили в ШАГ 2 для расчета фактического количества молей из хлорида натрия образовалось:
моль NaCl : моль Na
= 1 : 1
= x : 0,0870Используя форму дроби, мы имеем: 900 505
Темы
Вопрос
Рассчитайте массу NaCl , полученную при взаимодействии 2 г натрия с избытком хлора.
ШАГ 5 : Расчет неизвестного количества
Из ШАГ 4 , мы получаем число молей из образовавшегося хлорида натрия .
Поскольку нам нужно найти массу образовавшегося хлорида натрия, мы должны выбрать формулу, которая связывает массу с числом молей:
относительная формула массы .
Это можно найти, добавив Относительная атомная масса из всех ионов в блоке формулы NaCl:
Используя эти 5 5 стадий и четыре м. (масса/объем/количество частиц/молярность) вида, если указано количество другого вида в химическом уравнении.
Темы
Практические вопросы
- Рассчитайте объем газообразного кислорода, необходимого при RTP для реакции с 4 г лития с образованием оксида лития.