Определение формул неизвестных соединений | Задача 117
Изредка встречаются задачи, в которых неизвестно несколько элементов в формуле или качественный состав неизвестен вовсе. При их решении возникает необходимость составлять систему уравнений, в которых неизвестными членами будут молярные массы атомов искомых элементов. Решение большинства из этих задач возможно только по встречному алгоритму с составлением одного или нескольких математических уравнений. Рассмотрим решение такой задачи.
Задача 117.
Некоторые элементы «А» и «Б» образуют соединения с кислородом вида А2Б2О3 и А2БО3. Массовая доля кислорода в них 30,38% и 38,10% соответственно. Определите формулы неизвестных соединений.
Дано:
общие формулы двух веществ: А2Б2О3 и А2БО3;
массовая доля кислорода в А2Б2О3: (О)(в А2Б2
массовая доля кислорода в А2БО3: (О)(в А2БО3) = 38,10% .

Найти:
формулу вещества А2Б2О3;
формулу вещества А2БО3.
Решение:
Решение задачи удобно провести по встречному алгоритму. Схематично его можно выразить так:
1) Записываем выражение для молярной массы М(А2Б2О3), пользуясь значениями молярных масс элементов из Периодической системы:
М(А2Б2О3) = (М(А) . 2 + М(Б) .
(М(А) . 2 + М(Б) .2 + 48) г — это масса 1 моль (А2Б2О3 и в этой массе содержится 48 г кислорода.
Запишем выражение для массовой доли кислорода в (М(А) . 2 + М(Б) . 2 + 48) г вещества (А2Б2О3):
Приравниваем полученное выражение к значению массовой доли кислорода в А2Б2О3 из условия:
Преобразуем это выражение:
М(А) . 2 + М(Б)
2 + М(Б)
Получили первое математическое уравнение с двумя неизвестными.
2) Записываем выражение для молярной массы М(А2БО3), пользуясь значениями молярных масс элементов из Периодической системы:
М(А2БО3) = (М(А) . 2 + М(Б) + 48) г/моль.
(М(А) .2 + М(Б) + 48) г — это масса 1 моль А2БО3 и в этой массе содержится 48 г кислорода.
Запишем выражение для массовой доли кислорода в (М(А) х 2 + М(Б) + 48) г вещества А2БО3:
Приравниваем полученное выражение к значению массовой доли кислорода в А
Преобразуем это выражение:
М(А) .2 + М(Б) + 48 = 126.
Получили второе математическое уравнение с теми же двумя неизвестными.
3) Объединяем оба уравнения в систему:
Данная система математических уравнений легко решается методом вычитания.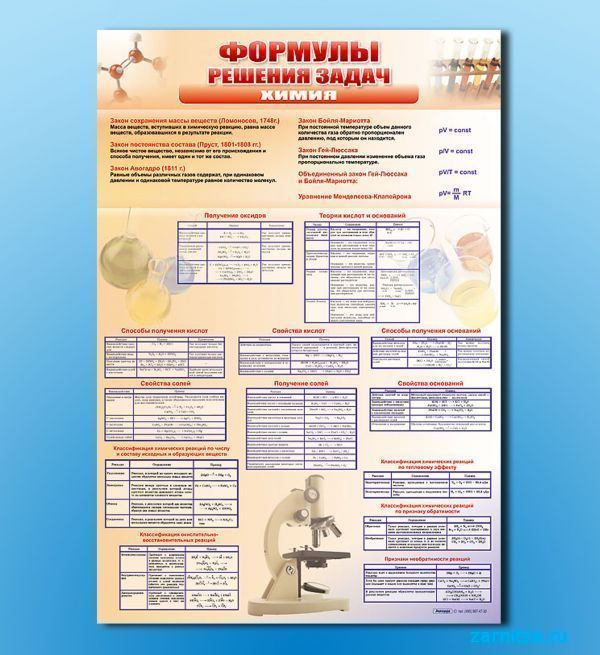 В результате получаем молярные массы искомых элементов «А» и «Б»: М(Б) = 32 г/моль;
В результате получаем молярные массы искомых элементов «А» и «Б»: М(Б) = 32 г/моль;
М(А) = 23 г/моль.
По периодической системе определим элементы, имеющие молярные массы атомов 32 г/моль и 23 г/моль. Это сера и натрий. Следовательно, искомые формулы веществ: Nа
Ответ: Nа2S2О3 и Nа2SО3.
Комментарии:
1Задача № 115.
Решение задач по химии на Himikatus.ru
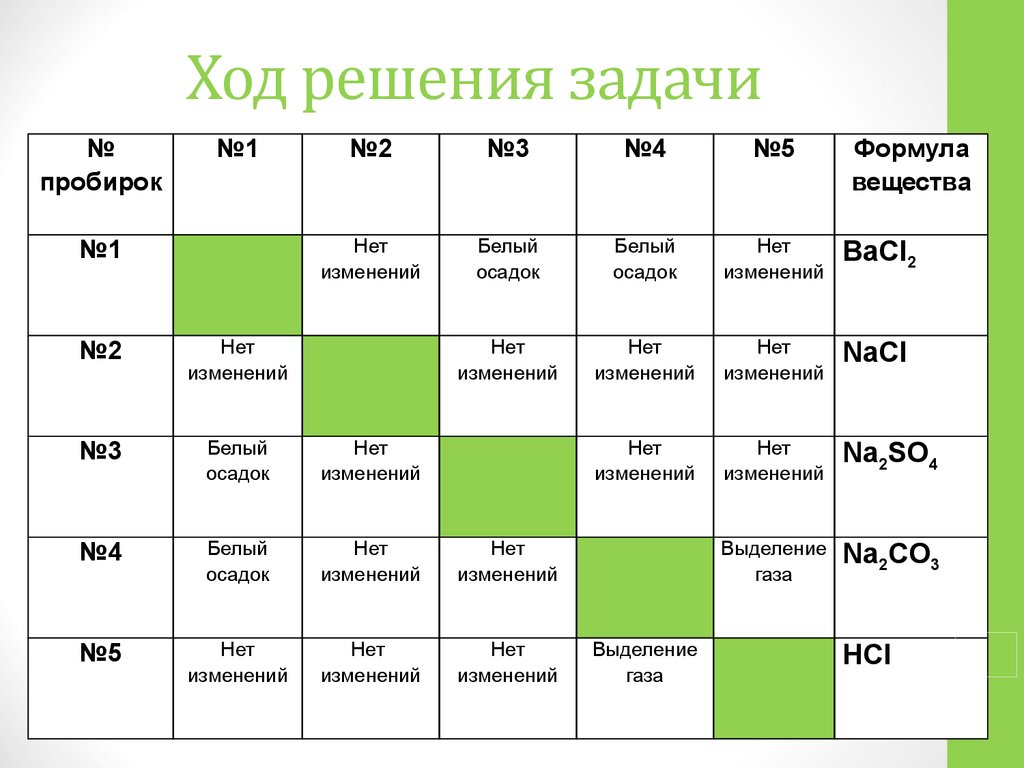
Большинство людей, за исключением тех, кто тем или иным образом связал свою жизнь с химией, весьма туманно представляют динамику протекания химических реакций. Это и не мудрено. Процесс обучения, как правило, сводится к заучиванию не всегда понятных формул. Для решения задач этого явно мало. Если ещё учесть, что кроме химии учащиеся изучают и другие предметы, то становится ясно, почему складывается такая ситуация. Желательно, чтобы информация, которая была почерпнута из учебников, подкреплялась наглядными опытами с подробным объяснением.
Базой для решения сложных химических задач являются простейшие уравнения, описывающие процесс химической реакции (такие задания есть и в ЕГЭ). Требуется, исходя из известной массы одного из веществ, вступающих в реакцию, рассчитать массу одной из производных реакции. Для успеха в решении необходимо знание химических формул и периодической таблицы Менделеева.
Инструкция по решению задач
Ознакомление с инструкцией, подробно описывающей решение задач по химии:
- Первым делом необходимо ознакомиться с исходными данными, представленными в условии задачи. Предположим, что 2,7 грамма алюминия добавили в серную кислоту. Нужно вычислить, какова будет масса сульфида алюминия.
- Кратко записываем условие задания.
- Решение задачи требует составления уравнения данной реакции.

- Затем при помощи периодической таблицы Менделеева находится молекулярная масса нужных нам веществ.
- Умножив на 1 г/моль, получим молярную массу.
- Далее записывается основная формула, показывающая связь между массой, количеством вещества и молярной массой.
- Потом, основываясь на наших значениях и опираясь на основную формулу, производится расчёт.
- Наступило время решения пропорции, где количество сульфида алюминия, измеряемое в молях – это X.
- Исходя из количества и молярной массы (нам уже известных) находится масса сульфида алюминия.

- Теперь по подставленным значениям осуществляется расчёт.
- Задача решена. Записываем ответ.
Начинающим изучать химию, всё кажется очень сложным. На самом деле это абсолютно не соответствует действительности. Достаточно только спокойно и вдумчиво подойти к изучению материала, и всё пойдёт как по маслу. К тому же на просторах сети можно отыскать практически всё по интересующему вопросу. Лет двадцать тому назад ситуация была не такая, но всё же люди как-то справлялись. И вы справитесь! Попробуйте, взяв за основу приведённый выше пример, решить аналогичную задачу, но с другими данными. Вскоре формулы запомнятся, и даже решение более сложных задач не будет вызывать никакого труда. Продолжая упражняться, вы почувствуете глубокое понимание предмета, и вполне возможно, что мир обретёт ещё одного великого химика и нобелевского лауреата.
Литература для дополнительных занятий по химии
В наш информационный век можно без труда найти любую литературу, способную помочь тяготеющим к химии пытливым умам. Но особенно хочется отметить пособие, автором которого является Хомченко Г. П. В нём весь материал изложен просто и без всяких излишних премудростей.
Но особенно хочется отметить пособие, автором которого является Хомченко Г. П. В нём весь материал изложен просто и без всяких излишних премудростей.
Напоследок хочется сказать, что химия очень захватывающая, полезная и не такая уж скучная наука, как может показаться на первый взгляд. Ведь не зря даже незабвенный Артур Конан Дойл наделил своего знаменитого Шерлока Холмса страстью к познаниям в этой области.
Химия – газы – Применение формул для решения задач
Химия – газы – Применение формул для решения задачШаг 1 Решите, какую формулу вы следует использовать. Посмотрите на заданные переменные. Понятно, что сумма газа является постоянной величиной.
Шаг 2 Пусть P 2 = 2 P 1
Шаг 3 Решить для V 2 Получить выражение
в пересчете на В 1
Нажмите к скрыть подсказки
Используйте эту формулу
Нажмите к скрыть подсказки
Применение правильной формулы к проблеме
решение. | |
| Часто необходимо выбрать соответствующую формулу для решения данной задачи. Мы рассмотрели формулы, перечисленные справа. Это вопрос выбора правильная формула, учитывая информацию в задаче. Ниже приведены четыре примера с подробными решениями. Попробуйте все четыре, затем нажмите на решения, чтобы посмотрите, были ли вы правы. | |
На неизвестной планете чистый
Образец газообразного водорода помещают в 450-литровый баллон под давлением
80 кПа при температуре 23 o C и позволили подняться ввысь.
На высоте 2330 м объем воздушного шара составляет 350 м.
литров и давление 30 кПа. Какая температура на высоте 2330 м?
| |
Шины истребителя
имеют объем 45 литров каждая. Какая масса азота помещена
в каждой шине? | |
Образец кислорода объемом 7,5 литров
газ при 284 o С был нагрет, При какой температуре будет объем
быть 10,0 литров при условии, что давление остается постоянным? | |
А
проба газа хранится в баллоне при температуре 284 o C. Если давление
Воздействие на газ удваивается, а затем газ нагревается до 354 o C. во сколько раз изменится объем газа? во сколько раз изменится объем газа? Подсказки | |
Одной из частей стратегии решения задач для балансировки химических уравнений является «начиная с…
CT, Ex 04Sec 3.10, Ex 06
10-е издание
Choose Section
Section 3.3: The Mole
КРИТИЧЕСКОЕ МЫШЛЕНИЕ
Упражнение 01
Упражнение 02
Раздел 3.7. Определение формулы соединения
КРИТИЧЕСКОЕ МЫШЛЕНИЕ
Упражнение 03
Раздел 3.9: Балансирование химических уравнений
Критическое мышление
Упражнение 04
Упражнение 05
Раздел 3.10: Stoichiometric Расчеты: Summous and Products
Критическое мышление 9000
. Глава
Глава
Контрольные вопросы
Упражнение 1
Упражнение 2
Упражнение 3
Упражнение 4
Упражнение 5
Упражнение 6
Упражнение 7
Упражнение 8
Упражнение 9
Упражнение 10
Активное обучение Вопросы
Упражнение 1
Упражнение 2
Упражнение 3
Упражнение 4
Упражнение 5
.
Упражнение 8
Упражнение 9
Упражнение 10
Упражнение 11
Упражнение 12
Упражнение 13
Упражнение 14
Упражнение 15
УПРАЖНЕНИЕ 16
УПРАЖНЕНИЕ 17
УПРАЖНЕНИЕ 18
УПРАЖНЕНИЕ 19
УПРАЖНЕНИЕ 20
УПРАЖНЕНИЕ 21
УПРАЖНЕНИЕ 22
УПРАЖНЕНИЕ 23
УПРАЖНЕНИЯ 24
УПРАЖНЕНИЕ 25
УПРАЖНЕНИЕ 26
24
. Упражнение 28
Упражнение 29
Упражнение 30
Упражнение 31
Упражнение 32
Упражнение 33
Упр. 0018 Упражнение 36
0018 Упражнение 36
Упражнение 37
Упражнение 38
Упражнение 39
Упражнение 40
Упражнение 41
Упражнение 42
Упражнение 43
. 48
Упражнение 49
Упражнение 50
Упражнение 51
Упражнение 52
Упражнение 53
Упражнение 54
Упражнение 55
56019 Упражнение0003УПРАЖНЕНИЕ 57
УПРАЖНЕНИЕ 58
УПРАЖНЕНИЕ 59
УПРАЖНЕНИЕ 60
УПРАЖНЕНИЕ 61
УПРАЖНЕНИЕ 62
УПРАЖНЕНИЕ 63
. Упражнение 69
Упражнение 70
Упражнение 71
Упражнение 72
Упражнение 73
Упр.0018 УПРАЖНЕНИЕ 77
Упражнение 78
Упражнение 79
Упражнение 80
Упражнение 81
Упражнение 82
Упражнение 83
Упражнение 84
УПРАЖНЕНИЕ 85
. 89
Упражнение 90
Упражнение 91
Упражнение 92
Упражнение 93
Упражнение 94
Упражнение 95
Упражнение 96
7
УПРАЖНЕНИЕ 98
Упражнение 99
Упражнение 100
Упражнение 101
Упражнение 102
Упражнение 103
Упражнение 104
. Упражнение 105
Упражнение 105
УПРАЖНЕНИЕ 106
ДРУГИЕ ДЕЙСТВИЯ 107 9003
. УПРАЖНЕНИЕ 106
. 107003
9699003
107003
9699003
. 107003
9003
9699003
9003
9003
.
Упражнение 110
Упражнение 111
Упражнение 112
Упражнение 113
Упражнение 114
Упражнение 115
Упражнение 116
Упражнение 117
Упражнение 118
Упражнение 119
Упражнение 120
Упражнение 121
Упражнение 122
Упражнение 123
Упражнение 124
. 129
Задание 130
Задание 131
Задание 132
Задание 133
Задание 134
Задание 135
Задание 136
УПРАЖНЕНИЕ 137
УПРАЖНЕНИЕ 138
УПРАЖНЕНИЕ 139
Упражнение 140
Упражнение 141
Упражнение 142
. Упражнение 149
Упражнение 150
Упражнение 151
Упражнение 152
Упражнение 153
Упражнение 154
Упражнение 155
Упражнение 156
Упражнение 157
Упражнение 158
Упражнение 159
Упражнение 160
Упражнение 161
Упражнение 162
Упражнение 163
. 168
168
Упражнение 169
Упражнение 170
Упражнение 171
Упражнение 172
Упражнение 173
Упражнение 174
Упражнение 175
Упражнение 176
Упражнение 177
УПРАЖНЕНИЕ 178
УПРАЖНЕНИЕ 179
УПРАЖНЕНИЕ 180
УПРАЖНЕНИЕ 181
УПРАЖНЕНИЕ 182
. Упражнение 188
Упражнение 189
Упражнение 190
Упражнение 191
Упражнение 192
Упражнение 193
Упражнение 194
Упражнение 195
Упражнение 196
Глава 3, раздел 3.9, Критическое мышление, упражнение 05
Page 93
Решение по предмету Эксперт
KWASIBOATENG
Ответ
S a ante, Dapibus a Secutie ascalie. магна. Fusce dui lectus, congue vel laoreet ac, dictum vitae odio. Донец Аликет. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nam lacinia pulvinar tortor nec facilisis. Pellentesque dapibus efficitur laoreet. Nam risus ante, dapibus a molestie consequat, ultrices ac magna.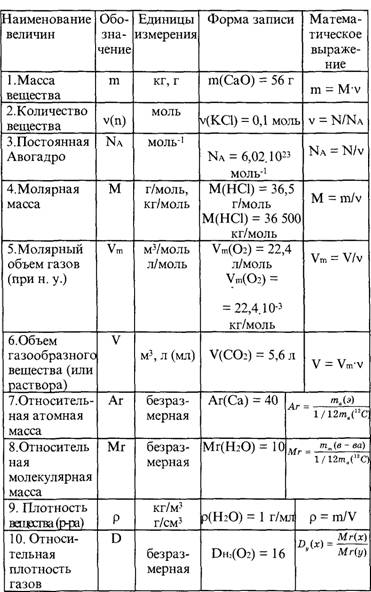



 Каждая шина накачивается до давления
410 кПа при 22 o C с чистым азотом. При посадке шин
нагреть до 117 o С . Производитель шин рекомендует
давление в шинах не должно превышать 600 кПа, поскольку велика вероятность их разрыва.
Каждая шина накачивается до давления
410 кПа при 22 o C с чистым азотом. При посадке шин
нагреть до 117 o С . Производитель шин рекомендует
давление в шинах не должно превышать 600 кПа, поскольку велика вероятность их разрыва.