Количество теплоты в физике – формулы и определение с примерами
Содержание:
Количество теплоты:
В чём причина изменения внутренней энергии макроскопического тела при теплообмене?
Другим способом изменения внутренней энергии термодинамической системы является теплообмен.
Теплообмен — самопроизвольный процесс передачи внутренней энергии от тела с большей температурой телу с меньшей температурой без совершения работы.
Теплообмен между контактирующими телами называют теплопередачей. За счёт переданной при этом энергии увеличивается внутренняя энергия одного тела и уменьшается внутренняя энергия другого. Если, например, привести в соприкосновение два тела с разными температурами, то частицы более нагретого тела будут передавать часть своей кинетической энергии частицам менее нагретого тела. В результате внутренняя энергия одного тела уменьшается, а другого увеличивается.
Таким образом, при теплопередаче не происходит превращения энергии из одной формы в другую: часть внутренней энергии более нагретого тела передаётся менее нагретому.
Количественной мерой энергии, сообщённой телу (или отданной им) в процессе теплообмена, является количество теплоты.
В СИ единицей количества теплоты Q является джоуль (Дж). Иногда для измерения количества теплоты используют внесистемную единицу — калорию
Если процесс теплообмена не сопровождается изменением агрегатного состояния вещества, то
где — масса тела; — разность температур в конце и в начале процесса теплообмена; с — удельная теплоёмкость вещества — физическая величина, численно равная количеству теплоты, которое получает вещество массой 1 кг при увеличении его температуры на 1 К. Удельную теплоёмкость измеряют в джоулях, деленных на килограмм, кельвин
Удельная теплоёмкость зависит от свойств данного вещества и, как показывает опыт, в достаточно большом интервале температур практически не изменяется. Однако удельная теплоёмкость газа зависит от того, при каком процессе (изобарном или изохорном) осуществляется теплообмен.
Интересно знать:
Физическая величина, равная произведению массы тела на удельную теплоёмкость вещества, носит название теплоёмкость тела. Обозначают теплоёмкость С и измеряют в джоулях, деленных на кельвин Теплоёмкость в отличии от удельной теплоёмкости, является тепловой характеристикой тела, а не вещества.
Удельная теплота плавленияФизическую величину, численно равную количеству теплоты, необходимому для превращения кристаллического вещества массой 1 кг, взятого при температуре плавления, в жидкость той же температуры, называют удельной теплотой плавления Эту величину измеряют в джоулях, делённых на килограмм Для плавления тела массой предварительно нагретого до температуры плавления, ему необходимо сообщить количество теплоты При кристаллизации тела такое же количество теплоты выделяется:
Удельная теплота парообразованияФизическую величину, численно равную количеству теплоты, которое необходимо передать жидкости массой 1 кг, находящейся при температуре кипения, для превращения её при постоянной температуре в пар, называют удельной теплотой парообразования L. Единицей измерения этой величины является джоуль, делённый на килограмм Количество теплоты, необходимое для превращения жидкости массой предварительно нагретой до температуры кипения, в пар, определяют по формуле Конденсация пара сопровождается выделением количества теплоты
Единицей измерения этой величины является джоуль, делённый на килограмм Количество теплоты, необходимое для превращения жидкости массой предварительно нагретой до температуры кипения, в пар, определяют по формуле Конденсация пара сопровождается выделением количества теплоты
Физическую величину, численно равную количеству теплоты, выделяющемуся при полном сгорании топлива массой 1 кг, называют удельной теплотой сгорания топлива и измеряют в джоулях, делённых на килограмм Количество теплоты, выделившееся при полном сгорании некоторой массы топлива, определяют по формуле
Это количество теплоты передаётся телам, образующим термодинамическую систему, и по отношению к ним является положительной величиной.
- Заказать решение задач по физике
Пример №1
На рисунке 77 представлен график зависимости абсолютной температуры нагреваемого тела от переданного ему количества теплоты. Воспользовавшись таблицей на с. 84, определите вещество, из которого изготовлено тело, если его масса
Воспользовавшись таблицей на с. 84, определите вещество, из которого изготовлено тело, если его масса
Решение:
Для того чтобы определить вещество, из которого изготовлено тело, найдём его удельную теплоёмкость с. Анализируя график, делаем вывод, что при нагревании тела от температуры до температуры ему было передано количество теплоты которое можно рассчитать по формуле
Следовательно, удельная теплоёмкость вещества
Полученное значение удельной теплоёмкости соответствует олову.
Ответ: — олово.
Пример №2
В налитую в сосуд воду, масса которой и температура добавили некоторое количество льда при температуре Определите массу льда, если после достижения теплового равновесия температура содержимого сосуда Теплоёмкостью сосуда и потерями тепла пренебречь. Удельная теплоёмкость воды льда удельная теплота плавления льда
Решение:
Пренебрегая потерями энергии в окружающую среду, учитываем только обмен энергией между входящими в систему телами. Рассмотрим тепловые процессы, происходившие в системе:
Рассмотрим тепловые процессы, происходившие в системе:
1) нагревание льда от температуры до температуры плавления
2) таяние льда:
3) нагревание воды, появившейся при таянии льда, от температуры до температуры
4) остывание тёплой воды массой от температуры до температуры Составим уравнение теплового баланса: или
Откуда масса льда:
Ответ:
Как найти массу по формуле удельной теплоемкости. Удельная теплоёмкость
Изменение внутренней энергии путём совершения работы характеризуется величиной работы, т.е. работа является мерой изменения внутренней энергии в данном процессе. Изменение внутренней энергии тела при теплопередаче характеризуется величиной, называемой количествоv теплоты.
– это изменение внутренней энергии тела в процессе теплопередачи без совершения работы. Количество теплоты обозначают буквой Q .
Работа, внутренняя энергия и количество теплоты измеряются в одних и тех же единицах – джоулях (Дж ), как и всякий вид энергии.
В тепловых измерениях в качестве единицы количества теплоты раньше использовалась особая единица энергии – калория (
При передаче телу некоторого количества теплоты без совершения работы его внутренняя энергия увеличивается, если тело отдаёт какое-то количество теплоты, то его внутренняя энергия уменьшается.
Если в два одинаковых сосуда налить в один 100 г воды, а в другой 400 г при одной и той же температуре и поставить их на одинаковые горелки, то раньше закипит вода в первом сосуде. Таким образом, чем больше масса тела, тем большее количество тепла требуется ему для нагревания.
Количество теплоты, необходимое для нагревания тела зависит еще и от рода вещества, из которого это тело сделано. Эта зависимость количества теплоты, необходимого для нагревания тела, от рода вещества характеризуется физической величиной, называемой удельной теплоёмкостью вещества.
– это физическая величина, равная количеству теплоты, которое необходимо сообщить 1 кг вещества для нагревания его на 1 °С (или на 1 К). Такое же количество теплоты 1 кг вещества отдаёт при охлаждении на 1 °С.
Удельная теплоёмкость обозначается буквой с . Единицей удельной теплоёмкости является 1 Дж/кг °С или 1 Дж/кг °К.
Значения удельной теплоёмкости веществ определяют экспериментально. Жидкости имеют большую удельную теплоёмкость, чем металлы; самую большую удельную теплоёмкость имеет вода, очень маленькую удельную теплоёмкость имеет золото.
Поскольку кол-во теплоты равно изменению внутренней энергии тела, то можно сказать, что удельная теплоёмкость показывает, на сколько изменяется внутренняя энергия 1 кг вещества при изменении его температуры на
 В частности, внутренняя энергия 1 кг свинца при его нагревании на 1 °С увеличивается на 140 Дж, а при охлаждении уменьшается на 140 Дж.
В частности, внутренняя энергия 1 кг свинца при его нагревании на 1 °С увеличивается на 140 Дж, а при охлаждении уменьшается на 140 Дж.Q , необходимое для нагревания тела массой m от температуры t 1 °С до температуры t 2 °С , равно произведению удельной теплоёмкости вещества, массы тела и разности конечной и начальной температур, т.е.
Q = c ∙ m (t 2 — t 1)По этой же формуле вычисляется и количество теплоты, которое тело отдаёт при охлаждении. Только в этом случае от начальной температуры следует отнять конечную, т.е. от большего значения температуры отнять меньшее.
Это конспект по теме «Количество теплоты. Удельная теплоёмкость» . Выберите дальнейшие действия:
- Перейти к следующему конспекту:
Удельная теплоемкость является характеристикой вещества. То есть у разных веществ она различна. Кроме того, одно и то же вещество, но в разных агрегатных состояниях обладает разной удельной теплоемкостью. Таким образом, правильно говорить об удельной теплоемкости вещества (удельная теплоемкость воды, удельная теплоемкость золота, удельная теплоемкость древесины и т. д.).
Таким образом, правильно говорить об удельной теплоемкости вещества (удельная теплоемкость воды, удельная теплоемкость золота, удельная теплоемкость древесины и т. д.).
Удельная теплоемкость конкретного вещества показывает, сколько тепла (Q) надо ему передать, чтобы нагреть 1 килограмм этого вещества на 1 градус Цельсия. Удельную теплоемкость обозначают латинской буквой c . То есть, c = Q/mt. Учитывая, что t и m равны единице (1 кг и 1 °C), то удельная теплоемкость численно равна количеству теплоты.
Однако теплота и удельная теплоемкость имеют разные единицы измерения. Теплота (Q) в системе Си измеряется в Джоулях (Дж). А удельная теплоемкость – в Джоулях, деленных на килограмм, умноженный на градус Цельсия: Дж/(кг · °C).
Если удельная теплоемкость какого-то вещества равна, например, 390 Дж/(кг · °C), то это значит, что если 1 кг этого вещества нагреется на 1 °C, то оно поглотит 390 Дж тепла. Или, другими словами, чтобы нагреть 1 кг этого вещества на 1 °C, ему надо передать 390 Дж тепла.
Если же на 1 °C нагревается не 1, а 2 кг вещества, то ему надо передать в два раза больше тепла. Так для примера выше это уже будет 780 Дж. То же самое будет, если нагреть на 2 °C 1 кг вещества.
Удельная теплоемкость вещества не зависит от его начальной температуры. То есть если например, жидкая вода имеет удельную теплоемкость 4200 Дж/(кг · °C), то нагревание на 1 °C хоть двадцатиградусной, хоть девяностоградусной воды одинаково потребует 4200 Дж тепла на 1 кг.
А вот лед имеет удельную теплоемкость отличную от жидкой воды, почти в два раза меньше. Однако, чтобы и его нагреть на 1 °C потребуется одинаковое количество теплоты на 1 кг, независимо от его начальной температуры.
Удельная теплоемкость также не зависит от формы тела, которое изготовлено из данного вещества. Стальной брусок и стальной лист, имеющие одинаковую массу, потребуют одинаковое количество теплоты для нагревания их на одинаковое количество градусов. Другое дело, что при этом следует пренебречь обменом теплом с окружающей средой. У листа поверхность больше, чем у бруска, а значит, лист больше отдает тепла, и поэтому быстрее будет остывать. Но в идеальных условиях (когда можно пренебречь потерей тепла) форма тела не играет роли. Поэтому говорят, что удельная теплоемкость – это характеристика вещества, но не тела.
Другое дело, что при этом следует пренебречь обменом теплом с окружающей средой. У листа поверхность больше, чем у бруска, а значит, лист больше отдает тепла, и поэтому быстрее будет остывать. Но в идеальных условиях (когда можно пренебречь потерей тепла) форма тела не играет роли. Поэтому говорят, что удельная теплоемкость – это характеристика вещества, но не тела.
Итак, удельная теплоемкость у разных веществ различна. Это значит, что если даны различные вещества одинаковой массы и с одинаковой температурой, то чтобы нагреть их до другой температуры, им надо передать разное количество тепла. Например, килограмму меди потребуется тепла примерно в 10 раз меньше, чем воде. То есть у меди удельная теплоемкость примерно в 10 раз меньше, чем у воды. Можно сказать, что в «медь помещается меньше тепла».
Количество теплоты, которое надо передать телу, чтобы нагреть его от одной температуры до другой, находят по следующей формуле:
Q = cm(t к – t н)
Здесь t к и t н – конечная и начальная температуры, m – масса вещества, c – его удельная теплоемкость. Удельную теплоемкость обычно берут из таблиц. Из этой формулы можно выразить удельную теплоемкость.
Удельную теплоемкость обычно берут из таблиц. Из этой формулы можно выразить удельную теплоемкость.
Количество энергии, которое необходимо сообщить 1 г какого либо вещества, чтобы повысить его температуру на 1°С. По определению, для того чтобы повысить температуру 1 г воды на 1°С, требуется 4,18 Дж. Экологический энциклопедический словарь.… … Экологический словарь
удельная теплоёмкость – — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN specific heatSH …
УДЕЛЬНАЯ ТЕПЛОЁМКОСТЬ – физ. величина, измеряемая количеством теплоты, необходимым для нагревания 1 кг вещества на 1 К (см.). Единица удельной темплоёмкости в СИ (см.) на килограмм кельвин (Дж кг∙К)) … Большая политехническая энциклопедия
удельная теплоёмкость – savitoji šiluminė talpa statusas T sritis fizika atitikmenys: angl. heat capacity per unit mass; massic heat capacity; specific heat capacity vok. Eigenwärme, f; spezifische Wärme, f; spezifische Wärmekapazität, f rus. массовая теплоёмкость, f;… … Fizikos terminų žodynas
массовая теплоёмкость, f;… … Fizikos terminų žodynas
См. Теплоёмкость … Большая советская энциклопедия
удельная теплоёмкость – удельная теплота … Cловарь химических синонимов I
удельная теплоёмкость газа – — Тематики нефтегазовая промышленность EN gas specific heat … Справочник технического переводчика
удельная теплоёмкость нефти – — Тематики нефтегазовая промышленность EN oil specific heat … Справочник технического переводчика
удельная теплоёмкость при постоянном давлении – — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN specific heat at constant pressurecpconstant pressure specific heat … Справочник технического переводчика
удельная теплоёмкость при постоянном объёме – — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN specific heat at constant volumeconstant volume specific heatCv … Справочник технического переводчика
Книги
- Физические и геологические основы изучения движения вод в глубоких горизонтах , Трушкин В.
 В.. В целом книга посвящена закону авторегулирования температуры воды с вмещающим телом, открытому автором в 1991 г.
В начале книги проведен обзор состояния изученностипроблемы движения глубоких…
В.. В целом книга посвящена закону авторегулирования температуры воды с вмещающим телом, открытому автором в 1991 г.
В начале книги проведен обзор состояния изученностипроблемы движения глубоких…
Как вы думаете, что быстрее нагревается на плите: литр воды в кастрюльке или же сама кастрюлька массой 1 килограмм? Масса тел одинакова, можно предположить, что нагревание будет происходить с одинаковой скоростью.
А не тут-то было! Можете проделать эксперимент – поставьте пустую кастрюльку на огонь на несколько секунд, только не спалите, и запомните, до какой температуры она нагрелась. А потом налейте в кастрюлю воды ровно такого же веса, как и вес кастрюли. По идее, вода должна нагреться до такой же температуры, что и пустая кастрюля за вдвое большее время, так как в данном случае нагреваются они обе – и вода, и кастрюля.
Однако, даже если вы выждете втрое большее время, то убедитесь, что вода нагрелась все равно меньше. Воде потребуется почти в десять раз большее время, чтобы нагреться до такой же температуры, что и кастрюля того же веса. Почему это происходит? Что мешает воде нагреваться? Почему мы должны тратить лишний газ на подогрев воды при приготовлении пищи? Потому что существует физическая величина, называемая удельной теплоемкостью вещества.
Почему это происходит? Что мешает воде нагреваться? Почему мы должны тратить лишний газ на подогрев воды при приготовлении пищи? Потому что существует физическая величина, называемая удельной теплоемкостью вещества.
Удельная теплоемкость вещества
Эта величина показывает, какое количество теплоты надо передать телу массой один килограмм, чтобы его температура увеличилась на один градус Цельсия. Измеряется в Дж/(кг * ˚С). Существует эта величина не по собственной прихоти, а по причине разности свойств различных веществ.
Удельная теплоемкость воды примерно в десять раз выше удельной теплоемкости железа, поэтому кастрюля нагреется в десять раз быстрее воды в ней. Любопытно, что удельная теплоемкость льда в два раза меньше теплоемкости воды. Поэтому лед будет нагреваться в два раза быстрее воды. Растопить лед проще, чем нагреть воду. Как ни странно звучит, но это факт.
Расчет количества теплоты
Обозначается удельная теплоемкость буквой c и применяется в формуле для расчета количества теплоты:
Q = c*m*(t2 – t1),
где Q – это количество теплоты,
c – удельная теплоемкость,
m – масса тела,
t2 и t1 – соответственно, конечная и начальная температуры тела.
Формула удельной теплоемкости: c = Q / m*(t2 – t1)
Также из этой формулы можно выразить:
- m = Q / c*(t2-t1) – массу тела
- t1 = t2 – (Q / c*m) – начальную температуру тела
- t2 = t1 + (Q / c*m) – конечную температуру тела
- Δt = t2 – t1 = (Q / c*m) – разницу температур (дельта t)
А что насчет удельной теплоемкости газов? Тут все запутанней. С твердыми веществами и жидкостями дело обстоит намного проще. Их удельная теплоемкость – величина постоянная, известная, легко рассчитываемая. А что касается удельной теплоемкости газов, то величина эта очень различна в разных ситуациях. Возьмем для примера воздух. Удельная теплоемкость воздуха зависит от состава, влажности, атмосферного давления.
При этом, при увеличении температуры, газ увеличивается в объеме, и нам надо ввести еще одно значение – постоянного или переменного объема, что тоже повлияет на теплоемкость. Поэтому при расчетах количества теплоты для воздуха и других газов пользуются специальными графиками величин удельной теплоемкости газов в зависимости от различных факторов и условий.
Удельная теплоёмкость – это энергия, которая требуется для увеличения температуры 1 грамма чистого вещества на 1°. Параметр зависит от его химического состава и агрегатного состояния: газообразное, жидкое или твёрдое тело. После его открытия начался новый виток развития термодинамики, науки о переходных процессах энергии, которые касаются теплоты и функционирования системы.
Как правило, удельная теплоёмкость и основы термодинамики используются при изготовлении радиаторов и систем, предназначенных для охлаждения автомобилей, а также в химии, ядерной инженерии и аэродинамике. Если вы хотите узнать, как рассчитывается удельная теплоёмкость, то ознакомьтесь с предложенной статьёй.
Перед тем, как приступить к непосредственному расчёту параметра следует ознакомиться с формулой и её компонентами.
Формула для расчёта удельной теплоёмкости имеет следующий вид:
- с = Q/(m*∆T)
Знание величин и их символических обозначений, использующихся при расчёте, крайне важно. Однако необходимо не только знать их визуальный вид, но и чётко представлять значение каждого из них. Расчёт удельной теплоёмкости вещества представлен следующими компонентами:
Однако необходимо не только знать их визуальный вид, но и чётко представлять значение каждого из них. Расчёт удельной теплоёмкости вещества представлен следующими компонентами:
ΔT – символ, означающий постепенное изменение температуры вещества. Символ «Δ» произносится как дельта.
ΔT = t2–t1, где
- t1 – первичная температура;
- t2 – конечная температура после изменения.
m – масса вещества используемого при нагреве (гр).
Q – количество теплоты (Дж/J)
На основании Цр можно вывести и другие уравнения:
- Q = m*цp*ΔT – количество теплоты;
- m = Q/цр*(t2 — t1) – массы вещества;
- t1 = t2–(Q/цp*m) – первичной температуры;
- t2 = t1+(Q/цp*m) – конечной температуры.
Инструкция по расчёту параметра
- Взять расчётную формулу: Теплоемкость = Q/(m*∆T)
- Выписать исходные данные.
- Подставить их в формулу.
- Провести расчёт и получим результат.
В качестве примера произведём расчёт неизвестного вещества массой 480 грамм обладающего температурой 15ºC, которая в результате нагрева (подвода 35 тыс. Дж) увеличилась до 250º.
Дж) увеличилась до 250º.
Согласно инструкции приведённой выше производим следующие действия:
Выписываем исходные данные:
- Q = 35 тыс. Дж;
- m = 480 г;
- ΔT = t2–t1 =250–15 = 235 ºC.
Берём формулу, подставляем значения и решаем:
с=Q/(m*∆T)=35тыс.Дж/(480 г*235º)=35тыс.Дж/(112800 г*º)=0,31 Дж/г*º.
Расчёт
Выполним расчёт C P воды и олова при следующих условиях:
- m = 500 грамм;
- t1 =24ºC и t2 = 80ºC – для воды;
- t1 =20ºC и t2 =180ºC – для олова;
- Q = 28 тыс. Дж.
Для начала определяем ΔT для воды и олова соответственно:
- ΔТв = t2–t1 = 80–24 = 56ºC
- ΔТо = t2–t1 = 180–20 =160ºC
Затем находим удельную теплоёмкость:
- с=Q/(m*ΔТв)= 28 тыс. Дж/(500 г *56ºC) = 28 тыс.Дж/(28 тыс.г*ºC) = 1 Дж/г*ºC.
- с=Q/(m*ΔТо)=28тыс.Дж/(500 гр*160ºC)=28 тыс.Дж/(80 тыс.г*ºC)=0,35 Дж/г*ºC.
Таким образом, удельная теплоемкость воды составила 1 Дж/г *ºC, а олова 0,35 Дж/г*ºC. Отсюда можно сделать вывод о том, что при равном значении подводимого тепла в 28 тыс. Дж олово нагрется быстрее воды, поскольку его теплоёмкость меньше.
Отсюда можно сделать вывод о том, что при равном значении подводимого тепла в 28 тыс. Дж олово нагрется быстрее воды, поскольку его теплоёмкость меньше.
Теплоёмкостью обладают не только газы, жидкости и твёрдые тела, но и продукты питания.
Как рассчитать теплоемкость продуктов питания
При расчёте емкости питания уравнение примет следующий вид:
с=(4.180*w)+(1.711*p)+(1.928*f)+(1.547*c)+(0.908 *a), где:
- w – количество воды в продукте;
- p – количество белков в продукте;
- f – процентное содержание жиров;
- c – процентное содержание углеводов;
- a – процентное содержание неорганических компонентов.
Определим теплоемкость плавленого сливочного сыра Viola . Для этого выписываем нужные значения из состава продукта (масса 140 грамм):
- вода – 35 г;
- белки – 12,9 г;
- жиры – 25,8 г;
- углеводы – 6,96 г;
- неорганические компоненты – 21 г.
Затем находим с:
- с=(4.
 180*w)+(1.711*p)+(1.928*f)+(1.547*c)+(0.908*a)=(4.180*35)+(1.711*12,9)+(1.928*25,8) + (1.547*6,96)+(0.908*21)=146,3+22,1+49,7+10,8+19,1=248 кДж /кг*ºC.
180*w)+(1.711*p)+(1.928*f)+(1.547*c)+(0.908*a)=(4.180*35)+(1.711*12,9)+(1.928*25,8) + (1.547*6,96)+(0.908*21)=146,3+22,1+49,7+10,8+19,1=248 кДж /кг*ºC.
Всегда помните, что:
- процесс нагревания металла проходит быстрее, чем у воды, так как он обладает C P в 2,5 раза меньше;
- по возможности преобразуйте полученные результаты в более высокий порядок, если позволяют условия;
- в целях проверки результатов можно воспользоваться интернетом и посмотреть с для расчётного вещества;
- при равных экспериментальных условиях более значительные температурные изменения будут наблюдаться у материалов с низкой удельной теплоёмкостью.
Уравнение теплового баланса – Умскул Учебник
На этой странице вы узнаете- Сможет ли физика объяснить противостояние “Чай VS Вода”?
- Как обычный школьный опыт по термодинамике способен оторвать от любимой книги?
- Может ли существовать отрицательная теплота?
Возможно вы встречали людей, у которых постоянно холодные руки. Задумывались ли вы когда-нибудь, почему так? Мне говорили, что эти люди привыкли делиться своим теплом с другими, поэтому они часто мерзнут. Не думаю, что это научное объяснение. Но про отдачу тепла в физике прочитать можно. Сейчас расскажем, что именно.
Задумывались ли вы когда-нибудь, почему так? Мне говорили, что эти люди привыкли делиться своим теплом с другими, поэтому они часто мерзнут. Не думаю, что это научное объяснение. Но про отдачу тепла в физике прочитать можно. Сейчас расскажем, что именно.
Если мы вернемся домой зимним, студеным вечером и захотим погреться у батареи. Будем ли мы воровать тепло у батареи? Как вообще это устроено? В каких случаях одни тела будут делиться теплом, а другие отбирать его?
Давайте рассмотрим простой пример, и поможет нам в этом Светозар. Однажды Светозар решил провести будний вечер за любимым романом и чашечкой чая. Он достал чашку, положил в нее заварку, налил кипятка. Чай, как всегда, оказался слишком горячим. Естественно, Светозар решил немного разбавить его холодной водой из графина.
| Как обычный школьный опыт по термодинамике способен оторвать от любимой книги? В голове у парня возник вопрос, который отвлек его от прочтения книги: «Когда я разбавляю чай водой, что происходит внутри кружки?» Кто у кого забирает тепло: вода у чая или чай у воды? Роман забыт, а Светозар отправилась на поиски ответа. |
Если бы Светозар внимательно читал учебник по физике, то таких вопросов не возникло. Но к счастью, герой был настроен восполнить пробел в знаниях и решил воспользоваться формулой количества теплоты при нагревании или охлаждении тел. Она имеет следующий вид:
Единица измерения Q — Дж (Джоуль).
Подробнее с этой и другими формулами можно ознакомиться в статье «Количество теплоты и фазовые переходы».
Опишем ход действий Светозара:
Шаг 1. Поскольку он уверен в надобности формулы количества теплоты, он сразу попробует ее применить. Но вдруг понимает, что из необходимых данных у него имеются только табличные.
Шаг 2. Он нашел на кухне термометр и измерил температуру воды в чайнике, воды в графине и смеси в стакане. Аллилуйя, уже что-то.
Шаг 3. Он взял мерный стакан, которым мама обычно отмеряет продукты, когда готовит вкусняшки, – но сейчас речь идет о физике. Затем измерил начальный объем чая и объем воды, которую долил. Как уж он это сделал, оставим на его совести. Нам важно знать, что он умеет пользоваться формулой плотности и легко выведет оттуда массу жидкостей.
Затем измерил начальный объем чая и объем воды, которую долил. Как уж он это сделал, оставим на его совести. Нам важно знать, что он умеет пользоваться формулой плотности и легко выведет оттуда массу жидкостей.
Что ж, Светозар умничка и готов проводить необходимые расчеты. Вот так типичная бытовая ситуация для Светозара переросла в настоящую школьную задачку по физике:
На столе стоит стакан с чаем, температура которого 93°С. Его разбавляют водой температурой в 23°С. По итогу разбавленный чай имеет температуру 63°С. Известно, что стакан с чаем имеет объем 350 мл, из них 200 мл занимает чай, 150 мл — вода. Найти количество теплоты, которое холодная вода забрала у чая, и количество теплоты, которое чай отдал воде. Теплообменом с окружающей средой пренебречь.
Примечание: будем считать, что Светозар правильно использовал мерный стакан и термометр, и все его данные достоверные.
Оформим задачу в виде следующей таблицы:
Теперь обсудим результаты опыта Светозара: почему же получились два одинаковых по модулю выражения, но разные по знаку?
Отрицательная теплотаЗнак минус возникает при подсчете Q1, когда мы вычитаем из начальной температуры конечную. Естественно, так как вода нагревается, то во втором случае конечная температура больше начальной и Q2 мы получаем положительное.
Естественно, так как вода нагревается, то во втором случае конечная температура больше начальной и Q2 мы получаем положительное.
Соответственно, чай при этом остывает, тогда в скобке первой формулы из меньшего числа вычитается большее. Значит, числа получились противоположные по знаку из-за того, что одно из веществ нагревается и получает тепло, а другое остывает и отдает тепло.
| Может ли существовать отрицательная теплота? Только что мы с вами объяснили невероятный феномен — отрицательная теплота. То есть это просто теплота, которая выделяется, когда тело остывает. |
Со знаками разобрались, но почему значения одинаковые? В этом и есть суть теплового равновесия, которое описывается уравнением теплового баланса.
Тепловое равновесие — это такое состояние системы тел, при котором в этой системе не происходит теплопередачи.
В нашем примере произошел теплообмен, когда жидкости обменивались теплом. В конечном счете система приняла стабильное состояние, когда теплообмена не происходит и можно спокойно попивать чаек. А то, как происходило перераспределение тепла между веществами, описывает уравнение теплового баланса (УТБ):
Уравнение теплового баланса (УТБ):
Причем: та энергия, которую тело принимает, берется со знаком “+”, а которая отдается, со знаком “-”.
По сути, УТБ — это закон сохранения энергии для процессов теплообмена в изолированных системах: сколько теплоты выделили одни тела, столько же и поглотили другие.
| Сможет ли физика объяснить противостояние “Чай VS Вода”? Теперь же Светозару понятно, что это не вода отняла тепло и не чай решил поделиться. Это никакое не противостояние. Это дуэт, который дополняет друг друга. Вместе они способны дать человеку то, что так необходимо — теплый бодрящий напиток для прекрасного чаепития. |
И вот Светозар, удовлетворенный ответом на свой вопрос, берет в руки любимую книгу и наслаждается отдыхом.
А мы давайте разберем еще одну задачку на УТБ, но более каверзную.
Задача: в калориметре находится 1,5 кг льда. Определите его начальную температуру, если после добавления к нему воды массой 20 г, имеющей температуру 32°С, в калориметре установилось тепловое равновесие при температуре -2,7°С. Теплообменом с окружающей средой и калориметром можно пренебречь.
Замечание: все величины, помимо Q, с индексом “1” будут относиться ко льду, а с индексом “2” — к воде.
ТерминыТабличные данные — это данные, которые общедоступны каждому, являются постоянными и ими можно спокойно пользоваться. К примеру, таблица плотностей, удельная теплоемкость веществ, астрономические величины и др.
Фактчек- Тепловое равновесие — это такое состояние системы тел, при котором в этой системе не происходит теплообмена.

- Тепловое равновесие можно описать с помощью уравнения теплового баланса (УТБ), которое имеет вид: Q1 + Q2 + … + Qn = 0.
- Если тела остывают, то они отдают тепло, и считается, что величина Q отрицательная. Тогда в УТБ на соответствующем месте будет стоять знак “-”.
- Если же тела нагреваются, то они получают тепло, и считается, что величина Q положительная. Тогда в УТБ на соответствующем месте будет стоять знак “+”.
Задание 1.
В каких случаях мы говорим, что количество теплоты при теплопередаче отрицательно?
- Когда тело принимает тепло;
- Когда тело отдает тепло;
- Такого не может быть, мы так не говорим;
- Когда тела находятся в тепловом равновесии.
Задание 2.
Какое(-ие) из следующих утверждений верно(-ы)?
- Уравнение теплового баланса описывает переход к тепловому равновесию.

- Уравнение теплового баланса — закон сохранения энергии при фазовых переходах изолированной системы, а также при ее нагревании и охлаждении.
- Верно только 1;
- Верно только 2;
- Верны и 1 и 2;
- Неверны ни 1, ни 2.
Задание 3. 8 л воды, взятой при температуре 10℃, смешали с водой при температуре 95℃. Температура смеси получилась 70℃. Чему равна масса горячей воды? Теплообменом с окружающей средой пренебречь.
- 19,2
- 20,4
- 17,2
- 14,6
Ответы: 1 — В; 2 — С; 3 -—19,2 кг.
{\circ}\mathrm{C}$ для разницы температур, потому что разница температур и “относительная” температура работают по-разному. Обратите внимание, что разница температур вообще не зависит от $T_3$. На самом деле, если бы мы использовали совершенно другое опорное значение вместо $T_3$, разница осталась бы той же. Если у вас есть температура разница , вы можете умножить или разделить ее на другие вещи.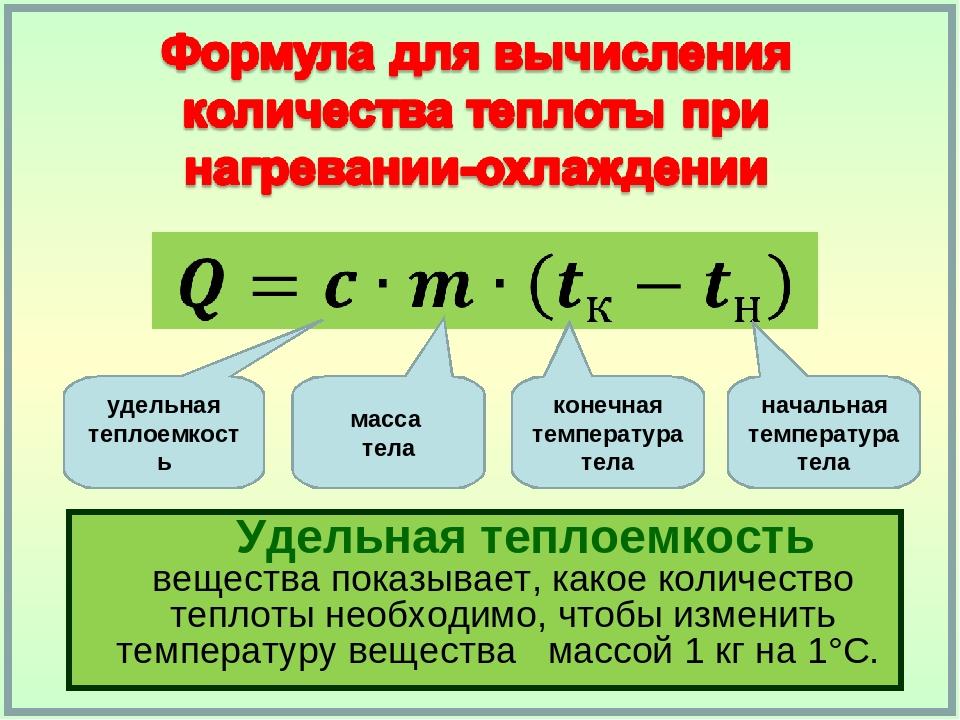 Вы также можете добавить или вычесть другие разности температур. Это очень похоже на такие вещи, как потенциальная энергия, где имеет значение только разница между двумя энергиями, а не фактическое количество энергии. 9\circ\mathrm{C}$$
Так что, очевидно, природа придает разнице температур относительно $T_0$ какое-то особое значение: разница $t – T_0$ важна в некотором роде, как никакая другая разность температур (например, $t – T_3$). Основываясь на этом результате, физики подумали, что имеет смысл разработать температурную шкалу, в которой $T_0 = 0$, чтобы нам не приходилось все время ее вычитать. Первым, кто пришел к такому выводу, был лорд Кельвин, поэтому термодинамическая шкала температуры и ее единица были названы в его честь. Это происхождение Кельвина. 9\circ\mathrm{C}}$$
то есть вы добавляете 273,15 к числовому значению.
Вы также можете добавить или вычесть другие разности температур. Это очень похоже на такие вещи, как потенциальная энергия, где имеет значение только разница между двумя энергиями, а не фактическое количество энергии. 9\circ\mathrm{C}$$
Так что, очевидно, природа придает разнице температур относительно $T_0$ какое-то особое значение: разница $t – T_0$ важна в некотором роде, как никакая другая разность температур (например, $t – T_3$). Основываясь на этом результате, физики подумали, что имеет смысл разработать температурную шкалу, в которой $T_0 = 0$, чтобы нам не приходилось все время ее вычитать. Первым, кто пришел к такому выводу, был лорд Кельвин, поэтому термодинамическая шкала температуры и ее единица были названы в его честь. Это происхождение Кельвина. 9\circ\mathrm{C}}$$
то есть вы добавляете 273,15 к числовому значению.
С другой стороны, когда у вас есть разница температур, вы действительно имеете $t_f – t_i$, которая не зависит ни от какой контрольной точки. Таким образом, чтобы преобразовать из Цельсия в Кельвин, вам не нужно ничего делать. \circ\mathrm{C} = \Delta\mathrm{K}$, так что эти два результата совпадают. Но из-за особых свойств температуры $T_0$ можно также показать, что $\Delta\mathrm{K} = 1\text{ K}$; другими словами, , когда вы имеете дело с Кельвинами , безопасно не использовать дельты и не слишком беспокоиться о том, когда $t$ является температурой, а когда — разностью температур. Однако это работает только для градусов Кельвина, а не градусов Цельсия.
\circ\mathrm{C} = \Delta\mathrm{K}$, так что эти два результата совпадают. Но из-за особых свойств температуры $T_0$ можно также показать, что $\Delta\mathrm{K} = 1\text{ K}$; другими словами, , когда вы имеете дело с Кельвинами , безопасно не использовать дельты и не слишком беспокоиться о том, когда $t$ является температурой, а когда — разностью температур. Однако это работает только для градусов Кельвина, а не градусов Цельсия.
Какова формула удельной теплоемкости?
by Veerendra
Какова формула удельной теплоемкости? Удельная теплоемкость
На рисунке показаны вода и растительное масло в одинаковых кастрюлях, которые нагреваются с одинаковой скоростью.
Какая жидкость нагревается быстрее: вода или растительное масло?
Такой вывод было бы трудно сделать, потому что вода и растительное масло имеют разные массы. Лучшее сравнение было бы, когда и вода, и растительное масло имеют одинаковую массу.
- Удельная теплоемкость вещества равна количеству теплоты, которое необходимо сообщить, чтобы увеличить температуру на 1°C для массы 1 кг вещества.
- Удельная теплоемкость выражается в единицах Дж кг -1 °C -1 или Дж кг -1 °K -1 .
- Удельная теплоемкость стекла 840 Дж кг -1 °C -1 . Это означает, что для повышения температуры 1 кг стекла на 1 °С требуется 840 Дж тепла.
Вода имеет удельную теплоемкость 4200 Дж кг -1 °C -1 , что в пять раз больше, чем удельная теплоемкость стекла.
Рисунок иллюстрирует разницу удельных теплоемкостей стекла и воды. - Удельная теплоемкость, c может быть рассчитана из количества подведенного тепла, Q, к массе m вещества при повышении температуры, θ.
- Следовательно, количество тепла, поглощаемого или теряемого телом, определяется как:
- Важно связать соответствующие величины и использовать правильные единицы измерения в уравнении.
 На рисунке выше это наглядно показано.
На рисунке выше это наглядно показано. - Удельная теплоемкость — это физическое свойство вещества. Одни вещества имеют низкую удельную теплоемкость, другие – более высокую удельную теплоемкость. В таблице приведены удельные теплоемкости некоторых распространенных веществ.
- Другие формы энергии, такие как электрическая энергия, потенциальная энергия и кинетическая энергия, могут быть преобразованы в тепловую энергию. Это преобразование можно резюмировать, как показано на рисунке.
Люди также спрашивают
- Что такое теплоемкость?
- Что означает скрытая теплота?
- Что такое скрытая теплота плавления льда?
- Что такое скрытая теплота испарения воды?
Цель: Определить удельную теплоемкость воды.
Материал: Водопроводная вода
Аппаратура: Стакан из полистирола, погружной нагреватель, термометр, блок питания, мешалка, балансиры или электронные весы, секундомер .
Результаты:
Анализ данных:
Обсуждение:
- Полистироловая чашка предпочтительнее стеклянной мензурки, поскольку она плохо проводит тепло. Это уменьшит потери тепла в окружающую среду. Обладает небольшой теплоемкостью. Теплота, поглощаемая чашкой, пренебрежимо мала.
- Значение удельной теплоемкости воды, полученное в этом задании, больше стандартного значения, поскольку при нагревании воды часть тепла теряется в окружающую среду. При расчете предполагалось, что все тепло, подаваемое нагревателем, поглощается водой.

Вывод:
Удельная теплоемкость воды, определенная по активности, составляет 4235 Дж кг -1 °C -1
Цель: Определить удельную теплоемкость алюминия.
Материалы: Папиросная бумага, лист полистирола, небольшое количество масла
Аппаратура: Погружной нагреватель, термометр, блок питания, весы, секундомер, алюминиевый цилиндр
Метод:
- Аппарат настроен как показано на рисунке.
- Массу алюминиевого баллона, м, определяют с помощью балансировочных весов.
- Начальная температура алюминиевого цилиндра, θ 1 записан в табл.
- Нагреватель включен. При этом запускается секундомер.
- Через t = 10 минут нагреватель выключается. Самая высокая температура θ 2 алюминиевого цилиндра указана в табл.
Результаты:
Анализ данных:
Обсуждение:
- Для уменьшения потерь тепла от алюминиевого цилиндра в окружающую среду использовались папиросная бумага и лист полистирола.

- В отверстие налили небольшое количество масла, чтобы обеспечить хороший тепловой контакт между колбой термометра и алюминиевым цилиндром. Это делается для того, чтобы обеспечить очень быстрое достижение теплового равновесия между термометром и цилиндром. Тогда показания термометра будут равны температуре алюминиевого цилиндра.
- Значение удельной теплоемкости алюминия, полученное в этом задании, немного превышает стандартное значение, поскольку при нагревании алюминиевого цилиндра часть тепла теряется в окружающую среду. При расчете предполагалось, что все тепло, подводимое нагревателем, поглощается цилиндром.
Заключение:
Удельная теплоемкость алюминия, определяемая по активности, составляет 929 Дж кг -1 °С -1 .
- Физический смысл удельной теплоемкости c можно проиллюстрировать следующим образом:
(a) Когда два объекта одинаковой массы нагреваются с одинаковой скоростью, объект с меньшей удельной теплоемкостью емкость будет иметь более быстрое повышение температуры.
(b) При нагревании двух тел одинаковой массы для получения одинакового повышения температуры необходимо передать больше тепла объекту с большей удельной теплоемкостью. - Когда два горячих объекта одинаковой массы оставляют охлаждаться,
(а) объект с меньшей удельной теплоемкостью будет остывать быстрее,
(б) объект с большей удельной теплоемкостью будет охлаждаться вниз более медленными темпами. - Материалы с малой удельной теплоемкостью используются в ситуациях, отличных от материалов с большой удельной теплоемкостью.
- Кастрюля:
Корпус, основание и ручка кастрюли на рисунке изготовлены из материалов с различной удельной теплоемкостью.
(б) В таблице приведены характеристики частей кастрюли.Деталь Характеристики Основание Медное основание.
Низкая удельная теплоемкость. Очень быстро становится горячим. Позволяет быстро приготовить пищу в кастрюле.
Позволяет быстро приготовить пищу в кастрюле.
Высокая плотность. Более тяжелое основание гарантирует, что горшок устойчив и не может легко опрокинуться.Ручка Рукоятка из синтетического материала.
Большая удельная теплоемкость. Не станет слишком горячим при поглощении тепла.
Плохой проводник тепла. Очень мало тепла от тела и содержимого кастрюли передается руке человека, держащего кастрюлю.
Низкая плотность. Не сильно увеличивает общий вес горшка.Корпус Алюминиевый корпус.
Относительно низкая удельная теплоемкость. Быстро становится жарко.
Низкая плотность. Уменьшает общий вес горшка.
Не взаимодействует с едой в кастрюле. - Система охлаждения двигателя автомобиля:
(а) Вода имеет большую удельную теплоёмкость. Он может поглощать большое количество тепла без сильного повышения температуры. Вода также доступна по низкой цене. Это делает воду очень полезной в качестве охлаждающего агента в автомобильных двигателях и больших машинах, которые выделяют много тепла.
Это делает воду очень полезной в качестве охлаждающего агента в автомобильных двигателях и больших машинах, которые выделяют много тепла.
(b) Вода используется для охлаждения двигателей внутреннего сгорания, таких как двигатель автомобиля. На рисунке показано, как тепло отводится от двигателя и теряется в окружающую среду при использовании воды в качестве окружающей среды при использовании воды в качестве охлаждающего агента.
(c) Водяной насос качает воду. Тепло, выделяющееся при сгорании бензино-воздушной смеси, поглощается водой, протекающей по пространствам в стенках двигателя. Горячая вода течет к радиатору, где тепло отдается более холодному воздуху, проходящему через систему охлаждения
(d) Перенос тепловой энергии в системе охлаждения можно резюмировать, как показано на рисунке. - Морской бриз и бриз с суши
(a) Морской бриз – это естественный бриз, дующий с моря на сушу в течение дня.
(b) Сухопутный бриз – это естественный бриз, дующий ночью с суши в сторону моря.
(c) Они вызваны тем, что море обладает большей теплоемкостью, чем суша.
(d) Рисунок поясняет формирование морского бриза и сухопутного бриза. - Умеренный климат:
(a) Наличие больших масс воды, таких как озера, моря и океаны, может оказывать влияние на климат в определенном месте.
(б) В дневное время в условиях жаркой погоды вода поглощает тепло из окружающей среды. Это помогает снизить температуру окружающей среды.
(c) В ночное время вода отдает поглощенное тепло. Это предотвращает падение температуры до очень низких значений.
(d) Таким образом, районы вблизи большой массы воды будут иметь меньший диапазон температурных изменений и, следовательно, умеренные климатические условия. - Фабрики с низкими потолками:
Некоторые фабрики, не имеющие большого оборудования, имеют низкие потолки. Это уменьшает объем воздуха внутри здания. Меньшая масса воздуха будет иметь меньшую теплоемкость. Для охлаждения воздуха требуется отводить меньше тепла. Это помогает снизить затраты на кондиционирование воздуха на заводе.
Это помогает снизить затраты на кондиционирование воздуха на заводе.
Пример 1. Сколько тепловой энергии требуется, чтобы поднять температуру листа стекла массой 3 кг с 24°C до 36°C? [Удельная теплоемкость стекла = 840 Дж кг -1 °C -1 ]
Решение:
Пример 2. Вода в льдогенераторе холодильника имеет массу 0,4 кг и температура 22°С. Какова будет температура воды после отвода от нее 33 600 Дж теплоты?
[Удельная теплоемкость воды = 4200 Дж кг -1 °C -1 ]
Решение:
C в 0,25 кг воды при 24°C в чашке из полистирола. При какой температуре стальная гайка и вода пришли в термическое равновесие?
[Удельная теплоемкость воды = 4200 Дж кг -1 °C -1 ; Удельная теплоемкость стали = 450 Дж кг -1 °C -1 ]
* Предположим, что теплообмен происходит только между стальной гайкой и водой.
Решение:
Пример 4. Электрический чайник мощностью P может нагреть 4,0 кг воды с 30°C до 100°C за 10 минут.
(a) Рассчитайте мощность P чайника.
(б) Какое предположение вы должны сделать, чтобы получить ответ?
[Удельная теплоемкость воды = 4200 Дж кг -1 °C -1 ]
Решение:
Пример 5. На определенном участке водопада Виктория в Африке вода падает вертикально с высоты 480 м.
(a) Объясните, почему температура воды у подножия водопада немного выше, чем у воды наверху.
(б) Оцените максимально возможную разницу температур воды у основания и наверху водопада. (Возьмем g = 10 м с -2 )
Решение:
Пример 6. При баллистическом испытании пуля, летящая со скоростью 360 м с -1 , останавливается неподвижным мешком с песком, как показано на рисунке. 20% энергии, теряемой пулей, преобразуется в тепловую энергию, которая поглощается пулей.
20% энергии, теряемой пулей, преобразуется в тепловую энергию, которая поглощается пулей.
Что такое повышение температуры пули? [Удельная теплоемкость пули = 150 Дж кг -1 °C -1 ]
Решение:
Рубрики: Физика С тегами: Как рассчитать удельную теплоемкость, Как рассчитать удельную теплоемкость алюминия, Как рассчитать удельную теплоемкость воды, Удельная теплоемкость, Уравнение удельной теплоемкости, Примеры задач удельной теплоемкости, Примеры задач удельной теплоемкости с решениями, Примеры удельной теплоемкости, Формула удельной теплоемкости, Формула удельной теплоемкости по физике , единица удельной теплоемкости, Понимание удельной теплоемкости
термодинамика | Законы, определения и уравнения
- Ключевые люди:
- Макс Планк Джеймс Клерк Максвелл Гилберт Н. Льюис Дж. Уиллард Гиббс Илья Пригожин
- Связанные темы:
- нагревать законы термодинамики энергия классическая термодинамика Транспортное уравнение Больцмана
Просмотреть весь связанный контент →
Популярные вопросы
Что такое термодинамика?
Термодинамика изучает отношения между теплом, работой, температурой и энергией. Законы термодинамики описывают, как изменяется энергия в системе и может ли система выполнять полезную работу над окружающей средой.
Законы термодинамики описывают, как изменяется энергия в системе и может ли система выполнять полезную работу над окружающей средой.
Является ли термодинамика физикой?
Да, термодинамика — это раздел физики, изучающий изменение энергии в системе. Ключевое понимание термодинамики заключается в том, что тепло — это форма энергии, соответствующая механической работе (то есть действующая на объект сила на расстоянии).
Сводка
Прочтите краткий обзор этой темы
термодинамика , наука о взаимосвязи между теплотой, работой, температурой и энергией. В широком смысле термодинамика имеет дело с переносом энергии из одного места в другое и из одной формы в другую. Ключевое понятие состоит в том, что теплота — это форма энергии, соответствующая определенному количеству механической работы.
Тепло не было официально признано формой энергии примерно до 179 г.8, когда граф Румфорд (сэр Бенджамин Томпсон), британский военный инженер, заметил, что при сверлении пушечных стволов может выделяться неограниченное количество тепла и что количество выделяемого тепла пропорционально работе, выполняемой при повороте тупого сверлильного инструмента. . Наблюдение Румфордом пропорциональности между произведенным теплом и выполненной работой лежит в основе термодинамики. Другим первооткрывателем был французский военный инженер Сади Карно, который в 1824 г. ввел понятие теплового цикла и принцип обратимости. высокотемпературный теплообмен как его движущая сила. Позже в том же столетии эти идеи были развиты Рудольфом Клаузиусом, немецким математиком и физиком, в первый и второй законы термодинамики соответственно.
. Наблюдение Румфордом пропорциональности между произведенным теплом и выполненной работой лежит в основе термодинамики. Другим первооткрывателем был французский военный инженер Сади Карно, который в 1824 г. ввел понятие теплового цикла и принцип обратимости. высокотемпературный теплообмен как его движущая сила. Позже в том же столетии эти идеи были развиты Рудольфом Клаузиусом, немецким математиком и физиком, в первый и второй законы термодинамики соответственно.
Наиболее важные законы термодинамики:
Нулевой закон термодинамики. Когда две системы находятся в тепловом равновесии с третьей системой, первые две системы находятся в тепловом равновесии друг с другом. Это свойство делает целесообразным использование термометров в качестве «третьей системы» и для определения температурной шкалы.
Первый закон термодинамики или закон сохранения энергии. Изменение внутренней энергии системы равно разнице между теплом, переданным системе из окружающей среды, и работой, совершенной системой над окружающей средой.

Второй закон термодинамики. Теплота не перетекает самопроизвольно из более холодной области в более горячую, или, что то же самое, теплота при данной температуре не может быть полностью преобразована в работу. Следовательно, энтропия замкнутой системы, или тепловая энергия на единицу температуры, со временем увеличивается до некоторого максимального значения. Таким образом, все закрытые системы стремятся к равновесному состоянию, в котором энтропия максимальна и нет энергии для выполнения полезной работы.
Третий закон термодинамики. Энтропия идеального кристалла элемента в его наиболее стабильной форме стремится к нулю, когда температура приближается к абсолютному нулю. Это позволяет установить абсолютную шкалу энтропии, которая со статистической точки зрения определяет степень случайности или беспорядка в системе.
Хотя термодинамика быстро развивалась в 19 веке в связи с необходимостью оптимизации характеристик паровых двигателей, всеобъемлющая универсальность законов термодинамики делает их применимыми ко всем физическим и биологическим системам. В частности, законы термодинамики дают полное описание всех изменений энергетического состояния любой системы и ее способности совершать полезную работу над своим окружением.
В частности, законы термодинамики дают полное описание всех изменений энергетического состояния любой системы и ее способности совершать полезную работу над своим окружением.
Викторина “Британника”
Наука: правда или вымысел?
Вас увлекает физика? Устали от геологии? С помощью этих вопросов отделите научный факт от вымысла.
Эта статья посвящена классической термодинамике, которая не включает рассмотрение отдельных атомов или молекул. Такие проблемы находятся в центре внимания раздела термодинамики, известного как статистическая термодинамика или статистическая механика, которая выражает макроскопические термодинамические свойства с точки зрения поведения отдельных частиц и их взаимодействий. Он уходит своими корнями во вторую половину XIX в.ХХ века, когда стали общепринятыми атомарная и молекулярная теории материи.
Фундаментальные концепции
Термодинамические состояния
Применение термодинамических принципов начинается с определения системы, которая в некотором смысле отличается от своего окружения. Например, системой может быть образец газа внутри цилиндра с подвижным поршнем, целая паровая машина, марафонец, планета Земля, нейтронная звезда, черная дыра или даже вся Вселенная. В общем, системы могут свободно обмениваться теплом, работой и другими формами энергии со своим окружением.
Например, системой может быть образец газа внутри цилиндра с подвижным поршнем, целая паровая машина, марафонец, планета Земля, нейтронная звезда, черная дыра или даже вся Вселенная. В общем, системы могут свободно обмениваться теплом, работой и другими формами энергии со своим окружением.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Состояние системы в любой момент времени называется ее термодинамическим состоянием. Для газа в цилиндре с подвижным поршнем состояние системы определяется по температуре, давлению и объему газа. Эти свойства являются характеристическими параметрами, которые имеют определенные значения в каждом состоянии и не зависят от того, каким образом система пришла в это состояние. Другими словами, любое изменение значения свойства зависит только от начального и конечного состояний системы, а не от пути, пройденного системой из одного состояния в другое. Такие свойства называются функциями состояния.

 В.. В целом книга посвящена закону авторегулирования температуры воды с вмещающим телом, открытому автором в 1991 г.
В начале книги проведен обзор состояния изученностипроблемы движения глубоких…
В.. В целом книга посвящена закону авторегулирования температуры воды с вмещающим телом, открытому автором в 1991 г.
В начале книги проведен обзор состояния изученностипроблемы движения глубоких… 180*w)+(1.711*p)+(1.928*f)+(1.547*c)+(0.908*a)=(4.180*35)+(1.711*12,9)+(1.928*25,8) + (1.547*6,96)+(0.908*21)=146,3+22,1+49,7+10,8+19,1=248 кДж /кг*ºC.
180*w)+(1.711*p)+(1.928*f)+(1.547*c)+(0.908*a)=(4.180*35)+(1.711*12,9)+(1.928*25,8) + (1.547*6,96)+(0.908*21)=146,3+22,1+49,7+10,8+19,1=248 кДж /кг*ºC.



 На рисунке выше это наглядно показано.
На рисунке выше это наглядно показано.


 Позволяет быстро приготовить пищу в кастрюле.
Позволяет быстро приготовить пищу в кастрюле.  Это делает воду очень полезной в качестве охлаждающего агента в автомобильных двигателях и больших машинах, которые выделяют много тепла.
Это делает воду очень полезной в качестве охлаждающего агента в автомобильных двигателях и больших машинах, которые выделяют много тепла. 
 Это помогает снизить затраты на кондиционирование воздуха на заводе.
Это помогает снизить затраты на кондиционирование воздуха на заводе.