|
Меню сайта Календарь
Архив записей
Наш опрос Друзья сайта Статистика Онлайн всего: 1 Гостей: 1 Пользователей: 0 |
|
|||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярная физика тесты | Fiziku5
Молекулярная физика.
Основные положения МКТ.
1.Ч. т. молекула.
2.Укажите примерные размеры молекул.
3.Что понимают под тепловым движением молекул?
4. Ч. т. макроскопические тела?
5.Какие явления считают тепловыми?
6. Что изучает раздел физики – термодинамика?
7. Сформулируйте основные положения МКТ.
8.Их опытное подтверждение.
9. Ч. т. Броуновское движение?
10.Ч. т. диффузия?
11.Ч. т. число Авогадро?
12. Ч. т. моль?
13. Как вычислить число молей в теле?
14. Ч. т. молярная масса?
Строение жидких, твёрдых и газообразных тел.
15. Каково расположение частиц в теле при различных агрегатных сосотояниях?
16. Каков характер их движения?
Каков характер их движения?
17. В каком состоянии вещество обладает текучестью?
18.Вкаком сохраняет объём?
19. Форму?
Идеальный газ. Основное положение МКТ.
20.Ч. т. идеальный газ?
21. Какие реальные газы близки к идеальному?
22. Написать основное ур-е М. К.Т.
23.Ч. т. концентрация молекул?
24.Ч. т. средняя квадратичная скорость молекул?
25. Напишите выражение средней кинетической энергии молекул идеального газа.
26. Напишите выражение давления идеального газа через среднюю кинетическую энергию молекул.
27. Каким соотношением связаны средняя и среднеквадратичная скорости движения молекул?
Температура.
28.Какким прибором измеряется температура?
29. Что называется термодинамическим (тепловым) равновесием?
30. Какие параметры характеризуют состояние теплового равновесия?
31. Как осуществляется измерение температуры?
32. Как построена шкала Цельсия?
33.В чём преимущество использования разрежённых газов для измерения температуры.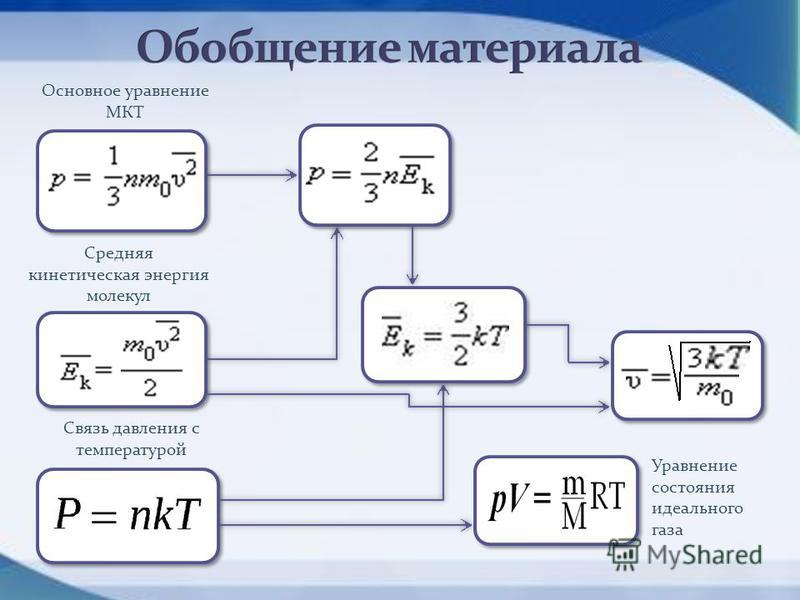
34. Ч. т. идеальная газовая шкала температур?
35. Сформулируйте термодинамическое определение температуры.
36.Напишите формулу связывающую среднюю кинетическую энергию и абсолютную температуру идеального газа.
37.Сформулируйте закон Авогадро.
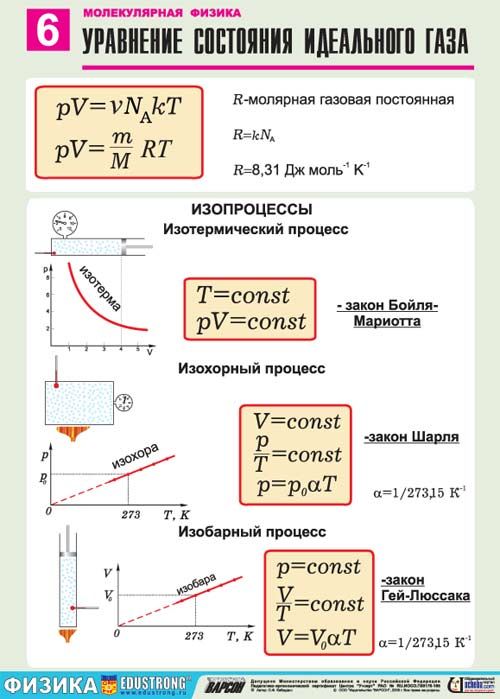
38. Ч. т. абсолютный 0 температур? Чему он равен по шкале Цельсия?
39. Шкалы Цельсия и Кельвина.
40.Постоянная Больцмана, её физический смысл.
41. Формула связывающая давление и температуру.
42. Ч. т. тройная точка воды.
Измерение скоростей молекул.
43. Цель опыта Штерна.
44Установка.45.Расчёт скорости в опыте.
46.Почему толщина полоски серебра на поверхности вращающегося цилиндра разная?
47.Выводы из опыта.
Уравнение состояния идеального газа.
48. Выведите ур-е состояния идеального газа, используя формулу p=nkT.
49. Физ. Смысл универсальной газовой постоянной.
50. Ур-е Клапейрона.
51. Ур-е Менделеева- Клапейрона.
52. Сравните их.
Сравните их.
Газовые законы. По плану
1. Вывести из ур — я М-К.
2. Сформулировать закон.
3. Какой процесс описывает.
4. Какая величина постоянна.
5. Графики.
Определение молекулярной формулы в химии.
(существительное)
Формула, описывающая точное количество и тип атомов в одной молекуле соединения.
Молекулярные формулы
- Например, для бутана молекулярная формула равна C4h20.
- Например, молекулярная
- Молекулярные формулы являются более ограничивающими, чем химические названия и структурные формулы .
- Молекулярная формула для глюкозы C6h22O6.
- Чтобы преобразовать эмпирическую и молекулярную формулы , эмпирическую формулу можно умножить на целое число, чтобы получить молекулярную формулу .

Связь формулы структуры
- Напомним, что молекулярная
- В приведенной ниже формуле тройная связь считается как две двойные связи.
- Этот молекулярный формула анализ может быть расширен за пределы углеводородов с помощью нескольких простых поправок.
- Все галогены, присутствующие в молекулярной формуле , должны быть заменены водородом.
- Каждый атом азота в формуле должен быть заменен фрагментом CH.
- Напомним, что молекулярная
Алкены и алкины
- Молекулярные формулы этих ненасыщенных углеводородов отражают многократное связывание функциональных групп:
- Как отмечалось ранее в разделе Анализ Молекулярных Формул , Молекулярная Формула углеводорода предоставляет информацию о возможных структурных типах, которые он может представлять.

- Например, рассмотрим соединения, имеющие формулу 9 .0013 С5Н8.
- Формула пятиуглеродного алкана пентана C5h22, поэтому разница в содержании водорода составляет 4.
Эмпирические формулы
- Молекулярная формула для соединения равна или кратна его эмпирической
- Что такое молекулярная формула декана?
- Шаг 1: Рассчитайте молекулярную массу эмпирического формула ( молекулярная масса С = 12,011 г/моль и Н = 1,008 г/моль)
- Шаг 2: Разделите молекулярную массу молекулярной массы формулы на молекулярную массу эмпирической формулы , чтобы найти соотношение между ними.
- В этом видео показано, как перейти от молекулярной формулы соединения к соответствующей эмпирической формуле .
- Молекулярная формула для соединения равна или кратна его эмпирической
Анализ молекулярных формул
- Хотя структурные формулы необходимы для уникального описания органических соединений, интересно и поучительно оценить информацию, которая может быть получена только из молекулярной

- Рассмотрим углеводород с молекулярной структурой, состоящей из простой цепи из четырех атомов углерода, Ch4Ch3Ch3Ch4.
- Молекулярный формула равна C4h20 (максимальное число связанных атомов водорода по правилу 2n + 2).
- Из приведенного выше обсуждения и примеров должно быть ясно, что молекулярная формула углеводорода (CnHm) дает информацию о количестве колец и/или двойных связей, которые должны присутствовать в его структурной формуле .
- Все галогены, присутствующие в молекулярной формуле , должны быть заменены водородом.
- Хотя структурные формулы необходимы для уникального описания органических соединений, интересно и поучительно оценить информацию, которая может быть получена только из молекулярной
Процентный состав соединений
- Атомный состав химических соединений может быть описан с использованием различных обозначений, включая молекулярные , эмпирические и структурные формулы .
- Процентный состав рассчитывается по молекулярной формуле путем деления массы одного элемента в одном моле соединения на массу одного моля всего соединения.

- Например, бутан имеет молекулярная формула C4h20.
- Однако этой информации недостаточно для определения молекулярной формулы без дополнительной информации о молекулярной массе соединения.
- Перевод между молекулярной формулой соединения и его процентным составом по массе
Многоатомные молекулы
- Наука о молекулах называется молекулярной химия или молекулярная физика, в зависимости от направленности.
- Молекулярная химия изучает законы взаимодействия между молекулами, приводящие к образованию и разрыву химических связей; молекулярная физика имеет дело с законами, управляющими их структурой и свойствами.
- Эмпирическая формула соединения представляет собой простейшее целочисленное отношение составляющих его химических элементов.
- Молекулярный формула характеризует различные молекулы, отражая точное количество атомов в их составе.

- Эмпирическая формула часто совпадает с молекулярной формулой , но не всегда; например, молекула ацетилена имеет молекулярную формулу C2h3, но простейшее целочисленное соотношение элементов – это CH.
Спектры высокого разрешения
- Разрабатывая масс-спектрометры, которые могут определять значения m/z с точностью до четырех знаков после запятой, можно различать различные формулы , имеющие одинаковую номинальную массу. Таким образом, масс-спектрометрия
- не только дает конкретное молекулярное значение массы, но также может установить молекулярную формулу неизвестного соединения.
- Поскольку данная номинальная масса может соответствовать нескольким молекулярным формулам , списки таких возможностей особенно полезны при оценке спектра неизвестного соединения.
Молекулы
- Молекулярный Размер варьируется в зависимости от количества атомов, составляющих молекулу.

- Часто состав соединения можно также обозначить эмпирической формулой , которая представляет собой простейшее целочисленное соотношение составляющих его химических элементов.
- Однако эта эмпирическая формула не всегда описывает конкретную рассматриваемую молекулу, поскольку дает только соотношение ее элементов.
- Полный элементный состав молекулы может быть точно представлен ее молекулярная формула , которая указывает точное количество атомов, находящихся в молекуле.
- Химическая формула для пропанола (C3H7OH) описывает несколько различных молекул, которые различаются положением спирта (ОН).
- Молекулярный Размер варьируется в зависимости от количества атомов, составляющих молекулу.
Наименование молекулярных соединений
- Молекулярные соединения названы с использованием систематического подхода префиксов для обозначения количества каждого элемента, присутствующего в соединении.
- Молекулярные соединения образуются, когда два или более элементов имеют общие электроны в ковалентной связи для соединения элементов.

- Как правило, неметаллы склонны делиться электронами, образовывать ковалентные связи и, таким образом, образовывать молекулярных соединений.
- При названии молекулярных соединений префиксы используются для определения количества данного элемента, присутствующего в соединении. «моно-» означает один, «ди-» означает два, «три-» — три, «тетра-» — четыре, «пента-» — пять, «гекса-» — шесть, «гепта-» — семь, «окто-» — восемь, «нона-» — девять, а «дека» — десять.
- В этом видео объясняется, как использовать химическое название для записи формулы для этого соединения.
13.4: Кинетическая теория – атомное и молекулярное объяснение давления и температуры
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1582
- OpenStax
- OpenStax
Цели обучения
К концу этого раздела вы сможете:
- Выражать закон идеального газа через молекулярную массу и скорость.

- Дайте определение тепловой энергии.
- Рассчитайте кинетическую энергию молекулы газа, зная ее температуру.
- Опишите связь между температурой газа и кинетической энергией атомов и молекул.
- Опишите распределение скоростей молекул в газе.
Мы разработали макроскопические определения давления и температуры. Давление — это сила, деленная на площадь, на которую действует сила, а температура измеряется термометром. Мы лучше понимаем давление и температуру из кинетической теории газов, которая предполагает, что атомы и молекулы находятся в непрерывном случайном движении.
Рисунок \(\PageIndex{1}\): когда молекула сталкивается с твердой стенкой, компонент ее импульса, перпендикулярный стенке, меняется на противоположный. Таким образом, на стену действует сила, создающая давление. На рисунке показано упругое столкновение молекулы газа со стенкой сосуда, так что она действует на стенку с силой (по третьему закону Ньютона). Поскольку за короткое время со стенкой столкнется огромное количество молекул, мы наблюдаем среднюю силу на единицу площади. Эти столкновения являются источником давления в газе. По мере увеличения числа молекул увеличивается число столкновений и, следовательно, давление. Точно так же давление газа тем выше, чем выше средняя скорость молекул. Фактическая взаимосвязь показана в статье «Великие и малые дела» ниже. Найдено следующее соотношение: 92} = НкТ.\]
Поскольку за короткое время со стенкой столкнется огромное количество молекул, мы наблюдаем среднюю силу на единицу площади. Эти столкновения являются источником давления в газе. По мере увеличения числа молекул увеличивается число столкновений и, следовательно, давление. Точно так же давление газа тем выше, чем выше средняя скорость молекул. Фактическая взаимосвязь показана в статье «Великие и малые дела» ниже. Найдено следующее соотношение: 92} = НкТ.\]
Установление связей: большие и малые вещи — атомное и молекулярное происхождение
Давление в газе
На рисунке показан ящик, заполненный газом. Из наших предыдущих обсуждений мы знаем, что добавление большего количества газа в ящик создает большее давление, и что повышение температуры газа также приводит к большему давлению. Но почему повышение температуры газа должно увеличивать давление в ящике? Взгляд на атомный и молекулярный масштаб дает нам некоторые ответы и альтернативное выражение закона идеального газа.
На рисунке в увеличенном виде показано упругое столкновение молекулы газа со стенкой сосуда. Вычисление средней силы, действующей на такие молекулы, приведет нас к закону идеального газа и к связи между температурой и молекулярной кинетической энергией. Мы предполагаем, что молекула мала по сравнению с расстоянием между молекулами в газе и что ее взаимодействием с другими молекулами можно пренебречь. Мы также предполагаем, что стенка является жесткой и что направление молекулы меняется, но ее скорость остается постоянной (и, следовательно, ее кинетическая энергия и величина ее импульса также остаются постоянными). Это предположение не всегда справедливо, но тот же результат получается при более детальном описании обмена энергией и импульсом молекулы со стенкой.
Рисунок \(\PageIndex{2}\): Газ в ящике оказывает внешнее давление на его стенки. Молекула, сталкивающаяся с твердой стенкой, имеет обратное направление скорости и импульса по оси x. Это направление перпендикулярно стене. Составляющие его импульса скорости в направлениях y и z не меняются, а значит, сила, параллельная стенке, отсутствует.
Составляющие его импульса скорости в направлениях y и z не меняются, а значит, сила, параллельная стенке, отсутствует.Если скорость молекулы изменяется в направлении x, ее импульс изменяется с \(-mv_x\) на \(+mv_x\). Таким образом, его изменение импульса равно \(\Delta mv = +mv_x -(-mv_x) = 2mv_x\). Сила, действующая на молекулу, равна
\[F = \dfrac{\Delta p}{\Delta t} = \dfrac{2mv_x}{\Delta t}.\]
Между стенкой и молекулой нет силы, пока молекула не ударится о стенку . В течение короткого времени столкновения сила между молекулой и стенкой относительно велика. Ищем среднюю силу; мы принимаем \(\Delta t\) за среднее время между столкновениями молекулы с этой стенкой. Это время, за которое молекула пройдет через ящик и обратно (расстояние \(2l\)) со скоростью \(v_x.\). Таким образом, \(\Delta t = 2l/v_x\), и выражение для силы становится 9{-26} \, кг}} = 511 \, м/с.\]
Обсуждение
Отметим, что средняя кинетическая энергия молекулы не зависит от типа молекулы. Средняя поступательная кинетическая энергия зависит только от абсолютной температуры. Кинетическая энергия очень мала по сравнению с макроскопическими энергиями, поэтому мы не чувствуем, когда молекула воздуха попадает на нашу кожу. Среднеквадратичная скорость молекулы азота удивительно велика. Эти большие молекулярные скорости не дают макроскопического движения воздуха, так как молекулы движутся во всех направлениях с равной вероятностью. средний свободный пробег (расстояние, которое молекула может пройти в среднем между столкновениями) молекул в воздухе очень мал, поэтому молекулы движутся быстро, но не уходят очень далеко за секунду. Однако высокое значение среднеквадратичной скорости отражено в скорости звука, которая составляет около 340 м/с при комнатной температуре. Чем выше среднеквадратическая скорость молекул воздуха, тем быстрее звуковые колебания могут передаваться по воздуху. Скорость звука увеличивается с температурой и больше в газах с малой молекулярной массой, таких как гелий.
Средняя поступательная кинетическая энергия зависит только от абсолютной температуры. Кинетическая энергия очень мала по сравнению с макроскопическими энергиями, поэтому мы не чувствуем, когда молекула воздуха попадает на нашу кожу. Среднеквадратичная скорость молекулы азота удивительно велика. Эти большие молекулярные скорости не дают макроскопического движения воздуха, так как молекулы движутся во всех направлениях с равной вероятностью. средний свободный пробег (расстояние, которое молекула может пройти в среднем между столкновениями) молекул в воздухе очень мал, поэтому молекулы движутся быстро, но не уходят очень далеко за секунду. Однако высокое значение среднеквадратичной скорости отражено в скорости звука, которая составляет около 340 м/с при комнатной температуре. Чем выше среднеквадратическая скорость молекул воздуха, тем быстрее звуковые колебания могут передаваться по воздуху. Скорость звука увеличивается с температурой и больше в газах с малой молекулярной массой, таких как гелий. (См. рис.)
(См. рис.)
Установление связей: историческая справка — кинетика
Теория газов
- Кинетическая теория газов была разработана Даниэлем Бернулли (1700–1782), наиболее известным в физике своими работами по течению жидкости (гидродинамике). Работа Бернулли предшествовала атомистическому взгляду на материю, установленному Дальтоном.
Распределение молекулярных скоростей
Движение молекул в газе является случайным по величине и направлению для отдельных молекул, но газ, состоящий из многих молекул, имеет предсказуемое распределение молекулярных скоростей. Это распределение называется распределением Максвелла-Больцмана по имени его создателей, которые рассчитали его на основе кинетической теории и с тех пор подтвердили экспериментально. (См. рисунок.) Распределение имеет длинный хвост, потому что несколько молекул могут двигаться со скоростью, в несколько раз превышающей среднеквадратичную скорость. Наиболее вероятная скорость меньше среднеквадратичной скорости \(v_{rms}\). На рисунке видно, что кривая смещается в сторону более высоких скоростей при более высоких температурах, с более широким диапазоном скоростей.
(См. рисунок.) Распределение имеет длинный хвост, потому что несколько молекул могут двигаться со скоростью, в несколько раз превышающей среднеквадратичную скорость. Наиболее вероятная скорость меньше среднеквадратичной скорости \(v_{rms}\). На рисунке видно, что кривая смещается в сторону более высоких скоростей при более высоких температурах, с более широким диапазоном скоростей.
Распределение тепловых скоростей сильно зависит от температуры. При повышении температуры скорости смещаются в сторону более высоких значений, а распределение расширяется.
Рисунок \(\PageIndex{5}\): Распределение Максвелла-Больцмана смещается в сторону более высоких скоростей и уширяется при более высоких температурах.
Какое значение для человека имеет показанное на рисунке изменение распределения в зависимости от температуры? При прочих равных условиях, если у человека жар, он или она, вероятно, потеряет больше молекул воды, особенно из слизистых оболочек вдоль влажных полостей, таких как легкие и рот, создавая ощущение сухости во рту.
Пример \(\PageIndex{2}\): расчет температуры: скорость убегания атомов гелия
Земля на скорости 11,1 км/с. Эта скорость называется скорость убегания . При какой температуре атомы гелия будут иметь среднеквадратичную скорость, равную скорости убегания?
Стратегия
Определите известные и неизвестные и определите, какие уравнения использовать для решения задачи.
Решение
1. Определите известные: \(v\) – скорость убегания, 11,1 км/с.
2. Определите неизвестные: Нам нужно найти температуру \(T\). Нам также нужно найти массу \(m\)
атома гелия. 9oF)\) на большой высоте. В атмосфере осталось очень мало атомов гелия, но при формировании атмосферы их было много. Причина потери атомов гелия заключается в том, что существует небольшое количество атомов гелия со скоростями выше скорости убегания Земли даже при нормальных температурах. Скорость атома гелия меняется от одного мгновения к другому, так что в любой момент существует небольшая, но ненулевая вероятность того, что скорость больше, чем скорость убегания, и молекула ускользнет от гравитационного притяжения Земли. Более тяжелые молекулы, такие как кислород, азот и вода (очень немногие из которых достигают очень большой высоты), имеют меньшую среднеквадратичную скорость, и поэтому гораздо менее вероятно, что какая-либо из них будет иметь скорость, превышающую скорость убегания. На самом деле, скорость, превышающая скорость убегания, настолько мала, что требуются миллиарды лет, чтобы потерять значительное количество атмосферы. На рисунке показано влияние отсутствия атмосферы на Луну. Поскольку гравитационное притяжение Луны намного слабее, она потеряла почти всю свою атмосферу.
В атмосфере осталось очень мало атомов гелия, но при формировании атмосферы их было много. Причина потери атомов гелия заключается в том, что существует небольшое количество атомов гелия со скоростями выше скорости убегания Земли даже при нормальных температурах. Скорость атома гелия меняется от одного мгновения к другому, так что в любой момент существует небольшая, но ненулевая вероятность того, что скорость больше, чем скорость убегания, и молекула ускользнет от гравитационного притяжения Земли. Более тяжелые молекулы, такие как кислород, азот и вода (очень немногие из которых достигают очень большой высоты), имеют меньшую среднеквадратичную скорость, и поэтому гораздо менее вероятно, что какая-либо из них будет иметь скорость, превышающую скорость убегания. На самом деле, скорость, превышающая скорость убегания, настолько мала, что требуются миллиарды лет, чтобы потерять значительное количество атмосферы. На рисунке показано влияние отсутствия атмосферы на Луну. Поскольку гравитационное притяжение Луны намного слабее, она потеряла почти всю свою атмосферу. Сравнение Земли и Луны обсуждается в задачах и упражнениях этой главы.
Сравнение Земли и Луны обсуждается в задачах и упражнениях этой главы.
Проверьте свое понимание
Если рассмотреть очень маленький объект, например пыльцу, в газе, то число атомов и молекул, ударяющихся о его поверхность, также будет относительно небольшим. Испытывает ли пыльцевое зерно какие-либо колебания давления из-за статистических колебаний числа атомов и молекул газа, сталкивающихся с ним в течение заданного промежутка времени?
[Скрыть решение]
Да. Такие флуктуации действительно происходят для тела любого размера в газе, но так как число атомов и молекул огромно для макроскопических тел, флуктуации составляют ничтожный процент от числа столкновений, и средние значения, о которых говорится в этом разделе, меняются незаметно. . Грубо говоря, флуктуации пропорциональны обратному квадратному корню из числа столкновений, поэтому для малых тел они могут стать значительными. Это действительно наблюдалось в 19го века для пыльцевых зерен в воде и известен как броуновский эффект.
Такие флуктуации действительно происходят для тела любого размера в газе, но так как число атомов и молекул огромно для макроскопических тел, флуктуации составляют ничтожный процент от числа столкновений, и средние значения, о которых говорится в этом разделе, меняются незаметно. . Грубо говоря, флуктуации пропорциональны обратному квадратному корню из числа столкновений, поэтому для малых тел они могут стать значительными. Это действительно наблюдалось в 19го века для пыльцевых зерен в воде и известен как броуновский эффект.
Исследования PhET: свойства газа
Закачивайте молекулы газа в коробку и смотрите, что происходит при изменении объема, добавлении или удалении тепла, изменении гравитации и т. д. Измерьте температуру и давление и узнайте, как свойства газа меняются по отношению друг к другу.
Рисунок \(\PageIndex{7}\): Свойство газаРезюме
- Кинетическая теория представляет собой атомистическое описание газов, а также жидкостей и твердых тел.
 92}} = v_{rms} = \sqrt{\dfrac{3kT}{m}}.\]
92}} = v_{rms} = \sqrt{\dfrac{3kT}{m}}.\] - Движение отдельных молекул в газе случайно по величине и направлению. Однако газ из многих молекул имеет предсказуемое распределение молекулярных скоростей, известное как распределение Максвелла-Больцмана .
Эта страница под названием 13.4: Кинетическая теория — атомное и молекулярное объяснение давления и температуры распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами платформа LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Программа OER или Publisher
- ОпенСтакс
- Показать оглавление
- нет
- Теги
- кинетическая теория
- источник@https://openstax.


 Основные положения МКТ.
Основные положения МКТ.







 92}} = v_{rms} = \sqrt{\dfrac{3kT}{m}}.\]
92}} = v_{rms} = \sqrt{\dfrac{3kT}{m}}.\]