ГДЗ Алгебра 9 класс Макарычев Дидактические
Авторы:Макарычев, Миндюк, Крайнева
Тип:дидактические материалы
Какой номер надо решить?
Итоговый тест
Контрольные работы
Самостоятельные работы
Топовые ГДЗ по другим предметам
- Учебник
- Учебник
- Учебник
- Учебник
- Учебник
- Контурные
- Учебник
- Учебник
- Учебник
- Контрольные
- Дидактич.
Подробные решения по алгебре за 9 класс авторы Макарычев, Миндюк, Крайнева
Планируя подготовку к занятиям, девятиклассники задумываются и о предстоящем в конце года ОГЭ. Многие из них, особенно те, кто решил поступать в колледжи, техникумы, стараются получить максимально высокий из возможных балл по дисциплине, поскольку прием в эти учебные заведения ведется по конкурсу школьных аттестатов. Заблаговременная подготовка к самостоятельным, контрольным, итоговому тесту возможна своими силами. В качестве помощника многие рекомендуют ответы по алгебре за 9 класс дидактический материал Макарычев – понятный и удобный для подростков материал. Для достижения максимального результата желательно разбирать ответы сборника заранее, по мере освоения темы или за одну-две недели до намеченной в школе проверочной.
Многие из них, особенно те, кто решил поступать в колледжи, техникумы, стараются получить максимально высокий из возможных балл по дисциплине, поскольку прием в эти учебные заведения ведется по конкурсу школьных аттестатов. Заблаговременная подготовка к самостоятельным, контрольным, итоговому тесту возможна своими силами. В качестве помощника многие рекомендуют ответы по алгебре за 9 класс дидактический материал Макарычев – понятный и удобный для подростков материал. Для достижения максимального результата желательно разбирать ответы сборника заранее, по мере освоения темы или за одну-две недели до намеченной в школе проверочной.
Для кого предназначены подробные решения к практикумам?
Среди тех, кто использует сборник решений к дидактическим материалам для 9 класса Макарычева в своей регулярной практике:
- девятиклассники, готовящиеся к математическим олимпиадам, поскольку ресурс также содержит задания с ответами по конкурсным работам.
 Такой помощник позволит отследить порядок решения материалов прошлых лет, правильную запись результатов, что немаловажно, поскольку учитывается при оценивании работ;
Такой помощник позволит отследить порядок решения материалов прошлых лет, правильную запись результатов, что немаловажно, поскольку учитывается при оценивании работ; - выпускники не только 9-х, но и 11-х классов, готовящиеся к ОГЭ и ЕГЭ и повторяющие курс материала за девятый класс;
- подростки, пропускающие уроки по уважительной причине (болезни, участии в конкурсах, сборах, соревнованиях). С помощью этой площадки они смогут эффективно подготовиться к предстоящей в классе проверке и без проблем написать работу;
- школьники, переведенные на дистанционную форму обучения или избравшие семейный/домашний формат образования. Для них это источник сведений о том, как следует писать и оформлять проверочные. Это пригодится им на аттестации, контроле;
- школьные педагоги, которым надо оперативно проверить большое количество самостоятельных, контрольных, тестов своих учеников. Иногда учителя крайне загружены рабочими вопросами, поэтому такой помощник для них актуален и важен;
- родители девятиклассников, желающие оценить уровень знаний своего ребенка, не “погружаясь” в курс дисциплины.
Ощутимая польза от применения онлайн справочника за 9 класс к дидактическим материалам Макарычева
С каждым годом скептиков, отрицательно относящихся к еуроки ГДЗ, становится все меньше и меньше. Каждому понятны безусловные плюсы этого источника информации:
- его доступность для всех без исключения пользователей, в любое время;
- актуальность данных, их соответствие регламентам Стандартов образования;
- экономическая выгода, нередко платформа становится заменой приглашения репетиторов, посещения математических, подготовительных курсов, кружков;
- удобный поиск, помогающий быстро найти нужный ответ, воспользоваться им.
Применяя справочные материалы, девятиклассники смогут более эффективно реализовать свои цели: получить хорошую отметку, подготовиться к проверке, конкурсу, экзамену. А заодно – научатся работать с информацией в условиях ограниченного времени.
ГДЗ(дүж) решения для учебника Геометрия Солтан 9 класс 2020 KZGDZ.
 COM
COMАвторы: Солтан Г., Солтан А., Жумадилова А.
Издательство: Келешек-2030
Год: 2020
Электронный учебник
К 9 классу ученик должен знать и уметь разбираться в геометрических фигурах, их свойствах. В новом курсе предмета Геометрия девятиклассника ждут такие темы как: векторы, преобразование плоскости, решение треугольников, окружность и многоугольники. Чтобы не попасть впросак при разборе трудных упражнений, предлагаем воспользоваться решебником для учебника от автора Солтан Г., тут разобраны все задания дисциплины, приведены правильные ответы с пояснениями. Осваивать теоремы станет намного проще даже самым отстающим ребятам. С ГДЗ знания приобретают осмысленный характер, их можно применять для более сложных задач, интегрировать в смежные науки.
Повторение курса геометрии 8 класса.
6789101112131415171920212223242526272829
I. Векторы
1.
 Понятие вектора. Коллинеарные векторы
Понятие вектора. Коллинеарные векторы3334353637383941
2. Сложение и вычитание векторов
4345464950515253545556
3. Умножение вектора на число. Критерий коллинеарности двух векторов
6162636466676869707172
4. Разложение вектора по двум неколлинеарным векторам.
737475767778798081828384
5. Координаты вектора.
87889093949596979899100101
6. Угол между векторами. Скалярное произведение двух векторов.
103104105106107108109110112113114115116117118119120
7. Применение векторов при решении задач
121122124126127128
8. Упражнения на повторение раздела «Векторы»
129131132133134135136138139140141142144145
Проверь себя!
148 3B148 4B148 5C
II.
 Преобразования плоскости.
Преобразования плоскости.9. Преобразование плоскости. Движение и его виды
149150151153154155157
10. Применение движений к решению задач
158159160161164165
11. Преобразования гомотетии и подобия, их свойства
166167168169170171172
12. Подобные треугольники
174175176177178179180181182183184185186187188189190
13. Подобные многоугольники
192193194195196197198199200
14. Применение гомотетии и подобия при решении задач.
202203204205206207208
15. Упражнения на повторение раздела «Преобразования плоскости»
209210211212213214215216217218219220221222223224
Проверь себя!
225 4B225 5С
III. Решение треугольников.
16. Теорема синусов
226227228229230231232233234235
17.
 Теорема косинусов
Теорема косинусов236237
238239240241242243244245246
18. Решение треугольников
247248249250251253254255256257258259
19. Углы, вписанные в окружность, и их свойства
260262263264265266267268269
20. Свойства касательной и секущей, пересекающихся хорд окружности
270271272273274275276277278279
21. Применение тригонометрии к выводу формул площадей треугольника и решению задач
280281282283284285286287288289290291292293294295296297298299300301302303
22. Упражнения на повторение раздела «Решение треугольников»
304305306307308309310311312313
Проверь себя!
314 4В
IV. Окружность. Многоугольники
23. Вписанные в окружность четырехугольники
316317318319320321
24.
 Описанные около окружности четырехугольники
Описанные около окружности четырехугольники322323324325326327328329330331332333334
25. Правильные многоугольники. Окружности, описанная около правильного многоугольника и вписанная в него
336337338339340341
342
26. Нахождение длин сторон и площадей правильных многоугольников.
343344345346347348349
27. Длина окружности и ее дуги
351352353354355356357358359360361362363364365366367368
28. Площадь круга, его сектора и сегмента
370371372373374375376377378379380381382383384385
29. Упражнения на повторение раздела «Окружность. Многоугольники»
386387388389390391392393394395396397398399400401402403404405406407408409
Повторение курса геометрии 9 класса
29. Упражнения на повторение раздела «Окружность.
 Многоугольники»
Многоугольники»411412413414415416417418419420421422423424425426427428430431433434435436437438439440441442443444445446
447448449450451452
К 9 классу ученик должен знать и уметь разбираться в геометрических фигурах, их свойствах. В новом курсе предмета Геометрия девятиклассника ждут такие темы как: векторы, преобразование плоскости, решение треугольников, окружность и многоугольники. Чтобы не попасть впросак при разборе трудных упражнений, предлагаем воспользоваться решебником для учебника от автора Солтан Г., тут разобраны все задания дисциплины, приведены правильные ответы с пояснениями. Осваивать теоремы станет намного проще даже самым отстающим ребятам. С ГДЗ знания приобретают осмысленный характер, их можно применять для более сложных задач, интегрировать в смежные науки.
Tinder: приложение для знакомств. Встретиться. Чат
С более чем 70 миллиардами совпадений на сегодняшний день Tinder® является лучшим бесплатным приложением для знакомств, и лучшим местом для знакомства с новыми людьми. Вы ищете настоящую любовь? Открытые отношения? Вы хотите пойти туда и найти дату, или вы просто хотите подружиться и поболтать? С Tinder вы можете встречаться с местными жителями повсюду и получать максимум удовольствия от свиданий:
Вы ищете настоящую любовь? Открытые отношения? Вы хотите пойти туда и найти дату, или вы просто хотите подружиться и поболтать? С Tinder вы можете встречаться с местными жителями повсюду и получать максимум удовольствия от свиданий:
Независимо от того, натурал вы, гей, бисексуал или кто-то другой, Tinder позволяет вам быть тем, кто вы есть, и найти того, кого вы хотите.
Поделитесь своими интересами и узнайте больше о своих совпадениях, чтобы начать разговор и зажечь искры.
Фото Проверенные профили: Потому что единственные сюрпризы, которые нам нужны, это цветы на первом свидании
Видеочат: Проверьте свою химию онлайн-знакомств и познакомьтесь с новыми людьми из дома!
Куда-то едете? Познакомьтесь с местными жителями и присоединитесь к сообществу людей со всего мира. Свидание в Нью-Йорке, знакомство с новыми друзьями в Майами или свидание в Лондоне: куда бы вы ни пошли, мы будем там.
Некоторые люди называют нас своим «самым надежным приложением для знакомств», некоторые люди называют нас «самым популярным в мире бесплатным сайтом знакомств» , но вы можете просто позвонить нам, когда захотите встретиться с людьми в вашем районе.
Матч, чат и свидание. Это наша мантра.
Находить новых людей в Tinder® легко и весело. Выделите свой профиль своими лучшими фотографиями и немного о себе, чтобы повысить свой потенциал поиска партнеров. Используйте функцию Swipe Right™, чтобы поставить лайк кому-то, используйте функцию Swipe Left™, чтобы отказаться. Если кто-то любит вас в ответ, это совпадение! И никакого давления: с нашей функцией двойного согласия интерес должен быть взаимным, чтобы он соответствовал. Сколько приложений для знакомств могут сказать это?
Пока вы здесь, поднимите тост за жизнь Gold и насладитесь некоторыми премиальными функциями Tinder с нашей подпиской Tinder Gold™.
отметок «Нравится». чувства для стольких новых людей, сколько вы хотите
Перемотка назад, чтобы вы могли отменить свой последний лайк или нет
Используйте Passport, чтобы отправиться в любую точку мира, чтобы найти людей в Интернете за пределами вашего почтового индекса минут, чтобы привлечь больше внимания
Доступно 5 суперлайков в неделю, потому что иногда вам очень-очень нравится кто-то
Ищете доступ ко всем премиум-функциям Tinder? Присоединяйтесь к Tinder Platinum™, чтобы ваши лайки располагались в приоритете с потенциальными совпадениями, чтобы иметь возможность отправлять сообщения перед сопоставлением и многое другое.
Есть плюс для тех, кто не готов завязать отношения с Gold или Platinum. С Tinder Plus® вы разблокируете такие функции, как неограниченные лайки, неограниченные перемотки и паспорт.
Так чего же ты ждешь? Загрузите лучшее бесплатное приложение для знакомств уже сегодня! Неважно, хотите ли вы завести друзей, познакомиться с новыми людьми или найти свою идеальную пару, Tinder — это место, где каждый может найти именно то, что ищет. — и тебе пора уже появиться.
———————————–
Если вы решите приобрести Tinder Plus®, Tinder Gold ™ или Tinder Platinum™ будет снята с вашей учетной записи Google Play, и с вашей учетной записи будет снята плата за продление в течение 24 часов до окончания текущего периода. Автообновление можно отключить в любое время, зайдя в настройки в Play Store после покупки. Отмена текущей подписки не допускается в течение активного периода подписки. Если вы не хотите покупать Tinder Plus®, Tinder Gold™ или Tinder Platinum™, вы можете просто продолжать использовать Tinder бесплатно.
Все фотографии моделей представлены только в иллюстративных целях.
Конфиденциальность: https://www.gotinder.com/privacy
Условия: https://www.gotinder.com/terms
Научные и технологические решения для класса 9, наука, глава 5 9 Наука Глава 5 Кислоты, основания и соли представлены здесь с простыми пошаговыми пояснениями. Эти растворы для кислот, оснований и солей чрезвычайно популярны среди учащихся 9-го класса. Растворы для кислот, оснований и солей пригодятся для быстрого выполнения домашних заданий и подготовки к экзаменам. Все вопросы и ответы из книги “Научные и технологические решения” для 9 классаНаука Глава 5 предоставляется здесь для вас бесплатно. Вам также понравится опыт без рекламы в решениях Meritnation Science And Technology Solutions Solutions. Все решения в области науки и техники. Решения для класса 9 «Наука» подготовлены экспертами и на 100 % точны.
Страница № 73:
Вопрос 1:
Найдите лишнее и обоснуйте.
(a) Хлорид, нитрат, гидрид, аммоний
(b) Хлористый водород, гидроксид натрия, оксид кальция, аммиак
(c) Уксусная кислота, угольная кислота, соляная кислота, азотная кислота
(d) Хлорид аммония, хлорид натрия, нитрат калия, сульфат натрия
(e) Нитрат натрия, карбонат натрия, сульфат натрия, хлорид натрия
(f) Оксид кальция, оксид магния, оксид цинка, оксид натрия.
(г) Медный купорос кристаллический, соль поваренная кристаллическая, сульфат железа кристаллический, карбонат натрия кристаллический.
(з) Хлорид натрия, гидроксид калия, уксусная кислота, ацетат натрия.
Ответ:
ANS
A.Mamonium = NH 4 +
Нитрат = NO 3 –
Гиддд = H –
. Чола катион и остальные являются анионами.
b. Хлористый водород является нечетным, потому что хлористый водород является кислотой, а остальные являются щелочными.
c. Уксусная кислота = CH 3 COOH
Углекислота = H 2 CO 3
Соляная кислота = HCl
Азотная кислота = – HNO 3
HCl является единственным двухатомным гетероядерным соединением, а остальные являются полиатомными соединениями.
d. Хлорид аммония нечетный, потому что это кислая соль, а все остальные соли являются нейтральными.
e. Карбонат натрия является нечетным, поскольку растворы нитрата натрия, сульфата натрия и хлорида натрия нейтральны. А вот раствор карбоната натрия BASIC .
А вот раствор карбоната натрия BASIC .
f. Оксид кальция = CaO
Оксид магния = MgO
Оксид цинка = ZnO
оксид натрия = Na 2 O
ZnO является нечетным, поскольку он амфотерен по своей природе, а другие ионы являются основными по своей природе
г. Поваренная соль является нечетной, поскольку при нагревании соединение не меняет цвет. Но в остальных соединениях есть изменение цвета.
ч. Гидроксид калия странный, потому что в реакции, когда хлорид натрия реагирует с уксусной кислотой, образуется ацетат натрия. В приведенной ниже реакции гидроксид калия не участвует.
NaCl +Ch4COOH→Ch4COONa +HCl
Страница № 73:
Вопрос 2:
Запишите изменения, которые будут видны в каждом случае, и объясните их причину.
(a) 50 мл воды добавляют к 50 мл раствора сульфата меди.
(b) Две капли индикатора фенфталеина были добавлены к 10 мл раствора гидроксида натрия.
(c) К 10 мл разбавленной азотной кислоты добавляли две или три медные опилки и перемешивали.
(d) Лакмусовую бумажку опускали в 2 мл разбавленной HCl. Затем к нему добавляли 2 мл концентрированного NaOH и перемешивали.
(e) Оксид магния добавляли к разбавленной HCl, а оксид магния добавляли к разбавленному NaOH.
(f) Оксид цинка добавляли к разбавленной HCl, а оксид цинка добавляли к разбавленному NaOH.
(g) К известняку добавили разбавленную HCl.
(з) Кусочки медного купороса нагревали в пробирке. При охлаждении к нему добавляли воду.
(i) Разбавленную H 2 SO 4 помещали в электролитическую ячейку и пропускали через нее электрический ток.
Ответ:
и
а. При добавлении 50 мл воды к 50 мл раствора сульфата меди происходит обратимая реакция и цвет меняется с бледно-голубого на белый, а затем снова на синий при повторном добавлении воды.
CuSO4 +h3O ↔ CuSO4,5h3O ( СИНИЙ ВИТРИОЛ).
б. Фенолфталеин — индикатор, используемый для определения количества основания. При добавлении 2 капель индикатора фенолфталеина к 10 мл раствора гидроксида натрия раствор окрашивается в розовый цвет, так как кислая часть фенофталеина реагирует с основанием, образуя натриевую соль фенолфталеина, имеющую розовый цвет.
Например: При кислотно-щелочном титровании фенолфталеин используется для определения конечной точки основания.
в. Медь является нереакционноспособным металлом и в нормальных условиях не реагирует с разбавленными кислотами.
На самом деле имеют место два уравнения реакции меди с азотной кислотой. Это зависит от того, концентрирована азотная кислота или нет. Если он концентрированный, то соотношение меди и азотной кислоты составляет 1:4. Если он разбавлен, то соотношение составляет 3:8.
Cu + 4HNO3 (разб.) → Cu(NO3)2 + 2NO2 + 2h3O 3Cu + 8HNO3 (конц.) → 3Cu(NO3)2 + 2NO + 4h3O
Концентрированная азотная кислота действует как сильный окислитель, поэтому логично, что образуется более высокая степень окисления оксида азота (IV).
д. При погружении лакмусовой бумаги в 2 мл разбавленного раствора HCl синяя лакмусовая бумага окрашивается в красный цвет, а на красную лакмусовая бумага не действует. Опять же, если ту же лакмусовую бумажку опустить в 2 мл концентрированного раствора NaOH, то красная лакмусовая бумажка окрасится в синюю, но на синюю лакмусовую бумагу не повлияет. Это связано с соответствующими свойствами синей и красной лакмусовой бумажки с кислотой. и база.
Опять же, если ту же лакмусовую бумажку опустить в 2 мл концентрированного раствора NaOH, то красная лакмусовая бумажка окрасится в синюю, но на синюю лакмусовую бумагу не повлияет. Это связано с соответствующими свойствами синей и красной лакмусовой бумажки с кислотой. и база.
e. Оксид магния является основанием. когда основание реагирует с кислотой, оно образует соль и воду. Эта реакция известна как реакция нейтрализации.
MgO(s) + 2HCl(l) = MgCl2 (водн.) + h3O(l)
MgO не реагирует с NaOH. Поскольку NaOH является основанием, а основания реагируют только с оксидами неметаллов с образованием соли и воды, потому что оксиды неметаллов считаются кислыми по своей природе, поэтому происходит реакция нейтрализации. Но MgO — это оксид металла, поэтому реакция невозможна.
ф. Оксид цинка добавляют к разбавленной HCl, затем происходит реакция нейтрализации с образованием соли и воды.
Реакция выглядит следующим образом:
ZnO(водн.)+2HCl(водн. )→ZnCl2(водн.)+h3O(л)
)→ZnCl2(водн.)+h3O(л)
Оксид цинка реагирует с гидроксидом натрия с образованием цинката натрия и воды. Эта реакция протекает при температуре 500-600°С. Это экзотермическая реакция.
ZnO + 2NaOH→Na2ZnO2 + h3O
г. Известняк – это карбонат кальция. При добавлении известняка к 10% раствору разбавленной HCl происходит бурное вскипание CO
2HCl + CaCO3 → CaCl2 + CO2 +h30
ч. При нагревании кусочков медного купороса в пробирке происходит разрушение кристаллической структуры медного купороса с образованием бесцветного порошка и выделением воды. Эта вода называется кристаллизационной. при добавлении воды в ту же пробирку белый порошок снова приобретал синий цвет. Это связано с обратимой реакцией из безводной соли в водную и наоборот.
CUSO4.5h3O↔CUSO4 +5h3O
i. При электролизе разбавленного раствора серной кислоты газы образуются как на аноде, так и на катоде.
t
Газ, образующийся на катоде , горит с хлопком, когда образец поджигается зажженной лучиной. Это показывает, что газ водород .
Газ, образующийся на аноде , повторно зажигает светящуюся лучину, погруженную в образец газа. Это показывает, что газ кислород .
Газы образуются, когда ионы движутся к электродам.
на катоде:
2H + + 2E – → H 2
на Anode:
4OH – – 4E – → 2H – – 4E – → 2H 2 2 –
Страница № 73:
Вопрос 3:
Распределите следующие оксиды по трем типам и назовите типы.
CaO, MgO, CO 2 , SO 3 , NA 2 O, ZNO, AL 2 O 3 , FE 2 O 3
Ответ:
Оксиды : CO : CO : CO : CO : CO : CO : CO : CO : CO : CO : CO : CO : CO . 2 (двуокись углерода), SO 3 (триоксид серы)
2) Основные оксиды: CaO (оксид кальция), MgO (оксид магния), Na 2 O (оксид натрия)
3) Амфотерные оксиды: ZnO (оксид цинка), Al 2 O 3 (оксид алюминия), Fe 2 O 3 (оксид железа)
Страница № 73:
Вопрос 4:
Объясните, нарисовав рисунок электронной конфигурации.
а. Образование хлорида натрия из натрия и хлора.
б. Образование хлорида магния из магния и хлора.
Ответ:
а. Атомный номер атома натрия (Na) равен 11.
Электронная конфигурация:
Na = 2, 8, 1
Таким образом, он содержит 1 валентный электрон. Чтобы достичь ближайшей конфигурации благородного газа, он теряет один электрон, образуя ион натрия.
Чтобы достичь ближайшей конфигурации благородного газа, он теряет один электрон, образуя ион натрия.
Na + = 2,8
Атомный номер атома хлора (Cl) равен 17.
Электронная конфигурация:
Cl = 2, 8, 7
Таким образом, он содержит 7 валентных электронов. Чтобы достичь ближайшей конфигурации благородного газа, он получает один электрон, образуя ион хлорида.
Cl – = 2,8
Ионная связь образуется между ионом натрия и ионом хлора за счет полного переноса электрона от натрия к хлору.
б. Атомный номер атома магния (12) равен 12,9.0005 Электронная конфигурация:
Mg = 2, 8, 2
Таким образом, он содержит 2 валентных электрона. Чтобы достичь ближайшей конфигурации благородного газа, он теряет два электрона, образуя ион магния.
Mg 2+ = 2,8
Атомный номер атома хлора (Cl) равен 17.
Электронная конфигурация:
Cl = 2, 8, 7
Таким образом, он содержит 7 валентных электронов. Чтобы достичь ближайшей конфигурации благородного газа, он получает один электрон, образуя ион хлорида.
Кл – = 2,8
Ионная связь образуется между ионом магния и двумя ионами хлорида путем полного переноса одного электрона на каждый ион хлора.
Страница № 74:
Вопрос 5:
Покажите диссоциацию следующих соединений при растворении в воде с помощью химического уравнения и напишите, мала или велика степень диссоциации.
Соляная кислота, хлорид натрия, гидроксид калия, аммиак, уксусная кислота, хлорид магния, сульфат меди
Ответ:
a.HCl(водн.) + h3O(л)→h4O + (водн.)+Cl – (водн.)
Объяснение:
Соляная кислота (HCl) является сильной кислотой, поэтому HCl полностью ионизируется в водном растворе. Другими словами, каждая молекула соляной кислоты, добавленная к воде, отдает свой протон H
б. Реакция:
NaCl(s) + H 2 O(водн. ) -> Na + (водный) + Cl – (водный) + H 2 O(ж)
) -> Na + (водный) + Cl – (водный) + H 2 O(ж)
Объяснение:
Когда хлорид натрия реагирует с водой, Na + часть NaCl притягивается к кислородной стороне молекул воды, в то время как сторона Cl – притягивается к водородной стороне молекулы воды.
Это приводит к тому, что хлорид натрия (соль) расщепляется в воде, а NaCl ионизируется на Na + и Cl 9.0082 –
ионы полностью. c)KOH(s) + H 2 O(l)<--> K + (водн.) + OH – (водн.) + H 2 O(l)
Объяснение:
KOH является основанием , поэтому смешивание его с водой дает основной раствор, который находится в равновесии. КОН просто растворяется в воде.
d)NH 3 (основание) + H 2 O(кислота)<--> NH 4 + (сопряженная кислота) + OH – (сопряженная основа)
Объяснение:
при растворении аммиака в воде. В водном растворе аммиак действует как основание, приобретая ионы водорода из H 2 O с образованием катиона аммония и ионов гидроксида.
В водном растворе аммиак действует как основание, приобретая ионы водорода из H 2 O с образованием катиона аммония и ионов гидроксида.
e)CH 3 COOH(l) + H 2 O(l) -> CH 3 COO – + H 3 O +
При добавлении к уксусной кислоте 9005 воды, за счет разности электроотрицательностей кислорода и водорода в ОН-группе уксусной кислоты и имеет место дипольное взаимодействие с молекулой воды. Следовательно, уксусная кислота ионизируется в ацетат-ион и H 9Ион 0082 +
соединяется с водой с образованием иона гидроксония. — f)MgCl 2 (т) + H 2 O(ж) -> Mg 2+ (водный) + Cl – (водный) + H 2 O(ж)
Объяснение:
При добавлении воды Mg 2+ часть MgCl 2 притягивается к кислородной стороне молекул воды, а Cl- сторона притягивается к водородной стороне молекулы воды. Это приводит к тому, что хлорид магния (соль) расщепляется в воде, и MgCl 2 полностью ионизируется в ионы Mg 2+ и Cl – .
g)CuSO 4 (тв) + H 2 O (ж) –> Cu +2 (вод) + SO 4 -2 (вод) + H 2 O(ж)
Объяснение:
когда соединение растворяется в воде, оно диссоциирует с образованием ионов. Реакция между безводным сульфатом меди (II) (белым) и водой становится синей в присутствии воды.
Страница № 74:
Вопрос 6:
Запишите концентрацию каждого из следующих растворов в г/л и моль/л.
а. 7,3 г HCl в 100 мл раствора
b. 2 г NaOH в 50 мл раствора
c. 3 г CH 3 COOH в 100 мл раствора
d. 4,9 г ч 2 SO 4 в 200 мл раствора
Ответ:
A) 7,3 г HCl в 100 мл раствор:
Концентрация Hcl в G l-1 = масса сольтута в Грамволюме Hcl. в литрах
= 7,3 × 1000100 = 73 г L -1
по грамм на литр:
7,3 г HCl в 100 мл имеет концентрацию = 73 г L -1
Моликулярная масса HCl = 1+ 35,5 = 36,5
Молярность = масса растворенного вещества в молевалом HCl в L
= 7,3 × 100036,5 × 100 = 2 моль L -1
с точки зрения моле на литр: 9005 7,3 G of hcl in hcl in hcl in hcl in hcl in hcl in hl in hl in hl in hcl in hcl in hcl in hcl in hl in hles на лит. 100 мл имеет концентрацию = 2 моль л -1
100 мл имеет концентрацию = 2 моль л -1
B) 2G NaOH в растворе 50 мл
Концентрация NaOH в G l -1 = масса NaOH в Gvolume of NaOH в L
= 2 × 100050 = 40 г -1
= 2 × 100050 = 40 г -1
= 2 × 100050 = 40 г -1
В пересчете на грамм на литр:
2 г NaOH в 50 мл имеет концентрацию = 40 г л -1
Молекулярная масса NaOH = 23 +16 + 1 = 40
Молярность = масса эсмолютола NaOH в л
=2 × 100040 ×50=1 моль л -1
В молях на литр:
2 г NaOH в 50 мл имеет концентрацию = 1 моль л 18 -1 G CH 3 COOH в растворе 50 мл
Концентрация CH4COOH в G L -1 = масса OFCH4COOH в GVOLUME CH4COOH в L Молярность = масса растворенного вещества в молюломе раствора в L = 3 × 100060 × 100 = 0,5 моль L -1 С точки зрения молей на литр: d)4,9 г H 2 SO 4 в растворе 200 мл Концентрация H3SO4 в G L -1 = масса H3SO4 в GVOLUME H3SO4 в L Молярность = масса растворенного вещества в молюломе раствора в L = 4,9 × 100098 × 200 = 1 моль L -1 с точки зрения молей на литр: Возьмите образец дождевой воды. Добавьте к нему несколько капель универсального индикатора. Измерьте его рН. Опишите природу пробы дождевой воды и объясните ее влияние на живой мир. Ответ 7. Это вопрос, основанный на деятельности, в котором вы должны собирать дождевую воду из разных мест и сравнивать полученные результаты на основе следующих параметров: Приведенные выше наблюдения показывают, что дождевая вода имеет кислую природу. Для большей уверенности мы можем сравнить синюю лакмусовую бумажку, смоченную в разных образцах дождевой воды, со шкалой рН. Ответьте на следующие вопросы. а. Классифицируйте кислоты по их щелочности и приведите по одному примеру каждого типа. б. Что понимается под нейтрализацией? Приведите два примера из повседневной жизни реакции нейтрализации. в. Объясните, что понимается под электролизом воды. Напишите электродные реакции и объясните их. Ответ 8. а. Число ионизируемых ионов водорода (Н+), присутствующих в одной молекуле кислоты, называется ее основностью . Например: H 2 SO 4— > 2H + + SO 4 2- По основности кислоты подразделяются на различные типы: 1. Одноосновные кислоты: Кислоты, которые при ионизации образуют один ион гидроксония при взаимодействии с водой. 2. Двухосновные кислоты: Кислоты, которые при ионизации образуют два иона гидроксония при реакции с водой Например: H 2 SO 4, H 2 CO 3 и т. д. 3. Трехосновные кислоты: Например: H 3 PO 4 , H 3 PO 3 и т.д. Реакция нейтрализации — это реакция, в которой кислота и основание реагируют с образованием воды и соли. Когда раствор нейтрализуют, это означает, что соли образуются из равных по весу кислоты и основания. Реакция нейтрализации применяется в быту: 1) Самооборона животных и растений с помощью химического оружия: Пчелиные укусы имеют кислую природу, домашним средством от укуса пчелы является пищевая сода или бикарбонат натрия, который является основным веществом. 2)pH в нашей пищеварительной системе: 3) Изменение рН как причина кариеса: в. Электролиз воды : Электролиз воды – это разложение на кислород и газообразный водород под действием электрического тока, проходящего через воду. Следующее уравнение представляет собой электролиз воды: h3O(l) В чистой воде на отрицательно заряженном катоде происходит реакция восстановления, при этом электроны (e − ) с катода отдаются катионам водорода в образуют газообразный водород. На положительно заряженном аноде происходит реакция окисления с образованием газообразного кислорода путем отдачи электронов аноду
= 3 × 1000100 = 30 г -1
с точки зрения GRAM на на на одного литр:
3 г CH 3 COOH в 100 мл имеет концентрацию = 30 г л -1
Молекулярная масса CH 3 COOH = 2 × 12 + 90 × 16 1 + 4
3 г 3 COOH в 10017
3 г CH 3 в 100. мл имеет концентрацию = 0,5 моль л -1
мл имеет концентрацию = 0,5 моль л -1
= 4,9 × 1000200 = 24,5 г L -1
в термине. Грамм за литр:
4,9 г H 2 SO 4 в 200 мл имеет концентрацию = 24,5 г L -1
Молекулярная масса H 2 SO 4 = 2 × 12+2. × 16 + 4 × 1 = 60
4.9 G 2 SO 4 в 200 мл имеет концентрацию = 1 моль л -1 Страница № 74:
Вопрос 7:

Ответ:
а) рН воды
б) Действие воды на синий лакмусовая бумага
c) Действие воды на красную лакмусовую бумагу
d) Влияние индикатора типа фенолфталеина и метилового оранжевого
Вывод:
Если мы возьмем пробы дождевой воды из разных мест, то увидим следующие результаты: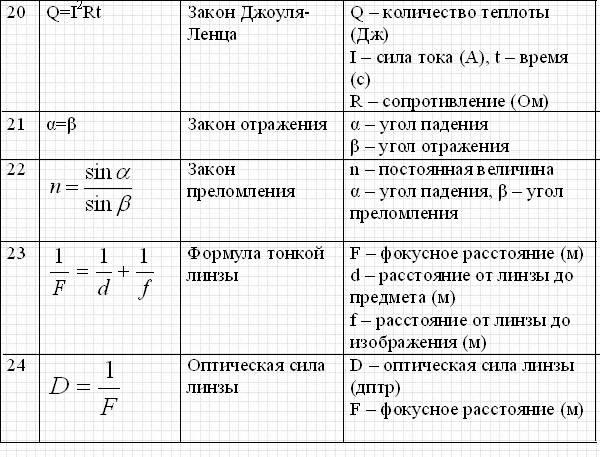
Если дождевая вода кислая, то ее рН должен быть в пределах 0-6.
Сила уксусной кислоты зависит от ее значения pH, т.е. чем ниже значение pH, тем выше будет сила кислоты и наоборот. Страница № 74:
Вопрос 8:
Ответ:
HCl ———> H + + Cl –
Основность HCl равна 1.
Основность H 2 SO 4 равна 2.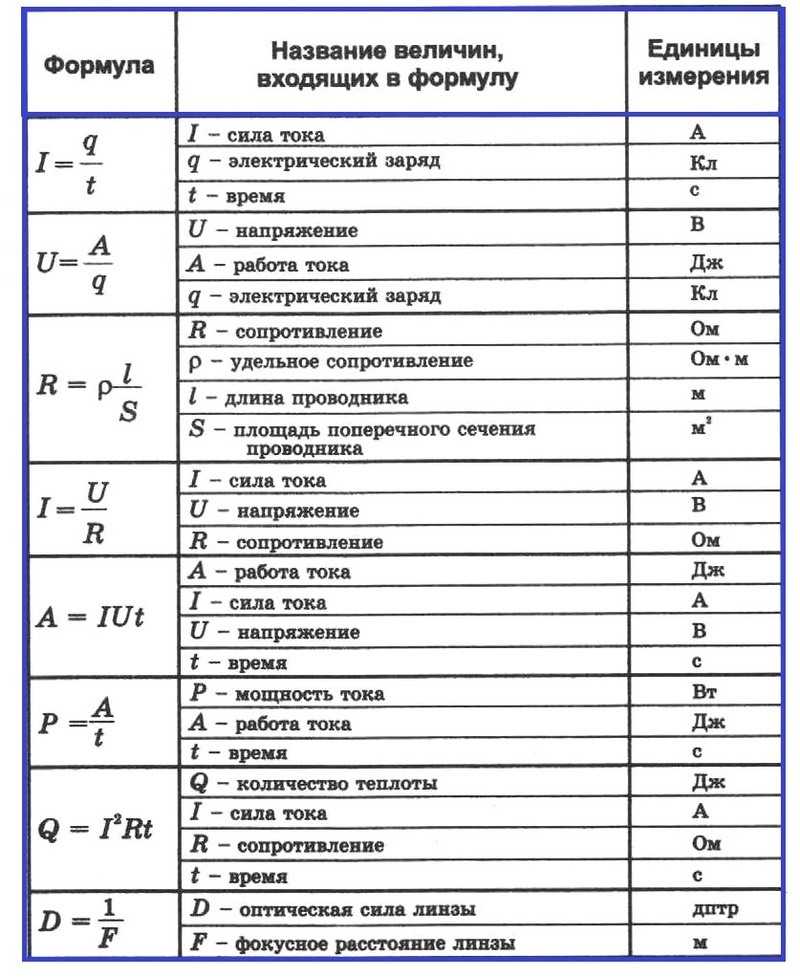
1. Одноосновные кислоты
2. Двухосновные кислоты
3. Трехосновные кислоты
Кислоты, которые при ионизации образуют один ион водорода.
Например: HCl, HNO 3 и т.д.
Кислоты, которые при ионизации образуют два иона водорода
Кислоты, которые при ионизации образуют три иона водорода
b. Реакция нейтрализации :  Он включает комбинацию H + ионов и ОН – ионов для получения воды.
Он включает комбинацию H + ионов и ОН – ионов для получения воды.
Нейтрализация сильной кислоты и сильного основания имеет рН, равный 7.
Нейтрализация сильной кислоты и слабого основания будет иметь рН менее 7.
Нейтрализация сильного основания нейтрализует слабую кислоту, будет больше чем 7.
Укусы осы слабощелочные, домашним средством от них будет уксус, он же уксусная кислота.
Эти простые процедуры облегчают эти болезненные укусы с помощью процесса, называемого нейтрализацией.
Повышенную кислотность желудка из-за употребления слишком большого количества острой пищи можно уменьшить, приняв антацид. Антацид является щелочным / основным по своей природе и помогает нейтрализовать кислотность желудка, или вы можете принять гидроксид магния (молоко магнезии) и гидрокарбонат натрия (пищевая сода).
Антацид является щелочным / основным по своей природе и помогает нейтрализовать кислотность желудка, или вы можете принять гидроксид магния (молоко магнезии) и гидрокарбонат натрия (пищевая сода).
Когда мы едим пищу, содержащую сахар, бактерии, присутствующие во рту, расщепляют сахар с образованием кислот (таких как молочная кислота). Таким образом, после пищеварения во рту образуется кислота. Это приведет к возникновению кариеса. Лучший способ предотвратить кариес – чистить полость рта после еды зубной пастой, которая по своей природе является основной. Это приведет к нейтрализации кислоты основанием.
4)рН почвы и рост растений:
Большинство растений лучше всего растут, когда рН почвы близок к 7, что является нейронным. Если почва слишком кислая или слишком щелочная (щелочная), растения плохо растут.
Кислая почва нейтрализуется путем обработки такими материалами, как негашеная известь (оксид кальция), гашеная известь (гидроксид кальция) или мел (карбонат кальция).
Если почва слишком щелочная, то щелочность можно уменьшить, добавив разлагающееся органическое вещество (навоз или композит), которое содержит кислые вещества.
Те же полуреакции можно уравновесить основанием, как указано ниже. Чтобы добавить полуреакции, они должны быть уравновешены кислотой или основанием.
Чтобы добавить полуреакции, они должны быть уравновешены кислотой или основанием.
| Катод (восстановление): | 2 H 2 O( l ) + 2e − | → | H 2 ( г ) + 2 OH − ( водный раствор ) |
| Анод (окисление): | 4 ОН − ( водный ) | → | O 2 ( г ) + 2 H 2 O( l ) + 4 e − |
Объединение двух половин реакции приводит к одинаковому общему разложению воды на кислород и водород:
- Общая реакция: 2 H 2 O( l ) → 2 H 2 ( г ) 2 ( г )
Таким образом, количество произведенных молекул водорода в два раза превышает количество молекул кислорода. Таким образом, произведенный газообразный водород имеет вдвое больший объем, чем произведенный газообразный кислород. Количество электронов, проталкиваемых через воду, в два раза превышает количество генерируемых молекул водорода и в четыре раза превышает количество генерируемых молекул кислорода.
Количество электронов, проталкиваемых через воду, в два раза превышает количество генерируемых молекул водорода и в четыре раза превышает количество генерируемых молекул кислорода.
2h3O(ж)⟶2h3(г)+O2(г)
Страница № 74:
Вопрос 9:
Объясните следующее.
а. Ионы гидроксония всегда находятся в форме H 3 O +
б. Пахта портится, если хранится в медной или латунной посуде.
Ответ:
а) Когда кислоты растворяются в воде. Н 9Ион 0082 + из кислоты всегда переходит к ближайшей молекуле воды, образуя ион гидроксония.
HCl(водн.)+H 2 O(водн.)→h4O + (водн.)+Cl-(водн.)
Например: Когда соляная кислота (HCl) является сильной кислотой. При растворении в воде HCl полностью ионизируется в водном растворе. Соляная кислота отдает свой протон H + молекуле воды с образованием катиона гидроксония H 3 O + и хлорид-анионов Cl –.
Соляная кислота отдает свой протон H + молекуле воды с образованием катиона гидроксония H 3 O + и хлорид-анионов Cl –.
b) Пахта портится, если хранится в медной или латунной емкости, потому что пахта на самом деле является молочной кислотой. Молочная кислота вступает в реакцию с материалом контейнера и образует ядовитый комплекс. На самом деле это реакция между кислотой и металлом. Эта реакция называется электрохимической реакцией.
Страница № 74:
Вопрос 10:
Напишите химические уравнения для следующих действий.
(a) Раствор NaOH добавляли к раствору HCl.
(b) Цинковая пыль была добавлена к разбавленному H 2 SO 4 .
(c) К оксиду кальция добавили разбавленную азотную кислоту.
(e) Газообразный диоксид углерода пропускали через раствор КОН.
(f) Разбавленную HCl вылили на пищевую соду.
Ответ:
а. HCl(ж) + NaOH(ж) → NaCl(т) + h3O(ж) + Энергия b.