Формулы по физике за 8 класс
Формулы по физике за 8 класс
| Давление | Р=F/S |
| Плотность | ρ=m/V |
| Давление на глубине жидкости | P=ρ∙g∙h |
| Архимедова сила | Fa=ρж∙g∙Vт |
| Скорость при движении по окружности | υ=2πR/Т |
| I закон Ньютона | |
| II закон Ньютона | F=ma |
| III закон Ньютона | F(1,2)=-F(2,1) |
| Закон Гука | Fy=-kx |
| Закон Всемирного тяготения | F=G∙M∙m/R2 |
| Вес тела, движущегося с ускорением а↑ | Р=m(g+a) |
| Вес тела, движущегося с ускорением а↓ | Р=m(g-a) |
| Сила трения | Fтр=µN |
| Импульс тела | p=mυ |
| Импульс силы | Ft=∆p |
| Момент силы | M=F∙ℓ |
| Потенциальная энергия тела | Eп=mgh |
| Потенциальная энергия упруго деформированного тела | Eп=kx²/2 |
| Кинетическая энергия тела | Ek=mυ²/2 |
| Работа | A=F∙S∙cosα |
| Мощность | N=A/t=F∙υ |
| Коэффициент полезного действия | η=Aп/Аз |
| Количество вещества | ν=N/ Na |
| Молярная масса | М=m/ν |
Cр. кин. энергия молекул одноатомного газа кин. энергия молекул одноатомного газа | Ek=3kT/2 |
| Основное уравнение МКТ | P=nkT=1/3nm0υ² |
| Закон Гей – Люссака | V/T =const |
| Закон Шарля | P/T =const |
| Закон Бойля – Мариотта | PV=const |
| Количество теплоты при нагревании | Q=Cm(T2-T1) |
| Количество теплоты при плавлении | Q=λm |
| Количество теплоты при парообразовании | Q=Lm |
| Уравнение состояния идеального газа | PV=m/M∙RT |
| Первый закон термодинамики | ΔU=A+Q |
| КПД тепловых двигателей | η= (Q1 – Q2)/ Q1 |
| Закон Кулона | F=k∙q1∙q2/R2 |
| Напряженность электрического поля | E=F/q |
| Напряженность эл. поля точечного заряда | E=k∙q/R2 |
Потенциальная энергия взаимод. зарядов зарядов | W= k∙q1q2/R |
| Электроемкость | C=q/U |
| Электроемкость плоского конденсатора | C=S∙ε∙ε0/d |
| Энергия заряженного конденсатора | W=qU/2=q²/2С=CU²/2 |
| Сила тока | I=q/t |
| Сопротивление проводника | R=ρ∙ℓ/S |
| Закон Ома для участка цепи | I=U/R |
| Закон преломления света | n(2,1)=n2/n1= υ1/υ2 |
| Показатель преломления | n21=sinα/sinγ |
| Формула тонкой линзы | 1/F=1/d + 1/f |
| Оптическая сила линзы | D=1/F |
Главная страница
Подписаться на: Сообщения (Atom)
как найти удельную, единица измерения, формула, как обозначается
Источник: myslide.ru
Процесс теплопередачи всегда предусматривает переход энергии между телами либо при обмене с внешней средой. Сколько именно энергии потеряло либо приобрело тело, отражает специальный параметр — количество теплоты.
Сколько именно энергии потеряло либо приобрело тело, отражает специальный параметр — количество теплоты.
Количество теплоты — что это за параметр в физике
Определение 1Под «количеством теплоты» в физике понимают энергию, которую в результате теплопередачи приобретает либо теряет какое-то тело. В международной СИ введена специальная единица — Джоуль. Вне этой системы для измерения может применяться единица «калория» (килокалория). Переход между этими единицами происходит с учетом, что 1 кал равняется 4,2 Дж.
Для обозначения количества теплоты введено обозначение Q.
Джоуль является также единицей, измеряющей работу. Поэтому справедлива запись:
Q=A=E=1Дж
Тело теряет либо приобретает энергию в ходе какого-либо процесса, в который оно вовлечено. Количественная характеристика определяется способом осуществления этого процесса. Имеет значение также начальная внутренняя энергия этого тела, на которую оказывают влияние внешние силы.
Какой физический параметр определяет количество теплоты
То количество теплоты, которое передается между телами, вызывает их нагревание (вплоть до парообразования и плавления), охлаждение (вплоть до кристаллизации). Возможно также образование конденсата. В то же время не каждое количество теплоты способно вызвать эти процессы. Существует определенная зависимость между количеством теплоты и массой взятого вещества. Эта зависимость выражается формулой:
Возможно также образование конденсата. В то же время не каждое количество теплоты способно вызвать эти процессы. Существует определенная зависимость между количеством теплоты и массой взятого вещества. Эта зависимость выражается формулой:
Q=CMΔT
Определение 2Количество теплоты, необходимое для нагревания тела, есть величина, прямо пропорциональная его массе и разнице его начальной и конечной температур.
Аналогичным образом формулируются следующие закономерности:
- Величина Q, которое потребуется для перехода жидкости из обычного состояния в парообразное, находится в прямой зависимости от ее массы: Q=Lm, где L — особая величина, именуемая теплотой парообразования.
- Величина Q, которое потребуется для перехода твердого тела в расплавленное состояние либо наоборот, находится в прямой зависимости от его массы: Q=λm, где λ — особая величина, именуемая удельной теплотой плавления.
- Величина Q, которое выделится при сгорании топлива, находится в прямо пропорциональной зависимости от его массы: Q=qm, где q — особая величина, именуемая удельной теплотой сгорания.

Таким образом, мы пришли к физическому понятию «удельная теплоемкость».
Определение 3Удельная теплоемкость характеризует величину количества теплоты, которое потратится в процессе нагревания (либо выделится в процессе охлаждения) тела массой 1 кг на 1 К.
Исходя из определения, чтобы определить, какое количество теплоты будет затрачено на парообразование либо плавление (конденсацию, кристаллизацию), необходимо знать удельную теплоту парообразования, плавления, конденсации, кристаллизации, сгорания. Эти показатели рассчитываются экспериментальным путем и являются величинами постоянными. Для решения соответствующих задач по термодинамике пользуются специальными таблицами.
Источник: ru.teplowiki.org
Для некоторых жидкостей:
Источник: ru.teplowiki.org
Понятие теплоемкости, как измеряется, график зависимости температуры от времени
Определение 4Под понятием «теплоемкости» подразумевается то количество теплоты, которое поглощается либо выделяется телом при его нагревании (либо охлаждении) на 1 Кельвин. Это физическое понятие, зависящее от соотношения количества теплоты, которое в термодинамической системе поглощается либо выделяется, незначительно изменяя температуру, к данному изменению.
Это физическое понятие, зависящее от соотношения количества теплоты, которое в термодинамической системе поглощается либо выделяется, незначительно изменяя температуру, к данному изменению.
Для обозначения теплоемкости вводится знак C. Формула для ее определения:
C=ΔQ÷ΔT
Становится понятным, что, с увеличением массы тела количества теплоты, необходимое для его нагревания, увеличивается. Другими словами, теплоемкость тела находится в прямо пропорциональной зависимости от количества содержащегося в нем вещества.
С другой стороны, показателем количества вещества является масса либо количество молей. Отсюда вытекает уже знакомое понятие и формула «удельной теплоемкости»:
c=C÷m
и теплоемкости молярной:
Cμ=C÷ν
Существует также понятие «объемной теплоемкости»:
С’=C÷V
Одно и то же вещество, принимая различное агрегатное состояние, определяет теплоемкость.
Например, теплоемкость идеального газа зависит от числа степеней свобод молекул. Теплоемкость твердого тела характеризуется по нескольким теориям:
Теплоемкость твердого тела характеризуется по нескольким теориям:
- Законы Дюлонга — Пти и Джоуля — Коппа;
- Квантовая теория Эйнштейна;
- Квантовая теория теплоёмкостей Дебая.
На рисунке графически изображены характеристики теплоемкости твердого тела согласно теорий Дебая и Эйнштейна.
Источник: ru.wikipedia.org
ПримечаниеПонятие «теплоемкость» отличается от «удельная теплоемкость» тем, что в нем речь идет о сообщении теплоты всему телу, а не единице его массы (1 кг).
Единицей измерения теплоемкости является Дж/К (для системы СИ).
Удельная теплоемкость может иметь различные единицы измерения, поскольку количество вещества имеет несколько выражений (по массе, объему, молям).
Выражая количество теплоты, необходимое для нагревания (либо охлаждения) 1 кг на 1 К, говорят о массовой теплоемкости, которая измеряется в Дж/кг*К.
Если необходимо выразить количество теплоты, которое нужно дать (либо забрать) телу в рассчете на 1 м3, чтобы изменить его температуру на 1К, говорят об объемной темплоемкости, которая измеряется в Дж/м3*К.
Если затрагивается понятие «молярная теплоемкость», то имеют ввиду то количество теплоты, которое необходимо для нагревания (либо охлаждения) 1 моля вещества на 1К. Единицей измерения в таком случае является Дж/моль*К.
Рассчитывать затраты тепла в физике принято, основываясь на законе сохранения энергии, являющегося первым началом термодинамики. Для случаев, когда работа равна нулю, т.е. учитывается только теплообмен, уравнение теплового баланса учитывает для изолированной системы сумму количеств теплоты, которые отдаются телами (при этом их внутренняя энергия снижается) и получаются. При этом количество отданной и полученной энергии равно. Такой энергетический обмен между телами будет происходить до тех пор, пока их температуры уравновесятся, т.е. наступит термодинамическое равновесие.
Рассмотрим, как выглядит график зависимости температуры тела от времени его нагревания. В данном примере первоначально тело находилось в твердом состоянии:
Источник: neznaika.info
Как найти удельную теплоёмкость, формулы
Удельная теплоемкость по сути является коэффициентом пропорциональности между изменением температуры тела и его массой. Поэтом рассчитать ее можно по формуле:
Поэтом рассчитать ее можно по формуле:
Источник: skysmart.ru
Вторым способом ее можно рассчитать, используя теплоемкость:
Источник: skysmart.ru
Количество теплоты, необходимое для нагревания веществ
Если нужно узнать, какое количество теплоты необходимо для нагревания вещества, то нужно произвести действие умножения между его удельной теплоемкостью, массой и разностью конечной и начальной температур:
Q=cm(tкон-tнач)
Поскольку конечная температура тела выше, чем начальная, то Q будет положительным числом.
Количество теплоты, выделяемое при охлаждении веществ
Рассматривая процесс охлаждения, анализируем ситуацию, когда конечная температура тела ниже начальной. Высчитать, какое количество теплоты тело будет выделять, можно по той же формуле, однако Q будет иметь знак минус.
Примеры решения задач
Задача 1Определить вещество, лежащее в основе тела, если при нагревании его с 200 до 600К ему передалось 4,0*106 Дж. Масса тела 40 кг.
Решение
Чтобы решить задачу, необходимо узнать удельную теплоемкость этого вещества, затем — по таблице узнать его название.
C=Q÷mΔT
C=4,0*106÷40*400=0,25*103Дж/кгК
По таблице находим, что такую удельную теплоемкость имеет олово.
Задача 2Масса воды в сосуде 800г, температура 60оС. В эту воду помещают лед с температурой -10оС. Какой массы лед был помещен, если термодинамическое равновесие установилось, когда температура воды стала равной 40оС.
Решение
Из таблиц определяем, что удельная теплоемкость воды равна 4,2*103 Дж/кгК, льда – 2,1*103 Дж/кгК. λ льда (удельная теплота плавления) = 3,33*105Дж/кг.
Для состояния теплового баланса характерно:
с2m2(to-t2)+λm2+c1m2(t3-to)+c1m1(t3-t1)=0
Находим m2:
m2=c1m1(t1-t3)⁄(c2(to-t2)+λ+c1(t3-t0))
Подставляя значения, находим величину массы, равную 0,13 кг.
Задача 3Определить Q, выделившееся при охлаждении 20 л масла, если его температура снизилась с 60оС до 20оС.
Первым делом, для перехода в систему СИ заменяем объем, выраженный в литрах, на единицу м3: 20л=0,02м3.
Q=cmΔT.
В то же время m=ρV/
Найдя в таблице ρ, высчитываем массу масла: m=90*0,02=18 кг
Разница температур составила 40оС.
Q=1800*18*40=1296 (кДж).
Изменение температуры и теплоемкость
Цели обучения
К концу этого раздела вы сможете:
- Наблюдать теплопередачу и изменение температуры и массы.
- Рассчитать конечную температуру после теплопередачи между двумя объектами.
Одним из основных эффектов теплопередачи является изменение температуры: при нагревании температура повышается, а при охлаждении снижается. Мы предполагаем, что фазового перехода нет и что над системой или системой не совершается никакой работы. Опыты показывают, что передаваемое тепло зависит от трех факторов — изменения температуры, массы системы, вещества и фазы вещества.
Рис. 1. Теплота Q , переданная для изменения температуры, зависит от величины изменения температуры, массы системы, а также вовлеченного вещества и фазы. а) Количество переданного тепла прямо пропорционально изменению температуры. Чтобы удвоить изменение температуры массы m, нужно добавить удвоенное количество теплоты. б) Количество переданного тепла также прямо пропорционально массе. Чтобы вызвать эквивалентное изменение температуры в удвоенной массе, нужно добавить в два раза больше тепла. в) Количество переданного тепла зависит от вещества и его фазы. Если требуется сумма
а) Количество переданного тепла прямо пропорционально изменению температуры. Чтобы удвоить изменение температуры массы m, нужно добавить удвоенное количество теплоты. б) Количество переданного тепла также прямо пропорционально массе. Чтобы вызвать эквивалентное изменение температуры в удвоенной массе, нужно добавить в два раза больше тепла. в) Количество переданного тепла зависит от вещества и его фазы. Если требуется сумма
Зависимость от изменения температуры и массы легко понять. Благодаря тому, что (средняя) кинетическая энергия атома или молекулы пропорциональна абсолютной температуре, внутренняя энергия системы пропорциональна абсолютной температуре и числу атомов или молекул. Благодаря тому, что переданное тепло равно изменению внутренней энергии, теплота пропорциональна массе вещества и изменению температуры.
Теплопередача и изменение температуры
Количественная связь между теплопередачей и изменением температуры содержит все три фактора: Q = mc Δ T , где Q — символ теплопередачи, м масса вещества, а Δ T — изменение температуры. Символ c означает удельную теплоемкость и зависит от материала и фазы. Удельная теплоемкость – это количество теплоты, необходимое для изменения температуры 1,00 кг массы на 1,00°С. Удельная теплоемкость c — свойство вещества; его единица СИ – Дж / (кг ⋅ K) или Дж / (кг ⋅ ºC). Напомним, что изменение температуры (Δ T ) одинаково в единицах кельвина и градусах Цельсия. Если теплопередача измеряется в килокалориях, то единицей удельной теплоемкости является ккал/(кг ⋅ ºC).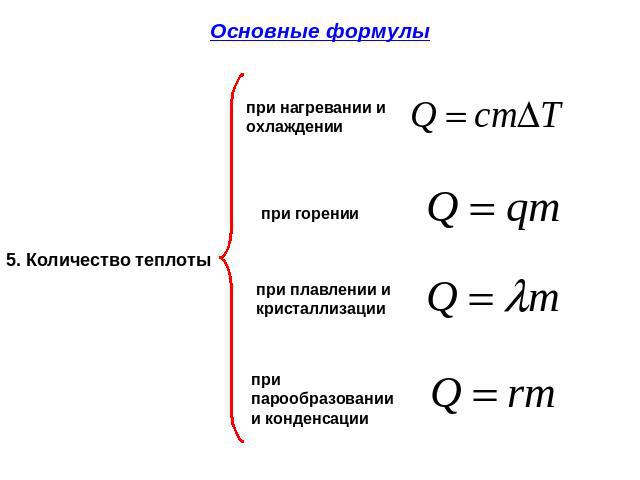
Значения удельной теплоемкости обычно нужно искать в таблицах, потому что нет простого способа их расчета. В общем случае удельная теплоемкость также зависит от температуры. В таблице 1 перечислены репрезентативные значения удельной теплоемкости для различных веществ. За исключением газов, зависимость теплоемкости большинства веществ от температуры и объема слабая. Из этой таблицы мы видим, что удельная теплоемкость воды в пять раз больше, чем у стекла, и в десять раз больше, чем у железа, а это значит, что требуется в пять раз больше теплоты, чтобы поднять температуру воды на ту же величину, что и для стекла, и в десять раз больше, чем для стекла. много тепла, чтобы поднять температуру воды, как для железа. На самом деле вода имеет одну из самых больших удельных теплоемкостей среди всех материалов, что важно для поддержания жизни на Земле.
Пример 1. Расчет необходимого количества тепла: нагрев воды в алюминиевой кастрюле
Алюминиевая кастрюля весом 0,500 кг на плите используется для нагрева 0,250 л воды с 20,0°C до 80,0°C. а) Какое количество тепла потребуется? Какой процент тепла используется для повышения температуры (b) кастрюли и (c) воды?
а) Какое количество тепла потребуется? Какой процент тепла используется для повышения температуры (b) кастрюли и (c) воды?
Стратегия
Посуда и вода всегда имеют одинаковую температуру. Когда вы ставите кастрюлю на плиту, температура воды и сковороды увеличивается на одинаковую величину. Воспользуемся уравнением теплообмена при заданном изменении температуры и массы воды и алюминия. Удельные теплоемкости воды и алюминия приведены в табл. 1.
Решение
Поскольку вода находится в тепловом контакте с алюминием, кастрюля и вода имеют одинаковую температуру.
Рассчитайте разницу температур:
Δ T = T f − T i = 60,0ºC.
Рассчитайте массу воды. Поскольку плотность воды 1000 кг/м 3 , один литр воды имеет массу 1 кг, а масса 0,250 л воды равна м w = 0,250 кг.
Рассчитайте теплоту, переданную воде. Используйте удельное тепло воды в Таблице 1:
Q W = M W C W Δ T = (0,250 кг) (4186 J/KGºC) (60,0,016C) (60,0,016C) (60,016C) (60,0,016C) (60,016C) (60,016C) (60,016C) (60,016C) (60,016 ° С) = 62,8 кДж.
Рассчитайте тепло, переданное алюминию. Используйте удельную теплоемкость алюминия из таблицы 1:
Q Al = m Al c Al Δ T = (0,500 кг)(900 Дж/кгºC)(60,0ºC) = 27,0 × 10 4 Дж = 27,0 кДж. вода. Сначала найдем общее переданное тепло:
Q Всего = Q Вт + Q Al = 62,8 кДж + 27,8 кДж + 27,8 кДж + 27,8 кДж + 27,8 кДж + 27,8 кДж
Таким образом, количество тепла, идущее на нагрев сковороды, равно
[латекс]\frac{27.0\text{ кДж}}{89.8\text{ кДж}}\times100\%=30,1\%\\[/латекс]
и количество, идущее на нагрев воды, составляет
[латекс]\фрак{62,8\текст{ кДж}}{89,8 \text{ кДж}}\times100\%=69,9\%\\[/latex].
Обсуждение
В этом примере тепло, переданное контейнеру, составляет значительную долю от общего количества переданного тепла. Хотя масса кастрюли в два раза больше массы воды, удельная теплоемкость воды более чем в четыре раза больше, чем у алюминия. Следовательно, для достижения заданного изменения температуры воды требуется чуть более чем в два раза больше тепла по сравнению с алюминиевой кастрюлей.
Следовательно, для достижения заданного изменения температуры воды требуется чуть более чем в два раза больше тепла по сравнению с алюминиевой кастрюлей.
Пример 2. Расчет повышения температуры по работе, совершаемой над веществом: перегрев тормозов грузовика при движении под гору
Рис. 2. Дымящиеся тормоза на этом грузовике являются видимым свидетельством механического эквивалента тепла.
Тормоза грузовиков, используемые для контроля скорости на спуске, работают, преобразовывая потенциальную энергию гравитации в повышенную внутреннюю энергию (более высокую температуру) тормозного материала. Это преобразование предотвращает преобразование потенциальной энергии гравитации в кинетическую энергию грузовика. Проблема заключается в том, что масса грузовика велика по сравнению с массой тормозного материала, поглощающего энергию, и повышение температуры может происходить слишком быстро, чтобы достаточное количество тепла передавалось от тормозов в окружающую среду.
Рассчитайте повышение температуры 100 кг тормозного материала со средней удельной теплоемкостью 800 Дж/кг ⋅ ºC, если материал сохраняет 10 % энергии от 10 000-килограммового грузовика, спускающегося с высоты 75,0 м (при вертикальном перемещении) при постоянном скорость.
Стратегия
Если тормоза не задействованы, гравитационная потенциальная энергия преобразуется в кинетическую энергию. При торможении потенциальная энергия гравитации преобразуется во внутреннюю энергию тормозного материала. Сначала вычислим гравитационную потенциальную энергию ( Mgh ), что весь грузовик теряет при спуске, а затем найти повышение температуры только в тормозном материале.
Решение
- Рассчитайте изменение потенциальной энергии гравитации при движении грузовика под гору
- Рассчитайте температуру по переданному теплу, используя Q = Mgh и [латекс]\Delta{T}=\frac{Q}{mc}\\[/latex], где 9{\ circ} C \\ [/латекс].
Обсуждение
Эта температура близка к температуре кипения воды. Если бы грузовик какое-то время ехал, то непосредственно перед спуском температура тормозов, вероятно, была бы выше температуры окружающей среды. Повышение температуры при спуске, вероятно, повысит температуру тормозного материала выше точки кипения воды, поэтому этот метод нецелесообразен. Однако та же идея лежит в основе новейшей гибридной технологии автомобилей, где механическая энергия (потенциальная энергия гравитации) преобразуется тормозами в электрическую энергию (аккумулятор).
Однако та же идея лежит в основе новейшей гибридной технологии автомобилей, где механическая энергия (потенциальная энергия гравитации) преобразуется тормозами в электрическую энергию (аккумулятор).
| Таблица 1. Удельная теплоемкость [1] различных веществ | ||
|---|---|---|
| Вещества | Удельная теплоемкость ( c ) | |
| Твердые вещества | Дж/кг ⋅ ºC | ккал/кг ⋅ ºC [2] |
| Алюминий | 900 | 0,215 |
| Асбест | 800 | 0,19 |
| Бетон, гранит (средний) | 840 | 0,20 |
| Медь | 387 | 0,0924 |
| Стекло | 840 | |
| Золото | 129 | 0,0308 |
| Тело человека (в среднем при 37 °C) | 3500 | 0,83 |
| Лед (средний, от −50°C до 0°C) | 2090 | 0,50 |
| Железо, сталь | 452 | 0,108 |
| Свинец | 128 | 0,0305 |
| Серебро | 235 | 0,0562 |
| Дерево | 1700 | 0,4 |
| Жидкости | ||
| Бензол | 1740 | 0,415 |
| Этанол | 2450 | 0,586 |
| Глицерин | 2410 | 0,576 |
| Меркурий | 139 | 0,0333 |
| Вода (15,0 °С) | 4186 | 1. 000 000 |
| Газы [3] | ||
| Воздух (сухой) | 721 (1015) | 0,172 (0,242) |
| Аммиак | 1670 (2190) | 0,399 (0,523) |
| Углекислый газ | 638 (833) | 0,152 (0,199) |
| Азот | 739 (1040) | 0,177 (0,248) |
| Кислород | 651 (913) | 0,156 (0,218) |
| Пар (100°C) | 1520 (2020) | 0,363 (0,482) |
Обратите внимание, что пример 2 является иллюстрацией механического эквивалента тепла. В качестве альтернативы, повышение температуры может быть произведено с помощью паяльной лампы вместо механического.
Пример 3. Расчет конечной температуры при передаче тепла между двумя телами: наливание холодной воды на горячую сковороду
Предположим, вы наливаете 0,250 кг воды температурой 20,0ºC (около чашки) в 0,500-килограммовую алюминиевую кастрюлю с температурой 150ºC, снятую с плиты. Предположим, что кастрюля находится на изолированной подушке и что незначительное количество воды выкипает. При какой температуре вода и кастрюля через короткое время достигают теплового равновесия?
Предположим, что кастрюля находится на изолированной подушке и что незначительное количество воды выкипает. При какой температуре вода и кастрюля через короткое время достигают теплового равновесия?
Стратегия
Кастрюля размещена на изолирующей прокладке, чтобы обеспечить небольшой теплообмен с окружающей средой. Первоначально кастрюля и вода не находятся в тепловом равновесии: кастрюля имеет более высокую температуру, чем вода. Затем теплопередача восстанавливает тепловое равновесие, когда вода и кастрюля соприкасаются. Поскольку теплопередача между кастрюлей и водой происходит быстро, масса испаряемой воды пренебрежимо мала, а величина тепла, теряемого кастрюлей, равна теплу, приобретаемому водой. Обмен теплом прекращается, как только достигается тепловое равновесие между чашей и водой. Теплообмен можно записать как | Q горячий |= Q холодный .
Решение
Используйте уравнение теплопередачи Q = mc Δ T , чтобы выразить потери тепла алюминиевой кастрюлей через массу кастрюли, удельную теплоемкость алюминия, начальную температуру сковороде и конечная температура: Q горячий = m Al c Al ( T f − 150ºC).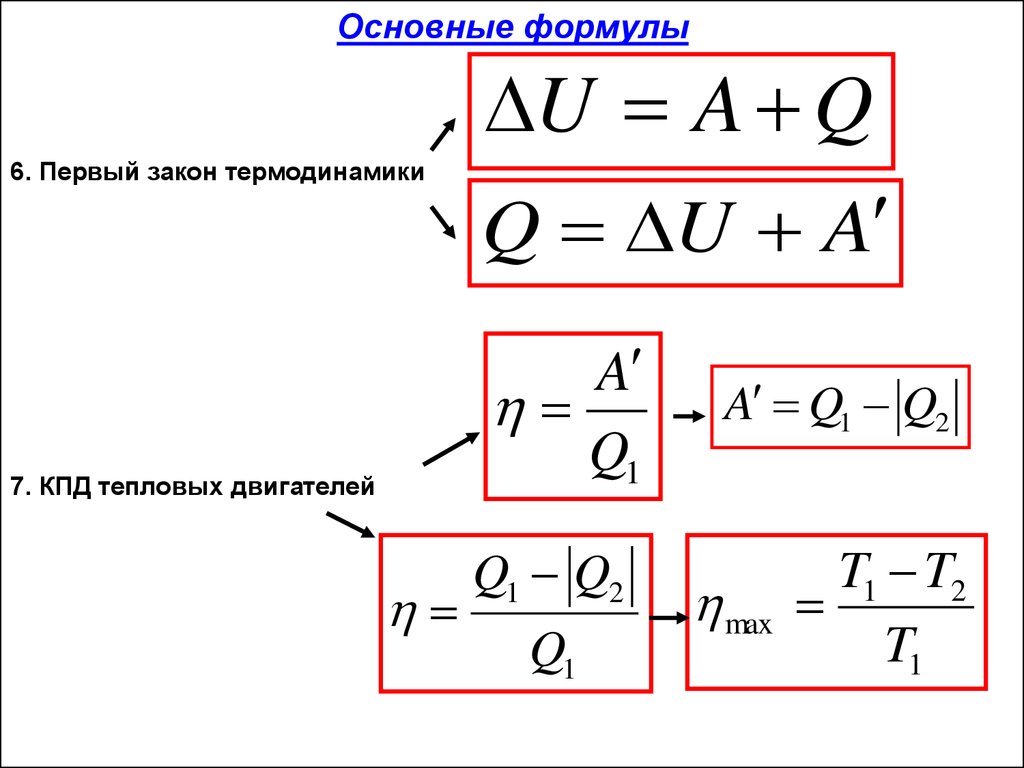
Выразите тепло, полученное водой, через массу воды, удельную теплоемкость воды, начальную температуру воды и конечную температуру: Q холод = m W c W ( T f – 20,0ºC).
Обратите внимание, что Q горячая <0 и Q холодная >0 и что их сумма должна равняться нулю, поскольку тепло, отводимое горячей кастрюлей, должно быть таким же, как тепло, полученное холодной водой: 9{\circ}\text{C}\end{array}\\[/latex]
Обсуждение
Это типичная задача калориметрии : два тела при разных температурах соприкасаются друг с другом и обмениваются нагревать до достижения общей температуры. Почему конечная температура намного ближе к 20,0ºC, чем к 150ºC? Причина в том, что вода имеет большую удельную теплоемкость, чем большинство обычных веществ, и, таким образом, претерпевает небольшое изменение температуры при заданной теплопередаче. Большому водоему, такому как озеро, требуется большое количество тепла, чтобы заметно повысить его температуру. Это объясняет, почему температура озера остается относительно постоянной в течение дня даже при больших изменениях температуры воздуха. Однако температура воды меняется в течение более длительного времени (например, с лета на зиму).
Большому водоему, такому как озеро, требуется большое количество тепла, чтобы заметно повысить его температуру. Это объясняет, почему температура озера остается относительно постоянной в течение дня даже при больших изменениях температуры воздуха. Однако температура воды меняется в течение более длительного времени (например, с лета на зиму).
Самостоятельный эксперимент: изменение температуры земли и воды
Что нагревается быстрее, земля или вода?
Для изучения различий в теплоемкости:
- Поместите равные массы сухого песка (или почвы) и воды одинаковой температуры в два небольших сосуда. (Средняя плотность почвы или песка примерно в 1,6 раза выше, чем у воды, поэтому вы можете получить примерно равные массы, используя на 50% больше воды по объему.)
- Нагревайте оба (используя духовку или нагревательную лампу) в течение одинакового времени.
- Запишите конечную температуру двух масс.
- Теперь доведите обе банки до одинаковой температуры, нагревая их в течение более длительного периода времени.

- Снимите банки с источника тепла и измеряйте их температуру каждые 5 минут в течение примерно 30 минут.
Какой образец остывает быстрее? Эта деятельность воспроизводит явления, ответственные за наземные и морские бризы.
Проверьте свое понимание
Если для повышения температуры блока с 25°C до 30°C необходимо 25 кДж, то какое количество теплоты необходимо для нагрева блока с 45°C до 50°C?
Решение
Теплопередача зависит только от разницы температур. Так как разность температур одинакова в обоих случаях, то и во втором случае необходимы одни и те же 25 кДж.
Section Summary
- The transfer of heat Q that leads to a change Δ T in the temperature of a body with mass m is Q = mc Δ T , where c – удельная теплоемкость материала. Это соотношение также можно рассматривать как определение удельной теплоемкости.
Концептуальные вопросы
- Какие три фактора влияют на теплопередачу, необходимую для изменения температуры объекта?
- Температура тормозов автомобиля повышается на Δ T при остановке автомобиля со скорости v .
 Насколько больше было бы Δ T , если бы скорость автомобиля изначально была вдвое больше? Вы можете предположить, что автомобиль останавливается достаточно быстро, чтобы тепло от тормозов не отводилось.
Насколько больше было бы Δ T , если бы скорость автомобиля изначально была вдвое больше? Вы можете предположить, что автомобиль останавливается достаточно быстро, чтобы тепло от тормозов не отводилось.
Задачи и упражнения
- В жаркий день температура в бассейне объемом 80 000 литров повышается на 1,50ºC. Какова чистая теплопередача при этом нагреве? Игнорируйте любые осложнения, такие как потеря воды в результате испарения.
- Показать, что 1 кал/г · ºC = 1 ккал/кг · ºC.
- Чтобы стерилизовать стеклянную детскую бутылочку весом 50,0 г, мы должны поднять ее температуру с 22,0ºC до 95,0ºC. Какая теплопередача требуется?
- Одинаковая передача тепла одинаковым массам различных веществ вызывает различные изменения температуры. Рассчитайте конечную температуру, когда 1,00 ккал теплоты переходит в 1,00 кг следующих веществ при исходной температуре 20,0ºC: (a) вода; (б) бетон; (в) сталь; и d) ртуть.
- Потирание рук согревает их, превращая работу в тепловую энергию.
 Если женщина потирает руки взад-вперед, совершая в общей сложности 20 движений, на расстоянии 7,50 см за одно движение и со средней силой трения 40,0 Н, на сколько повысится температура? Масса согреваемых тканей составляет всего 0,100 кг, преимущественно в ладонях и пальцах.
Если женщина потирает руки взад-вперед, совершая в общей сложности 20 движений, на расстоянии 7,50 см за одно движение и со средней силой трения 40,0 Н, на сколько повысится температура? Масса согреваемых тканей составляет всего 0,100 кг, преимущественно в ладонях и пальцах. - Блок чистого материала массой 0,250 кг нагревается с 20,0ºC до 65,0ºC за счет добавления 4,35 кДж энергии. Рассчитайте его удельную теплоемкость и определите вещество, из которого он, скорее всего, состоит.
- Предположим, что одинаковые количества тепла передаются разным массам меди и воды, вызывая одинаковые изменения температуры. Каково отношение массы меди к воде?
- (a) Количество килокалорий в пище определяется методами калориметрии, при которых пища сжигается и измеряется количество теплопередачи. Сколько килокалорий на грамм содержится в 5,00 г арахиса, если энергия его сжигания передается 0,500 кг воды, находящейся в алюминиевом стакане весом 0,100 кг, вызывая 54,9ºC повышение температуры? (б) Сравните свой ответ с информацией на этикетке на упаковке арахиса и прокомментируйте, совпадают ли значения.

- После интенсивной физической нагрузки температура тела человека массой 80,0 кг составляет 40,0ºC. С какой скоростью в ваттах человек должен передать тепловую энергию, чтобы снизить температуру тела до 37,0ºC за 30,0 мин, если предположить, что тело продолжает производить энергию мощностью 150 Вт? 1 Вт = 1 Дж/сек или 1 Вт = 1 Дж/сек.
- Даже при остановке после периода нормальной эксплуатации большой коммерческий ядерный реактор передает тепловую энергию со скоростью 150 МВт за счет радиоактивного распада продуктов деления. Этот теплообмен вызывает быстрое повышение температуры в случае отказа системы охлаждения (1 Вт = 1 Дж/сек или 1 Вт = 1 Дж/сек и 1 МВт = 1 мегаватт). (a) Рассчитайте скорость повышения температуры в градусах Цельсия в секунду (ºC/с), если масса активной зоны реактора составляет 1,60 × 10 5 кг и имеет среднюю удельную теплоемкость 0,3349 кДж/кг ⋅ ºC. (б) Сколько времени потребуется, чтобы получить повышение температуры на 2000ºC, что может привести к плавлению некоторых металлов, содержащих радиоактивные материалы? (Начальная скорость повышения температуры будет больше рассчитанной здесь, поскольку теплопередача сосредоточена в меньшей массе.
 Однако позже рост температуры замедлится, поскольку стальная защитная оболочка массой 5 × 10 5 кг также начинают нагреваться.)
Однако позже рост температуры замедлится, поскольку стальная защитная оболочка массой 5 × 10 5 кг также начинают нагреваться.)
Рис. 3. Бассейн с радиоактивным отработавшим топливом на атомной электростанции. Отработавшее топливо долго остается горячим. (кредит: Министерство энергетики США)
Глоссарий
удельная теплоемкость: количество теплоты, необходимое для изменения температуры 1,00 кг вещества на 1,00 ºC
Избранные решения задач и упражнений
×2. 10 8 J
3. 3,07 × 10 3 J
5. 0,171ºC
7. 10,8
9. 617 Вт
- Значения для твердых и жидких веществ даны при постоянном объеме и температуре 25ºC, если не указано иное. ↵
- Эти значения идентичны в единицах кал/г ⋅ ºC. ↵
- c v при постоянном объеме и температуре 20,0ºC, если не указано иное, и среднем давлении 1,00 атм. В скобках указаны значения c p при постоянном давлении 1,00 атм.
 ↵
↵
Теплофизика: определение, уравнение, задача, решение
Естественно, мы все знакомы с понятием температуры, но как на самом деле определить температуру вещества с помощью физики? Описание внутренней тепловой энергии вещества с помощью температуры оказывается фундаментальным аспектом физики и термодинамики.
Что такое температура?
Тепловая энергия вещества пропорциональна (средней) кинетической энергии составляющих его молекул или атомов. В системе с двумя объектами горячее объект имеет более высокую температуру и более высокую среднюю кинетическую энергию . Тепловая энергия перетекает от более горячего объекта к более холодному до тех пор, пока оба объекта не достигнут одинаковой температуры. Это формализовано в нулевом законе термодинамики .
Нулевой закон термодинамики
Хотя нулевой закон термодинамики был предложен только четвертым законом, он считался настолько фундаментальным для теплофизики, что теперь стоит на первом месте.
Рисунок 1. Нулевой закон является фундаментальной концепцией теплофизики, которая обеспечивает основу для определения температуры и математических законов о влиянии температуры. Источник: Росс Макдональд, StudySmarter.
Нулевой закон гласит:
Если два объекта А и С независимо друг от друга находятся в тепловом равновесии с некоторым третьим объектом В, то А и С также находятся в равновесии друг с другом. Это также показывает, что все три объекта имеют одинаковую температуру.
Этот (кажущийся очевидным) закон определяет температуру как свойство, описывающее направление передачи любой тепловой энергии между объектами. Нулевой закон важен, поскольку он показывает, что передача тепловой энергии контролируется физическими температурами, а не общей тепловой (кинетической) энергией объекта.
Температурные весы
Определив, что такое температура, теперь нам нужен способ ее измерения. Для того, чтобы сравнивать температуры разных объектов, нужна шкала. Температурная шкала определяется две фиксированные точки при определенных температурах с некоторым шагом между ними.
Температурная шкала определяется две фиксированные точки при определенных температурах с некоторым шагом между ними.
В настоящее время в мире используются три основные температурные шкалы:
Цельсия
- Эта температурная шкала, предложенная шведским астрономом Андерсом Цельсия в 1742 году, используется в большинстве стран мира.
- Фиксированные точки шкалы Цельсия – это точка замерзания (0°C) и точка кипения воды (100°C при атмосферном давлении 1,01⋅10 5 Па), со 100 шагами по 1°C между ними.
Фаренгейты
- Шкала Фаренгейта, предложенная немецким физиком Даниэлем Фаренгейтом в 18 веке, в основном используется в Соединенных Штатах.
- Шкала также основана на точках замерзания (32°F) и кипения (212°F) воды с шагом 180 между ними.
- Шкала абсолютной температуры использует фиксированные точки тройной точки воды (273,16°K) и абсолютный ноль (0°К).
 Они были выбраны потому, что они не зависят от атмосферного давления, в отличие от шкал Цельсия и Фаренгейта.
Они были выбраны потому, что они не зависят от атмосферного давления, в отличие от шкал Цельсия и Фаренгейта. - При определении шкалы Кельвина было решено, что каждый шаг должен быть равен 1°C, чтобы упростить сравнение. Вот почему между двумя фиксированными точками ровно 273,16°F.
- Кельвин — единица измерения температуры в системе СИ. Чтобы преобразовать температуру в градусах Цельсия в кельвины, мы можем использовать формулу T(K)=T(C)+273,16.
- Температура по шкале Кельвина всегда положительна.
Тройная точка воды (или других веществ) — это температура и давление, при которых все три фазы вещества (твердое, жидкое и газообразное) могут сосуществовать. Различные фазы также существуют в тепловом равновесии, без передачи чистой тепловой энергии между ними. Для чистой воды тройная точка составляет 0,01 °C при 611,2 Па.
Теплопередача
Теперь, когда мы понимаем, что такое температура, мы можем исследовать, как тепловая энергия (тепло) передается между объектами в системе. Эта область физики известна как термодинамика, которая занимается отношениями между теплом, работой, температурой и энергией в системах.
Эта область физики известна как термодинамика, которая занимается отношениями между теплом, работой, температурой и энергией в системах.
Законы термодинамики
Мы уже встречались с нулевым законом термодинамики, на котором основано определение температуры. Давайте теперь исследуем оставшиеся законы термодинамики.
Первый закон термодинамики
Q используется для представления изменения тепловой энергии в первом законе термодинамики, который гласит:
Изменение внутренней энергии (ΔU) системы состоит из тепловой энергии добавляется к системе (Q) плюс любой чистый прирост или потеря энергии в результате работы, выполненной системой или системой (W).
ΔU=Q-W
Это показывает, что энергия не может быть создана или уничтожена .
Второй закон термодинамики
Второй закон вводит свойство энтропии , представленное S .
Когда двум ранее изолированным системам дают возможность взаимодействовать, они в конечном итоге достигают состояния теплового равновесия. Общая энтропия (S) объединенной системы будет больше, чем сумма двух изолированных систем.
Общая энтропия (S) объединенной системы будет больше, чем сумма двух изолированных систем.
Единица переданного тепла (δQ) представляет собой произведение температуры систем (T) и изменения общей энтропии (∂s).
δQ=T·∂S
Третий закон термодинамики
Третий закон гласит, что, когда температура системы приближается к абсолютному нулю и удаляется вся тепловая энергия, система достигает постоянного основного состояния. Значение энтропии в этой точке известно как остаточная энтропия системы . Если в системе есть только один возможный микросостояние при абсолютном нуле, то остаточная энтропия также будет равна нулю. Постоянное значение остаточной энтропии системы при абсолютном нуле увеличивается с увеличением количества возможных микросостояний системы.
S=kB·lnΩ
Здесь S – остаточная энтропия системы, k B – постоянная Больцмана, Ω – число микросостояний.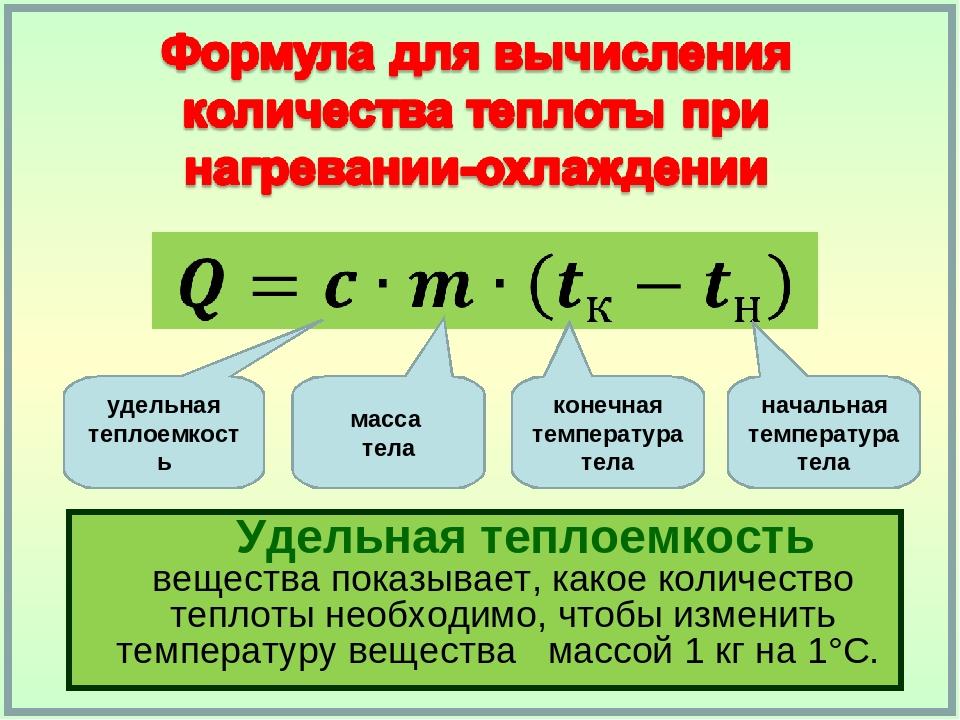
Чистый кристалл является примером материала, который будет иметь нулевую остаточную энтропию, поскольку существует только одна допустимая кристаллическая структура (микросостояние), которую могут принять его атомы.
Внутренняя энергия
Все вещества (твердые, жидкие или газообразные) обладают внутренней энергией (U) , которая представляет собой сумму кинетической энергии и потенциальной энергии составляющих его молекул. Уровни кинетической и потенциальной энергии каждой отдельной молекулы составляют 90 523 случайных 90 524 (в диапазоне энергий, содержащихся в системе), но мы можем понять эти свойства более крупного вещества, используя 90 523 средних энергий его молекул 9.0524 .
Кинетическая энергия молекул в веществе напрямую связана с его температурой , а их потенциальная энергия зависит от фазы вещества. Потенциальная энергия состоит из электростатической потенциальной энергии . Силы притяжения между молекулами «растягиваются» по мере того, как среднее расстояние между молекулами увеличивается при переходе из твердого состояния в жидкое или из жидкого в газообразное. Это увеличивает их электростатическую потенциальную энергию, точно так же, как увеличение расстояния между объектом и землей увеличивает его гравитационную потенциальную энергию.
Потенциальная энергия состоит из электростатической потенциальной энергии . Силы притяжения между молекулами «растягиваются» по мере того, как среднее расстояние между молекулами увеличивается при переходе из твердого состояния в жидкое или из жидкого в газообразное. Это увеличивает их электростатическую потенциальную энергию, точно так же, как увеличение расстояния между объектом и землей увеличивает его гравитационную потенциальную энергию.
Рисунок 2. На диаграмме показано, как компоненты кинетического и электростатического потенциала внутренней энергии вещества увеличиваются за счет фазовых переходов по мере того, как энергия передается в вещество с постоянной скоростью. Источник: Росс Макдональд, StudySmarter.
На диаграмме показано, как энергия передается веществу с постоянной скоростью . В течение фазовых переходов кинетическая энергия его молекул (температура) остается постоянной , а электростатическая потенциальная энергия увеличивается . Это связано с тем, что при фазовом переходе подводимая энергия передается на увеличение электростатического потенциала по мере плавления или испарения вещества и изменения сил между молекулами .
Это связано с тем, что при фазовом переходе подводимая энергия передается на увеличение электростатического потенциала по мере плавления или испарения вещества и изменения сил между молекулами .
Вне фазовых переходов электростатический потенциал остается относительно постоянным, а вся подводимая энергия преобразуется в молекулярную кинетическую энергию, повышая температуру вещества. Полная внутренняя энергия y представляет собой сумму этих двух составляющих s и увеличивается с той же скоростью, с какой энергия передается в вещество.
- В твердых телах электростатическая потенциальная энергия является большим отрицательным , так как для разрыва прочных связей между атомами или молекулами требуется значительная энергия.
- В жидкостях электростатические силы между молекулами меньше, поэтому потенциал меньше отрицательного , так как для их разрыва требуется меньше энергии.

- В газах электростатический потенциал близок к нулю , так как силы между молекулами очень слабые или незначительные.
Скрытая теплота
Вклад электростатической потенциальной энергии в общую внутреннюю энергию создает свойство, известное как удельная скрытая теплота вещества.
Удельная скрытая теплота л определяется как энергия , необходимая для изменения фазы вещества на единицу массы при постоянная температура .
L=EM
Здесь E — энергия, необходимая для фазового перехода, а M — масса вещества.
Удельная теплоемкость
Разным веществам требуется передача разного количества тепловой энергии для изменения их температуры на одинаковую величину. Вода является примером вещества с высокой удельной теплоемкостью (вспомните, сколько времени нужно, чтобы вскипятить воду для чашки чая). Это связано с тем, что чайник должен передать воде большое количество энергии, чтобы поднять ее температуру до 100°C. Пример 9.0523 низкая удельная теплоемкость – это железо, а значит и большинство сталей (вспомните, как быстро нагревается стальная ложка в только что заваренной кружке чая).
Это связано с тем, что чайник должен передать воде большое количество энергии, чтобы поднять ее температуру до 100°C. Пример 9.0523 низкая удельная теплоемкость – это железо, а значит и большинство сталей (вспомните, как быстро нагревается стальная ложка в только что заваренной кружке чая).
Удельная теплоемкость вещества рассчитывается как:
изменение энергии = масса · удельная теплоемкость · изменение температуры
∆E=mc∆θ
Здесь ΔE – изменение внутренней энергии, м – масса вещества, c – удельная теплоемкость, Δθ – изменение тепловой энергии. Удельная теплоемкость указана в Дж⋅кг -1 К -1 .
Сколько энергии требуется, чтобы вскипятить воду для чашки чая? Если использовать чайник мощностью 2000 Вт, сколько времени потребуется, чтобы закипеть?
Количество воды: 0,25 кг
Начальная температура: 21°C
Удельная теплоемкость воды: 4200 Дж⋅кг -1 K -1
Предположим, мы завариваем чай на высоте вблизи моря уровень, наша целевая температура кипения составляет 100°C. Следовательно, требуемое изменение температуры равно 79°С.
Следовательно, требуемое изменение температуры равно 79°С.
Чтобы определить изменение энергии, мы теперь умножаем:
∆E=0,25·79·4200=82950 Дж
Номинальная мощность прибора в ваттах показывает, сколько джоулей энергии он использует в секунду. Моделируя чайник со 100% эффективностью, мы можем разделить, чтобы найти время, необходимое для закипания:
t=829502000=41,48 с
Идеальные газы
Мы можем описать макроскопические свойства, такие как масса, температура или давление газов относительно легко. Однако, чтобы полностью понять, как ведут себя газы, нам также необходимо знать, что происходит на уровне отдельная частица . Количество атомов (или молекул) в объеме газа описывается с использованием единицы, называемой моль , единицы СИ для количества вещества , которая указывает количество атомов или молекул в данной пробе данного вещества. .
Один моль вещества – это количество, которое содержит столько элементарных частиц (атомов или молекул), сколько атомов содержится в 0,012 кг углерода-12. Это количество сущностей равно 6,02⋅10 23 , также известное как 9.0523 Постоянная Авогадро N A .
Это количество сущностей равно 6,02⋅10 23 , также известное как 9.0523 Постоянная Авогадро N A .
Постоянную Авогадро можно использовать для расчета числа атомов N в n молях вещества:
N=n·NA
Идеальный газ – это теоретическое вещество, молекулы которого занимают пренебрежимо мало места и не под влиянием электростатических силовых взаимодействий. Эти свойства означают, что он будет точно подчиняться законам идеального газа.
Тепловая физика. Ключевые выводы
- Нулевой закон термодинамики гласит, что если два объекта А и С независимо друг от друга находятся в тепловом равновесии с некоторым третьим объектом В, то А и С также находятся в равновесии друг с другом.
- Температурные шкалы определяются двумя фиксированными точками при определенных температурах с некоторым шагом между ними. Шкала абсолютных температур использует единицы кельвина (°K), которые равны градусам Цельсия (°C), где 0°K соответствует абсолютному нулю (-273,16°C).




 Насколько больше было бы Δ T , если бы скорость автомобиля изначально была вдвое больше? Вы можете предположить, что автомобиль останавливается достаточно быстро, чтобы тепло от тормозов не отводилось.
Насколько больше было бы Δ T , если бы скорость автомобиля изначально была вдвое больше? Вы можете предположить, что автомобиль останавливается достаточно быстро, чтобы тепло от тормозов не отводилось. Если женщина потирает руки взад-вперед, совершая в общей сложности 20 движений, на расстоянии 7,50 см за одно движение и со средней силой трения 40,0 Н, на сколько повысится температура? Масса согреваемых тканей составляет всего 0,100 кг, преимущественно в ладонях и пальцах.
Если женщина потирает руки взад-вперед, совершая в общей сложности 20 движений, на расстоянии 7,50 см за одно движение и со средней силой трения 40,0 Н, на сколько повысится температура? Масса согреваемых тканей составляет всего 0,100 кг, преимущественно в ладонях и пальцах.
 Однако позже рост температуры замедлится, поскольку стальная защитная оболочка массой 5 × 10 5 кг также начинают нагреваться.)
Однако позже рост температуры замедлится, поскольку стальная защитная оболочка массой 5 × 10 5 кг также начинают нагреваться.) ↵
↵ Они были выбраны потому, что они не зависят от атмосферного давления, в отличие от шкал Цельсия и Фаренгейта.
Они были выбраны потому, что они не зависят от атмосферного давления, в отличие от шкал Цельсия и Фаренгейта.
