Основные формулы для подготовки к ЕГЭ по химии
|
№ |
Количественные |
Обозначение |
Единицы |
Формула |
|
1 |
Относительная атомная |
Аr |
– |
Ar = ma / u см. в периодической система химических элементов (ПСХЭ) |
|
2 |
Атомная единица массы |
u а.е.м. |
кг |
u=1/12 * ma(12C) const=1.66*10-27 |
|
3 |
Масса тома (абсолютная) |
ma |
кг |
ma = Ar * u |
|
4 |
Относительная молекулярная (формульная) масса вещества |
Mr |
– |
Mr (AxBy)=m(AB) / u Mr(AxBy)=x*Ar(A) + y*Ar(B) |
|
5 |
Масса молекулы (формульной единицы) |
mM |
кг |
mM = Mr*u |
|
6 |
Количество вещества |
n |
моль |
n=m/M n=N/NA n=V/Vm |
|
7 |
Молярная масса (масса 1 моль вещества) |
M |
г/моль |
M=m/n M=Mr, M=Ar (для простых веществ) |
|
8 |
Масса вещества |
m |
г (кг) |
m=M*n m=ρ*V |
|
9 |
Число структурных единиц |
N |
атомов, молекул, ионов, частиц, формульных единиц (Ф. |
N=NA*n |
|
10 |
Молярный объем – число 1 моль ГАЗООБРАЗНОГО вещества в нормальных условиях (н.у.) |
Vm |
л/моль |
const=22,4 |
|
11 |
Объем газа при н.у. |
V |
|
V=Vm*n V=m/ρ |
|
12 |
Постоянная Авогадро |
NA |
частиц/моль |
const=6,02*1023 |
Вернуться в меню выбора предмета
все формулы для 8 класса
Автор fast12v0_vseproh На чтение 5 мин Просмотров 5 Опубликовано
Содержание
- Алгоритм решения задач по химии
- Молярная масса вещества
- Расчет по уравнениям химических реакций с использованием понятия количества вещества
Алгоритм решения задач по химии
- Ознакомьтесь с условиями задачи (если есть). Да, все знают — как решить проблему без условий — но в любом случае для полноты инструкции мы не могли не указать этот момент.
- Записывайте данные о деятельности. Мы не будем заострять внимание на этом моменте, так как требования разных учебных заведений, учителей и профессоров могут существенно различаться.
- Напишите уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть осторожным! Обязательно правильно ставить коэффициенты перед формулами веществ. Если вы забудете это сделать, все наши усилия окажутся напрасными.
- Выполните соответствующие расчеты в соответствии с химическим уравнением. Далее мы рассмотрим, как произвести эти самые вычисления.
Для этого у нас есть два пути, как решить проблему в химии. Условно назовем их правильными (используя понятие количества вещества) и неправильными (используя пропорции). Конечно, мы рекомендуем вам правильно решать проблемы. Поскольку у неправильного пути много противников. Как правило, учителя считают, что ученики, решающие задачи пропорциями, не понимают самой сути процессов химических реакций и решают задачи просто математически.
Условно назовем их правильными (используя понятие количества вещества) и неправильными (используя пропорции). Конечно, мы рекомендуем вам правильно решать проблемы. Поскольку у неправильного пути много противников. Как правило, учителя считают, что ученики, решающие задачи пропорциями, не понимают самой сути процессов химических реакций и решают задачи просто математически.
Молярная масса вещества
Молярная масса — это масса 1 моля вещества, выраженная в граммах. Молярная масса моля любого химического элемента может быть легко найдена из периодической таблицы, поскольку молярная масса численно равна атомной массе, но их размеры разные (молярная масса имеет размер г / моль). Запишите и запомните формулы для расчета молярной массы, количества вещества и количества молекул:
- Формула молярной массы M = m / n
- Количество вещества формулы n = m / M
- Формула числа молекул N = NA n
где m — масса вещества, n — количество вещества (число молей), M — молярная масса, N — количество молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут считать атомы и молекулы в лаборатории, просто взвесив их. Это позволяет удобно использовать концепцию крота.
Благодаря молярной массе вещества химики могут считать атомы и молекулы в лаборатории, просто взвесив их. Это позволяет удобно использовать концепцию крота.
На рисунке изображены четыре колбы с разными веществами, но каждая из них содержит только 1 моль вещества. Вы можете дважды проверить, используя приведенные выше формулы.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть этого метода в том, что вещества реагируют друг с другом в строгой взаимосвязи. И уравнение реакции, которое мы написали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам необходимые данные для расчетов.
Например, напишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_ {2} SO_ {4} + NaOH → Na_ {2} SO_ {4} + H_ {2} O
Зафиксируем коэффициенты:
H_ {2} SO_ {4} + 2NaOH → Na_ {2} SO_ {4} + 2H_ {2} O
Основываясь на этом уравнении, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Теперь мы сделаем небольшой шаг назад от анализа проблем, чтобы ознакомиться с основными концепциями, которые будут полезны для решения задач по химии.
Подсчитать количество молекул, например, в 98 граммах серной кислоты — не самое удобное занятие. Цифры получатся огромными (≈ 6,022140857⋅1023 молекул в 98 граммах серной кислоты). Для этого в химии были введены понятия количества вещества (моль) и молярной массы.
1 моль (единица измерения количества вещества) — это количество атомов, молекул или любой другой структурной единицы, содержащейся в 12 граммах изотопа углерода-12. Впоследствии было обнаружено, что 12 граммов вещества углерода-12 содержат 6,022140857⋅1023 атома. Следовательно, можно сказать, что 1 моль — это масса вещества, содержащего 6,022140857⋅1023 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют разный состав и структуру. Разные атомы содержат разное количество протонов и нейтронов.
В результате 1 моль для разных веществ будет иметь разную массу, несмотря на одинаковое количество молекул (атомов). Эта масса называется молярным.
Молярная масса — это масса 1 моля вещества.
Используя эти концепции, мы можем сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моля воды.
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам нужно второго вещества для полного протекания реакции и сколько конечных продуктов образуется.
Например, мы решаем несколько задач, используя одно и то же уравнение.
Проблема: сколько граммов гидроксида натрия (NaOH) необходимо, чтобы 49 граммов серной кислоты (h3SO4) полностью прореагировали?
Итак, наши действия: запишите уравнение химической реакции, расставьте коэффициенты. Для наглядности запишем эти задачи на уравнение реакции. Возьмем неизвестное значение для X.
Нет необходимости записывать данные по каждому веществу.
Примерно так должны выглядеть записанные данные в зависимости от состояния проблемы. Мы не претендуем на единственно правильный дизайн, требования у всех разные. Но, как нам кажется, все кажется достаточно ясным и информативным.
Наше первое действие — пересчитать массу известного вещества в молях. Для этого делим известную массу вещества (49 грамм) на молярную массу:
49 = 98 = 0,5 моль серной кислоты
Как упоминалось выше, согласно уравнению реакции 1 моль серной кислоты реагирует с 2 молями гидроксида натрия. В результате 1 моль гидроксида натрия будет реагировать с 0,5 моль серной кислоты.
n (NaOH) = 0,5 * 2 = 1 моль гидроксида натрия
Найдите массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г / моль = 40 граммов гидроксида натрия.
Ответ: 40 граммов NaOH
Как видите, в решении задачи с помощью уравнения реакции нет ничего сложного. Задача решается за 2-3 действия, с которыми придется столкнуться младшим школьникам. Вам просто нужно запомнить несколько концепций.
Задача решается за 2-3 действия, с которыми придется столкнуться младшим школьникам. Вам просто нужно запомнить несколько концепций.
7.4: Как писать сбалансированные химические уравнения
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47502
Цели обучения
- Объяснить роль индексов и коэффициентов в химических уравнениях.
- Сбалансируйте химическое уравнение, если дано несбалансированное уравнение.
- Объясните роль закона сохранения массы в химической реакции.
Несмотря на то, что химические соединения распадаются и образуются новые соединения во время химической реакции, атомы в реагентах не исчезают, и новые атомы не появляются в продуктах. В химических реакциях атомы никогда не образуются и не разрушаются. Те же самые атомы, которые присутствовали в реагентах, присутствуют и в продуктах — они просто реорганизованы в другое расположение. В полном химическом уравнении должны присутствовать две стороны уравнения: реагент и продукт.
В химических реакциях атомы никогда не образуются и не разрушаются. Те же самые атомы, которые присутствовали в реагентах, присутствуют и в продуктах — они просто реорганизованы в другое расположение. В полном химическом уравнении должны присутствовать две стороны уравнения: реагент и продукт.
Коэффициенты и индексы
В химических уравнениях используются два типа чисел. Имеются нижние индексы, входящие в состав химических формул реагентов и продуктов; и есть коэффициенты, которые ставятся перед формулами, чтобы указать, сколько молекул этого вещества используется или производится.
Рисунок \(\PageIndex{1}\): уравнения балансировки. Вы не можете изменить нижние индексы в химической формуле, чтобы сбалансировать химическое уравнение; можно изменить только коэффициенты. Изменение индексов меняет соотношение атомов в молекуле и результирующие химические свойства. Например, вода (H 2 O) и перекись водорода (H 2 O 2 ) являются химически различными веществами. H 2 O 2 разлагается до газа H 2 O и O 2 при контакте с металлической платиной, тогда как между водой и платиной такой реакции не происходит.
H 2 O 2 разлагается до газа H 2 O и O 2 при контакте с металлической платиной, тогда как между водой и платиной такой реакции не происходит.Нижние индексы являются частью формул, и после определения формул для реагентов и продуктов нижние индексы не могут быть изменены. Коэффициенты указывают количество каждого вещества, участвующего в реакции, и могут быть изменены, чтобы сбалансировать уравнение. Приведенное выше уравнение показывает, что один моль твердой меди реагирует с двумя молями водного раствора нитрата серебра с образованием одного моля водного раствора нитрата меди (II) и двух атомов твердого серебра.
Балансировка химического уравнения
Поскольку идентичность реагентов и продуктов фиксирована, уравнение нельзя сбалансировать, изменив индексы реагентов или продуктов. Это изменит химическую идентичность описываемых видов, как показано на рисунке \(\PageIndex{1}\).
Исходная молекула h3O: если перед ней добавить коэффициент 2, получится 2 молекулы воды; но если индекс 2 добавляется, чтобы получить h3O2, это перекись водорода.
Самый простой и наиболее полезный метод балансировки химических уравнений — это «проверка», более известная как метод проб и ошибок. Ниже приводится эффективный подход к балансировке химического уравнения с использованием этого метода.
Этапы балансировки химического уравнения
- Определите самое сложное вещество.
- Начиная с этого вещества, выберите элемент(ы), который(ые) присутствует только в одном реагенте и одном продукте, если возможно. Отрегулируйте коэффициенты, чтобы получить одинаковое количество атомов этого элемента (элементов) с обеих сторон.
- Сбалансированные многоатомные ионы (если они присутствуют в обеих частях химического уравнения) как единое целое.
- Сбалансируйте оставшиеся атомы, обычно заканчивая наименее сложным веществом и при необходимости используя дробные коэффициенты.
 Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.
Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов. - Подсчитайте количество атомов каждого вида в обеих частях уравнения, чтобы убедиться, что химическое уравнение сбалансировано.
Пример \(\PageIndex{1}\): Горение гептана
Сбалансируйте химическое уравнение горения гептана (\(\ce{C_7H_{16}}\)).
\[\ce{C_7H_{16} (ж) + O_2 (г) → CO_2 (г) + H_2O (г) } \номер \]
Раствор
| Этапы | Пример |
|---|---|
| 1. Определите самое сложное вещество. | Самым сложным веществом является вещество с наибольшим количеством различных атомов, то есть \(C_7H_{16}\). Предположим изначально, что итоговое сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества.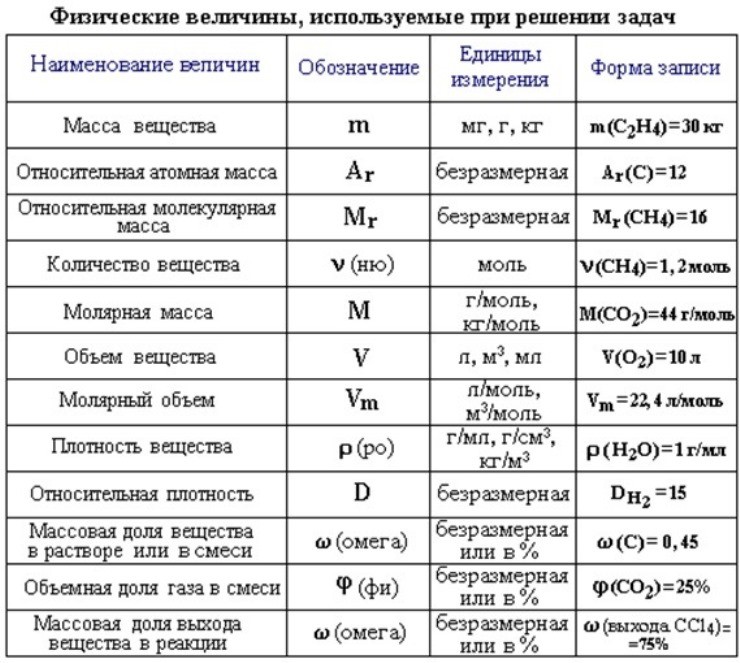 |
| 2. Настройте коэффициенты. | а. Так как одна молекула н-гептана содержит 7 атомов углерода, нам нужно 7 молекул CO 2 , каждая из которых содержит 1 атом углерода, справа: \[\ce{C7h26 (л) + O2 (г) → } \underline{7} \ce{CO2 (г) + h3O (г) } \номер \]
б. Поскольку одна молекула н-гептана содержит 16 атомов водорода, нам нужно 8 H 2 Молекулы O, каждая из которых содержит 2 атома водорода, справа: \[\ce{C7h26 (л) + O2 (г) → 7 CO2 (г) + } \underline{8} \ce{h3O (г) } \nonumber \]
|
3. Баланс многоатомных ионов как единое целое. | В этой реакции не учитываются многоатомные ионы. |
| 4. Сбалансируйте остальные атомы. | Атомы углерода и водорода теперь сбалансированы, но у нас 22 атома кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать атомы кислорода, регулируя коэффициент перед наименее сложным веществом, O 2 , на стороне реагента: \[\ce{C7h26 (л) + }\underline{11} \ce{ O2 (г) → 7 CO2 (г) + 8h3O (г) } \nonumber \]
|
| 5. Проверьте свою работу. | Теперь уравнение уравновешено, дробные коэффициенты отсутствуют: с каждой стороны 7 атомов углерода, 16 атомов водорода и 22 атома кислорода.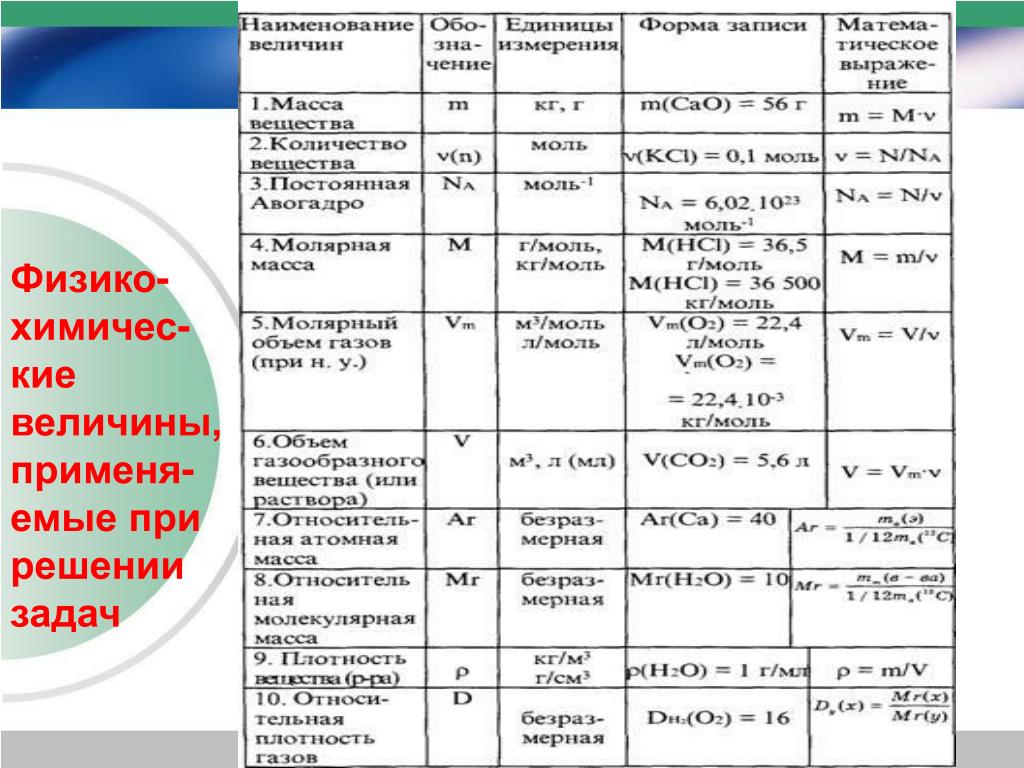 Всегда проверяйте, чтобы убедиться, что химическое уравнение сбалансировано. Всегда проверяйте, чтобы убедиться, что химическое уравнение сбалансировано. |
Пример \(\PageIndex{2}\): сжигание изооктана
Горение изооктана (\(\ce{C_8H_{18}}\))
\[\ce{C8h28(ж) + O2(г) -> CO_2(г) + H_2O(г)} \номер \]
Решение
Предположение, что окончательное сбалансированное химическое уравнение содержит только одну молекулу или формульную единицу самого сложного вещества, не всегда верно, но с него можно начать. При сгорании любого углеводорода с кислородом образуется углекислый газ и вода.
| Шаги | Пример |
|---|---|
| 1. Определите самое сложное вещество. | Самое сложное вещество — это вещество с наибольшим числом различных атомов, то есть \(\ce{C8h28}\). Предположим изначально, что итоговое сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. Предположим изначально, что итоговое сбалансированное химическое уравнение содержит 1 молекулу или формульную единицу этого вещества. |
| 2. Настройте коэффициенты. | а. Первым элементом, который появляется в реагентах только один раз, является углерод: 8 атомов углерода в изооктане означает, что в продуктах должно быть 8 молекул CO 2 : \[\ce{C8h28 (л) + O2 (г) -> }\underline{8} \ce{ CO2 (г) + h3O(г)}\номер \]
б. 18 атомов водорода в изооктане означает, что их должно быть 9.H 2 Молекулы O в продуктах: \[\ce{C8h28 (л) + O2 (г) -> 8CO2 (г) + }\underline{9} \ce{ h3O(г)} \номер \]
|
3. Баланс многоатомных ионов как единое целое. Баланс многоатомных ионов как единое целое. | В этой реакции не учитываются многоатомные ионы. |
| 4. Сбалансируйте оставшиеся атомы. | Атомы углерода и водорода теперь уравновешены, но у нас 25 атомов кислорода справа и только 2 атома кислорода слева. Мы можем сбалансировать наименее сложное вещество, O 2 , но поскольку на молекулу O 2 приходится 2 атома кислорода, мы должны использовать дробный коэффициент (\(\dfrac{25}{2}\)) для балансировки атомов кислорода: \[\ce{C8h28 (ж) + } \underline{ \dfrac{25}{2} } \ce{O2 (г)→ 8CO2 (г) + 9h3O(г) }\номер\]
Теперь уравнение сбалансировано, но мы обычно пишем уравнения с целыми коэффициентами. \[ \underline{2} \ce{C8h28(л) + } \underline{25} \ce{O2(г) ->} \underline{16} \ce{CO2(г) + } \underline{18 } \ce{h3O(g)} \nonumber \] |
| 5. Проверьте свою работу. | Сбалансированное химическое уравнение содержит 16 атомов углерода, 36 атомов водорода и 50 атомов кислорода с каждой стороны. Уравнения баланса требуют от вас некоторой практики, а также некоторого здравого смысла. Если вы обнаружите, что используете очень большие коэффициенты или если вы безуспешно потратили несколько минут, вернитесь и убедитесь, что вы правильно написали формулы реагентов и продуктов. |
Пример \(\PageIndex{3}\): Осаждение хлорида свинца (II)
Водные растворы нитрата свинца (II) и хлорида натрия смешивают. Продуктами реакции являются водный раствор нитрата натрия и твердый осадок хлорида свинца (II). Напишите сбалансированное химическое уравнение этой реакции.
Продуктами реакции являются водный раствор нитрата натрия и твердый осадок хлорида свинца (II). Напишите сбалансированное химическое уравнение этой реакции.
Решение
| Ступени | Пример |
|---|---|
| 1. Определите самое сложное вещество. | Наиболее сложным веществом является хлорид свинца (II). \[\ce{Pb(NO3)2(водн.) + NaCl(водн.) → NaNO3(водн.) + PbCl2(s)} \номер \] |
| 2. Настройте коэффициенты. | В реагентах содержится в два раза больше ионов хлора, чем в продуктах. Поместите 2 перед NaCl, чтобы сбалансировать ионы хлорида. \[\ce{Pb(NO3)2(водн.) + }\underline{ 2} \ce{NaCl(водн.) → NaNO3(водн.) + PbCl2(s)} \номер \]
|
| 3. Баланс многоатомных ионов как единое целое. | Нитрат-ионы все еще не сбалансированы. Поместите 2 перед NaNO 3 . Результат: \[\ce{Pb(NO3)2(водн.) + 2NaCl(водн.) → } \underline {2} \ce{NaNO3(водн.) + PbCl2(s)} \номер \]
|
4. Сбалансируйте оставшиеся атомы. Сбалансируйте оставшиеся атомы. | Нет необходимости уравновешивать оставшиеся атомы, потому что они уже уравновешены. |
| 5. Проверьте свою работу. | \[\ce{Pb(NO3)2(водн.) + 2NaCl(водн.) → 2NaNO3(водн.) + PbCl2(s)} \номер \]
|
Упражнение \(\PageIndex{1}\)
Сбалансировано ли каждое химическое уравнение?
- \(\ce{2Hg(ℓ)+ O_2(g) \rightarrow Hg_2O_2(s)}\)
- \(\ce{C_2H_4(г) + 2O_2(г)→ 2CO_2(г) + 2H_2O(г)}\)
- \(\ce{Mg(NO_3)_2(s) + 2Li(s) \rightarrow Mg(s)+ 2LiNO_3(s)}\)
- Ответить на
- да
- Ответ б
- нет
- Ответ c
- да
Упражнение \(\PageIndex{2}\)
Уравняйте следующие химические уравнения.
- \(\ce{N2 (г) + O2 (г) → NO2 (г) }\)
- \(\ce{Pb(NO3)2(водн.) + FeCl3(водн.) → Fe(NO3)3(водн.) + PbCl2(тв.)}\)
- \(\ce{C6h24(ж) + O2(г)→ CO2(г) + h3O(г)}\)
- Ответить на
- N 2 (ж) + 2O 2 (ж) → 2NO 2 (ж)
- Ответ б
- 3Pb(NO 3 ) 2 (водн.) + 2FeCl 3 (водн.) → 2Fe(NO 3 ) 3 (водн.) + 3PbCl 1 8 900
- Ответ c
- 2C 6 H 14 (л) + 19O 2 (г)→ 12CO 2 (г) + 14H 2 O(г)
Резюме
- Чтобы химические уравнения были полезными, они всегда должны быть сбалансированы. Сбалансированные химические уравнения имеют одинаковое количество и тип каждого атома в обеих частях уравнения.
- Коэффициенты в сбалансированном уравнении должны представлять собой простейшее отношение целых чисел.
 Масса всегда сохраняется в химических реакциях.
Масса всегда сохраняется в химических реакциях.
Словарь
- Химическая реакция – Процесс, при котором одно или несколько веществ превращаются в одно или несколько новых веществ.
- Реагенты – Исходные материалы в реакции.
- Продукты – Материалы, присутствующие в конце реакции.
- Сбалансированное химическое уравнение – Химическое уравнение, в котором количество атомов каждого типа одинаково в двух частях уравнения.
- Нижний индекс – Часть химических формул реагентов и продуктов, указывающая число атомов предшествующего элемента.
- Коэффициент – Небольшое целое число, которое появляется перед формулой в сбалансированном химическом уравнении.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- автор @ Генри Агнью
- автор@Мариса Альвиар-Агнью
- Уравновешивание химического уравнения
- Коэффициенты и индексы
- источник@https://www.ck12.org/c/chemistry/
4.2) Химическая формула ионных соединений
Задание 1) Вспомнить разницу между атомом, молекулой, элементом и соединением – не делать 2019
Исследования определения атома, молекулы, элемента и соединения. Объясните в группе различия между этими определениями и/или научите Рабочий лист . Используйте эти знания для заполнения рабочего листа « Атомы, молекулы, элементы и соединения» |
Задание 2) Вспомнить, как атомы превращаются в положительные или отрицательные ионы
Давайте вспомним, как нейтральные атомы превращаются в положительные или отрицательные ионы, посмотрев видео на YouTube под названием «Формирование ионов». |
Задание 3) Вспомнить, как пользоваться периодической таблицей для определения валентности ионов
Столбец 1 = все эти элементы имеют один электрон на внешней оболочке и, следовательно, имеют валентность +1
Столбец 2 = все эти элементы имеют два электрона на внешней оболочке и, следовательно, имеют валентность +2
Столбцы 3–12 = Большинство переходных металлов обычно имеют валентность +2, но есть исключения, такие как серебро, Ag +1 и Fe могут иметь +2 или +39.0666 Столбец 13 = Все эти элементы имеют три электрона на внешней оболочке и, следовательно, имеют валентность +30666 Столбец 18 = Благородные газы, которые имеют 8 электронов на внешней оболочке и, следовательно, полны, поэтому нереактивны
Задача 4) Вспомнить многоатомные ионы
Задание 5) Вспомнить, как определить химическую формулу ионных соединений
Ионные соединения образуются, когда положительные и отрицательные ионы химически связаны друг с другом.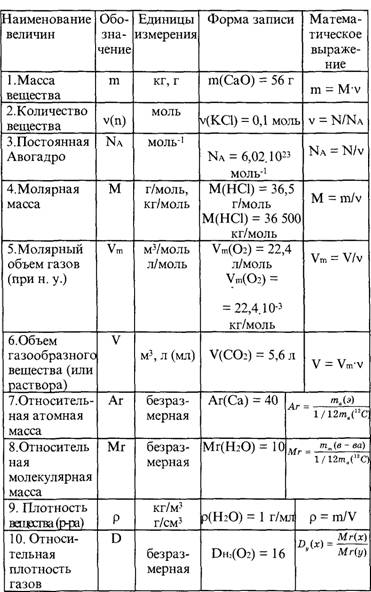 Обычно это происходит между ионами металлов и ионами неметаллов. Примером может служить соль, хлорид натрия или NaCl. В основном мы будем рассматривать ионные соединения, которые образуются при соединении положительных и отрицательных ионов.
Обычно это происходит между ионами металлов и ионами неметаллов. Примером может служить соль, хлорид натрия или NaCl. В основном мы будем рассматривать ионные соединения, которые образуются при соединении положительных и отрицательных ионов.
Заполните * Прочитайте раздел 5.6) Ионные соединения * Заполните вопросы из заданий Q8, 9, 10 и 11 * Заполните рабочий лист 4.2) Называние и написание химических формул. Если у вас возникли трудности, посмотрите видео ниже *Заполните рабочий лист 2) Химические формулы |
Интересная информация – Ионы в действии
Великолепное южное полярное сияние, которое выглядит как удивительные световые завесы в небе, создано ионами, поступающими от Солнца и захваченными магнитным полем Земли. |
Дополнительная деятельность) Узнать о ковалентных соединениях
Ковалентные соединения обычно образуются, когда атомы неметаллов ОБМЕНЯЮТ электроны. Примером является газообразный озон, показанный на рисунке 9.0666 * Читать раздел 5.6) Ковалентные соединения * Нарисуйте электронные точки диаграммы а) Вода |
| Дополнительные ресурсы и ответы 1. 2. Задание 1.1) Написание формул в научной среде 4 3. Просмотрите видео о химических связях и затем ответьте на вопросы в документах Примечания по ионным связям и Примечания по ковалентным связям. 4. Ответы на рабочий лист 4.2) Называние и написание химических формул 5. Ответы на рабочий лист 2) Химические формулы |
2) Информация о физических и химических изменениях. |

 Е.)
Е.) В результате 1 моль для разных веществ будет иметь разную массу, несмотря на одинаковое количество молекул (атомов). Эта масса называется молярным.
В результате 1 моль для разных веществ будет иметь разную массу, несмотря на одинаковое количество молекул (атомов). Эта масса называется молярным. Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов.
Если использовался дробный коэффициент, умножьте обе части уравнения на знаменатель, чтобы получить целые числа для коэффициентов. Мы можем исключить дробный коэффициент, умножив все коэффициенты в обеих частях химического уравнения на 2 :
Мы можем исключить дробный коэффициент, умножив все коэффициенты в обеих частях химического уравнения на 2 :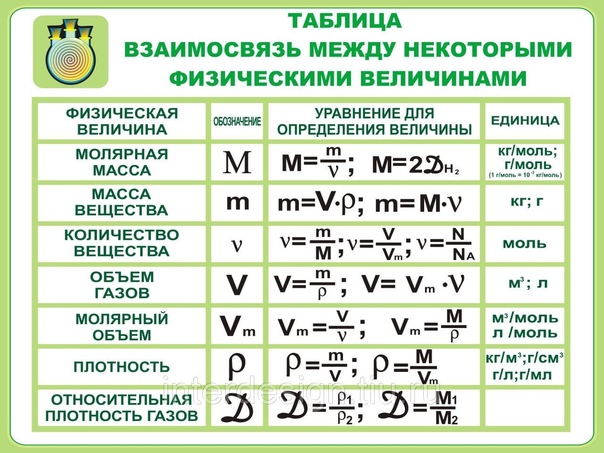
 Масса всегда сохраняется в химических реакциях.
Масса всегда сохраняется в химических реакциях.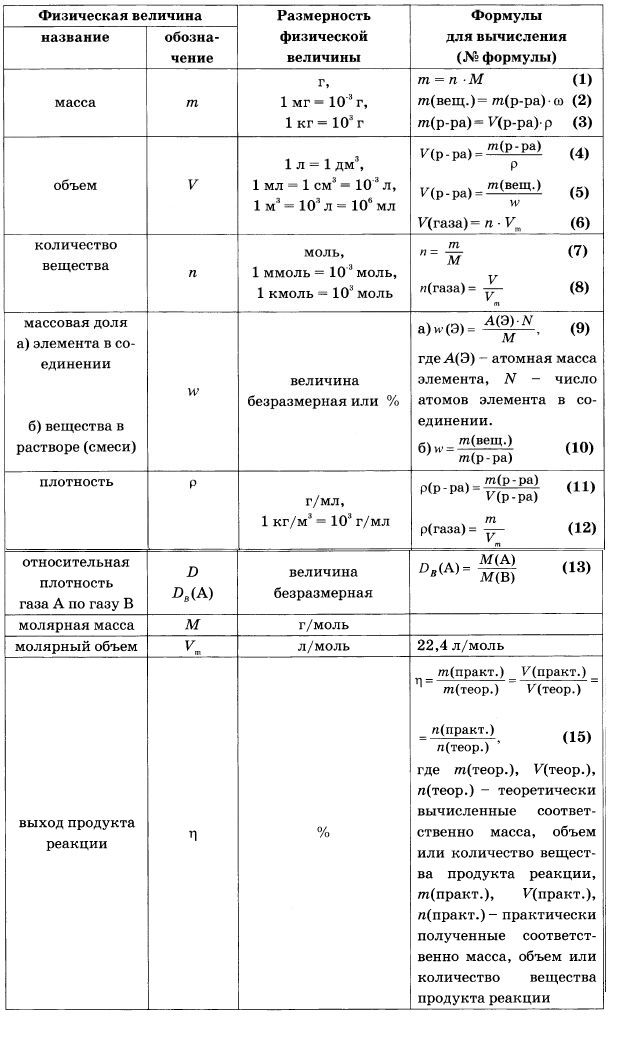

 Подробнее об этом прекрасном природном явлении читайте в статье Australian Geographic «Aurora Australis» 9.0034
Подробнее об этом прекрасном природном явлении читайте в статье Australian Geographic «Aurora Australis» 9.0034 Мероприятие 3.1) Ионные соединения в науке. Фокус 3. Домашнее задание. Чтобы узнать о химических формулах и названиях ионных соединений
Мероприятие 3.1) Ионные соединения в науке. Фокус 3. Домашнее задание. Чтобы узнать о химических формулах и названиях ионных соединений