Алгоритм решения задач на вывод формулы органических веществ. | Учебно-методическое пособие по химии (10 класс):
Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
- Образовательные:
- закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
- научить школьников решать задачи на нахождение молекулярной формулы органического вещества;
- сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
- Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
- Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для учащихся 10 класса, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, Ch4 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4h22 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая Dh3 = 15.
Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4h22 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая Dh3 = 15.
Тогда M(CxHy) = 15 M(h3) = 15•2 г/моль = 30 г/моль.
Поскольку M(Ch4) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов Сnh3n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:
(C) = (CO2) = 2 моль.
5. Найти количество вещества воды:
(h3O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
(H) = 2(h3O),
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) : (Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4h20.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.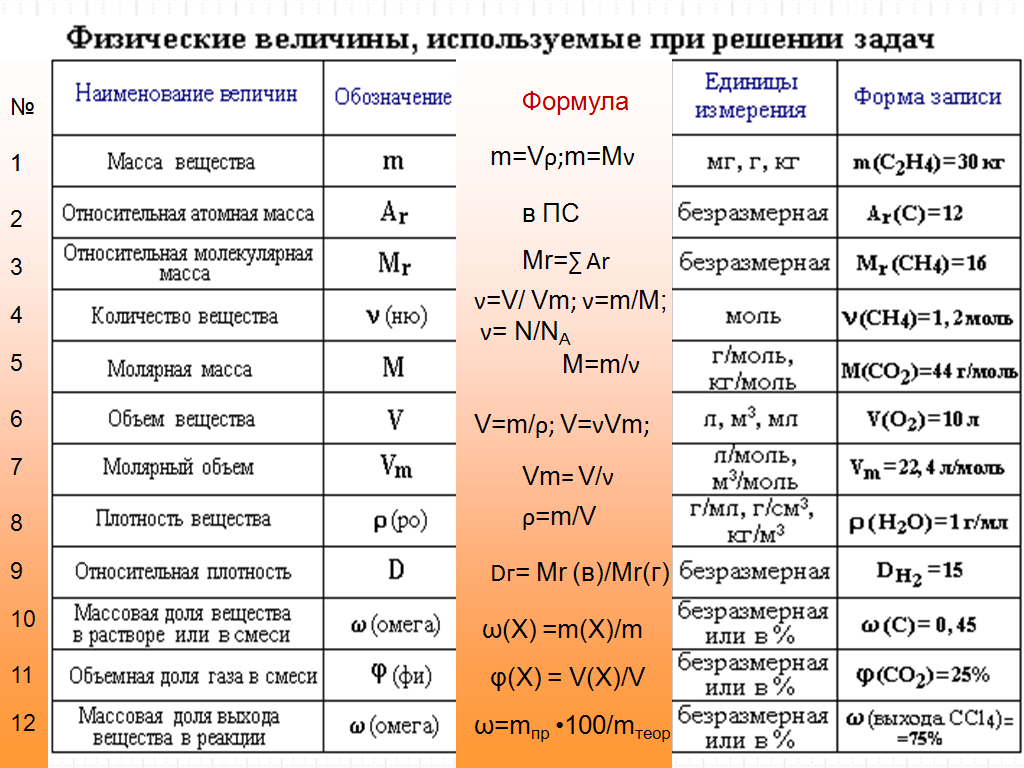 у. равна 1,875 г. Найти его молекулярную формулу.
у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(h3O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) : (H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(Ch3) = 14,
Mr(в-ва) : Mr(Ch3) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
- Общая формула алканов Cnh3n+2, общая формула монохлоралканов Cnh3n+1Cl
- Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(Cnh3n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
- Общая формула монобромлканов Cnh3n+1Br.
 Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
Молярная масса монобромлкана М= 12n+2n+1+80=14n+81 - Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
- Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
- Уравнения реакций:
Cnh3n + Н Сl = Cnh3n+1Cl
Cnh3n + Н Br = Cnh3n+1Br
- Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(Cnh3n+1Cl) = n(Cnh3n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
- Находим количество вещества алкена:
n(Cnh3n) = 1,012/22,4 = 0,045 моль
- По уравнению реакции
Cnh3n +Сl2 = Cnh3nCl2
n(Cnh3nCl2)= n(Cnh3n) =0,045 моль
- М(Cnh3nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. | Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. | Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. | Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. | Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода | Задача 10. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Вывод формул соединений
Вывод формул соединений
Этот вид расчетов чрезвычайно важен для химической практики, так как позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), то есть его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Целые числа (1 и 3) получены делением числа 0,2 на число 0,0666. Число 0,0666 примем за 1. Число 0,2 в 3 раза больше, чем число 0,0666. Таким образом, CH3
Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D.
Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2

Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Определение формулы вещества зависит от точности математических вычислений. При нахождении значения ν элемента следует учитывать хотя бы два знака после запятой и аккуратно производить округление чисел. Например, 0,8878 ≈ 0,89 но не 1.
Соотношение атомов в молекуле не всегда определяется простым делением полученных чисел на меньшее число. Рассмотрим этот случай на следующем примере.
Задача 1. Установите формулу вещества, которое состоит из углерода (ω=25%) и алюминия (ω=75%).
Разделим 2,08 на 2. Полученное число 1,04 не укладывается целое число раз в числе 2,78 (2,78 : 1,04 = 2,67 : 1).
Теперь разделим 2,08 на 3. При этом получается число 0,69, которое укладывается ровно 4 раза в числе 2,78 и 3 раза в числе 2,08.
Следовательно, индексы x и y в формуле вещества AlxCy равны 4 и 3, соответственно.
Ответ: Al4C
Более сложным вариантом задач на вывод формул соединений является случай, когда состав вещества задается через продукты сгорания этих соединений.
Задача 2. При сжигании углеводорода массой 8,316 г образовалось 26,4 г CO2. Плотность вещества при нормальных условиях равна 1,875 г/мл. Найдите его молекулярную формулу.
2.7: Решение задач, связанных с уравнениями
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 274877
Многие задачи по химии связаны с манипулированием уравнениями и требуют использования нескольких шагов преобразования. Такие задачи легко решить как числовые задачи, если вы понимаете, как к ним подходить. Четыре простых шага в решении проблем: ПРОЧИТАЙТЕ-ПЛАНИРУЙТЕ-РЕШИТЕ-ПРОВЕРЬТЕ.
Такие задачи легко решить как числовые задачи, если вы понимаете, как к ним подходить. Четыре простых шага в решении проблем: ПРОЧИТАЙТЕ-ПЛАНИРУЙТЕ-РЕШИТЕ-ПРОВЕРЬТЕ.
Этапы решения задач по химии
- ПРОЧИТАЙТЕ вопрос: Прежде чем приступить к вычислениям и манипуляциям с уравнениями, прочтите всю задачу полностью, чтобы убедиться, что вы понимаете, о чем вас спрашивают.
- ПЛАН ваш подход:
- Запишите всю полученную информацию. Нередки случаи, когда задачи дают больше фактов, чем требуется для решения — в этом есть доля реальности в задаче.
- Определите уравнения, которые необходимо использовать для решения задачи. Часто для получения желаемого ответа требуется манипулировать одним или несколькими уравнениями.
- РЕШИТЬ проблему
- Перед вычислением результатов подтвердите правильные единицы , необходимые для уравнений.
 Часто вам может потребоваться выполнить одно или несколько преобразований единиц измерения перед непосредственным использованием уравнений.
Часто вам может потребоваться выполнить одно или несколько преобразований единиц измерения перед непосредственным использованием уравнений. - Вставьте соответствующие параметры в уравнение(я) и получите ответ. Не забывайте, что в большинстве ответов будут фигурировать единицы.
- Перед вычислением результатов подтвердите правильные единицы , необходимые для уравнений.
- ПРОВЕРЬТЕ ваш ответ: Подтвердите, что вы ответили на все, что требуется в задаче, и что ответ кажется разумным. Например, если вы вычисляете объем пробы и ваши расчетные результаты выражены в кубических километрах, вы, вероятно, допустили ошибку при преобразовании или расчете (если только вы не работаете в классе астрономии).
Пример \(\PageIndex{1}\)
| Пример \(\PageIndex{1}\) | Пример \(\PageIndex{2}\) | |
|---|---|---|
| Действия по устранению неполадок | Средний объем крови у взрослого мужчины составляет 4,7 л. Каков этот объем в миллилитрах? Каков этот объем в миллилитрах? | Колибри может взмахнуть крыльями один раз за 18 мс. Сколько секунд в 18 мс? |
| Определите «данную» информацию и то, что проблема просит вас «найти». 9{-3}\; \rm{s}}{1 \; \отменить{\rm{мс}}} = 0,018\; \rm{s}\) или \( 18 \; \cancel{\rm{ms}} \times \dfrac{1\; \rm{s}}{1000 \; \cancel{\rm{ms}}} = 0,018\; \rm{ с}\) | ||
| Подумайте о своем результате. | Количество в мл должно быть в 1000 раз больше указанного количества в л. | Сумма в s должна быть 1/1000 заданной суммы в мс. |
Эта страница была создана на основе контента следующих авторов и отредактирована (тематически или подробно) командой разработчиков LibreTexts для соответствия стилю, представлению и качеству платформы:
Мариса Альвиар-Агнью (Городской колледж Сакраменто)
Генри Эгнью (Калифорнийский университет в Дэвисе)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Включено
- да
- Теги
- источник[1]-хим-25449
Распространенные формулы, используемые в химии – Высшая школа – Блог онлайн-репетиторов для школьников и студентов
Химия — это научное исследование свойств и поведения материи. Среди основных предметов науки химия занимает промежуточное положение между физикой и биологией. Учащиеся до старшей школы знакомятся с общими науками, и в зависимости от школьной программы и интересов ученика специализацию, такую как химия, могут выбрать учащиеся 10-го (второкурсник), 11-го (младший год) или 12-й класс (старший год). Учебная программа по химии в старших классах познакомит учащихся с некоторыми основными темами химии, такими как:
- Стехиометрия
- Термодинамика
- Химические реакции
- Химическое соединение
- Закон о газе
- Кинетика
- Решения
- Кислоты и основания
- Расчет количества молей
- Измерения
Для старшеклассников недостаточно изучения химических формул из школьных учебников по химии. Нужно активно практиковать химические формулы, изученные в классе, в лаборатории, чтобы проводить практические эксперименты и лучше понимать, как работает химия. Учащиеся, интересующиеся химией в старшей школе, также могут подать заявление в колледж на получение степени бакалавра по химии.
Нужно активно практиковать химические формулы, изученные в классе, в лаборатории, чтобы проводить практические эксперименты и лучше понимать, как работает химия. Учащиеся, интересующиеся химией в старшей школе, также могут подать заявление в колледж на получение степени бакалавра по химии.
В этом блоге кратко рассматриваются некоторые ключи и формулы, полезные в школьной химии, а также использование формул для решения некоторых примеров вопросов по химии и уравнений. Вы узнаете:
- Ключи
- Формулы
- Задачи по химии с решениями
Ключи: –
| Переменные | Значение |
| с | Удельная теплоемкость |
| Д | Плотность |
| 𝚺 | «Сумма» |
| ΔG | Изменения свободной энергии Гиббса |
| ΔН | Изменения энтальпии |
| и | Ионы в растворе |
| М | Молярность |
| м | Масса |
| м | Моляльность |
| нет | Кроты |
| П | Давление |
| q | Тепло |
| С | Растворимость |
| ΔS | Изменение энтропии |
| Т | Температура |
| В | Том |
Формула по химии для средней школы
- Измерение: –
- Расчет количества молей:-
- Стехиометрия: –
- Газовые законы: –
- Термодинамика и кинетика: –
- Решения: –
- Кислоты и основания: –
Ответ :- Океан не синий только потому, что он отражает небо. Океан в основном
Океан в основном
голубой, потому что сама вода голубая. На самом деле вода поглощает красный свет из-за колебательных переходов молекул, оставляя синий свет отражаться обратно. По той же причине большие объемы снега и льда также имеют голубой оттенок.
Примечание:- Если поверхность океана спокойна и вы смотрите на нее под низким углом обзора, то часть голубого цвета на поверхности воды является отражением неба. Но отражение неба не полностью объясняет голубизну воды.
(2) Как называется это соединение?
Ответ: – Данное соединение представляет собой «Винилхлорид».
(3) Какова молекулярная формула и структура пентановой кислоты?
Answer :- Molecular formula of pentanoic acid is: C 5 H 10 O 2
Structure of pentanoic кислота:


 Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
Молярная масса монобромлкана М= 12n+2n+1+80=14n+81 Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
 При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана.
При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. Часто вам может потребоваться выполнить одно или несколько преобразований единиц измерения перед непосредственным использованием уравнений.
Часто вам может потребоваться выполнить одно или несколько преобразований единиц измерения перед непосредственным использованием уравнений.