Нулевая группа » Детская энциклопедия (первое издание)
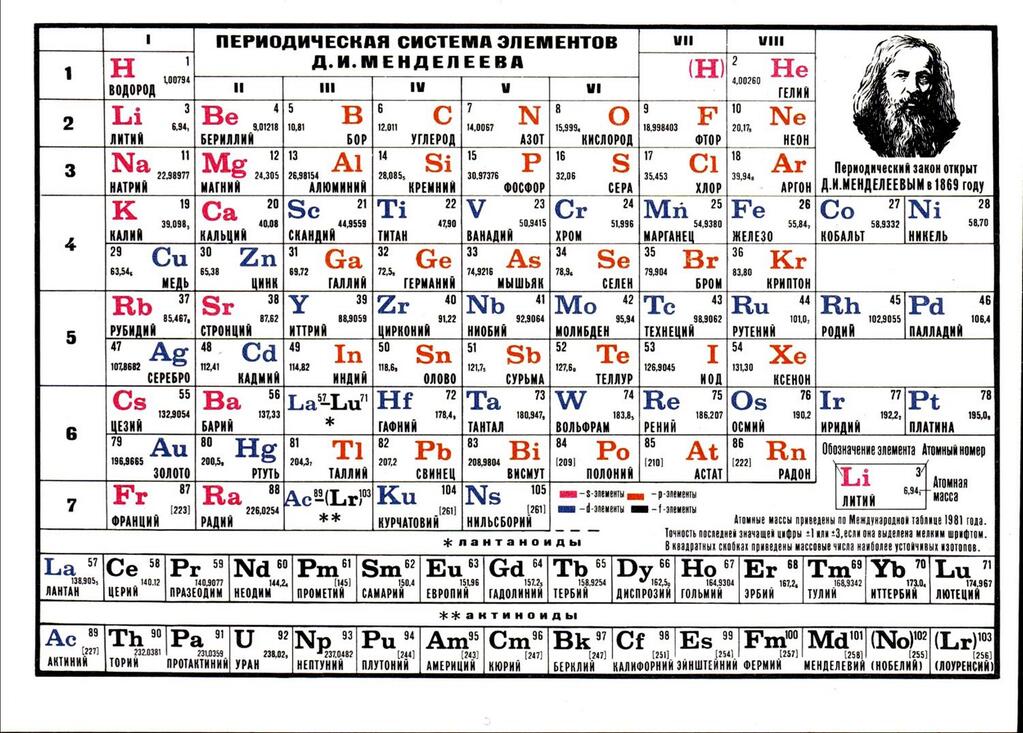
Воздух имеет сложный состав В поисках новых элементовЕсли первые научные шаги в познании недр окружающего нас воздуха связаны с именем Михаила Васильевича Ломоносова, то следующие, решающие, этапы в этом познании связаны с именем другого величайшего гения нашей родины — с Дмитрием Ивановичем Менделеевым, с его периодической системой химических элементов.
Когда Д. И. Менделеев создавал свою таблицу, никто из химиков, в том числе и автор таблицы, не предполагал, что воздух может содержать еще какие-либо элементы, кроме уже открытых азота и кислорода. Думали, что их даже никто не пытается искать. Но это было не так. Их искал и теоретически нашел запертый в одиночной камере Шлиссельбургской крепости царский узник, ученый и революционер Николай Александрович Морозов еще в 1884 году. На основании глубокого анализа периодического закона Менделеева он пришел к мысли, что среди элементов окружающего нас мира должно существовать семейство химически инертных элементов, которые еще не открыты.
В 1894 году было опубликовано сообщение английского физика Релея об исследовании плотности азота. Было замечено, что плотность азота, полученного из какого-либо его химического соединения, например аммиака, меньше, чем плотность азота, полученного из воздуха. Литр азота, полученного из воздуха, весил 1,2572 грамма, а литр того же азота, но полученного из аммиака, весил 1,2560 грамма, то есть почти на. одну тысячную грамма меньше. Эта небольшая сама по себе величина, своевременно замеченная и точно измеренная, привела, как мы увидим далее, к замечательным открытиям. В первое время и физики и химики пришли в смущение.
Единственно разумным выходом из создавшегося положения было предположение английского химика Рамзая о том, что воздух, очевидно, содержит какую-то небольшую газообразную примесь, более тяжелую, чем азот. Эта примесь и искажает плотность азота, получаемого из воздуха. В ходе этих научных споров английские ученые вспомнили об одном интересном, но полузабытом сообщении, опубликованном еще в 1786 году их соотечественником Кавендишем. В этом сообщении описывался следующий опыт. Была взята стеклянная трубка, изогнутая дугой, и ее концы опущены в стаканы с ртутью. В трубке находился воздух. Через этот воздух исследователь начал пропускать электрические разряды, под влиянием которых азот и кислород воздуха начали химически реагировать друг с другом, образуя химические соединения — окислы азота — газ, обладающий удушливыми свойствами.
Исследователь удалял этот газ из трубки, поглощая его раствором щелочи. Время от времени он прибавлял в оставшийся в трубке азот еще некоторое количество кислорода, чтобы химически связать весь азот в трубке и удалить его в виде окислов азота. В ходе химической реакции количество газа в трубке уменьшалось и освободившееся пространство занимала ртуть. Наконец, в трубке остался лишь небольшой пузырек воздуха. Ученый решил, что опыт не доведен до конца. Он прибавил еще кислорода и продолжал еще в течение двух недель пропускать электрический ток через оставшийся воздух. Но больше он удушливого газа не получил — пузырек воздуха так и не исчез.
Ученый вычислил, что оставшийся воздух составляет 1/120 часть первоначального объема азота в трубке и записал: «Из этого опыта я заключаю, что азот воздуха неоднороден: 1/120 часть его ведет себя по-другому, чем большая, основная часть. Стало быть, азот — это не одно вещество, а смесь двух различных веществ». Яснее не скажешь. Так более чем за 100 лет до опытов 1893 года была разгадана загадка азота.
Эта плотность оказалась в 20 раз больше плотности водорода, в то время как плотность азота в 14 раз больше плотности водорода Спектроскопическое исследование показало, что исследователь имеет дело с новым элементом, о чем он и заявил 13 августа 1894 года.
Этот элемент, заявил он, находится в воздухе и составляет в нем почти один процент. Сообщение вызвало среди ученых того времени недоверие и изумление. Казалось удивительным, что в воздухе, в котором удалось обнаружить примесь в 0,03 процента углекислого газа, даже найти тысячную долю процента водорода, не удавалось до сих пор найти почти целый процент нового газа. Это было действительно странно и требовало объяснения. Кроме того, оставалось совершенно не ясным, где найдет себе место новый элемент в таблице Менделеева. К сожалению, ученые не знали об исследованиях шлиссельбуржца Морозова и его выводах. Рамзай занялся изучением свойств нового элемента, чтобы пролить свет на все эти недоуменные вопросы.
Это было действительно странно и требовало объяснения. Кроме того, оставалось совершенно не ясным, где найдет себе место новый элемент в таблице Менделеева. К сожалению, ученые не знали об исследованиях шлиссельбуржца Морозова и его выводах. Рамзай занялся изучением свойств нового элемента, чтобы пролить свет на все эти недоуменные вопросы.
Оказалось, что новый элемент не вступает в химическое соединение ни с какими другими элементами и химическими соединениями ни при каких известных тогда условиях. На него не действуют ни кислоты, ни щелочи, ни раскаленные металлы, ни даже такие химически деятельные газы, как хлор и фтор, ни раскаленный фосфор и углерод. Он был химически пассивен, не имел ни вкуса, ни запаха, и в силу этих свойств ему было дано название аргон, что означает по-гречески «недеятельный».
Во время своих продолжительных опытов по выяснению природы аргона Рамзай получил от одного знакомого геолога письмо следующего содержания: «Не знаю, пытались ли вы соединить аргон с металлом ураном. Если не пытались, то, мне кажется, стоило бы испробовать это сделать. Несколько лет назад американский геолог Гиллебранд заметил, что из уранового минерала клевеита, если его нагревать в серной кислоте, выделяется очень много газа. Гиллебранд утверждает, что этот газ — азот. Но, может быть, там есть и аргон?» Это, действительно, имело смысл проверить.
Если не пытались, то, мне кажется, стоило бы испробовать это сделать. Несколько лет назад американский геолог Гиллебранд заметил, что из уранового минерала клевеита, если его нагревать в серной кислоте, выделяется очень много газа. Гиллебранд утверждает, что этот газ — азот. Но, может быть, там есть и аргон?» Это, действительно, имело смысл проверить.
Рамзай достал минерал клевеит и добыл из него описанным способом газ, но азота, который там нашел Гиллебранд, он не обнаружил.
Изучая спектроскопически полученный газ, он заметил в нем присутствие нового, неизвестного до сих пор на Земле элемента. Это открытие было настолько неожиданным и невероятным, что Рамзай решил себя проверить. Не будучи физиком, он посылает пробу газа специалисту по спектроскопическому анализу и вскоре получает ответ, что присланная им проба газа является элементом гелием. Тем самым гелием, который до сих пор не был известен на Земле и был спектроскопическим анализом найден еще в 1868 году физиками на Солнце, откуда и получил свое название гелий, что по-гречески означает «солнечный».
Почему же гелий не открыл американец Гиллебранд, который еще за 5 лет до Рамзая исследовал газ, получаемый из клевеита? Это очень поучительный факт в науке, и мы расскажем о нем в нескольких словах. Как выяснилось позднее, Гиллебранд, спектроскопически изучавший газ, выделявшийся из клевеита, действительно нашел в нем линии, принадлежавшие спектру гелия. Но сила старой традиции, говорившей о том, что гелий имеется только на Солнце, боязнь нового факта, казавшегося Гиллебранду необъяснимым, заставили его отступить от самого факта — «воздуха» ученого, скрыть истину. Он умолчал об открытом им факте, умолчал о результатах проведенного им спектроскопического анализа. За свою научную трусость он был жестоко наказан. Потомство не только не связало его имя с вновь открытым элементом, но в истории науки о нем вспоминается, как о человеке, не оставшемся верным науке, ее фактам.
Но как связать вновь открытые элементы с таблицей Менделеева? Были и такие ученые, которые подвергали сомнению открытие Рамзая: они считали новые элементы разновидностями азота, еще более инертными, чем основной азот. Укажем кстати, что по химическим свойствам гелий оказался аналогом аргона: он также был химически инертен. Рамзай, однако, был другого мнения: он считал, что для вновь открытых элементов должно найтись место в периодической системе. Более того, как верный ученик и последователь Менделеева, исходя из его периодического закона, он предсказал, что на основании изучения свойств вновь открытых элементов должны быть найдены еще по крайней мере три новых элемента, похожих своими свойствами на аргон и гелий, которые образуют с ними новую семью в таблице Менделеева. На чем же покоилось его убеждение?
Укажем кстати, что по химическим свойствам гелий оказался аналогом аргона: он также был химически инертен. Рамзай, однако, был другого мнения: он считал, что для вновь открытых элементов должно найтись место в периодической системе. Более того, как верный ученик и последователь Менделеева, исходя из его периодического закона, он предсказал, что на основании изучения свойств вновь открытых элементов должны быть найдены еще по крайней мере три новых элемента, похожих своими свойствами на аргон и гелий, которые образуют с ними новую семью в таблице Менделеева. На чем же покоилось его убеждение?
В таблице Менделеева, доложенной на заседании Русского физико-химического общества 3 декабря 1870 года, все элементы, в зависимости от их валентности, были разделены на восемь групп. Валентностью элемента называется его свойство соединяться с определенным числом атомов другого элемента. Обычно валентность считается по водороду. В первой группе Менделеев расположил одновалентные элементы. Элементы второй группы соединяются с двумя атомами водорода, — они двухвалентны, и т. д. до восьмивалентных элементов. Все известные элементы укладывались в эти группы Менделеевской таблицы, но гелий и аргон не вступали ни в какие химические соединения с другими элементами, их валентность была нулевая. Где же их место в таблице? И вот на съезде естествоиспытателей в Торонто (Канада) Рамзай выступает с утверждением, что для открытых им инертных газов есть место в таблице Менделеева. Это место перед первой группой, то есть должна быть создана нулевая группа периодической системы. Он говорил примерно следующее: «Мы еще не все открыли. Надо продолжать поиски, потому что, наверно, есть еще элементы, похожие на аргон и гелий. Все вместе они составят новую большую «семью» элементов, новую группу, которая целиком войдет в таблицу Менделеева. Новые открытия не опрокидывают и не опрокинут периодическую систему, наоборот, она станет полнее, а следовательно, точнее и правильнее». Будущее показало верность этого предвидения. Но исследователь не стал пассивно выжидать, пока другие докажут его правоту.
д. до восьмивалентных элементов. Все известные элементы укладывались в эти группы Менделеевской таблицы, но гелий и аргон не вступали ни в какие химические соединения с другими элементами, их валентность была нулевая. Где же их место в таблице? И вот на съезде естествоиспытателей в Торонто (Канада) Рамзай выступает с утверждением, что для открытых им инертных газов есть место в таблице Менделеева. Это место перед первой группой, то есть должна быть создана нулевая группа периодической системы. Он говорил примерно следующее: «Мы еще не все открыли. Надо продолжать поиски, потому что, наверно, есть еще элементы, похожие на аргон и гелий. Все вместе они составят новую большую «семью» элементов, новую группу, которая целиком войдет в таблицу Менделеева. Новые открытия не опрокидывают и не опрокинут периодическую систему, наоборот, она станет полнее, а следовательно, точнее и правильнее». Будущее показало верность этого предвидения. Но исследователь не стал пассивно выжидать, пока другие докажут его правоту. Со всей страстью ученого вместе со своими помощниками он принимается за поиски недостающих элементов.
Со всей страстью ученого вместе со своими помощниками он принимается за поиски недостающих элементов.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Воздух имеет сложный состав В поисках новых элементовОткрытие элементов 113, 115, 117 и 118: что это дает
Борис Жуйков — радиохимик, докт. хим. наук, зав. Лабораторией радиоизотопного комплекса Института ядерных исследований РАН, ранее много лет работавший в Лаборатории ядерных реакций ОИЯИ (Дубна), занимался исследованием свойств новых элементов.Открытие новых элементов Периодической таблицы Менделеева всегда вызывало интерес у широкой публики. Дело даже не столько в научной значимости этих открытий, а в том, что в школе все проходили Периодический закон, и некоторые даже помнят символы, обозначающие элементы. Это понятно, знакомо. Но сейчас за этими открытиями стоят сложные исследования в ядерной физике и радиохимии, о которых многие не имеют представления.
Но сейчас за этими открытиями стоят сложные исследования в ядерной физике и радиохимии, о которых многие не имеют представления.
В настоящее время новые элементы получают только на ускорителях тяжелых ионов. (Ранее их обнаруживали в земных минералах, продуктах ядерных реакторов и ядерных взрывов.) Тяжелыми ионами, ускоренными в циклотронах или линейных ускорителях, бомбардируют мишени из тяжелых элементов, и в результате реакции слияния с испусканием одного или нескольких нейтронов синтезируется новый элемент с порядковым номером (зарядом ядра) — суммой зарядов ядер налетающего иона и ядра мишени. Затем образующиеся ядра претерпевают радиоактивный распад. Для синтеза наиболее устойчивых изотопов выбирают такие комбинации ядер, в которых содержится по возможности большее число нейтронов и составные ядра имеют низкую энергию возбуждения. Выход получаемых тяжелых элементов чрезвычайно мал — отдельные атомы или десятки атомов, иногда за месяцы облучения на ускорителе. Период полураспада — секунды, а иногда и доли миллисекунд. Довольно сложно выделить ядра новых элементов из всей смеси образующихся продуктов ядерных реакций и правильно идентифицировать полученные продукты. Для этого создаются специальные установки, которые в результате регистрируют цепочку распадов с испусканием альфа-частиц и образованием изотопов более легких элементов, иногда цепочка оканчивается спонтанным делением ядра.
Довольно сложно выделить ядра новых элементов из всей смеси образующихся продуктов ядерных реакций и правильно идентифицировать полученные продукты. Для этого создаются специальные установки, которые в результате регистрируют цепочку распадов с испусканием альфа-частиц и образованием изотопов более легких элементов, иногда цепочка оканчивается спонтанным делением ядра.
В нашей стране начиная с 1950-х годов работы по синтезу новых элементов на ускорителях тяжелых ионов проводились в Дубне под руководством акад. Г. Н. Флёрова (1913–1990) — основателя этого направления. Сейчас эти работы проводятся под научным руководством акад. Ю. Ц. Оганесяна. В мире существует лишь несколько ускорителей и установок, где можно получать трансактиноидные элементы (т. е. элементы с зарядом ядра Z более 103).
Последнее решение iupac (Международный союз теоретической и прикладной химии [1] о признании открытия сразу четырех элементов — под номерами 113, 115, 117 и 118 — привлекло внимание российской общественности еще и потому, что приоритет в трех из них — 115, 117 и 118 — признан за российско-американской коллаборацией, включающей Лабораторию ядерных реакций им. Г. Н. Флёрова Объединенного института ядерных исследований (Дубна) (ФЛЯР ОИЯИ), Ливерморскую национальную лабораторию им. Э. Лоуренса (LLNL), Окриджскую национальную лабораторию (ORNL) и Университет Вандербильта. Приоритет в открытии элемента 113 признан за группой из японского ускорительного научного центра riken.
Г. Н. Флёрова Объединенного института ядерных исследований (Дубна) (ФЛЯР ОИЯИ), Ливерморскую национальную лабораторию им. Э. Лоуренса (LLNL), Окриджскую национальную лабораторию (ORNL) и Университет Вандербильта. Приоритет в открытии элемента 113 признан за группой из японского ускорительного научного центра riken.
Установление приоритета — непростая задача, так как неточности в первых сообщениях об открытии в какой-то мере неизбежны. Вопрос — какие неточности существенны, а какие можно принять и насколько выводы авторов обоснованны. Решение IUPAC основывалось на отчетах объединенной рабочей группы экспертов (Joint Working Party, JWP) [2, 3] и разработанных ранее критериях открытия. Согласно существующей практике авторам предоставляется право предложить названия новых элементов.
Рис. 2. Карта радионуклидов трансактиноидных элементов, включая некоторые ядерные реакции их получения (взято из [4])Элемент 113 предложено назвать нихонием (nihonium, Nh). Nihon — одно из двух названий Японии на японском языке, означающее «Страна восходящего солнца».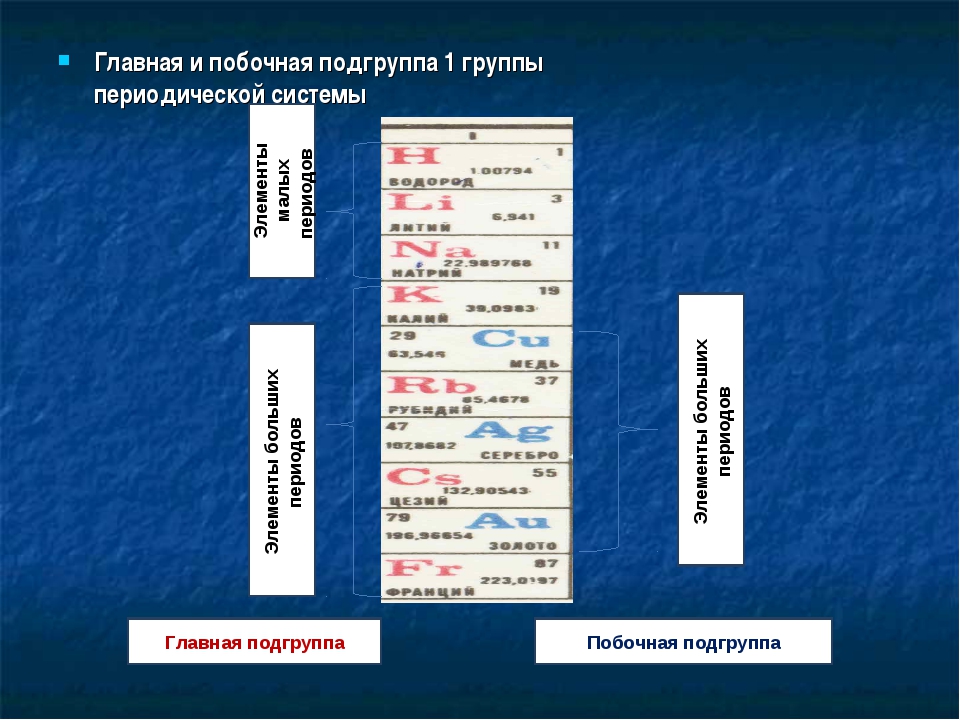 Это первый элемент, открытый в Азии. Дубнинская группа оспаривала это первенство.
Это первый элемент, открытый в Азии. Дубнинская группа оспаривала это первенство.Приоритетные работы были опубликованы ФЛЯР ОИЯИ и RIKEN почти одновременно в 2004 году, группа из Дубны опубликовала работу даже несколько раньше. Для синтеза новых ядер в Японии использовали «холодную» реакцию слияния, бомбардируя изотопом цинка мишень из висмута 70Zn+209Bi, с образованием изотопа 278113 (время жизни — миллисекунды и десятые доли миллисекунд).
В Дубне применили более выгодную (с точки зрения выхода и периодов полураспада) ядерную реакцию ионов тяжелого изотопа кальция и америция 48Ca+243Am, которая приводит к образованию изотопов 288115 и 287115. Эти радионуклиды, испуская альфа-частицы, распадаются сначала соответственно в 284113 и 283113 (время жизни — сотни миллисекунд), а затем по цепочке в долгоживущие изотопы элемента 105 (дубния, Db). 268Db выделяли химически и затем регистрировали спонтанное деление.
Но промежуточные нуклиды в этих цепочках распада на тот момент не были известны, и их независимая физическая идентификация не проводилась. А химическое выделение и идентификацию Db на основе ионного обмена, проведенные в ФЛЯР ОИЯИ, объединенная рабочая группа посчитала неселективными и неубедительными. Также не были приняты во внимание попытки исследовать химические свойства элемента 113 методом газовой хроматографии, хотя этот метод ранее успешно использовался для изучения химии других трансактиноидных элементов. В результате заключили, что заявка Дубны в данном случае не соответствует критериям открытия элементов.
В то же время все промежуточные продукты распада синтезированного в Японии изотопа 278113 (всего 3 события за 8 лет работы) были подтверждены, в том числе в специальных экспериментах в новом исследовательском центре по тяжелым ионам Ланжо в Китае. Таким образом, приоритет в открытии элемента 113 был признан за японской группой.
Элемент 115 был синтезирован в Дубне, и в честь региона, где расположен этот международный центр, авторами было предложено название московий (moscovium, Mc). Элемент получали опять же в ядерной реакции 48Ca+243Am с образованием 287115 и 288115 (время жизни — десятки и сотни миллисекунд соответственно). Позднее был получен 289115 и другие изотопы этого элемента. В отличие от первого цикла химических экспериментов, которые дубнинская группа проводила самостоятельно, позднее, в 2007 году, химическое выделение продукта распада — 268Db осуществлялось уже с привлечением американских специалистов из Ливермора, и была достаточно убедительно доказана принадлежность этого элемента — продукта распада 115-го элемента — к V группе Периодической системы.
Элемент получали опять же в ядерной реакции 48Ca+243Am с образованием 287115 и 288115 (время жизни — десятки и сотни миллисекунд соответственно). Позднее был получен 289115 и другие изотопы этого элемента. В отличие от первого цикла химических экспериментов, которые дубнинская группа проводила самостоятельно, позднее, в 2007 году, химическое выделение продукта распада — 268Db осуществлялось уже с привлечением американских специалистов из Ливермора, и была достаточно убедительно доказана принадлежность этого элемента — продукта распада 115-го элемента — к V группе Периодической системы.
Более того, в 2013 году коллаборации из немецкого Центра исследований c тяжелыми ионами в Дармштадте (GSI) удалось повторить дубнинские результаты по получению изотопов элемента 115 в ядерной реакции 48Ca+243Am. Таким образом, приоритет в открытии элемента 115 был признан за российско-американской группой.
Элемент 117 предложено назвать теннеcсин (tennessine, Ts) в честь американского штата Теннесси, где расположена Окриджская национальная лаборатория. Окончание в названии — п о аналогии с астатином и другими элементами группы галогенов (на английском языке). Этот элемент также был синтезирован в Дубне, в ядерной реакции 48Ca+249Bk. Роль американских коллег из Окриджа в основном состояла в изготовлении уникальной мишени берклия-249, который получали на высокопоточном реакторе в ORNL. В 2010–2013 годах было зарегистрировано всего 13 цепочек распадов 293117 и 294117, причем характеристики (время жизни и энергия альфа-распада) продукта распада 289115 соответствовали данным, полученным ранее для этого радионуклида в другой ядерной реакции 48Ca+243Am. По этой причине заявка на открытие этого элемента была признана отвечающей установленным критериям.
Окончание в названии — п о аналогии с астатином и другими элементами группы галогенов (на английском языке). Этот элемент также был синтезирован в Дубне, в ядерной реакции 48Ca+249Bk. Роль американских коллег из Окриджа в основном состояла в изготовлении уникальной мишени берклия-249, который получали на высокопоточном реакторе в ORNL. В 2010–2013 годах было зарегистрировано всего 13 цепочек распадов 293117 и 294117, причем характеристики (время жизни и энергия альфа-распада) продукта распада 289115 соответствовали данным, полученным ранее для этого радионуклида в другой ядерной реакции 48Ca+243Am. По этой причине заявка на открытие этого элемента была признана отвечающей установленным критериям.
Элементу 118 авторами предложено название оганесон (oganesson, Og). Он должен являться аналогом радона и других инертных газов, и его открытие завершает седьмой период таблицы Менделеева. Этот элемент предложено назвать в честь Юрия Цолаковича Оганесяна за его пионерский вклад в исследование трансактиноидных элементов и важные ядерно-физические достижения в открытии сверхтяжелых ядер и исследовании «острова ядерной стабильности».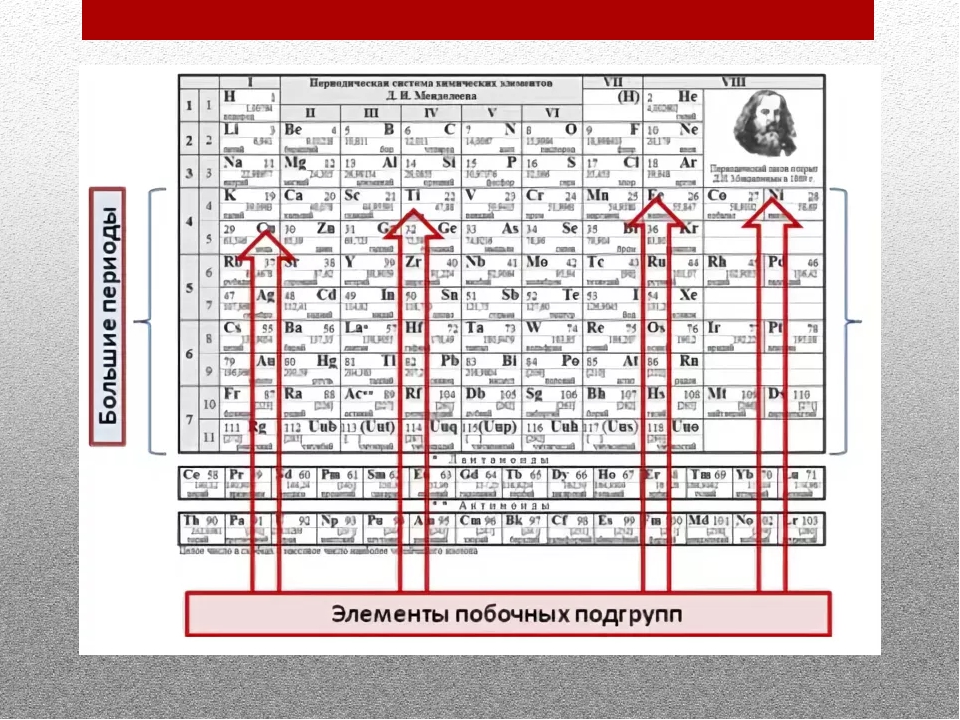 В истории существовал только еще один пример, когда имя элемента присваивалось действующему ученому. Элемент 106 был назван в 1997 году сиборгием (Sg) в честь Гленна Сиборга (1912–1999), лауреата Нобелевской премии, автора открытия плутония и целого ряда трансплутониевых элементов.
В истории существовал только еще один пример, когда имя элемента присваивалось действующему ученому. Элемент 106 был назван в 1997 году сиборгием (Sg) в честь Гленна Сиборга (1912–1999), лауреата Нобелевской премии, автора открытия плутония и целого ряда трансплутониевых элементов.
В 2002–2012 годах в Дубне при облучении мишени 249Cf ионами 48Ca было обнаружено несколько событий образования 294118 (время жизни — порядка 1 миллисекунды), сопровождающихся последовательным распадом 290Lv (ливермория), 286Fl (флеровия) и 282Cn (коперниция). Время жизни и энергии альфа-частиц этих изотопов Fl и Cn были подтверждены американской коллаборацией на циклотроне в Беркли, поэтому объединенная рабочая группа рекомендовала признать открытие.
Следует отметить, что все вновь предложенные названия и символы элементов пока еще не утверждены IUPAC.
* * *
Какое значение имеет открытие этих новых элементов?
Вопрос «Сколько хлеба и угля это может дать?» абсолютно некорректен. Пользу от развития определенной ветви фундаментальной науки часто невозможно предсказать, и такого рода аргументы не должны тормозить ее развитие. Попытки заранее расписать доход и политические выгоды от научных открытий смехотворны. Соображения престижа также не должны как-то ограничивать развитие направления, потому что его истинное значение может раскрыться много позже. И наоборот, широко разрекламированные достижения могут не иметь никакого значительного продолжения. Вообще, наука должна руководствоваться своей логикой, а не логикой людей, далеких от нее. Общество должно доверять ученым, и «удовлетворение собственного любопытства за государственный счет» — это нормальное положение в данной области человеческой деятельности. И именно ученые, квалифицированные специалисты должны определять, на что следует тратить деньги, а что может подождать или вообще бесперспективно.
Пользу от развития определенной ветви фундаментальной науки часто невозможно предсказать, и такого рода аргументы не должны тормозить ее развитие. Попытки заранее расписать доход и политические выгоды от научных открытий смехотворны. Соображения престижа также не должны как-то ограничивать развитие направления, потому что его истинное значение может раскрыться много позже. И наоборот, широко разрекламированные достижения могут не иметь никакого значительного продолжения. Вообще, наука должна руководствоваться своей логикой, а не логикой людей, далеких от нее. Общество должно доверять ученым, и «удовлетворение собственного любопытства за государственный счет» — это нормальное положение в данной области человеческой деятельности. И именно ученые, квалифицированные специалисты должны определять, на что следует тратить деньги, а что может подождать или вообще бесперспективно.
Другой вопрос, какое научное значение может иметь этот результат об открытии новых элементов. Что он изменяет в наших представлениях о структуре ядра и химических свойствах элементов вообще?
С физической точки зрения эти результаты могут иметь значение для лучшего понимания ядерной структуры и ядерного взаимодействия. С 1960-х годов бурно обсуждался вопрос о существовании так называемых островов стабильности в районе зарядов ядер Z=114 и 126 как проявление оболочечной структуры ядер. Поэтому получение первых трансактиноидных элементов, которые имели гораздо больший период полураспада, чем предсказывалось старой «капельной» моделью строения ядра, было действительно принципиально важно. Сейчас в оболочечной модели никто не сомневается. Полученные результаты по новым элементам и новым изотопам позволяют уточнить существующие модели ядра и ядерных реакций. Хотя и не ожидается принципиально новых явлений, набор новых данных всегда полезен. Очевидно, что вершины острова стабильности существующими методами не достигнуть: просто нет таких комбинаций в ядерных реакциях — в получаемых изотопах не хватает нейтронов. Ранее много лет проводились попытки обнаружения в природных образцах СТЭ, которые были бы настолько долгоживущими, что могли остаться со времен образования Солнечной системы. Но эти попытки не увенчались успехом.
С 1960-х годов бурно обсуждался вопрос о существовании так называемых островов стабильности в районе зарядов ядер Z=114 и 126 как проявление оболочечной структуры ядер. Поэтому получение первых трансактиноидных элементов, которые имели гораздо больший период полураспада, чем предсказывалось старой «капельной» моделью строения ядра, было действительно принципиально важно. Сейчас в оболочечной модели никто не сомневается. Полученные результаты по новым элементам и новым изотопам позволяют уточнить существующие модели ядра и ядерных реакций. Хотя и не ожидается принципиально новых явлений, набор новых данных всегда полезен. Очевидно, что вершины острова стабильности существующими методами не достигнуть: просто нет таких комбинаций в ядерных реакциях — в получаемых изотопах не хватает нейтронов. Ранее много лет проводились попытки обнаружения в природных образцах СТЭ, которые были бы настолько долгоживущими, что могли остаться со времен образования Солнечной системы. Но эти попытки не увенчались успехом. Некогда заявленные результаты не нашли ни экспериментального, ни теоретического подтверждения.
Некогда заявленные результаты не нашли ни экспериментального, ни теоретического подтверждения.
С химической точки зрения ситуация несколько иная. Здесь действительно можно ожидать принципиально новых явлений. Дело в так называемых «релятивистских эффектах». В атомах с большим зарядом ядра электроны приобретают релятивистские скорости, и обычное уравнение Шрёдингера, используемое для описания атомов, уже не работает. В частности, знакомые всем «гантельки» р-электронов в VII периоде претерпевают изменения, и одна из них превращается в шар. В результате электронная структура атомов меняется. У новых элементов возможно значительное отклонение химических свойств от экстраполированных по Периодической таблице и возникновение необычных химических свойств.
В отношении «релятивистских эффектов» существует много спекуляций, очевидно направленных на поднятие интереса к вопросу. Например, высказывалось предположение, что элемент 104 резерфордий (Rf) — формальный аналог титана, циркония и гафния — может оказаться p-элементом, по химическим свойствам близким к свинцу. Или заявлялось, что элемент 114 флеровий (Fl) — аналог свинца — может оказаться инертным газом. На самом деле при аккуратном рассмотрении выясняется, что, хотя атом Rf и имеет необычную конфигурацию внешней электронной оболочки (ds2p), по своим химическим свойствам это типичный d-элемент, аналог гафния. А Fl, обладая повышенной летучестью (как это следует и из любых экстраполяций), в конденсированном состоянии остается типичным металлом. Вообще, абсолютно некорректно любое отклонение от экстраполяции по Периодической системе приписывать «релятивистским эффектам»: оно может быть обусловлено совершенно другими причинами, например межконфигурационным взаимодействием.
Или заявлялось, что элемент 114 флеровий (Fl) — аналог свинца — может оказаться инертным газом. На самом деле при аккуратном рассмотрении выясняется, что, хотя атом Rf и имеет необычную конфигурацию внешней электронной оболочки (ds2p), по своим химическим свойствам это типичный d-элемент, аналог гафния. А Fl, обладая повышенной летучестью (как это следует и из любых экстраполяций), в конденсированном состоянии остается типичным металлом. Вообще, абсолютно некорректно любое отклонение от экстраполяции по Периодической системе приписывать «релятивистским эффектам»: оно может быть обусловлено совершенно другими причинами, например межконфигурационным взаимодействием.
Так или иначе, исследование релятивистских эффектов позволяет лучше понять и химические свойства давно известных и повсеместно применяемых элементов. Также это позволяет лучше разобраться в том, каким образом электронное строение атомов и молекул, которое можно рассчитать, определяет их конкретные химические свойства. Это до сих пор является далеко не до конца решенным вопросом. Дальнейшее продвижение по Периодической таблице может привести к образованию совсем новой группы элементов — g-элементов (начиная с элемента 121) с интересными свойствами. Все эти вопросы еще ждут подробного исследования.
Это до сих пор является далеко не до конца решенным вопросом. Дальнейшее продвижение по Периодической таблице может привести к образованию совсем новой группы элементов — g-элементов (начиная с элемента 121) с интересными свойствами. Все эти вопросы еще ждут подробного исследования.
Однако приходится отметить, что в последних открытиях исследования химических свойств новых элементов вообще не фигурируют (химически выделялся лишь продукт распада элемента 115 — элемент 105, Db, чтобы подтвердить конец цепочки распада). Но такое исследование трудно было провести ввиду низкого выхода и коротких периодов полураспада полученных изотопов. Тем не менее это возможно, хотя требует нового подхода к постановке химических экспериментов.
Открытие новых элементов дает еще один пример того, что значительные достижения российских ученых возможны в тесной коллаборации с учеными из США, Германии и других развитых стран. Именно такие работы и поднимают престиж нашей науки.
- International Union of Pure and Applied Chemistry.
 Официальный сайт: http://iupac.org/
Официальный сайт: http://iupac.org/ - Karola P. J., Barber R. C., Sherrill В. M., Vardaci E., Yamazaki T. Discovery of the elements with atomic numbers Z= 113, 115 and 117 (IUPAC Technical Report) // Pure Appl. Chem. 2016. V. 88. P. 139–153.
- Karola P. J., Barber R. C., Sherrill B. M., Vardaci E., Yamazaki T. Discovery of the elements with atomic numbers Z= 118 (IUPAC Technical Report) // Pure Appl. 2016. V. 88. P. 155–160.
- Hamilton H., Hofman S., Oganessian Y.T. Search for Superheavy Nuclei // Annu. Rev. Nucl. Part. Sci., 2013. V. 63. P. 383–405.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
См. также:
Ученые получили новый элемент таблицы Менделеева — Российская газета
Команда российских и американских физиков под руководством академика Юрия Оганесяна синтезировала новый химический элемент – под номером 117. Он пока получил неофициальное название унунсептий.
Как известно, сейчас на Земле всего 83 стабильных химических элемента, хотя при образовании Солнечной системы элементов родилось гораздо больше. Самый легкий – водород с атомным номером 1, самый тяжелый – уран с номером 92. Но сохранились лишь те, время жизни которых больше возраста Земли – 4,5 миллиарда лет. Другие распались и не дожили до наших дней. Причем это касается только сверхтяжелых элементов, чей номер в таблице Менделеева превышает 83. А, к примеру, уран распадется и сейчас.
Хотя казалось, с чего бы ядрам атомов разваливаться? Ведь теория “отца” атома Резерфорда справедлива и для элементов с атомными номерами 170 и даже более. Еще в 30-х годах прошлого века физики вроде бы докопались до истины, предложив красивую модель деления ядра, состоящего из нейтронов и протонов. Ядро якобы подобно капле жидкости. Его стремятся разорвать заряженные протоны, но им препятствуют силы поверхностного натяжения. Чем больше протонов, тем нестабильней ядро. Поэтому-то легкие элементы живут миллиарды лет, а сверхтяжелые разваливаются.
– Но постепенно появились данные, которые противоречили этой теории, – говорит вице-директор Объединенного института ядерных исследований Михаил Иткис. – В ходе экспериментов ученые заметили, что некоторые тяжелые элементы делятся как-то странно, не вписываясь в теорию.
– Более того, появились признаки, что стабильными могут быть элементы, которым теория это категорически запрещала. И вот в конце 60-х годов группой ученых из разных стран была создана новая модель атомного ядра. В ней доказывалось, что ядро – это не совсем аморфная капля, у него куда более сложная структура (ее назвали замкнутой протонной оболочкой). Именно благодаря ей должен существовать “остров стабильности” – группа сверхтяжелых элементов, которые могут прожить определенное время, не распадаясь. Этот вывод и стал сигналом для поиска.
Более того, теоретики дали экспериментаторам “ключ” для синтеза новых элементов. Они доказали, что существуют “магические числа” (число протонов и нейтронов в ядре), при которых ядра сверхтяжелых элементов будут стабильны. Скажем, элемент на вершине “острова стабильности” должен иметь 120 протонов и 184 нейтрона. Кстати, именно к нему и стремятся физики, синтезируя новые элементы. Его срок жизни может составить тысячи, а может, миллионы лет. Таким образом появляется шанс, в принципе, получать принципиально новые материалы. Что же касается только что синтезированного 117-го унунсептия, то у него “всего” 117 протонов и 177 нейтронов. Он прожил доли секунды.
Эксперимент был задуман академиком Юрием Оганесяном еще шесть лет назад, но только сейчас воплотился в жизнь. Все дело в атомах берклия-249, который использовался в данной работе. Только с его помощью можно было добраться до 117-го. Почему именно берклий?
– Дело в том, что для обстрела мишени у нас применяется один из изотопов кальция, у которого 20 протонов, – говорит Михаил Иткис. – Раз у нового элемента должно быть 117 протонов, требовался элемент с 97 протонами. А это только берклий. Но он очень капризен, так как живет всего 320 дней и распадается. Его нарабатывают только в США. Требовалось накопить 25 миллиграмм этого элемента, выделить, очистить от примесей, привезти в Россию, доставить в Димитровград, сделать мишень, отправить ее в Дубну, поставить на ускоритель и облучать шесть месяцев, чтобы для надежности результата получить минимум шесть атомов 117-го элемента. По сути, по одному в месяц.
Ранее дубненскими физиками впервые в мире были синтезированы новые, долгоживущие сверхтяжелые элементы с порядковыми номерами 113, 114, 115, 116 и 118. По мнению специалистов, результаты многолетних работ ядерщиков из Дубны – одно из наиболее выдающихся достижений российской науки.
Устройство таблицы Менделеева | WhoYOUgle
Таблица Менделеева — визуализация переодической системы свойств химических элементов, открытая Д. И. Менделеевым.
Период и группа
Расположенный в каждой ячейке таблицы элемент оказывается на пересечении строки и столбца, номера которых являются, соответственно, периодом и группой.
Период и группа химического элемента
Начиная с четвертого, периоды состоят из двух рядов (строк), но это не должно смущать — это традиционный прием, позволяющий сделать таблицу не слишком широкой.
Химический элемент принадлежит либо основной, либо побочной группе. Принадлежность элемента основной группе в первую очередь означает, что он обладает свойствами, присущими группе в целом (например, все инертные газы находятся в восьмой группе, а щелочные металлы — в первой).
Цвет ячейки показывает принадлежность элемента определенному семейству (например, металлов или полупроводников). Расшифровка цветов приведена под таблицей.
Два больших семейства — лантаноиды и актиноиды — вынесены за пределы основной таблицы.
Химический элемент
Ячейка таблицы содержит символ элемента, его название, порядковый номер и относительную атомную массу.
Основные параметры элемента
Дробное значение атомной массы говорит о том, что в природе встречаются изотопы элементов; если атомная масса указана в квадратных скобках, она означает массу наиболее долгоживущего изотопа.
Символ элемента расположен слева, если элемент принадлежит основной группе, и справа, если побочной.
Основная и побочная группы
Распределение электронов
Увеличенная ячейка таблицы, показанная на странице химического элемента, содержит дополнительную информацию о распределении электронов по орбиталям и название по-латыни (одно-, двух- или трехбуквенный символ, обозначающий элемент, образован именно от латинского названия).
Детализированная карточка химического элемента
С ростом номера элемента электроны в атоме занимают более высокие уровни: общее число электронов на каждом уровне показано в столбике чисел под атомным номером. Нижнее число соответствует первому уровню.
Чем выше уровень, тем больше разнообразие орбиталей, по которым «вращаются» электроны атомной оболочки. Например, на первом уровне возможна только орбита s-типа, на втором — s– и p-типов.
Электронная конфигурация показана в сокращенном виде и по клику разворачивается в полную запись. Сокращенная запись говорит о том, что нижние уровни полностью заняты, причем совпадают с оболочкой одного из предыдущих элементов в таблице. Совпадающая часть условно записана символом элемента восьмой группы, помещенным в квадратные скобки (именно у элементов этой группы полностью заполняется очередной уровень). Цифры перед буквами обозначают номера уровней, верхние индексы — число электронов на орбитали.
Сокращенная и расширенная электронная конфигурация
Наконец, на отдельном рисунке показано условное распределение атомов по орбитам. Обратите внимание, что реальные орбитали имеют другую форму (не говоря уже о волновых функциях).
Условная визуализация электронных уровней
Разъяснение названий групп периодической таблицы для родителей
Периодическая таблица Менделеева представляет собой компиляцию химических элементов в табличной форме.
Все элементы в периодической таблице расположены в соответствии с несколькими символами. Это: общие химические свойства, электронная конфигурация (распределение электронов по орбитам) и атомные номера (количество протонов в атоме).
Периодическая таблица разделена на семь строк, называемых периодами, и 18 столбцов, называемых группами. Вот краткий список всех групп Периодической таблицы, которым вы можете легко научить своих детей.
Чтобы узнать больше о разных именах, взгляните на эти королевские фамилии или эти тайские фамилии и значения.
Группы периодической таблицы
Группа 1: Щелочные металлы
Щелочные металлы мягкие, пластичные и хорошо проводят электричество и тепло. В эту группу входят элементы литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы очень реактивны. По сравнению с другими элементами они имеют низкую температуру плавления и кипения.
Группа 2: Щелочноземельные металлы
Вторая группа элементов Периодической таблицы – это щелочноземельные металлы.Эти элементы находятся в земной коре и представляют собой мягкие серебристые металлы. Они могут проводить тепло и электричество и могут быть превращены в листы. Некоторые элементы в этой группе – бериллий, кальций и магний.
Группа 3 В группу 12: переходные металлы
Элементы от 3 до 12 группы называются переходными металлами. Они включают семейства элементов скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь и цинк. Переходные металлы твердые и плотные, они хорошо проводят тепло и электричество и легко сгибаются.Золото, железо и медь являются важными такими элементами.
Группа 13: группа бора
Группа бора названа в честь ведущего элемента бора. Они хорошие проводники, но редко встречаются в природе. Алюминий является исключением из этой группы, так как он встречается в изобилии.
Группа 14: Группа углерода
Группа углерода состоит из углерода, кремния, германия, олова, свинца и флеровия. Все элементы встречаются в природе довольно широко, кроме флеровиума.Элементы этой группы и их соединения обычно токсичны.
Группа 15: Пниктогены
Пниктогены состоят из азота (N), за которым следуют фосфор (представлен как P), мышьяк (As), сурьма (Sb), висмут (Bi) и, наконец, московий (Mc ). В то время как азот и фосфор встречаются в природе, других нет, поскольку московий является синтетическим элементом, который производится только в лабораториях.
Группа 16: Халькогены
Халькогены содержат элементы кислород, серу, селен, теллур и радиоактивный элемент полоний.Ливерморий – синтетический элемент, входящий в эту группу. В то время как кислород и фосфор в изобилии в природе, селен и теллур нет. Полоний содержится только в следовых количествах из-за радиоактивного распада, а ливерморий производится только в лабораториях.
Группа 17: Галогены
Галогены состоят из фтора, хлора, брома, йода, астата и синтетического элемента теннессина. Это неметаллы, которые являются плохими проводниками с низкими температурами плавления и кипения. Группа галогенов также является единственной группой, в элементах которой при комнатной температуре можно увидеть все три состояния вещества.
Группа 18: Благородные газы
Благородные газы состоят из гелия, неона, аргона, криптона, ксенона, радона и синтетического газа Оганессон. Они составляют около 0,96% атмосферы. Эти газы используются в различных целях, таких как освещение, сварка и исследование космоса, хотя по своей природе они очень инертны и бесцветны.
В Kidadl есть множество замечательных статей, которые могут вас вдохновить. Если вам понравился наш список названий периодической таблицы, почему бы не узнать об этих венгерских фамилиях или этих индийских фамилиях, имеющих историю и значения.{40} \ text {Ca} \).
Размер атома (атомный радиус)
Электроотрицательность
Первая энергия ионизации
Температура кипения
Решение пока недоступно.
Изучите следующий график и объясните тенденцию изменения электроотрицательности элементов группы 2.
Решение пока недоступно.
См. Элементы, перечисленные ниже:
Какой из перечисленных выше элементов:
относится к группе 1
галоген
– благородный газ
– щелочной металл
имеет атомный номер 12
имеет четыре нейтрона в ядре своих атомов
содержит электроны на 4-м уровне энергии
имеет все свои энергетические орбитали
будет иметь наиболее близкие химические свойства
Решение пока недоступно.
номер группы таблицы Менделеева
На этом уровне все, что мы делаем в дополнение к элементам в этой части Периодической таблицы, – это более подробно рассматриваем целые группы 1, 2, 14, 17 и 18. Но мы фактически игнорируем другие элементы в этой части Периодической таблицы. центр стола.
Почему я не использую систему IUPAC?
На это есть две причины:
В учебных программах Великобритании, которые я отслеживаю, он не используется на момент написания (октябрь 2012 г.).Хотя Chemguide используется во всем мире, моя целевая аудитория состоит из студентов, сдающих экзамены уровня A (и эквивалентные) в Великобритании.
Даже если бы они использовали систему IUPAC, я был бы недоволен ее использованием. Я думаю, что это вызывает серьезные проблемы при обучении химии на начальном уровне. Подробнее об этом позже.
Я использую упрощенную версию старой системы. Обозначение, которое я использую для части Периодической таблицы, показанной выше:
Это также система, используемая нынешними экзаменаторами Великобритании.
В этой системе основные группы (показаны красным и зеленым) пронумерованы от 1 до 8 (или от 1 до 7, а затем 0 – благородные газы иногда описываются как Группа 8, иногда как Группа 0).
Элементам d-блока (показаны синим) не нужно давать номера групп на этом уровне, потому что мы практически никогда не смотрим ни на один из них, кроме элементов в первой строке.
Традиционно, попытка дать номера групп элементов d-блока приводила к совершенно запутанной системе нумерации, включающей подгруппы A и B, с такими именами, как группа VIA и IVB (это 6A и 4B) и так далее.
Это было еще хуже, потому что использование букв A и B в США было полностью противоположным таковому в Европе. И поэтому IUPAC разобрал все, пронумеровав все от 1 до 18.
Основной недостаток использования системы IUPAC
Так почему же, если система ИЮПАК намного аккуратнее, не все ее используют?
Система IUPAC нарушает то, как Периодическая таблица Менделеева впервые была представлена как важный инструмент в изучении химии.
Обучение электронной структуре первых 20 элементов (вплоть до Ca) напрямую связано с Периодической таблицей. Студенты могут видеть, что элементы в одной группе имеют одинаковое количество внешних электронов (за одним исключением гелия).
И, более того, количество внешних электронов совпадает с номером группы – до тех пор, пока вы не используете текущую систему IUPAC.
Итак, если элемент находится в группе 2, он имеет 2 внешних электрона. Таким образом, даже если вы не можете определить полную структуру, вы знаете, что у бария есть 2 внешних электрона.Точно так же, если вы обнаружите, что йод находится в группе 7, вы знаете, что у него 7 внешних электронов.
За исключением элементов в группах 1 и 2, это явно не работает, если вы используете версию IUPAC.
Наличие простого способа определения количества внешних электронов напрямую связано с возможностью легко вычислить заряды многих простых ионов, что логически приводит к написанию химических формул.
Таким образом, простой факт наличия групповых номеров, равных количеству внешних электронов, делает в остальном утомительный и загадочный процесс разработки формул относительно простым и понятным.
Наверное, нет смысла во всем преподавании химии, где легче полностью отвлечь учащихся от предмета, чем введение в атомную структуру и формулы. Система нумерации IUPAC просто усложняет задачу.
Есть ли недостатки в использовании метода нумерации, отличного от IUPAC, на этом уровне?
“… на этом уровне”? По сути, это все, что ниже степени.
Нет, минусов нет. Нумерация IUPAC позволяет вам четко прикреплять номера к группам d-блоков. Но нам никогда не нужно этого делать.
За всю жизнь преподавания химии ученикам в возрасте до 18 лет я никогда не исследовал групповые тенденции в элементах d-блока. Фактически, очень мало элементов, которые даже упоминаются за пределами первой строки.
На самом деле, не глядя, я даже не знаю, какие элементы лежат под железом, например, в Периодической таблице! И это в равной степени верно для всех групп d-блока, кроме двух (я могу делать группы меди и цинка!).Меня это беспокоит? Ни в коей мере – ученикам безразлично, что я пытаюсь помочь.
И хотя я посмотрел на старую систему нумерации на примере из химии для 14–16-летних, она все еще актуальна на следующем этапе. По-прежнему полезно иметь возможность найти, скажем, фосфор в Периодической таблице и знать (не задумываясь), что, поскольку он находится в группе 5, он имеет 5 внешних электронов, а затем продолжить оттуда.
Нумерация ИЮПАК вполне может упорядочить жизнь университетских людей, но делает беспорядок важным учебным пособием для остальных из нас.Мне это не кажется хорошей сделкой.
WebElements Periodic Table »Периодичность» Номера групп »Галерея Менделеева
Номер группы – это идентификатор, используемый для описания столбца стандартной периодической таблицы, в котором появляется элемент.
Группы 1-2 называются s-блочными элементами.
Группы 1-2 (кроме водорода) и 13-18 называются элементами основной группы.
Группы 3-12 называются d -блочными элементами.
Группы 3-11 называются переходными элементами. Переходные элементы – это те, чьи атомы имеют неполную d-подоболочку или чьи катионы имеют неполную d-подоболочку.
Группы 13-18 называются p-блочными элементами.
Элементы основной группы в первых двух строках таблицы называются типичными элементами.
Первый ряд элементов f-блока называется лантаноидами (или, что менее желательно, лантаноидами. Второй ряд элементов блока f называется актаноидами (или, что менее желательно, актанидами).
Обычно используются следующие названия определенных групп в периодической таблице:
- Группа 1: щелочные металлы
- Группа 2: щелочноземельные металлы
- Группа 11: чеканные металлы (название не утверждено ИЮПАК)
- Группа 15: пниктогены (название не одобрено ИЮПАК)
- Группа 16: халькогены
- Группа 17: галогены
- Группа 18: благородные газы
Кроме того, группы могут быть идентифицированы первым элементом в каждой группе, поэтому набор элементов Группы 16 иногда называют кислородной группой.
Квартир
Нет
Банкноты
С лейблами Группы существует значительная путаница. Схема, используемая в WebElements, является числовой и соответствует текущему соглашению IUPAC. Две другие системы менее желательны, так как они сбивают с толку, но все еще широко используются. Обозначения A и B совершенно произвольны. Первый из них (A слева, B справа) основан на более старых рекомендациях IUPAC и часто используется в Европе. Последний набор (элементы основной группы А, переходные элементы В) широко использовался в Америке.
| Группа | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 13281 | 14281 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Европейский | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | VIIIA | VIIIA | VIIIAVIIIA IIIA | VIIIAVIIIA IIIA | VB | VIB | VIIB | VIIIB | |
| Американский | IA | IIA | IIIB | IVAB | VB | VIB | VII326 | VIIIB | VIIIB | VIIIB IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA |
Источники литературы
- Международный союз теоретической и прикладной химии: Комиссия по номенклатуре неорганической химии, Номенклатура рекомендаций по неорганической химии 2005 , Eds.Н.Г. Коннелли, Т. Дамхус, Р.М. Хартсхорн, А. Хаттон, Королевское химическое общество, 2005. ISBN-13: 978-0854044382.
- W.C. Фернелиус и В. Пауэлл, “Путаница в периодической таблице элементов”, J. Chem. Эд. , 1982, 59 , 504-508.
- Периодическая таблица в любом томе Inorganic Oxford Chemistry Primers, Oxford University Press, Oxford, UK.
| Grandinetti Group
Еще до того, как мы получили это хорошее представление об атомной структуре, ученые идентифицировали определенные вещества как элементов .Поэтому было много попыток расположить известные элементы так, чтобы между их известными свойствами существовала некоторая корреляция. Первая достаточно успешная попытка была предпринята Дмитрием Менделеевым в 1869 году. У него была идея расположить элементы в порядке , увеличивая атомную массу , и, что наиболее важно, обнаружил, что элементы с подобными химическими и физическими свойствами периодически встречаются . Он расположили эти похожие элементы друг под другом в столбцы.
В 1914 году Генри Мозли определил, что лучше расположить атомный номер в порядке увеличения атомного номера , что дает нам периодическую таблицу, которую мы имеем сегодня.Мы можем определить периодическую таблицу как , расположение элементов в порядке увеличения атомного номера, поместив элементы с аналогичными химическими и физическими свойствами в столбцы.
Характеристики Периодической таблицы
Группы
Вертикальные столбцы называются группами. Элементы внутри группы имеют схожие химические и физические свойства. Группы обозначаются вверху цифрами 1-8 и буквами A и B. (Примечание: маркировка групп несколько произвольна, поэтому следите за другими обозначениями, особенно с A и B.)
Элементы группы A – Элементы репрезентативной или основной группы
Элементы группы B – Переходные элементы
Помимо буквенно-цифрового обозначения, некоторые группы имеют собственное название.
| 1A | → | щелочные металлы | |||||
| 2A | → | щелочноземельные земли | |||||
| 7A | → | галогены |
Периоды
Горизонтальные строки называются периодами .Периоды обозначены числами слева в периодической таблице. Два длинных ряда, расположенные чуть ниже основной части стола, представляют собой внутренние переходные элементы
.Элементы 58-71 относятся к серии лантанидов
Элементы 90-103 относятся к серии актинидов
Три категории элементов
Есть три широкие категории элементов, которые называются
.- Металлы
- Неметаллы
- Металлоиды
Чтобы отделить металлы от неметаллов, мы проводим ступенчатую линию слева и снизу от B, Si, As, Te и At.
Эта классификация или группа полезны, потому что определенные свойства связаны с каждой категорией.
Металлы
- твердые вещества при комнатной температуре (кроме Hg)
- металлический блеск
- ковкий и пластичный
- хорошие проводники тепла и электричества
Неметаллы
- газы или твердые вещества при комнатной температуре (кроме Br 2 )
- разнообразие цвета и внешнего вида
- хрупкие твердые вещества
- изоляторы (плохие проводники)
Металлоиды
- промежуточное звено по свойствам между металлами и неметаллами
- твердых частиц при комнатной температуре
- многие имеют более одной структуры (одна металлическая, другая неметаллическая)
- некоторые полупроводники
Домашнее задание от
Chemisty, The Central Science, 10-е изд.2.15, 2.19, 2.21, 2.23, 2.25, 2.27, 2.33, 2.35, 2.37, 2.47, 2.49
Характеристики групп и периодов в таблице Менделеева
- Характеристика группы:
Элементы группы показывают схожие химические свойства, но есть постепенное изменение физических свойств элементов в группе.
- Размер атома: Сверху вниз в группе размер атома увеличивается как новая оболочка атома.
- Валентные электроны (V.E): Количество валентных электронов в группе одинаково
- Валентность: Все элементы в группе обычно имеют одинаковую валентность
а. Валентность металла (от IA до IIIA) = No. V.E
г. Валентность неметалла (от IVA до VIIIA) = 8 – № V.E
4 . Металлический знак: увеличивается сверху вниз в группе.
5. Электроположительность и реакционная способность металлов:
- Электроположительность – это тенденция атома терять валентные электроны и приобретать положительный заряд.
- При движении вниз по группе размер атома увеличивается.
- Итак, V.Es находятся далеко от ядра и сила притяжения между протонами в ядре и валентными электронами уменьшается.
- Следовательно, элементы в группе могут легко потерять свой V.E. с образованием положительных ионов, т. Е. Электроположительность и реакционная способность возрастают в группе. Например. К> Na> Li
6 . Электроотрицательность и реакционная способность неметаллов:
- Электроотрицательность – это тенденция атома приобретать электроны и отрицательный заряд.
- При движении вниз по группе размер атома увеличивается.
- Итак, сила притяжения между протонами в ядре и набираемым электроном уменьшается.
- Следовательно, элементы в группе с трудом получают электрон для образования отрицательных ионов, т.е. электроотрицательность и реакционная способность снижаются в группе. Например. F
Характеристики периодов:
- Каждый период начинается с группы IA (1) и заканчивается в группе VIIIA (0 или 18)
1 .Атомный размер:
- Размер атома уменьшается слева направо за период.
- Вдоль периода, с увеличением атомного номера, количество протонов и электронов увеличивается.
- Итак, сила притяжения к ядру увеличена. Следовательно, размер атома уменьшается и уменьшается.
2. Валентные электроны:
- Количество V.Es увеличивается с 1 до 8 с течением времени.
- В период 1 -го года увеличение только с 1 до 2.
3 . Валентность:
- За период слева направо валентность сначала увеличивается от 1 до 4, а затем уменьшается до нуля.
| 2 nd Период | Ли | Be | В | С | № | О | Ф. | Ne |
| Валентность | 1 | 2 | 3 | 4 | 3 | 2 | 1 | 0 |
4 .Электроположительность и реакционная способность металлов:
- Слева направо в периоде размер атома уменьшается из-за увеличения ядерной силы притяжения.
- Таким образом, трудно потерять V.Es. Следовательно, электроположительность и реакционная способность металлов уменьшается с течением времени.
5 . Электроотрицательность и реакционная способность неметаллов:
- Слева направо в периоде размер атома уменьшается из-за увеличения ядерной силы притяжения.
- Итак, для атома неметалла легко получить электроны. Следовательно, электроотрицательность и реакционная способность неметаллов возрастают с течением времени.
- Электронная конфигурация: Распределение электронов в различных оболочках и подоболочках
Классификация элементов на основе электронной конфигурации:
1 . Элементы s-блока:
- Блок щелочных металлов (группа IA или 1) i.е. От Li до Fr и щелочноземельных металлов (группа IIA или 2), то есть от Be до Ra, которые присутствуют в левой части таблицы Менделеева
- Эти элементы имеют последний электрон в s-подоболочке
2 . p-элементы блока:
- Блок металлов, неметаллов, металлоидов и инертных газов, которые присутствуют в группах с IIIA по VIIIA (0), составляют элементы p-блока, например B, C, O, N, F, Ne и т. Д.
- присутствует в правой части современной таблицы Менделеева
- эти элементы имеют последний электрон в p-подоболочке
* Элементы, принадлежащие s-блоку и p-блоку, являются «нормальными» или «репрезентативными» элементами.
3 . Элементы d-блока:
- блок переходных металлов, присутствующий в средней части современной таблицы Менделеева
- включает элементы от IB до VIIIB, т. Е. С 3 по 12
- эти элементы имеют последний электрон в d-подоболочке
- их свойства находятся посередине между s-block и p-block, поэтому они называются «переходными элементами».
4 . Элементы f-блока:
- Блок лантаноидов и актинидов, находящихся под основной периодической таблицей
- последний электрон валентной оболочки этих элементов попадает в f-подоболочку
Советы по запоминанию:
- Период = Количество используемых основных снарядов
- Группа = Общее количество валентных электронов
- Валентность:
| Группа | IA (1) | IIA (2) | IIIA (13) | IVA (14) | ВА (15) | ЧЕРЕЗ (16) | VIIA (17) | VIIIA (0) |
| Валентность | 1 | 2 | 3 | 4 | 3 | 2 | 1 | 0 |
- Металлы = элементов группы IA (1), IIA (2), IIIA (13)
- Неметаллы = элементов Группы IVA (14), VA (15), VIA (16), VIIA (17), VIIIA (18)
Инертные / благородные газы = Группа VIIIA (0 или 18)
Автор: Сулакша Пурна Шреста
Характеристики групп и периодов в таблице Менделеева
| Следующие записи были сделаны мной во время прослушивания
Chem 1A, лекции 11 и 12, автор:
Профессор Хейно Ницше Атомный номер и масса:
Имена групп:
|

 Официальный сайт: http://iupac.org/
Официальный сайт: http://iupac.org/