Нулевая группа » Детская энциклопедия (первое издание)
Воздух имеет сложный состав
В поисках новых элементов
Если первые научные шаги в познании недр окружающего нас воздуха связаны с именем Михаила Васильевича Ломоносова, то следующие, решающие, этапы в этом познании связаны с именем другого величайшего гения нашей родины — с Дмитрием Ивановичем Менделеевым, с его периодической системой химических элементов.
Когда Д. И. Менделеев создавал свою таблицу, никто из химиков, в том числе и автор таблицы, не предполагал, что воздух может содержать еще какие-либо элементы, кроме уже открытых азота и кислорода. Думали, что их даже никто не пытается искать. Но это было не так. Их искал и теоретически нашел запертый в одиночной камере Шлиссельбургской крепости царский узник, ученый и революционер Николай Александрович Морозов еще в 1884 году. На основании глубокого анализа периодического закона Менделеева он пришел к мысли, что среди элементов окружающего нас мира должно существовать семейство химически инертных элементов, которые еще не открыты. Морозов даже примерно вычислил их атомные веса. Но ученый был в строгом заключении, и его мысли не вышли за стены тюрьмы. Когда же в 1905 году, после 28-летнего заключения в крепости, Морозов вышел на свободу, он мог убедиться, что его предвидение было верным, предполагаемые им элементы были экспериментально открыты, и нашли их в воздухе. Случилось это при следующих обстоятельствах.
Морозов даже примерно вычислил их атомные веса. Но ученый был в строгом заключении, и его мысли не вышли за стены тюрьмы. Когда же в 1905 году, после 28-летнего заключения в крепости, Морозов вышел на свободу, он мог убедиться, что его предвидение было верным, предполагаемые им элементы были экспериментально открыты, и нашли их в воздухе. Случилось это при следующих обстоятельствах.
В 1894 году было опубликовано сообщение английского физика Релея об исследовании плотности азота. Было замечено, что плотность азота, полученного из какого-либо его химического соединения, например аммиака, меньше, чем плотность азота, полученного из воздуха. Литр азота, полученного из воздуха, весил 1,2572 грамма, а литр того же азота, но полученного из аммиака, весил 1,2560 грамма, то есть почти на. одну тысячную грамма меньше. Эта небольшая сама по себе величина, своевременно замеченная и точно измеренная, привела, как мы увидим далее, к замечательным открытиям. В первое время и физики и химики пришли в смущение. Точность работ исследователя была вне сомнений, оставалось предположить, что есть в природе каких-то два азота: более легкий — в химических соединениях и более тяжелый — в воздухе. Однако нелепость подобного предположения была очевидна.
Точность работ исследователя была вне сомнений, оставалось предположить, что есть в природе каких-то два азота: более легкий — в химических соединениях и более тяжелый — в воздухе. Однако нелепость подобного предположения была очевидна.
Единственно разумным выходом из создавшегося положения было предположение английского химика Рамзая о том, что воздух, очевидно, содержит какую-то небольшую газообразную примесь, более тяжелую, чем азот. Эта примесь и искажает плотность азота, получаемого из воздуха. В ходе этих научных споров английские ученые вспомнили об одном интересном, но полузабытом сообщении, опубликованном еще в 1786 году их соотечественником Кавендишем. В этом сообщении описывался следующий опыт. Была взята стеклянная трубка, изогнутая дугой, и ее концы опущены в стаканы с ртутью. В трубке находился воздух. Через этот воздух исследователь начал пропускать электрические разряды, под влиянием которых азот и кислород воздуха начали химически реагировать друг с другом, образуя химические соединения — окислы азота — газ, обладающий удушливыми свойствами.
Исследователь удалял этот газ из трубки, поглощая его раствором щелочи. Время от времени он прибавлял в оставшийся в трубке азот еще некоторое количество кислорода, чтобы химически связать весь азот в трубке и удалить его в виде окислов азота. В ходе химической реакции количество газа в трубке уменьшалось и освободившееся пространство занимала ртуть. Наконец, в трубке остался лишь небольшой пузырек воздуха. Ученый решил, что опыт не доведен до конца. Он прибавил еще кислорода и продолжал еще в течение двух недель пропускать электрический ток через оставшийся воздух. Но больше он удушливого газа не получил — пузырек воздуха так и не исчез.
Ученый вычислил, что оставшийся воздух составляет 1/120 часть первоначального объема азота в трубке и записал: «Из этого опыта я заключаю, что азот воздуха неоднороден: 1/120 часть его ведет себя по-другому, чем большая, основная часть. Стало быть, азот — это не одно вещество, а смесь двух различных веществ». Яснее не скажешь. Так более чем за 100 лет до опытов 1893 года была разгадана загадка азота. Этот факт лишний раз напомнил ученым, как опасно забывать труды своих предшественников. Итак, в воздухе имеется еще один газ, но что это за газ, каковы его свойства? Разрешить этот вопрос взялся Рамзай. Он избрал новый путь. Очистив сухой воздух от углекислоты и кислорода, он затем оставшийся азот начал улавливать раскаленным магнием, с которым азот химически реагирует. Он продувал азот над раскаленным магнием до тех пор, пока не получался постоянный остаток газа, не вступавший в химическое соединение с магнием и имевший постоянную плотность.
Этот факт лишний раз напомнил ученым, как опасно забывать труды своих предшественников. Итак, в воздухе имеется еще один газ, но что это за газ, каковы его свойства? Разрешить этот вопрос взялся Рамзай. Он избрал новый путь. Очистив сухой воздух от углекислоты и кислорода, он затем оставшийся азот начал улавливать раскаленным магнием, с которым азот химически реагирует. Он продувал азот над раскаленным магнием до тех пор, пока не получался постоянный остаток газа, не вступавший в химическое соединение с магнием и имевший постоянную плотность.
Эта плотность оказалась в 20 раз больше плотности водорода, в то время как плотность азота в 14 раз больше плотности водорода Спектроскопическое исследование показало, что исследователь имеет дело с новым элементом, о чем он и заявил 13 августа 1894 года.
Этот элемент, заявил он, находится в воздухе и составляет в нем почти один процент. Сообщение вызвало среди ученых того времени недоверие и изумление. Казалось удивительным, что в воздухе, в котором удалось обнаружить примесь в 0,03 процента углекислого газа, даже найти тысячную долю процента водорода, не удавалось до сих пор найти почти целый процент нового газа.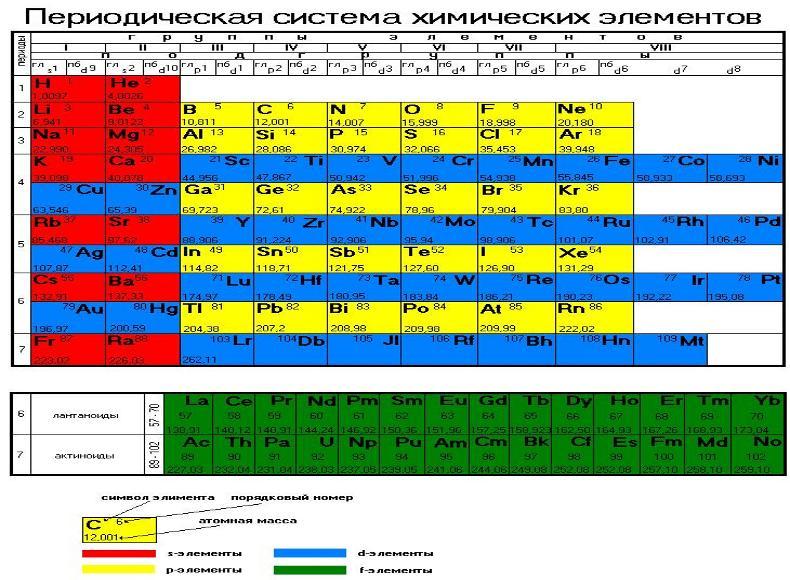 Это было действительно странно и требовало объяснения. Кроме того, оставалось совершенно не ясным, где найдет себе место новый элемент в таблице Менделеева. К сожалению, ученые не знали об исследованиях шлиссельбуржца Морозова и его выводах. Рамзай занялся изучением свойств нового элемента, чтобы пролить свет на все эти недоуменные вопросы.
Это было действительно странно и требовало объяснения. Кроме того, оставалось совершенно не ясным, где найдет себе место новый элемент в таблице Менделеева. К сожалению, ученые не знали об исследованиях шлиссельбуржца Морозова и его выводах. Рамзай занялся изучением свойств нового элемента, чтобы пролить свет на все эти недоуменные вопросы.
Оказалось, что новый элемент не вступает в химическое соединение ни с какими другими элементами и химическими соединениями ни при каких известных тогда условиях. На него не действуют ни кислоты, ни щелочи, ни раскаленные металлы, ни даже такие химически деятельные газы, как хлор и фтор, ни раскаленный фосфор и углерод. Он был химически пассивен, не имел ни вкуса, ни запаха, и в силу этих свойств ему было дано название аргон, что означает по-гречески «недеятельный».
Во время своих продолжительных опытов по выяснению природы аргона Рамзай получил от одного знакомого геолога письмо следующего содержания: «Не знаю, пытались ли вы соединить аргон с металлом ураном. Если не пытались, то, мне кажется, стоило бы испробовать это сделать. Несколько лет назад американский геолог Гиллебранд заметил, что из уранового минерала клевеита, если его нагревать в серной кислоте, выделяется очень много газа. Гиллебранд утверждает, что этот газ — азот. Но, может быть, там есть и аргон?» Это, действительно, имело смысл проверить.
Если не пытались, то, мне кажется, стоило бы испробовать это сделать. Несколько лет назад американский геолог Гиллебранд заметил, что из уранового минерала клевеита, если его нагревать в серной кислоте, выделяется очень много газа. Гиллебранд утверждает, что этот газ — азот. Но, может быть, там есть и аргон?» Это, действительно, имело смысл проверить.
Рамзай достал минерал клевеит и добыл из него описанным способом газ, но азота, который там нашел Гиллебранд, он не обнаружил.
Изучая спектроскопически полученный газ, он заметил в нем присутствие нового, неизвестного до сих пор на Земле элемента. Это открытие было настолько неожиданным и невероятным, что Рамзай решил себя проверить. Не будучи физиком, он посылает пробу газа специалисту по спектроскопическому анализу и вскоре получает ответ, что присланная им проба газа является элементом гелием. Тем самым гелием, который до сих пор не был известен на Земле и был спектроскопическим анализом найден еще в 1868 году физиками на Солнце, откуда и получил свое название гелий, что по-гречески означает «солнечный».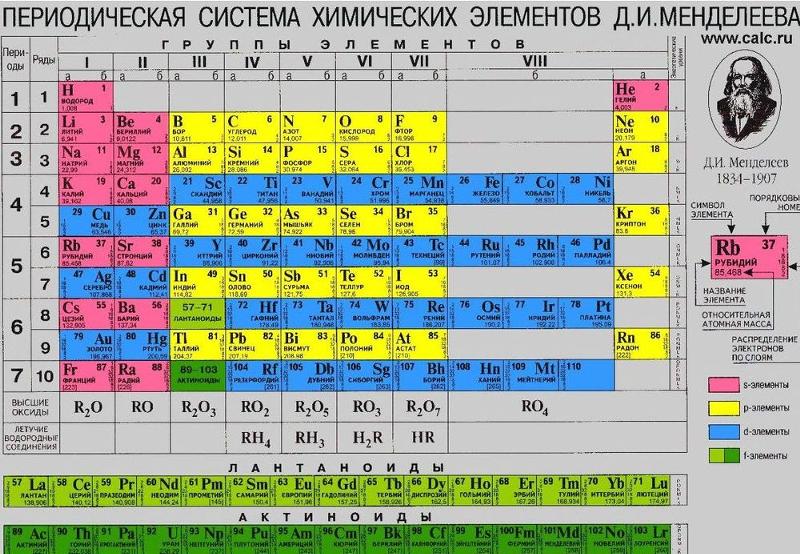
Почему же гелий не открыл американец Гиллебранд, который еще за 5 лет до Рамзая исследовал газ, получаемый из клевеита? Это очень поучительный факт в науке, и мы расскажем о нем в нескольких словах. Как выяснилось позднее, Гиллебранд, спектроскопически изучавший газ, выделявшийся из клевеита, действительно нашел в нем линии, принадлежавшие спектру гелия. Но сила старой традиции, говорившей о том, что гелий имеется только на Солнце, боязнь нового факта, казавшегося Гиллебранду необъяснимым, заставили его отступить от самого факта — «воздуха» ученого, скрыть истину. Он умолчал об открытом им факте, умолчал о результатах проведенного им спектроскопического анализа. За свою научную трусость он был жестоко наказан. Потомство не только не связало его имя с вновь открытым элементом, но в истории науки о нем вспоминается, как о человеке, не оставшемся верным науке, ее фактам.
Но как связать вновь открытые элементы с таблицей Менделеева? Были и такие ученые, которые подвергали сомнению открытие Рамзая: они считали новые элементы разновидностями азота, еще более инертными, чем основной азот.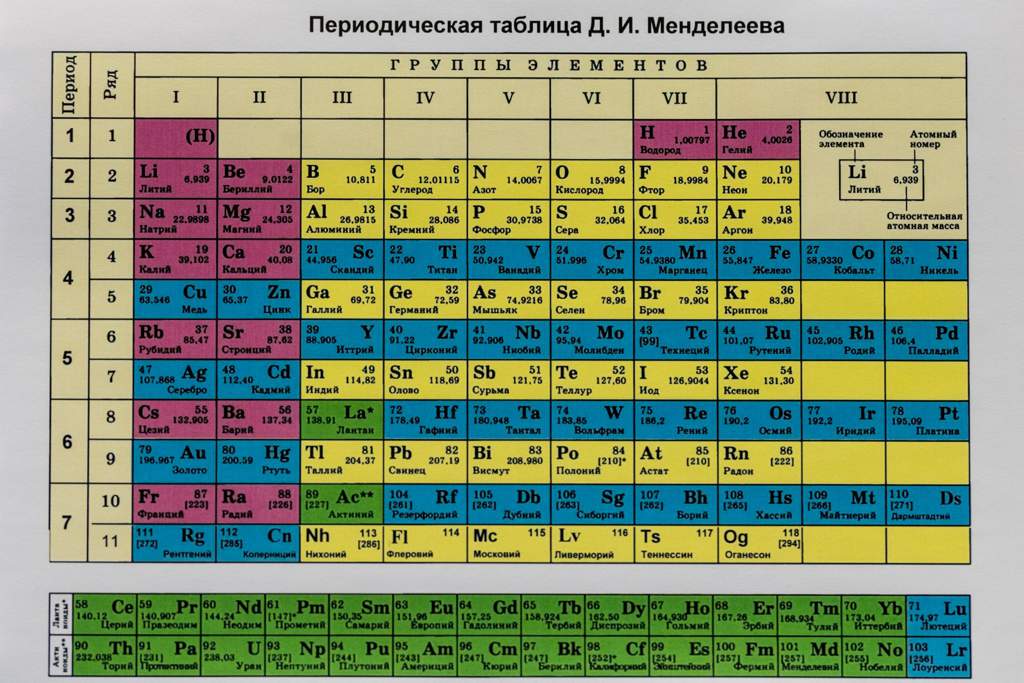 Укажем кстати, что по химическим свойствам гелий оказался аналогом аргона: он также был химически инертен. Рамзай, однако, был другого мнения: он считал, что для вновь открытых элементов должно найтись место в периодической системе. Более того, как верный ученик и последователь Менделеева, исходя из его периодического закона, он предсказал, что на основании изучения свойств вновь открытых элементов должны быть найдены еще по крайней мере три новых элемента, похожих своими свойствами на аргон и гелий, которые образуют с ними новую семью в таблице Менделеева. На чем же покоилось его убеждение?
Укажем кстати, что по химическим свойствам гелий оказался аналогом аргона: он также был химически инертен. Рамзай, однако, был другого мнения: он считал, что для вновь открытых элементов должно найтись место в периодической системе. Более того, как верный ученик и последователь Менделеева, исходя из его периодического закона, он предсказал, что на основании изучения свойств вновь открытых элементов должны быть найдены еще по крайней мере три новых элемента, похожих своими свойствами на аргон и гелий, которые образуют с ними новую семью в таблице Менделеева. На чем же покоилось его убеждение?
В таблице Менделеева, доложенной на заседании Русского физико-химического общества 3 декабря 1870 года, все элементы, в зависимости от их валентности, были разделены на восемь групп. Валентностью элемента называется его свойство соединяться с определенным числом атомов другого элемента. Обычно валентность считается по водороду. В первой группе Менделеев расположил одновалентные элементы. Элементы второй группы соединяются с двумя атомами водорода, — они двухвалентны, и т.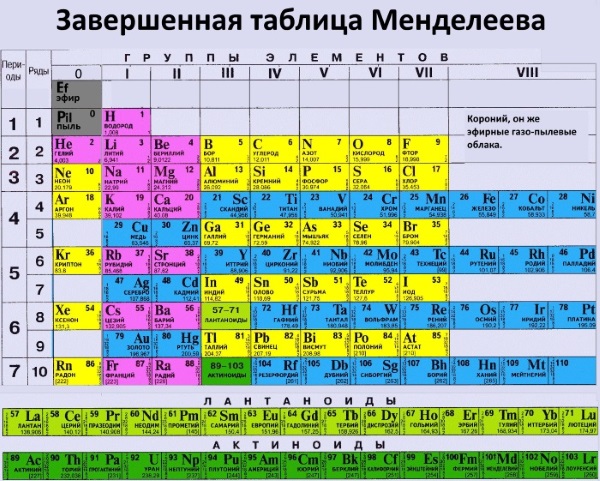 д. до восьмивалентных элементов. Все известные элементы укладывались в эти группы Менделеевской таблицы, но гелий и аргон не вступали ни в какие химические соединения с другими элементами, их валентность была нулевая. Где же их место в таблице? И вот на съезде естествоиспытателей в Торонто (Канада) Рамзай выступает с утверждением, что для открытых им инертных газов есть место в таблице Менделеева. Это место перед первой группой, то есть должна быть создана нулевая группа периодической системы. Он говорил примерно следующее: «Мы еще не все открыли. Надо продолжать поиски, потому что, наверно, есть еще элементы, похожие на аргон и гелий. Все вместе они составят новую большую «семью» элементов, новую группу, которая целиком войдет в таблицу Менделеева. Новые открытия не опрокидывают и не опрокинут периодическую систему, наоборот, она станет полнее, а следовательно, точнее и правильнее». Будущее показало верность этого предвидения. Но исследователь не стал пассивно выжидать, пока другие докажут его правоту.
д. до восьмивалентных элементов. Все известные элементы укладывались в эти группы Менделеевской таблицы, но гелий и аргон не вступали ни в какие химические соединения с другими элементами, их валентность была нулевая. Где же их место в таблице? И вот на съезде естествоиспытателей в Торонто (Канада) Рамзай выступает с утверждением, что для открытых им инертных газов есть место в таблице Менделеева. Это место перед первой группой, то есть должна быть создана нулевая группа периодической системы. Он говорил примерно следующее: «Мы еще не все открыли. Надо продолжать поиски, потому что, наверно, есть еще элементы, похожие на аргон и гелий. Все вместе они составят новую большую «семью» элементов, новую группу, которая целиком войдет в таблицу Менделеева. Новые открытия не опрокидывают и не опрокинут периодическую систему, наоборот, она станет полнее, а следовательно, точнее и правильнее». Будущее показало верность этого предвидения. Но исследователь не стал пассивно выжидать, пока другие докажут его правоту.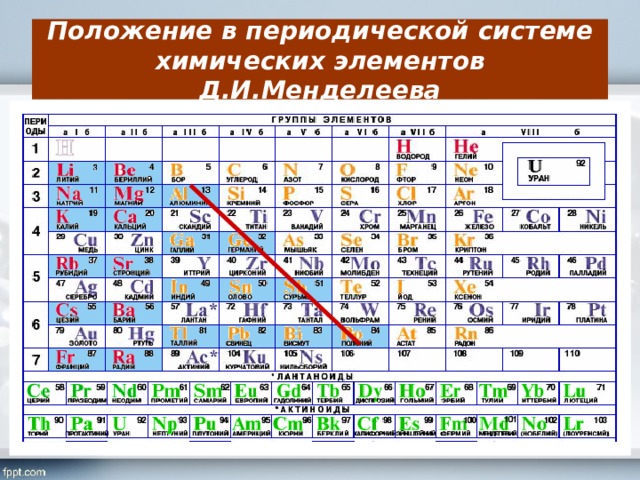 Со всей страстью ученого вместе со своими помощниками он принимается за поиски недостающих элементов.
Со всей страстью ученого вместе со своими помощниками он принимается за поиски недостающих элементов.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Воздух имеет сложный состав
В поисках новых элементов
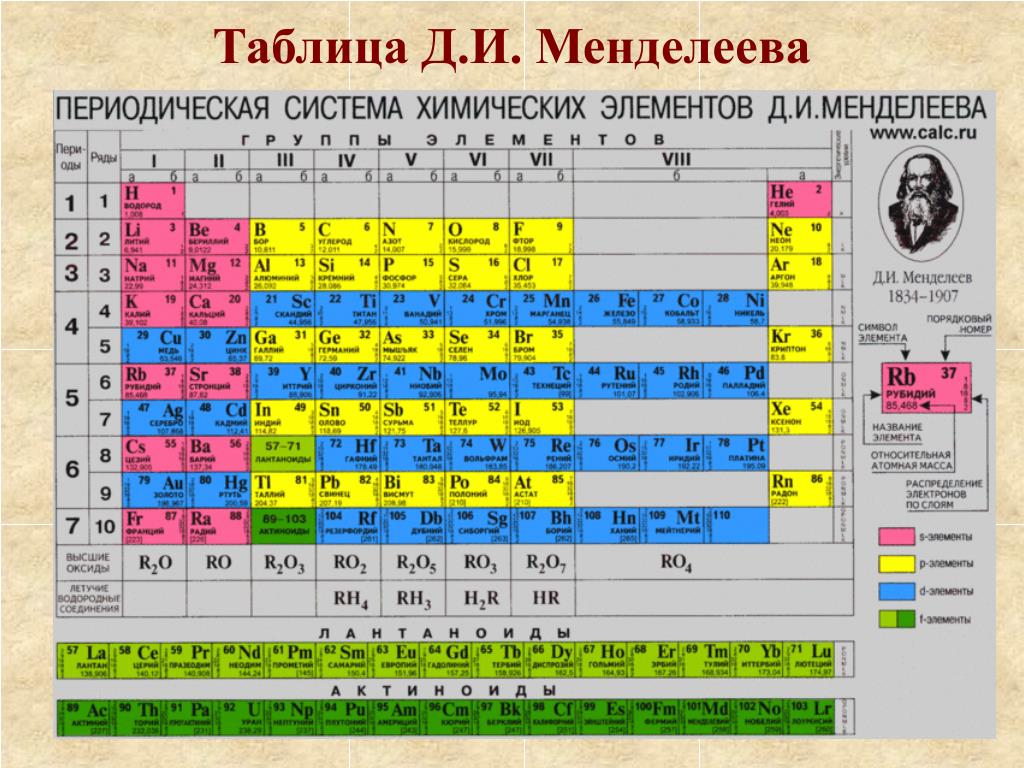
Элементы VII группы периодической таблицы Д.И. Менделеева
1. Элементы VII группы периодической таблицы Д. И. Менделеева.
Подготовила:Студентка 11 группы
Бурлака К.
Проверила:
Лазовская Л. Д.
2. Общая характеристика элементов
•Реагируют почти со всеми простыми веществами,кроме некоторых неметаллов.
• Все галогены — энергичные окислители, поэтому
встречаются в природе только в виде соединений.
•Все галогены — неметаллы, являются
сильными окислителями.
•На внешнем энергетическом уровне 7 электронов.
•При взаимодействии с металлами возникает ионная
связь, и образуются соли.
3. Периодическая система химических элементов Д.И.Менделеева
К VII группе периодической системы относятся: фтор, хлор,бром, иод, астат – главная группа; побочная – марганец,
технеций, рений, борий.
4. История открытия галогенов
ФторХлор
Бром
Йод
Астат
Марганец
5. История открытия фтора
В 1886 году французский химик А. Муассан,используя электролиз жидкого фтороводорода,
охлажденного до температуры –23°C, смог на
аноде получить первую порцию нового газа. В
первых опытах для получения фтора Муассан
использовал
очень
дорогой
электролизер,
изготовленный из платины и иридия. При этом
каждый грамм полученного фтора «съедал» до 6 г
платины.
Анри
Муассан
(1852 – 1907)
6. Хлор
КарлВильгельм
Шееле
(1742 – 1786)
В 1774 году шведский ученый К. Шееле
открыл хлор, который принял за сложное
вещество и назвал “дефлогистированной
соляной кислотой”.
В 1807 году английский химик Гемфри
Дэви получил тот же газ. Он пришел к
выводу, что получил новый элемент и
назвал его “хлорин” (от “хлорос” – желтозеленый).
В 1812 году Гей-Люсеок дал газу
название хлор.

7. Бром
В 1825 году французский химик А.Ж.Баларпри изучении маточных рассолов выделил
темно-бурую жидкость, который он назвал “мурид” (от латинского слова muria,
означающего “рассол”). Комиссия Академии,
проверив
это
сообщение,
подтвердила
открытие Балара и предложила назвать
элемент бромом (от “бромос”, с греческого
“зловонный”).
Антуан Жером
Балар
(1802 – 1876)
Бернар Куртуа
(1777 –
1838 )
В 1811 году французский химик Бернар
Куртуа открыл иод
путём перегонки
маточных
растворов
от
своего
азотнокислого кальция с серной кислотой
Чтобы другие химики могли изучать
новое вещество, Б. Куртуа подарил его
(правда, очень небольшое количество)
фармацевтической фирме в Дижоне.
В 1813 году Ж.-Л.Гей-Люссак подробно
изучил этот элемент и дал ему
современное название. Название “иод”
происходит от греческого слова “иодэс” “фиолетовый” (по цвету паров).
9.
 АстатВ 1869 г Д.И.Мендеелеев предсказал его существование и
АстатВ 1869 г Д.И.Мендеелеев предсказал его существование ивозможность открытия в будущем (как «эка-иод»).
Впервые астат был получен искусственно в 1940 г открыт
Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский
университет в Беркли) . Для синтеза изотопа 211At они облучали
висмут альфа-частицами.
В 1943-1946 годах изотопы астата были обнаружены в
составе природных радиоактивных рядов. Астат является
наиболее редким элементом среди всех, обнаруженных в
природе. В поверхностном слое земной коры толщиной 1,6 км
содержится всего 70 мг астата.
10. Марганец
Один из основных минералов марганца — пиролюзит — былизвестен в древности как чёрная магнезия и использовался при
варке
стекла
для
его
осветления.
Его
считали
разновидностью магнитного железняка, а тот факт, что он не
притягивается магнитом, Плиний Старший объяснил женским
полом чёрной магнезии, к которому магнит «равнодушен».
В 1774 г.
 шведский химик К. Шееле показал, что в руде содержится
шведский химик К. Шееле показал, что в руде содержитсянеизвестный металл. Он послал образцы руды своему другу
химику Ю. Гану, который, нагревая в печке пиролюзит с углем,
получил металлический марганец.
В начале XIX века для него было принято название «манганум».
11. Физические свойства Фтор
Фторбледножелтый
высокореакционноспособный газ,
вызывающий раздражение
дыхательных путей и коррозию
материалов.
.
Хлор едкий, химически агрессивный газ темного зеленоватожелтого цвета, менее
реакционноспособен по сравнению со фтором.
Бром – тяжелая краснокоричневая жидкость при обычных условиях, но легко
испаряется, превращаясь в едкий газ.
Иод – темнофиолетовое, с металлическим
оттенком, вещество, твердое , но
легко сублимирующееся. Часто
встречается в виде блестящих серочерные кристаллов.
Астат радиоактивный
элемент,
единственный галоген, не
имеющий стабильного
изотопа. Он существует
только в следовых
количествах в некоторых
минералах.

16. Марганец
Твёрдый, хрупкий металл серебристобелого цвета. Наряду с железом и егосплавами относится к чёрным
металлам.
17. Химические свойства
F2 – самый активный неметалл. Он проявляет только одну степеньокисления -1, непосредственно реагирует почти со всеми металлами (даже
с золотом и платиной), а также с неметаллами. Раствор фтороводорода в
воде называют плавиковой кислотой, а ее соли называются фторидами.
Химическим путем фтор получить невозможно, поэтому используется
исключительно электролиз. Взаимодействие фтора со сложными
веществами также протекает очень энергично. Так, он окисляет воду, при
этом реакция носит взрывной характер.
Cl2 – свободный хлор также очень реакционноспособен, хотя его
активность и меньше, чем у фтора. Он непосредственно реагирует со
всеми простыми веществами, за исключением кислорода, азота и
благородных газов. Хлор вступает в реакцию со многими сложными
веществами.
Br2 – химическая активность брома меньше, чем у
фтора и хлора, но все же достаточно велика в связи с
тем, что бром обычно используют в жидком состоянии и
поэтому его исходные концентрации при прочих равных
условиях больше, чем у хлора.
 Являясь более «мягким»
Являясь более «мягким»реагентом, бром находит широкое применение в
органической химии.
Отметим, что бром, так же, как и хлор, растворяется в
воде, и, частично реагируя с ней, образует так
называемую «бромную воду».
I2 – иод существенно отличается по химической активности от остальных
галогенов. Он не реагирует с большинством неметаллов, а с металлами
медленно реагирует только при нагревании. Взаимодействие же иода с
водородом происходит только при сильном нагревании, реакция является
эндотермической и сильно обратимой. Водный раствор иода называется
«иодной водой»[5]. Иод способен растворяться в растворах иодидов с
образованием комплексных анионов
19. Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять
Таким образом, химическая активность галогеновпоследовательно уменьшается от фтора к астату. Каждый
галоген в ряду F — At может вытеснять последующий из его
соединений с водородом или металлами, то есть каждый
галоген в виде простого вещества способен окислять
галогенид-ион любого из последующих галогенов.

Астат ещё менее реакционноспособен, чем иод. Но и он
реагирует с металлами (например с литием).
При диссоциации образуются не только анионы, но и
катионы At+ .
Mn – Характерные степени окисления марганца: 0, +2, +3, +4, +6, +7
(степени окисления +1, +5 малохарактерны). При окислении на воздухе
пассивируется. Порошкообразный марганец сгорает в кислороде.
Марганец поглощает водород, с повышением температуры его
растворимость в марганце увеличивается. При температуре выше
1200 °C взаимодействует с азотом, образуя различные по
составу нитриды. Марганцевая кислота очень сильная, но неустойчивая,
её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её
соли (перманганаты) — сильные окислители.
20. Применение элементов VII группы
ТефлонФреон
Применение
фтора
Заменитель
крови
Фториды
в
зубных
Окислитель
пастах
ракетного
топлива
Дезинфекция
воды
Лекарственные
препараты
Органические
растворители
Отбеливатели
Применение Хлорирование
хлора
органических
веществ
Производство Получение
Получение
неорганических брома, йода
HCl
хлоридов
Лекарственные
препараты
Ветеренарные
Фотография
препараты
Применение
брома
Красители
Присадки
к
Ингибиторы
бензину
Лекарственные
препараты
Дезинфекция
одежды
Применение
Фотография
йода
Электролампы
Красители
Металлургия
Применение
марганца
Медицина
Химическая
промышленность
Использованная литература,
интернет-ресурсы
«Химия-9», О.
 С.Габриелян, М, Дрофа,2005г, стр 78-90
С.Габриелян, М, Дрофа,2005г, стр 78-90«Химия в действии», М.Фримантл, М, «Мир»,1991г, стр 269-286.
«Неорганическая химия в таблицах»,Н.В.Манцевич, Минск, Современная
школа,2008г, стр 275-280
http://www.chem100.ru/
http://rrc.dgu.ru/res/n-t.ru/ri/ps/index.htm
http://www.periodictable.ru/
http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=35
http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=23
http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=72
http://ru.wikipedia.org/wiki/%D0%A4%D1%80%D1%8D%D0%B4_
%D0%90%D0%BB%D0%BB%D0%B8%D1%81%D0%BE%D0%BD
Спасибо за
внимание!!!
Все элементы периодической таблицы объединены в 9 групп
Все элементы периодической таблицы разделены на группы. Все элементы в группе ведут себя одинаково. Однако у них довольно странные имена, которые очень трудно запомнить… если, конечно, вы не используете сюжетную технику «Память мамонта»!
Примечание:
Наиболее обсуждаемые в школьной химии группы:
Группа 1 Щелочные металлы
Группа 2 Alkali Earth Metals
Группа 7 Halogens
Группа 0 NOBLE GASES
и переходные металлы
Чтобы помнить названия групп, используйте следующую историю:
. Мы говорили о группах, и это совпадение — буквально на днях я гулял с компанией друзей.
Мы говорили о группах, и это совпадение — буквально на днях я гулял с компанией друзей.
1. Щелочные металлы
Мы все очень нервничали, потому что нам пришлось идти по переулку, полному пьяных, всех alki es были ly ing вниз с их металлическими пивными банками. (Щелочные металлы)Никогда не называйте эту группу просто щелочами, она должна всегда называться щелочными металлами. Щелочи сами по себе представляют собой нечто совершенно другое . См. наш раздел «Кислоты и щелочи».
2. Щелочноземельные металлы
Посмотрев вниз, я увидел, что сама улица была вымощена бутылками и банками алк охол в ряд с в земля . ( Щелочная земля )
Никогда не называйте эту группу просто щелочными; эти элементы должны всегда называться щелочноземельными металлами. Слово «щелочной» относится к чему-то совершенно другому . См. наш раздел «Кислоты и щелочи».
Слово «щелочной» относится к чему-то совершенно другому . См. наш раздел «Кислоты и щелочи».
3. Переходные металлы
Мы так боялись идти пешком, что вместо этого проехали на -м транзитном -м фургоне. (Переходные металлы)
4. Икосагены
Мы благополучно выехали из переулка, и мое внимание привлек очень дорогой ювелирный магазин – в нем продавали дорогих драгоценных камней. ( Икосаген )
5. Crystallogens
Самой впечатляющей вещью, которую они продавали, было сверкающее ожерелье из кристалла . ( Кристаллогены )
6. Пниктогены
Но, пока я смотрел, вдруг подбежали воры и разбили стекло! Ожерелье быстро получило никнейм ! ( Пниктогены )
7. Халькогены
Я мог видеть бедного владельца магазина внутри, подсчитывающего то, что было взято на его калькуляторе калькулятор . ( Халькогены )
( Халькогены )
8. Галогены
То, что произошло дальше, было невероятным! Ангел спикировал вниз и поймал одного из воров, поймав его в ловушку своим нимбом ! (Галогены)
9. Благородные газы
Ангел представила мэру пойманного ею вора. В одежде он выглядел очень благородный . (благородные газы)
Резюме
Итак, чтобы напомнить вам, мы…
- Пришлось идти по переулку с алк ies ly ing вниз. (щелочь)
- Пила алк охол в линейка с в земля (Щелочноземельная)
- Проехался на фургоне транзит (Транзит)
- Остановился у магазина, продающего дорогих драгоценных камней (икосагены)
- Увидел ожерелье из кристалла … (кристаллогены)
- …который получил (пниктогены)
- Кладовщик что-то подсчитывал на своем
- Ангел заманил вора в ловушку своим ореолом (галогены)
- Она отвела его к мэру, который выглядел благородным (благородные газы)
Подробнее
Периодическая таблица элементов
Группа представляет собой вертикальный столбец элементов в периодической таблице химических элементов.
